Extraction of Auricularia auricula Glycoprotein and Analysis of Monosaccharide and Amino Acid Composition
-
摘要: 为获得优质的黑木耳糖蛋白,明确其单糖及氨基酸组成,本研究通过单因素实验和响应面法对超声波辅助碱法提取黑木耳糖蛋白的工艺条件进行优化,并采用AKTAgo纯化仪、DEAE GE Healthcare色谱柱对糖蛋白进行分离纯化,采用高效液相色谱(HPLC)法分析其单糖和氨基酸组成。黑木耳糖蛋白的最佳提取工艺条件为:超声时间90 min、料液比1:90 g/L、超声功率200 W、pH8.4、提取温度45 ℃,此条件下糖蛋白提取的综合评分为55.93分。经分离纯化得到糖蛋白的纯度为74.1%、蛋白回收率为37.5%,该糖蛋白中的单糖组成以葡萄糖(9.95 mg/g)、甘露糖(5.24 mg/g)为主,氨基酸以L-天冬氨酸/L-天冬酰胺(1.16 mg/g)、L-苯丙氨酸(1.14 mg/g)、L-谷氨酸/L-谷氨酰胺(1.10 mg/g)为主。因此,超声波碱法可有效提高黑木耳糖蛋白提取效率,且黑木耳糖蛋白中含有酸性杂多糖、必需氨基酸齐全,为黑木耳糖蛋白的深入研究及应用开发提供了科学参考。Abstract: In order to obtain high-quality Auricularia auricula glycoprotein and clarify its monosaccharide and amino acid composition, the process conditions of ultrasonic assisted alkaline extraction of Auricularia auricula glycoprotein were optimized by single factor experiment and response surface methodology, and the glycoprotein was separated and purified by AKTAgo purifier and DEAE GE Healthcare chromatographic column, and its monosaccharide and amino acid composition were analyzed by high performance liquid chromatography (HPLC). The optimum extraction conditions of Auricularia auricula glycoprotein were: ultrasonic time 90 min, material liquid ratio 1:90 g/L, ultrasonic power 200 W, pH8.4, extraction temperature 45 ℃, and the comprehensive score of glycoprotein extraction was 55.93. After separation and purification, the purity of the glycoprotein was 74.1% and the protein recovery rate was 37.5%. The monosaccharide composition of the glycoprotein was mainly glucose (9.95 mg/g) and mannose (5.24 mg/g), and the amino acids were mainly L-aspartic acid/L-asparagine (1.16 mg/g), L-phenylalanine (1.14 mg/g) and L-glutamic acid/L-glutamine (1.10 mg/g). Therefore, the ultrasonic alkali method can effectively improve the extraction efficiency of Auricularia auricula glycoprotein, and the Auricularia auricula glycoprotein contains acidic heteropolysaccharides and the necessary amino acids are complete, which provides a scientific reference for the in-depth research and application development of Auricularia auricula glycoprotein.
-
Keywords:
- Auricularia auricula /
- glycoprotein /
- extraction /
- purification /
- monosaccharide /
- amino acid
-
糖蛋白是一种结合蛋白,它由糖链和多肽链以共价键的形式连接而成[1],其广泛存在于食用真菌等微生物中[2]。研究发现糖蛋白不仅富含多种单糖及氨基酸[3],还具有抗氧化[4]、调节免疫力[5]、抗直肠癌活性[6]和抗衰老[7]等生理功能。粗糖蛋白可通过超声波辅助法[8]、碱法[9]提取,将两种方法结合的超声波辅助碱法在提高蛋白质提取率方面有相关研究[10],而在粗糖蛋白提取方面研究较少。袁莉婷等[11]利用超声波辅助碱法提取海带中的蛋白质,结果表明蛋白质提取率达到了8.11%;马梦婷等[12]利用超声波辅助碱法提取棉籽中的蛋白质,结果表明蛋白质的提取率达到了87.64%。为了得到高纯度、单一组分的糖蛋白,通常采用盐析、离子交换柱层析、凝胶过滤柱层析等方法去除粗糖蛋白中的杂蛋白及小分子杂质[13]。张金豫等[14]采用离子交换柱层析法对大鲵黏液中糖蛋白进行纯化,结果表明总糖和蛋白质含量之和为92.15%,得到了高纯度的大鲵黏液糖蛋白样品。Zhou等[15]采用凝胶过滤柱层析法对苦荞种子中糖蛋白进行了纯化,结果表明糖蛋白中含有47.16%的多糖和52.84%的蛋白质,其平均分子量为123.43 kDa,得到了高纯度的苦荞种子糖蛋白样品。
黑木耳(Auricularia auricula)是一种食药兼用的真菌[16],其子实体胶质含量极高,质地柔软,且弹性较好,口感极佳[17]。我国黑木耳产量较高,且随着农业科学的快速发展,其产量逐年递增,资源较为丰富[18]。黑木耳中不仅含有丰富的多糖、蛋白质、矿物质、黑色素等营养与生物活性物质[19],还具有补气益肺、活血补血、延缓衰老、增强免疫、预防癌症等功效[20-22],被誉为“素中之王”。然而,目前对于黑木耳功效成分的研究多集中于多糖[23]、黑色素[24]等方面,很少有人关注黑木耳中糖蛋白的研究,对黑木耳糖蛋白提取、结构、性质、功能等方面缺乏认识。因此,本研究以干黑木耳为原料,采用超声波辅助碱法提取,通过单因素实验和响应面法优化黑木耳糖蛋白的提取与纯化条件,得到最佳提取和纯化工艺条件,并对其单糖及氨基酸组成进行分析,为黑木耳的开发利用及其糖蛋白后续研究奠定理论与技术基础。
1. 材料与方法
1.1 材料与仪器
干黑木耳 哈尔滨市某超市;浓硫酸、苯酚、考马斯亮蓝、磷酸、丙酮、磷酸二氢钾、乙醇、盐酸、氯化钡、甲醇、乙腈 均为分析纯,天津市科密欧化学试剂有限公司;L-酪氨酸、L-异亮氨酸、L-苯丙氨酸、L-亮氨酸、L-丙氨酸、L-缬氨酸、L-胱氨酸、L-蛋氨酸、L-赖氨酸、L-脯氨酸、L-组氨酸、L-谷氨酸、L-天冬氨酸、L-丝氨酸、L-苏氨酸、L-精氨酸 均为色谱纯,上海安谱实验科技股份有限公司;鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖、岩藻糖、半乳糖 源叶生物;牛血清蛋白,纯度≥99% 广州蕊特生物科技有限公司。
JY10001型电子分析天平 北京市赛多利斯仪器系统有限公司;FW100型万能粉碎机 北京市永光明医疗仪器厂;80目标准检验筛 浙江上虞市华丰五金仪器有限公司;DHG-9140A型电热恒温鼓风干燥箱 上海一恒科技有限公司;LD5-2B型低速高效离心机 北京京立离心机有限公司;UV-1200型紫外-可见分光光度计 上海美谱达仪器有限公司;KQ-250DE型数控超声波清洗器 昆山市超声仪器有限公司;FiveEasy Plus型pH计 梅特勒-托利多仪器有限公司;AKTA go纯化仪、DEAE色谱柱 美国通用电气医疗集团(GE Healthcare);高效液相色谱Agilent1260 安捷伦科技中国有限公司。
1.2 实验方法
1.2.1 黑木耳粗糖蛋白提取工艺
采用超声波辅助碱法提取黑木耳糖蛋白[25]。将干黑木耳(含水量3.55%)用万能粉碎机粉碎后过80目筛,装入广口瓶中备用。准确称取1.0 g黑木耳粉放入烧杯中,按料液比要求加入一定量的蒸馏水,搅拌均匀后采用0.5 mol/L NaOH将提取液pH调节至提取规定pH,放入超声波清洗器中,调节超声功率,控制提取液温度,提取一定时间后取出离心(4000 r/min,12 min,室温),将上清液采用旋转蒸发仪浓缩5倍左右后,用0.5 mol/L HCl调节pH至3.5,加入3倍体积的冷丙酮,4 ℃冷藏过夜,离心(6000 r/min,40 min,4 ℃)取沉淀,冷冻干燥制得黑木耳糖蛋白粗提取物。
1.2.2 单因素实验
1.2.2.1 超声功率对糖蛋白提取的影响
固定提取温度为40 ℃,pH为8.4,超声时间为60 min,料液比为1:90 g/L,在超声功率分别为125、150、175、200、225、250 W进行提取。
1.2.2.2 提取温度对糖蛋白提取的影响
固定超声功率为200 W,pH为8.4,超声时间为60 min,料液比为1:90 g/L,在提取温度分别为35、40、45、50、55、60 ℃进行提取。
1.2.2.3 pH对糖蛋白提取的影响
固定超声功率为200 W,提取温度为45 ℃,超声时间为60 min,料液比为1:90 g/L,在pH分别为7.6、7.8、8.0、8.2、8.4、8.6进行提取。
1.2.2.4 超声时间对糖蛋白提取的影响
固定超声功率为200 W,提取温度为45 ℃,pH为8.4,料液比为1:90 g/L,在超声时间分别为30、60、90、120、150、180 min进行提取。
1.2.2.5 料液比对糖蛋白提取的影响
固定超声功率为200 W,提取温度为45 ℃,pH为8.4,超声时间为90 min,在料液比分别为1:50、1:60、1:70、1:80、1:90、1:100 g/L进行提取。
1.2.3 考马斯亮蓝法测定粗糖蛋白中蛋白质含量
1.2.3.1 蛋白质标准曲线
分别移取100 μg/mL BSA(牛血清蛋白)标准液0、0.2、0.4、0.6、0.8和1.0 mL于10 mL刻度试管中,并用蒸馏水定容至1 mL,加入5 mL考马斯亮蓝,充分摇匀后静置2 min,在595 nm波长下测定吸光度,以蛋白质质量浓度作横坐标,吸光度作纵坐标,绘制标准曲线[26]。标准曲线方程为y=0.0068x+0.0106,R2=0.9992。
1.2.3.2 样品中蛋白质含量测定
将样品稀释50倍后,取1 mL于25 mL具塞试管中,再加入5 mL考马斯亮蓝,摇匀后静置5 min,在595 nm测吸光度,以样品吸光度根据标准曲线公式计算相应的黑木耳糖蛋白样品中蛋白质的浓度,而后按下式计算蛋白质含量。
式中:C:蛋白质浓度,μg/mL;V:提取液体积,mL;M:黑木耳质量,g。
1.2.4 苯酚-硫酸法测定粗糖蛋白中总糖含量
1.2.4.1 总糖标准曲线
分别移取100 μg/mL葡萄糖标准液0、0.2、0.4、0.6、0.8和1.0 mL于25 mL刻度试管中,并分别加蒸馏水至1 mL,分别加入5 mL浓硫酸和1 mL浓度为6%的苯酚溶液,充分摇匀后静置20 min,在490 nm波长下测定吸光度,以葡萄糖质量浓度作横坐标,吸光度作纵坐标,绘制标准曲线[27]。标准曲线方程为y=0.0105x+0.0138,R2=0.9989。
1.2.4.2 样品中总糖含量测定
将样品稀释50倍后,准确吸取1 mL稀释后的样品于25 mL具塞试管中,再向试管中准确加入5 mL浓硫酸和1 mL浓度为6%的苯酚溶液,摇匀后静置20 min,在490 nm处测吸光值,以吸光度结合标准曲线公式计算出相应样品中的总糖浓度,而后按下式计算总糖含量。
式中:C:总糖浓度,μg/mL;V:提取液体积,mL;M:黑木耳质量,g。
1.2.5 响应面试验
对黑木耳糖蛋白提取方法的单因素进行筛选,选取料液比、超声时间、pH以及超声功率这四个因素,以糖蛋白综合评分为评价指标,根据Design_Expert8.0.6.1软件中的Box-Behnken试验原理,设计响应面试验,根据试验结果了解各种因素在糖蛋白提取中产生的影响,确定黑木耳糖蛋白最佳提取条件。试验水平及因素见表1。
表 1 Box-Behnken试验因素与水平Table 1. Factors and levels used in Box-Behnken水平 因素 X1料液比(g/L) X2超声时间(min) X3 pH X4超声功率(W) −1 1:80 60 8.2 175 0 1:90 90 8.4 200 1 1:100 120 8.6 225 1.2.6 糖蛋白综合评分的计算
由于糖蛋白是由蛋白质与糖类结合而成的复合物[28],在研究中以提取物的蛋白质含量和总糖含量的综合评分作为评价指标,按下式计算糖蛋白的综合评分[29]。
式中:H:综合评分;X:样品蛋白质含量,mg/g;Y:样品多糖含量,mg/g。
1.2.7 黑木耳糖蛋白的分离纯化
精准称取20 mg糖蛋白冻干粉,溶于2 mL去离子水中,注入AKTAgo仪器中,采用DEAE GE Healthcare色谱柱进行分离,以1 moL/L NaCl和去离子水按比例机器自动混合进行梯度洗脱,收集各紫外检测峰处洗脱液,采用苯酚-硫酸法测定糖含量,收集紫外检测峰与糖峰重合的洗脱液,冷冻干燥。分别按以下公式计算糖蛋白得率、纯度和回收率。
式中:m0:糖蛋白质量,mg;m1:黑木耳质量,mg;m2:纯化样品质量,mg;m3:黑木耳中蛋白质质量,mg。
1.2.8 单糖组成分析
1.2.8.1 样品处理
在水解管中加入20 mg样品,向其中加入1 mL 4 mol/L的三氟乙酸,然后将水解管置于烘箱中,将温度调至120 ℃,使样品在其中水解2 h,取出用氮气吹干;向吹干后的样品中加入1 mL 0.5 mol/L PMP-甲醇溶液以及0.5 mL 0.3 mol/L NaOH溶液,在温度为70 ℃的水浴锅中水浴1 h,冷却后加0.5 mL 0.3 mol/L HCl溶液以及0.5 mL氯仿,震荡均匀后静置20 min,弃下层,以相同的方法萃取三次后,收集水层,通过过滤膜进行上机检测。
1.2.8.2 色谱条件
所用色谱柱为C18 SHISEIDO(4.6 mm×250 mm×5 μm);流动相:A为0.1 mol/L磷酸二氢钾(pH6.8);B为乙腈;A:B=82:18;检测柱温度设为25 ℃;样品检测量为10 μL;流动相以1 mL/min流经检测系统;紫外可见吸收检测器的波长为245 nm。
式中:V:定容体积,2 mL;N:稀释倍数,1;CX:检测浓度,mg/g;C0:空白;m:称样量,mg;X:样品浓度,mg/g。
1.2.9 氨基酸组成分析
1.2.9.1 样品处理
分别取两份20 mg样品于两个水解管中,其中一份加入20 mL HCl(用于除色氨酸以外的17种氨基酸的测定),另一份加入20 mL 4.3 mol/L NaOH(用于色氨酸的测定),充氮气封管后放入110 ℃电热鼓风干燥箱中水解22~24 h,取出冷却后,转移至25 mL比色管中定容;分取1 mL清液,85 ℃水浴吹干,加水1 mL,吹干;加入10 mL 0.02 mol/L HCl,混匀,分取500 μL,加入250 μL 0.1 mol/L异硫氰酸苯酯乙腈,250 μL 1 mol/L三乙胺乙腈,氮气保护衍生1 h;加入2 mL正己烷,震荡,静置。分层后取下层过0.45 μm有机滤膜上机。
1.2.9.2 色谱条件
所用色谱柱为C18 SHISEIDO(4.6 mm×250 mm×5 μm);流动相A为0.05 mol/L磷酸二氢钾:流动相B为乙腈;流动相洗脱梯度见表2,检测柱温设置为35 ℃;检测样品量为10 μL,用二极管阵列检测器(Diode array detector,DAD)进行检测。
表 2 流动相洗脱梯度Table 2. Elution gradient of mobile phase时间(min) 流速(mL/min) 流动相A(%) 流动相B(%) 0.0 1.2 100 0 10.0 1.2 80 20 15.0 1.2 100 0 25.0 1.2 100 0 1.3 数据处理
每组实验重复3次并取平均值,实验结果以平均值±标准差表示。采用Design_Expert 8.0.6.1软件设计分析响应面,采用Origin 2019作图,采用SPSS 17.0进行数据处理与分析。
2. 结果与分析
2.1 单因素条件的确定
2.1.1 不同超声功率对糖蛋白提取的影响
如图1所示,为不同超声功率对样品糖蛋白含量及综合评分的影响。通过计算得到蛋白质与葡萄糖的综合评分,在超声功率为200 W时综合评分最高,为55.8分,此时蛋白质含量为39.2 mg/g,总糖含量为80.7 mg/g。超声功率低于200 W时,综合评分呈现出明显的增长趋势,超过200 W时,糖蛋白含量虽有下降,但趋势不大。由此可见利用超声可以使黑木耳中的糖蛋白更好地溶于溶剂,但超声功率超过200 W时,糖蛋白含量下降,不利于糖蛋白的提取。薛张芝等[30]提取了墨鱼缠卵腺糖蛋白,在超声功率为200 W时糖蛋白的率最高。因此本实验的超声功率确定为200 W。
2.1.2 不同提取温度对糖蛋白提取的影响
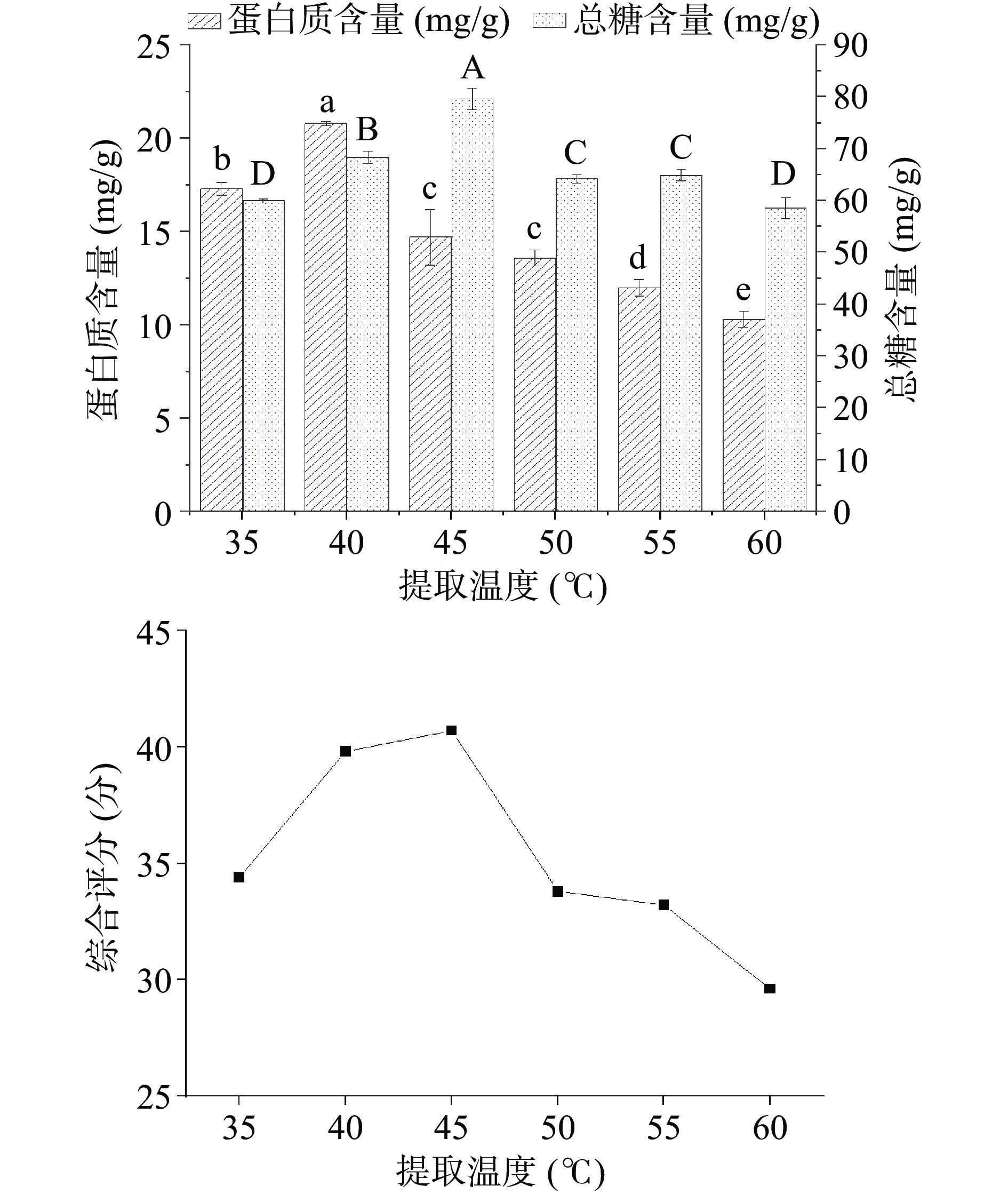
如图2所示,为不同提取温度对样品糖蛋白含量及综合评分的影响。通过计算得到蛋白质与葡萄糖的综合评分,随着提取温度的增加,先增大后下降,在提取温度为45 ℃时综合评分达到最大值为40.7分,此时蛋白质含量为14.7 mg/g,总糖含量为79.6 mg/g,在35~45 ℃时差异显著(P<0.05),由此可见适当增加提取温度有利于增加糖蛋白的提取率,但是当温度过高时则会降低糖蛋白活性,从而导致含量降低的情况[31]。赵胜男等[32]提取了桔梗糖蛋白,在提取温度为45 ℃时糖蛋白得率最高。因此将温度控制在45 ℃进行提取。
2.1.3 不同pH对糖蛋白提取的影响
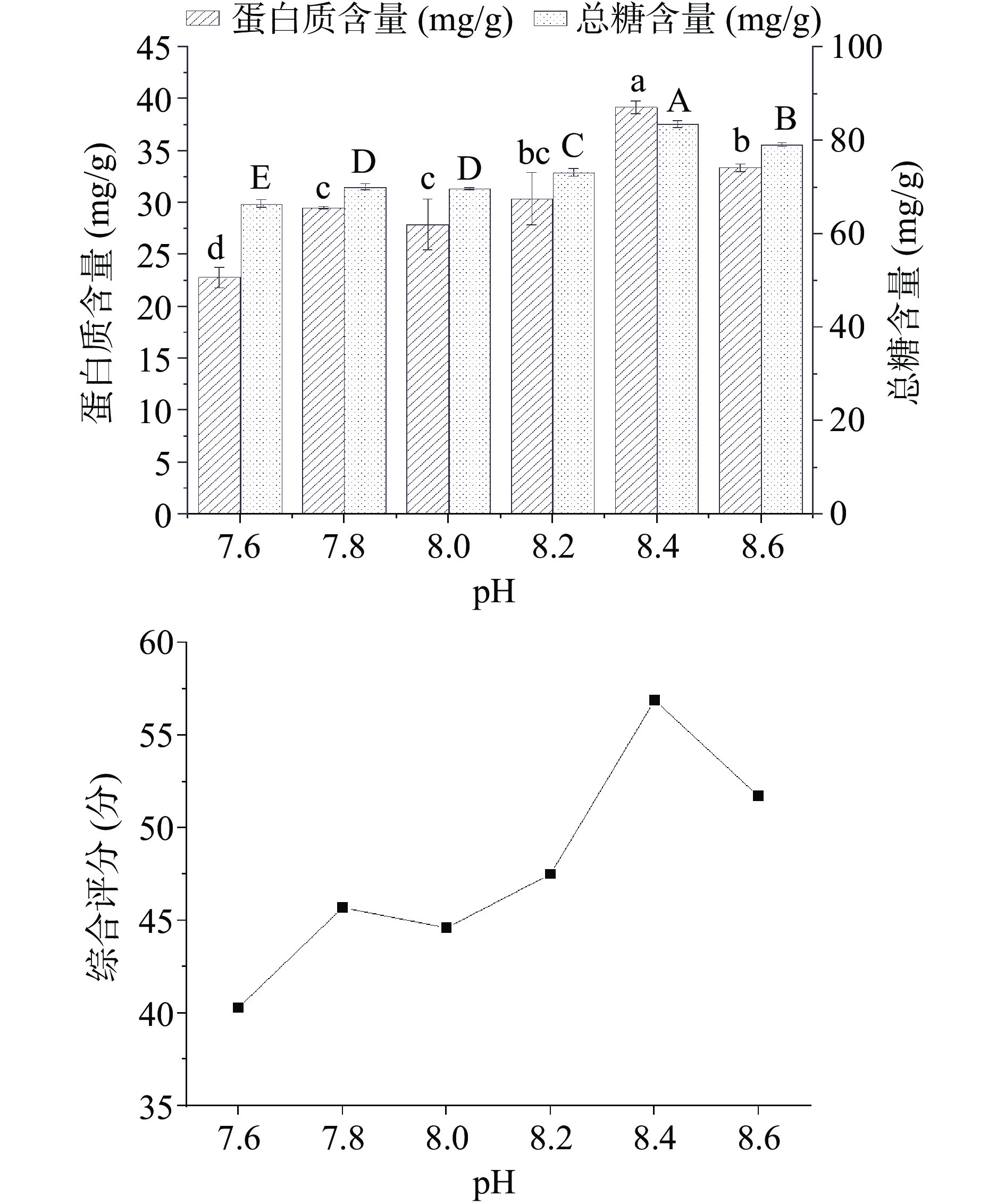
如图3所示,为不同pH对样品糖蛋白含量及综合评分的影响。通过计算得到蛋白质与葡萄糖的综合评分,随着pH的变大,先增大后下降,在pH为8.4时达到最大,综合评分为56.9分,此时蛋白质含量为39.2 mg/g,总糖含量为83.5 mg/g。由此可见增加缓冲液pH有利于增加糖蛋白的提取率,但当pH过高,使溶液呈过碱性时,糖蛋白的结构、活性会被破坏[33],从而使糖蛋白含量降低,因此确定最佳pH为8.4。
2.1.4 不同超声时间对糖蛋白提取的影响
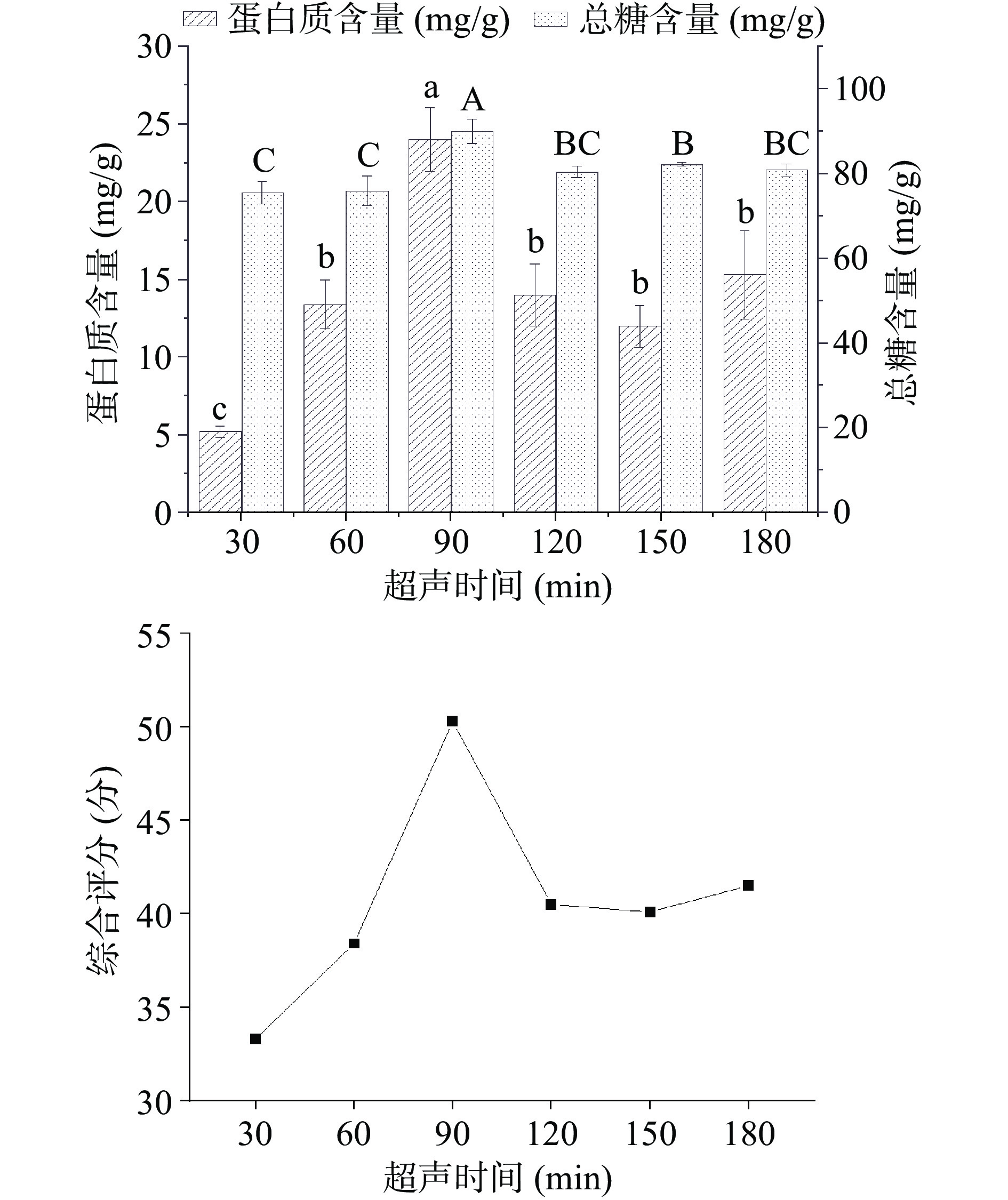
如图4所示,为研究不同的超声时间对样品糖蛋白含量及综合评分的影响。通过计算得到蛋白质与葡萄糖的综合评分,随超声时间的延长而先上升后下降,在超声时间为90 min时综合评分达到最大值,为50.3分,此时蛋白质含量为24 mg/g,总糖含量为89.9 mg/g。由此可见增加超声时间有利于增加糖蛋白的提取率,但是当超声时间过长时,可能使糖蛋白链发生断裂,其结构被破坏[34],从而导致含量降低。因此选择超声时间为90 min。
2.1.5 不同料液比对糖蛋白提取的影响
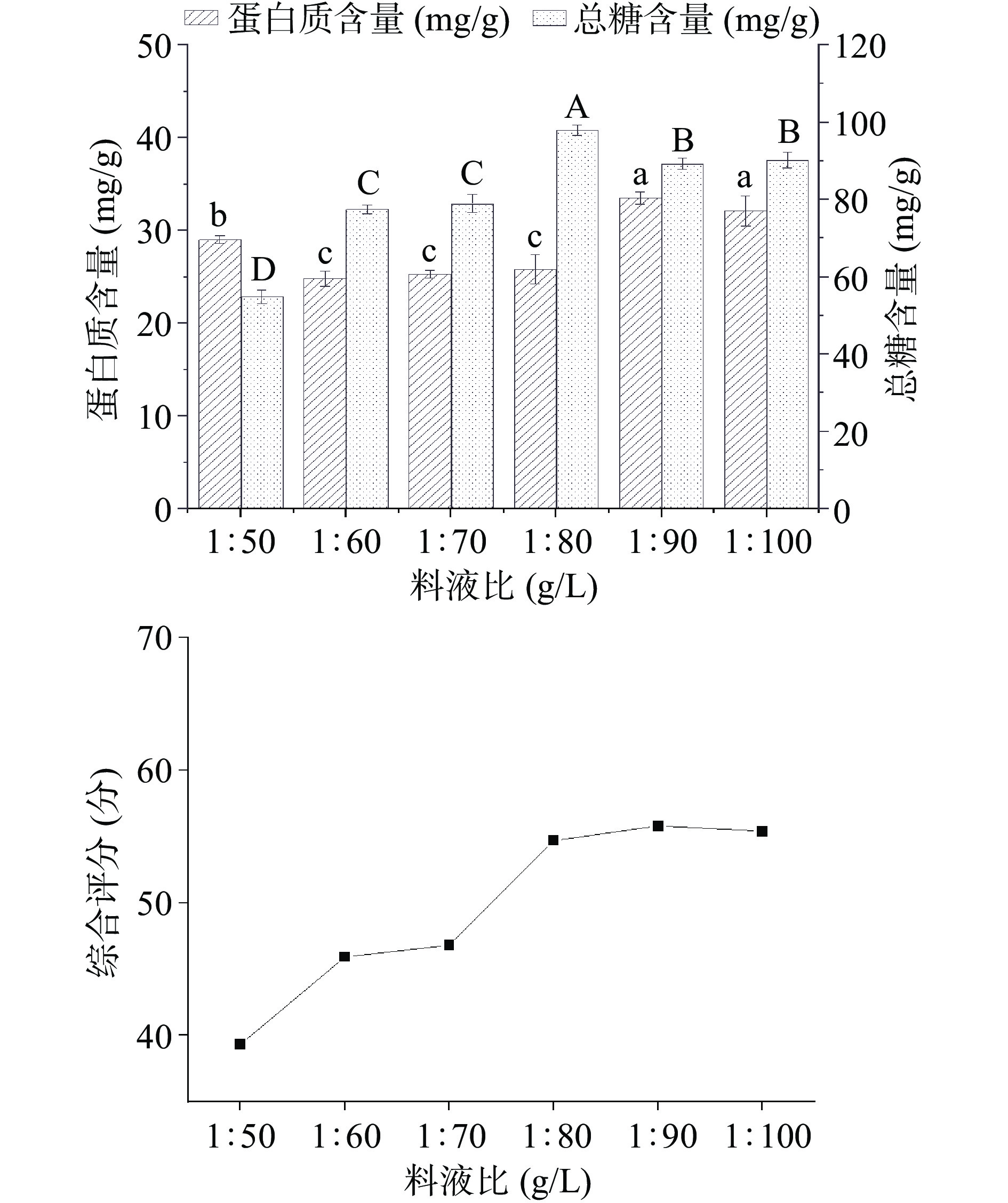
如图5所示,为不同料液比对样品糖蛋白含量及综合评分的影响。通过计算得到蛋白质与葡萄糖的综合评分,随料液比的增大而先增大后略有下降,当料液比为1:90 g/L时综合评分最高,为55.8分,此时蛋白质含量为33.5 mg/g,总糖含量为89.25 mg/g。由此可见增加料液比有利于增加糖蛋白的提取率,但是随着料液比增加,糖和蛋白质溶出达到平衡点[35],为了节约实验试剂用量和提高糖蛋白提取效率,本实验选择1:90 g/L进行提取。
2.2 响应面结果分析
2.2.1 显著性分析
响应面设计及结果见表3。根据Design-expert.V 8.0.6对试验数据的分析,得出料液比、超声时间、超声功率及pH对糖蛋白综合评分影响的多元二次回归方程为:Y=−15448.93+10.34X1+2.63X2+3452.69X3+4.06X4−6.22×10−5X1X2+ 0.43X1X3+4.60×10−3X1X4−0.13X2X3−1.91×10−4X2X4−0.02X3X4−0.08X12−8.10×10−3X22−206.73X32−0.01X42。
表 3 响应面试验设计方案及结果Table 3. Experimental scheme and results of response surface methodology试验号 X1 X2 X3 X4 Y综合评分(分) 1 0 1 1 0 44.75 2 0 −1 0 −1 44.31 3 −1 0 1 0 38.99 4 0 0 0 0 56.13 5 0 −1 0 1 43.07 6 −1 0 0 −1 43.88 7 1 0 −1 0 40.98 8 0 1 0 −1 45.15 9 0 −1 −1 0 42.75 10 0 0 −1 1 43.76 11 1 0 1 0 40.85 12 1 −1 0 0 39.87 13 1 0 0 1 42.70 14 1 1 0 0 41.71 15 0 0 0 0 56.01 16 0 0 1 1 41.75 17 0 0 −1 −1 38.69 18 −1 0 0 1 40.79 19 1 0 0 −1 40.20 20 0 0 0 0 55.88 21 0 0 0 0 56.11 22 0 0 1 −1 39.88 23 0 1 −1 0 42.09 24 −1 0 −1 0 40.79 25 0 −1 1 0 41.09 26 −1 1 0 0 39.80 27 −1 −1 0 0 37.88 28 0 0 0 0 55.89 29 0 1 0 1 41.39 由表4可知此法黑木耳蛋白提取模型高度显著(P<0.0001),失拟项不显著(P>0.05),决定系数R2=0.9563,校正决定系数R2Adj=0.9127,此模型拟合度良好,可用该模型对黑木耳糖蛋白提取的综合评分进行预测分析。
表 4 回归方程系数及显著性检验Table 4. Regression equation coefficient and significance test模型来源 SS df MS F值 P值 显著性 模型 9.59 14 1.44 21.91 <0.0001 *** X1 料液比 0.59 1 0.59 10.095 0.0076 ** X2 超声时间 0.06 1 0.06 0.80 0.3863 X3 pH 0.71 1 0.71 11.14 0.0303 * X4 超声功率 0.6 1 0.6 10.022 0.0088 ** X1X2 1.394E-003 1 1.394E-003 4.291E-004 0.3838 X1X3 0.63 1 0.63 10.89 0.0019 ** X1X4 0.77 1 0.77 11.63 0.0024 ** X2X3 0.6 1 0.60 10.78 0.0320 * X2X4 0.58 1 0.58 10.025 0.0358 * X3X4 0.59 1 0.59 7.182E-003 0.0137 * X12 7.11 1 7.11 135.22 <0.0001 *** X22 6.51 1 6.51 106.09 <0.0001 *** X32 7.56 1 7.56 136.59 <0.0001 *** X42 5.64 1 5.64 91.35 <0.0001 *** 残差 4.54 14 3.25 失拟项 4.05 10 4.05 3.28 0.1320 不显著 纯误差 0.49 4 1.24 总离差 104.13 28 注:*P<0.05;**P<0.01;***P<0.001;R2=0.9563;R2Adj=0.9127。 2.2.2 交互作用分析
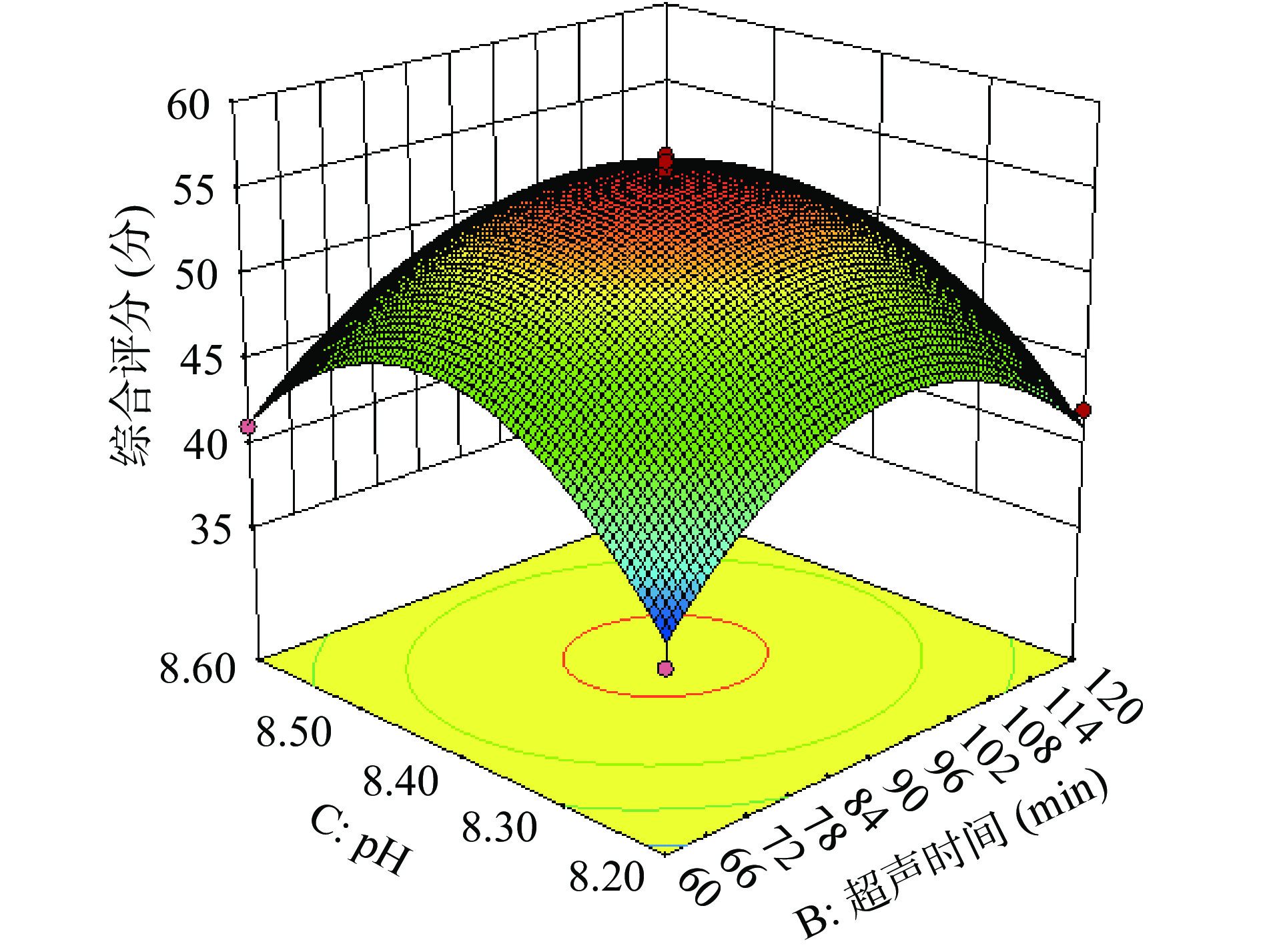
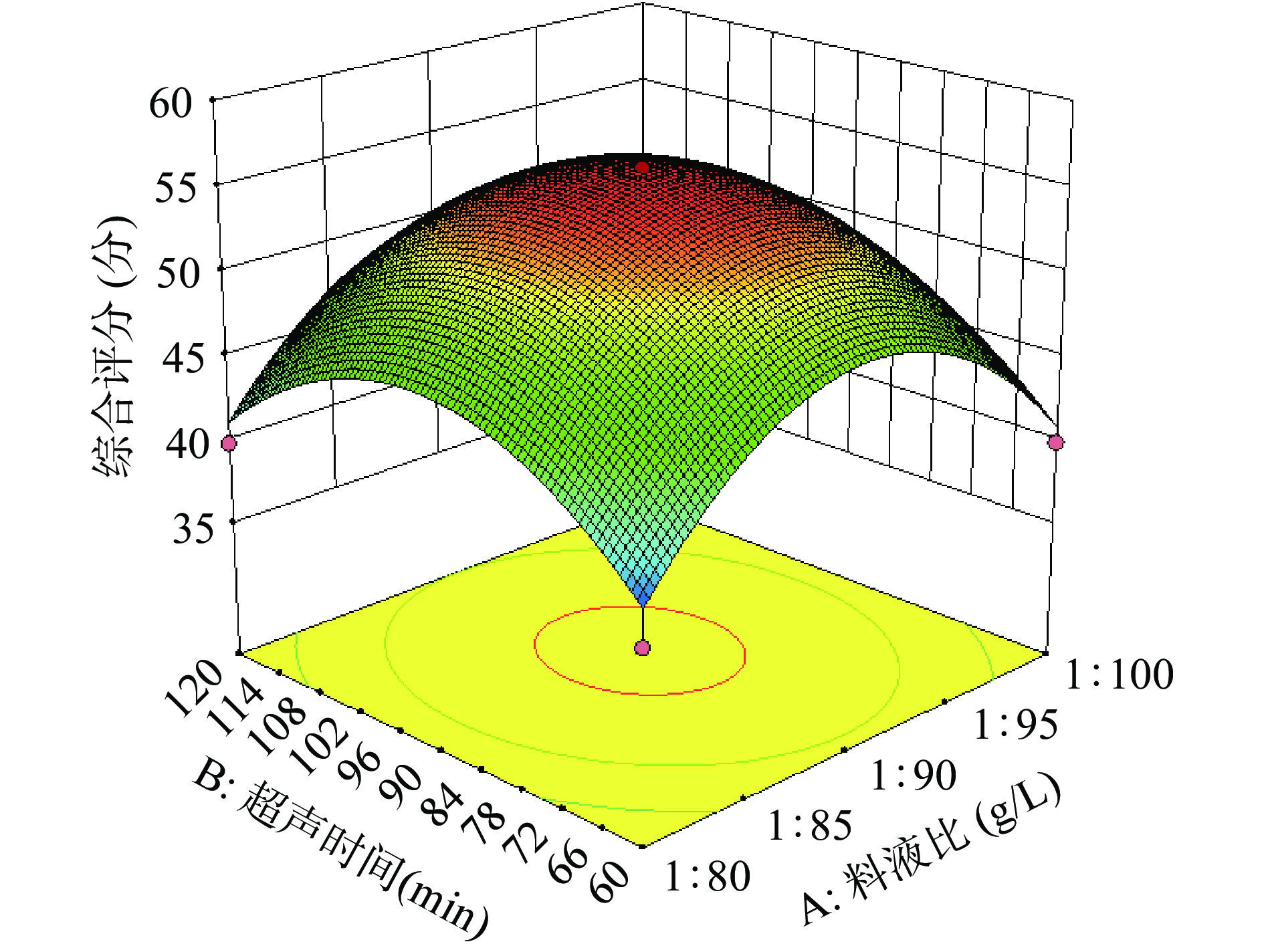
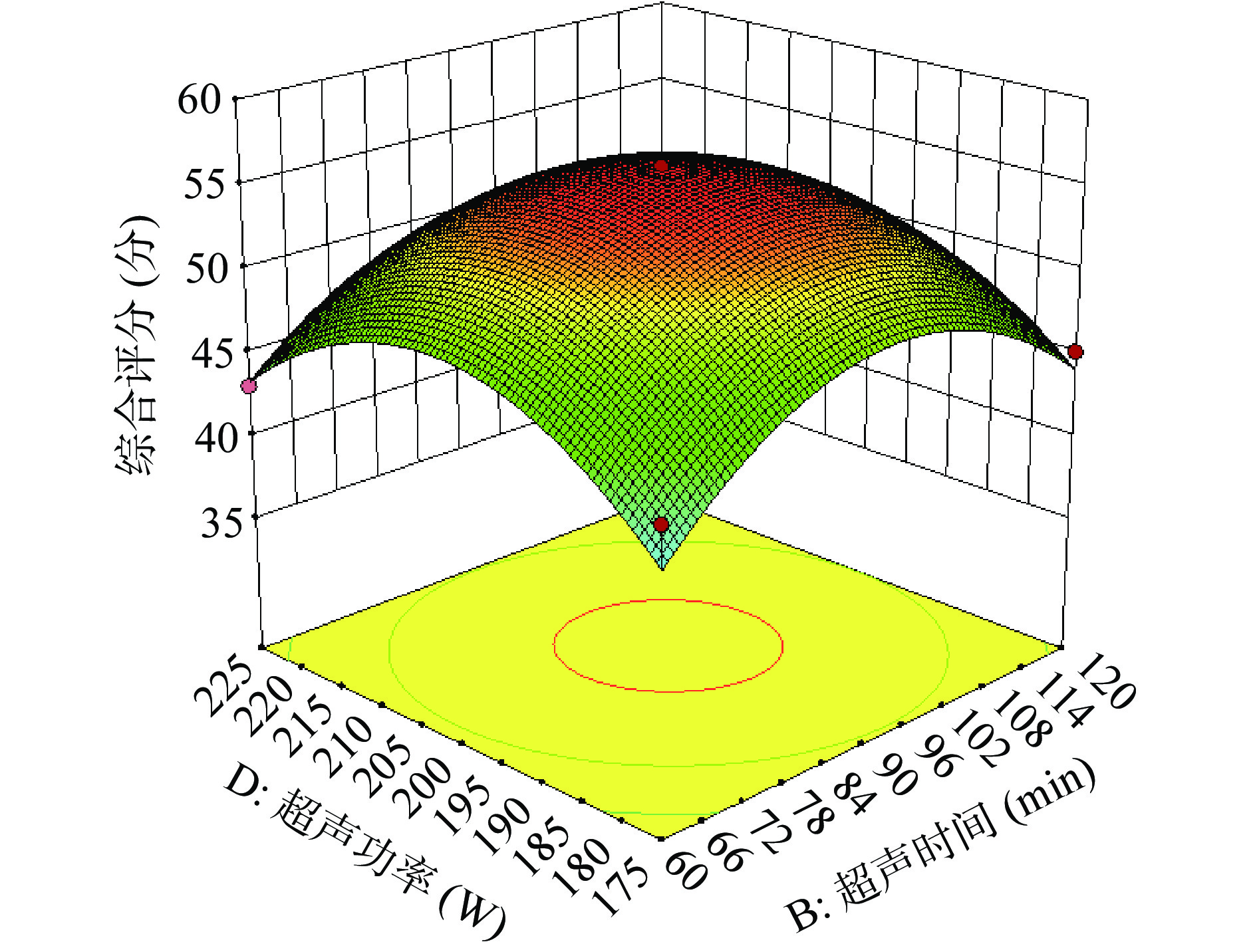
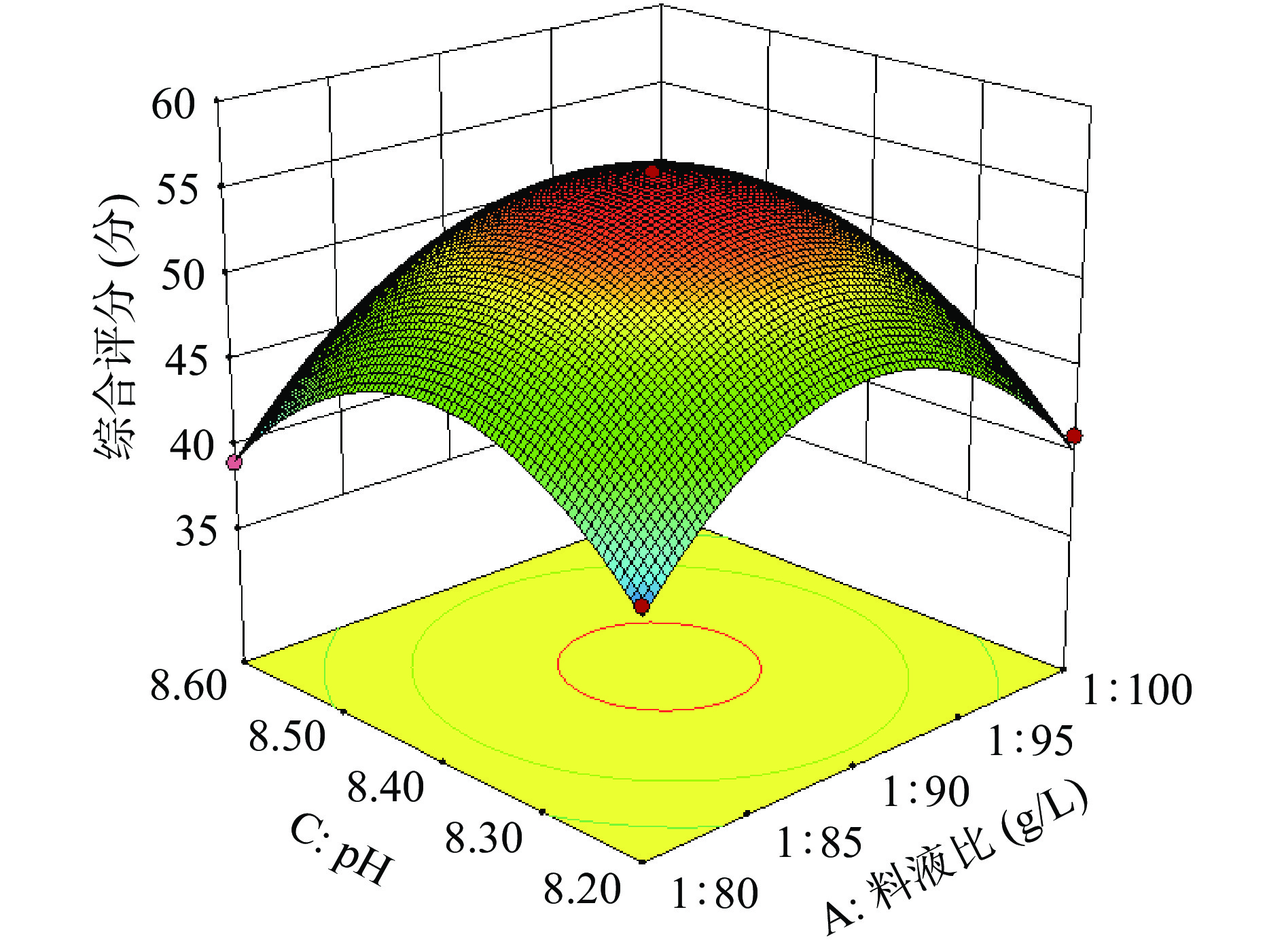
图6~图11为各因素交互的等高线图。在等高线的形状中,椭圆形和圆形分别表示交互作用的显著和不显著。在此试验中料液比以及超声功率对综合评分的影响都极显著(P<0.01),pH对综合评分的影响显著(P<0.05),超声时间对综合评分的影响不显著(P>0.05);交互作用:料液比与pH、料液比与超声功率这两组交互作用对综合评分的影响极显著(P<0.01),超声时间与pH、超声时间与超声功率、pH与超声功率对综合评分的影响显著(P<0.05),料液比与超声时间对综合评分的影响不显著(P>0.05)。
由响应面得到的黑木耳糖蛋白的最佳提取工艺条件为:料液比1:90.22 g/L、超声时间91.1 min、缓冲溶液pH8.4、超声功率200.23 W,此时糖蛋白提取的理论综合评分为56.02分。根据实验的可操作性与验证实验的准确性,确定本实验的实际操作条件:料液比为1:90 g/L、pH为8.4、超声时间为90 min、超声功率为200 W,进行三次平行实验,所得综合评分的平均值为55.93分,误差较小,说明响应面的拟合度较好,能够较好地预测出实验条件以及糖蛋白的综合评分。
2.3 黑木耳糖蛋白的分离纯化
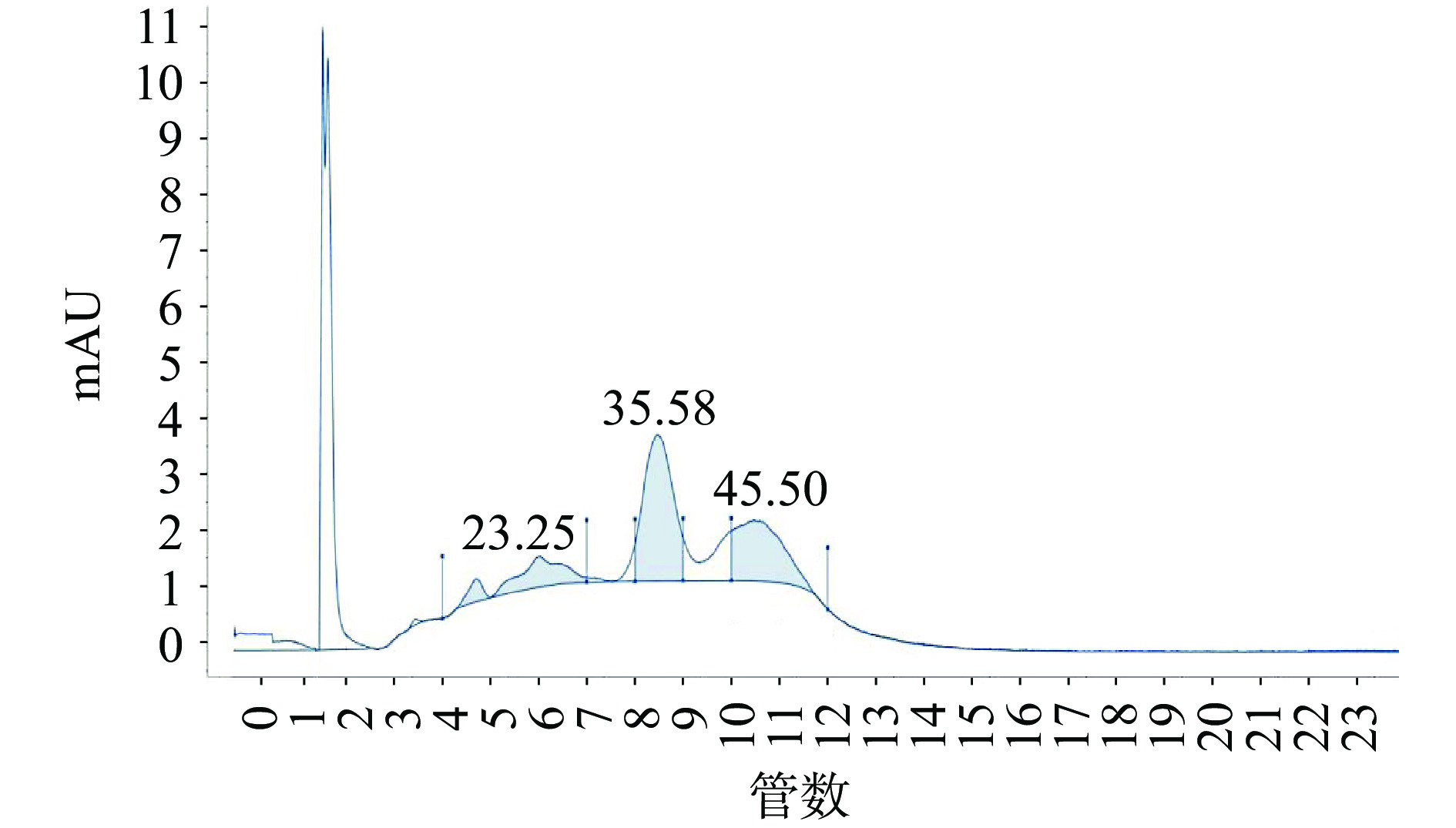
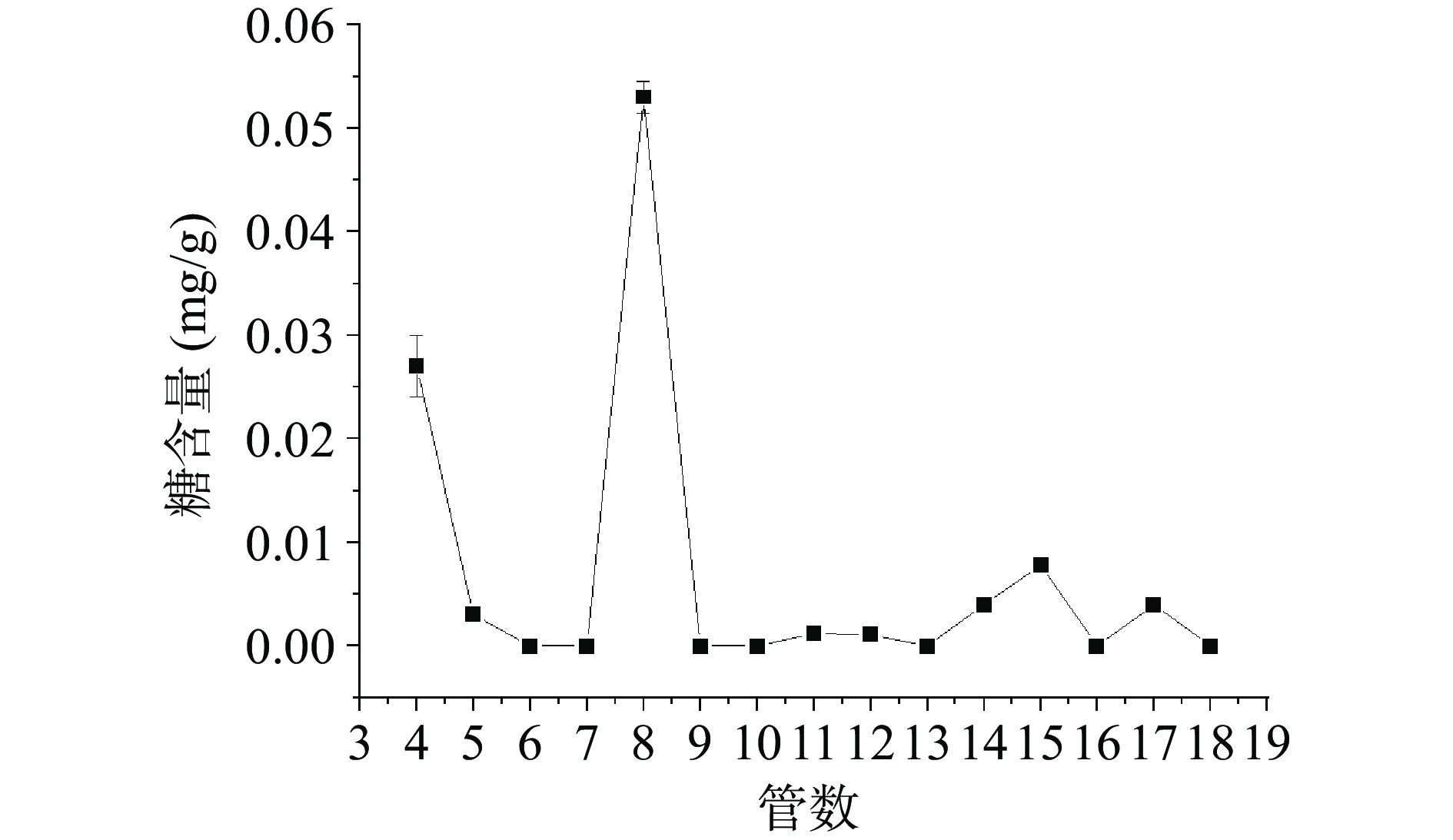
图12为NaCl梯度洗脱紫外检测曲线,其中横坐标为样品管号、纵坐标是紫外检测mAU,图12中0~3管仅为去离子水洗脱,4管之后为不同浓度的NaCl梯度洗脱曲线。由图12可知,主要的蛋白质峰有三个,分别为5~6管、8管和10~11管,其中,第8管蛋白质峰最高。收集洗脱后的样品,测定其中的糖含量,如图13所示,第8管出现较高糖峰,结合紫外检测峰,可以推断第8管中可能含有较高糖蛋白,根据AKTA数据分析可知,分离第8管时的洗脱液NaCl溶液的浓度为0.15 mol/L,因此,确定黑木耳糖蛋白的洗脱盐浓度为0.15 mol/L NaCl。
图14为DEAE洗脱曲线,其中粗糖蛋白的进样量为20 mg,流速设置为1 mL/min,先将NaCl溶液浓度设置为0.1 mol/L,将第一段蛋白洗脱下来后,再将NaCl溶液浓度调至0.15 mol/L,洗脱糖蛋白,收集这部分洗脱液,即为糖蛋白纯品。将这部分的洗脱液先浓缩、再透析、最后进行冷冻干燥,即可得到黑木耳糖蛋白。此纯化条件制备的糖蛋白的纯度为74.1%,蛋白回收率为37.5%。
2.4 单糖组成分析
由表5可知,黑木耳糖蛋白中含有7种单糖,其中主要为葡萄糖和甘露糖,半乳糖次之,含量分别为9.95、5.24和2.34 mg/g,且有葡萄糖醛酸被检测出,表明黑木耳糖蛋白分子上可能含有酸性杂多糖组分[36]。鼠李糖、阿拉伯糖和半乳糖醛酸未被检出。Shi等[37]对锁阳糖蛋白进行分离纯化并分析其单糖组成,结果表明锁阳糖蛋白由木糖、葡萄糖、甘露糖和半乳糖组成,与本实验结果相比缺少核糖和岩藻糖组分。
表 5 黑木耳糖蛋白的单糖组成Table 5. Monosaccharide composition of glycoprotein of Auricularia auricula名称 保留时间(min) 测定结果(mg/g) 甘露糖 18.01 5.24 核糖 23.92 0.41 鼠李糖 24.97 未检出(<0.0015) 葡萄糖醛酸 30.08 0.77 半乳糖醛酸 34.26 未检出(<0.0018) 葡萄糖 39.37 9.95 半乳糖 45.32 2.34 木糖 47.99 1.31 阿拉伯糖 49.89 未检出(<0.0013) 岩藻糖 57.88 1.03 2.5 氨基酸组成分析
如表6所示,在对18种常见氨基酸组成进行分析时,检出了17种氨基酸,其中,8种人体必需氨基酸(总含量为4.72 mg/g)及婴幼儿必需的组氨酸齐全,而由于检测方法的限制,L-胱氨酸未检出。其中,含量最高的氨基酸是L-天冬氨酸/L-天冬酰胺,达到了1.16 mg/g;其次是L-苯丙氨酸和L-谷氨酸/L-谷氨酰胺,分别为1.14和1.10 mg/g。徐永健等[38]纯化了海马糖蛋白并从中检测出了16种氨基酸,仅色氨酸未检出,其余氨基酸组成与本研究一致。
表 6 黑木耳糖蛋白中氨基酸组成Table 6. Amino acid composition of glycoprotein of Auricularia auricula名称 保留时间(min) 测定结果(mg/g) L-天冬氨酸/L-天冬酰胺 5.24 1.16 L-谷氨酸/L-谷氨酰胺 5.95 1.10 L-丝氨酸 9.32 0.44 L-甘氨酸 9.83 0.52 L-组氨酸b 10.23 0.35 L-精氨酸 11.07 0.57 L-苏氨酸ab 11.65 0.87 L-丙氨酸 12.06 0.78 L-脯氨酸 12.36 0.58 L-酪氨酸 15.99 0.40 L-缬氨酸ab 17.10 0.60 L-蛋氨酸ab 17.94 0.10 L-胱氨酸 19.40 未检出(<0.02) L-异亮氨酸ab 20.23 0.44 L-亮氨酸ab 20.62 0.83 L-苯丙氨酸ab 22.78 1.14 L-赖氨酸ab 25.31 0.40 L-色氨酸ab 6.54 0.34 注:a为人体必需氨基酸;b为儿童必需氨基酸。 3. 结论
本文以超声波辅助碱法提取黑木耳糖蛋白,单因素实验和响应面法优化得到的最佳提取条件为超声时间90 min、料液比1:90 g/L、超声功率200 W、pH 8.4、提取温度45 ℃,此条件下糖蛋白提取的综合评分为55.93分;采用阴离子交换蛋白纯化系统,经0.15 mol/L NaCl溶液洗脱纯化得到的糖蛋白纯度为74.1%,蛋白回收率为37.5%。研究发现,黑木耳糖蛋白中含有7种单糖,其中,葡萄糖和甘露糖含量较高,其次为半乳糖,且有酸性杂多糖组分存在;黑木耳糖蛋白中L-天冬氨酸/L-天冬酰胺、L-苯丙氨酸、L-谷氨酸/L-谷氨酰胺含量较高,且8种必需氨基酸及婴幼儿所必须的组氨酸齐全。通过以上研究,可为深入了解与开发黑木耳糖蛋白提供一定的理论基础。
-
表 1 Box-Behnken试验因素与水平
Table 1 Factors and levels used in Box-Behnken
水平 因素 X1料液比(g/L) X2超声时间(min) X3 pH X4超声功率(W) −1 1:80 60 8.2 175 0 1:90 90 8.4 200 1 1:100 120 8.6 225 表 2 流动相洗脱梯度
Table 2 Elution gradient of mobile phase
时间(min) 流速(mL/min) 流动相A(%) 流动相B(%) 0.0 1.2 100 0 10.0 1.2 80 20 15.0 1.2 100 0 25.0 1.2 100 0 表 3 响应面试验设计方案及结果
Table 3 Experimental scheme and results of response surface methodology
试验号 X1 X2 X3 X4 Y综合评分(分) 1 0 1 1 0 44.75 2 0 −1 0 −1 44.31 3 −1 0 1 0 38.99 4 0 0 0 0 56.13 5 0 −1 0 1 43.07 6 −1 0 0 −1 43.88 7 1 0 −1 0 40.98 8 0 1 0 −1 45.15 9 0 −1 −1 0 42.75 10 0 0 −1 1 43.76 11 1 0 1 0 40.85 12 1 −1 0 0 39.87 13 1 0 0 1 42.70 14 1 1 0 0 41.71 15 0 0 0 0 56.01 16 0 0 1 1 41.75 17 0 0 −1 −1 38.69 18 −1 0 0 1 40.79 19 1 0 0 −1 40.20 20 0 0 0 0 55.88 21 0 0 0 0 56.11 22 0 0 1 −1 39.88 23 0 1 −1 0 42.09 24 −1 0 −1 0 40.79 25 0 −1 1 0 41.09 26 −1 1 0 0 39.80 27 −1 −1 0 0 37.88 28 0 0 0 0 55.89 29 0 1 0 1 41.39 表 4 回归方程系数及显著性检验
Table 4 Regression equation coefficient and significance test
模型来源 SS df MS F值 P值 显著性 模型 9.59 14 1.44 21.91 <0.0001 *** X1 料液比 0.59 1 0.59 10.095 0.0076 ** X2 超声时间 0.06 1 0.06 0.80 0.3863 X3 pH 0.71 1 0.71 11.14 0.0303 * X4 超声功率 0.6 1 0.6 10.022 0.0088 ** X1X2 1.394E-003 1 1.394E-003 4.291E-004 0.3838 X1X3 0.63 1 0.63 10.89 0.0019 ** X1X4 0.77 1 0.77 11.63 0.0024 ** X2X3 0.6 1 0.60 10.78 0.0320 * X2X4 0.58 1 0.58 10.025 0.0358 * X3X4 0.59 1 0.59 7.182E-003 0.0137 * X12 7.11 1 7.11 135.22 <0.0001 *** X22 6.51 1 6.51 106.09 <0.0001 *** X32 7.56 1 7.56 136.59 <0.0001 *** X42 5.64 1 5.64 91.35 <0.0001 *** 残差 4.54 14 3.25 失拟项 4.05 10 4.05 3.28 0.1320 不显著 纯误差 0.49 4 1.24 总离差 104.13 28 注:*P<0.05;**P<0.01;***P<0.001;R2=0.9563;R2Adj=0.9127。 表 5 黑木耳糖蛋白的单糖组成
Table 5 Monosaccharide composition of glycoprotein of Auricularia auricula
名称 保留时间(min) 测定结果(mg/g) 甘露糖 18.01 5.24 核糖 23.92 0.41 鼠李糖 24.97 未检出(<0.0015) 葡萄糖醛酸 30.08 0.77 半乳糖醛酸 34.26 未检出(<0.0018) 葡萄糖 39.37 9.95 半乳糖 45.32 2.34 木糖 47.99 1.31 阿拉伯糖 49.89 未检出(<0.0013) 岩藻糖 57.88 1.03 表 6 黑木耳糖蛋白中氨基酸组成
Table 6 Amino acid composition of glycoprotein of Auricularia auricula
名称 保留时间(min) 测定结果(mg/g) L-天冬氨酸/L-天冬酰胺 5.24 1.16 L-谷氨酸/L-谷氨酰胺 5.95 1.10 L-丝氨酸 9.32 0.44 L-甘氨酸 9.83 0.52 L-组氨酸b 10.23 0.35 L-精氨酸 11.07 0.57 L-苏氨酸ab 11.65 0.87 L-丙氨酸 12.06 0.78 L-脯氨酸 12.36 0.58 L-酪氨酸 15.99 0.40 L-缬氨酸ab 17.10 0.60 L-蛋氨酸ab 17.94 0.10 L-胱氨酸 19.40 未检出(<0.02) L-异亮氨酸ab 20.23 0.44 L-亮氨酸ab 20.62 0.83 L-苯丙氨酸ab 22.78 1.14 L-赖氨酸ab 25.31 0.40 L-色氨酸ab 6.54 0.34 注:a为人体必需氨基酸;b为儿童必需氨基酸。 -
[1] 陈佳琪, 陆晓丹, 林瑞榕, 等. 食源性糖蛋白研究进展[J]. 食品科技,2021,46(12):263−268. [CHEN J Q, LU X D, LIN R R, et al. Research progress of foodborne glycoprotein[J]. Food Science and Technology,2021,46(12):263−268. doi: 10.3969/j.issn.1005-9989.2021.12.spkj202112043 [2] 徐多多, 王海洋, 孙濛濛, 等. 平菇等六种食用真菌糖蛋白的理化性质及对顺铂诱导肾细胞损伤恢复的作用[J]. 浙江农业学报,2016,28(9):1538−1543. [XU D D, WANG H Y, SUN M M, et al. Studies on physiochemical property and restoration on cisplatin-induced renal cell injury of the glycoprotein from six different edible fungus[J]. Acta Agriculturae Zhejiangensis,2016,28(9):1538−1543. doi: 10.3969/j.issn.1004-1524.2016.09.12 [3] 袁丽萍, 王宝宇, 欧阳敏, 等. 美洲大蠊糖蛋白分子量分布及氨基酸和单糖组成分析[J]. 广东化工,2022,49(12):56−59. [YUAN L P, WANG B Y, OU Y M, et al. Molecular weight distribution and amino acid and monosaccharide composition of periplaneta Americana glycoprotein[J]. Guangdong Chemical Industry,2022,49(12):56−59. doi: 10.3969/j.issn.1007-1865.2022.12.020 [4] OSMAN A, ABDEL-SHAFI S, AL-MOHAMMADI A R, et al. Catfish glycoprotein, a highly powerful safe preservative of minced beef stored at 4 ℃ for 15 Days[J]. Foods,2020,9(8):1115. doi: 10.3390/foods9081115
[5] FABRIZIO C, CRISTINA L, et al. The immune functions of alpha1 acid glycoprotein[J]. Current Protein & Peptide Science,2019,20(6):505−524.
[6] TIAN C, WANG M M, LIU S S, et al. A new glycoprotein SPG-8700 isolated from sweet potato with potential anti-cancer activity against colon cancer[J]. Natural Product Research,2019,33(16):2322−2328. doi: 10.1080/14786419.2018.1446007
[7] ZENG H J, ZHE L, WANG Y P, et al. Studies on the anti-aging activity of a glycoprotein isolated from Fupenzi (Rubus chingii Hu.) and its regulation on klotho gene expression in mice kidney[J]. International Journal of Biological Macromolecules,2018,119:470−476. doi: 10.1016/j.ijbiomac.2018.07.157
[8] 王岸娜, 崔文慧, 吴立根, 等. 响应面法优化超声辅助提取猕猴桃糖蛋白[J]. 粮食与油脂,2018,31(6):14−19. [WANG A N, CUI W H, WU L G, et al. Optimization of ultrasonic extraction of kiwifruit glycoprotein by response surface methodology[J]. Cereals & Oils,2018,31(6):14−19. doi: 10.3969/j.issn.1008-9578.2018.06.005 [9] 朱珈庆, 李帅斐, 于雷, 等. 米糠蛋白碱法提取联合微波与酶法改性工艺的优化[J]. 粮食与油脂,2017,30(7):60−64. [ZHU J Q, LI S F, YU L, et al. Optimization of alkaline extraction joint microwave and enzymatic modification of rice bran protein[J]. Cereals & Oils,2017,30(7):60−64. doi: 10.3969/j.issn.1008-9578.2017.07.015 [10] 林洋. 黑木耳蛋白质的提取、分离纯化及特性研究[D]. 哈尔滨: 东北林业大学, 2016. LIN Y. Extraction, purification and characteristic analysis of the protein from Auricularia auricula[D]. Harbin: Northeast Forestry Universitym, 2016.
[11] 袁莉婷, 刘玉德, 石文天, 等. 响应面优化超声波辅助碱法提取海带蛋白工艺[J]. 中国食品添加剂,2021,32(4):23−33. [YUAN L T, LIU Y D, SHI W T, et al. Optimization of ultrasonic-assisted alkaline extraction of kelp protein by response surface method[J]. China Food Additives,2021,32(4):23−33. doi: 10.19804/j.issn1006-2513.2021.04.005 [12] 马梦婷, 王艺静, 王青林, 等. 超声波辅助碱法提取棉籽蛋白工艺条件的优化[J]. 食品工业,2017,38(8):66−71. [MA M T, WANG Y J, WANG Q L, et al. Optimization of ultrasonic-assisted alkaline extraction technology on cottonseed protein[J]. The Food Industry,2017,38(8):66−71. [13] 杜涓. 发酵麸皮糖蛋白的制备、抗氧化活性评价及分离纯化研究[D]. 呼和浩特: 内蒙古农业大学, 2020. DU J. Study on the preparation, antioxidant activity evaluation and purification of fermented wheat bran glycoprotein[D]. Hohhot: Inner Mongolia Agricultural University, 2020.
[14] 张金豫, 刘豪, 孙会轻, 等. 大鲵黏液糖蛋白的提取纯化及其抗氧化性[J]. 中国食品学报,2018,18(9):175−181. [ZHANG J Y, LIU H, SUN H Q, et al. Extraction and purification of mucous glycoprotein from giant salamander and its antioxidant activity[J]. Journal of Chinese Institute of Food Science and Technology,2018,18(9):175−181. doi: 10.16429/j.1009-7848.2018.09.022 [15] ZHOU Y H, MA Y L, LI L R, et al. Purification, characterization, and functional properties of a novel glycoprotein from tartary buckwheat (Fagopyrum tartaricum) seed[J]. Food Chemistry,2019,309:125671.
[16] 覃发玠, 敖珍, 龙俊训, 等. 黑木耳多糖的提取纯化及生物功能研究进展[J]. 食品科技,2022,47(2):227−231. [QIN F J, AO Z, LONG J X, et al. Research progress on extraction, purification and biological functions of polysaccharide from Auricularia auricula[J]. Food Science and Technology,2022,47(2):227−231. doi: 10.3969/j.issn.1005-9989.2022.2.spkj202202035 [17] 罗晓莉, 张沙沙, 曹晶晶, 等. 云南3种胶质食用菌营养成分分析与蛋白质营养价值评价[J]. 食品工业科技,2021,42(14):328−333. [LUO X L, ZHANG S S, CAO J J, et al. Analysis of nutritional components and evaluation of protein nutritional value of three kinds of gelatinous edible[J]. Science and Technology of Food Industry,2021,42(14):328−333. doi: 10.13386/j.issn1002-0306.2020090143 [18] 李文枫, 毕洪文, 黄峰华. 我国黑木耳产业发展现状及对策建议[J]. 北方园艺,2021(7):142−147. [LI W F, BI H W, HUANG F H, et al. Present situation and countermeasures and recommendation of development of Auricularia auricula industry in China[J]. Northern Horticulture,2021(7):142−147. [19] 张廷婷, 赵文颖, 谢倍珍, 等. 黑木耳及其多糖对高脂饮食大鼠的降血脂和肠道菌群调节作用[J]. 中国食品学报,2021,21(9):89−101. [ZHANG T T, ZHAO W Y, XIE B Z, et al. Effects of Auricularia auricula and its polysaccharides on hypolipidemic and regulating intestinal flora in high-fat diet rats[J]. Journal of Chinese Institute of Food Science and Technology,2021,21(9):89−101. [20] ZHANG Y, ZENG Y, MEN Y, et al. Structural characterization and immunomodulatory activity of exopolysaccharides from submerged culture of Auricularia auricula-judae[J]. International Journal of Biological Macromolecules,2018:978−984.
[21] 刘振东, 黄悦, 李鹏飞, 等. 西藏黑木耳中1种新的凝集素的分离纯化及鉴定[J]. 中草药,2018,49(20):4785−4790. [LIU Z D, HUANG Y, LI P F, et al. Extraction, isolation, and identification of a new lectin from Tibetan medicine Auricularia auricula[J]. Chinese Traditional and Herbal Drugs,2018,49(20):4785−4790. doi: 10.7501/j.issn.0253-2670.2018.20.012 [22] MA Y, WANG C, ZhANG Q, et al. The effects of polysaccharides from Auricularia auricula (Huaier) in adjuvant anti-gastrointestinal cancer therapy: A systematic review and network meta-analysis[J]. Pharmacological Research,2018(132):80−89.
[23] 宋丹靓敏, 么宏伟, 曾伟民, 等. 响应面法优化超声微波联用辅助提取黑木耳黑色素工艺[J]. 食品工业科技,2021,42(7):162−170. [SONGDAN L M, MO H W, ZENG W M, et al. Optimization of ultrasound-microwave assisted extraction of melanin from Auricularia auricula-judae by response surface methodology[J]. Science and Technology of Food Industry,2021,42(7):162−170. [24] WU Q, QIN D, CAO H, et al. Enzymatic hydrolysis of polysaccharide from Auricularia auricula and characterization of the degradation product[J]. International Journal of Biological Macromolecules,2020(162):127−135.
[25] 张莉, 于国萍, 齐微微, 等. 碱溶酸沉法提取黑木耳蛋白质的工艺优化[J]. 食品工业,2015,36(6):24−27. [ZHANG L, YU G P, QI W W, et al. Optimization of the alkali solution and acid precipitation method to extract protein from Auricularia auricula[J]. The Food Industry,2015,36(6):24−27. [26] SU Y T, XU Y J. Study on the extraction and purification of glycoprotein from the yellow seahorse, Hippocampus kuda Bleeker[J]. Food Science and Nutrition,2015,3(4):302−312. doi: 10.1002/fsn3.219
[27] MASUKO T, MINAMI A, IWASAKI N, et al. Carbohydrate analysis by a phenol-sulfuric acid method in microplate format[J]. Analytical Biochemistry,2005,339(1):69−72. doi: 10.1016/j.ab.2004.12.001
[28] WEN X, ZHENG H J, ZHANG Y, et al. Progress in monolithic column-based separation and enrichment of glycoproteins[J]. Chinese Journal of Analytical Chemistry,2020,48(1):13−21. doi: 10.1016/S1872-2040(19)61207-7
[29] 张宏玲. 生姜糖蛋白提取纯化及活性研究[D]. 锦州: 渤海大学, 2019. ZHANG H L. Extraction and purificationofginger glycoprotein and its activities[D]. Jingzhou: Bohai University, 2019.
[30] 薛张芝, 张洪超, 丁源, 等. 墨鱼缠卵腺糖蛋白提取工艺优化及纯化[J]. 食品工业科技,2019,40(6):167−172, 178. [XUE Z Z, ZHANG H C, DING Y, et al. Optimization of extraction process and purification of nidamental gland glycoprotein from cuttlefish[J]. Science and Technology of Food Industry,2019,40(6):167−172, 178. [31] 陈佳琪, 陆晓丹, 沈熠杰, 等. 超声辅助制备带鱼副产物糖蛋白工艺优化[J/OL]. 食品研究与开发: 1−14[2023-01-01]. http://kns.cnki.net/kcms/detail/12.1231.TS.20220622.1623.002.html. CHEN J Q, LU X D, SHEN Y J, et al. Optimization of ultrasonic-assisted preparation of glycoprotein from hairtail by-products[J/OL]. Food Research and Development, 1−14[2023-01-01]. http://kns.cnki.net/kcms/detail/12.1231.TS.20220622.1623.002.html.
[32] 赵胜男, 郑晓凤, 崔琳, 等. 桔梗糖蛋白超临界辅助提取工艺及对α-葡萄糖苷酶抑制作用的研究[J]. 食品工业科技,2016,37(3):187−190, 195. [ZHAO S N, ZHENG X F, CUI L, et al. Study on the optimum conditions of extraction and inhibition of α-glucosidase of glycoprotein from platycodon grandiflorum with supercritical CO2 and ultrasonic[J]. Science and Technology of Food Industry,2016,37(3):187−190, 195. [33] 张丽丽, 张娟娟, 王亚樵, 等. 黄芩糖蛋白提取工艺的正交实验优选[J]. 时珍国医国药,2017,28(3):594−596. [ZHANG L L, ZHANG J J, WANG Y Q, et al. Orthogonal experiment optimization radix scutellariae glycoprotein extraction process[J]. Lishizhen Medicine and Materia Medica Research,2017,28(3):594−596. [34] WU J, CHEN B S, FANG J H, et al. Spectroscopic analysis of structural transformation in biodiesel oxidation[J]. China Petroleum Processing & Petrochemical Technology,2013,15(3):28−32.
[35] 俞萍, 岳煜贤, 张宇, 等. 响应面法优化人参糖蛋白制备工艺[J]. 食品与机械,2021,37(7):194−199. [YU P, YUE Y X, ZHANG Y, et al. Optimization of preparation of ginseng glycoprotein by response surface methodology[J]. Food and Machinery,2021,37(7):194−199. [36] 向瑞琪, 谢锋, 谭红, 等. 三种食用菌多糖的基本结构与抗氧化活性研究[J]. 食品工业科技,2022,43(14):69−76. [XIANG R Q, XIE F, TAN H, et al. Study on basic structure and antioxidant activity of polysaccharides from three edible fungi[J]. Science and Technology of Food Industry,2022,43(14):69−76. [37] SHI J P, XU Y F, GUO J, et al. Extraction, purification, characterization, and rheological properties of a glycoprotein from cynomorium songaricum rupr[J]. Biotechnology and applied biochemistry,2020,68(1):41−51.
[38] 徐永健, 宿宇婷, 葛晓鸣, 等. 海马糖蛋白结构的初步鉴定及其抗氧化特性分析[J]. 中国海洋药物,2017,36(6):39−46. [XU Y J, SU Y T, GE X M, et al. Purification and characterization of antioxidant glycoprotein from the yellow seahorse Hippocampus kuda Bleeker[J]. Chinese Journal of Marine Drugs,2017,36(6):39−46. -
期刊类型引用(5)
1. 张根生,黄昕钰,李琪,李月明,韩冰,费英敏. 植物清蛋白的制备、功能特性及其在食品中的应用进展. 中国调味品. 2023(05): 202-207 .  百度学术
百度学术
2. 张宇涵,周靖萱,张南海,赵亮,张列兵,周峰. 胶原蛋白肽与弹性蛋白肽对改善皮肤光老化的研究进展. 食品研究与开发. 2023(11): 208-216 .  百度学术
百度学术
3. 王娟娟,刘勋,周学,罗欢,赵国建. 胶原蛋白的研究进展及其应用. 中国皮革. 2022(07): 1-7 .  百度学术
百度学术
4. 赵琼瑜,胡鉴,陈雨欣,李彩燕,宋伟. 中华鳖背甲脱钙工艺优化及其胶原蛋白结构表征. 食品与机械. 2022(10): 151-157+223 .  百度学术
百度学术
5. 赵琼瑜,胡鉴,李彩燕,徐树杰,宋伟. 超声波辅助鳖甲脱钙工艺优化及其对胶原蛋白生化特征的影响. 食品工业科技. 2022(22): 39-51 .  本站查看
本站查看
其他类型引用(6)







 下载:
下载:









 下载:
下载:



