Quality Analysis and Comprehensive Evaluation of Cistanche deserticola from Different Origins in China
-
摘要: 为了明确我国不同产地荒漠肉苁蓉的品质差异,以我国不同沙漠地区的荒漠肉苁蓉为原料,对其不同部位(根部、中部、顶部)生物活性物质含量及其抗氧化活性进行测定,并进行多元统计分析。结果表明:产地和部位对荒漠肉苁蓉生物活性物质含量和抗氧化活性具有明显影响。腾格里沙漠南部(D)样品中总多酚和毛蕊花糖苷平均含量较高,分别为17.66和6.98 mg/g DW,该样品对ABTS+和DPPH自由基清除能力较强,IC50平均值分别为1.48和0.38 mg/mL。古尔班通古特沙漠南部(E)样品中总黄酮平均含量最高,为16.58 mg RE/g DW。巴丹吉林沙漠(A)样品中总三萜平均含量最高,为18.63 mg OAE/g DW。古尔班通古特沙漠北部(F)样品中总多糖和总原花青素平均含量较高,分别为31.18 mg DE/g DW和4.71 PCE/g DW。腾格里沙漠北部(C)样品中松果菊苷平均含量最高,为17.75 mg/g DW,该样品对羟基自由基清除能力最强,平均IC50值为3.05 mg/mL。主成分分析(Prin-cipal component analysis,PCA)共提取3个主成分,累计方差贡献率为85.43%;通过系统聚类分析(Hierarchical cluster analysis,HCA)将样品分为三个类群,其中第一、二类群的四个产地(A、B、C、D)分布在内蒙古和甘肃地区,综合评分为前四名。本研究结果将为我国荒漠肉苁蓉品质评价、产品开发及其标准化提供理论依据。Abstract: The present study aims at clarifying the quality differences of Cistanche deserticola (CD) from different areas. The contents of bioactive compounds extracted from different parts (root, middle and top stems) and their antioxidant activities were comparatively analyzed. The results showed that the contents and antioxidant activities of bioactive components were significantly affected by origins and parts. The samples from the southern Tengger desert (D) showed high concentrations of total polyphenols (17.66 mg GAE/g DW) and verbascoside (6.98 mg/g DW). These compounds showed high scavenging abilities against ABTS+ (IC50=1.48 mg/mL) and DPPH (IC50=0.38 mg/mL) free radical. Samples from the southern Gurbantunggut desert (E) showed the highest content of total flavonoids (16.58 mg RE/g DW). The highest content of total triterpenoid appeared in the sample from Badangirin desert (A) (18.63 mg OAE/g DW). Samples from the Gurbantunggut desert (F) had polysaccharides and procyanidins at levels of 31.18 and 4.71 mg PCE/g DW, respectively. The samples from the northern Tengger desert (C) had the highest echinoside content (17.75 mg/g DW) and hydroxyl radical scavenging ability (IC50=3.05 mg/mL). Three principal components were extracted by principal component analysis (PCA) with a cumulative variance contribution rate of 85.43%. Through hierarchical cluster analysis (HCA), the samples were divided into three groups. The four producing areas (A, B, C and D) of the first and second groups were distributed in Inner Mongolia and Gansu, and the comprehensive score was the top four. The results of this study would provide a theoretical basis for quality evaluation, product development and standardization of Cistanche deserticola in China.
-
肉苁蓉属(Cistanche)植物为列当科(Orobanchaceae)多年生专性根全寄生植物,又名大芸、地精、金笋等[1]。我国有肉苁蓉属植物4种1变种,包括荒漠肉苁蓉、管花肉苁蓉、盐生肉苁蓉、白花盐苁蓉以及沙苁蓉。《中国药典》2020版收载的肉苁蓉为荒漠肉苁蓉和管花肉苁蓉的干燥肉质茎。管花肉苁蓉寄生于沙漠柽柳属根部,主要分布在新疆南疆沙漠地区。荒漠肉苁蓉寄生于固沙防风植物梭梭树的根部,主要分布于内蒙古地区的阿拉善盟(左旗、右旗、额济纳旗)、甘肃和新疆北部等沙漠地区[2-3]。
肉苁蓉始载于《神农本草经》,喜干旱、半干旱,是传统的食药同源原料。其味甘、性温,具有“主五劳七伤,补中,除茎中寒热痛,养五脏,强阴,益精血”等功效,素有“沙漠人参”之称[4]。现代药理学研究表明,肉苁蓉具有降血糖、降血脂[5]、增强骨功能[6]、润肠通便[7-8]、抗氧化[9]、护肝[10-11]、抗抑郁[12]、缓解疲劳[13]等生理活性。肉苁蓉的生物活性与其所含的多种功能性成分密切相关,如多酚、黄酮、多糖、松果菊苷、毛蕊花糖苷等[14]。研究表明:肉苁蓉中的松果菊苷和毛蕊花糖苷等苯乙醇苷类化合物为补肾阳、抗衰老、抗疲劳的主要活性物质[15],能促进成骨细胞的增殖以及骨髓间充质干细胞向成骨细胞分化[16-18];肉苁蓉多糖具有调节免疫活性[19]、保护神经[20]、抗骨质疏松[21]等药理活性,同时对衰老模型小鼠的学习记忆能力有一定的改善作用[22]。
肉苁蓉中生物活性成分的种类和含量受到气候、地理环境、土壤条件等多种因素的影响而产生较大差异,为肉苁蓉的精深加工及其制品的质量控制和标准化带来困难[23]。因此,研究不同产地荒漠肉苁蓉中生物活性物质的种类、含量及其抗氧化活性,对肉苁蓉的药、食安全以及综合开发利用具有重要意义。本文以我国不同沙漠产地的荒漠肉苁蓉为研究对象,在对其总多酚、总黄酮、总多糖、总三萜、总原花青素、松果菊苷、毛蕊花糖苷等生物活性物质及其抗氧化活性研究的基础上,进一步采用主成分分析(Principal component analysis,PCA)和系统聚类分析(Hierarchical cluster analysis,HCA)进行多元统计分析,为荒漠肉苁蓉的质量评价及其加工产品的标准化提供理论依据。
1. 材料和方法
1.1 材料与仪器
荒漠肉苁蓉 6个产地(产地A~F)样品均为荒漠肉苁蓉干燥肉质茎(表1)。根据已报道的取样方法[24-26],分别取根部、中部、顶部命名为1、2和3(如图1所示)。样品经冷冻干燥后,粉碎并过50目筛,真空密封包装并于−18 ℃保存备用;乙腈、甲酸 色谱纯,德国Merck公司;毛蕊花糖苷与松果菊苷标准品 色谱纯,安倍尔(上海)有限公司;碳酸钠、没食子酸、亚硝酸钠、硝酸铝、氢氧化钠、乙醇、芦丁、香草醛、冰乙酸、高氯酸、乙酸乙酯、丙酮、乙醚、苯酚、硫酸、甲醇、过硫酸钾等试剂 均为国产分析纯,北京索莱宝科技有限公司。
表 1 荒漠肉苁蓉样品信息Table 1. Sample information ofCD 编号 产地 沙漠产区 经度 纬度 A 内蒙古阿拉善盟额旗 巴丹吉林沙漠 101°E 41°N B 内蒙古阿拉善盟左旗 乌兰布和沙漠 106°E 39°N C 内蒙古阿拉善盟右旗 腾格里沙漠北部 103°E 39°N D 甘肃武威 腾格里沙漠南部 102°E 37°N E 新疆吉木萨尔 古尔班通古特沙漠南部 89°E 44°N F 新疆阿勒泰 古尔班通古特沙漠北部 88°E 47°N FD1A-50型冷冻干燥机 北京博医康公司;TGL-20B型离心机 上海安亭科学仪器有限公司;756型紫外可见分光光度计 上海箐华科技仪器有限公司;LC-20AB型高效液相色谱仪 日本岛津公司;Synergy H1多功能酶标仪 博腾仪器有限公司。
1.2 实验方法
1.2.1 总多酚含量测定
参照Li等[27]的方法。称取0.50 g样品,以70%乙醇为提取溶剂(料液比1:40),于固定功率为250 W超声装置中提取(60 ℃,40 min),冷却后4000 r/min离心10 min,收集上清液定容(50 mL)备用。
取样液(1 mL)加入福林酚溶液(5 mL,10%),振荡摇匀,静置15 min后,再加入碳酸钠溶液(4 mL,7.5%),摇匀后避光静置20 min后测定其吸光度(765 nm),结果以没食子酸当量(mg Gallic acid equivalent,GAE/g DW)表示,标准曲线方程为y=0.0505x+0.0347,R2=0.9991。
1.2.2 总黄酮含量测定
参照熊双丽等[28]的方法。样液制备同1.2.1。取样液(1 mL)于10 mL棕色容量瓶中,加入亚硝酸钠溶液(0.3 mL,5%),振荡摇匀,静置15 min后依次加入硝酸铝溶液(0.3 mL,10%)、氢氧化钠溶液(4 mL,4%),用乙醇(50%)定容至10 mL,振荡摇匀,避光静置20 min后测定其吸光度(510 nm),结果以芦丁当量(mg Rutin equivalent, RE/g DW)表示,标准曲线方程为y=0.0053x+0.0161,R2=0.9992。
1.2.3 总三萜含量测定
参照何策等[29]的方法。样液制备同1.2.1。取样液(0.4 mL)水浴挥干,依次加入现配香草醛-冰乙酸溶液(0.4 mL,1.5%)、高氯酸(1.6 mL),热水水浴(70 ℃,15 min),冷却后加入乙酸乙酯(5 mL),静置10 min后测定其吸光度(560 nm),结果以齐墩果酸当量(mg Oleanolic acid equivalent,OAE/g DW)表示,得出标准曲线方程为y=16.005x−0.0256,R2=0.9987。
1.2.4 总多糖含量测定
参照张雅丹等[30]的方法。称取1.00 g样品,以去离子水为提取溶剂(料液比1:30),于固定功率为250 W超声装置中进行提取(60 ℃,50 min),冷却后4000 r/min离心10 min,收集上清液并加入4倍体积乙醇(95%),静置后(4 ℃,12 h),5000 r/min离心收集沉淀,并依次用丙酮、乙醚、无水乙醇反复清洗2次后,加入适量去离子水复溶后进行脱蛋白(sevage法)、脱色素(活性炭法),定容至10 mL后待测。
取样液(1 mL)依次加入苯酚溶液(0.6 mL,6%)、浓硫酸(3 mL),振荡摇匀后沸水浴10 min,冷却后测定其吸光度(490 nm),结果以葡萄糖当量(mg dextrose equivalent,DE/g DW)表示。标准曲线方程为y=0.0146x−0.015,R2=0.9998。
1.2.5 原花青素含量测定
参照李彩霞等[31]的方法。称取0.50 g样品,以80%乙醇为提取溶剂(料液比1:30),于固定功率为250 W超声装置中进行提取(50 ℃,40 min),冷却后4000 r/min离心10 min,收集上清液定容(50 mL)备用。
取样液(0.5 mL)加入香草醛-甲醇溶液(3 mL,4%)、浓盐酸(1.5 mL),反应15 min后测定其吸光度(500 nm),结果以原花青素当量(mg Proanthocyanidin equivalent,PCE/g DW)表示,标准曲线方程为y=2.1709x−0.0036,R2=0.9979。
1.2.6 毛蕊花糖苷与松果菊苷含量测定
参照许明君等[32]的方法。称取1.00 g样品,以80%乙醇为提取溶剂(料液比1:30),于固定功率为250 W超声装置中进行提取(60 ℃,40 min),冷却后4000 r/min离心10 min,收集上清液定容(50 mL)备用。
色谱柱:Alltima C18柱(4.6 mm×250 mm,5 μm);流动相:0.4%甲酸溶液(A)-乙腈(B);洗脱程序为:0~10 min,90%A;10~20 min,90%~80%A;20~30 min,80%~75%A;30~40 min,75%~80%A;40~50 min,80%~90%A,柱温25 ℃,流速为1.00 mL/min;检测波长为330 nm;进样量为10 μL。以物质浓度为横坐标,相应的峰面积为纵坐标,得出松果菊苷的标准曲线y=15311296.40x−119140.61,R2=0.9996,线性范围为0.04~0.48 mg/mL;毛蕊花糖苷的标准曲线y=21780400.45x−121356.95,R2=0.9994,线性范围0.04~0.08 mg/mL。
1.2.7 体外抗氧化活性测定
样液的制备:称取1.20 g样品,以60%乙醇为提取溶剂(料液比1:25),置于功率为250 W超声装置中进行提取(60 ℃,40 min),冷却后4500 r/min离心15 min,收集上清液,取多份适量上清液经60%乙醇稀释,使样液浓度分别为1、3、5、10、20、30、40 mg/mL待测。
1.2.7.1 ABTS+自由基清除能力
参照Roberta等[33]的方法稍作修改:ABTS母液为去离子水配制过硫酸钾终浓度为2.45 mmol/L、ABTS终浓度为7 mmol/L的混合溶液,避光条件静置(25 ℃,12 h)。使用前用去离子水稀释,使其在734 nm处吸光度为0.70±0.05,即为ABTS工作液。取10 μL样液(1~40 mg/mL)加入到酶标板中,加入ABTS工作液(200 μL),室温避光30 min,以60%乙醇为对照测定其吸光度(734 nm),按照公式(1)计算ABTS+自由基清除率。
ABTS+自由基清除率(%)=(1−A1−A2A0)×100 (1) 式中:A0为60%乙醇代替样液(空白)的吸光值;A1为样液与ABTS溶液混合后的吸光值;A2为去离子水代替ABTS溶液的吸光值。
1.2.7.2 DPPH自由基清除能力
参照钟文秀等[34]的方法稍作修改:取样液(10 μL)加入DPPH溶液(250 μL)混匀后加入酶标板,室温避光25 min,以60%乙醇为对照测定其吸光度(517 nm),按照公式(2)计算DPPH自由基清除率。
DPPH自由基清除率(%)=(1−A1−A2A0)×100 (2) 其中:A0为60%乙醇代替样品(空白)的吸光值;A1为样液与DPPH溶液混合后的吸光值;A2为无水乙醇代替DPPH溶液的吸光值。
1.2.7.3 羟基自由基清除能力
参照Smirnoff等[35]的方法稍作修改:将50 μL样液加入50 μL硫酸亚铁溶液(6.0 mmol/L),加入50 μL双氧水溶液(6 mmol/L),充分混匀后反应15 min,再加入50 μL 6 mmol/L的水杨酸-无水乙醇溶液,37 ℃反应30 min后,在510 nm处测定吸光度,按公式(3)计算·OH清除率。
⋅OH清除率(%)=(1−A1−A2A0)×100 (3) 其中:A0:空白样(蒸馏水代替样品)的吸光值;A1:显色体系与样品的吸光值;A2:蒸馏水代替双氧水溶液的吸光值。
1.3 数据处理
所有数据平行测定三次,结果以平均值±标准偏差(SD)的表示。利用Origin 2019软件进行主成分分析和聚类分析;利用SPSS Statistics 26.0软件对数据进行方差分析,P<0.05表示差异显著。
2. 结果与分析
2.1 不同产地荒漠肉苁蓉生物活性物质含量
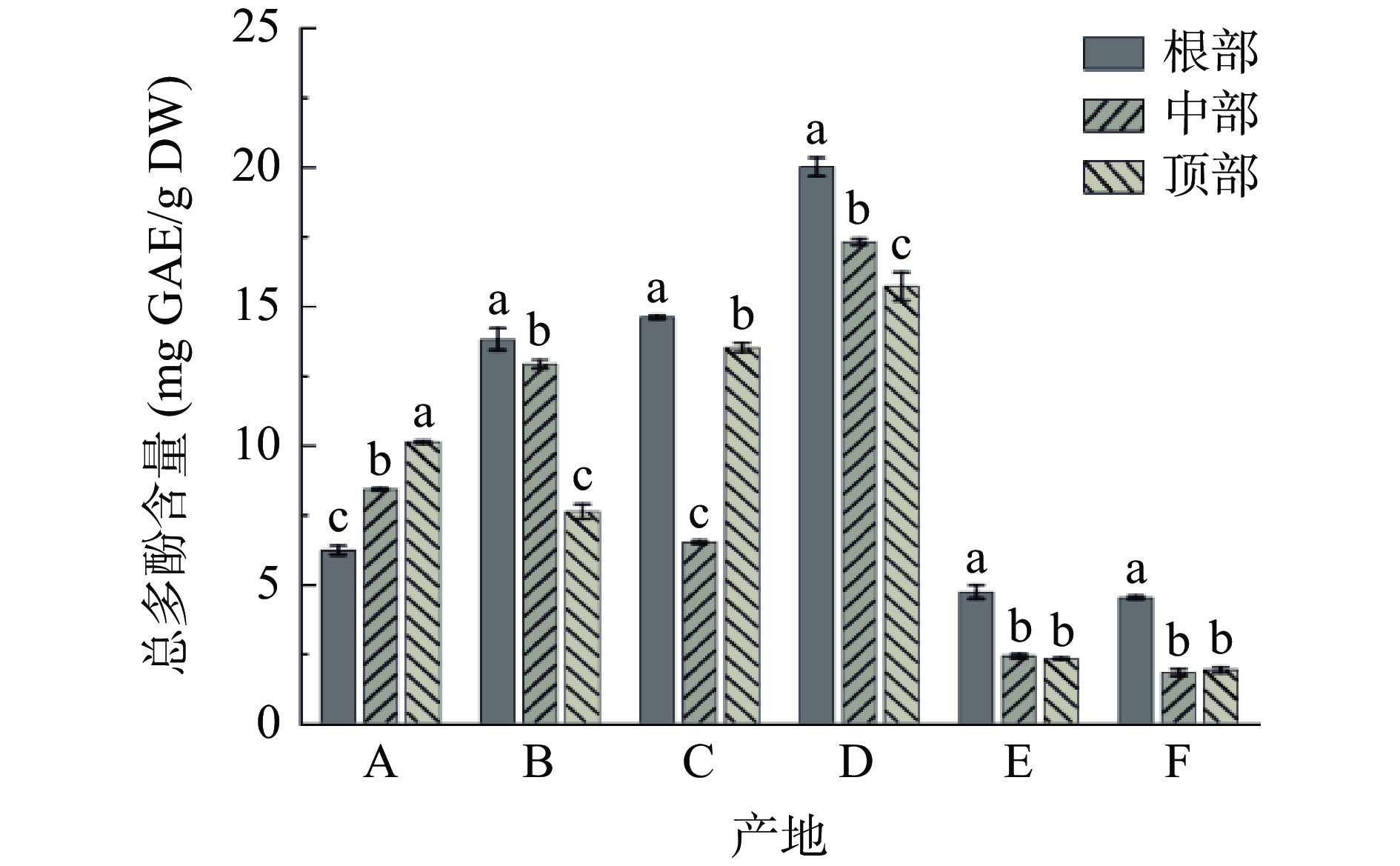
图2为不同产地荒漠肉苁蓉总多酚含量。由图2可知:除产地A外,其他五个产地样品根部总多酚含量均显著(P<0.05)高于中部和顶部。其中,产地D样品中总多酚含量最高,其根部、中部和顶部含量分别为20.06、17.33和15.67 mg GAE/g DW。其次是产地B(分别为13.85、12.93和7.58 mg GAE/g DW)、产地C(分别为14.64、6.48和13.48 mg GAE/g DW)。产地E和产地F的样品中总多酚含量较低,其各部位含量均低于5.00 mg GAE/g DW。
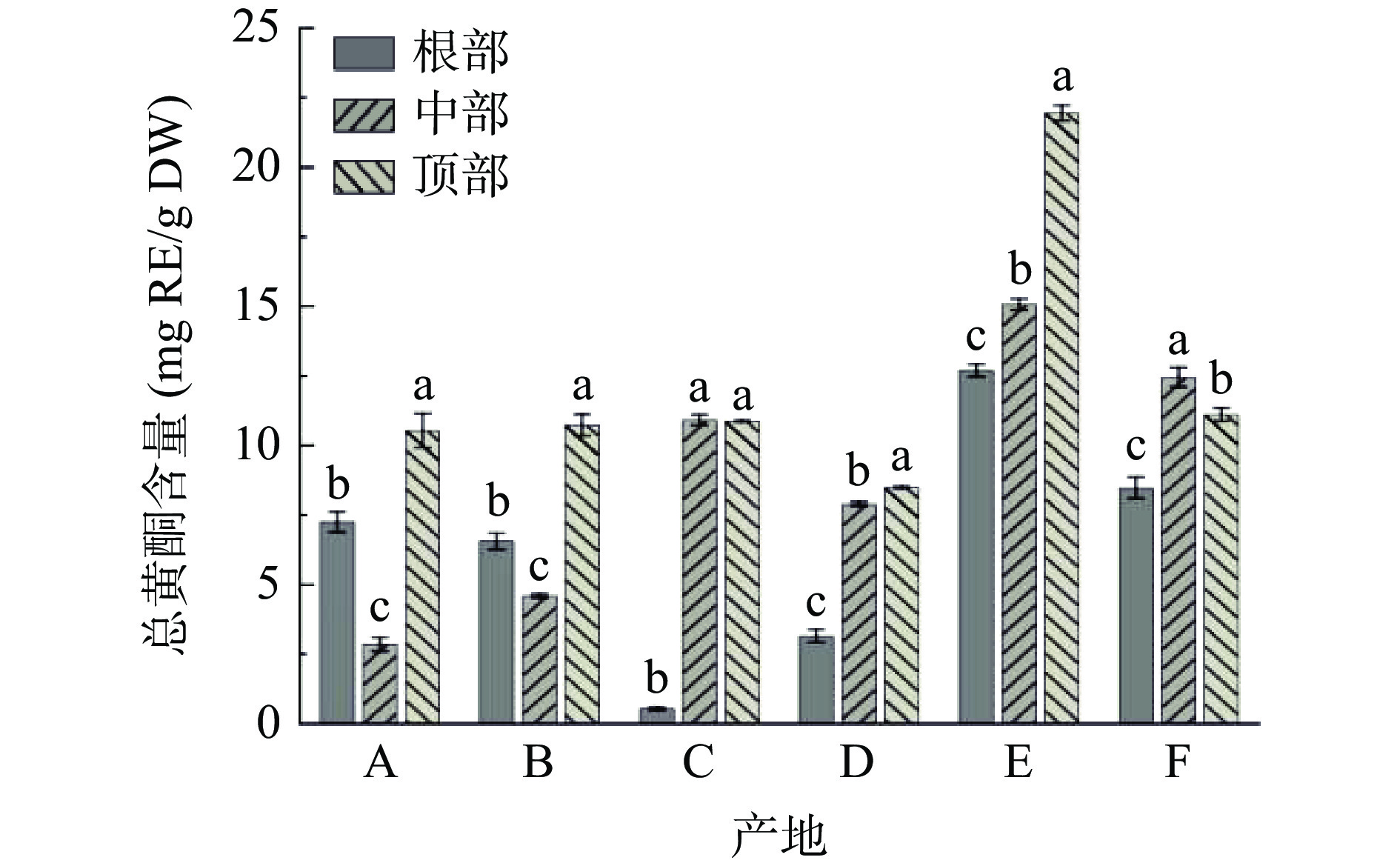
图3为不同产地荒漠肉苁蓉总黄酮含量。由图3可知:产地F之外,其他五个产地样品中,顶部总黄酮含量均高于中部和底部。其中产地E和F的样品中总黄酮含量显著高于其他产地(P<0.05),其中产地E顶部样品总黄酮含量最高(21.96 mg RE/g DW);产地C根部样品总黄酮含量最低,仅为0.54 mg RE/g DW。
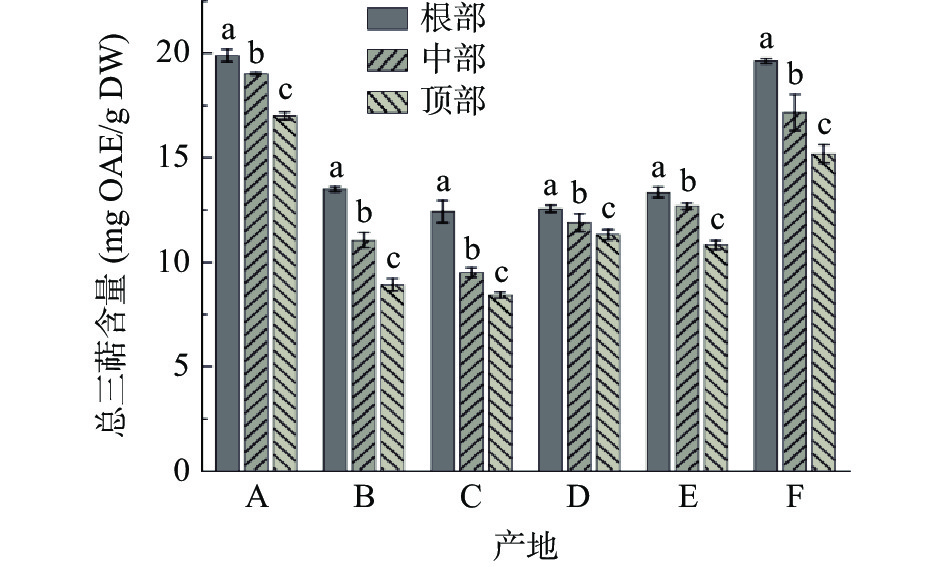
图4为不同产地荒漠肉苁蓉总三萜含量。由图4可知:六个产地样品中,总三萜含量均表现为根部>中部>顶部。产地A样品中总三萜含量最高,根部含量高达19.88 mg OAE/g DW,中部和顶部分别为19.01和16.99 mg OAE/g DW。其次是产地F,其根部含量也达到19.62 mg OAE/g DW,中部和顶部含量分别为17.15和15.17 mg OAE/g DW;A与F两产地样品的总三萜含量显著(P<0.05)高于其他四个产地。
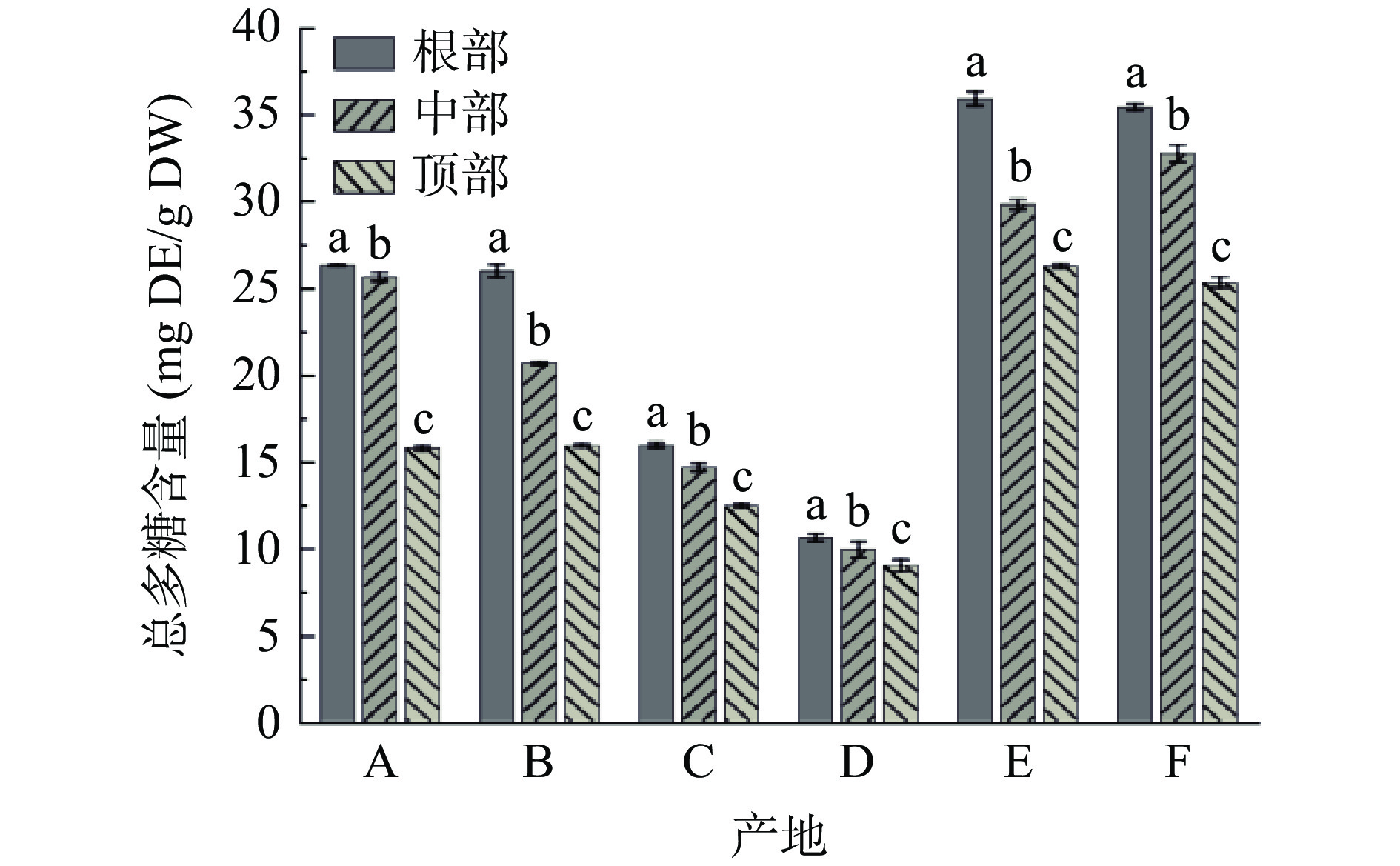
图5为不同产地荒漠肉苁蓉总多糖含量。由图5可知:六个产地的样品中,根部的多糖含量均高于中部和顶部,顺序均为根部>中部>顶部。产地F样品中总多糖含量最高,其根部、中部、顶部含量分别为35.44、32.76 和25.34 mg DE/g DW。其次是产地E,其根部含量较高,为35.92 mg DE/g DW,中部和顶部含量为29.82和26.26 mg DE/g DW。E、F两产地样品的总多糖含量要显著(P<0.05)高于其他四个产地;产地D样品中的总多糖含量最低,其根部、中部、顶部含量仅为10.60、9.92和9.00 mg DE/g DW。
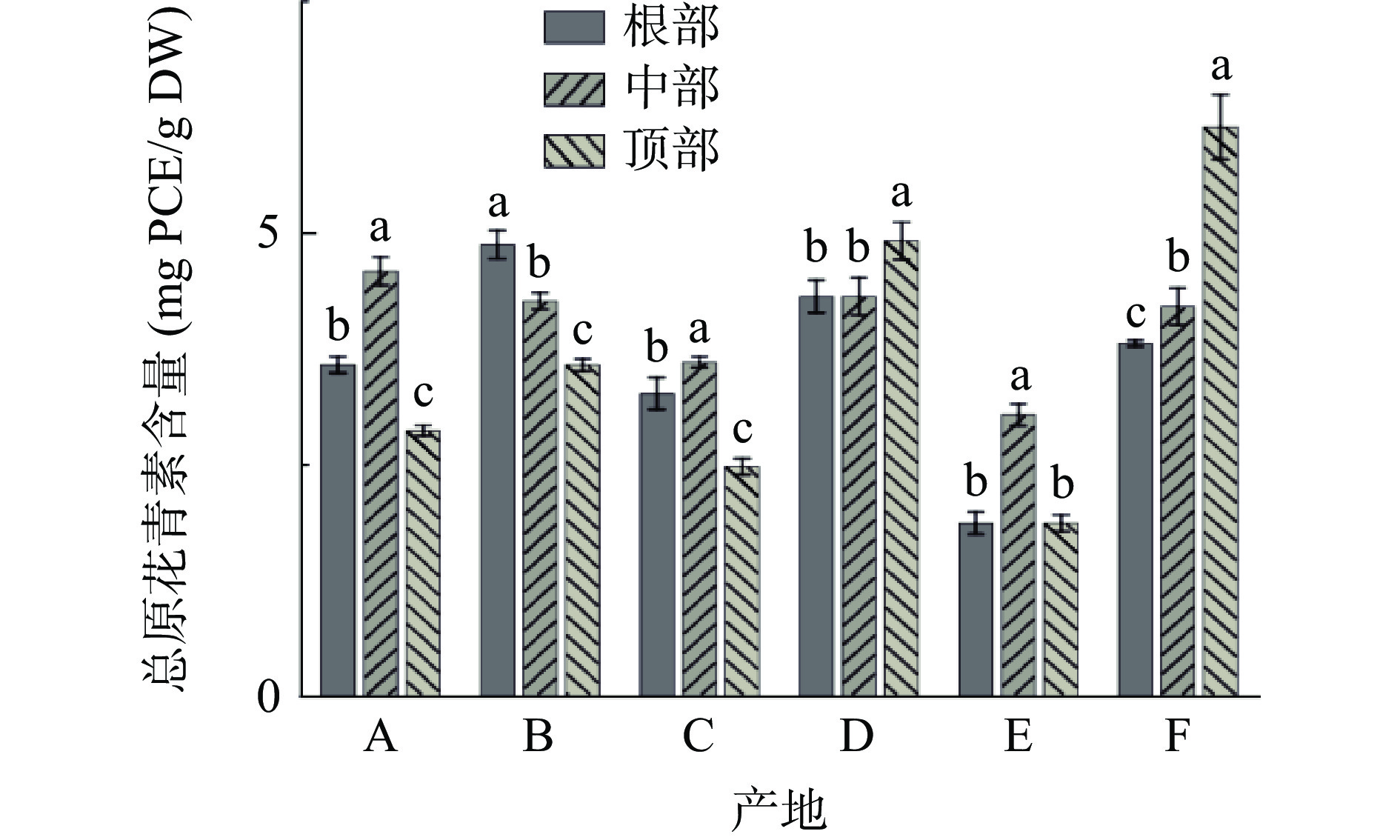
图6为不同产地荒漠肉苁蓉总原花青素含量。由图6可知:产地A、C和E样品中部的总原花青素含量高于根部和顶部,分别为4.58、3.60和3.03 mg PCE/g DW。产地B样品根部的总原花青素含量高于中部和顶部,为4.87 mg PCE/g DW;产地D和产地F样品顶部的总原花青素含量高于根部和中部,分别为4.91和6.14 mg PCE/g DW。总体上产地F三个部位的总原花青素平均含量最高,为4.71 mg PCE/g DW,产地E三个部位的总原花青素平均含量最低,仅为2.25 mg PCE/g DW。
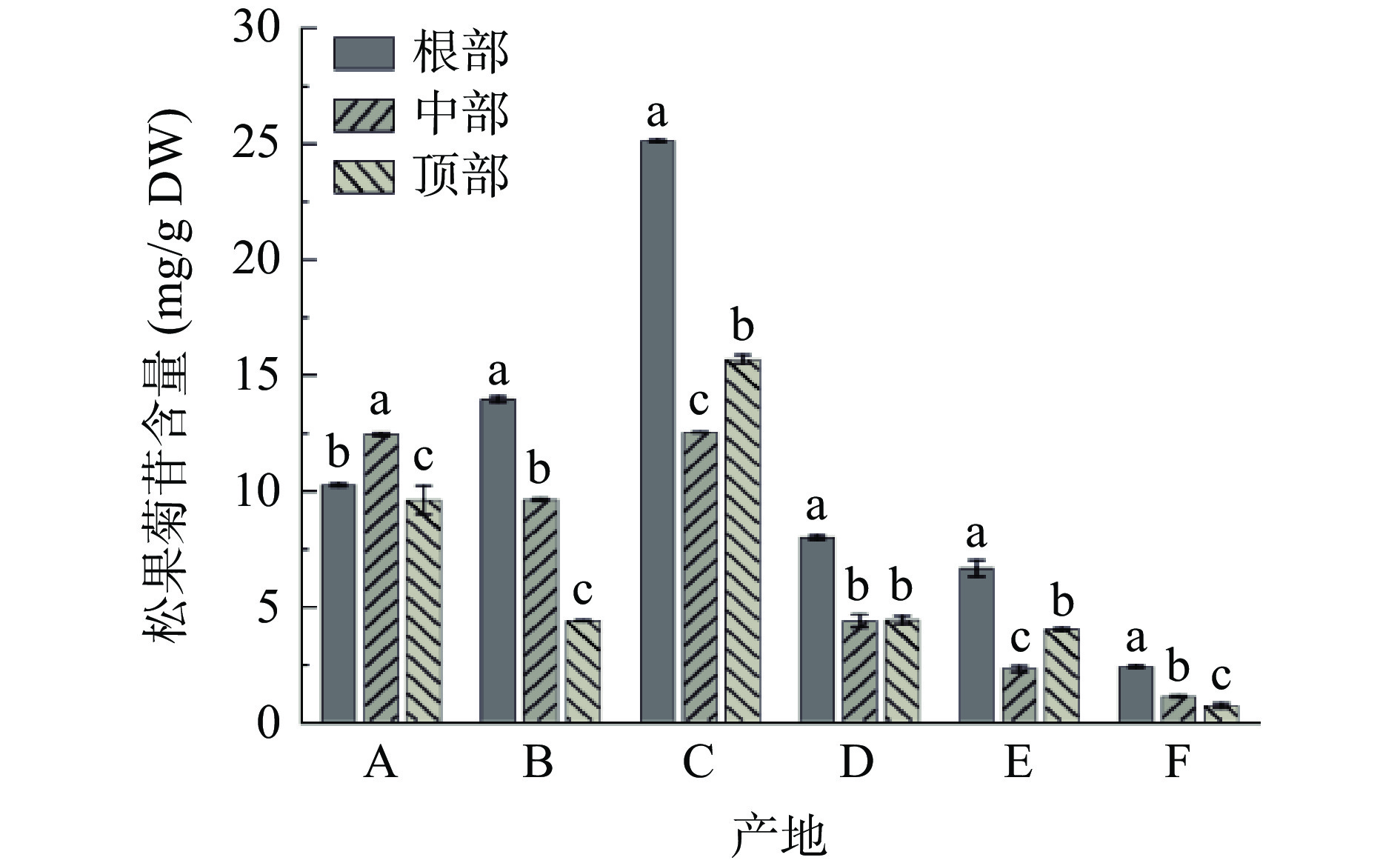
图7为不同产地荒漠肉苁蓉松果菊苷的含量。由图7可知:除产地A之外,其他产地样品根部的松果菊苷含量均显著高于中部和顶部(P<0.05)。产地C样品的松果菊苷含量最高,其根部、中部、顶部的含量分别为25.11、12.50和15.65 mg/g DW。产地F样品中的松果菊苷含量最低,其根部、中部和顶部的含量分别为2.37、1.09和0.68 mg/g DW。
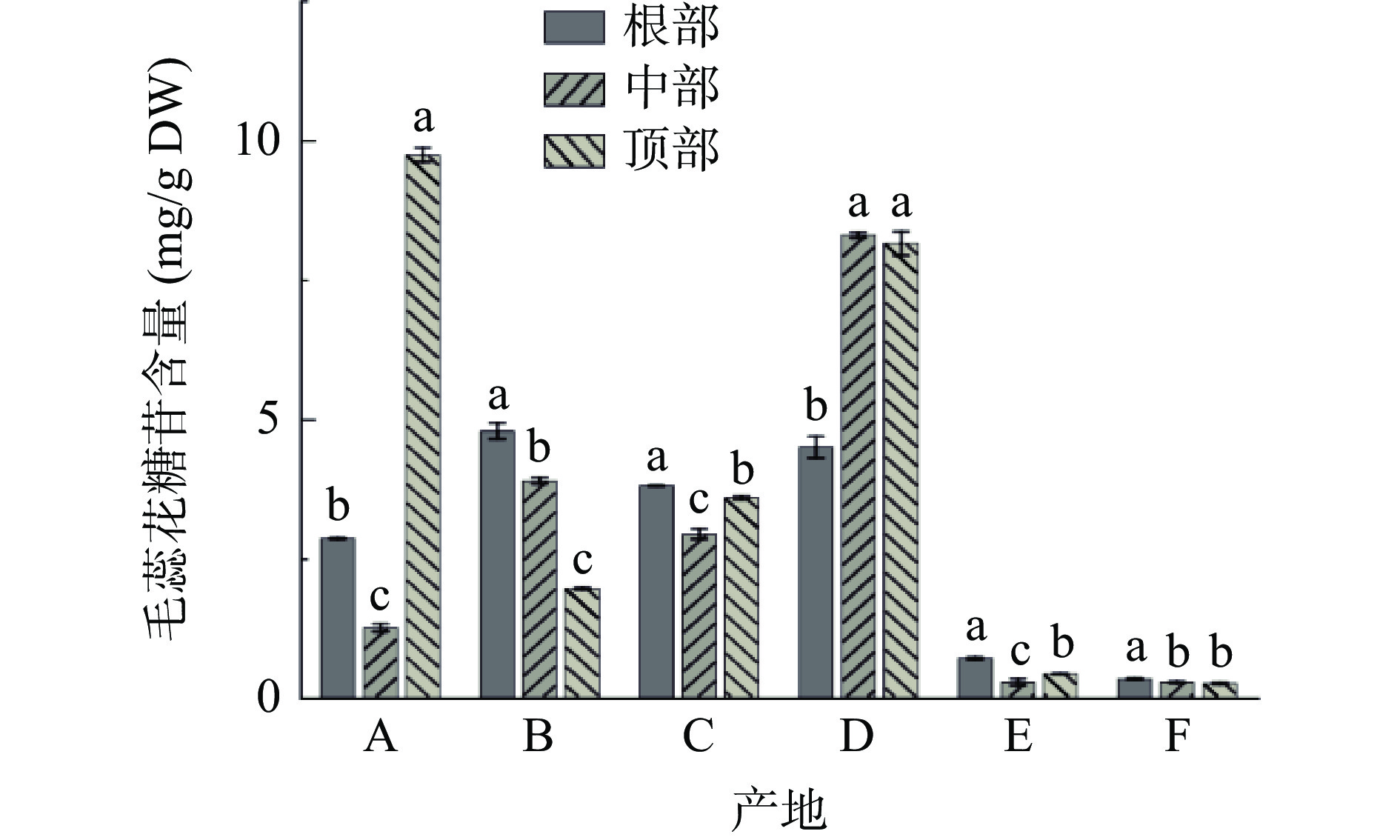
图8为不同产地荒漠肉苁蓉毛蕊花糖苷的含量。由图8可知:产地B、C、E和F样品根部的毛蕊花糖苷含量较高,分别为4.78、3.80、0.70和0.33 mg/g DW。产地A样品顶部含量最高,为9.74 mg/g DW;产地D样品中部含量最高,为8.30 mg/g DW。其中产地D样品的毛蕊花糖苷含量显著高于其他产地(P<0.05),平均含量为6.98 mg/g DW。产地E和F样品的毛蕊花糖苷含量较低,平均含量分别为0.46 和0.28 mg/g DW。
李彪[26]将采集的肉苁蓉平均分成上、中、下三部分,对其松果菊苷与毛蕊花糖苷含量进行测定,发现不同部位的含量差异显著,根部的松果菊苷和毛蕊花糖苷含量均高于中部和上部。本文测定的荒漠肉苁蓉样品中,大部分样品根部的总多酚、总三萜、总多糖、毛蕊花糖苷以及松果菊苷的含量相对较高。姬晓慧等[36]研究了新疆古尔班通古特沙漠产荒漠肉苁蓉中的生物活性成分,发现不同部位的样品中,肉质茎(下)部活性成分含量较高,中部和顶部含量较低,该现象可能与荒漠肉苁蓉的生殖生长以及营养成分的运输有关。同时,其还发现同一沙漠的不同区域产的荒漠肉苁蓉活性成分含量也存在不同程度的差异。刘雄等[37]发现不同产地肉苁蓉中的松果菊苷含量差异较大(0.42%~1.52%)。赵志红等[38]提出不同产区的肉苁蓉因大气环境、土壤因子以及水热条件等差异,会导致品质特征的不同,样品均一性较差,从而影响临床效果。
2.2 不同产地荒漠肉苁蓉的抗氧化活性
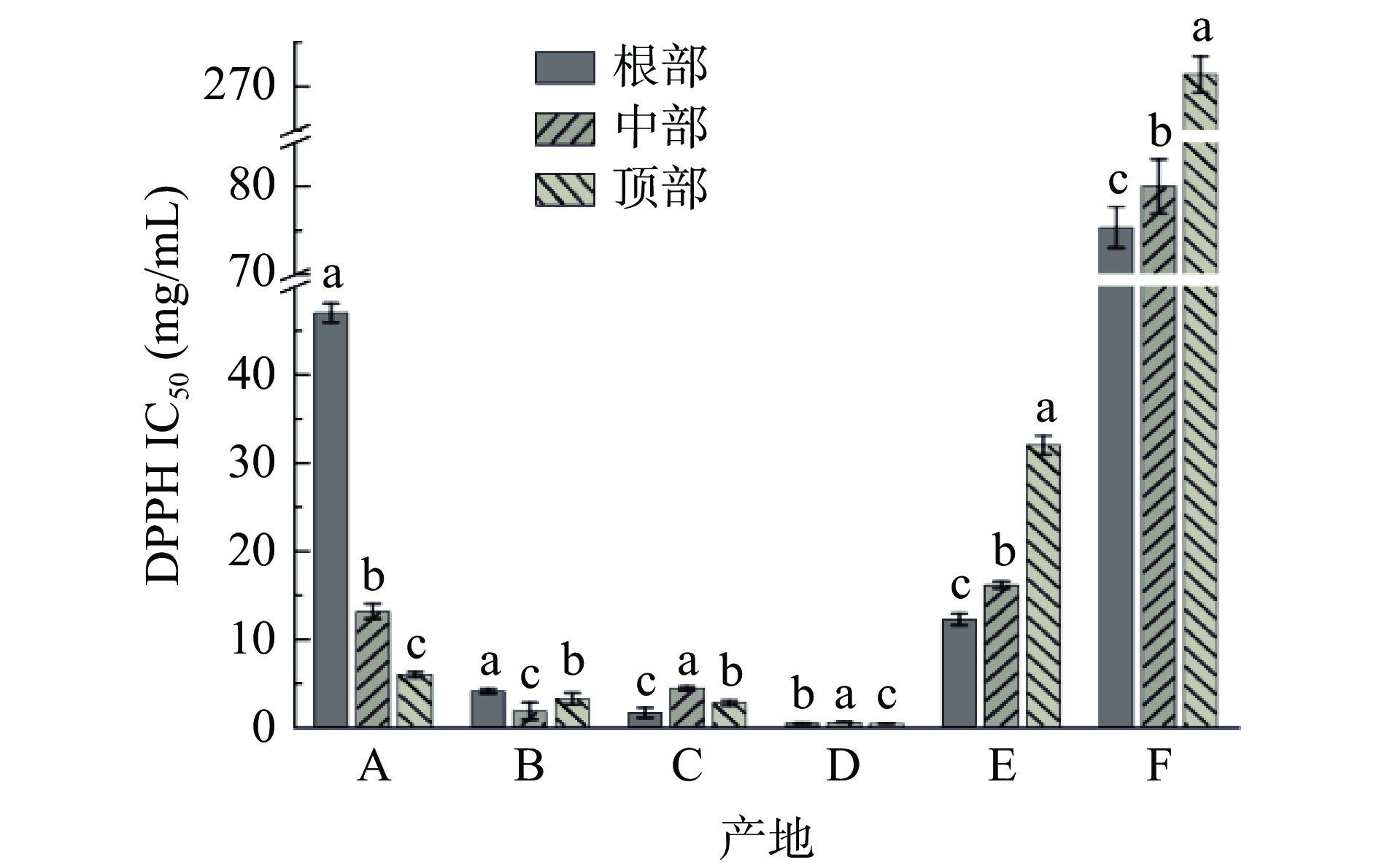
植物样品中同时含有多种生物活性成分,不同成分可能会表现出协同或者拮抗作用,因此测定样品提取物抗氧化能力比单一成分的抗氧化活性更具代表性[39]。图9为不同产地荒漠肉苁蓉DPPH自由基的IC50值。由图9可知:产地D样品不同部位的IC50值最小(分别为0.37、0.46和0.32 mg/mL),说明该样品对DPPH自由基具有最强的清除能力。其次是产地B和C的样品,其对DPPH自由基同样具有较强的清除能力,其根部、中部和顶部的IC50值分别为4.00、1.74、3.14 mg/mL和1.56、4.31、2.65 mg/mL。产地F样品对DPPH自由基的清除能力最弱,其不同部位的IC50值显著(P<0.05)大于其他五个产地。
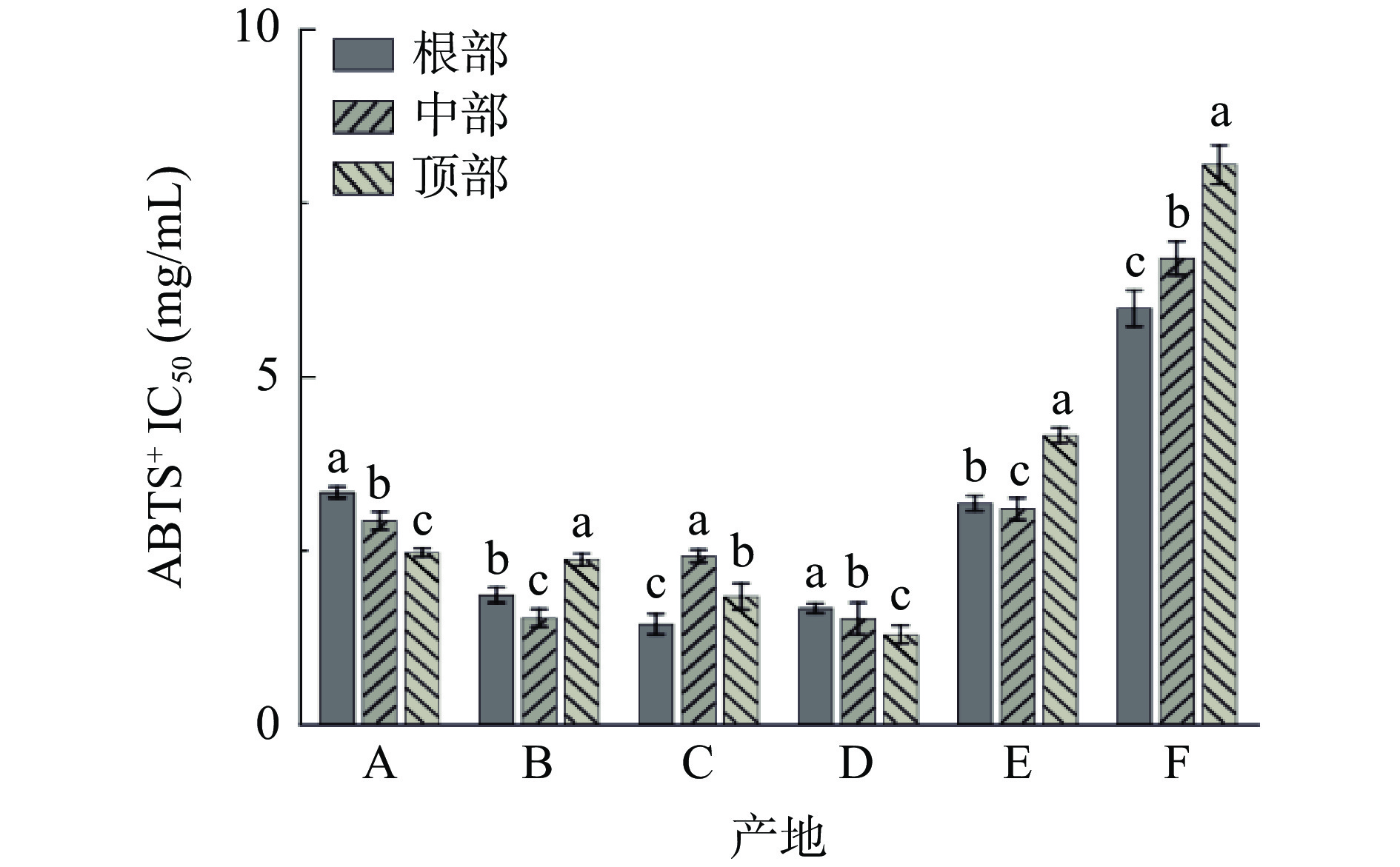
图10为不同产地荒漠肉苁蓉ABTS+自由基清除率的IC50值。由图10可知:产地B、C和D的样品IC50值最小,其三部位的平均IC50值分别为1.91、1.89和1.48 mg/mL,说明这三个产地的样品对ABTS+自由基具有较强的清除能力。产地F的样品对ABTS+自由基的清除能力最弱,其根部、中部和顶部的IC50值显著(P<0.05)大于其他五个产地(分别为5.98、6.7和8.05 mg/mL)。
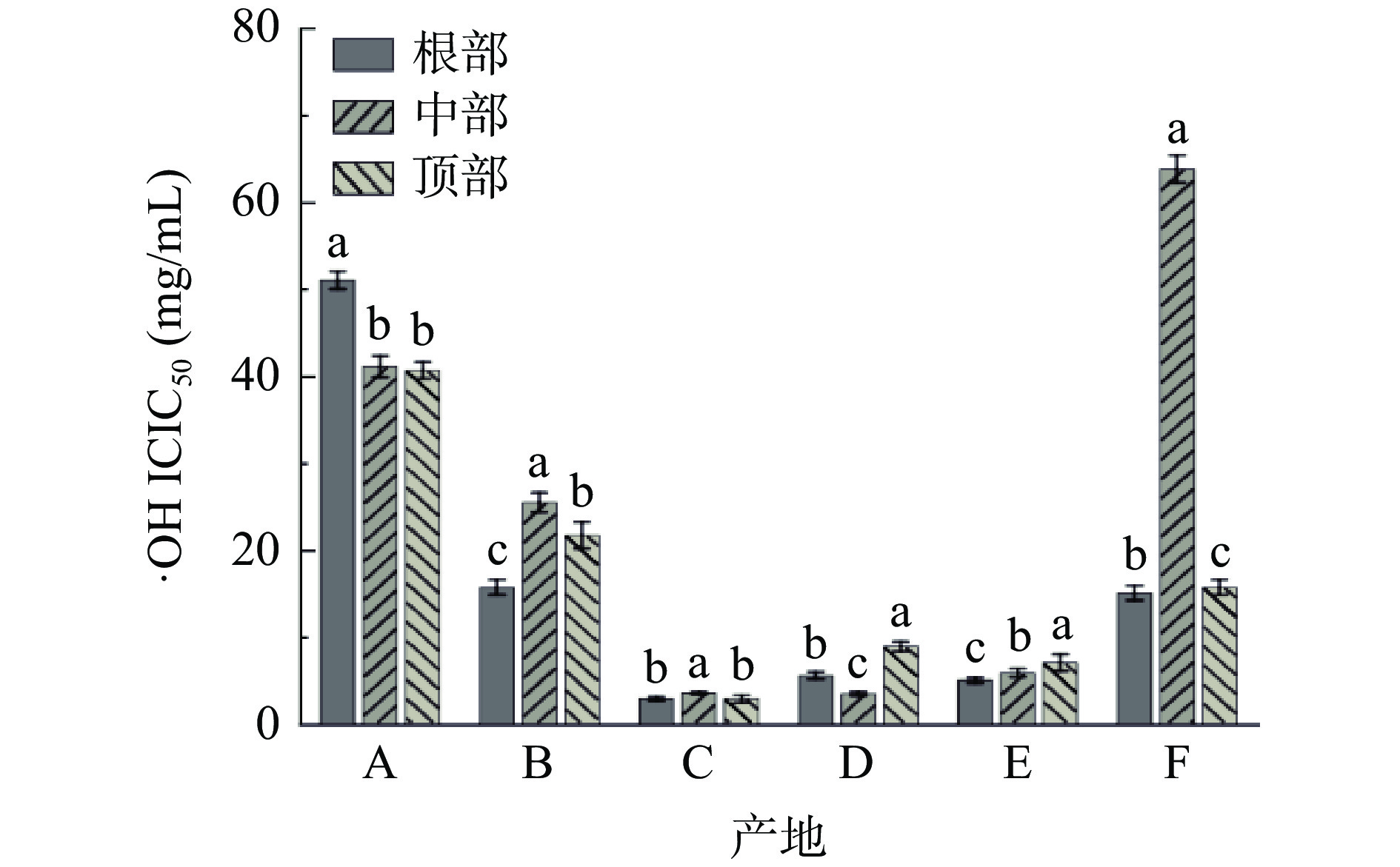
图11为不同产地荒漠肉苁蓉对羟基自由基清除率的IC50值。由图11可知:产地C、D和E的样品对羟基自由基具有较强的清除能力,其三部位的平均IC50值分别为3.05、5.91和5.90 mg/mL。测定A样品对羟基自由基的清除能力较弱,其根部、中部、顶部的IC50值分别为51.01、41.06和40.62 mg/mL。
综上所述:除产地F样品外,其它产地样品均表现出较强的抗氧化能力。包斌[39]和何梦梦[8]等分别研究了肉苁蓉的甲醇、乙醇和水提物对ABTS+和DPPH自由基的清除能力,并得出了类似结论。
2.3 主成分分析及综合品质评价
根据刘丙花等[40]的评价方法,通过对肉苁蓉各主成分的特征值和贡献率进行主成分提取,提高肉苁蓉品质评价的可靠性与分析效率,结果如表2所示。由表2可知:共提取3个主成分(特征值>1),其中PC1方差贡献率为46.93%,PC2为22.85%,PC3为15.66%。三个主成分累计方差贡献率高达85.43%,能够有效的代表所有指标的大部分信息,综合反映样品的品质特征。
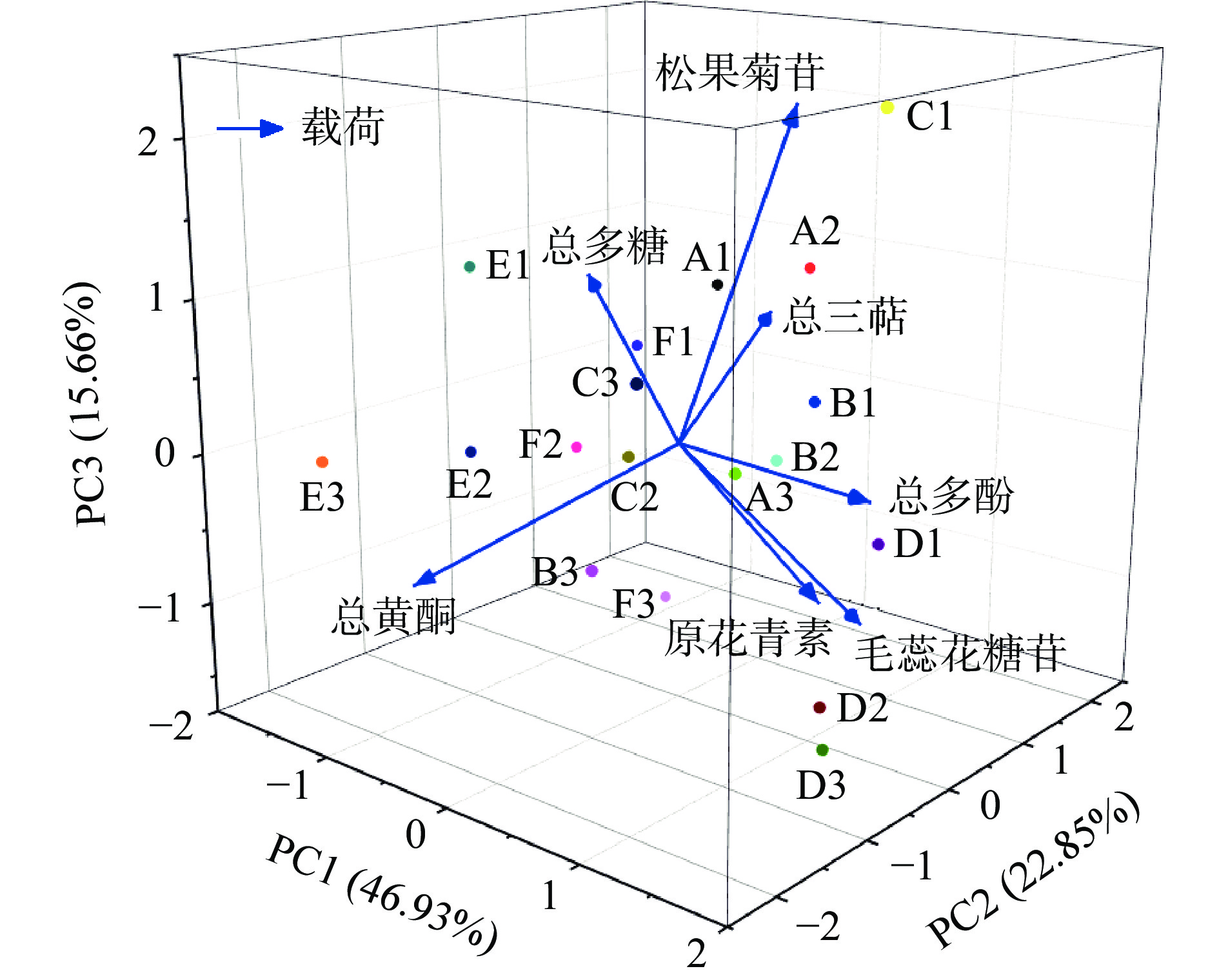
表 2 各主成分方差贡献率Table 2. Percentage of variance of each principal component主成分 特征值 方差百分比(%) 累积方差贡献率(%) PC1 3.285 46.93 46.93 PC2 1.599 22.85 69.78 PC3 1.096 15.66 85.43 将主成分因子进行旋转处理,通过其载荷值反映出主成分因子与各项指标之间的关系,结果如图12和表3所示。
表 3 各主成分因子向量载荷系数Table 3. Principal component factor vector load coefficient活性成分 PC1 PC2 PC3 总多酚 0.523 0.009 −0.024 总黄酮 −0.375 −0.495 −0.268 总三萜 −0.202 0.620 0.148 总多糖 −0.478 0.233 0.255 原花青素 0.135 0.560 −0.513 松果菊苷 0.325 −0.012 0.723 毛蕊花糖苷 0.439 −0.057 −0.233 由表3可知:PC1主要与总多酚、总多糖和毛蕊花糖苷含量相关;PC2主要与总黄酮、总三萜和原花青素含量相关;PC3主要与松果菊苷含量相关。
以三个主成分的方差贡献率为权重,构建荒漠肉苁蓉品质综合评价模型:
综合评价指数Y=46.93%F1+22.85%F2+15.66%F3 (4) 通过主成分分析将18个样品的7种品质因子降维成3项公因子,这三项公因子包含了85.43%的原始信息,以各项主成分因子的方差贡献率代替人为赋值作为权重,将主观描述和模糊评分转化为数学运算对肉苁蓉品质进行综合评价,综合分值越高,表明该样品品质越好[41-42]。不同产地荒漠肉苁蓉品质预测评价结果如表4所示。由表4可知:不同产地荒漠肉苁蓉得分差异较大,总体上根部得分高于中部和顶部。
表 4 不同产地荒漠肉苁蓉品质预测评价结果Table 4. Quality prediction and evaluation results of CD from different origins样品编号 标准化分值 综合得分 F1 F2 F3 A1 −0.381 1.035 0.827 0.187 A2 −0.041 1.680 0.901 0.506 A3 0.571 −0.216 −0.030 0.214 B1 0.583 0.718 0.260 0.478 B2 0.615 0.204 −0.021 0.332 B3 −0.051 −0.914 −0.659 −0.336 C1 1.340 0.186 2.280 1.028 C2 0.223 −0.892 0.143 −0.077 C3 0.739 −1.542 0.819 0.123 D1 1.288 0.333 −0.441 0.611 D2 1.201 −0.198 −1.404 0.299 D3 1.171 −0.099 −1.728 0.256 E1 −1.161 −0.732 1.083 −0.543 E2 −1.253 −0.653 −0.197 −0.768 E3 −1.399 −1.997 −0.021 −1.116 F1 −1.196 1.235 0.224 −0.244 F2 −1.355 0.693 −0.457 −0.549 F3 −0.894 1.160 −1.579 −0.402 通过对比不同产地荒漠肉苁蓉根部、中部、顶部三部分得分的平均值,对不同产地的荒漠肉苁蓉进行品质排序,结果如表5所示:各产地平均得分由高到低依次为:D>C>A>B>F>E。
表 5 不同产地荒漠肉苁蓉平均得分与排序Table 5. Average score and ranking of CD from different origins产地 平均得分 排名 巴丹吉林沙漠(A) 0.302 3 乌兰布和沙漠(B) 0.158 4 腾格里沙漠北部(C) 0.358 2 腾格里沙漠南部(D) 0.389 1 古尔班通古特沙漠南部(E) −0.809 6 古尔班通古特沙漠北部(F) −0.398 5 2.4 聚类分析
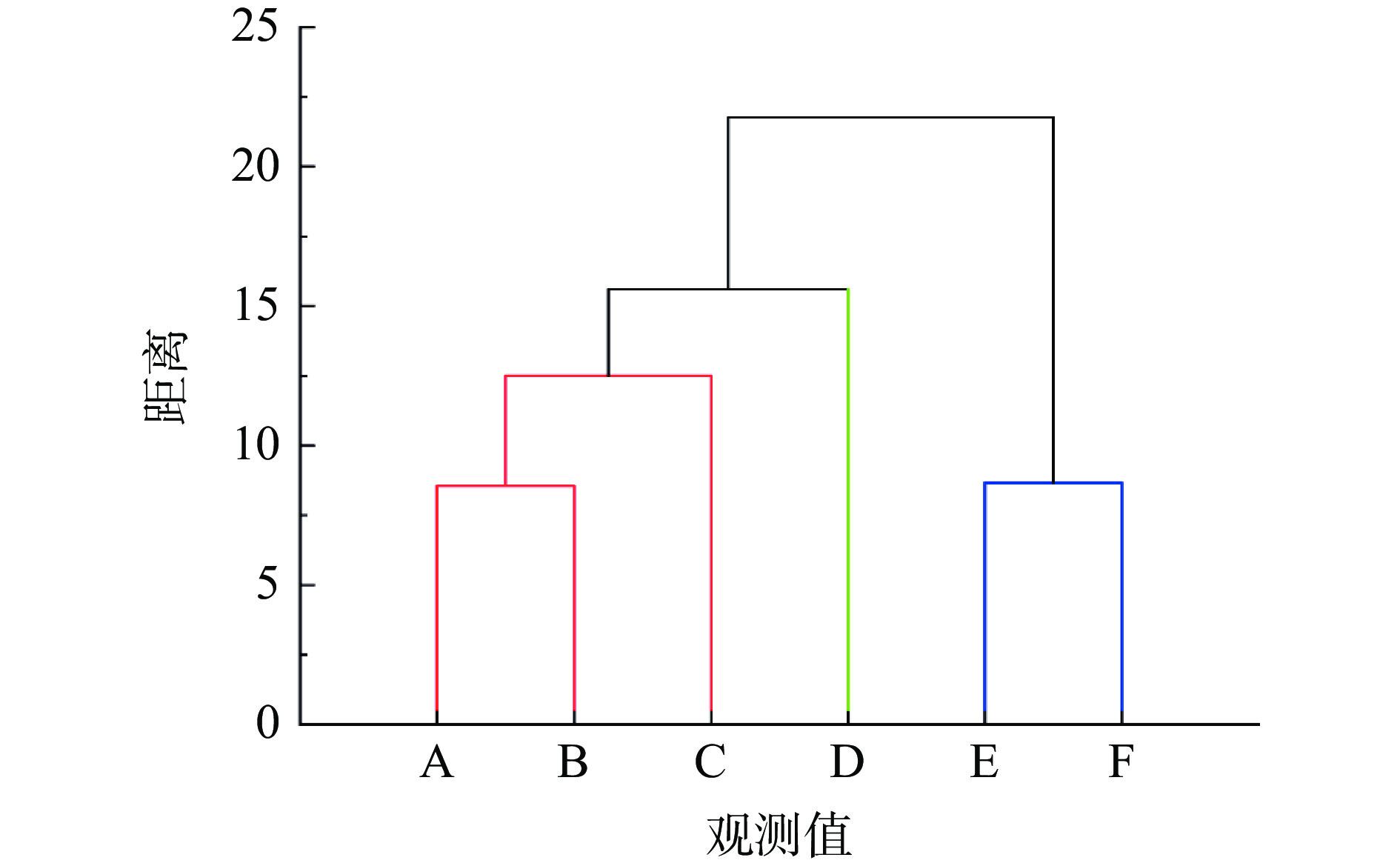
根据荆瑞勇等[43]的聚类方法,基于不同产地荒漠肉苁蓉三个部位品质指标的平均值,对不同样品进行聚类分析,结果如图13所示。
由图13可知:当距离为15时,可将6个产地聚类为三个类群,第一类群聚集了三个产地,分别为A、B、C。第二类群为产地D,这两个类群主要分布在内蒙古和甘肃地区;第三类群聚集了两个产地,分别为E和F,均分布在新疆地区。
表6为不同聚类中各个检测指标的平均值。类群1中松果菊苷平均含量最高,为12.59 mg/g DW;类群2中,总多酚、原花青素以及毛蕊花糖苷平均含量均较高,分别为17.67 mg GAE/g DW、4.51 mg PCE/g DW和6.98 mg/g DW;总黄酮、总三萜与总多糖含量较低,分别为6.52 mg RE/g DW、11.90 mg OAE/g DW、9.84 mg DE/g DW;类群3中总黄酮、总三萜与总多糖平均含量最高,分别为13.64 mg RE/g DW、14.79 mg OAE/g DW、30.93 mg DE/g DW,原花青素、松果菊苷以及毛蕊花糖苷平均含量最低。
表 6 不同聚类中各个检测指标的平均值Table 6. Mean values of the detected compounds in different clusters指标 类群1 类群2 类群3 总多酚 10.40 17.67a 2.93b 总黄酮 7.21 6.52b 13.64a 总三萜 13.28 11.90b 14.79a 总多糖 19.26 9.84b 30.93a 原花青素 3.67 4.51a 3.48b 松果菊苷 12.59a 5.56 2.84b 毛蕊花糖苷 3.86 6.98a 0.37b ·OH IC50 22.73a 5.91b 17.01 DPPH IC50 9.25 0.38b 81.11a ABTS+ IC50 2.23 1.48b 5.19a 注:极值以粗体显示,其中a表示极大值,b表示极小值。 类群2对·OH、DPPH·与ABTS+·的清除能力较强,其平均IC50值分别为5.91、0.38、1.48 mg/mL;类群3对DPPH·与ABTS+·清除能力较弱,平均IC50值分别为81.11、5.19 mg/mL。
通过对不同产地荒漠肉苁蓉进行聚类分析后发现,松果菊苷与毛蕊花糖苷含量在类群1、2中远高于类群3。类群1与类群2四个产地分布在内蒙、甘肃地区,类群3则分布在新疆北疆,这一结果与姬晓慧等[36]对荒漠肉苁蓉的研究结果基本一致,经度的南移可能会有利于毛蕊花糖苷与松果菊苷在荒漠肉苁蓉中的积累。同时发现新疆北部所产荒漠肉苁蓉多糖含量显著高于内蒙古、甘肃地区,推测原因为新疆地区昼夜温差大、日照时间长而有利于植物体内糖的积累[44-45],具体影响因素需进一步研究。同时通过本研究发现,荒漠肉苁蓉中含有多种生物活性物质,因此,在对肉苁蓉品质进行研究时,除《中国药典》规定的主要指标松果菊苷与毛蕊花糖苷外,应结合其他活性成分进行综合评定。
3. 结论
本文对我国不同产地的荒漠肉苁蓉中生物活性物质和抗氧化活性进行了比较分析。结果显示产地和取样部位对荒漠肉苁蓉生物活性物质的含量均具有显著影响,大部分样品根部生物活性物质的含量均显著高于中部和顶部。主成分分析共提取三个主成分,累计方差贡献率为85.43%,综合品质最好的产地为D,其次C和A。聚类分析将样品分为三个类群,其中第一类群(A、B、C)与第二类群(D)分布在内蒙古和甘肃地区,综合得分占前四名,综合品质较好。第三类群(E、F)的产地为新疆地区,综合得分较低。研究结果将为我国不同产地荒漠肉苁蓉的品质评价、功能性产品开发及其标准化提供了重要的基础数据。
-
表 1 荒漠肉苁蓉样品信息
Table 1 Sample information of
CD 编号 产地 沙漠产区 经度 纬度 A 内蒙古阿拉善盟额旗 巴丹吉林沙漠 101°E 41°N B 内蒙古阿拉善盟左旗 乌兰布和沙漠 106°E 39°N C 内蒙古阿拉善盟右旗 腾格里沙漠北部 103°E 39°N D 甘肃武威 腾格里沙漠南部 102°E 37°N E 新疆吉木萨尔 古尔班通古特沙漠南部 89°E 44°N F 新疆阿勒泰 古尔班通古特沙漠北部 88°E 47°N 表 2 各主成分方差贡献率
Table 2 Percentage of variance of each principal component
主成分 特征值 方差百分比(%) 累积方差贡献率(%) PC1 3.285 46.93 46.93 PC2 1.599 22.85 69.78 PC3 1.096 15.66 85.43 表 3 各主成分因子向量载荷系数
Table 3 Principal component factor vector load coefficient
活性成分 PC1 PC2 PC3 总多酚 0.523 0.009 −0.024 总黄酮 −0.375 −0.495 −0.268 总三萜 −0.202 0.620 0.148 总多糖 −0.478 0.233 0.255 原花青素 0.135 0.560 −0.513 松果菊苷 0.325 −0.012 0.723 毛蕊花糖苷 0.439 −0.057 −0.233 表 4 不同产地荒漠肉苁蓉品质预测评价结果
Table 4 Quality prediction and evaluation results of CD from different origins
样品编号 标准化分值 综合得分 F1 F2 F3 A1 −0.381 1.035 0.827 0.187 A2 −0.041 1.680 0.901 0.506 A3 0.571 −0.216 −0.030 0.214 B1 0.583 0.718 0.260 0.478 B2 0.615 0.204 −0.021 0.332 B3 −0.051 −0.914 −0.659 −0.336 C1 1.340 0.186 2.280 1.028 C2 0.223 −0.892 0.143 −0.077 C3 0.739 −1.542 0.819 0.123 D1 1.288 0.333 −0.441 0.611 D2 1.201 −0.198 −1.404 0.299 D3 1.171 −0.099 −1.728 0.256 E1 −1.161 −0.732 1.083 −0.543 E2 −1.253 −0.653 −0.197 −0.768 E3 −1.399 −1.997 −0.021 −1.116 F1 −1.196 1.235 0.224 −0.244 F2 −1.355 0.693 −0.457 −0.549 F3 −0.894 1.160 −1.579 −0.402 表 5 不同产地荒漠肉苁蓉平均得分与排序
Table 5 Average score and ranking of CD from different origins
产地 平均得分 排名 巴丹吉林沙漠(A) 0.302 3 乌兰布和沙漠(B) 0.158 4 腾格里沙漠北部(C) 0.358 2 腾格里沙漠南部(D) 0.389 1 古尔班通古特沙漠南部(E) −0.809 6 古尔班通古特沙漠北部(F) −0.398 5 表 6 不同聚类中各个检测指标的平均值
Table 6 Mean values of the detected compounds in different clusters
指标 类群1 类群2 类群3 总多酚 10.40 17.67a 2.93b 总黄酮 7.21 6.52b 13.64a 总三萜 13.28 11.90b 14.79a 总多糖 19.26 9.84b 30.93a 原花青素 3.67 4.51a 3.48b 松果菊苷 12.59a 5.56 2.84b 毛蕊花糖苷 3.86 6.98a 0.37b ·OH IC50 22.73a 5.91b 17.01 DPPH IC50 9.25 0.38b 81.11a ABTS+ IC50 2.23 1.48b 5.19a 注:极值以粗体显示,其中a表示极大值,b表示极小值。 -
[1] 国家药典委员会. 中华人民共和国药典(1部)[S]. 北京: 化学工业出版社, 2020: 140. National pharmacopoeia commission. pharmacopoeia of the People's Republic of China (Part 1)[M]. Beijing: Chemical Industry Press, 2020: 140.
[2] 陈庆亮, 武志博, 郭玉海, 等. 荒漠肉苁蓉及其寄主梭梭栽培技术[J]. 中国现代中药,2015,17(4):359−368. [CHEN Q L, WU Z B, GUO Y H, et al. Cultivation techniques of Cistanche deserticola and its host haloxylon ammodendron[J]. Modern Chinese Medicine,2015,17(4):359−368. doi: 10.13313/j.issn.1673-4890.2015.4.014 [3] 屠鹏飞, 陈庆亮, 姜勇, 等. 管花肉苁蓉及其寄主柽柳栽培技术[J]. 中国现代中药,2015,17(4):349−358. [TU P F, CHEN Q L, JIANG Y, et al. Cultivation techniques of Cistanche tubulosa and its host tamarix ramosissima[J]. Modern Chinese Medicine,2015,17(4):349−358. doi: 10.13313/j.issn.1673-4890.2015.4.013 [4] 冯朵, 何悦, 蒋勇军, 等. 肉苁蓉抗衰老功能的研究进展[J]. 食品安全质量检测学报,2021,12(11):4429−4437. [FENG D, HE Y, JIANG Y J, et al. Research progress on anti-aging function of Cistanche deserticola[J]. Journal of Food Safety and Quality,2021,12(11):4429−4437. doi: 10.19812/j.cnki.jfsq11-5956/ts.2021.11.018 [5] ZHU K N, MENG Z Q, TIAN Y S, et al. Hypoglycemic and hypolipidemic effects of total glycosides of Cistanche tubulosa in diet/streptozotocin-induced diabetic rats[J]. Journal of Ethnopharmacology,2021,276:113991−113991. doi: 10.1016/j.jep.2021.113991
[6] WANG F J, TU P F, ZENG K W, et al. Total glycosides and polysaccharides of C. deserticola prevent osteoporosis by activating Wnt/β-catenin signaling pathway in SAMP6 mice[J]. Journal of ethnopharmacology,2021,271:113899. doi: 10.1016/j.jep.2021.113899
[7] FAN L, PENG Y, WANG J W, et al. Total glycosides from stems of Cistanche tubulosa alleviate depression-like behaviors: bidirectional interaction of the phytochemicals and gut microbiota[J]. Phytomedicine,2021,83:153471. doi: 10.1016/j.phymed.2021.153471
[8] 何梦梦, 游林, 包晓玮, 等. 肉苁蓉水提物体外抗氧化及对小鼠肠道菌群紊乱的作用[J]. 食品研究与开发,2020,41(23):44−50. [HE M M, YOU L, BAO X W, et al. Effects of water extract of Cistanche deserticola on external antioxidant and intestinal microflora disturbance in mice[J]. Food Research and Development,2020,41(23):44−50. doi: 10.12161/j.issn.1005-6521.2020.23.008 [9] LEI H B, WANG X Y, ZHANG Y H, et al. Herba Cistanche (Rou Cong Rong): A review of its phytochemistry and pharmacology: reviews[J]. Chemical and Pharmaceutical Bulletin,2020,68(8):694−712. doi: 10.1248/cpb.c20-00057
[10] 郭元亨, 曹丽丽, 赵兵, 等. 荒漠肉苁蓉苯乙醇苷对酒精诱导的慢性肝损伤的修复作用[J]. 食品科学,2018,39(13):176−183. [GUO Y H, CAO L L, ZHAO B, et al. Effects of phenylethanol glycoside in Cistanche deserticola on the repair of alcohol-induced chronic liver injury[J]. Food Science,2018,39(13):176−183. doi: 10.7506/spkx1002-6630-201813026 [11] GUO Y L, CUI Q L, REN S M, et al. The hepatoprotective efficacy and biological mechanisms of three phenylethanoid glycosides from Cistanches herba and their metabolites based on intestinal bacteria and network pharmacology[J]. Journal of Natural Medicines,2021,75(4):1−14.
[12] WANG D F, WANG H Z, GU L. The antidepressant and cognitive improvement activities of the traditional Chinese herbCistanche[J]. Evidence-Based Complementary and Alternative Medicine,2017,2017:3925903.
[13] 姚辛敏, 周晓洁, 周妍妍. 肉苁蓉化学成分及药理作用研究进展[J]. 中医药学报,2021,49(2):93−97. [YAO X M, ZHOU X J, ZHOU Y Y. Advances in chemical constituents and pharmacological effects of Cistanche deserticola[J]. Acta Chinese Medicine and Pharmacology,2021,49(2):93−97. doi: 10.19664/j.cnki.1002-2392.210045 [14] 丁燕, 张开梅, 苍小鑫, 等. 肉苁蓉属化学成分及生物活性研究进展[J]. 大连工业大学学报,2016,35(6):395−402. [DING Y, ZHANG K M, CANG X X, et al. Advances in chemical constituents and biological activities of Cistanche[J]. Journal of Dalian Polytechnic University,2016,35(6):395−402. doi: 10.19670/j.cnki.dlgydxxb.2016.06.002 [15] 颜贵卉, 田金虎, 龙本文, 等. 肉苁蓉中苯乙醇苷类成分的研究进展[J]. 中南药学,2012,10(9):692−695. [YAN G H, TIAN J H, LONG B W, et al. Advances in studies of phenylethanol glycosides in Cistanche deserticola[J]. Central South Pharmacy,2012,10(9):692−695. [16] 方海林, 李军考, 姚森明, 等. 松果菊苷通过激活ERK/BMP-2信号通路促进大鼠成骨细胞增殖观察[J]. 基层医学,2015,19(4):435−438. [FANG H L, LI J K, YAO S M, et al. Effects of echinoside on the proliferation of osteoblasts in rats by activating ERK/BMP-2 signaling pathway[J]. Primary care medicine,2015,19(4):435−438. [17] 田原. 松果菊苷诱导骨髓间充质干细胞向成骨细胞分化及作用机制研究[D]. 沈阳: 辽宁中医药大学, 2015: 35-55. TIAN Y. Effects of echinoside on the differentiation of bone marrow mesenchymal stem cells into osteoblasts [J]. Shenyang: Liaoning University of Traditional Chinese Medicine, 2015: 35-55.
[18] 尉大为, 葛锌雨, 刘奕含, 等. 松果菊苷诱导骨髓间充质干细胞向成骨细胞分化的研究[J]. 中药药理与临床,2017,33(2):48−52. [YU D W, GE X Y, LIU Y H, et al. Study on differentiation of bone marrow mesenchymal stem cells into osteoblasts induced by echinoside[J]. Pharmacology and Clinics of Chinese materia medica,2017,33(2):48−52. doi: 10.13412/j.cnki.zyyl.2017.02.014 [19] 姚金茜, 王学敏, 鞠静, 等. 肉苁蓉多糖对气管切开插管留置大鼠肺部免疫功能的干预作用[J]. 时珍国医国药,2019,30(2):275−277. [YAO J Q, WANG X M, JU J, et al. Effects of Cistanche deserticola polysaccharide on pulmonary immune function in tracheostomy intubation indplacement rats[J]. Li Shi Zhen Medicine and Materia Medica Research,2019,30(2):275−277. [20] LIU Y, WANG H, YANG M, et al. Cistanche deserticola polysaccharides protects PC12 cells against OGD/RP-induced injury[J]. Biomedicine & Pharmacotherapy,2018,99:671−680.
[21] SONG D Z, CAO Z, LIU Z B, et al. Cistanche deserticola polysaccharide attenuates osteoclastogenesis and bone resorption via inhibiting RANKL signaling and reactive oxygen species production[J]. Journal of Cellular Physiology,2018,233(7):9674−9684.
[22] 马慧, 尹若熙, 郭敏, 等. 肉苁蓉多糖对D-半乳糖致衰老模型小鼠CREB表达的影响[J]. 中国实验方剂学杂志,2014,20(20):137−141. [MA H, YIN R X, GUO M, et al. Effects of Cistanche deserticola polysaccharides on CREB expression in d-galactose induced aging mice[J]. Chinese Journal of Experimental Traditional Medical Formulae,2014,20(20):137−141. doi: 10.13422/j.cnki.syfjx.2014200137 [23] 蔡鸿, 鲍忠, 姜勇, 等. 不同影响因素下肉苁蓉中3种活性成分的定量分析[J]. 中草药,2013,44(22):3223−3230. [CAI H, BAO Z, JIANG Y, et al. Quantitative analysis of three active components in Cistanche under different influencing factors[J]. Chinese Traditional and Herbal Drugs,2013,44(22):3223−3230. [24] 杨太新, 杜艳华, 刘金娜, 等. 管花肉苁蓉不同生长时间和部位的有效成分含量分析[J]. 时珍国医国药,2014,25(5):1191−1193. [YANG T X, DU Y H, LIU J N, et al. Analysis of active components in different growth time and parts of Cistanche tubulosa[J]. Li Shi Zhen Medicine and Materia Medica Research,2014,25(5):1191−1193. [25] 周美娟, 沈丽琴, 刘强, 等. 肉苁蓉产地加工方法研究[J]. 亚太传统医药,2020,16(12):54−58. [ZHOU M J, SHEN L Q, LIU Q, et al. Study on producing area processing methods of Cistanche[J]. Asia-pacific Traditional Medicine,2020,16(12):54−58. [26] 李彪. 肉苁蓉有效成分含量的研究[D]. 呼和浩特: 内蒙古农业大学, 2012: 19. LI B. Study on the content of active components in Cistanche[D]. Hohhot: Inner Mongolia Agricultural University, 2012: 19.
[27] LI F H, ZHANG X L, ZHENG S J, et al. The composition, antioxidant and antiproliferative capacities of phenolic compounds extracted from tartary buckwheat bran [Fagopyrum tartaricum (L.) Gaerth][J]. Journal of Functional Foods,2016,22:145−155. doi: 10.1016/j.jff.2016.01.027
[28] 熊双丽, 李安林, 任飞, 等. 苦荞和甜荞麦粉及麦壳中总黄酮的提取和自由基清除活性[J]. 食品科学,2009,30(3):118−122. [XIONG S L, LI A L, REN F, et al. Extraction and free radical scavenging activity of total flavonoids from tartary buckwheat, sweet buckwheat powder and wheat husk[J]. Food Science,2009,30(3):118−122. doi: 10.3321/j.issn:1002-6630.2009.03.025 [29] 何策, 王超, 陈纯, 等. 桑树桑黄总三萜提取工艺优化及其降血脂、抗氧化活性研究[J]. 食品工业科技,2021,42(7):208−215. [HE C, WANG C, CHEN C, et al. Optimization of extraction technology of total triterpenoids from mulberry yellow and its hypidemia and antioxidant activity[J]. Science and Technology of Food Industry,2021,42(7):208−215. doi: 10.13386/j.issn1002-0306.2020060237 [30] 张雅丹, 赵梦倩, 杨煜佼, 等. 铁皮石斛多糖提取及对羟自由基诱导的SH-SY5Y细胞凋亡的抑制作用[J]. 食品科学,2020,41(14):286−293. [ZHANG Y D, ZHAO M Q, YANG Y J, et al. Extraction of dendrobium officinale polysaccharide and its inhibitory effect on sh-SY5Y cell apoptosis induced by hydroxyl radical[J]. Food science,2020,41(14):286−293. doi: 10.7506/spkx1002-6630-20190802-033 [31] 李彩霞, 焦扬, 崔玮, 等. 赤霞珠葡萄梗原花青素的表征及其抗氧化活性研究[J]. 中国酿造,2021,40(10):201−206. [LI C X, JIAO Y, CUI W, et al. Characterization and antioxidant activity of proanthocyanidins from Cabernet Sauvignon grape stalks[J]. China Brewed,2021,40(10):201−206. doi: 10.11882/j.issn.0254-5071.2021.10.034 [32] 冯昌寅. 肉苁蓉中松果菊苷和毛蕊花糖苷提取纯化工艺研究[D]. 哈尔滨: 东北林业大学, 2021: 10-11. FENG C Y. Study on extraction and purification technology of echinoside and calyx glycoside from Cistanche deserticola[D]. Harbin: Northeast Forestry University, 2021: 10-11.
[33] ROBERTA R, NICOLETTA P, ANNA P, et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay[J]. Free Radical Biology and Medicine,1999,26(9):1231−1237.
[34] 钟文秀, 袁江兰, 李传雯, 等. 菌种耦合发酵米渣生酱油的品质和抗氧化活性[J]. 食品科学,2017,38(6):55−61. [ZHONG W X, YUAN J L, LI C W, et al. Quality and antioxidant activity of rice residue raw soy sauce fermented by bacterial coupling[J]. Food Science,2017,38(6):55−61. doi: 10.7506/spkx1002-6630-201706009 [35] SMIRNOFF N, CUMBES Q J. Hydroxyl radical scavenging activity of compatible solutes[J]. Phytochemistry,1989,28(4):1057−1060. doi: 10.1016/0031-9422(89)80182-7
[36] 姬晓慧, 李鸿辉, 李桂芳, 等. 新疆古尔班通古特沙漠不同地区荒漠肉苁蓉功效物质评价[J]. 广东农业科学,2018,45(10):112−117. [JI X H, LI H H, LI G F, et al. Evaluation of functional substances of Cistanche deserticola in different areas of gurbantunggut desert, Xinjiang[J]. Guangdong Agricultural Sciences,2018,45(10):112−117. doi: 10.16768/j.issn.1004-874X.2018.10.018 [37] 刘雄, 吴蓉, 余晓晖, 等. HPLC法测定不同产地肉苁蓉中松果菊苷的含量[J]. 甘肃中医学院学报,2009,26(5):42−44. [LIU X, WU R, YU X H, et al. Determination of echinoside in Cistanche from different habitats by HPLC[J]. Journal of Gansu College of Traditional Chinese Medicine,2009,26(5):42−44. [38] 赵志红, 邢桉荣, 王志强, 等. 不同产地肉苁蓉品质特征研究[J]. 辽宁中医药大学学报,2019,21(12):65−69. [ZHAO Z H, XING A R, WANG Z Q, et al. Quality characteristics of Cistanche deserticola from different habitats[J]. Journal of Liaoning University of Traditional Chinese Medicine,2019,21(12):65−69. doi: 10.13194/j.issn.1673-842x.2019.12.016 [39] 包斌, 唐晓阳, 田宏, 等. 管花肉苁蓉提取物的抗氧化活性研究[J]. 上海中医药杂志,2010,44(2):68−71. [BAO B, TANG X Y, TIAN H, et al. Study on antioxidant activity of extracts from Cistanche tubulosa[J]. Shanghai Journal of Traditional Chinese Medicine,2010,44(2):68−71. doi: 10.16305/j.1007-1334.2010.02.024 [40] 刘丙花, 孙锐, 王开芳, 等. 不同蓝莓品种果实品质比较与综合评价[J]. 食品科学,2019,40(1):70−76. [LIU B H, SUN R, WANG K F, et al. Comparison and comprehensive evaluation of fruit quality of different blueberry varieties[J]. Food Science,2019,40(1):70−76. doi: 10.7506/spkx1002-6630-20170829-338 [41] 李跃红, 冉茂乾, 徐孟怀, 等. 不同品种猕猴桃果实品质比较与综合评价[J]. 食品与发酵工业,2020,46(23):162−168. [LI Y H, RAN M Q, XU M H, et al. Comparison and comprehensive evaluation of fruit quality of different kiwifruit varieties[J]. Food and Fermentation Industries,2020,46(23):162−168. doi: 10.13995/j.cnki.11-1802/ts.024429 [42] 张春岭, 刘慧, 刘杰超, 等. 基于主成分分析与聚类分析的中、早熟桃品种制汁品质评价[J]. 食品科学,2019,40(17):141−149. [ZHANG C L, LIU H, LIU J C, et al. Juice quality evaluation of medium and early maturing peach varieties based on principal component analysis and cluster analysis[J]. Food Science,2019,40(17):141−149. doi: 10.7506/spkx1002-6630-20190222-137 [43] 荆瑞勇, 卫佳琪, 王丽艳, 等. 基于主成分分析的不同水稻品种品质综合评价[J]. 食品科学,2020,41(24):179−184. [JIN R Y, WEI J Q, WANG L Y, et al. Comprehensive quality evaluation of different rice varieties based on principal component analysis[J]. Food Science,2020,41(24):179−184. doi: 10.7506/spkx1002-6630-20191218-198 [44] 张春柳. 昼夜温差对铁皮石斛原球茎多糖含量的影响及机理研究[D]. 福州: 福建农林大学, 2015: 31-35. ZHANG C L. Effects of diurnal temperature difference on polysaccharide content in protocorm of dendrobium officinale and its mechanism[D]. Fuzhou: Fujian Agriculture and Forestry University, 2015: 31-35.
[45] 李莉, 李佳, 高青, 等. 昼夜温差对番茄生长发育、产量及果实品质的影响[J]. 应用生态学报,2015,26(9):2700−2706. [LI L, LI J, GAO Q, et al. Effects of diurnal temperature difference on growth, yield and fruit quality of tomato[J]. Chinese Journal of Applied Ecology,2015,26(9):2700−2706. doi: 10.13287/j.1001-9332.20150630.019 -
期刊类型引用(7)
1. 刘冀黔,旦正杰,韩丽娟,桂林生,侯生珍,王志有,杨葆春. 不同月龄黑藏羊肉品质及风味评价分析. 饲料研究. 2024(13): 105-111 .  百度学术
百度学术
2. 宁舒娴,曾金秀,沙小梅,丁红秀. 不同生境来源的鳙鱼肉挥发性物质组成比较分析. 食品工业科技. 2024(18): 265-272 .  本站查看
本站查看
3. 董平,范文教,朱开宪,吴华昌,邓静. 不同复热方式对咸烧白风味的影响. 食品科技. 2023(02): 122-129 .  百度学术
百度学术
4. 陈方雪,邓祎,谌玲薇,李冬生,乔宇,吴文锦,熊光权,汪兰,李新,石柳,丁安子. 预制冷风风干武昌鱼干制过程中的品质变化及香气形成. 现代食品科技. 2023(02): 9-17 .  百度学术
百度学术
5. 张蓝月,孙万成,罗毅皓. 基于气相色谱-离子迁移谱分析不同地区羊肉的挥发性风味化合物. 食品与发酵工业. 2023(10): 265-272 .  百度学术
百度学术
6. 火玉明,柯汉杰,吴晨昕,姜红贺,梁鹏,汪晴,陈小辉. 海鲈鱼鱼松加工工艺研究. 食品安全质量检测学报. 2022(10): 3367-3374 .  百度学术
百度学术
7. 戴振庭,周惠敏,殷泽生,周瑜,陈舜胜. 添加植物油对鲣鱼鱼松滋味的影响. 甘肃农业大学学报. 2022(06): 227-234 .  百度学术
百度学术
其他类型引用(5)





 下载:
下载:





 下载:
下载:
