Isolation and Identification of Ellagic Acid from Rosa roxburghii Tratt and Its Optimization of Extraction Process
-
摘要: 目的:本研究旨在建立刺梨中鞣花酸的分离纯化方法,并对提取鞣花酸的酸水解法进行工艺优化。方法:以刺梨干果为原料,通过超声辅助提取法提取单宁酸,加酸进行水解制得粗鞣花酸,并通过甲醇重结晶进行纯化,采用高效液相色谱测定其纯度,及核磁共振波谱法(NMR)、红外光谱法(IR)、质谱法(MS)、高效液相色谱法(HPLC)、紫外光谱法(UV)对提取得到的鞣花酸进行结构确证,另外,以得率为指标,以酸浓度、提取温度、提取时间、液料比为自变量,在单因素实验的基础上,通过Box-Benhnken中心组合设计和响应面分析法确定刺梨鞣花酸的酸水解工艺条件。结果:从刺梨中提取得到了鞣花酸提取物,通过HPLC分析测定其纯度达到92%,鞣花酸提取物的最大吸收波长254 nm,分子离子峰m/z 301.00,红外吸收各波数与标准品一致,并利用1H-NMR,13C-NMR确定了其结构。通过响应面法得到了酸水解法制取鞣花酸的最优工艺:酸浓度5%,提取温度127 ℃,液料比为8:1 mL/g,提取时间9.8 h,在此条件下刺梨鞣花酸的得率为30.2%±2.3%(与预测值相比P>0.05)。结论:本研究建立了一种刺梨中鞣花酸简便高效的纯化方法并对其进行了结构确证,并获得了酸水解法制取鞣花酸的最优工艺,为刺梨资源的开发利用提供了参考。Abstract: Objective: The purpose of this study was to establish a method for the isolation and purification of ellagic acid from Rosa roxburghii Tratt and to investigate the optimal acidification process condition for extraction of ellagic acid from Rosa roxburghii Tratt. Methods: Rosa roxburghii Tratt dried fruit was used as material, ellagic acid was obtained by acid hydrolyzed, and it was purified by methanol recrystallization. Its purity was determined by high performance liquid chromatography (HPLC), the structure of ellagic acid sample was confirmed by Nuclear magnetic resonance spectroscopy (NMR), infrared spectroscopy (IR), mass spectrometry (MS), high performance liquid chromatography (HPLC), ultraviolet spectroscopy (UV). In addition, with ellagic acid extraction yield as an indicator, acid concentration, extraction temperature, extraction time and liquid ratio as independent variables, based on the single-factor tests, a Box-Benhnken central composite and response surface methodology was designed to explore the optimum extraction conditions. Results: The ellagic acid extract was obtained from Rosa roxburghii Tratt, and its purification was 92% analyzed by HPLC, the maximum absorption wavelength of ellagic acid extract was 254 nm, the molecular ion peak m/z was 301.00, and the infrared absorption wavenumber was consistent with the standard, and its structure was determined by 1H-NMR and 13C-NMR, and the optimal extraction parameters of ellagic acid was obtained by response surface method: Acid concentration 5%, extraction temperature 127 ℃, liquid ratio 8:1 mL/g, extraction time 9.8 h. Under this condition, the highest yield of ellagic acid could reach 30.2%±2.3% (compared to predicted value P>0.05). Conclusion: In this study, a simple and efficient purification method of ellagic acid from Rosa roxburghii Tratt was established and its structure was confirmed, and the optimal process for the preparation of ellagic acid by acid hydrolysis was obtained, which would provide a reference for the development and utilization of Rosa roxburghii Tratt resources.
-
Keywords:
- Rosa roxburghii Tratt /
- ellagic acid /
- extraction /
- purification /
- identification /
- process optimization
-
刺梨(Rosa roxburghii Tratt),蔷薇科蔷薇属小灌木植物,又名野石榴、缫丝花等,其果实表皮绿色,成熟时呈金黄色,表面一般带有短刺,可食用,是贵州省特有的药食同源的民族药[1-2],贵州刺梨分布密集,产量高[3],目前市面上开发的刺梨汁,刺梨茶等产品受到大众的喜爱。刺梨含有丰富的维生素C、超氧化物歧化酶、酚类化合物和有机酸等活性物质[4-5],其抗氧化活性、抗高血脂、抗动脉粥样硬化等多种生理活性,使其成为一种极具潜力的功能性食品,近年来,刺梨资源的合理利用渐受关注[6]。
多酚是刺梨中第二主要成分[7],而鞣花酸(C14H6O8)是一种多酚二内酯,是没食子酸的二聚衍生物[8],具有抗氧化活性、抗病毒、抗肿瘤作用等[9-10]。已有研究者利用UPLC-Triple-TOF/MS鉴定出了刺梨中含有鞣花酸及其衍生物组分[11];谭登航等[12]利用高效液相色谱法对刺梨不同部位鞣花酸含量进行了测定,刺梨果中游离鞣花酸的含量可达20.59 mg/g;向卓亚等[13]通过热风干燥法制得的刺梨干果中鞣花酸含量为1.70 mg/g;谢国芳等[14]对金刺梨果实和叶中鞣花酸的含量进行了比较,测得贵州金刺梨果实中鞣花酸含量仅为26.8 μg/g,可以看出不同研究者测定的刺梨中鞣花酸含量差异巨大,这可能是刺梨果品种、产地和研究者的提取方法不同所致。
鞣花酸的提取制备方法主要有直接提取法、五倍子单宁氧化制备法、发酵制备法、酸水解制备法等[15],其中水解法过程简单,得率较高[16]。水解法包括先提取后水解和直接酸水解法,与先提取后水解相比,直接酸水解法纯度较低,但得率较高,且操作更加简单[17]。甲醇重结晶法是一种简单有效的鞣花酸纯化方法,能得到较高纯度的鞣花酸[18]。徐涓等[19]对比了溶剂法、重结晶法、碱溶酸沉法、反溶剂法对鞣花酸纯度的影响,发现重结晶法可得到纯度为98%的鞣花酸;徐曼等[20]从化香果中得到纯度为45%的鞣花酸粗产品,利用甲醇重结晶法精制得到纯度≥97%的鞣花酸产品。
本研究通过响应面法优化刺梨中酸水解法制取鞣花酸的提取工艺,确定了酸水解法提取刺梨中鞣花酸的最优条件,并利用甲醇重结晶法,提纯得到了纯度较高的鞣花酸产品,并对其进行了结构鉴定,以期为刺梨资源的合理开发利用提供理论依据,为后续的研究者提供一种切实可行的参考方法。
1. 材料与方法
1.1 材料与仪器
刺梨果 贵州龙膳香坊食品有限公司;二甲基硅油 上海麦克林生化科技有限公司;活性炭 北京鼎国昌盛生物技术有限责任公司;EDTA-2Na Genview公司;甲醇(分析纯)、乙腈(色谱纯) 天津市科密欧化学试剂有限公司;鞣花酸标准品(纯度≥98%) 北京索莱宝科技有限公司。
KQ-300DE超声清洗器 昆山市超声仪器有限公司;N-1300旋转蒸发仪、OSB-2200油浴锅 上海爱朗仪器有限公司;Agilent-1260高效液相色谱仪 美国安捷伦科技有限公司;UV-2700紫外分光光度计 苏州岛津仪器有限公司;FTIR-650傅里叶变换红外光谱仪 天津港东科技发展股份有限公司;SRD-3600质谱仪 赛默飞世尔科技有限公司等。
1.2 实验方法
1.2.1 刺梨果中鞣花酸的分离纯化
参考吴兴付[21]的提取方法结合预实验改进。将刺梨鲜果晒干,用粉碎机粉碎,过80目筛,称取1 kg刺梨粉末,加入10倍量的80%甲醇溶液在60 ℃进行超声提取(300 W),提取60 min,共提取两次,超声结束后进行抽滤。取上清,利用旋转蒸发仪减压浓缩,水浴温度50 ℃,浓缩至总体积的1/5左右。加入3%浓H2SO4溶液(v/v)进行酸水解反应,于110 ℃油浴搅拌发生反应(1000 r/min),6 h后,趁热进行过滤,弃去上清,用超纯水将滤饼水洗至pH为6~7,烘箱干燥后得到样品A。取样品A放入圆底烧瓶,加入少量EDTA-2Na和活性炭吸附金属离子和有色杂质,再加入20倍量的甲醇溶液,于80 ℃回流2 h,趁热过滤,取出上清液静置冷却至室温,48 h后过滤得到结晶,水洗两次后放入烘箱干燥。将重结晶得到的样品进行二次重结晶,步骤同上,水洗干燥后得到样品B。
实验步骤如图1:
1.2.2 鞣花酸的分析方法
鞣花酸标准品的测定:准确称取一定量的鞣花酸标准品,转移至容量瓶,用甲醇定容,作为对照品溶液。
使用高效液相色谱法(HPLC)分析测定样品中鞣花酸纯度,具体检测方法如下:色谱柱为Symmetry C18(4.6 mm×250 mm,5.0 μm),柱温35 ℃,流动相为乙腈(A)和0.5%的磷酸水(B),梯度洗脱(0~25 min,10%~20% A;25~45 min,20%~90% A;45~50 min,90%~10% A),流速2.5 mL/min,检测波长254 nm,上样量10 μL,根据下式计算鞣花酸样品纯度:
PB=AUCB×UB×CAAUCA×UA×CB×PA 其中,PA、PB是标准品和样品B的纯度,AUCA、AUCB是标准品和样品B的峰面积,UA、UB是标准品和样品B的进样量,CA、CB是标准品和样品B的浓度[22]。
1.2.3 鞣花酸的鉴定
分别使用紫外光谱、核磁共振波谱、红外光谱、质谱对鞣花酸样品进行定性分析。
紫外光谱检测:参考苏宏伟等[23]的实验,称取适量鞣花酸标准品与样品B,50%甲醇定容,200~800 nm内进行全波长扫描。
核磁共振波谱检测:鞣花酸标准品与样品B溶于DMSO-d6,1H-NMR和13C-NMR的工作频率分别为500和100 MHz。
红外光谱检测:称取适量鞣花酸标准品与样品B,加入适量干燥的KBr,制成均匀透明的薄片,使用红外光谱仪在400~4000 cm−1波数内分别对鞣花酸标准品和样品B进行扫描。
质谱检测:鞣花酸标准品与样品B溶于甲醇,使用电喷雾电离源(ESI),负离子模式,扫描范围m/z 0~2000,毛细管电压4.20 kV,锥孔电压36 V,离子源温度100 ℃,脱溶剂气温度250 ℃,雾化器压力30 psi。
1.2.4 直接酸水解法提取刺梨中鞣花酸的单因素实验设计
以刺梨鞣花酸得率为指标,分别对液料比、反应时间、反应温度、硫酸浓度这4个影响因素及其对鞣花酸得率的影响进行考察,每个因素设定5个水平,每组试验重复3次,结果取平均值。准确称取10 g刺梨粉末5份,采用直接酸水解的方法,分别固定3个反应条件,即液料比10:1 mL/g、提取时间6 h、提取温度110 ℃、硫酸浓度3%,考察另一个反应条件,如提取温度(90、100、110、120、130 ℃)、提取时间(2、4、6、8、10 h)、液料比(5:1、7.5:1、10:1、15:1、20:1 mL/g)、硫酸浓度(1%、2%、3%、4%、5%)对鞣花酸得率的影响,以确定刺梨鞣花酸提取的最适液料比、提取时间、提取温度、硫酸浓度。
得率(%)=鞣花酸的质量原料质量×100 1.2.5 刺梨鞣花酸提取工艺的响应面优化试验设计
应用Design-Expert 8.0.6统计分析液料比、提取时间、提取温度等3个影响因素对刺梨鞣花酸的影响,采用中心组合试验Box-Benhnken设计试验方案进行3因素及3水平的响应面试验,响应面试验的因素及水平见表1。
表 1 刺梨鞣花酸提取工艺响应面优化试验的因素及水平Table 1. Factors and levels of response surface method optimization experiment for extraction process of ellagic acid from Rosa roxburghii tratt水平 因素 A提取温度(℃) B提取时间(h) C液料比(mL/g) −1 110 6 5:1 0 120 8 7.5:1 1 130 10 10:1 1.3 数据处理
实验平行重复三次,实验数据以Mean±SD值表示。单因素实验运用SPSS 13.0进行处理,使用GraphPad Prism 8软件作图,响应面试验运用Design-Expert 12软件进行数据处理,模型建立和分析。
2. 结果与分析
2.1 刺梨中鞣花酸的定性分析
2.1.1 HPLC测定刺梨中鞣花酸
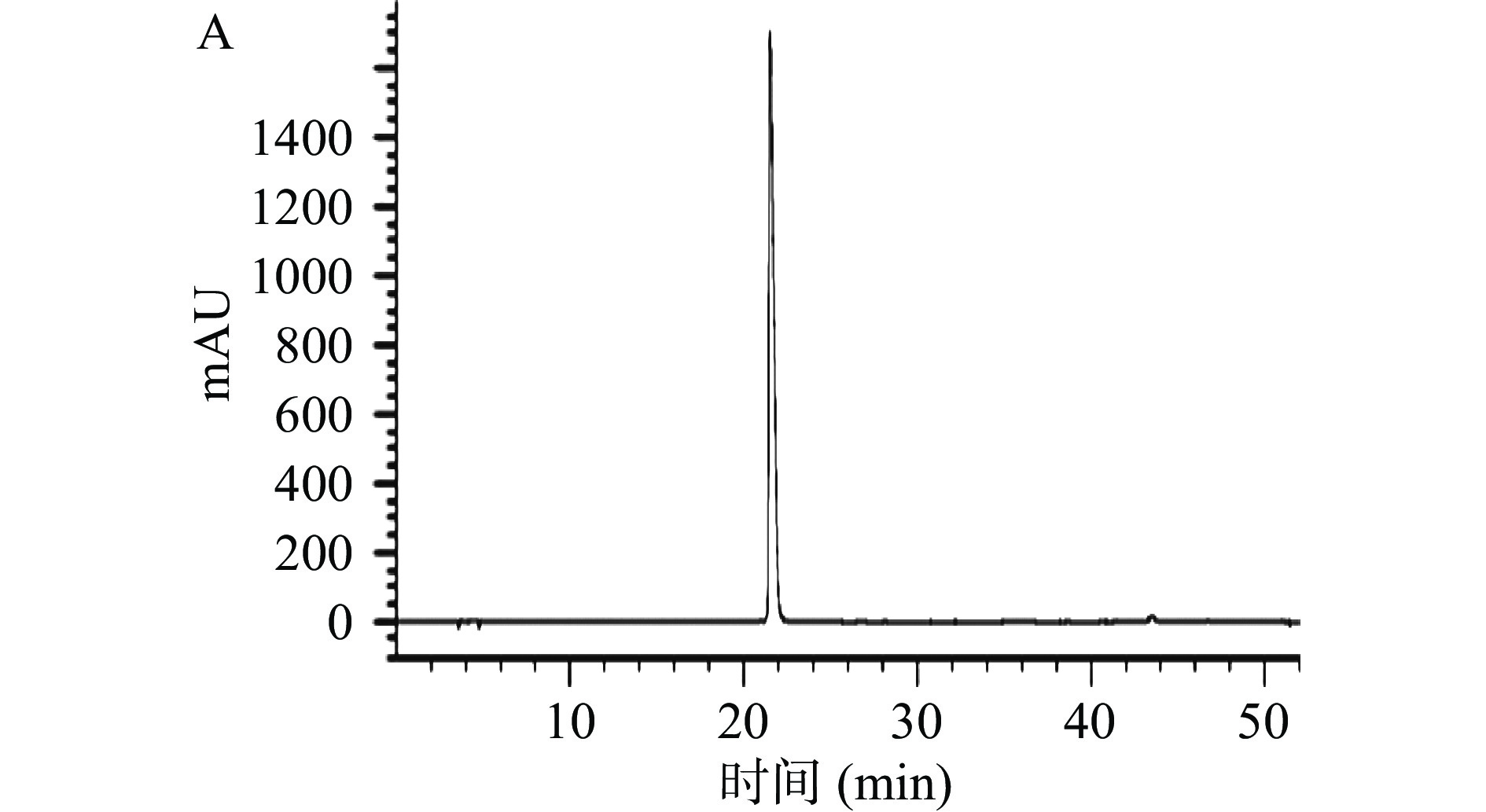
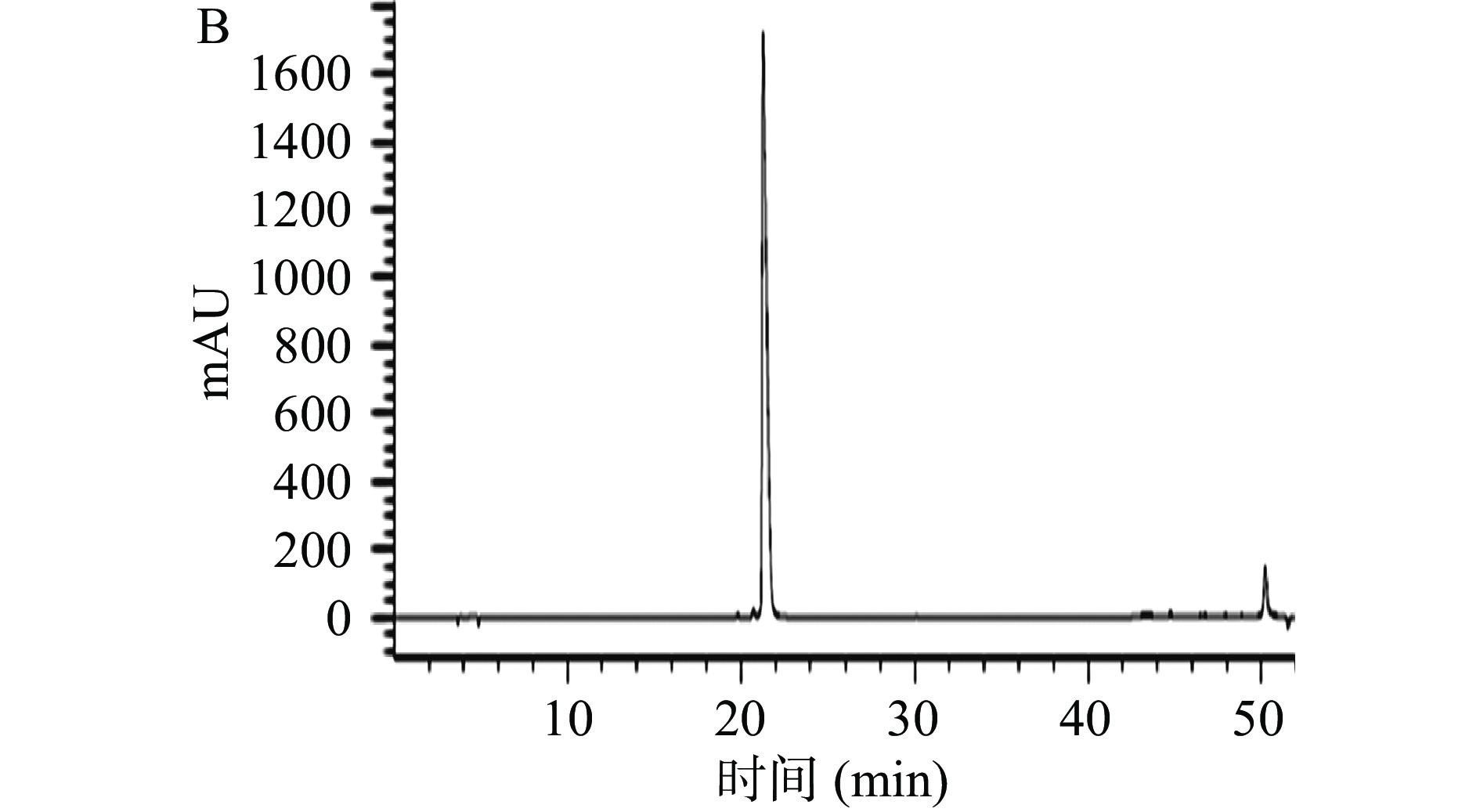
使用HPLC对1.2.1分离得到样品B进行分析测定,以初步判断样品B是否为鞣花酸,如图2所示,鞣花酸标准品色谱图与鞣花酸样品色谱峰重叠良好,经计算,鞣花酸样品纯度为92%。
2.1.2 鞣花酸样品的定性分析
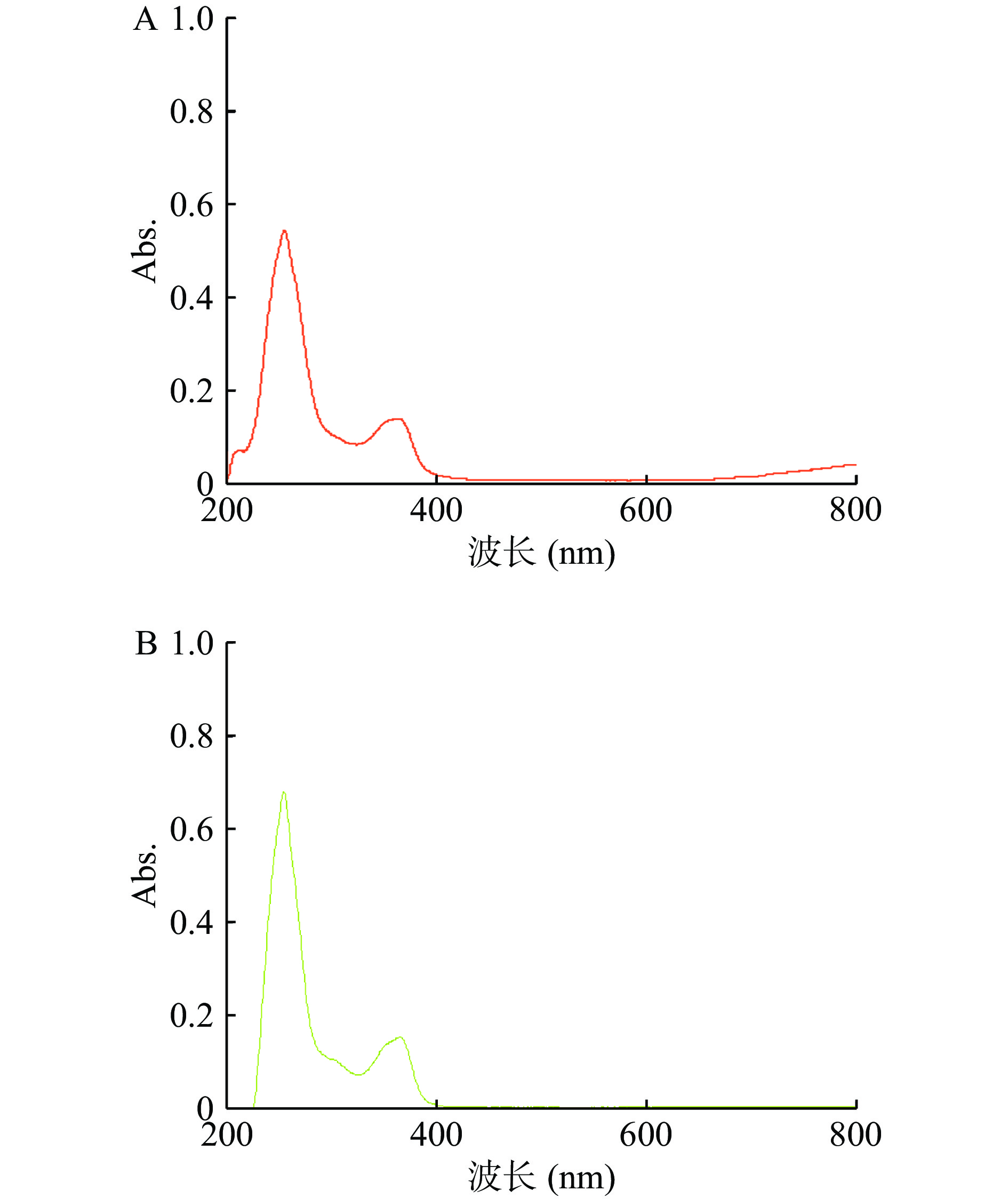
综合使用红外光谱法(IR)、紫外光谱法(UV)、质谱法(MS)、核磁共振波谱储存)对样品B进行定性分析,图3是鞣花酸标准品和样品B的紫外光谱图,两者均在254 nm波长处有最大吸收[23]。
鞣花酸标准品和鞣花酸样品的红外光谱图见图4,鞣花酸标准品的主要吸收峰是:3559、1700、1199、1112、1454、1509、1581、1616、1700 cm−1,样品B的主要吸收峰是:3559、1698、1185、1112、1448、1511、1583、1619、1698 cm−1。其中,3559 cm−1处是O-H伸缩振动峰,1699 cm−1附近的吸收峰是为C=O的伸缩振动引起的,1454~1616 cm−1是苯环上的C=C伸缩振动峰,1112~1199 cm−1是内酯和醚的特征峰,样品各个波数与鞣花酸标准品基本一致[24-25]。
图5分别为样品B与标准品的质谱图,通过与鞣花酸标准品的分子离子峰对比,判定m/z 301.00为鞣花酸的[M-H]−准分子离子峰,这与鞣花酸的分子量一致[26-27],其他碎片峰也基本一致。
使用NMR进一步确定样品B的结构,如图6,样品的H和C原子的化学位移如下:
1H NMR(600 MHz,DMSO)δ7.46(s,2H,H-3,H-3')。13C NMR (151 MHz,DMSO) δ112.81(C-1,C-1'),108.05(C-2,C-2'),110.68(C-3,C-3'),148.60(C-4,C-4'),140.14(C-5,C-5'),136.85(C-6,C-6'),159.62(C-7,C-7')与鞣花酸的结构式(图7)吻合且与文献报道的一致[28]。
2.2 刺梨鞣花酸提取工艺优化
2.2.1 刺梨鞣花酸提取的单因素实验
2.2.1.1 提取温度对刺梨鞣花酸得率的影响
由图8可知,温度对鞣花酸得率的影响较小,但是随着提取温度的增加,鞣花酸得率呈先增加后减小的趋势,当温度达到120 ℃时,得率达到最大值,之后鞣花酸得率反而下降,这是因为温度升高鞣花酸被氧化,稳定性降低而析出[29],因此温度升高鞣花酸得率增加,但是温度过高又会破坏鞣花酸的结构[30],导致鞣花酸得率降低。
2.2.1.2 提取时间对刺梨鞣花酸得率的影响
由图9可知,随着提取时间的增加,鞣花酸得率呈先增加后减小的趋势,当提取时间达到8 h时,得率达到最大值,之后鞣花酸得率呈下降状态,时长过短会导致鞣花酸与提取溶液接触不完全,溶解不充分,因此得率随着提取时间延长提高,但时间过长也会导致鞣花酸结构发生改变[31],或是增加其他杂质的溶出,促使得率下降[32-33]。
2.2.1.3 液料比对刺梨鞣花酸得率的影响
由图10可知,随着提取溶液的增加,鞣花酸得率增加,这是由于随着溶剂体积增大,鞣花酸与溶剂接触更充分,当液料比达到7:1 mL/g时,得率达到最大值,之后鞣花酸的得率呈下降趋势,因为鞣花酸与溶剂之间的扩散达到平衡,导致得率下降 [34-35],当液料比达到15:1 mL/g,继续增大溶剂的量,鞣花酸的得率又呈增加的趋势,这可能是单宁酸氧化分解所致,考虑到溶剂消耗和提取效果,并结合前期预实验结果,选取液料比7.5:1 mL/g进行后续研究。
2.2.1.4 硫酸浓度对刺梨鞣花酸得率的影响
由图11可知,随着硫酸浓度的增加,鞣花酸得率呈逐渐增加趋势,这是因为溶液中单宁酸随酸浓度增加,水解更完全[17],但考虑到酸浓度过高存在废液回收困难,成品颜色偏黑等问题[36],本实验采取5%的硫酸浓度为最佳浓度,来研究其他因素对于刺梨中鞣花酸得率的影响。
2.2.2 刺梨鞣花酸提取工艺的响应面优化
根据Box-Behnken中心组合试验设计原理,选取提取温度(A)、提取时间(B)、液料比(C)这3个因素,对刺梨中鞣花酸的提取工艺进行3因素及3个水平的响应面优化试验,所得结果如表2所示。
表 2 刺梨鞣花酸的提取工艺响应面优化试验结果Table 2. Experimental results of response surface method optimization for extraction ellagic acid from Rosa roxburghii Tratt实验号 A提取温度(℃) B提取时间(h) C液料比(mL/g) 得率(%) 1 130 10 7.5 26.3 2 120 8 7.5 39.3 3 120 8 7.5 37.5 4 120 8 7.5 39.4 5 110 8 5.0 32.0 6 120 6 5.0 33.8 7 110 8 10.0 22.9 8 120 10 10.0 28.1 9 120 8 7.5 33.2 10 120 10 5.0 29.5 11 120 8 7.5 34.4 12 120 6 10.0 18.5 13 130 6 7.5 26.9 14 110 10 7.5 34.7 15 130 8 10.0 29.3 16 110 6 7.5 24.1 17 130 8 5.0 26.5 2.2.3 响应面试验结果分析
对表2数据进行回归拟合分析,将提取温度(A)、提取时间(B)、液料比(C)作为自变量,将鞣花酸得率(Y)为因变量,得回归方程:
Y=36.76−0.5875A+1.91B−2.88C−2.80AB+2.98AC+3.48BC−4.28A2−4.48B2−4.80C2
回归模型的R2=0.9033,说明因变量与自变量间回归效果显著,可以对实验进行分析预测。
由表3可知,模型P<0.01,达极显著水平,可以表明实验模型拟合性良好,数据可靠。失拟项P值=0.5179>0.05,表明影响不显著,说明试验真实可靠,可用于刺梨鞣花酸提取的预测。液料比(C)、提取温度二次项(A2)、提取时间二次项(B2)、液料比二次项(C2)、提取时间与液料比交互项(BC)对响应值影响显著。在研究范围内,各因素对响应值显著性水平的排序为:C>B>A。
表 3 刺梨鞣花酸得率回归模型的方差分析Table 3. Analysis of variance for regression model of yield of ellagic acid方差来源 离差平方和 自由度 均方 F值 P值 显著性 模型项 502.42 9 55.82 7.27 0.008 显著 A 2.76 1 2.76 0.36 0.5677 B 29.26 1 29.26 3.81 0.0919 C 66.13 1 66.13 8.61 0.0219 AB 31.36 1 31.36 4.08 0.0831 AC 35.4 1 35.4 4.61 0.0689 BC 48.3 1 48.3 6.29 0.0405 A² 77.13 1 77.13 10.04 0.0157 B² 84.51 1 84.51 11.00 0.0128 C² 97.21 1 97.21 12.65 0.0093 残差 53.77 7 7.68 失拟项 21.56 3 7.19 0.8925 0.5179 不显著 误差 32.21 4 8.05 误差和 556.19 16 2.2.4 各因素交互作用的响应曲面分析
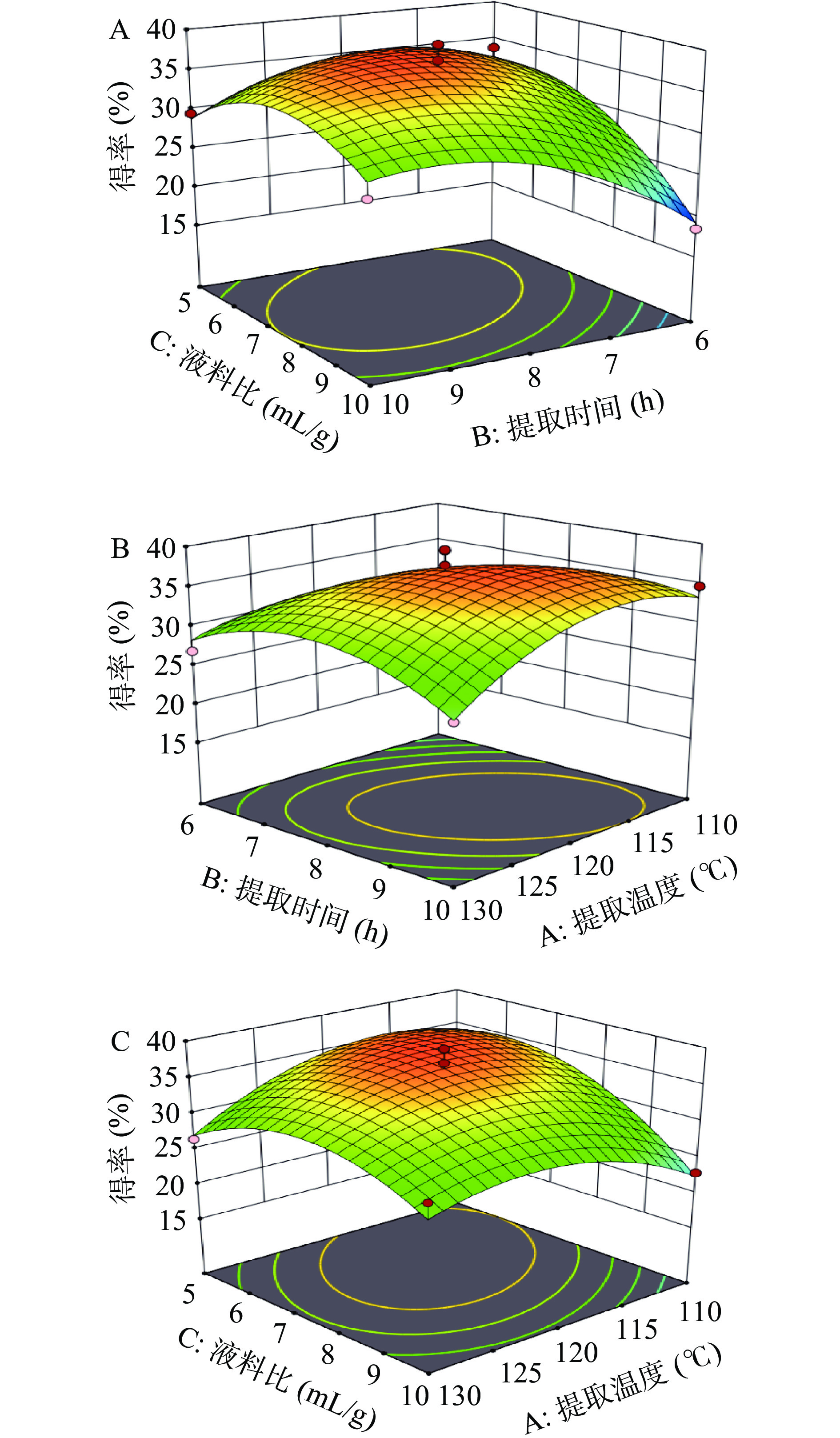
利用Design-Expert 8.0.6软件拟合出相应的曲面图和等高线,依据鞣花酸提取率的回归模型做出响应面图,可以直观地反映各因素之间的交互作用对鞣花酸得率的影响,并确定最佳提取工艺条件,各因素交互作用的响应面图如图12所示。
从图12A可以看出,三维图坡面陡峭,这说明液料比和提取时间的交互作用对刺梨中鞣花酸得率的影响显著,而液料比的坡面较提取时间的陡峭,说明液料比对得率的影响更大,当B=8 h,C=7.5 mL/g时,鞣花酸的得率达到极大值,但随着液料比和提取时间继续增大,液料比和提取时间对得率的影响逐渐减小,得率也逐渐降低。
从图12B可以看出,三维图坡面较为平缓,说明提取温度和提取时间对刺梨中鞣花酸得率的影响较为接近,而提取时间的坡面较提取温度的陡峭,说明提取时间对得率的影响更大,当A=120 ℃,B=8 h时,鞣花酸的得率达到极大值,随着提取时间和提取温度的增加或减少,得率也逐渐降低。
从图12C可以看出,三维图坡面较抖,说明提取温度和液料比的交互作用显著,刺梨鞣花酸得率受到二者共同影响,而液料比的坡面较提取温度的陡峭,说明液料比对得率有显著影响,当A=120 ℃,C=7.5 mL/g时,鞣花酸的得率取得极大值,随着提取温度和液料比的增加或减少,得率逐渐降低。
2.2.5 最优提取条件的确定及验证试验
利用Design-Expert 8.0.6软件对试验结果所得回归方程最优预测值求解,得到提取刺梨鞣花酸的最佳条件为:提取温度127.181 ℃,提取时间9.801 h,液料比7.986:1 mL/g,预测鞣花酸得率为30.694%。考虑到操作实际,将提取温度修正为127 ℃,而液料比定为8:1 mL/g,提取时间9.8 h,其他条件不变。3次平行验证试验表明,在最佳提取工艺条件下刺梨鞣花酸的平均得率为30.2%±2.3%,与预测值差异不显著(P>0.05),与回归模型所得理论值相符,证实了回归模型的可靠性。
3. 结论
为了获得纯度较高的鞣花酸产品并确证方法的可行性,本实验首先使用先提取后水解和重结晶纯化的方法,从刺梨中提取得到纯度为92%的鞣花酸单品,并利用紫外光谱法、红外光谱法、质谱法、核磁共振波谱法对提取得到的鞣花酸进行结构鉴定,确认了用此方法提取得到的物质是鞣花酸。
为了提高鞣花酸的得率,选取直接酸水解法并通过单因素实验设计,探究酸浓度、提取时间、提取温度、液料比四个影响因素对鞣花酸得率的影响,然后通过二次回归设计得到鞣花酸得率与提取温度、提取时间、液料比关系的回归模型,通过Design-Expert 12得到模型的响应面及等高线图,得到鞣花酸的最佳提取工艺为:提取温度127 ℃,提取时间9.8 h,液料比8:1 mL/g,并通过试验验证了最优工艺参数的准确性,在此条件下,鞣花酸的平均得率为30.2%±2.3%,为刺梨鞣花酸资源的后续研究提供了参考。
-
表 1 刺梨鞣花酸提取工艺响应面优化试验的因素及水平
Table 1 Factors and levels of response surface method optimization experiment for extraction process of ellagic acid from Rosa roxburghii tratt
水平 因素 A提取温度(℃) B提取时间(h) C液料比(mL/g) −1 110 6 5:1 0 120 8 7.5:1 1 130 10 10:1 表 2 刺梨鞣花酸的提取工艺响应面优化试验结果
Table 2 Experimental results of response surface method optimization for extraction ellagic acid from Rosa roxburghii Tratt
实验号 A提取温度(℃) B提取时间(h) C液料比(mL/g) 得率(%) 1 130 10 7.5 26.3 2 120 8 7.5 39.3 3 120 8 7.5 37.5 4 120 8 7.5 39.4 5 110 8 5.0 32.0 6 120 6 5.0 33.8 7 110 8 10.0 22.9 8 120 10 10.0 28.1 9 120 8 7.5 33.2 10 120 10 5.0 29.5 11 120 8 7.5 34.4 12 120 6 10.0 18.5 13 130 6 7.5 26.9 14 110 10 7.5 34.7 15 130 8 10.0 29.3 16 110 6 7.5 24.1 17 130 8 5.0 26.5 表 3 刺梨鞣花酸得率回归模型的方差分析
Table 3 Analysis of variance for regression model of yield of ellagic acid
方差来源 离差平方和 自由度 均方 F值 P值 显著性 模型项 502.42 9 55.82 7.27 0.008 显著 A 2.76 1 2.76 0.36 0.5677 B 29.26 1 29.26 3.81 0.0919 C 66.13 1 66.13 8.61 0.0219 AB 31.36 1 31.36 4.08 0.0831 AC 35.4 1 35.4 4.61 0.0689 BC 48.3 1 48.3 6.29 0.0405 A² 77.13 1 77.13 10.04 0.0157 B² 84.51 1 84.51 11.00 0.0128 C² 97.21 1 97.21 12.65 0.0093 残差 53.77 7 7.68 失拟项 21.56 3 7.19 0.8925 0.5179 不显著 误差 32.21 4 8.05 误差和 556.19 16 -
[1] 梁茜, 吴琼, 武晶芳, 等. 刺梨根多酚提取工艺考察和含量测定方法建立[J]. 时珍国医国药,2019(2):319−322. [LIANG Q, WU Q, WU J F, et al. Investigation on extraction process and determination of polyphenols in Rosa roxburghii root[J]. Shizhen Traditional Chinese Medicine and Traditional Chinese Medicine,2019(2):319−322. [2] 刘英, 张丽艳, 罗君, 等. 单因素试验结合响应面法优化刺梨维生素C的提取工艺[J]. 辽宁中医杂志,2018,45(6):1236−1239. [LIU Y, ZHANG L X, LUO J, et al. Optimization of extraction technology of vitamin C from Rosa roxburghii Tratt by single factor test combined with response surface method[J]. Liaoning Journal of Traditional Chinese Medicine,2018,45(6):1236−1239. [3] 敖芹, 谷晓平, 于飞, 等. 贵州刺梨气候适宜性研究[J]. 中国农学通报,2013,29(34):177−185. [AO Q, GU X P, YU F, et al. Study on climatic suitability of Rosa roxburghii Tratt in Guizhou[J]. Chinese Agricultural Science Bulletin,2013,29(34):177−185. doi: 10.11924/j.issn.1000-6850.2013-0933 [4] 代甜甜, 杨小生. 刺梨化学成分及药理活性研究进展[J]. 贵阳中医学院学报,2015,37(4):93−97. [DAI T T, YANG X S. Research progress on chemical composition and pharmacological activity of prickly pear[J]. Journal of Guiyang College of Traditional Chinese Medicine,2015,37(4):93−97. doi: 10.3969/j.issn.1002-1108.2015.04.029 [5] LI Q J, NAN Y, QIN J J, et al. Chemical constituents from medical and edible plants of Rosa roxburghii[J]. China Journal of Chinese Materia Medica,2016:451−455.
[6] WANG L T, LV M J, AN J Y, et al. Botanical characteristics, phytochemistry and related biological activities of Rosa roxburghii Tratt fruit, and its potential use in functional foods: A review[J]. Food & Function,2021,12(4):1432−1451.
[7] XU J, VIDYARTHI S K, BAI W, et al. Nutritional constituents, health benefits and processing of Rosa roxburghii: A review[J]. Journal of Functional Foods,2019,9(60):103456.
[8] WILLIAMS D J, EDWARDS D, CHALIHA M, et al. Measuring free ellagic acid: Influence of extraction conditions on recovery by studying solubility and UV-Visible spectra[J]. Chemical Papers,2016,70(8):1078−1086.
[9] 汪淑琴, 金紫嫣, 何明霞, 等. 覆盆子中鞣花酸的提取工艺研究[J]. 中国化工贸易,2020,12(5):71−73. [WANG S J, JIN Z Y, HE M X, et al. Study on extraction process of ellagic acid in raspberry[J]. China Chemical Trade,2020,12(5):71−73. [10] JOSELUIS R, ROSA G, MARTA M, et al. A pharmacological update of ellagic acid[J]. Planta Medica,2018,84(15):1068−1093. doi: 10.1055/a-0633-9492
[11] ZENG F F, GE Z W, JARUKITT L, et al. Antioxidant and tyrosinase inhibitory activity of Rosa roxburghii fruit and identification of main bioactive phytochemicals by UPLC-Triple-TOF/MS[J]. International Journal of Food Science and Technology,2017,52(4):897−905. doi: 10.1111/ijfs.13353
[12] 谭登航, 王鹏娇, 张硕, 等. 刺梨不同药用部位中鞣花酸的含量测定及其醇提物的体外抗氧化活性研究[J]. 中国药房,2019,30(9):1236−1240. [TAN D H, WANG P J, ZHANG S, et al. Study on content determination of ellagic acid in different medicinal parts of Rosa roxburghii and in vitro antioxidant activity of its ethanol extract[J]. China Pharmacy,2019,30(9):1236−1240. [13] 向卓亚, 夏陈, 邓俊琳, 等. 热风干燥法对刺梨果活性成分影响的研究[J]. 中国食物与营养,2021,27(5):9−12. [XIANG Z Y, XIA C, DENG J L, et al. Effect of hot air drying on bioactive substance in Rose roxburghii Tratt[J]. Chinese Food and Nutrition,2021,27(5):9−12. doi: 10.3969/j.issn.1006-9577.2021.05.003 [14] 谢国芳, 徐小燕, 王瑞, 等. 金刺梨果实和叶中酚类、VC含量及其抗氧化能力分析[J]. 植物科学学报,2017,35(1):122−127. [XIE G F, XU X Y, WANG R, et al. Analysis of phenolic VC and antioxidant activity of fruits and leaves of Rosa sterilis D. Shi[J]. Plant Science Journal,2017,35(1):122−127. doi: 10.11913/PSJ.2095-0837.2017.10122 [15] 刘宇文. 鞣花酸的生产制备工艺研究[D]. 北京: 北京化工大学, 2015. LIU Y W. Research on the production and preparation process of ellagic acid[D]. Beijing: Beijing University of Chemical Technology, 2015.
[16] 王妙飞, 程庚金生, 张道英, 等. 水解法制取五倍子鞣花酸的研究[J]. 食品工业科技,2010(2):233−234. [WANG M F, CHENG G J S, ZHANG D Y, et al. Study on the extraction of pentazical acid by hydrolysis method[J]. Science and Technology of Food Industry,2010(2):233−234. [17] 宋汉臣. 石榴中多酚物质的提取研究[D]. 北京: 北京化工大学, 2011. SONG H C. Study on extraction of polyphenol compounds from pomegranate[D]. Beijing: Beijing University of Chemical Technology, 2011.
[18] 王佳鸾, 赵俸艺, 张春红, 等. 鞣花酸提取, 纯化及其生物活性研究进展[J]. 食品工业科技,2022,43(13):9. [WANG J L, ZHAO F Y, ZHANG C H, et al. Research progress of extraction, purification and bioactivity of ellagic acid[J]. Science and Technology of Food Industry,2022,43(13):9. [19] 徐涓, 张弘, 李坤, 等. 液气射流技术改进单宁酸氧化制备高纯度鞣花酸[J]. 精细化工,2021,38(5):994. [XU J, ZHANG H, LI K, et al. Liquid-gas jet technology improves tannic acid oxidation to prepare high-purity ellagic acid[J]. Fine Chemical Industry,2021,38(5):994. doi: 10.13550/j.jxhg.20200785 [20] 徐曼, 汪咏梅, 张亮亮, 等. 一种化香果制备鞣花酸的方法: 中国, 102807570A[P]. 2012. XU M, WANG Y M, ZHANG L L, et al. Method for preparing ellagic acid from fragrant fruit: China, 102807570A[P]. 2012.
[21] 吴兴付. 以石榴皮、石榴叶为原料制备鞣花酸[D]. 北京: 北京化工大学, 2008. WU X F. Ellagic acid production using pomegranate husk and leaves as raw materials[D]. Beijing: Beijing University of Chemical Technology, 2008.
[22] 雷焱. 五倍子单宁为原料制备鞣花酸及鞣花酸的纯化[D]. 北京: 北京化工大学, 2007. LEI Y. Purification of ellagic acid and ellagic acid prepared from pentazitic tannins as raw materials[D]. Beijing: Beijing University of Chemical Technology, 2007.
[23] 苏宏伟, 谷瑶, 马锦林, 等. 香花油茶果壳与果壳芯总多酚和鞣花酸含量测定[J]. 广西林业科学,2021,50(4):453−457. [SU H W, GU Y, MA J L, et al. Study on total polyphenol and ellagic acid in shell and core of Camellia osmantha fruit[J]. Guangxi Forestry Sciences,2021,50(4):453−457. doi: 10.3969/j.issn.1006-1126.2021.04.016 [24] 娄兴维, 罗志军, 胡鹏刚, 等. 四种β-环糊精制备鞣花酸包合物的抗氧化性研究[J]. 中国酿造,2020,39(4):114−120. [LOU X W, LUO Z J, HU P G, et al. Antioxidant property of ellagic acid inclusion complex prepared by four β-cyclodextrins[J]. China Brewing,2020,39(4):114−120. doi: 10.11882/j.issn.0254-5071.2020.04.023 [25] 马晶, 康美玲, 田忠景, 等. 鞣花酸微球的制备及其对前脂肪细胞生长和成脂分化的影响[J]. 食品科学,2018,39(17):104−108. [MA J, KANG M L, TIAN Z J, et al. Preparation of ellagic acid microspheres and their effects on preadipocyte growth and adipogenic differentiation[J]. Food Science,2018,39(17):104−108. doi: 10.7506/spkx1002-6630-201817017 [26] YASIR M, SULTANA B, NIGAM P S, et al. Antioxidant and genoprotective activity of selected cucurbitaceae seed extracts and LC-ESIMS/MS identification of phenolic components[J]. Food Chemistry, 2016, 199(MAY 15): 307-313.
[27] 陈金玉, 曾健, 李春美. 龙眼核多酚提取工艺的正交试验优化及其分离纯化与结构表征[J]. 食品科学,2015,36(16):31−37. [CHEN J Y, ZENG J, LI C M. Separation and purification of phenols from Longan (Dimocarpus longan Lour.) seeds and their structural analysis[J]. Food Science,2015,36(16):31−37. doi: 10.7506/spkx1002-6630-201516006 [28] 王佳, 许娇娇, 乔卫, 等. 蓝桉果实一口钟化学成分研究[J]. 中草药,2016,47(24):4336−4339. [WANG J, XU J J, QIAO W, et al. Chemical constituents from fruits of Eucalyptus globulus[J]. Chinese and Herbal Medicine,2016,47(24):4336−4339. doi: 10.7501/j.issn.0253-2670.2016.24.007 [29] 马丽丽, 常利军, 张万存, 等. 响应面法优化石榴皮中鞣花酸的半仿生提取工艺[J]. 中国食品工业,2011(6):82−84. [MA L L, CHANG L J, ZHANG W C, et al. Semi-bionic extraction process of ellagic acid in pomegranate skin optimized by response surface method[J]. China Food Industry,2011(6):82−84. doi: 10.3969/j.issn.1006-6195.2011.06.050 [30] 吴士龙, 李敏, 李小玢, 等. 响应曲面法优化树莓叶中鞣花酸的提取工艺[J]. 中国新药杂志,2014,23(6):692−697. [WU S L, LI M, LI X F, et al. Optimization of extraction param eters of ellagic acid from raspberry leaves using response surface methodology[J]. China Journal of New Drugs,2014,23(6):692−697. [31] 王佳宁, 马永强, 王鑫, 等. 蓝靛果鞣花酸超声波辅助提取工艺的研究[J]. 农产品加工:下,2017(10):38−42. [WANG J N, MA Y Q, WANG X, et al. Study on ultrasonic-assisted extraction of ellagic acid from Lonicera edulis[J]. Agricultural Products Processing: Part II,2017(10):38−42. [32] 刘丽娜. 响应面法优化红树莓籽中鞣花酸的提取工艺[J]. 北方园艺,2020(2):107−112. [LIU L N. Optimization of extraction process of ellagic acid from red raspberry seeds by response surface methodology[J]. Northern Horticulture,2020(2):107−112. [33] 魏征, 赵雅娇, 黄羽, 等. 超声波辅助提取圆叶葡萄鞣花酸和总酚工艺优化[J]. 食品科学,2015(12):37−43. [WEI Z, ZHAO Y J, HUANG Y, et al. Optimization of ultrasound-assisted extraction of ellagic acid and total phenols from Muscadine (Vitis rotundifolia) by response surface methodology[J]. Food Science,2015(12):37−43. [34] 邹庭, 刘建富, 张志健. 魔芋飞粉生物碱提取技术研究[J]. 中国食品添加剂,2018(5):134−140. [ZOU T, LIU J F, ZHANG Z J. Extraction technology of alkaloid of konjac powder by-product[J]. China Food Additives,2018(5):134−140. doi: 10.3969/j.issn.1006-2513.2018.05.014 [35] XIA G, CHEN Y, LIANG U, et al. Optimization of extraction technology of ellagic acid from pomegranate peels with orthogonal experiment[J]. Agricultural Science and Technology (English version),2012,13(11):2404−2408.
[36] 吴嘉琳. 石榴皮多酚的分离纯化及生物活性的研究[D]. 济南: 齐鲁工业大学, 2013. WU J L. Study on isolation, purification and biological activity of polyphenols from pomegranate peel[D]. Jinan: Qilu University of Technology, 2013.
-
期刊类型引用(4)
1. 梁瑞强,刘彤彤,罗娇依,曹进,孙姗姗. UPLC-MS法测定肉制品中虾过敏原含量的不确定度评定. 生物加工过程. 2024(01): 89-98 .  百度学术
百度学术
2. 宁亚维,周泓鑫,杨正,马俊美,刘茁,张岩,李强. UPLC-MS/MS法检测3种食品中松仁过敏原. 食品科学. 2024(01): 247-253 .  百度学术
百度学术
3. 陈梦琪,彭淼曦,刘婧文,黄成栋,吴祖庆,凌莉,袁慕云,陈文锐,胡松青. 靶向蛋白质组学技术在食品安全检测的应用. 食品科学. 2024(23): 23297-23310 .  百度学术
百度学术
4. 黄浩伦,徐道坤,孙小杰,胡文彦,刘真,王玉梅,孙嘉笛,孙秀兰. 超高效液相色谱-串联质谱法检测婴幼儿低致敏配方乳粉中过敏原蛋白. 现代食品. 2023(09): 130-136+140 .  百度学术
百度学术
其他类型引用(0)






 下载:
下载:










 下载:
下载:
