Growth Characteristics of Bacillus velezensis Antagonistic to Botrytis Cinerea and Its Effects on Related Defense Enzyme Activities
-
摘要: 为了明确贝莱斯芽孢杆菌TP-1对葡萄灰霉病的抗病机制,通过抗生素标记法筛选抗性标记菌株,成功获得能抗300 μg/mL利福平的标记菌株TP-1R,研究了标记菌株的抗性遗传稳定性及其对葡萄灰霉病的拮抗作用,并分析其在葡萄中的定殖情况以及对葡萄果实内防御酶活性的影响。结果表明,标记菌株在经15次传代培养后,仍能在含利福平的培养基中稳定生长,且标记菌株对灰霉病的拮抗作用与原始菌株无明显差异。检测到标记菌株在葡萄上的定殖量于贮藏(20 ℃)第15 d达到峰值,为4.32×106 CFU/g,在贮藏第30 d菌株定殖数量仍可达到3.11×106 CFU/g,菌株TP-1能在葡萄上稳定定殖;接种菌株TP-1发酵液能有效抑制灰霉病的发生,降低葡萄采后腐烂率。在贮藏期间,葡萄防御酶PAL、PPO、APX活性均呈先上升后下降的趋势,拮抗菌TP-1处理组的3种酶活性显著高于CK(P<0.05),在第15 d时,拮抗菌处理组PAL、PPO、APX活性是CK的1.23、1.19、2.01倍。菌株TP-1在葡萄上的定殖可诱导葡萄PAL、PPO、APX活性的提高,在一定程度上增强了葡萄对灰霉病的抗性。本研究为揭示贝莱斯芽孢杆菌TP-1的生防机理及应用提供了科学依据。Abstract: To clarify the mechanism of resistance of Bacillus velezensis TP-1 to gray mold, a marker strain TP-1R was screened for resistance to 300 μg/mL of rifampicin by an antibiotic marker method in this study. The genetic stability of the resistance of the marker strains and their antagonism to gray mold of grapes were studied, and their colonization in grapes and their effect on the activity of defence enzymes in the grapes were analysed. The results showed that the labeled strain could still grow stably in the medium containing rifampicin after 15 times of subculture, and the antagonistic effect of the labeled strain against gray mold was not significantly different from that of the original strain. The colonization amount of the labeled strain reached the peak of 4.32×106 CFU/g on the 15th day of storage (20 ℃), and was still 3.11×106 CFU/g on the 30th day of storage, indicating that strain TP-1 could be stably colonized on grapes. Inoculation of strain TP-1 fermentation broth could effectively inhibit the occurrence of gray mold and resultantly reduced the decay rate of grapes. During storage, the activity of grape defence enzymes PAL, PPO and APX increased first and then decreased, and the activity of the three enzymes in the group treated with the antagonistic bacterium TP-1 was significantly higher than CK (P<0.05). At the 15th day, the activities of PAL, PPO and APX in the antagonistic bacterium treatment were 1.23, 1.19 and 2.01 times higher than CK. The colonization of strain TP-1 on grape could enhance activities of a set of defense-related enzymes, including PAL, PPO and APX, and enhance the resistance of grape to gray mold to a certain extent. This study provided a scientific basis for revealing the mechanism involved in the biocontrol effectiveness of Bacillus velezensis TP-1.
-
Keywords:
- Bacillus velezensis /
- colonization /
- enzymatic activity /
- gray mold /
- antibiotic marker
-
葡萄(Vitis vinifera L.)是葡萄科葡萄属木质藤本植物,在全世界范围内分布广泛,其味道鲜美,营养价值较高。葡萄含水量较高,采后生理代谢旺盛,在运输和贮藏过程中极易遭受病菌的侵染而引起果实腐烂变质[1]。由灰葡萄孢(Botrytis cinerea)引起的葡萄灰霉病(Gray mold)是危害葡萄果实的主要病害之一,严重影响葡萄的品质,造成了巨大的经济损失[2]。在采后葡萄灰霉病的防治中,通常采用的是SO2、硫化物、吡咯类等化学药剂,但是长期使用化学药剂存在很多弊端,如药剂残留对人体以及环境的危害、大量使用化学药剂也增加了病原菌的耐药性,导致防病效果明显下降[3-5]。近年来,随着食品安全问题的日益突出,绿色、安全、高效的生物防治逐渐成为当今果蔬防腐保鲜的新方向[6-7]。
生防微生物在宿主体内的增殖效率是决定生防效果的关键因素,是生防菌筛选与评价的重要指标[8]。与病原菌竞争营养物质以及生存空间是生防菌防病机制之一,Bacon等[9]对玉米内生枯草芽孢杆菌(Bacillus subtilis)研究发现,其与玉米病原菌串珠镰孢菌(Fusarium moniliforme)有相同的生态位点,枯草芽孢杆菌能快速地在玉米体内定殖,占据病原菌的生长位点,降低玉米的发病率。生防菌的次生代谢拮抗物质是其发挥防病作用的重要机制,高振峰等[10]研究发现贝莱斯芽孢杆菌ZSY-1产生的脂肽类物质在浓度为200~400 μg/mL能有效降低番茄采后早疫病的发生、延缓果实软化。此外,防御酶活性的提高是衡量植物体防御反应的重要指标,也是生防的主要作用机理,有大量研究表明生防菌能够诱导植物体内相关防御酶活性变化,以此来提高植物的抗病能力[11-13]。陈刘军等[14]研究证实蜡质芽孢杆菌(Bacillus cereus)AR156处理水稻后,诱导植株内抗病基因上调表达,增加水稻防御酶活性,从而抑制水稻纹枯病的发生。
有研究表明许多微生物具有防治灰霉病的作用,如枯草芽孢杆菌、多粘类芽孢杆菌(Paenibacillus polymyxa)、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、酵母菌(Saccharomyces)、荧光假单胞菌(Pseudomonas fluorescens)等[2,15-17]。贝莱斯芽孢杆菌(Bacillus velezensis)是芽孢杆菌属的一个新种,最早于1999年被Ruiz等[18]分离得到,最初认为贝莱斯芽孢杆菌是枯草芽孢杆菌的一个亚种。随着测序技术的进步,Dunlap等[19]通过比较基因组学的方法对贝莱斯芽孢杆菌及其相近种进行了分类,认为甲基营养型芽孢杆菌和解淀粉芽孢杆菌植物亚种是贝莱斯芽孢杆菌的异名。研究表明贝莱斯芽孢杆菌抑菌谱广,具有防治多种植物病害的潜力[20],是一种应用前景广泛的生防资源。张倩等[21]研究发现贝莱斯芽孢杆菌KT可通过分泌抗菌物质以及诱导甜樱桃果实防御酶活性的提高从而抑制甜樱桃软腐病的发生。还有研究发现贝莱斯芽孢杆菌SB023发酵液可显著抑制杧果炭疽病病原菌的生长,具有良好的生防效果[22]。然而目前关于贝莱斯芽孢杆菌防治葡萄灰霉病的研究鲜有报道,因此,研究贝莱斯芽孢杆菌在葡萄中的定殖能力以及生防机制,对该菌株的进一步开发利用具有重要意义。
本文以前期筛选的贝莱斯芽孢杆菌TP-1为研究对象,采用抗生素标记法筛选出具有抗利福平标记的抗性菌株,研究其在葡萄中的定殖能力、对葡萄果实腐烂率的影响以及对葡萄中苯丙氨酸解氨酶(PAL)、过氧化物酶(PPO)、抗坏血酸过氧化物酶(APX)等抗病相关酶活性的影响,初步探讨贝莱斯芽孢杆菌诱导葡萄对灰霉病产生抗性的机理,为葡萄灰霉病的防治提供一定的理论参考。
1. 材料与方法
1.1 材料与仪器
“玫瑰香”葡萄 购自乌鲁木齐市沙依巴克区北园春水果市场,选取果实饱满、无损伤、大小相似、成熟度基本一致的葡萄,立即运回实验室。贝莱斯芽孢杆菌TP-1 采集新疆五家渠市葡萄园根际土壤,通过稀释涂布法分离菌株,以灰葡萄孢PH-23为指示菌,通过平板对峙法筛选得到[23];灰葡萄孢PH-23 由本实验室从葡萄果实病健交界处分离,再回接到葡萄果实上进行验证,得到此菌株;马铃薯葡萄糖琼脂培养基(PDA)、营养琼脂(NA)培养基、营养肉汤(NB)培养基、马铃薯葡萄糖水培养基(PDB) 青岛高科技工业园海博生物技术有限公司;苯丙氨酸解氨酶(PAL)试剂盒、多酚氧化酶(PPO)试剂盒、抗坏血酸过氧化物酶(APX)试剂盒 苏州科铭生物技术有限公司;利福平(Rifampicin) 上海生工生物工程有限公司。
ZWY-2102C型智城恒温培养振荡器 上海智城分析仪器制造有限公司;UVZ2450型紫外分光光度计 日本岛津自动化设备有限公司;GMSX–280型高压蒸汽灭菌锅 北京市永光明医疗仪器厂;CENTRIFUGE型高速冷冻离心机 EPPENDORF;RXZ型智能人工气候箱 宁波江南仪器厂制造;DH–9162型电热恒温培养箱 上海恒一科技有限公司。
1.2 实验方法
1.2.1 贝莱斯芽孢杆菌抗利福平标记
参照罗云艳[24]的方法,采用抗生素标记法筛选贝莱斯芽孢杆菌的抗性标记菌株,配制利福平浓度为10、20、30、50、100、150、200、250、300 μg/mL的NA培养基。将贝莱斯芽孢杆菌TP-1接种于含10 μg/mL利福平的NA平板中,34 ℃下恒温培养24 h,待菌落大小约1 cm时,挑取形态与原始菌株相同的新菌落接种到含有相同浓度抗生素的NA平板上,继代培养24 h后,再接入利福平浓度为20 μg/mL的NA平板上培养,直到筛选出能在300 μg/mL利福平下正常生长且菌落形态与原始菌株相同的标记菌株[25-26]。利用平板对峙法,测定标记菌株的对灰葡萄孢的拮抗作用,以原始菌株为对照,最终获得稳定生长,且对灰葡萄孢的拮抗作用与原始菌株无明显差异的标记菌株。
1.2.2 标记菌株遗传稳定性测定
将获得的标记菌株接种在不添加利福平的NA培养基上,在34 ℃下继代培养15代后接种到利福平浓度为300 μg/mL的NA培养基上,在相同条件下继代培养15代。然后检测标记菌株在添加利福平和不添加利福平的NA培养基中的数量,比较其有无明显差异[27]。
1.2.3 贝莱斯芽孢杆菌生长曲线
根据郗良卿等[28]的方法进行改进,用无菌接种环分别将标记菌株与原始菌株接种于装有100 mL NB培养基的500 mL三角瓶中,在30 ℃、180 r/min条件下振荡培养。以未接菌的NB培养液为空白。0~10 h每1 h取一次样,10 h后每隔2 h取一次样,32 h结束,用紫外分光光度计在600 nm波长下测定OD值,比较标记菌株与原始菌株的生长曲线是否存在差异。
1.2.4 贝莱斯芽孢杆菌在葡萄果实中的定殖能力
标记菌株发酵液:将标记菌株接种至含300 μg/mL利福平的NB培养基中,于30 ℃、180 r/min条件下振荡培养24 h,调节浓度至1.0×107 CFU/mL。
灰葡萄孢孢子悬浮液:将灰葡萄孢接种于PDA上,27 ℃下培养7 d后,用无菌水冲洗,然后用灭过菌的纱布进行过滤得到孢子悬浮液,调节浓度到1×106孢子/mL。
参照罗琳等[29]的葡萄处理方法,选取大小和成熟度相近的葡萄果实,用无菌水将葡萄洗净,再用75%酒精进行表面消毒,然后用无菌水冲洗3次,自然晾干后,用无菌打孔器在葡萄表面赤道部位打取直径2 mm、深2 mm的伤口。吸取10 μL的拮抗菌液和灰葡萄孢孢子悬浮液接种于葡萄果实伤口内,以只接种拮抗菌液的葡萄为对照。于20 ℃、相对湿度为85%条件下贮藏。以接种后1 h测定的细菌数量为起始值,而后于接种第5、10、15、20、25、30 d取样测定。测定方法为取伤口处果肉组织,放于无菌研钵中研磨,用无菌水稀释至适宜浓度,取100 μL稀释液于含300 μg/mL利福平的NA平板上进行稀释涂布,30 ℃下恒温培养计数。每个处理3次重复,每重复10颗葡萄。
1.2.5 贝莱斯芽孢杆菌对葡萄果实腐烂率的影响
选取大小和成熟度相近的葡萄果实,以1.2.4相同方法进行消毒清洗。用无菌打孔器在果实赤道处打取直径2 mm、深2 mm的孔[30]。共分6个处理:接种10 μL无菌水为空白对照(CK);只接种10 μL拮抗菌发酵液(T1);接种5 μL拮抗菌发酵液,1 h后接种5 μL灰葡萄孢孢子悬浮液(T2);接种10 μL灰葡萄孢孢子悬浮液为病原菌对照组(T3);接种5 μL灰葡萄孢孢子悬浮液,1 h后接种5 μL拮抗菌发酵液(T4);拮抗菌发酵液(5 μL)与灰葡萄孢孢子悬浮液(5 μL)同时接种(T5)。接种后果实置于密封的保鲜盒中,在20 ℃、相对湿度为85%条件下贮藏。每个处理3次重复,每重复10颗葡萄。每5 d统计果实腐烂情况,共统计5次,计算腐烂率。将病斑直径大于4 mm记为发病果实,其相较于总果数的比例记为腐烂率。
1.2.6 防御相关酶活性的测定
选取大小和成熟度相同的葡萄,用无菌打孔器在葡萄果实赤道部位打出一个直径、深浅相同的伤口(2 mm)。实验选取1.2.5中CK、T1、T2、T3 4个处理组。常温下贮藏,相对湿度85%。每个处理3次重复。在贮藏第5、10、15、20、25 d取样检测,按照试剂盒步骤测定酶活性。
PAL酶活单位定义:每g组织在每mL反应体系中每min使290 nm下吸光值变化0.05为一个酶活性单位(U/g FW)。PPO酶活单位定义:每min每g组织在每mL反应体系中使525 nm处吸光值变化0.005为一个酶活性单位(U/g FW)。APX酶活单位定义:每g组织每min氧化1 nmol AsA为1个酶活性单位(nmol/min/g FW)。
1.3 数据处理
本研究每处理3个平行,每平行3次重复,数据以平均值±标准差表示,采用Excel 2016和SPSS 20.0软件进行数据分析,应用Duncan新复极差法进行显著性检验(P<0.05)。使用Origin 2020软件绘图。
2. 结果与分析
2.1 标记菌株稳定性实验
2.1.1 抗生素标记菌株的筛选
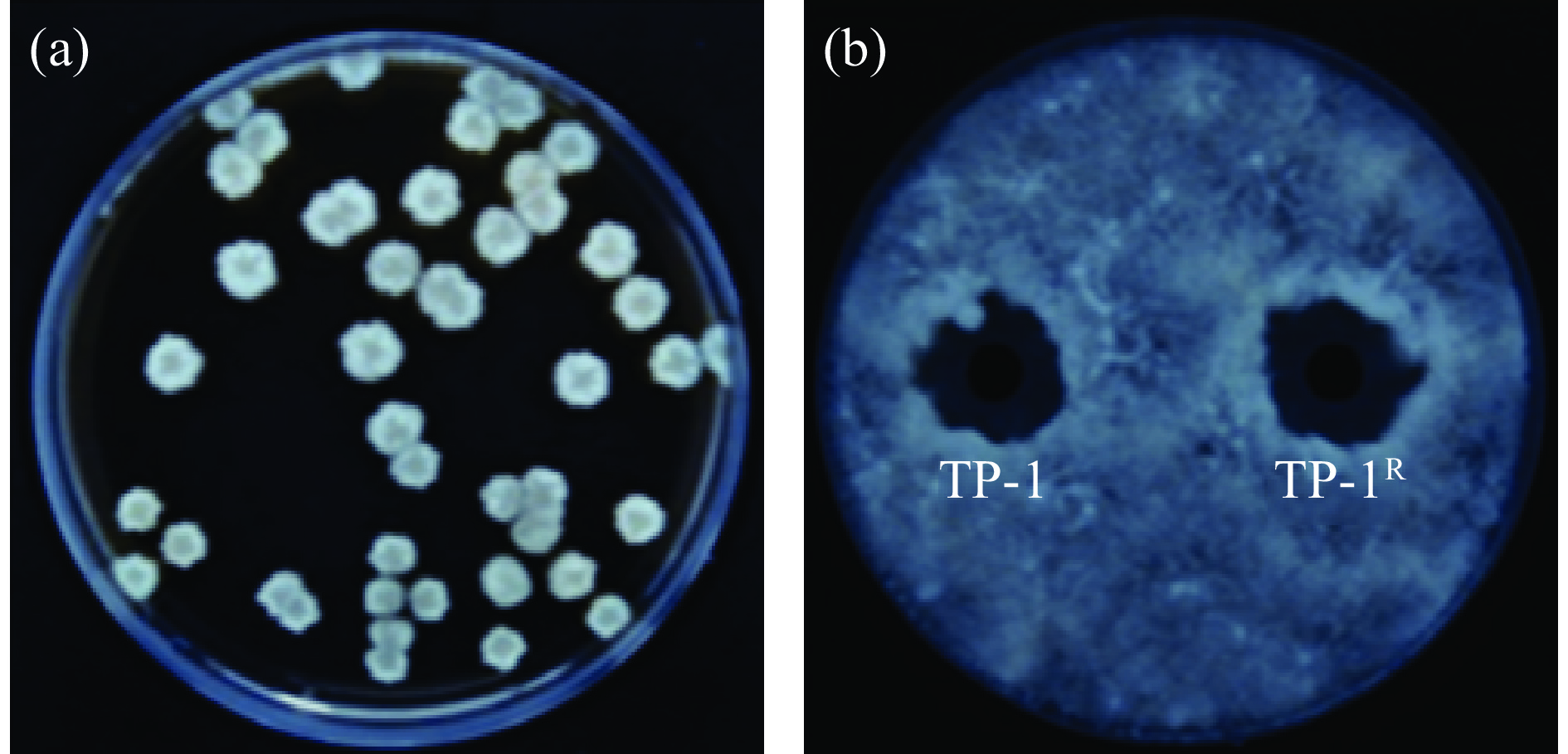
采用抗生素标记法获得可以在利福平浓度为300 μg/mL的平板上正常生长的标记菌株TP-1R,并且其菌落形态没有发生明显改变。图1(a)为标记菌株TP-1R在含利福平浓度为300 μg/mL NA平板的菌落图。图1(b)显示标记菌株抑菌圈直径为22.14±0.24 mm,原始菌株抑菌圈直径为22.48±0.16 mm,两者无明显差异,表明经利福平标记的标记菌株与原始菌株对病原菌的拮抗能力无显著差异(P>0.05)。
2.1.2 标记菌株遗传稳定性分析
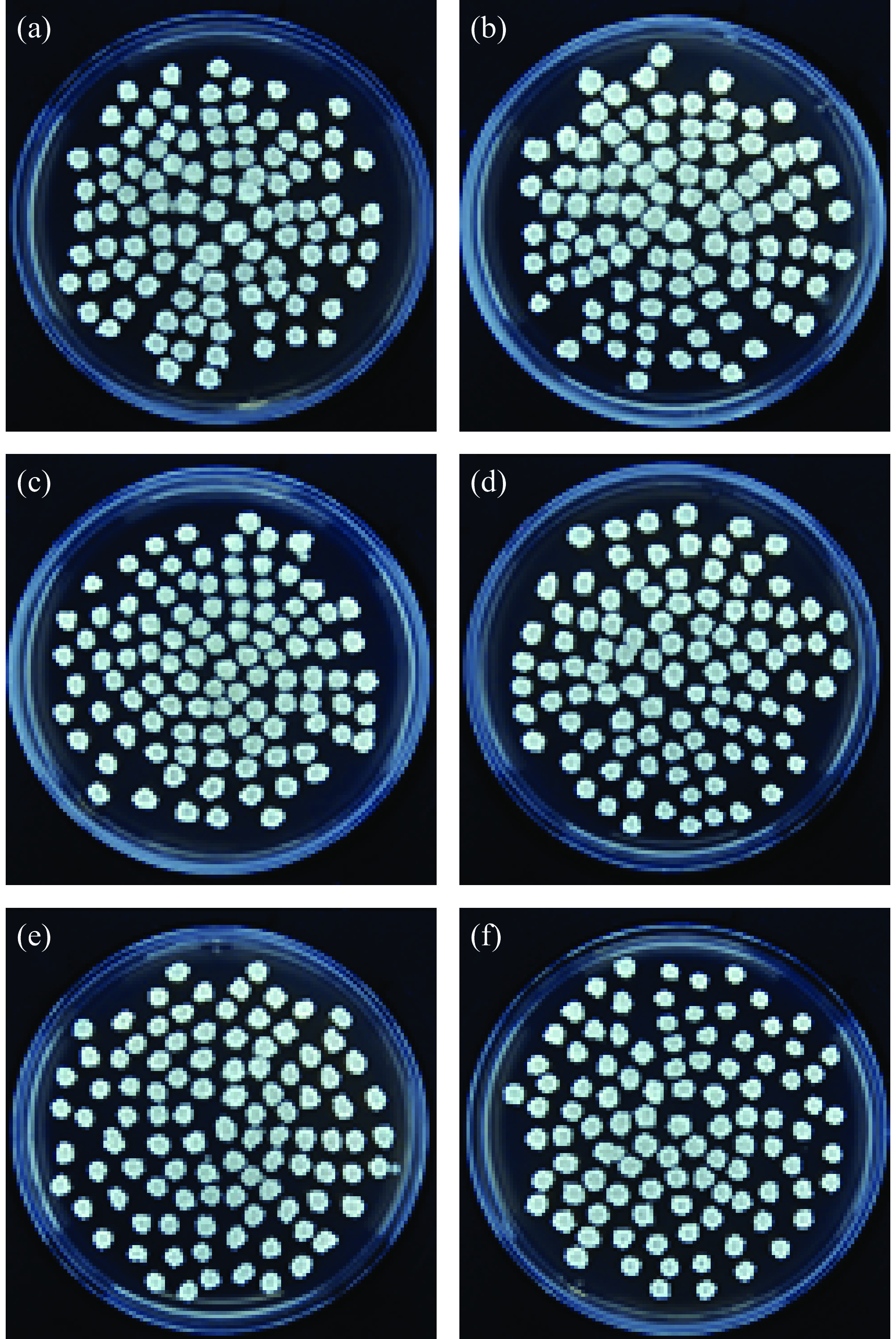
标记菌株在含利福平的NA培养基中传代培养15代,其第5、10、15代菌落数分别为1.0×109、1.01×109、0.97×109 CFU/mL,在不含利福平的NA培养基中第5、10、15代菌落数分别为1.0×109、0.99×109、0.95×109 CFU/mL,两者间无明显差异(P>0.05),均能稳定生长(图2)。
2.1.3 标记菌株与原始菌株生长曲线
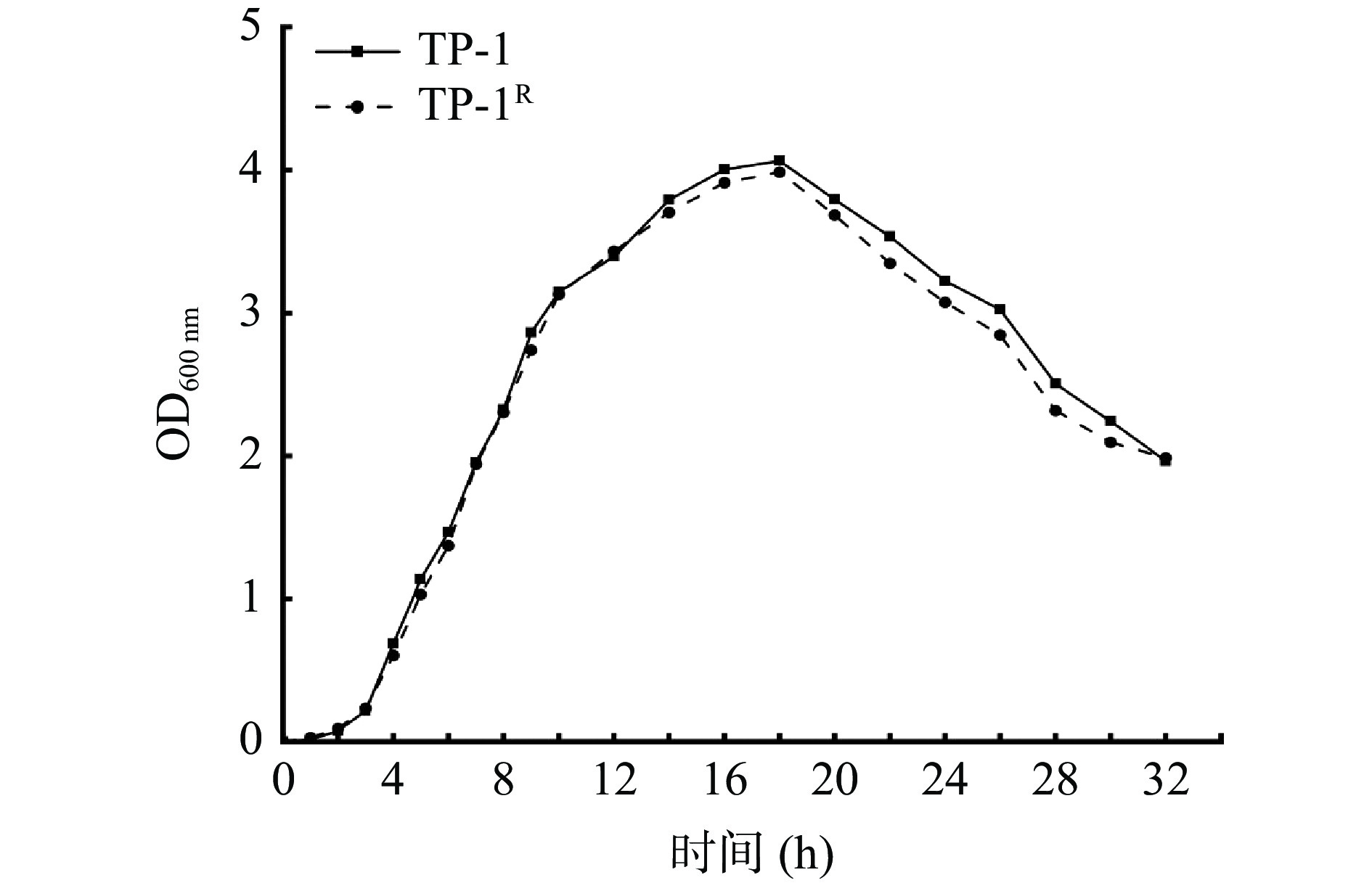
从图3可以看出标记菌株与原始菌株的生长曲线基本一致,3 h后进入对数生长期,在培养18 h时标记菌株OD值达到峰值,为3.986,原始菌株OD值为4.063,差异不显著(P>0.05)。结果表明标记菌株的抗性稳定,能够用于后续实验。
2.2 贝莱斯芽孢杆菌在葡萄果实中的定殖及其防腐效果
2.2.1 贝莱斯芽孢杆菌在萄果实中的定殖
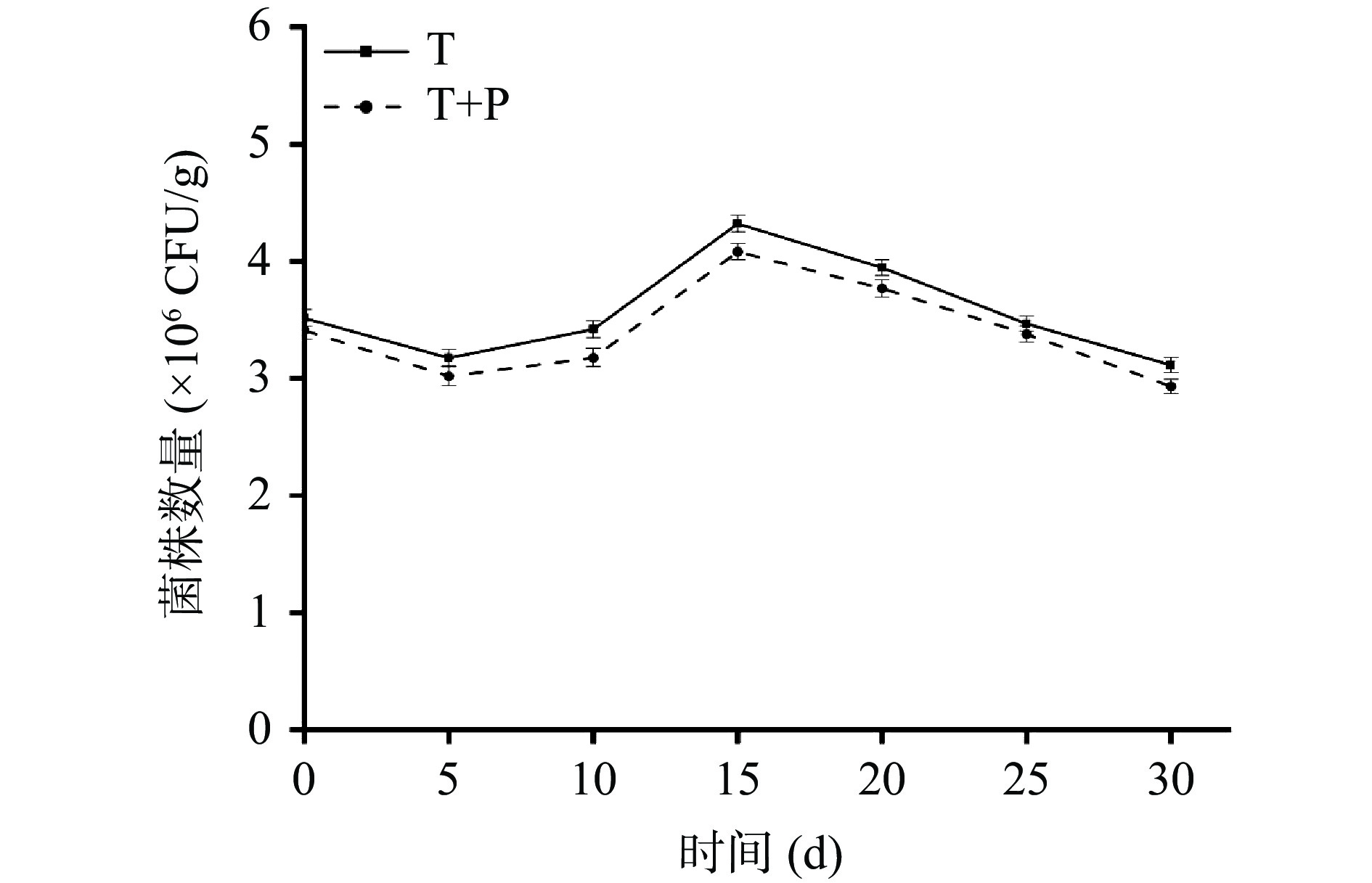
由图4可知,两个处理组在葡萄果实上的数量随着贮藏时间的延长呈现先下降后上升再下降的趋势。可能是由于拮抗菌在接种后需要适应其生态位点并与病原菌进行竞争,定殖数量有所下降,在拮抗菌适应生态位点后,定殖数量开始上升,在宿主营养消耗殆尽,拮抗菌定殖数量开始逐渐下降[31]。不同时期T处理组回收到的标记菌株数量均多于T+P处理组,都在第15 d时定殖数量达到最高值,T处理组为4.32×106 CFU/g,T+P处理组为4.08×106 CFU/g。分别是初始值的1.23倍和1.20倍。随着时间的延长,标记菌株的数量也逐渐下降,其中在第30 d时T处理组和T+P处理组可以回收到的标记菌株数量分别为3.11×106 CFU/g,2.93×106 CFU/g,表明贝莱斯芽孢杆菌TP-1R在葡萄上具有较强的定殖能力。
2.2.2 贝莱斯芽孢杆菌对葡萄果实腐烂率的影响
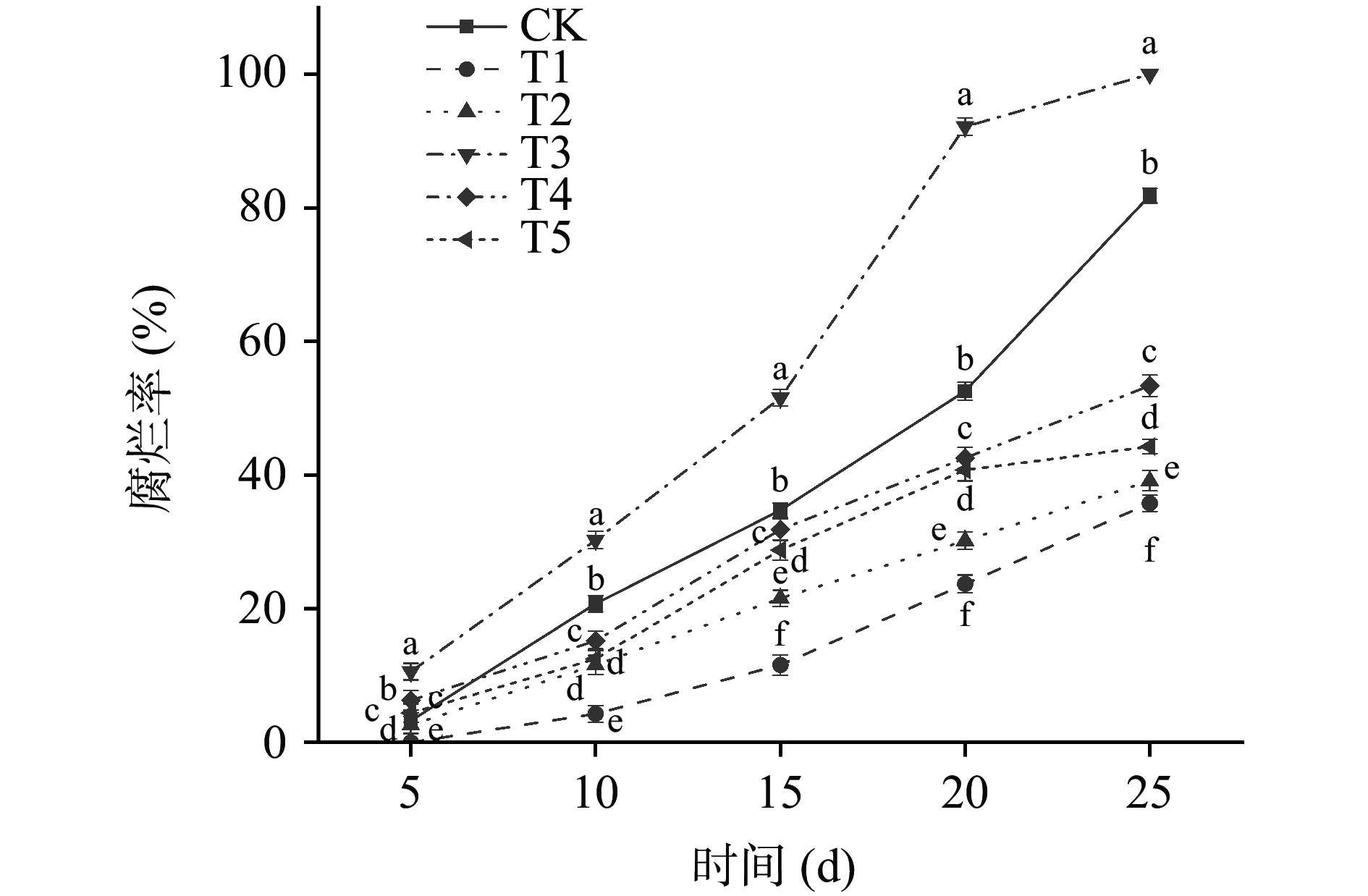
腐烂率能够直接反映果实的感官品质,是影响果实贮藏品质的重要指标。由图5可以看出,在整个贮藏期间玫瑰香葡萄腐烂率呈现逐渐上升的趋势。T1处理组的葡萄腐烂率要显著低于其他处理组(P<0.05),在第5 d时T1处理组无腐烂果实,在贮藏第25 d时T1处理组腐烂率为35.76%,CK、T2、T3、T4、T5处理组腐烂率分别为81.84%、39.14%、100%、53.39%、44.28%。其中T2处理组腐烂率要低于T5处理组,说明提前接种贝莱斯芽孢杆菌可有效抑制病原菌生长,减缓贮藏期间葡萄果实的腐烂。
2.3 防御相关酶活性的变化
2.3.1 苯丙氨酸解氨酶(PAL)活性的变化
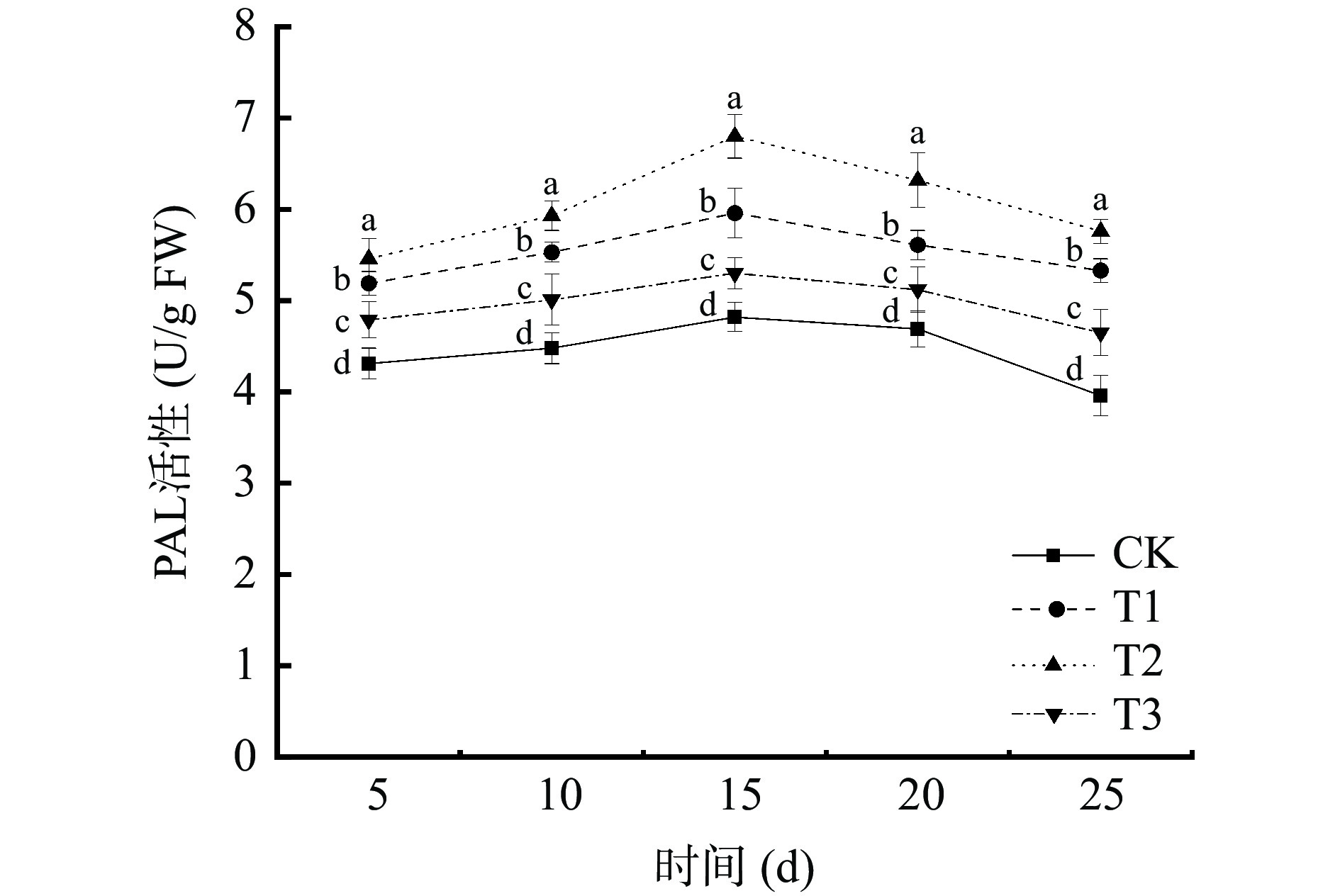
由图6可以看出,4种不同处理下,葡萄中PAL的活性都随时间延长呈现先上升后下降的趋势。初期在受到病原菌侵染,激活宿主防御反应,PAL活性逐渐上升,后期宿主体内代谢减缓,宿主体内酶活也逐渐下降。在贮藏第15 d时,4个处理组葡萄中PAL活性达到最大值,其中,T2处理组的葡萄PAL活性最大,为6.80 U/g FW,是对照组(CK)的1.41倍。T1处理组葡萄PAL活性为5.96 U/g FW,是对照组(CK)的1.23倍。T2处理组PAL活性峰值明显大于T1处理组PAL活性峰值(P<0.05)。表明混合接种对葡萄PAL诱导活性要大于单独接种贝莱斯芽孢杆菌TP-1R对葡萄PAL诱导活性,可能是因为两者在诱导PAL酶活中具有协同作用。拮抗菌TP-1R处理葡萄后能有效减缓PAL活性的降低。
2.3.2 多酚氧化酶(PPO)活性的变化
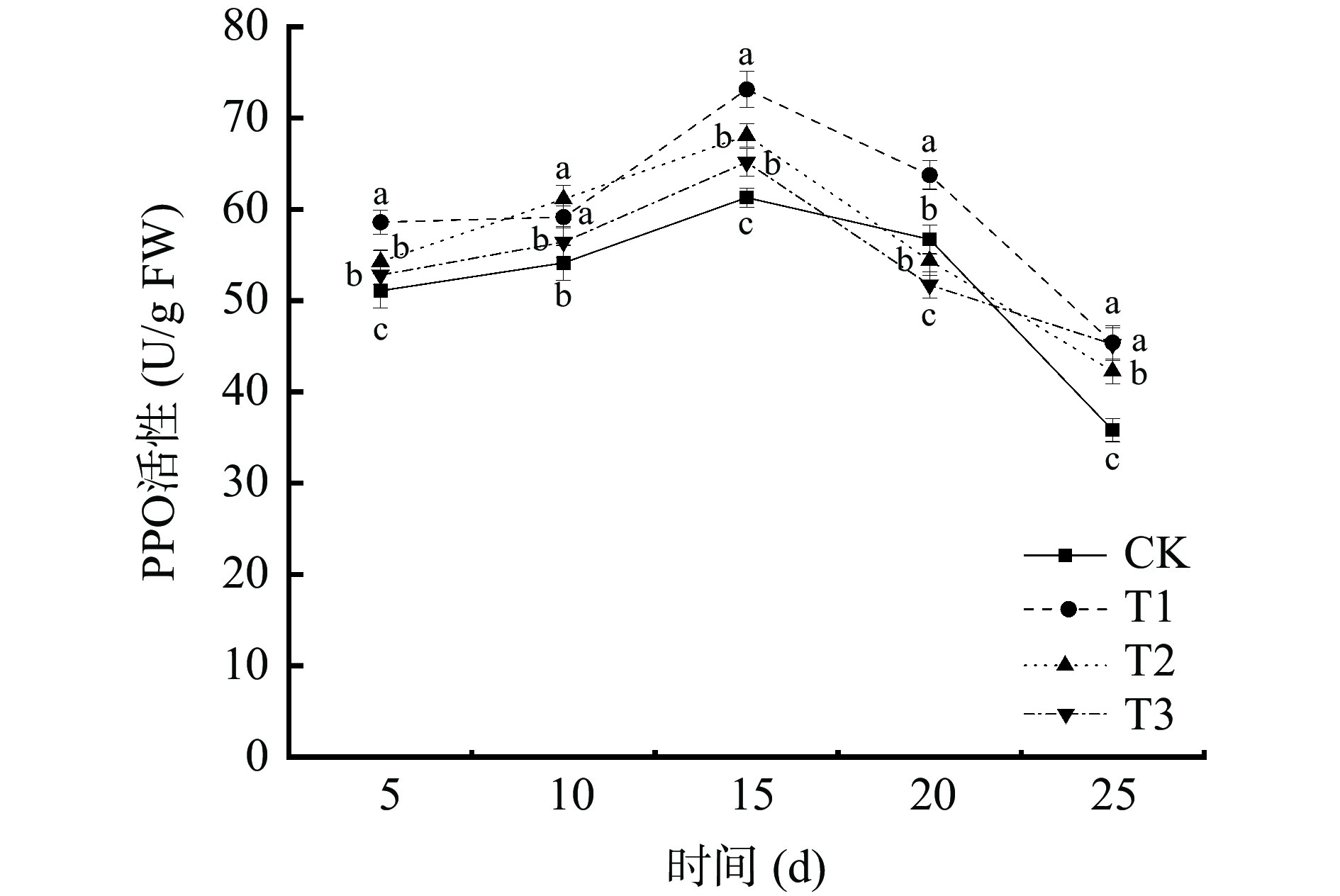
由图7可知,在贮藏期间,不同处理下的葡萄PPO活性呈现先上升后下降的趋势。T1处理与T2处理均能提高葡萄PPO活性,除第10 d二者无显著差异外(P>0.05),T1处理对葡萄PPO的诱导效应均大于T2处理。四个处理的PPO活性均于贮藏第15 d达到峰值,其中T1处理的PPO活性最大,为73.15 U/g FW,是对照组(CK)的1.19倍;T2处理组葡萄PPO活性为68.11 U/g FW,是对照组(CK)的1.11倍。
2.3.3 抗坏血酸过氧化物酶(APX)活性的变化
从图8可以看出,在贮藏期间,不同处理下葡萄APX活性呈先上升后下降的趋势,且T1和T2处理组葡萄APX活性显著高于其他处理组(P<0.05)。各处理组的APX活性均于贮藏第15 d达到峰值,T1处理为816.51 nmol/min/g FW,T2处理为703.58 nmol/min/g FW,分别是对照组(CK)的2.01倍和1.74倍。单独接种贝莱斯芽孢杆菌对葡萄APX诱导效应要显著高于其他处理组(P<0.05)。表明贝莱斯芽孢杆菌处理能有效减缓葡萄APX活性的降低。
3. 讨论
生防菌是否可以在宿主体内稳定定殖以及定殖数量是影响生防效果的关键因素。目前用于研究生防菌在宿主体内定殖情况的方法主要有:抗生素标记法、同位素示踪法、基因标记法等。其中抗生素标记法具有简单、快速、实用、不会改变原始菌株的重要性质等特点,适用于追踪微生物在宿主体内的定殖情况[8,12,27,32]。本研究通过用抗生素标记法,筛选出了能抗300 μg/mL利福平的标记菌株TP-1R,其拮抗性能、外观形态等均与原始菌株无明显差异,且抗性标记可稳定遗传。本研究发现贝莱斯芽孢杆菌在葡萄中的定殖规律呈现先下降后上升再下降趋势。在贮藏后期其定殖数量还可达到3.11×106 CFU/g,表明菌株TP-1R能在葡萄上稳定定殖。生防菌在宿主上的定殖是一个十分复杂的动态过程,温度、接种量、宿主自身特性等因素都会对其产生影响[33]。其中生防菌能否很快适应宿主所在的微生态环境,从而占据有利位点,抑制病原微生物的生长是其有效发挥生防作用的重要因素。目前只是在实验室环境下研究了贝莱斯芽孢杆菌的定殖能力,为了进一步地提高其在实际应用的效果,还需要对影响其定殖量的因素做更深入的研究。
诱导系统抗性是生防菌发挥防病作用的重要机制之一。参与植物体内生理代谢的APX、PPO、PAL、POD等酶系与植物抵抗病原菌侵染有着密切关系。APX是植物活性氧代谢中重要的抗氧化酶之一,APX酶能有效提高植物的活性氧代谢水平,并且能促进维生素C的代谢水平,有效清除植物体内过多的活性氧,提高APX的活性可以减轻果实的氧化损伤,降低腐烂率[4]。其中PAL是苯丙烷代谢途径的关键酶,参与酚类、植保素和木质素等抗菌物质的合成[34],已有研究表明酚的代谢产物是潜在的抗病因子,而PPO酶能将酚类物质氧化为活性更强的醌类物质,并能促进木质素的合成,增加植物的抗病能力[35-36]。已有大量研究报道芽孢杆菌能够诱导植物防御酶活性的提高,从而抵抗病原菌的侵染。孙一凡等[37]发现侧孢芽孢杆菌BI13可以诱导番茄叶片防御酶活性的提高增强植物对番茄早疫病的抗性。孙建波等[38]研究发现经枯草芽孢杆菌XB16处理后的香蕉,其POD和PPO活性均比接种病原菌和清水对照高。王雪等[39]采用灌根法对人参进行处理,发现解淀粉芽孢杆菌FS6能够提高人参CAT、PPO、POD酶活性,增强人参对根腐病菌的抗性。本研究中发现,葡萄果实在受到灰葡萄孢侵染时,与对照相比葡萄中PAL、PPO、APX活性略有上升,表明病原菌也可以诱导植物相关防御酶活性的提高,可能原因是葡萄在受到病菌入侵后,为了抵御病菌,体内防御酶基因被激活,相关防御酶上调表达。此外经拮抗菌处理和拮抗菌与病原菌共同处理的葡萄防御酶活性均高于对照组以及灰葡萄孢处理,防御酶活性有更大程度的增加,说明菌株TP-1R能诱导植物进一步提高防御酶活性,增强对灰葡萄孢的抗性。且拮抗菌和病原菌共同诱导的PAL活性要高于单独接种拮抗菌和病原菌,表明两者共同诱导对PAL活性有协同增效的作用。防御酶的活性是植物抗病性的重要生理特征,酶活性越高,抗病性越强。此外防御酶相关基因的增强有助于防御系统的激活,防御酶相关基因的表达水平与相应酶活性密切相关[4,40]。关于贝莱斯芽孢杆菌TP-1R诱导相关防御酶基因的表达水平以及关于其抑菌物质还有待进一步研究。
4. 结论
本研究通过抗生素标记法测定贝莱斯芽孢杆菌TP-1R在葡萄上定殖能力,发现其在贮藏第30 d菌株定殖数量仍可达到3.11×106 CFU/g,表明拮抗菌TP-1R能够在葡萄果实稳定定殖,从而有效发挥其生防效果。后续课题组将采用GFP基因标记法,研究菌株TP-1R在葡萄生长期间的定殖动态,对本实验进行补充验证。在接种拮抗菌发酵液后,能有效防治葡萄灰霉病,降低葡萄果实腐烂率,在贮藏第25 d时葡萄腐烂率为35.76%。在贮藏期间,葡萄防御酶PAL、PPO、APX均呈先上升后下降的趋势,接种拮抗菌TP-1R的葡萄3种酶活性显著高于CK(P<0.05),在第15 d时,拮抗菌处理组PAL、PPO、APX活性是CK的1.23、1.19、2.01倍。贝莱斯芽孢杆菌TP-1R处理能够提高葡萄防御酶PAL、PPO、APX的活性,增强葡萄对灰霉病的防御能力。本研究为利用该菌株进行生防菌剂的研制提供了理论依据,为后续研究贝莱斯芽孢杆菌对葡萄防御物质合成相关基因表达奠定了基础。
-
-
[1] 李静. 伯克霍尔德氏菌Burkholderia contaminans B-1对玫瑰香葡萄采后病害生防潜力研究[D]. 太原: 山西大学, 2016 LI J. The study on biocontrol of post harvest diseases of Muscat grapes by Burkholderia contaminans B-1[D]. Taiyuan: Shanxi University, 2016.
[2] NALLY M C, PESCE V M, MATURANO Y P, et al. Biocontrol of Botrytis cinerea in table grapes by non-pathogenic indigenous Saccharomyces cerevisiae yeasts isolated from viticultural environments in Argentina[J]. Postharvest Biology & Technology,2012,64(1):40−48.
[3] FURUYA S, MOCHIZUKI M, AOKI Y, et al. Isolation and characterization of Bacillus subtilis KS1 for the biocontrol of grapevine fungal diseases[J]. Biocontrol Science and Technology,2011,21(6):705−720. doi: 10.1080/09583157.2011.574208
[4] LI Q, LI C, LI P, et al. The biocontrol effect of Sporidiobolus pararoseus Y16 against postharvest diseases in table grapes caused by Aspergillus niger and the possible mechanisms involved[J]. Biological Control,2017,113:18−25. doi: 10.1016/j.biocontrol.2017.06.009
[5] 张威, 周勇, 彭言劼, 等. 葡萄灰霉病病原菌鉴定及天然药物的抑制效果评价[J]. 中外葡萄与葡萄酒,2021(4):26−32. [ZHANG W, ZHOU Y, PENG Y J, et al. Identification of grape gray mold pathogen and evaluation of inhibitory effect of natural fungicide[J]. Sino-Overseas Grapevine & Wine,2021(4):26−32. doi: 10.13414/j.cnki.zwpp.2021.04.006 ZHANG W, ZHOU Y, PENG Y J, et al. Identification of grape gray mold pathogen and evaluation of inhibitory effect of natural fungicide[J]. Sino-Overseas Grapevine & Wine, 2021, (4): 26-32. doi: 10.13414/j.cnki.zwpp.2021.04.006
[6] YANG L, ZENG K, MING J. Control of blue and green mold decay of citrus fruit by Pichia membranefaciens and induction of defense responses[J]. Entia Horticulturae,2012,135(none):120−127.
[7] 陈志谊. 芽孢杆菌类生物杀菌剂的研发与应用[J]. 中国生物防治学报,2015,31(5):723−732. [CHEN Z Y. Research and application of bio-fungicide with Bacillus spp J]. Chinese Journal of Biological Control,2015,31(5):723−732.
[8] 申红妙, 李正楠, 贾招闪, 等. 内生枯草芽孢杆菌JL4在葡萄叶上的定殖及其对葡萄霜霉病的防治[J]. 应用生态学报,2016,27(12):4022−4028. [SHEN H M, LI Z N, JIA Z S, et al. Colonization of grape leaves by endophytic Bacillus subtilis JL4 and its control of grape downy mildew[J]. Chinese Journal of Applied Ecology,2016,27(12):4022−4028. SHEN H M, LI Z N, JIA Z S, et al. Colonization of grape leaves by endophytic Bacillus subtilis JL4 and its control of grape downy mildew[J]. Chinese Journal of Applied Ecology, 2016, 27(12): 4022-4028.
[9] BACON C W, YATES I E, HINTON D M, et al. Biological control of Fusarium moniliforme in Maize[J]. Environmental Health Perspectives,2001,109(2):325−332.
[10] 高振峰, 赵佳. 贝莱斯芽孢杆菌ZSY-1脂肽物质对番茄采后软化及早疫病发生的影响[J]. 西北农业学报,2022,31(1):89−98. [GAO Z F, ZHAO J. Effect of lipopeptide by Bacillus velezensis ZSY-1 on tomato postharvest softening and early blight[J]. Acta Agriculturae Boreali-occidentalis Sinica,2022,31(1):89−98. doi: 10.7606/j.issn.1004-1389.2022.01.011 GAO Z F, ZHAO J. Effect of lipopeptide by Bacillus velezensis ZSY-1 on tomato postharvest softening and early blight[J]. Acta Agriculturae Boreali-occidentalis Sinica, 2022, 31(1): 89-98. doi: 10.7606/j.issn.1004-1389.2022.01.011
[11] DESOIGNIES N, SCHRAMME F, ONGENA M, et al. Systemic resistance induced by Bacillus lipopeptides in Beta vulgaris reduces infection by the rhizomania disease vector Polymyxa betae[J]. Molecular Plant Pathology,2013,14(4):416−421. doi: 10.1111/mpp.12008
[12] 沙月霞, 张昂, 伍顺华, 等. 假单胞菌S149对水稻防御酶的诱导及定殖能力[J]. 中国植保导刊,2020,40(7):10−16. [SHA Y X, ZHANG A, WU S H, et al. Colonization ability of Pseudomonas S149 and induction of defense-related enzymes in rice[J]. China Plant Protection,2020,40(7):10−16. SHA Y X, ZHANG A, WU S H, et al. Colonization ability of Pseudomonas S149 and induction of defense-related enzymes in rice[J]. China Plant Protection, 2020, 40(7): 10-16.
[13] DROBY S, WISNIEWSKI M. The fruit microbiome: A new frontier for postharvest biocontrol and postharvest biology[J]. Postharvest Biology and Technology,2018,140:107−112. doi: 10.1016/j.postharvbio.2018.03.004
[14] 陈刘军, 俞仪阳, 王超, 等. 蜡质芽孢杆菌AR156防治水稻纹枯病机理初探[J]. 中国生物防治学报,2014,30(1):107−112. [CHEN L J, YU Y Y, WANG C, et al. Preliminary research of mechanisms underlying Bacillus cereus AR156-mediated resistance to rhizoctonia solani in rice[J]. Chinese Journal of Biological Control,2014,30(1):107−112. doi: 10.16409/j.cnki.2095-039x.2014.01.018 CHEN L J, YU Y Y, WANG C, et al. Preliminary research of mechanisms underlying Bacillus cereus AR156-mediated resistance to rhizoctonia solani in rice[J]. Chinese Journal of Biological Control, 2014, 30(1): 107-112. doi: 10.16409/j.cnki.2095-039x.2014.01.018
[15] 沈艳, 何鹏搏, 何鹏飞, 等. 番茄产后灰霉病的病原鉴定及生物防治[J]. 中国农学通报,2021,37(13):102−107. [SHEN Y, HE P B, HE P F, et al. Pathogen identification and biological control of gray mold on postharvest tomato[J]. Chinese Agricultural Science Bulletin,2021,37(13):102−107. doi: 10.11924/j.issn.1000-6850.casb2020-0798 SHEN Y, HE P B, HE P F, et al. Pathogen identification and biological control of gray mold on postharvest tomato[J]. Chinese Agricultural Science Bulletin, 2021, 37(13): 102-107. doi: 10.11924/j.issn.1000-6850.casb2020-0798
[16] SANTIAGO R, HUILIñIRB C, COTTET L, et al. Microbiological characterization for a new wild strain of Paenibacillus polymyxa with antifungal activity against Botrytis cinerea[J]. Biological Control,2016,103:251−260. doi: 10.1016/j.biocontrol.2016.10.002
[17] BOUBAKRI H, HADJ-BRAHIM A, SCHMITT C, et al. Biocontrol potential of chenodeoxycholic acid (CDCA) and endophytic Bacillus subtilis strains against the most destructive grapevine pathogens[J]. Crop and Horticultural Science,2015,4(43):261−274.
[18] RUIZ C, BJAR V, MARTNEZ-CHECA F, et al. Bacillus velezensis sp. nov. a surfactant producing bacterium isolated from the river Vélez in Málaga, southern Spain[J]. Int J Syst Evol Microbiol,2005,55:191−195. doi: 10.1099/ijs.0.63310-0
[19] DUNLAP C A, KIM S J, KWON S W, et al. Bacillus velezensis is not a later heterotypic synonym of Bacillus amyloliquefaciens, Bacillus methylotrophicus, Bacillus amyloliquefaciens subsp. plantarum and 'Bacillus oryzicola' are later heterotypic synonyms of Bacillus velezensis based on phylogenomics[J]. International Journal of Systematic and Evolutionary Microbiology,2016,66(3):1212−1217. doi: 10.1099/ijsem.0.000858
[20] 潘梦诗, 郭文阳, 张宗源, 等. 贝莱斯芽孢杆菌对花生白绢病的防治效果[J]. 生物学杂志,2022,39(1):37−41. [PAN M S, GUO W Y, ZHANG Z Y, et al. Biocontrol effects of Bacillus velezensis on peanut stem rot caused by Sclerotium rolfsii[J]. Journal of Biology,2022,39(1):37−41. PAN M S, GUO W Y, ZHANG Z Y, et al. Biocontrol effects of Bacillus velezensis on peanut stem rot caused by Sclerotium rolfsii[J]. Journal of Biology, 2022, 39(1): 37-41.
[21] 张倩, 陈雨诗, 许春艳, 等. 贝莱斯芽孢杆菌防治甜樱桃采后软腐病的效果和机理[J]. 食品科学,2023,44(7):229−239. [ZHANG Q, CHEN Y S, XU C Y, et al. Effects and mechanism of Bacillus velezensis on control and induced resistance of postharvest soft rot of sweet cherry fruit[J]. Food Science,2023,44(7):229−239. ZHANG Q, CHEN Y S, XU C Y, et al. Effects and mechanism of Bacillus velezensis on control and induced resistance of postharvest soft rot of sweet cherry fruit[J]. Food Science, 2023, 44(7): 229-239.
[22] 张晓勇, 李树江, 严凯, 等. 杧果采后炭疽病生防菌株筛选及其培养特性研究[J]. 园艺学报,2021,48(11):2171−2184. [ZHANG X Y, LI S J, YAN K, et al. Screening and culture characteristics of biocontrol strains of postharvest anthracnose of mango[J]. Acta Horticulturae Sinica,2021,48(11):2171−2184. ZHANG X Y, LI S J, YAN Kai, et al. Screening and culture characteristics of biocontrol strains of postharvest anthracnose of mango[J]. Acta Horticulturae Sinica, 2021, 48(11): 2171-2184.
[23] 管力慧. 拮抗菌对甜瓜贮藏品质及生理影响的研究[D]. 乌鲁木齐: 新疆大学, 2021 GUAN L H. Study on the effect of antagonistic bacteria on storage quality and physiology of melon[D]. Urumqi: Xinjiang University, 2021.
[24] 罗云艳. 烟草根黑腐病根际拮抗菌的筛选、鉴定及其生物防治研究[D]. 杨凌: 西北农林科技大学, 2021 LUO Y Y. Screening, identification and biological control of antagonistic bacteria in the rhizosphere of tobacco root black rot[D]. Yangling: Northwest A&F University, 2021.
[25] 蔡学清, 何红, 胡方平. 双抗标记法测定枯草芽孢杆菌BS-2和BS-1在辣椒体内的定殖动态[J]. 福建农业大学学报,2003(1):41−45. [CAI X Q, HE H, HU F P. Colonization trends of Bacillus subtilis BS-2 and BS-1 in capsicum with dual-resistant label[J]. Journal of Fujian Agriculture and Forestry University (Natural Science Edition),2003(1):41−45. CAI X Q, HE H, HU F P. Colonization trends of Bacillus subtilis BS-2 and BS-1 in capsicum with dual-resistant label[J]. Journal of Fujian Agriculture and Forestry University (Natural Science Edition), 2003(1): 41-45.
[26] 肖相政, 刘可星, 廖宗文. 短小芽孢杆菌BX-4抗生素标记及定殖效果研究[J]. 农业环境科学学报,2009,28(6):1172−1176. [XIAO X Z, LIU K X, LIAO Z W. Ampicillin-resistant Bacillus pumilus BX-4 and Its colonization in the tomato rhizosphere[J]. Journal of Agro-Environment Science,2009,28(6):1172−1176. doi: 10.3321/j.issn:1672-2043.2009.06.014 XIAO X Z, LIU K X, LIAO Z W. Ampicillin-resistant Bacillus pumilus BX-4 and Its colonization in the tomato rhizosphere[J]. Journal of Agro-Environment Science, 2009, 28(6): 1172-1176. doi: 10.3321/j.issn:1672-2043.2009.06.014
[27] 张冬冬, 刘涛, 高同国, 等. 棉花黄萎病拮抗细菌Z-5菌株的定殖能力检测[J]. 棉花学报,2013,25(6):510−516. [ZHANG D D, LIU T, GAO T G, et al. Detection of the colonization ability of antagonistic bacteria strain Z-5 against cotton verticillium wilt[J]. Cotton Science,2013,25(6):510−516. doi: 10.3969/j.issn.1002-7807.2013.06.006 ZHANG D D, LIU T, GAO T G, et al. Detection of the colonization ability of antagonistic bacteria strain Z-5 against cotton verticillium wilt[J]. Cotton Science, 2013, 25(6): 510-516. doi: 10.3969/j.issn.1002-7807.2013.06.006
[28] 郗良卿, 吴澎, 李睿琪. 贝莱斯芽孢杆菌对甜樱桃软腐病生防效果的研究[J]. 中国果菜,2022,42(1):59−68. [XI L Q, WU P, LI R Q. Biocontrol effect of bacillus velezensis soft rot of sweet cherry[J]. China Fruit & Vegetable,2022,42(1):59−68. XI L Q, WU P, LI R Q. Biocontrol effect of bacillus velezensis soft rot of sweet cherry[J]. China Fruit & Vegetable, 2022, 42(1): 59-68.
[29] 罗琳, 王其慧, 赵海霞, 等. 葡萄灰霉病生防菌株的筛选及其拮抗机理初探[J]. 中国酿造,2017,36(4):93−98. [LUO L, WANG Q H, ZHAO H X, et al. Screening of bio-control strain against Botrytis cinerea and preliminary research on its antagonistic mechanisms[J]. China Brewing,2017,36(4):93−98. LUO L, WANG Q H, ZHAO H X, et al. Screening of bio-control strain against Botrytis cinerea and preliminary research on its antagonistic mechanisms[J]. China Brewing, 2017, 36(4): 93-98.
[30] 王红丽, 善文辉, 胡海瑶, 等. 生防菌混合接种对葡萄灰霉病菌的防治效果[J]. 中国生物防治学报,2020,36(2):265−271. [WANG H L, SHAN W H, HU H Y, et al. Control effect of mixed inoculation of different biocontrol strains on Botrytis cinerea[J]. Chinese Journal of Biological Control,2020,36(2):265−271. doi: 10.16409/j.cnki.2095-039x.2020.02.012 WANG H L, SHAN W H, HU H Y, et al. Control effect of mixed inoculation of different biocontrol strains on Botrytis cinerea[J]. Chinese Journal of Biological Control, 2020, 36(2): 265-271. doi: 10.16409/j.cnki.2095-039x.2020.02.012
[31] 徐莉, 陈小洁, 曹静婷, 等. 小麦赤霉病生防菌DZSG23的抗病机制[J]. 浙江农业学报,2020,32(11):2001−2008. [XU L, CHEN X J, CAO J T, et al. Resistance mechanism of biocontrol strain DZSG23 against wheat scab[J]. Acta Agriculturae Zhejiangensis,2020,32(11):2001−2008. doi: 10.3969/j.issn.1004-1524.2020.11.10 XU L, CHEN X J, CAO J T, et al. Resistance mechanism of biocontrol strain DZSG23 against wheat scab[J]. Acta Agriculturae Zhejiangensis, 2020, 32(11): 2001-2008. doi: 10.3969/j.issn.1004-1524.2020.11.10
[32] 文才艺, 王凯旋, 汪敏, 等. 内生细菌EBS05在小麦体内的定殖动态及其对小麦纹枯病的防治作用[J]. 植物保护学报,2011,38(6):481−486. [WEN C Y, WANG K X, WANG M, et al. Colonization trends of endophytic bacteria EBS05 in wheat and its control effect on wheat sharp eyespot[J]. Journal of Plant Protection,2011,38(6):481−486. doi: 10.13802/j.cnki.zwbhxb.2011.06.001 WEN C Y, WANG K X, WANG M, et al. Colonization trends of endophytic bacteria EBS05 in wheat and its control effect on wheat sharp eyespot[J]. Journal of Plant Protection, 2011, 38(6): 481-486. doi: 10.13802/j.cnki.zwbhxb.2011.06.001
[33] 杨洪凤, 薛雅蓉, 余向阳, 等. 内生解淀粉芽孢杆菌CC09菌株在小麦叶部的定殖能力及其防治白粉病效果研究[J]. 中国生物防治学报,2014,30(4):481−488. [YANG H F, XUE Y R, YU X Y, et al. Colonization of Bacillus amyloliquefaciens CC09 in wheat leaf and its biocontrol effect on powdery mildew disease[J]. Chinese Journal of Biological Control,2014,30(4):481−488. doi: 10.16409/j.cnki.2095-039x.2014.04.010 YANG H F, XUE Y R, YU X Y, et al. Colonization of Bacillus amyloliquefaciens CC09 in wheat leaf and its biocontrol effect on powdery mildew disease[J]. Chinese Journal of Biological Control, 2014, 30(4): 481-488. doi: 10.16409/j.cnki.2095-039x.2014.04.010
[34] 林陈强, 李占飞, 张慧, 等. 枯草芽孢杆菌CS16诱导香蕉抗病性相关防御酶系的研究[J]. 福建农业学报,2013,28(6):570−574. [LIN C Q, LI Z F, ZHANG H, et al. Induction of defense-related enzymes in banana seedling by Bacillus subtilis strain CS16[J]. Fujian Journal of Agricultural Sciences,2013,28(6):570−574. doi: 10.3969/j.issn.1008-0384.2013.06.013 LIN C Q, LI Z F, ZHANG H, et al. Induction of defense-related enzymes in banana seedling by Bacillus subtilis strain CS16[J]. Fujian Journal of Agricultural Sciences, 2013, 28(6): 570-574. doi: 10.3969/j.issn.1008-0384.2013.06.013
[35] 陈爽, 王继华, 张必弦, 等. 贝莱斯芽孢杆菌对大豆根腐病盆栽防效及防御酶活性检测[J]. 分子植物育种,2022,20(19):6492−6500. [CHEN S, WANG J H, ZHANG B X, et al. Control effect of Bacillus velezensis on soybean root rot in pot and detection of defensive enzyme activity[J]. Molecular Plant Breeding,2022,20(19):6492−6500. doi: 10.13271/j.mpb.020.006492 CHEN S, WANG J H, ZHANG B X, et al. Control effect of Bacillus velezensis on soybean root rot in pot and detection of defensive enzyme activity[J]. Molecular Plant Breeding, 2022, 20(19): 6492-6500. doi: 10.13271/j.mpb.020.006492
[36] FANG C, MIN W, YU Z, et al. Quantitative changes of plant defense enzymes and phytohormone in biocontrol of cucumber Fusarium wilt by Bacillus subtilis B579[J]. World Journal of Microbiology and Biotechnology,2010,26(4):675−684. doi: 10.1007/s11274-009-0222-0
[37] 孙一凡, 刘喆, 李海洋, 等. 侧孢芽孢杆菌Bl13对番茄早疫病防治效果及机制[J]. 应用生态学报,2021,32(1):299−308. [SUN Y F, LIU Z, LI H Y, et al. Biocontrol effect and mechanism of Bacillus laterosporus Bl13 against early blight disease of tomato[J]. Chinese Journal of Applied Ecology,2021,32(1):299−308. doi: 10.13287/j.1001-9332.202101.036 SUN Y F, LIU Z, LI H Y, et al. Biocontrol effect and mechanism of Bacillus laterosporus Bl13 against early blight disease of tomato[J]. Chinese Journal of Applied Ecology, 2021, 32(1): 299-308. doi: 10.13287/j.1001-9332.202101.036
[38] 孙建波, 王宇光, 赵平娟, 等. 拮抗菌XB16在香蕉体内的定殖及对抗病相关酶活性的影响[J]. 热带作物学报,2010,31(2):212−216. [SUN J B, WANG Y G, ZHAO P J, et al. Colonization of antagonistic XB16 in banana and its effects on the activities of disease-resistance related enzymes[J]. Chinese Journal of Tropical Crops,2010,31(2):212−216. doi: 10.3969/j.issn.1000-2561.2010.02.010 SUN J B, WANG Y G, ZHAO P J, et al. Colonization of antagonistic XB16 in banana and its effects on the activities of disease-resistance related enzymes[J]. Chinese Journal of Tropical Crops, 2010, 31(2): 212-216. doi: 10.3969/j.issn.1000-2561.2010.02.010
[39] 王雪, 张丹妮, 王春伟, 等. 解淀粉芽孢杆菌FS6在人参体内的定殖特性及对人参诱导抗病性[J]. 西北农林科技大学学报(自然科学版),2019,47(7):125−130, 138. [[WANG X, ZHANG D N, WANG C W, et al. Colonization and induced resistance of Bacillus amyloliquefaciens FS6 in ginseng[J]. Journal of Northwest A&F University (Natural Science Edition),2019,47(7):125−130, 138. [WANG X, ZHANG D N, WANG C W, et al. Colonization and induced resistance of Bacillus amyloliquefaciens FS6 in ginseng[J]. Journal of Northwest A & F University (Natural Science Edition), 2019, 47(7): 125-130, 138.
[40] NIU D D, LIU H X, JIANG C H, et al. The plant growth-promoting rhizobacterium Bacillus cereus AR156 induces systemic resistance in Arabidopsis thaliana by simultaneously activating salicylate- and jasmonate/ethylene-dependent signaling pathways[J]. Mol Plant Microbe Interact,2011,24(5):533−542. doi: 10.1094/MPMI-09-10-0213
-
期刊类型引用(9)
1. 方丽,江晓,李雪莹,张丽,黄嘉颖,张方圆. 气相色谱-三重四极杆质谱法同时测定乌梅中25种多环芳烃及其污染来源分析. 食品安全质量检测学报. 2024(02): 74-82 .  百度学术
百度学术
2. 王润博,刘思琪,王林山. 发酵型含乳饮料研究概况及新产品开发. 漯河职业技术学院学报. 2024(01): 34-40 .  百度学术
百度学术
3. 杨小丽,李本姣,章攀,李松,李智佳. 青梅果酒加工工艺研究进展. 南方农业. 2024(21): 130-133 .  百度学术
百度学术
4. 周丹英,姜慧洁,胡云莉,章越. 茶多酚银杏叶胶囊的研制及其辅助降血脂功能评价. 食品科技. 2023(05): 113-119 .  百度学术
百度学术
5. 郭锦荣. 中药调脂及抗动脉粥样硬化作用研究进展. 中国中医药现代远程教育. 2023(13): 200-202 .  百度学术
百度学术
6. 蒋维,舒晓燕,王玉霞,唐志康,梅国富,杨兴蓉,刘欣雨,侯大斌. 四川主产区不同品种青梅果实品质分析. 食品工业科技. 2023(16): 321-330 .  本站查看
本站查看
7. 周芳,陈文明,陈新宇,蔡嘉洛,LAU Yutong. 冬春谧阳方对高脂血症患者PPARγ/ANGPTL受体配体的影响. 陕西中医. 2023(11): 1537-1541 .  百度学术
百度学术
8. 任蓉,杜雅薇,冉隆开. 血脂异常的中医病因病机及辨证施治的研究进展. 疑难病杂志. 2023(11): 1228-1232 .  百度学术
百度学术
9. 裴占阳,韦经利,余江游,赵先游,班明政,陈福. 几种中草药饲料添加剂在动物生产中的应用研究. 现代畜牧兽医. 2022(09): 60-63 .  百度学术
百度学术
其他类型引用(1)





 下载:
下载:

 下载:
下载:
