Inhibitory Effect of Litsea cubeba Essential Oil on Aspergillus flavus Growth and Aflatoxin Production
-
摘要: 山苍子精油是一种纯天然植物精油,本文研究了其对黄曲霉生长、代谢和毒素产生的抑制作用,探讨了山苍子精油对黄曲霉菌的抑菌能力和作用机理。本研究将花生放置于自然环境染菌并分离纯化目标菌,采用形态学并结合ITS序列法进行菌株分类鉴定;结合抑菌圈、抑菌率和最低抑菌浓度(MIC)的测定探讨山苍子精油对黄曲霉菌的抑制能力;进行了山苍子精油影响黄曲霉孢子萌发率、生长曲线和黄曲霉毒素B1产生的实验研究;从细胞膜渗透性、细胞酶活性的变化探讨了山苍子精油抑制黄曲霉的作用机理。实验结果表明:从腐败花生中分离筛选出菌株HB2,经ITS序列法鉴定为黄曲霉(Aspergillus flavus);黄曲霉素测定结果显示其含有黄曲霉素B1(AFB1),质量浓度为3.4×103 μg·kg−1(纯湿菌体);抑菌圈随精油浓度的增大明显变大,对黄曲霉的最低抑菌体积分数(MIC)为0.800 μL·mL−1;孢子萌发率、牙管长度、黄曲霉菌体的生长量和AFB1的浓度随培养液中精油浓度的增大呈显著下降趋势,当山苍子精油浓度为0.100 μL·mL−1时,肉眼看不到菌体生长;随精油浓度的增大,培养液电导率增大、还原糖利用率和菌体蛋白质含量减少、菌体内苹果酸脱氢酶和琥珀酸脱氢酶活性降低。这些结果表明,山苍子精油对黄曲霉产生不可逆的破坏,推测山苍子精油破坏细胞壁和细胞膜,影响细胞的生长和代谢,并最终导致细胞死亡。因此,山苍子精油对黄曲霉具有良好的抑制作用,可广泛用于粮食储藏、食品防霉等方面。Abstract: Litsea cubeba essential oil is a pure natural plant essential oil. In this paper, the inhibitory effect of Litsea cubeba essential oil on the growth, metabolism and toxin production of Aspergillus flavus was investigated. In this study, peanuts were placed in a natural environment to infect bacteria, and the target bacteria were isolated and purified. Morphology and ITS sequence methods were used to classify and identify the strains. The inhibition ability of essential oil on Aspergillus flavus was discussed by the determination of inhibition zone, inhibition rate and minimum inhibitory concentration (MIC). The effects of essential oil on the germination rate, growth curve and aflatoxin B1 production of Aspergillus flavus, as well as the effects of cell membrane permeability and cellular enzyme activity, were tested. The results showed that strain HB2 was isolated and screened from spoilage peanuts and was identified as Aspergillus flavus by the ITS sequence method. The results of aflatoxin determination showed that aflatoxin B1 (AFB1) had a mass concentration of 3.4×103 μg·kg−1 (pure wet bacteria). The bacteriostatic zone significantly increased with increasing essential oil concentration, and the minimum inhibitory concentration (MIC) for Aspergillus flavus was 0.800 μL·mL−1. The germination rate, the length of the dental tube, the growth of Aspergillus flavus, and the concentration of AFB1 showed a significant decreasing trend with increasing concentrations of essential oil in the culture medium. When the concentration of Litsea cubeba essential oil was 0.100 μL·mL−1, the growth of the bacteria was invisible to the naked eye. With the increase in the concentration of essential oil, the conductivity of the culture medium increased, the utilization rate of reducing sugars and the protein content of the bacteria decreased, and the activities of malate dehydrogenase and succinate dehydrogenase in the bacteria decreased. These results indicated that Litsea cubeba essential oil caused irreversible damage to Aspergillus flavus. It is speculated that Litsea cubeba essential oil damaging the cell wall and cell membrane, affecting cell growth and metabolism and ultimately leading to cell death. Therefore, Litsea cubeba essential oil has a good inhibitory effect on Aspergillus flavus and can be widely used in grain storage and food antimolding.
-
Keywords:
- Litsea cubeba essential oil /
- Aspergillus flavus /
- aflatoxin B1 /
- inhibitory effect
-
黄曲霉是一种常见的腐生真菌,易着生于花生、玉米、大米等粮油或其制品上。黄曲霉毒素(AFT)是黄曲霉产毒菌株在生长代谢过程中所产生的次级代谢产物,主要有B1、B2、G1和G2等20多种,其中以B1(AFB1)的毒性最大,致癌性最强[1]。1993年黄曲霉毒素被世界卫生组织(WHO)的癌症研究机构划定为1类致癌物,是一种毒性极强的剧毒物质,多个国家和地区制定了各类食品中黄曲霉毒素限量标准。如我国规定了玉米、花生及其制品中AFB1最高允许质量浓度为20 μg·kg−1,大米、食用油类(花生油除外)中AFB1最高允许质量浓度为10 μg·kg−1[2]。粮油食品中AFB1的测定方法有高效液相色谱、薄层分析法、酶联免疫法和荧光光度法等,但这些方法存在对设备要求高,预处理步骤复杂,对酶的特异性要求高等缺点[3-4]。本文采用量子点荧光免疫层析法快速测定AFB1,样品中的AFB1与结合垫中的量子点标记AFB1抗体结合,并基于免疫层析原理,建立了AFB1快速、高灵敏荧光免疫层析检测方法。
在粮油食品中控制黄曲霉及其毒素的方法主要有物理法、化学法和生物法[5]。虽然物理和化学法对抑制黄曲霉生长和毒素合成是有效的,但存在成本较高,食物营养流失,化学残留等问题,生物法易受菌种和环境影响[6]。山苍子精油是山苍子果实及叶经蒸汽蒸馏出来的一种芳香油,主要成分是柠檬醛(66%~80%)。它既是国标GB 2760-2011中规定可直接使用的食用香料,安全无毒,又具有广谱的抗菌、抑菌和防霉脱毒作用,其中柠檬醛起最主要的作用[7-9]。近年来,国内外的研究证明了山苍子精油来源天然、无毒、对环境友好,对黄曲霉有显著的生长抑制作用,但大多数研究主要在山苍子精油对黄曲霉抑制的应用方式及作用效果,对黄曲霉生长量和AFB1产生的抑制作用研究较少[10-11]。本研究从自然发霉的花生中分离鉴定出一株产毒黄曲霉,探讨山苍子精油对黄曲霉菌的抑菌能力和作用机理,将其开发为天然的抑菌防霉剂,为粮油中黄曲霉的绿色防控提供一定的理论依据。
1. 材料与方法
1.1 材料与仪器
山苍子精油 江西洋浦生物科技有限公司,水蒸气蒸馏制备,柠檬醛含量67.8%;采用市场购买的花生仁洒少许水后室温自然放置一段时间,待表面长出明显的霉菌菌丝后分离目标菌株进行后续试验;马铃薯葡萄糖琼脂培养基(PDA)、马铃薯葡萄糖水(PDB)、麦芽汁琼脂培养基 广东环凯微生物科技有限公司;NADP-苹果酸脱氢酶(NADP-MDH)活性检测试剂盒(紫外分光光度法)、琥珀酸脱氢酶(SDH)活性检测试剂盒(可见分光光度法) 北京盒子生工科技有限公司。
HPX-200生化培养箱 上海跃进医疗器械有限公司;YXQ-LS-75SI立式压力蒸汽灭菌器 上海博讯实业有限公司医疗设备厂;SW-CJ-2FD净化工作台 上海博讯医疗生物仪器股份有限公司;E5显微镜 宁波舜宇仪器有限公司;ZQTY-70V恒温摇床 上海知楚仪器有限公司;NepQD-Infinity-V1干式荧光免疫分析仪 江苏量点科技有限公司。
1.2 实验方法
1.2.1 花生致霉菌的分离、培养与保存
参照郑自强等[12]的霉菌分离纯化方法进行黄曲霉的筛选试验。准确称取25.0 g霉腐变质的花生,在净化工作台上进行研磨,倒入装有225 mL无菌水的锥形瓶中,振荡20 min,使其混合均匀备用。将悬浊液按照10倍的梯度进行稀释。分别移取不同稀释梯度(10−4、10−5、10−6)的悬浊液0.1 mL加入马铃薯葡萄糖培养基(PDA)平板中,同时用涂布棒涂布匀称后,倒置于30 ℃生化培养箱中恒温培养5 d,每个稀释度做3次重复试验。待培养皿上长出各种形态的菌落后,依据《真菌鉴定手册》[13]黄曲霉菌落特征选取目标特征菌落在PDA平板上划线分离培养。重复以上步骤,直到获得菌落形态一致的纯菌株HB2。将纯化后的菌株制成菌种斜面保存在5 ℃冷藏箱中以供后续试验使用。
1.2.2 菌株的鉴定
1.2.2.1 形态学鉴定
将纯化菌株接种于麦芽汁琼脂培养基,30 ℃恒温箱培养,E5显微镜下观察菌落颜色、形状及菌丝疏密性。待产孢子后观察记录孢子的形态、结构和大小[14]。
1.2.2.2 分子生物学鉴定
将纯化的菌种试管斜面送广东省微生物分析检测中心进行ITS基因和benA基因测序,用blast程序在Genebank中与已登录的序列进行核苷酸同源性比较,并基于ITS序列邻接法构建系统发育树。
1.2.3 量子点免疫荧光层析法测定黄曲霉素B1
用无菌水从已在PDA培养基斜面培养10 d的菌物上洗涤稀释,制成浓度为106个·mL−1的孢子悬液,然后取0.10 mL加入装有100 mL PDA培养液的锥形瓶中,于30 ℃,120 r·min−1转速恒温摇床中培养5 d后抽滤得湿重菌体。将称重后的菌体置离心管,加入55%甲醇溶液25 mL,混匀,旋涡振荡10 min后,室温6000 g离心3 min,收集上层甲醇水溶液,将收集液用中速定量滤纸过滤,收集过滤液。取0.1 mL过滤液与20 mmol·L−1 PBS缓冲液0.4 mL振荡混匀为待测液,取75 μL待检液缓慢滴入荧光免疫分析仪检测卡的加样孔,15 min后将检测卡插入量子点免疫荧光分析仪检测,得样品中黄曲霉素B1的含量。
1.2.4 山苍子精油对HB2菌抑菌活性测定
1.2.4.1 抑菌圈大小的测定
采用滤纸片法(K-B法)测定抑菌圈直径[15]。制作直径为6 mm的滤纸片,干热灭菌后放入山苍子精油体积分数分别为0、3.13、6.25、12.50、25.00、50.00、80.00、100.00 μL·mL−1的70%乙醇水溶液中浸泡2 h。移取孢子悬液(孢子浓度为106个·mL−1)0.1 mL于PDA培养基平板,用涂布棒涂布均匀,取已浸泡过山苍子精油的滤纸片呈品字形贴附在每个培养基平板上,用70%乙醇水溶液浸泡的无菌滤纸片作空白对照。倒置于30 ℃恒温培养5 d后测量抑菌圈直径,每个浓度取3个平行实验的平均数值。
1.2.4.2 山苍子精油对HB2菌的抑菌率和最低抑菌体积分数(MIC)的测定
采用刘瑞玲等[16]的方法并稍作修改,测定山苍子精油对HB2菌的抑制效果。配制马铃薯葡萄糖琼脂培养基(PDA),分装于若干试管中(每支15 mL),灭菌后降温至60 ℃左右,分别吸取不同浓度的山苍子精油稀释液0.15 mL加入试管中,充分摇匀,于50 ℃左右倒制平板。山苍子精油在培养基的最终体积分数分别为:0、0.038、0.075、0.150、0.300、0.600、0.800、1.000、1.200 μL·mL−1。待培养基凝结成固体后,取0.1 mL菌悬液(孢子浓度为106个·mL−1)于每个平板中,用涂布棒涂布均匀后,倒置于30 ℃恒温培养5 d后观察计算菌落数。根据菌落数计算抑菌率。绘制精油浓度和抑菌率的回归方程,以抑菌率100%的最低精油体积分数为其最低抑菌体积分数(MIC)。每个浓度做3个平行实验,以70%乙醇水溶液进行对比参照。抑菌率计算公式为:
抑菌率(%)=dc−dedc×100 式中:de:处理组菌落数,CFU·mL−1;dc:对照组菌落数,CFU·mL−1。
1.2.5 山苍子精油对孢子萌发的影响
参考李敏等[17]的方法,采用液体培养法测定孢子萌发率。将山苍子精油用70%乙醇水溶液稀释后,分别加入装有灭菌马铃薯葡萄糖水(PDB)的锥形瓶中使培养液中精油浓度分别为0、0.013、0.025、0.030、0.040、0.050、0.060、0.080 μL·mL−1,再加入0.5 mL孢子悬液(孢子浓度为106个·mL−1),加塞,然后置于30 ℃、120 r/min的恒温摇床中培养8.0 h。用光学显微镜观察至少200个孢子,统计孢子萌发率和芽管长度。
1.2.6 山苍子精油对黄曲霉生长量和产毒含量的影响
配制马铃薯葡萄糖水(PDB),分别取100 mL分装于若干锥形瓶中,包扎灭菌后待用。根据前期预试验结果将山苍子精油用70%乙醇水溶液稀释后取一定量的稀释液于灭菌冷却后的马铃薯培养液中,培养液中山苍子精油的体积分数分别为:0、0.025、0.030、0.040、0.050、0.080、0.100、0.200、0.500、0.800、1.000、2.000 μL·mL−1,然后每个实验锥形瓶加入0.1 mL孢子悬液(孢子浓度为106个·mL−1),于30 ℃,120 r·min−1转速恒温摇床中培养,5 d后将锥形瓶中不同山苍子精油浓度中生长的菌丝球分别抽滤后,称重,然后采用量子点免疫荧光层析法测定黄曲霉素B1的量。取肉眼看不到菌丝或菌丝球生长的培养液0.1 mL于PDA平板,用涂布棒涂布均匀,倒置于30 ℃恒温培养48 h后观察。每个浓度做3个平行实验,设置70%乙醇水溶液做对照实验[18]。
1.2.7 山苍子精油对细胞膜渗透性的影响
将山苍子精油用70%乙醇水溶液稀释后取一定量的稀释液于灭菌冷却后的马铃薯培养液中,根据1.2.6实验结果,将培养液中山苍子精油的体积分数设置为:0、0.025、0.030、0.040、0.050、0.080、0.100 μL·mL−1,然后每个实验锥形瓶加入0.1 mL孢子悬液(孢子浓度为106个·mL−1),于30 ℃,120 r·min−1转速恒温摇床中培养。5 d后,取培养液于室温、8000 r·min−1离心15 min取上清液,采用电极法测定电导率,上清液消解后用原子吸收光度计测定Ca2+、K+和Mg2+浓度[19],3,5-二硝基水杨酸比色法测定还原糖含量[20],离心后的菌体用无菌水洗涤两次后烘干至恒重,采用凯氏定氮法测定菌体蛋白质含量[21]。
1.2.8 山苍子精油对细胞酶活性的影响
根据1.2.6实验结果,选取具有菌体生长的山苍子精油抑菌浓度按照NADP-苹果酸脱氢酶和琥珀酸脱氢酶活性检测试剂盒的说明方法测定山苍子精油对菌体苹果酸脱氢酶和琥珀酸脱氢酶活性的变化。将山苍子精油稀释后,取一定量加入装有PDB的锥形瓶中使培养液中精油浓度分别为0.03、0.05 μL·mL−1,再加入0.1 mL孢子悬液,盖上橡胶塞,摇匀。然后置于30 ℃、120 r·min−1的恒温摇床中培养5 d后,收集菌体,按照试剂盒说明进行加样测试[22]。
1.3 数据处理
用Microsoft Excel 2010与SPSS 22.0软件进行数据录入及处理,试验结果为平均值±标准差,统计检验的显著水平以P<0.05为基准。
2. 结果与分析
2.1 菌株鉴定
2.1.1 形态学鉴定
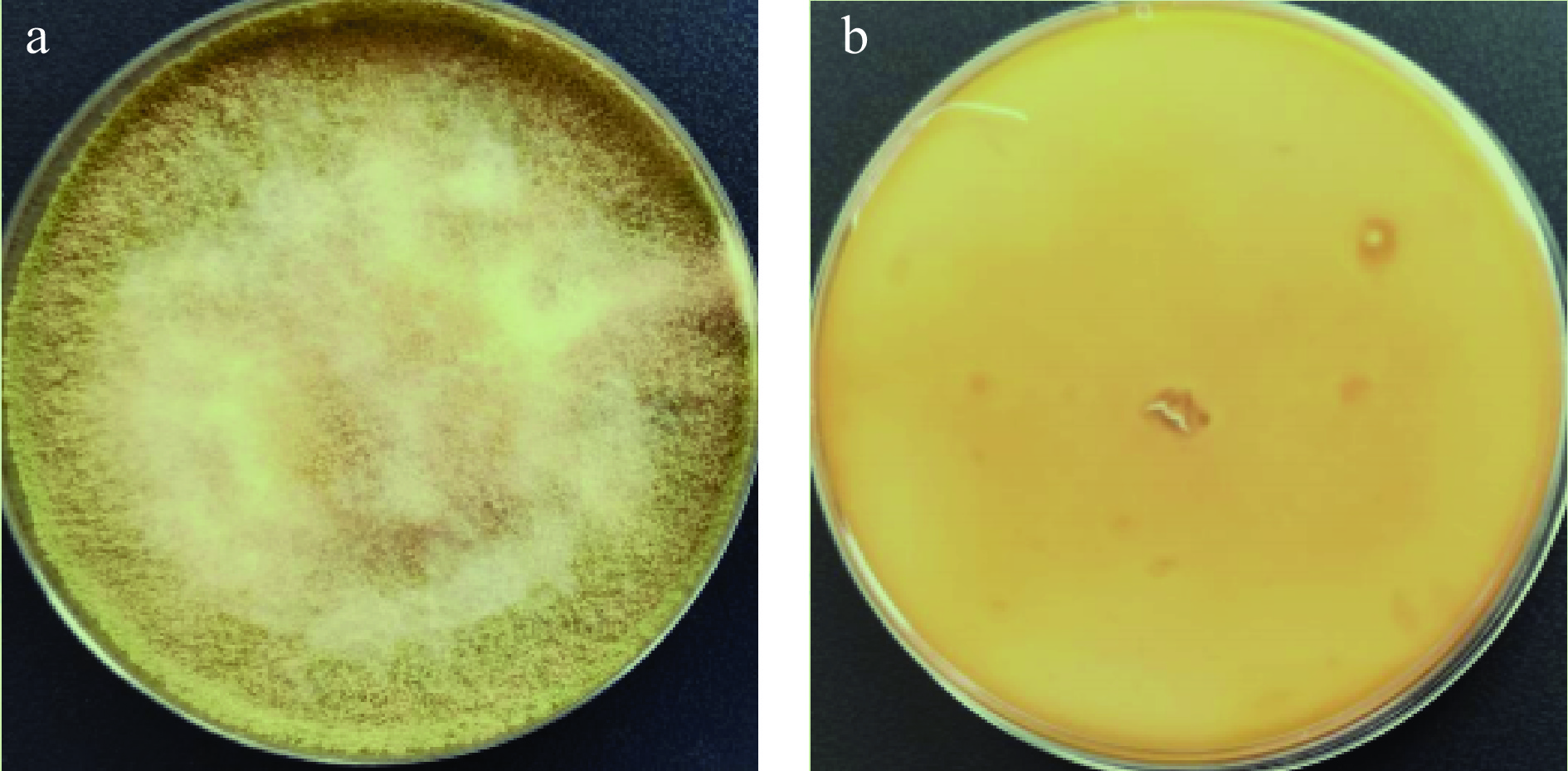
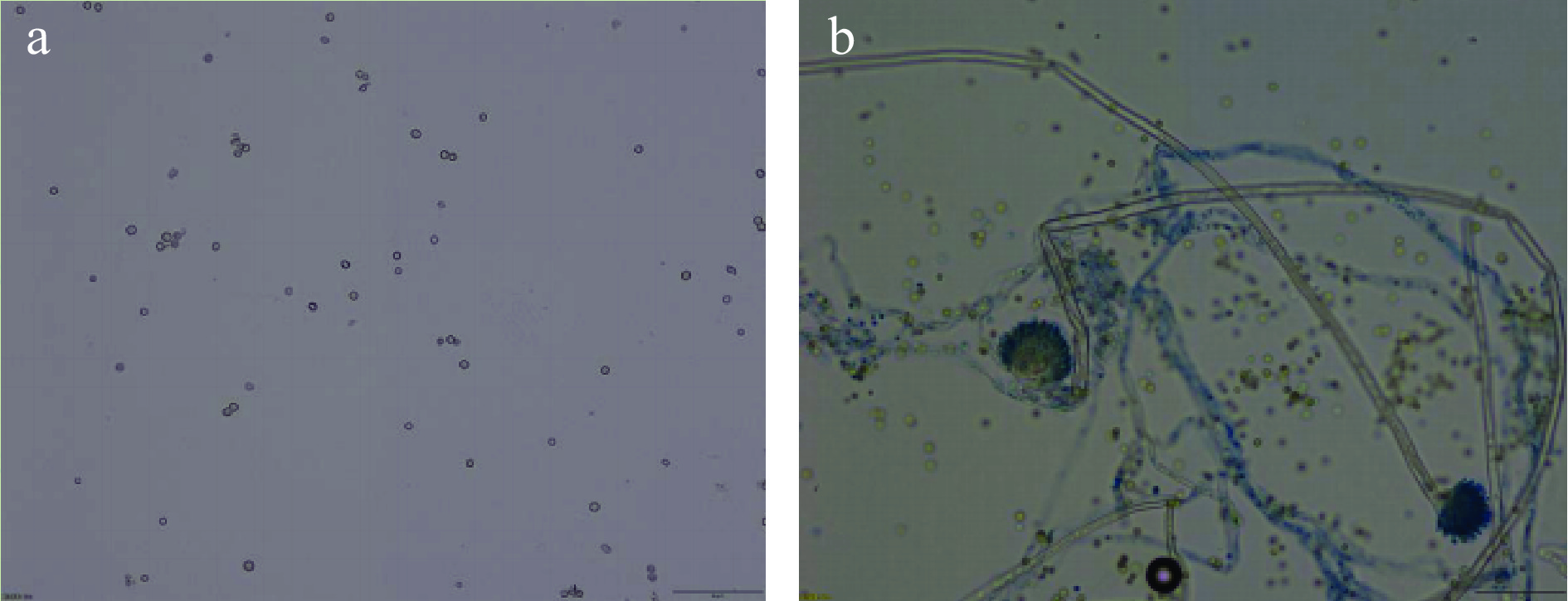
从霉变花生中分离纯化的菌株HB2在麦芽汁琼脂培养基上培养10~12 d后,覆盖全皿;质地呈丝绒状或絮状,生长较稀疏,起初为黄绿色,近于黄橄榄色,后变为淡褐橄榄色,菌落反面呈现不同程度的黄色,如图1a、图1b。分生孢子形态为头球形,后呈辐射形,散乱,分生孢子梗生自基质或气生菌丝,孢梗径长可达3500 μm或更长,直径为5.5~20 μm,生于气生菌丝者较短,壁通常粗糙,也有近于光滑者;顶囊近球形或烧瓶形,全面或四分之三表面可育;产孢结构单层或双层,甚至同一顶囊上两种情况兼有,梗基(8.0~14)μm×(3.5~5.0)μm,偶有多育现象,瓶梗(8.0~15)μm×(3.0~5.0)μm。其次,分生孢子发育球形至近球形(3.6~5.0)μm×(8.6~9.6)μm,或椭圆形至洋梨形(4.8~9.6)μm×(4.0~4.8)μm,壁近于光滑或稍粗糙。如图2a、图2b。对照《真菌鉴定手册》中黄曲霉(Aspergillus flavus)的菌落特征及其它显微形态特征,初步鉴定菌株HB2为黄曲霉(Aspergillus flavus)。
2.1.2 分子生物学鉴定
菌株HB2测序得到的ITS序列和benA序列分别为509 bp和463 bp,用blast程序在Genebank中与已登录的序列进行核苷酸同源性比较,该菌的ITS序列和benA序列与Aspergillus flavus(黄曲霉)同源性达99.41%和100%。基于ITS序列邻接法构建得到的系统发育树,结果如图3。黄曲霉素测定结果显示其含有黄曲霉素B1,质量浓度为3.4×103 μg·kg−1(纯湿菌体)。结合其培养特征及显微形态特征,确定菌株HB2为黄曲霉(Aspergillus flavus)。
2.2 山苍子精油对HB2菌抑菌活性
山苍子精油溶液会在PDA培养基中扩散,使其周围的菌生长发育受到一定的抑制进而形成了一个透明的圈层,即为抑菌圈[23]。不同浓度山苍子精油处理下的抑菌圈大小见表1,试验结果表明,山苍子精油对黄曲霉有明显的抑制作用,随着浓度的增加,抑菌圈明显扩大。当山苍子精油体积分数在3.13~25.00 μL·mL−1时,抑菌圈直径等级属于中度敏感(10~15 mm),山苍子精油体积分数在50 μL·mL−1以上时,属于最敏感。当为体积分数80 μL·mL−1时由于三个滤纸片中精油的扩散作用整个平板已无菌生长。
表 1 山苍子精油浓度对黄曲霉抑菌圈的影响Table 1. The bacteriostasis diameters of Litsea cubeba essential oil concentration on Aspergillus flavus体积分数(μL·mL−1) 0 3.13 6.25 12.50 25.00 50.00 80.00 100.00 抑菌圈直径(mm) 6.00±0.25 10.23±1.42 12.34±2.51 14.67±2.60 15.00±3.36 17.17±2.64 − − 注:“−”表示无菌生长;抑菌圈直径>15 mm为最敏感;10~15 mm为中等程度敏感;7~9 mm时为低等程度敏感;无抑菌者为不敏感[24]。 通过抑菌率定量研究山苍子精油对黄曲霉菌的抑制能力,表2试验结果显示,山苍子精油能够明显抑制黄曲霉的生长,随着浓度的增大抑菌率逐渐增强,精油浓度和抑菌率的多项式回归方程为y=−143.49x2+222.37x+17.032,R2=0.9395。当体积分数为0.800 μL·mL−1时,抑菌率达100%,即山苍子精油对黄曲霉的MIC值为0.800 μL·mL−1。
表 2 平板法测山苍子精油浓度对黄曲霉的抑制效果Table 2. Inhibitory effect of Litsea cubeba essential oil concentration on Aspergillus flavus by plate method体积分数(μL·mL−1) 0.038 0.075 0.150 0.300 0.600 0.800 1.000 1.200 抑菌率(%) 29.21±2.03 40.45±2.11 58.43±1.68 70.79±5.21 92.13±2.74 100±0 100±0 100±0 2.3 山苍子精油对孢子萌发的影响
由表3试验结果可知,山苍子精油能有效抑制黄曲霉孢子的萌发和芽管的伸长。随着山苍子精油浓度的增加,孢子萌发率降低,且芽管的长度也减小。对照组的萌发率和芽管长度分别为85.22%和123.8 μm,当精油浓度为0.060 μL·mL−1时萌发率和芽管长度分别为1.90%和8.04 μm,山苍子精油浓度为0.080 μL·mL−1时孢子萌发全部受到抑制。
表 3 山苍子精油浓度对黄曲霉孢子萌发率和芽管长度的影响Table 3. Effects of Litsea cubeba essential oil concentration on spore germination and germ tube elongation of Aspergillus flavus体积分数(μL·mL−1) 0 0.013 0.025 0.030 0.040 0.050 0.060 0.080 萌发率(%) 85.22±2.95 71.50±2.30 49.76±3.48 28.79±3.78 25.87±0.75 6.19±1.66 1.90±4.23 0 芽管长度(μm) 123.80±3.74 108.90±1.25 56.70±2.63 35.50±5.01 24.30±3.22 15.20±0.43 8.04±2.98 − 2.4 山苍子精油对菌体生长量和黄曲霉素B1产生的影响
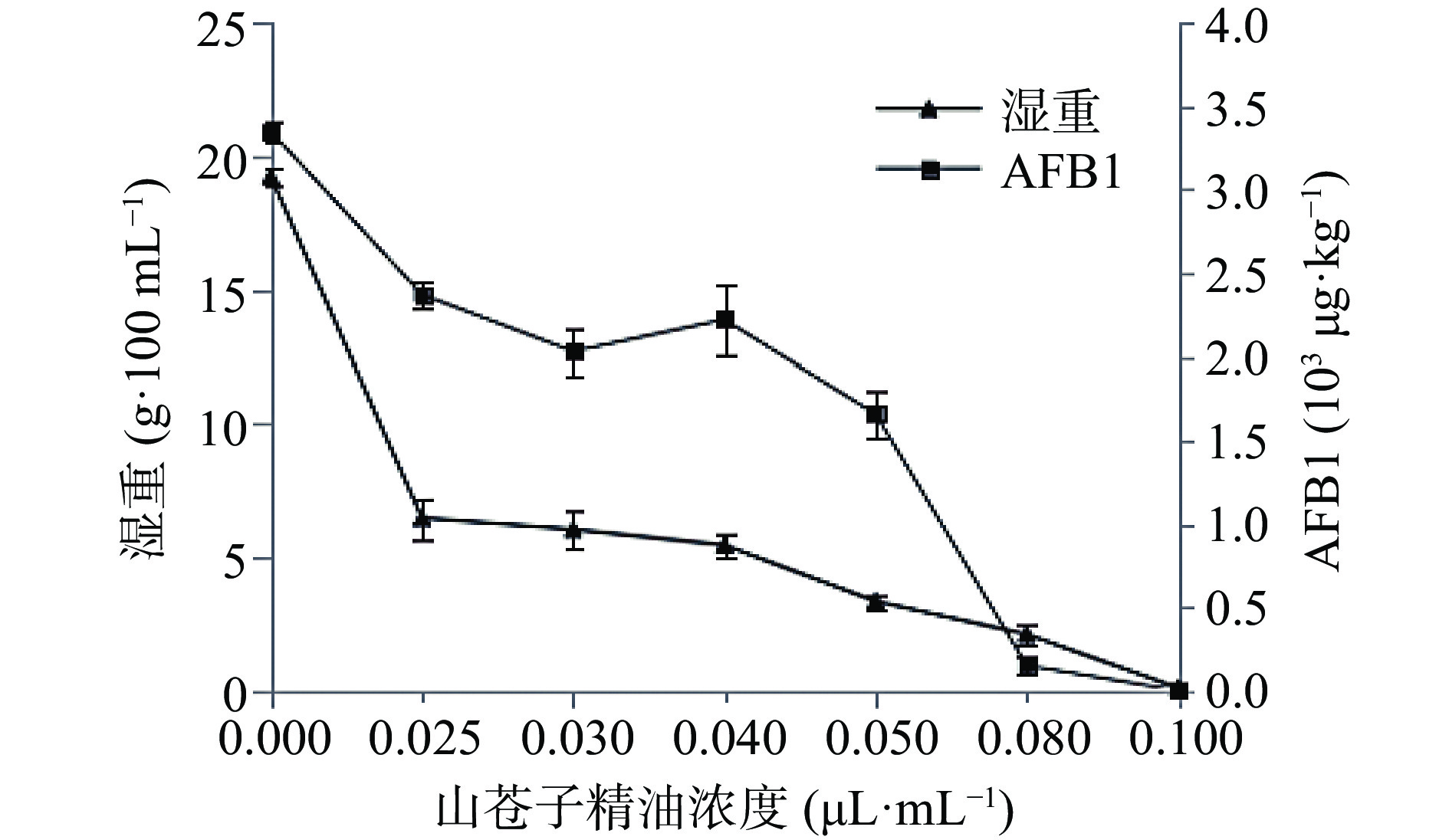
由图4可见,在PDA培养液中随着山苍子精油浓度的增加,菌体的生长量明显下降,当培养液中山苍子精油的体积分数为0.100 μL·mL−1时肉眼看不到菌丝,取培养5 d后山苍子精油处理浓度≥0.100 μL·mL−1的培养液于PDA平板涂布培养后,处理体积分数为0.100 μL·mL−1培养液有零星菌落,其他浓度无菌生长。相同重量菌丝体的黄曲霉素B1的质量浓度也随精油浓度的增加急剧下降,对照组黄曲霉素B1的质量浓度为3.35×103 μg·kg−1,当山苍子精油体积分数为0.080 μL·mL−1时,黄曲霉素B1的质量浓度下降至0.15×103 μg·kg−1,下降率为95.5%。因此,山苍子精油可抑制黄曲霉的生长和产毒以降低或阻断黄曲霉继续危害食品的可能。
2.5 山苍子精油对细胞膜渗透性的影响
溶液电导率、还原糖利用率和菌体蛋白质含量随山苍子精油浓度的变化如图5~图7所示。随着山苍子精油作用浓度的增加,溶液电导率从对照组1250 μs·cm−1逐渐增加至1720 μs·cm−1(0.040 μL·mL−1),随着菌体生长量减少,电导率稍有下降。蛋白质含量和还原糖利用率随处理浓度的增加而下降,当山苍子精油体积分数在0.100 μL·mL−1时,培养液中肉眼可见极少量的菌体,还原糖利用率从对照组的96.0%下降到14.0%,在山苍子精油体积分数0.025、0.050、0.100 μL·mL−1处理下菌体蛋白质含量分别为11.44、3.32、0 g·100 g−1。由试验结果推测山苍子精油破坏了黄曲霉细胞膜的结构,改变膜的通透性,导致细胞内重要离子或物质流出,细胞对营养物质的利用率下降,引起细胞死亡,从而达到抑制黄曲霉的效果。该结论与 Kiran 等[25]、Akash 等[26]和李璐等[27]关于植物精油,如肉桂精油、孜然精油、粗果芹精油等对黄曲霉菌细胞膜的破坏影响结论一致,黄曲霉受植物精油处理导致细胞膜破坏,不仅影响其对营养物质的吸收利用,而且细胞内部的胞液和蛋白质等物质会泄漏到胞外溶液中,导致胞外溶液的电导率和蛋白质等物质发生变化。
2.6 山苍子精油对细胞酶活性的影响
NADP-苹果酸脱氢酶(NADP-MDH)和琥珀酸脱氢酶(SDH)是生物体内呼吸代谢途径三羧酸循环(TCA)中重要的酶,有氧条件下葡萄糖经过三羧酸循环可彻底氧化为H2O和CO2,抑制糖的氧化分解便可阻碍生物体的新陈代谢,从而导致生物死亡[28]。通过测定黄曲霉呼吸代谢途径中重要的酶活性,可以反映山苍子精油对黄曲霉呼吸代谢途径的抑制结果。按照1.2.8进行抑菌实验,菌体内NADP-MDH和SDH活性变化的实验结果如表4所示。
表 4 山苍子精油对菌体酶活性的影响Table 4. Effect of Litsea cubeba essential oil on bacterial enzyme activity山苍子油浓度(μL·mL−1) 0 0.03 0.05 NADP-MDH(nmol/min/g鲜重) 4565.3±40.05 4051.0±29.65 727.0±31.54 SDH(nmol/min/g鲜重) 27.4±2.02 12.5±2.98 3.1±0.53 实验结果表明,经山苍子精油处理后,黄曲霉菌体内NADP-MDH和SDH的活性均呈下降趋势。当山苍子精油体积分数为0.05 μL·mL−1时,NADP-MDH酶活性由对照组4565.3 nmol/min/g鲜重下降至727.0 nmol/min/g鲜重,该酶活性下降率为84.1%;SDH酶活性由对照组27.4 nmol/min/g鲜重下降至3.1 nmol/min/g鲜重,该酶活性下降率为88.7%。因此,山苍子精油抑制NADP-MDH和SDH酶活性,阻碍三羧酸循环和能量代谢,从而影响黄曲霉的生长和代谢功能。
3. 结论
结合形态和分子生物学鉴定明确了从花生中分离纯化的HB2菌种为黄曲霉(Aspergillus flavus)。该菌产生强致癌物质黄曲霉毒素B1,对人体危害极大。本文体外抑菌活性试验结果表明,浓度是山苍子油体外抑菌效力的决定要素之一,随精油浓度增大抑菌圈明显增大,最低抑菌体积分数(MIC)为0.800 μL·mL−1。精油和黄曲霉菌接触方式的不同对抑菌活性影响较大,本研究表明精油在培养基(液)中与菌体直接混合接触抑菌、防霉效果显著。山苍子精油主要成分为柠檬醛,具有广泛的抗真菌和抗细菌活性,从本试验可看出,经山苍子精油处理黄曲霉孢子萌发和牙管生长受到抑制,进而影响菌体量的生长和黄曲霉素B1的产生。研究结果可为开发切实有效的防霉抑菌剂和防治方式提供参考依据。从山苍子精油处理后菌液的电导率上升、还原糖利用率和蛋白质含量下降、菌体内NADP-MDH和SDH活性减小的试验结果证明山苍子精油可破坏细胞膜结构,从而影响细胞的稳定性和能量代谢。山苍子精油抑制黄曲霉生长和产毒素机理较为复杂:山苍子精油中的醛类、酚类等物质破坏黄曲霉细胞壁和细胞膜,引起胞内无机离子的失衡;影响黄曲霉生长和产毒相关基因的正常合成和表达;破坏线粒体结构,影响细胞的能量代谢等,下一步将通过扫描电镜和透射电镜观察,培养基质碱性磷酸酶的活性,胞外蛋白和菌体蛋白的变化,编码生物膜和产毒相关基因变化等形态学、分子分析等方面进一步探讨山苍子精油对黄曲霉的抑制作用机理。
-
表 1 山苍子精油浓度对黄曲霉抑菌圈的影响
Table 1 The bacteriostasis diameters of Litsea cubeba essential oil concentration on Aspergillus flavus
体积分数(μL·mL−1) 0 3.13 6.25 12.50 25.00 50.00 80.00 100.00 抑菌圈直径(mm) 6.00±0.25 10.23±1.42 12.34±2.51 14.67±2.60 15.00±3.36 17.17±2.64 − − 注:“−”表示无菌生长;抑菌圈直径>15 mm为最敏感;10~15 mm为中等程度敏感;7~9 mm时为低等程度敏感;无抑菌者为不敏感[24]。 表 2 平板法测山苍子精油浓度对黄曲霉的抑制效果
Table 2 Inhibitory effect of Litsea cubeba essential oil concentration on Aspergillus flavus by plate method
体积分数(μL·mL−1) 0.038 0.075 0.150 0.300 0.600 0.800 1.000 1.200 抑菌率(%) 29.21±2.03 40.45±2.11 58.43±1.68 70.79±5.21 92.13±2.74 100±0 100±0 100±0 表 3 山苍子精油浓度对黄曲霉孢子萌发率和芽管长度的影响
Table 3 Effects of Litsea cubeba essential oil concentration on spore germination and germ tube elongation of Aspergillus flavus
体积分数(μL·mL−1) 0 0.013 0.025 0.030 0.040 0.050 0.060 0.080 萌发率(%) 85.22±2.95 71.50±2.30 49.76±3.48 28.79±3.78 25.87±0.75 6.19±1.66 1.90±4.23 0 芽管长度(μm) 123.80±3.74 108.90±1.25 56.70±2.63 35.50±5.01 24.30±3.22 15.20±0.43 8.04±2.98 − 表 4 山苍子精油对菌体酶活性的影响
Table 4 Effect of Litsea cubeba essential oil on bacterial enzyme activity
山苍子油浓度(μL·mL−1) 0 0.03 0.05 NADP-MDH(nmol/min/g鲜重) 4565.3±40.05 4051.0±29.65 727.0±31.54 SDH(nmol/min/g鲜重) 27.4±2.02 12.5±2.98 3.1±0.53 -
[1] RUSHING B R, SELIM M I. Aflatoxin B1: A review on metabolism, toxicity, occurrence in food, occupational exposure, and detoxi fication methods[J]. Food and Chemical Toxicology,2019,124:81−100. doi: 10.1016/j.fct.2018.11.047
[2] 余晓琴. 相关标准中黄曲霉毒素限量解读[N]. 中国市场监管报, 2019-09-26(8). YU X Q. Interpretation of aflatoxin limit in relevant standards[N]. China Market Supervision News, 2019-09-26(8).
[3] 巩桂花, 徐淑芝, 于淼, 等. 粮食储藏过程中黄曲霉毒素检测与去除研究进展[J]. 粮食与油脂,2019,32(3):6−8. [GONG G H, XU S Z, YU M, et al. Research progress on detection and removal of aflatoxin in grain storage[J]. Cereals & Oils,2019,32(3):6−8. doi: 10.3969/j.issn.1008-9578.2019.03.003 [4] 徐纬昊, 刘艳明, 刘建龙. 降低农产品中黄曲霉毒素的技术[J]. 中国果菜,2019,39(12):60−63. [XU W H, LIU Y M, LIU J L, et al. Technology of reducing aflatoxin in feed ingredients[J]. China Fruit & Vegetable,2019,39(12):60−63. doi: 10.19590/j.cnki.1008-1038.2019.12.014 [5] 李少晖, 任丹丹, 谢云峰, 等. 食品中黄曲霉毒素检测方法研究进展[J]. 食品安全质量检测学报,2015,6(4):1107−1115. [LI S H, REN D D, XIE Y F, et al. Research progress on determination methods of aflatoxins in foodstuffs[J]. Journal of Food Safety & Quality,2015,6(4):1107−1115. doi: 10.19812/j.cnki.jfsq11-5956/ts.2015.04.002 [6] 杨海莹, 张应龙, 丁新丽, 等. 植物精油在控制真菌及其毒素方面的应用进展[J]. 粮食与饲料工业,2014(5):23−26. [YANG H Y, ZHANG Y L, DING X L, et al. Advances in the application of plant essential oils in the control of fungi and their toxins[J]. Cereal & Feed Industry,2014(5):23−26. doi: 10.7633/j.issn.1003-6202.2014.05.006 [7] REZENDE D A D C S, CARDOSO M D G, ALVES E, et al. Effect of the essential oils of Satureja montana L., Myristica fragrans H. and Cymbopogon flexuosus S. on mycotoxin-producing Aspergillus flavus and Aspergillus ochraceus antifungal properties of essential oils[J]. FEMS Microbiology Letters,2021,368(19):137−142. doi: 10.1093/femsle/fnab137
[8] WEI H, CL B, JD C, et al. Antibacterial activity and mechanism of Litsea cubeba essential oil against methicillin-resistant Staphylococcus aureus (MRSA)[J]. Industrial Crops and Products,2019,130:34−41. doi: 10.1016/j.indcrop.2018.12.078
[9] KS A, SSB C, NMB C. Effects of bamboo sachets containing Litsea cubeba oil on the prevention of mold for extending the shelf life of dried fish, its reusability, and action mechanisms[J]. LWT, 2022, 154.
[10] WU H, ZHANG M, YANG Z. Repellent activity screening of 12 essential oils against Aedes albopictus skuse: Repellent liquid preparation of mentha arvensis and Litsea cubeba oils and bioassay on hand skin[J]. Industrial Crops and Products,2019,128:464−470. doi: 10.1016/j.indcrop.2018.11.015
[11] 向育君, 王海华, 孙远东. 山苍子油应用研究进展[J]. 中国粮油学报,2020,35(8):186−192. [XIANG Y J, WANG H H, SUN Y D. Review on application of Litsea cubeba essential oils[J]. Journal of the Chinese Cereals and Oils Association,2020,35(8):186−192. doi: 10.3969/j.issn.1003-0174.2020.08.029 [12] 郑自强, 卫春会, 张立伟, 等. 中高温大曲中霉菌的分离及其麸曲制备[J]. 现代食品科技,2022,38(1):165−172. [ZHENG Z Q, WEI C H, ZHANG L W, et al. Isolation of mold from medium high temperature daqu and preparation of fuqu[J]. Modern Food Science and Technology,2022,38(1):165−172. doi: 10.13982/j.mfst.1673-9078.2022.1.0472 [13] 魏景超. 真菌鉴定手册[M]. 上海: 上海科学技术出版社, 1979. WEI J C. Fungi identification manual[M]. Shanghai: Shanghai Science and Technology Press, 1979.
[14] HUANG Y G, WU Q, XU Y. Isolation and identification of a black Aspergillus strain and the effect of its novel protease on the aroma of moutai-flavoured liquor[J]. Journal of the Institute of Brewing,2014,120(3):268−276. doi: 10.1002/jib.135
[15] 陈永. 玫瑰茄花萼浸提液抑菌活性研究[J]. 广西民族师范学院学报,2017,34(3):152−154. [CHEN Y. Study on bacteriostatic activity of extracts from roselle calyx[J]. Journal of Guangxi Normal University for Nationalities,2017,34(3):152−154. doi: 10.3969/j.issn.1674-8891.2017.03.045 [16] 刘瑞玲, 郜海燕, 陈杭君, 等. 红肉火龙果采后病原菌分离鉴定与植物精油抑菌研究[J]. 农业机械学报,2018,49(8):338−345. [LIU R L, GAO H Y, CHEN H J, et al. Isolation, Identification and inhibition of pathogens from red pitaya fruit during storage[J]. Transactions of the Chinese Society for Agricultural Machinery,2018,49(8):338−345. doi: 10.6041/j.issn.1000-1298.2018.08.040 [17] 李敏, 杨帆, 刘春来, 等. 五株虫生真菌生物学特性及拮抗潜力初步研究[J]. 黑龙江农业科学,2021(8):42−47. [LI M, YANG F, LIU C L, et al. Primary study on biological characteristics and antagonistic potentiality of five strains of entomogenous fungi[J]. Heilongjiang Agricultural Sciences,2021(8):42−47. [18] 及华, 张海新, 李运朝, 等. 含水量对玉米粉贮藏期黄曲霉生长及黄曲霉毒素B1 积累的影响[J]. 食品安全质量检测学报,2018,9(22):5863−5866. [JI H, ZHANG H X, LI Y C, et al. Effects of water content on growth of Aspergillus flavus and accumulation of aflatoxin B1 in corn flour during storage[J]. Journal of Food Safety and Quality,2018,9(22):5863−5866. [19] 杨钦滟. 山鸡椒油的抑菌作用及应用研究[D]. 重庆: 西南大学, 2017. YANG Q Y. Study on the bactericidal action and application of Litsea cubeba[D]. Chongqing: Southwest University, 2017.
[20] 王莉丽, 梅文泉, 陈兴连, 等. 3,5-二硝基水杨酸比色法测定大米中水溶性糖含量[J]. 中国粮油学报,2020,35(9):168−173. [WANG L L, MEI W Q, CHEN X L, et al. Determination of water-soluble sugar in rice by 3,5-dinitrosalicylic acid colorimetric method[J]. Journal of the Chinese Cereals and Oils Association,2020,35(9):168−173. [21] 青文哲. 固态发酵油茶籽干渣产单细胞蛋白的研究[D]. 湖南: 湖南农业大学, 2015 . QING W Z. Study on single cell protein produced by solid-state fermentation from oil-camellia cake[D]. Hunan: Hunan Agricultural University, 2015 .
[22] 黎晓茜. 茉莉酸甲酯对 Botryosphaeria dothidea 的抑菌作用及其代谢酶活性的影响[D]. 贵州: 贵州大学, 2019 . LI X Q. Effect of methyl jasmonate on bacteriostatic action and metabolic enzyme activity of Botryosphaeria dothidea[D]. Guizhou: Guizhou University, 2019 .
[23] AMRANI S E, EL A, LALAMI O, et al. Evaluation of antibacterial and antioxidant effects of cinnamon and clove essential oils from madagascar[J]. Materials Today: Proceedings,2019,13:762−770. doi: 10.1016/j.matpr.2019.04.038
[24] 闫红秀, 刘香萍, 任乃芃, 等. 肉桂精油及其主要组分对饲料中常见真菌的抑菌活性的研究[J]. 饲料工业,2022,43(17):47−53. [YAN H X, LIU X P, REN N P, et al. Study on antibacterial activity of cinnamon essential oil and its main components against common fungi in feed[J]. Siliao Gongye,2022,43(17):47−53. doi: 10.13302/j.cnki.fi.2022.17.009 [25] KIRAN S, ANUPAM K, BHANU P. Assessment of preservative potential of cinnamomum zeylanicum blume essential oil against food borne molds, aflatoxin B1 synthesis, its functional properties and mode of action[J]. Innovative Food Science and Emerging Technologies,2016:37.
[26] AKASH K, BHANU P, PRASHANT K M, et al. Trachyspermum ammi L: Essential oil as plant based preservative in food system[J]. Industrial Crops & Products,2015,69:104−109.
[27] 李路, 李蔚, 车金鑫, 等. p-茴香醛抑制柑橘酸腐病菌的作用机制[J]. 食品科学,2020,41(9):133−138. [LI L, LI W, CHE J X, et al. Antifungal activity and mechanism of p-anisaldehyde aganist geotrichum citri-aurantii[J]. Food Science,2020,41(9):133−138. doi: 10.7506/spkx1002-6630-20190523-269 [28] TANG X, SHAO Y, TANG Y, et al. Antifungal activity of essential oil compounds (geraniol and citral) and inhibitory mechanisms on grain pathogens (Aspergillus flavus and Aspergillus ochraceus)[J]. Molecules (Basel, Switzerland),2018,23(9):2599−2607.
-
期刊类型引用(3)
1. 蒋美君,张启元,蒙扬辉,白科,张兴志,农珍珍,钟方杰,朱鹏,彭金霞,官俊良,严雪瑜. 香港牡蛎BMP7基因克隆与表达. 广东海洋大学学报. 2023(04): 129-136 .  百度学术
百度学术
2. 周晖,汤保贵,伍栩民,彭梓峰,钟培贵,于鸽,孔繁森. 香港牡蛎在综合养殖池塘育肥期间不同组织的碳、氮稳定同位素周转. 热带海洋学报. 2023(04): 125-132 .  百度学术
百度学术
3. 汤保贵,周晖,赵力强,伍栩民,彭梓峰,钟培贵,于鸽. 香港牡蛎在异地基围育肥时的生长、形态及体成分变化. 水生生物学报. 2023(11): 1762-1768 .  百度学术
百度学术
其他类型引用(1)






 下载:
下载:




 下载:
下载:



