Determination of Chlorate and Perchlorate Amounts in Meat by High Performance Liquid Chromatography-Tandem Mass Spectrometry
-
摘要: 建立了高效液相色谱-串联质谱法同时测定肉类中氯酸盐和高氯酸盐的分析方法。样品经乙腈-水(13:7,V:V)提取后离心,上清液经PRiME HLB固相萃取柱净化,Acclaim Trinity P1复合离子交换柱分离,以乙腈及20 mmol/L乙酸铵为流动相进行梯度洗脱,串联质谱分析中采用电喷雾正离子源和多反应监测模式,内标法定量。结果表明,氯酸盐和高氯酸盐分别在2~200.0 ng/mL、1~100.0 ng/mL范围内呈现良好线性关系,决定系数分别为0.9983和0.9998,方法的定量限分别为2.0、1.0 μg/kg。氯酸盐和高氯酸盐分别在三种肉类四个添加水平6.0、20、40、200 μg/kg和3.0、10、20、100 μg/kg的加标回收率为91.0%~105.7%和94.2%~110.5%,相对标准偏差为1.8%~9.7%和0.7%~9.4%。本方法具有操作简单、灵敏度高、稳定性好等优点,可很好地满足肉中氯酸盐、高氯酸盐的检测。
-
关键词:
- 氯酸盐 /
- 高氯酸盐 /
- 高效液相色谱-串联质谱法 /
- 肉类
Abstract: A method for simultaneous determination of chlorate and perchlorate amounts in meat by high performance liquid chromatography-tandem mass spectrometry was developed. Samples were extracted with acetonitrile/water (13:7, V:V ) and centrifuged. The obtained supernatants were purified on a PRiME HLB solid phase extraction column, followed by an Acclaim Trinity P1 ion exchange column with the gradient elution of acetonitrile and 20 mmol/L ammonium acetate as the mobile phase to afford chlorate and perchlorate. MS/MS was performed in ESI+ and multiple reaction monitoring mode with an internal standard for quantification. The results showed chlorate and perchlorate had calibration curves with good linearity in the ranges of 2~200.0 ng/mL and 1~100.0 ng/mL respectively, with corresponding correlation coefficients being 0.9983 and 0.9998. The detection limits of the method were 2.0 and 1.0 μg/kg, respectively. The recovery rates of chlorate and perchlorate were 91.0%~105.7% and 94.2%~110.5% respectively, at the addition levels of 6.0, 20, 40, 200 μg/kg, and 3.0, 10, 20, 100 μg/kg. The relative standard deviations for chlorate and perchlorate were 1.8%~9.7% and 0.7%~9.4% respectively. This method would be easy to use and has high detection sensitivity and good stability, and could well meet the requirements of determining chlorate and perchlorate amounts in meat. -
氯酸盐和高氯酸盐均为对人体健康有不良影响的含氯无机盐,其二者在食品中的污染和残留引起广泛的关注。欧盟食品安全局(European Food Safety Authority,EFSA)分别于2014、2015年评价了食品中高氯酸盐、氯酸盐对公众健康的危害,发现二者的慢性暴露均会使甲状腺吸收碘受到长期抑制,导致多结节性甲状腺肿的发生,对于高氯酸盐和氯酸盐所建立每日耐受摄入量分别为0.3和3 μg/kg bw[1-2]。目前,国内尚未制定食品中氯酸盐与高氯酸盐的限值标准,因此对其在食品中的残留量进行监控非常必要。
食品中氯酸盐和高氯酸盐的检测方法很多,有液相色谱-串联质谱法、离子色谱串联质谱法[3-4]及离子色谱法[5-6]等。因食品成分复杂,基质干扰严重,氯酸盐和高氯酸盐较多采用高效液相色谱-串联质谱法这种检测灵敏度高和选择性好的方法进行检测。氯酸盐和高氯酸盐的水溶性强,对于二者的残留检测多集中在生活饮用水[7]、果蔬[8-9]、液态乳[10-12]、奶粉[12-15]等基体,而对于其在水分含量少,蛋白质、脂肪含量较高的肉类中残留往往容易被忽视。本文在已有研究基础之上,针对基体复杂且含水量少的肉类中氯酸盐和高氯酸盐残留量进行探究,选用国内常见且消费量大的鸡肉、鸭肉、猪肉为检测对象,采用高效液相色谱-串联质谱分析技术结合同位素内标定量检测手段,建立一种快速、高效、准确的检测方法,为肉类中氯酸盐及高氯酸盐污染状况监控和检测提供科学依据和技术支持。
1. 材料与方法
1.1 材料与仪器
氯酸钾标准溶液、高氯酸钾标准溶液(1000 μg/mL,以氯酸根离子、高氯酸根离子计) 美国Inorganic Ventures公司;氯酸盐同位素内标氯酸盐−18O3标准溶液(200 μg/mL,以氯酸根−18O3离子计) 坛墨质检科技股份有限公司;高氯酸盐同位素内标高氯酸盐−18O4标准溶液(100 μg/mL,以高氯酸根−18O4离子计) 美国剑桥CIL公司;乙腈、甲醇、甲酸 HPLC级,上海安谱实验科技股份有限公司;甲酸铵、乙酸铵 HPLC级,美国Sigma公司;猪肉、鸡肉、鸭肉 冷冻肉样品,超市;实验室用水 均为超纯水;0.22 μm再生纤维素滤膜 上海安谱实验科技股份有限公司。
LC-1290-MS-6470 液相串联质谱联用仪器(配电喷雾负离子源ESI) 美国Agilent公司; AcclaimTM TrinityTM P1色谱柱(50 mm×2.1 mm,3 μm) 美国Thermo公司;AL204电子天平 瑞士梅特勒-托利多公司;T25DS25高速组织捣碎机 德国IKA公司;SORVALL ST16R高速离心机 美国Thermo公司;PRiME HLB固相萃取柱(3 cc/150 mg) 美国Waters公司。
1.2 实验方法
1.2.1 标准溶液的配制
1.2.1.1 混合标准储备液
10.0 mL容量瓶中准确加入0.2 mL氯酸钾标准液、0.1 mL高氯酸钾标准液,超纯水稀释并定容,配制的混合标准储备液中氯酸根离子、高氯酸根离子浓度分别为2.0、1.0 µg/mL,4 ℃保存。
1.2.1.2 混合同位素内标液
10.0 mL容量瓶中准确加入75 µL氯酸盐−18O3标准液及20 µL高氯酸盐−18O4标准液,超纯水稀释并定容,配制的混合同位素内标液中氯酸盐−18O3、高氯酸盐−18O4浓度分别为1500、200 ng/mL,4 ℃保存。
1.2.1.3 混合标准工作溶液
10只10 mL容量瓶中分别准确加入混合标准储备液0、10、25、50、75、100、250、500、750、1000 μL,再分别加入100 μL混合同位素内标液,用20 mmol/L甲酸铵-甲醇溶液(1:2,V:V)稀释并定容,配制成混合标准工作溶液系列。其中,氯酸盐−18O3、高氯酸盐−18O4浓度分别为15.0、2.0 ng/mL。氯酸根离子浓度依次为:0.00、2.00、5.00、10.0、15.0、20.0、50.0、100、150、200 ng/mL,高氯酸根离子浓度依次为:0.00、1.00、2.50、5.00、7.50、10.0、25.0、50.0、75.0、100 ng/mL。
1.2.2 样品前处理
取适量肉,切成小块,组织捣碎机捣碎后准确称取2.000 g置于50 mL具塞离心管中,加入200 μL混合同位素内标液,再准确加入7.0 mL超纯水,13.0 mL乙腈,混匀,10000 r/min均质30 s,于10000 r/min常温离心10 min获取上清液,吸取3.0 mL上清液,过PRiME HLB固相萃取柱及0.22 µm再生纤维素滤膜,弃去1 mL流出液,收集续滤液,供液相色谱-串联质谱仪测定。
1.2.3 色谱-质谱分析条件
1.2.3.1 色谱条件
色谱柱:Acclaim Trinity P1复合离子交换柱(50 mm×2.1 mm,3 μm),柱温:35 ℃;流动相:A为乙腈,B为20 mmol/L乙酸铵溶液;梯度洗脱程序:0~0.5 min,35% A;0.5~4.0 min,35% A~65% A;4.0~5.0 min,65%A~90% A;5.0~7.0 min,90% A;7.0~8.0 min,95% A~35% A;流速:0.5 mL/min;进样量:5 μL。
1.2.3.2 质谱条件
电喷雾离子源(ESI源);扫描方式:负离子模式扫描;毛细管电压:200 V;锥孔电压:60 V;离子化电压:4000.0 V;鞘气温度:350 ℃;脱溶剂温度:325 ℃;脱溶剂气流量:10 L/min;锥孔气流量:150 L/h;采用多反应监测(MRM)模式采集数据。
1.2.4 定性、定量方法
1.2.4.1 定性
按照优化后的实验条件测定待测样品和混合标准工作溶液,记录氯酸根离子、高氯酸根离子的色谱保留时间,若试样中检出与混合标准工作液中氯酸根离子、高氯酸根离子保留时间一致的色谱峰,且其定性离子与浓度相当的标准溶液中相应的定性离子的相对丰度相比在规定的偏差范围内,则确定试样中检出相应的目标物。
1.2.4.2 定量
如待测样品检出氯酸根离子或高氯酸根离子,则根据标准工作曲线按内标法以内标校正后的响应值计算目标物含量。
1.3 数据处理
数据分析软件使用QQQ Quantitative Analysis,绘图软件使用Qualitative Analysis 10.0。
2. 结果与分析
2.1 质谱条件优化
配制浓度为1.0 μg/mL的氯酸钾标准溶液,由于氯元素存在35Cl和37Cl两种同位素,在负离子模式条件下通过MS2 SCAN扫描母离子,能够观察到m/z为83和85两个明显的分子离子峰。分别以83和85作为Precursor Ion(母离子),在Product Ion模式下扫描二级质谱碎片离子。由于Cl-O键断裂失去氧原子,83(m/z)氯酸根生成碎片离子:[35ClO2]−、[35ClO]−、[35Cl]−,85(m/z)氯酸根离子裂解生成碎片离子[37ClO2]− 、[37ClO]− 、[37Cl]−,99(m/z)高氯酸根离子裂解生成碎片离子[35ClO3]−、[35ClO2]−、[35ClO]−、[35Cl]−,101(m/z)高氯酸根离子裂解生成碎片离子[37ClO3]−、[37ClO2]−、[37ClO]−、[37Cl]−,碎片离子的响应随着质荷比的降低而降低。考虑到氯元素独特的同位素特性,选取不同的母离子作定性,将会获得优越的特异性,能够极大程度地降低假阳性。故选取离子对83.0/67.0与85.0/69.0作为氯酸盐的定性离子对;99.0/83.0与101.0/85.0作为高氯酸盐的定性离子对。再经由自动优化软件获得最优的Fragmentor电压跟CE电压,采用MRM(多反应监测)模式采集数据,选取响应最好的定性离子对作定量离子,优化后的质谱参数见表1。
表 1 氯酸根离子、高氯酸根离子及其内标的质谱参数Table 1. MS parameters of chlorate, perchlorate and their internal standard化合物 母离子
(m/z)子离子
(m/z)锥孔电压
(V)碰撞能量
(eV)氯酸根离子 83.0* 67.0* 94 25 85.0 69.0 80 25 高氯酸根离子 99.0* 83.0* 136 30 101.0 85.0 80 29 氯酸根离子内标 89.0* 71.0* 80 25 高氯酸根离子内标 107.0* 89.0* 136 30 注:“*”为定量离子。 2.2 提取溶剂的选择
氯酸根离子和高氯酸根离子的水溶性很强,比较了常规的甲醇-水和乙腈-水两种提取试剂,回收率无显著差别。但在等待上机过程中,乙腈提取净化液始终保持澄清透明,而甲醇提取液则容易出现白色絮状沉淀。这可能是因为甲醇对蛋白质的沉淀效果弱于乙腈[16],没有沉淀完全后续又发生沉淀。如检测大批量样品时,应避免使用甲醇做提取液,以避免大量的絮状物可能导致的堵针现象发生。肉类中蛋白质含量较高,乙腈对蛋白质沉淀能力强,乙腈-水是适合的提取试剂。进一步考察乙腈和水的比例,分别用三种不同体积比乙腈:水(11:9、13:7、15:5,V:V)做提取试剂,实验结果见表2。结果表明三者对高氯酸根离子的提取没有显著差别,对氯酸根离子提取效率有显著差别,乙腈:水(13:7,V:V)氯酸根离子的回收率最高,故最终选择提取试剂为乙腈:水(13:7,V:V)。
表 2 不同体积比乙腈-水提取后氯酸根离子和高氯酸根离子及其内标的回收率Table 2. Recovery rates of chlorate, perchlorate and their internal standard extracted with acetonitrile-water at different volume ratios乙腈-水体
积比(V:V)回收率(%) 氯酸根离子 氯酸根
离子内标高氯酸根离子 高氯酸根
离子内标11:9 45.71 84.65 98.20 94.21 13:7 103.04 105.47 102.27 102.47 15:5 83.97 90.79 104.89 103.17 2.3 固相萃取柱的选择
对比了C18和PRiME HLB两种固相萃取柱,结果表明对于高氯酸根离子,回收率无显著差别,但对于氯酸根离子而言,C18回收率略差,且响应值只有PRiME HLB的一半。而且PRiME HLB小柱,无需活化,操作简便,所以选取PRiME HLB小柱作为固相萃取小柱。另外PRiME HLB小柱对目标物有少量吸附,有一定的过柱样品量之后,目标物的浓度趋于稳定。分别收集第1、2、3 mL的净化液进行测定,第2 mL和第3 mL响应值无明显差异,第1 mL响应值则明显小,使用时应该弃掉第1 mL的流出液,收集后续滤液用于测定。
2.4 色谱流动相选择
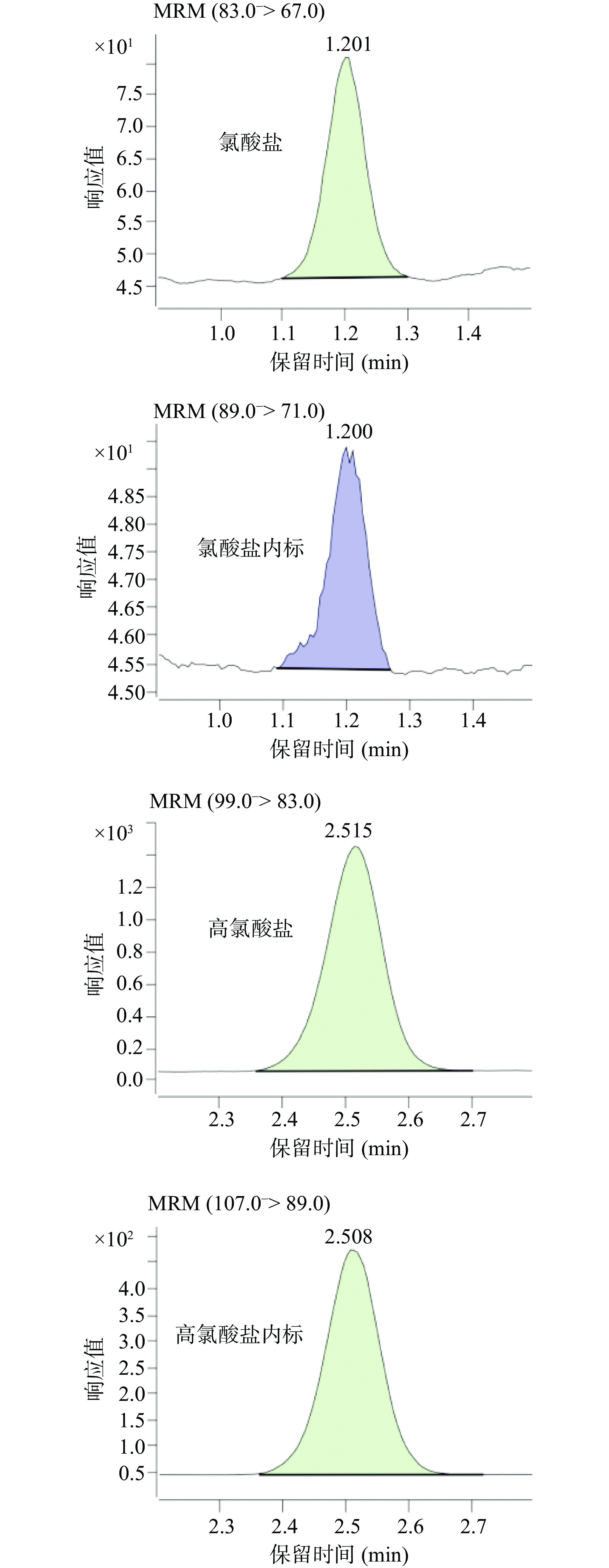
比较了甲醇-水、乙腈-水两种流动相,以色谱峰的峰形、半峰宽或拖尾因子来判断,乙腈-水优于甲醇-水。从响应值来看,采用乙腈-水作为流动相,氯酸根离子、高氯酸根离子及二者的内标物的响应值均高于甲醇-水20%左右。添加铵盐于乙腈-水流动相中能进一步改善氯酸根离子及高氯酸根离子的峰形,添加浓度均为20 mmol/L时,添加乙酸铵目标物的响应值是添加甲酸铵的3倍左右。进一步考察乙酸铵的不同浓度的影响,随着乙酸铵浓度从20 mmol/L逐步增加至100 mmol/L,目标物响应值亦逐步降低,保留时间也前移,这可能是由于乙酸铵浓度越高对目标物的离子化效率的抑制作用越强导致的。最终选择20 mmol/L乙酸铵-乙腈作为流动相,在此条件下,氯酸根离子及高氯酸根离子的保留时间分别为1.2和2.5 min,空白基质加标(氯酸根离子40 μg/kg,高氯酸根离子20 μg/kg)样品的色谱图见图1。
2.5 工作曲线、检出限和定量限
配制系列浓度梯度混合标准溶液,按上述优化条件上机测定后,以定量离子峰面积(y)为纵坐标,标准溶液浓度(x)为横坐标作图,得到线性回归方程。空白样品中添加混合标准溶液,以定量离子信噪比(S/N)大于3的浓度为检出限,以定量离子信噪比(S/N)大于10的浓度为定量限。氯酸根离子和高氯酸根离子的线性范围、线性方程、决定系数、检出限及定量限如表3所示。结果表明,氯酸根离子和高氯酸根离子在各自线性范围内线性关系良好,检出限低,方法灵敏度高。
表 3 氯酸根离子和高氯酸根离子线性范围、线性回归方程、决定系数、检出限和定量限Table 3. Linear range, linear equation, determination coefficient, detection limit and quantitative limit of chlorate and perchlorate化合物 线性范围(ng/mL) 线性方程 决定系数(R2) 检出限(μg/kg) 定量限(μg/kg) 氯酸根离子 2~200.0 y=0.119132x+
0.0601790.9983 0.6 2.0 高氯酸根离子 1~100.0 y=0.334560x+
0.1019390.9998 0.3 1.0 2.6 加标回收率和精密度
分别向猪肉、鸡肉和鸭肉3 种基质空白样品,添加4个添加水平的目标物,各添加水平分别做6次平行实验。按建立的实验方法进行分析测定,加标回收率和相对标准偏差RSD的计算结果如表4所示。结果显示,在4个加标水平下,2种目标物在3种基质中的平均回收率在91.0%~110.5%之间,RSD在0.7%~9.7%之间,表明方法准确度高,重复性好,适用于测定肉类样品中的氯酸盐和高氯酸盐,满足日常检测需求。
表 4 肉类样品加标回收率(n=6)Table 4. Spiked recoveries of meat samples (n=6)样品 氯酸盐 高氯酸盐 加标浓度
(μg/kg)平均回
收率(%)RSD
(%)加标浓度
(μg/kg)平均回
收率(%)RSD
(%)猪肉 6.0 91.0 8.0 3.0 98.3 4.9 20 98.3 1.9 10 99.3 2.1 40 96.0 3.0 20 106.0 0.7 200 105.7 1.8 100 106.9 0.9 鸡肉 6.0 96.1 7.1 3.0 102.2 9.4 20 96.4 6.8 10 94.6 5.0 40 95.6 4.3 20 96.7 1.6 200 101.4 3.1 100 94.2 1.5 鸭肉 6.0 97.7 9.7 3.0 94.9 7.4 20 91.3 5.2 10 110.5 4.9 40 96.5 5.3 20 108.9 2.9 200 101.1 3.3 100 104.7 1.2 2.7 实际样品检测
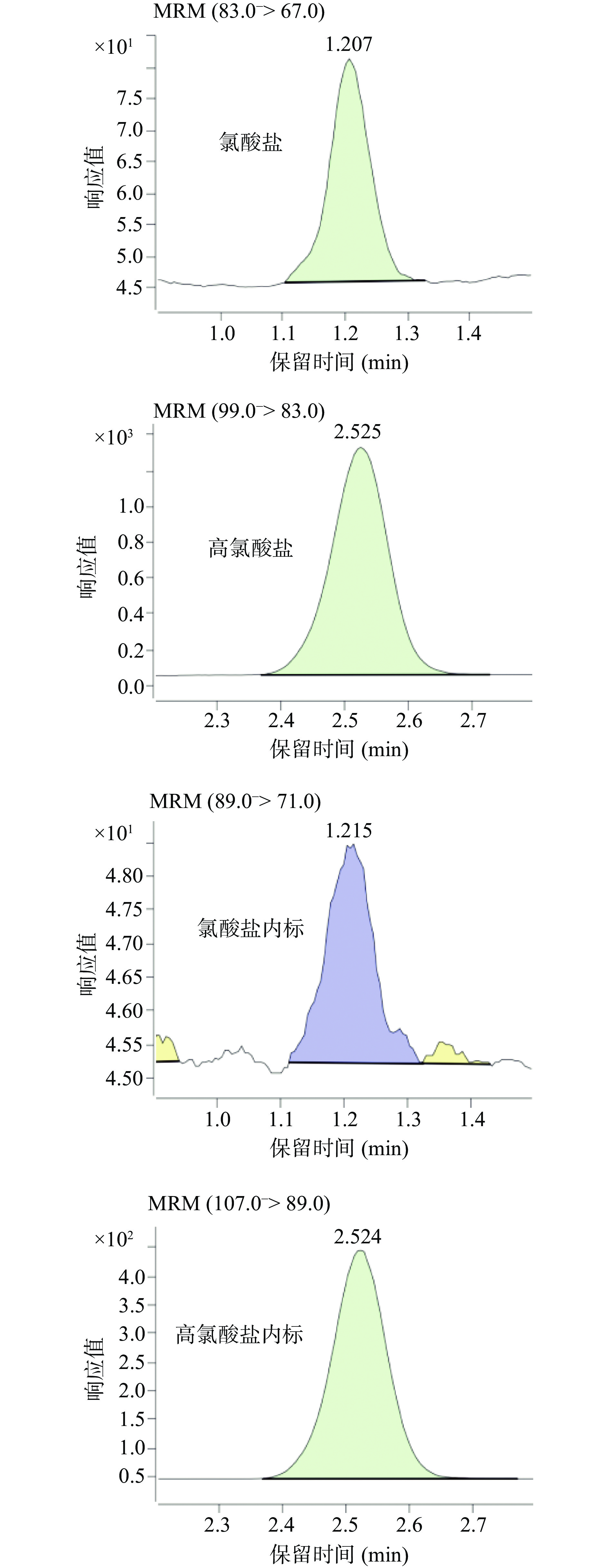
采用建立的方法测定30份肉类样品,分别为12份猪肉、10份鸡肉、8份鸭肉样品,阳性样品色谱图见图2。检测结果显示:氯酸盐检出率为20.0%,高氯酸盐检出率为16.6%。其中,有检出的猪肉、鸡肉和鸭肉氯酸盐平均含量分别为9.75、62.63和42.11 μg/kg;高氯酸盐平均含量分别为2.83、23.43和1.74 μg/kg。检出结果对比GB 5749-2006《生活饮用水卫生标准》规定饮用水中氯酸盐的限值为0.7 mg/L,欧盟发布蔬菜水果中的高氯酸盐的限量标准0.05 mg/kg,本实验检出鸡肉中的氯酸盐和高氯酸盐含量不低,存在一定风险。肉中检出氯酸盐或高氯酸盐的残留暗示了畜禽日常喂食或饮水中存在氯酸盐和高氯酸盐污染的可能。
3. 结论
本文针对肉类中的氯酸盐和高氯酸盐,通过对质谱参数优化,色谱流动相的选择,前处理过程提取试剂和固相萃取小柱的选择,建立了高效液相色谱-串联质谱法同时测定常见肉类中氯酸盐和高氯酸盐残留量的方法。方法确定20 mmol/L乙酸铵-乙腈作为流动相,获得氯酸根及高氯酸根的色谱峰分离完全,二者均在3 min内出峰,且峰型尖锐对称。乙腈:水(13:7,V:V)作为提取试剂提取后氯酸根及高氯酸根离子的回收率分别为103.04%和102.27%,且蛋白质沉淀完全,后续无絮状沉淀产生,适合大批样品批量检测等待。本方法操作简单,同位素内标降低基质效应,方法学参数表明该方法精密度和灵敏度高,定量准确、可靠,能满足肉类中氯酸盐和高氯酸盐的日常检测工作,为今后制定相关检测标准提供方法依据。
-
表 1 氯酸根离子、高氯酸根离子及其内标的质谱参数
Table 1 MS parameters of chlorate, perchlorate and their internal standard
化合物 母离子
(m/z)子离子
(m/z)锥孔电压
(V)碰撞能量
(eV)氯酸根离子 83.0* 67.0* 94 25 85.0 69.0 80 25 高氯酸根离子 99.0* 83.0* 136 30 101.0 85.0 80 29 氯酸根离子内标 89.0* 71.0* 80 25 高氯酸根离子内标 107.0* 89.0* 136 30 注:“*”为定量离子。 表 2 不同体积比乙腈-水提取后氯酸根离子和高氯酸根离子及其内标的回收率
Table 2 Recovery rates of chlorate, perchlorate and their internal standard extracted with acetonitrile-water at different volume ratios
乙腈-水体
积比(V:V)回收率(%) 氯酸根离子 氯酸根
离子内标高氯酸根离子 高氯酸根
离子内标11:9 45.71 84.65 98.20 94.21 13:7 103.04 105.47 102.27 102.47 15:5 83.97 90.79 104.89 103.17 表 3 氯酸根离子和高氯酸根离子线性范围、线性回归方程、决定系数、检出限和定量限
Table 3 Linear range, linear equation, determination coefficient, detection limit and quantitative limit of chlorate and perchlorate
化合物 线性范围(ng/mL) 线性方程 决定系数(R2) 检出限(μg/kg) 定量限(μg/kg) 氯酸根离子 2~200.0 y=0.119132x+
0.0601790.9983 0.6 2.0 高氯酸根离子 1~100.0 y=0.334560x+
0.1019390.9998 0.3 1.0 表 4 肉类样品加标回收率(n=6)
Table 4 Spiked recoveries of meat samples (n=6)
样品 氯酸盐 高氯酸盐 加标浓度
(μg/kg)平均回
收率(%)RSD
(%)加标浓度
(μg/kg)平均回
收率(%)RSD
(%)猪肉 6.0 91.0 8.0 3.0 98.3 4.9 20 98.3 1.9 10 99.3 2.1 40 96.0 3.0 20 106.0 0.7 200 105.7 1.8 100 106.9 0.9 鸡肉 6.0 96.1 7.1 3.0 102.2 9.4 20 96.4 6.8 10 94.6 5.0 40 95.6 4.3 20 96.7 1.6 200 101.4 3.1 100 94.2 1.5 鸭肉 6.0 97.7 9.7 3.0 94.9 7.4 20 91.3 5.2 10 110.5 4.9 40 96.5 5.3 20 108.9 2.9 200 101.1 3.3 100 104.7 1.2 -
[1] European Food Safety Authority. Scientific opinion on the risks to public health related to the presence of perchlorate in food, in particular fruits and vegetables[J]. EFSA J,2014,12(10):3869. doi: 10.2903/j.efsa.2014.3869
[2] European Food Safety Authority. Risks for public health related to the presence of chlorate in food EFSA Panel on Contaminants in the Food Chain (CONTAM)[J]. EFSA J,2015,13(6):4135.
[3] 张昊, 蒋晓宏, 霍宗利. 基于Captiva EMR-Lipid净化的婴儿配方乳粉中氯酸盐和高氯酸盐的离子色谱-串联质谱测定[J]. 食品科学,2021,42(12):315−321. [ZHANG H, JIANG X H, HUO Z L. Determination of chlorate and perchlorate in infant formula powder by ion chromatography coupled with tandem mass spectrometry based on Captiva EMR-Lipid clean-up[J]. Food Sci,2021,42(12):315−321. [4] 朱伟, 宁啸骏, 秦宇. 离子色谱串联质谱法测定婴幼儿配方奶粉中氯酸盐和高氯酸盐[J]. 食品安全质量检测学报,2019,10(11):3474−3480. [ZHU W, NING X J, QIN Y. Determination of chlorate and perchlorate in infant formula milk powder by ion chromatography tandem mass spectrometry[J]. J Food Saf Qual,2019,10(11):3474−3480. [5] 刘丽菁, 杨艳, 张文婷, 等. 离子色谱法同时测定饮用水中亚氯酸盐、氯酸盐和高氯酸盐[J]. 理化检验(化学分册),2021,57(3):247−251. [LIU L J, YANG Y, ZHANG W T, et al. Simultaneous determination of chlorite, chlorate and perchlorate in drinking water by ion chromatography[J]. Phys Test Chem Anal B,2021,57(3):247−251. [6] 贾娜, 张辰凌, 刘冰冰, 等. 离子色谱法快速测定饮用水中4种卤氧化合物[J]. 理化检验(化学分册),2019,55(11):1337−1340. [JIA N, ZHANG C L, LIU B B, et al. Rapid determination of 4 oxyhalides in drinking water by IC[J]. Phys Test Chem Anal B,2019,55(11):1337−1340. [7] 张文婷, 刘丽菁, 周浩德, 等. 超高效液相色谱-串联质谱法测定饮用水中高氯酸盐和氯酸盐[J]. 药物分析杂志,2020,40(12):2230−2235. [ZHANG W T, LIU L J, ZHOU H D, et al. Determination of perchlorate and chlorate in drinking water by ultra-high performance liquid chromatography-tandem mass spectrometry[J]. Chin J Pharm Anal,2020,40(12):2230−2235. [8] 盛华栋, 潘项捷, 张水锋, 等. 改良QuEChERS技术结合超高效液相色谱-串联质谱法同时测定果蔬中高氯酸盐、氯酸盐和溴酸盐[J]. 食品科学,2020,41(10):324−329. [SHENG H D, PAN X J, ZHANG S F, et al. Simultaneous determination of perchlorate, chlorate and bromate in vegetables and fruits by modified QuEChERS method coupled with UPLC-MS/MS[J]. Food Sci,2020,41(10):324−329. [9] 吴映璇, 林峰, 姚仰勋, 等. 固相萃取/18O标记高氯酸根稀释高效液相色谱-串联质谱法测定水果中的高氯酸盐[J]. 分析测试学报,2016,35(3):355−358. [WU Y X, LIN F, YAO Y X, et al. Determination of perchlorate in fruits by solid phase extraction/18O labeled perchlorate dilution high performance liquid chromatography-tandem mass spectrometry[J]. J Inst Anal,2016,35(3):355−358. [10] 毕瑞锋. 高效液相色谱-串联质谱法测定牛奶中的高氯酸盐和氯酸盐[J]. 中国乳品工业,2018,46(2):49−51, 58. [BI R F. Simultaneous determination of perchlorate and chlorate in milk by porous graphitic carbon column-high performance liquid chromatography-tandem mass spectrometry[J]. China Dairy Ind,2018,46(2):49−51, 58. [11] 刘煜, 周佳, 朱书强, 等. 高效液相色谱-串联质谱法测定液体乳中氯酸盐和高氯酸盐[J]. 食品安全质量检测学报,2021,12(7):2913−2918. [LIU Y, ZHOU J, ZHU S Q, et al. Determination of chlorate and perchlorate in liquid milk by high performance liquid chromatography-tandem mass spectrometry[J]. J Food Saf Qual,2021,12(7):2913−2918. [12] 王浩, 贾婧怡, 张杉, 等. 液质联用法同时测定婴幼儿配方乳粉中氯酸盐和高氯酸盐残留[J]. 中国乳品工业,2019,47(2):48−50, 64. [WANG H, JIA J Y, ZHANG B, et al. Simultaneous determination of chlorate and perchlorate in infant milk powder by HPLC-MS/MS[J]. China Dairy Ind,2019,47(2):48−50, 64. [13] 董恒涛, 张亚锋, 艾芸, 等. 超高效液相色谱-串联质谱法测定婴幼儿配方奶粉中的高氯酸盐和氯酸盐残留[J]. 食品安全质量检测学报,2021,12(16):6522−6527. [DONG H T, ZHANG Y F, AI Y, et al. Determination of perchlorate and chlorate residues in infant formula milk powder by ultra performance liquid chromatography-tandem mass spectrometry[J]. J Food Saf Qual,2021,12(16):6522−6527. [14] 詹胜群, 张浩, 周钧, 等. 超高效液相色谱-串联质谱法测定婴幼儿配方乳粉中氯酸盐和高氯酸盐[J]. 食品科技,2022,47(1):312−318. [ZHAN S Q, ZHANG H, ZHOU J, et al. Determination of chlorate and perchlorate in infant formula milk powder by UPLC-MS/MS[J]. Food Sci Technol,2022,47(1):312−318. [15] 周晓晴, 吕小丽, 万建春, 等. 高效液相色谱-串联质谱法测定奶粉中氯酸盐和高氯酸盐[J]. 色谱,2019,37(10):1064−1070. [ZHOU X Q, LÜ X L, WAN J C, et al. Determination of chlorate and perchlorate in milk power by high-performance liquid chromatography-tandem mass spectrometry[J]. Chin J Chrom,2019,37(10):1064−1070. doi: 10.3724/SP.J.1123.2019.04052 [16] 黄永桥, 马凯, 吴新文, 等. UHPLC-MS/MS法测定猪肉和牛肉中的高氯酸盐[J]. 食品工业,2019,40(12):298−300. [HUANG Y Q, MA K, WU X W, et al. Determination of perchlorate in pork and beef by ultra high performance liquid chromatography-tandem mass spectrometry[J]. Food Ind,2019,40(12):298−300. -
期刊类型引用(2)
1. 文华英,王傅玉,张玉红. 青稞蕨麻酵素发酵工艺优化及其品质评价. 中国酿造. 2024(02): 199-205 .  百度学术
百度学术
2. 董平,徐向波,周奎,曹娜娜,吴华昌,邓静. 沙米面包配方优化及其品质研究. 食品工业科技. 2024(14): 155-164 .  本站查看
本站查看
其他类型引用(3)





 下载:
下载:
 下载:
下载:



