Extraction Process Optimization and Functional Analysis of Soluble Dietary Fiber from Sporisorium reilianum
-
摘要: 本文采用碱法从高粱乌米中提取可溶性膳食纤维(soluble dietary fiber,SDF),在单因素实验的基础上,使用响应面法优化提取SDF并对其理化性质及抗氧化活性进行研究。优化后的最佳提取条件为料液比1:21.40 g/mL,碱液浓度2.11%,碱解时间90.71 min,提取温度59.30 ℃,SDF最大得率为20.21%。同时,SDF的持水能力、持油能力和溶胀能力分别为3.48±0.05 g/g、1.50±0.07 g/g和13.22±0.03 mL/g。此外,实验结果还表明SDF具有较高的抗氧化活性,对自由基的清除率与SDF浓度呈正相关。在SDF浓度为3.5 mg/mL时,对羟基自由基(·OH)、DPPH自由基和超氧阴离子(O2-·)的清除率分别为62.02%、56.98%和61.03%。结果表明高粱乌米是一种潜在的天然膳食纤维来源和潜在的功能性食品成分。Abstract: In this study, the physicochemical properties and antioxidant activity of alkali-extracted soluble dietary fiber (SDF) extracted from Sporisorium reilianum were investigated. According to the single-factor experiment results, the extraction process of SDF was optimized by response surface methodology. Response surface analysis results indicated that the maximum extraction yield of SDF reached up to 20.21% under the optimized conditions with the solid-to-liquid of 1:21.40 g/mL, alkali concentration of 2.11%, alkalinization time of 90.71 min and extraction temperature of 59.30 ℃. Meanwhile, the results showed that the water holding capacity, oil holding capacity and swelling capacity of SDF were 3.48±0.05 g/g, 1.50±0.07 g/g and 13.22±0.03 mL/g, respectively. In addition, the experimental results also showed that SDF had high antioxidant activity and the scavenging rate of free radicals was positively correlated with the concentration of SDF. The concentration of 3.5 mg/mL scavenged 62.02% ·OH, 56.98% DPPH·, and 61.03% O2-·, respectively. These results indicated that Sporisorium reilianum was a potential source of natural dietary fiber and a potential functional food ingredient.
-
高粱乌米是黑粉菌侵染高粱穗体形成的植物病原真菌,含有蛋白质、多糖、维生素等多种营养成分,具有良好的营养价值[1]。《全国中草药汇编》和《中华本草》记载高粱乌米可调经止血,用于血崩、便血,具有较好的药用价值[2]。但目前,国内外对高粱乌米活性成分的研究主要集中于多糖和黑色素的提取,关于高粱乌米其他活性成分如膳食纤维的提取优化及功能性质研究较少。
膳食纤维(Dietary Fiber,DF)被称为第七大营养素,具有降低糖尿病、结肠癌、动脉硬化、肥胖和心血管疾病风险的生理效益而受到广泛关注[3-5]。根据膳食纤维的溶解度,可将其分为可溶性膳食纤维(soluble dietary fiber,SDF)和不溶性膳食纤维(insoluble dietary fiber,IDF)。许多研究表明,与IDF相比,SDF具有乳化剂作用、凝胶形成能力,同时具有更强的抗氧化活性和与胆酸钠结合的能力,可以预防胃肠道问题、改善便秘[6-8]。然而,有限的食品原料及提取成本高等缺点远远不能满足食品工业对SDF的大量需求。目前,可溶性膳食纤维的提取方法主要有酶法和化学法两大类[9]。与酶法相比,碱法提取具有成本低和操作简单等优点,使其在膳食纤维提取中被广泛应用[10]。
因此,本文通过碱法提取SDF,在单因素实验基础上采用响应面法优化其最佳提取工艺,并对其持水能力、持油能力、溶胀能力、阳离子交换能力和抗氧化活性进行研究,为其在食品工业中的应用提供理论基础。
1. 材料与方法
1.1 材料与仪器
高粱乌米 吉林省四平市当地市场,经长春中医药研究所鉴定为高粱乌米;水杨酸、焦性没食子酚(邻苯三酚)、铁氰化钾、DPPH、Tris、L-抗坏血酸(VC) 分析纯,上海麦克林有限公司;H2O2、NaOH、FeCl3、HCl(化学纯)、硫酸亚铁、三氯乙酸(分析纯) 上海阿拉丁生化科技股份有限公司;大豆油 当地超市;其余溶剂均为国产分析纯。
FD-1A-50型真空冷冻干燥机 北京博医康公司;JA型电子天平 上海湘续公司;HH4型数显恒温水浴锅 常州天瑞仪器公司;UVT5500TC紫外可见分光光度计 上海元析仪器公司;FW135型样品粉碎机 常州润华公司。
1.2 实验方法
1.2.1 原料预处理
参照GB 5009.88-2014所述方法对高粱乌米进行预处理,略有修改。高粱乌米放置于60 ℃烘箱中干燥48 h,除杂,粉碎,过80目筛取筛下物。然后分别用石油醚(60~90 ℃沸程)和85%乙醇按照1:10 g/mL连续冲洗乌米粉末进行脱脂脱糖,处理结束后收集残渣于70 ℃烘箱中烘干,干燥后保存于干燥器中备用。
1.2.2 高粱乌米SDF的制备
称取5 g脱脂脱糖高粱乌米粉末(精确到1 mg)放入250 mL锥形瓶中,按照料液比1:20 g/mL加入2%(w/v)的NaOH溶液。将上述锥形瓶置于60 ℃恒温水浴中处理90 min。待反应结束后,冷却至室温,以4000 r/min离心15 min并收集上清液。将上清液旋转蒸发至原体积的2/3,向其加入4倍体积的无水乙醇在室温(25 ℃)静置5 h。以6000 r/min离心20 min回收沉淀并分别用75%乙醇和95%丙酮洗涤两次,冷冻干燥并称重。参照式(1)计算高粱乌米SDF得率。
SDF得率(%)=w1w2×100 (1) 式中:w1为SDF质量,g;w2为高粱乌米粉末质量,g。
1.2.3 单因素实验
1.2.3.1 料液比对SDF得率的影响
确定碱液浓度为2%,碱解时间为90 min,提取温度为60 ℃条件下,考察不同料液比(1:10、1:15、1:20、1:25、1:30 g/mL)对SDF得率的影响。
1.2.3.2 碱液浓度对SDF得率的影响
确定料液比为1:20 g/mL,其他条件同上述相同,考察不同碱液浓度(0.5%、1.0%、1.5%、2.0%、2.5%)对SDF得率的影响。
1.2.3.3 碱解时间对SDF得率的影响
确定料液比为1:20 g/mL,碱液浓度为2%,其他条件同上,考察不同碱解时间(30、60、90、120、150 min)对SDF得率的影响。
1.2.3.4 提取温度对SDF得率的影响
在碱解时间为90 min,碱液浓度为2%,料液比为1:20 g/mL条件下,考察不同温度(40、50、60、70、80 ℃)对SDF得率的影响
1.2.4 响应面优化
在单因素实验基础上,选择适宜的因素范围,以SDF得率(%)为响应值,利用Design Expert 12进行Box-Behnken(BBD)响应面优化设计。表1列出了因素及水平。
表 1 响应面试验的因素与水平Table 1. Factors and levels of response surface test水平 A料液比(g/mL) B碱液浓度(%) C碱解时间(min) D提取温度(℃) −1 1:15 1.5 60 50 0 1:20 2.0 90 60 1 1:25 2.5 120 70 1.2.5 理化性质
1.2.5.1 持水能力(Water holding capacity,WHC)测定
参照Chen等[11]的方法所述,对高粱乌米SDF进行持水能力测定。取样品(干基,w1)0.3 g置于50 mL离心管中,然后与蒸馏水(20 mL)充分混合并在25 ℃条件下平衡1 h。以4000 r/min 离心15 min,然后去除上清液并称量残留物重量(w2)。参照式(2)计算其持水能力。
WHC(g/g)=w2−w1w1 (2) 1.2.5.2 溶胀能力(Swelling capacity,SC)测定
参照Fjab等[12]的所述方法,对高粱乌米SDF进行溶胀能力的测定。取0.3 g高粱乌米SDF(w1)于25 mL的比色管中并记录样品的初始体积(v1),然后将样品与蒸馏水(10 mL)混合均匀,在室温下(25 ℃)静置24 h并记录样品膨胀后的体积(v2)。参照式(3)计算其溶胀能力。
SC(mL/g)=v2−v1w1 (3) 1.2.5.3 持油能力(Oil holding capacity,OHC)测定
参照Wang等[13]的所述方法,对高粱乌米SDF进行持油能力的测定。称取0.3 g样品(干基,w1)于50 mL离心管中,加入20 mL大豆油并在25 ℃条件下平衡1 h。4000 r/min离心15 min,去除上清液并称重收集残留物(w2)。参照式(4)计算其持油能力。
OHC(g/g)=w2−w1w1 (4) 1.2.5.4 阳离子交换能力测定
参照Chu等[14]的所述方法对高粱乌米SDF进行阳离子交换能力测定,稍作修改。称取1 g SDF样品于100 mL烧杯中,使其浸泡于80 mL HCl溶液(0.01 mol/L)中并在4 ℃条件下过夜;然后过滤并用蒸馏水对其洗涤;最后使用10% AgNO3(w/v)溶液滴定至滤液中无白色沉淀产生(即滤液中不含Cl−),收集滤渣并干燥。取0.3 g干燥样品浸泡于5% NaCl(50 mL)溶液中,用0.01 mol/L的NaOH滴定至pH为7,记录NaOH的消耗量,用蒸馏水做空白实验组。
1.2.6 体外抗氧化活性
1.2.6.1 羟基自由基清除能力测定
参照贾玮等[15]的所述方法对高粱乌米SDF的羟基自由基清除能力进行测定,稍作修改。将不同浓度的样品溶液(1.5、2.0、2.5、3.0、3.5 mg/mL)、PBS缓冲液(2 mmol/L,pH6.5)、水杨酸-乙醇(1.8 mmol/L)溶液、FeSO4(1.8 mmol/L)、H2O2(0.02%)和1 mL蒸馏水进行等体积混合均匀。在37 ℃下孵育30 min,在510 nm处测定吸光度值,以VC作为阳性对照。羟基自由基清除率的计算公式(5)如下:
清除率(%)=A0−(AS−A1)A0×100 (5) 式中:A0表示空白对照组的吸光度;AS表示样品的吸光度;A1表示蒸馏水代替H2O2溶液在相同条件下样品的吸光度。
1.2.6.2 DPPH自由基清除能力测定
参照Yan等[16]的所述方法对高粱乌米SDF的DPPH自由基清除能力进行测定,稍作修改。将2 mL 0.1 mmol/L DPPH甲醇溶液加入到2 mL不同浓度的SDF溶液(1.5、2.0、2.5、3.0、3.5 mg/mL)中,混合摇匀后于室温下黑暗放置30 min。以4000 r/min离心20 min,取其上清液在517 nm处测定吸光度值,以VC作为阳性对照。DPPH自由基清除能力的计算公式(6)如下:
清除率(%)=A0−(AS−A1)A0×100 (6) 式中:A0表示空白对照组的吸光度;AS表示样品的吸光度;A1表示样品在与AS相同的条件下用甲醇代替DPPH溶液的吸光度。
1.2.6.3 超氧阴离子清除能力测定
参照张云等[17]的所述方法对高粱乌米SDF的超氧阴离子清除能力进行测定,稍作修改。取1 mL不同浓度的样品溶液(1.5、2.0、2.5、3.0、3.5 mg/mL)于3 mL Tris-HCl缓冲液(pH8.2),在30 ℃下孵育20 min。然后加入3 mL 7 mmol/L的邻苯三酚反应10 min,最后加入1 mL浓HCl终止反应。4000 r/min离心20 min,取上清液,在420 nm测吸光度,以VC作为阳性对照。超氧阴离子自由基清除率的计算公式(7)如下:
清除率(%)=A0−(AS−A1)A0×100 (7) 式中:A0表示空白对照组的吸光度;AS表示样品的吸光度;A1表示以蒸馏水代替邻苯三酚溶液在相同条件下样品的吸光度。
1.2.6.4 还原能力测定
参考张博华等[18]的所述方法对高粱乌米SDF的还原能力进行测定,稍作修改。取2 mL不同浓度的样品溶液(1.5、2.0、2.5、3.0、3.5 mg/mL)于2 mL的磷酸缓冲液(0.2 mol/L,pH6.6)及1%铁氰化钾溶液中,在50 ℃恒温水浴中反应20 min。待反应结束后,立刻冷却至室温并加入10%三氯乙酸2 mL终止反应。3000 r/min离心10 min。取2 mL上清液与2 mL蒸馏水及浓度为1 mg/mL的FeCl3溶液0.4 mL混匀,室温放置10 min并在700 nm下测定吸光度,以VC作为阳性对照,吸光度越大,样品对Fe3+还原能力越强,抗氧化能力越好。
1.3 数据处理
所有实验重复三次,数据以平均值±标准差表示,样本之间观察到的显著差异使用方差分析进行评估,P<0.05时存在显著的统计学差异,使用SPSS 22和Design Expert 12软件对数据进行分析,并用Origin Pro 2021软件作图。
2. 结果与分析
2.1 单因素实验结果
2.1.1 料液比对SDF得率的影响
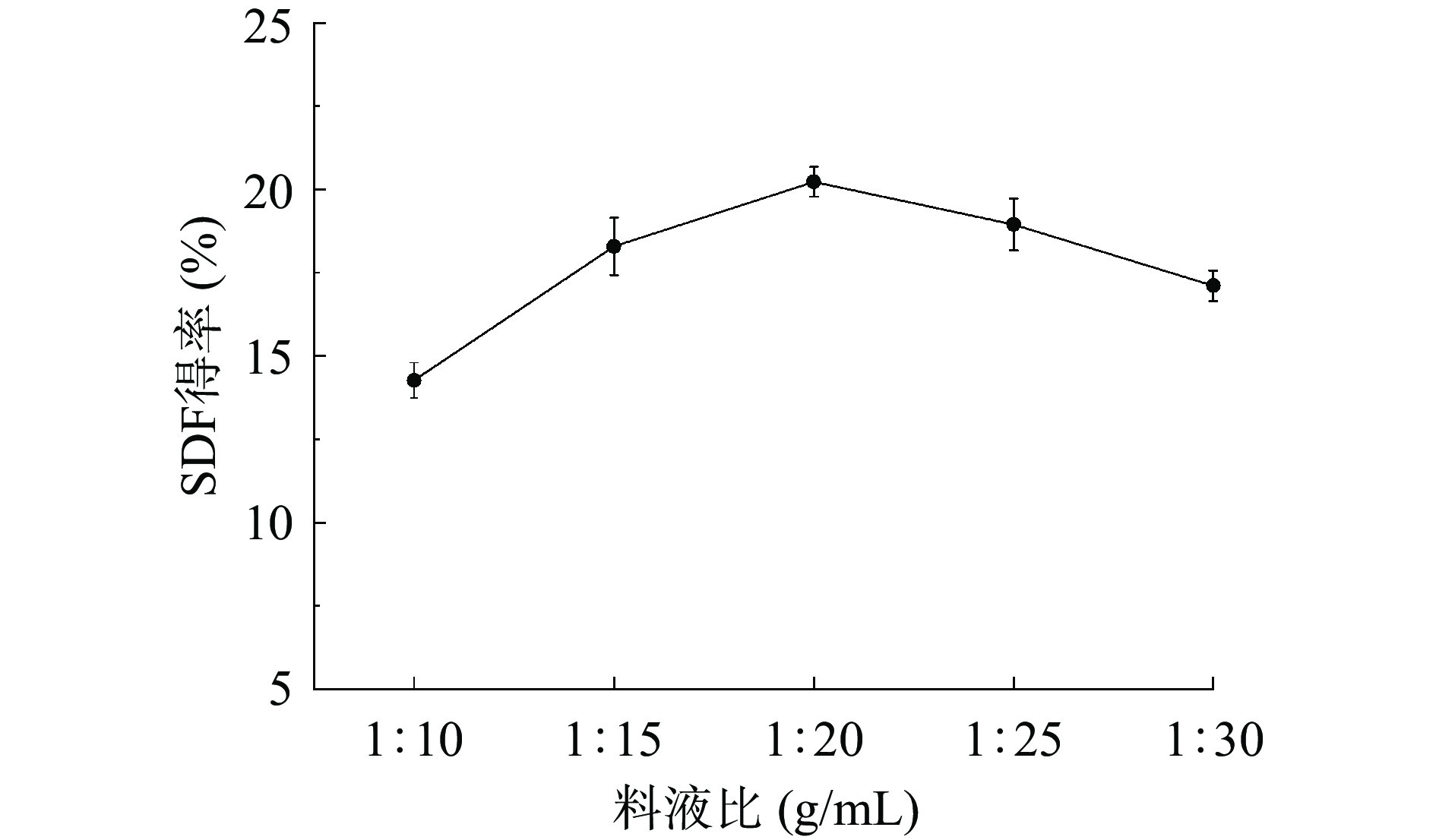
以高粱乌米SDF得率为指标,进行单因素实验以确定提取条件变量初步范围。如图1所示,SDF得率随着料液比的增加呈现先增加后减少的趋势。当料液比为1:10 g/mL时,得率较低可能是因为高粱乌米粉末与提取液(碱液)混合不充分[19],导致碱液不能完全溶解乌米粉末,进而导致SDF得率较低。当料液比从1:10 g/mL变化至1:20 g/mL时,SDF得率呈上升趋势,在料液比为1:20 g/mL时达到最大值,其得率为20.21%±0.14%,高于文献[20]在相同料液比条件下达到峰值的夏枯草SDF得率(13.33%)。然而,当料液比从1:20 g/mL变化至1:30 g/mL时,SDF得率却呈下降趋势。这可能是由于较大的料液比导致真菌细胞内部和外部溶剂之间的浓度差异较大,从而使得其他活性成分从溶液中溶解出来[21],进而使其得率降低。因此,1:20 g/mL为最佳的料液比。
2.1.2 碱液浓度对SDF得率的影响
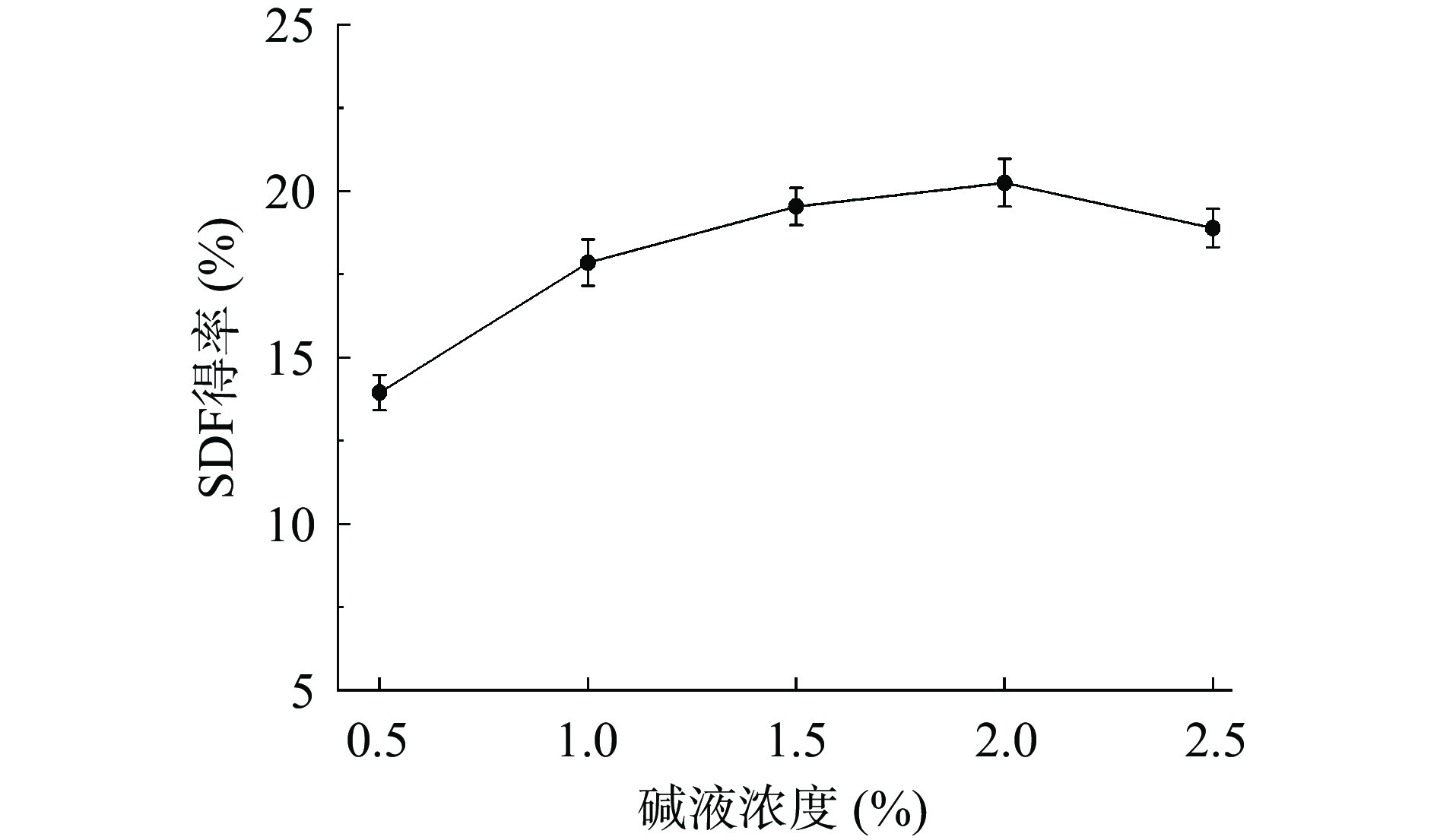
如图2所示,实验考察了氢氧化钠浓度在0.5%~2.5%范围内对SDF得率的影响。当碱液浓度从0.5%变化至2.0%时,得率随着碱液浓度的增加而增加并达到最大值。该现象出现的原因可能是随着碱液浓度的增加,对纤维素和半纤维之间的氢键破坏逐渐增强[22],进而使得SDF溶解性提高和得率的增加。当碱液浓度从2.0%变化至2.5%时,SDF得率却呈下降趋势。这可能是碱液浓度过高,破坏SDF糖链分子结构,使其分解为更小的分子进而导致SDF得率下降。因此,碱液浓度为2.0%是本次实验的最适条件。
2.1.3 碱解时间对SDF得率的影响
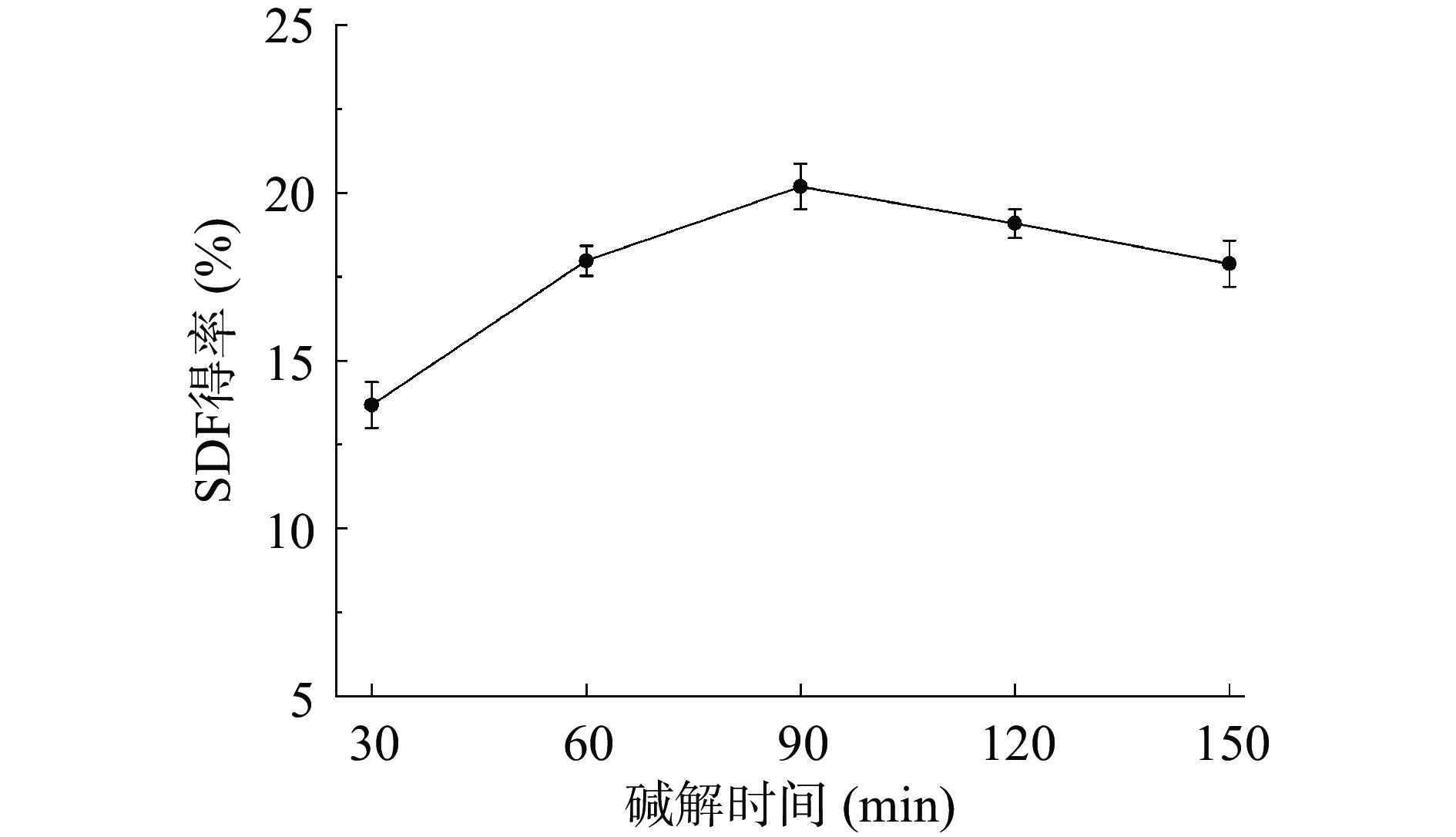
研究表明,SDF的溶出需要一定的碱处理时间,但碱解时间过长,可能会导致提取物部分降解[23]。因此,碱解时间也是影响SDF得率的重要变量。如图3所示,碱解时间从30 min变化至90 min时,得率从13.68%±0.69%逐渐增加到20.19%±0.43%。然而,碱解时间从90 min变化至150 min时,得率却下降。这可能是因为碱液长时间的作用破坏了SDF结构,使其分解为小分子不能完全醇沉或无法醇沉[24],进而SDF得率减小。因此,90 min是提取SDF的最适碱解时间。
2.1.4 提取温度对SDF得率的影响
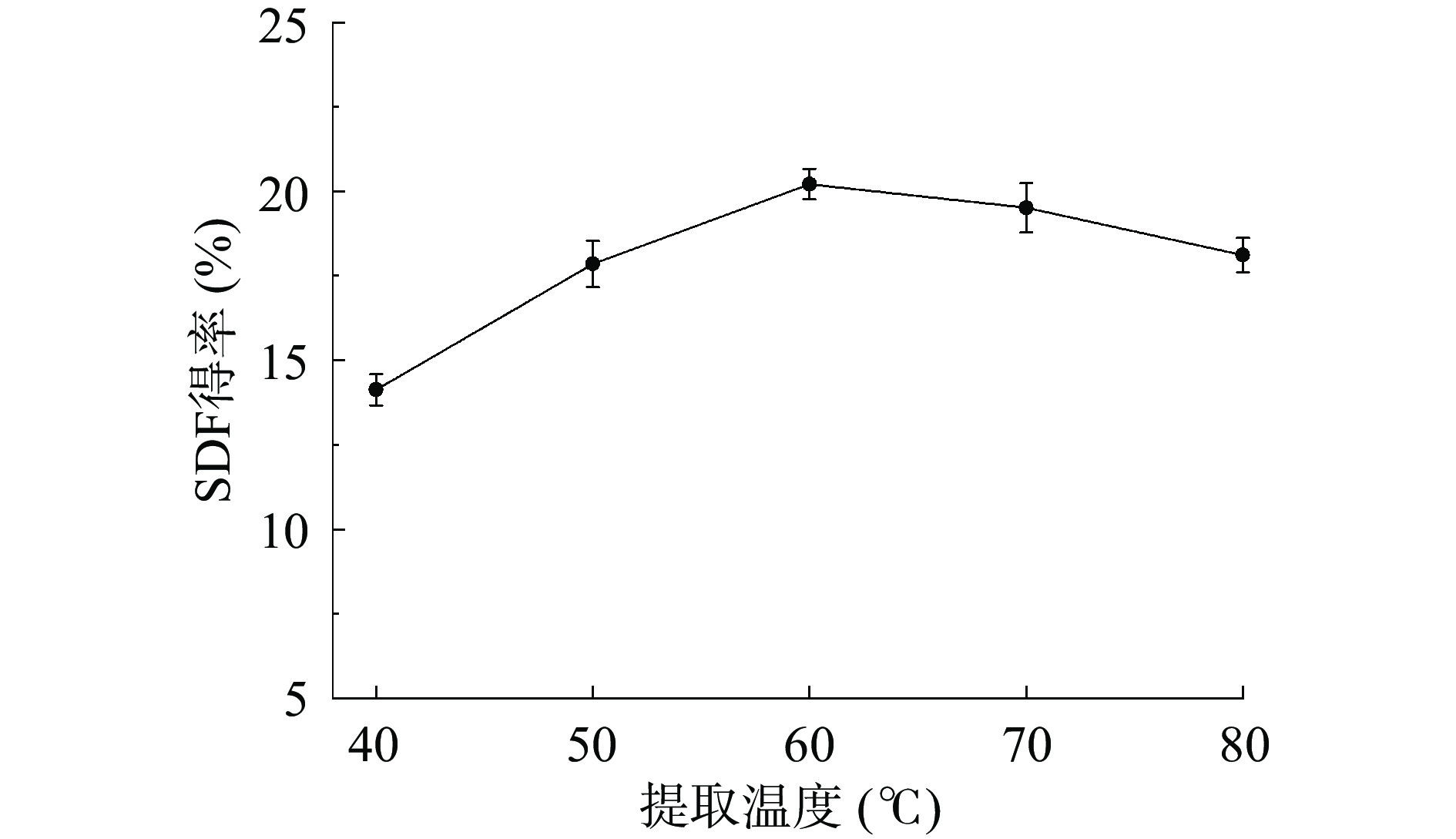
如图4所示,当提取温度从40 ℃升高到60 ℃时,SDF得率从14.13%±0.46%逐渐增加到20.21%±0.36%。这可能是由于温度的增加提高了溶液的流动性和物质的传质效率[25],进而使得SDF得率增加。然而当温度从60 ℃升高至80 ℃时,SDF得率却从20.21%±0.36%下降至18.11%±0.51%。这可能是由于高温导致SDF部分变性所致。因此,为了节约能源及提高SDF得率,选择60 ℃为SDF最佳提取温度。
2.2 响应面试验结果及分析
2.2.1 Box-Behnken试验结果
在单因素实验基础上,选择料液比(A)、碱液浓度(B)、碱解时间(C)和提取温度(D)进行Box-Behnken试验设计,结果如表2所示。
表 2 Box-Behnken实验设计结果表Table 2. Table of results of Box-Behnken experimental design序号 A料液比 B碱液浓度 C碱解时间 D提取温度 SDF得率
(%)1 1 1 0 0 19.65±0.32 2 0 1 0 −1 19.47±0.28 3 0 0 −1 1 18.98±0.25 4 −1 0 −1 0 19.41±0.37 5 1 0 0 1 19.39±0.49 6 0 0 0 0 20.15±0.11 7 1 0 −1 0 19.29±0.47 8 −1 0 0 1 19.01±0.35 9 0 −1 1 0 18.37±0.33 10 1 0 1 0 19.48±0.39 11 0 0 0 0 20.11±0.15 12 1 −1 0 0 18.82±0.12 13 −1 −1 0 0 18.85±0.69 14 −1 0 1 0 19.03±0.53 15 −1 0 0 −1 18.91±0.87 16 0 0 1 1 19.09±0.43 17 0 −1 −1 0 18.69±0.58 18 0 0 −1 −1 19.12±0.29 19 −1 1 0 0 19.01±0.38 20 0 1 0 1 18.96±0.68 21 0 0 0 0 20.27±0.04 22 0 −1 0 1 18.76±0.43 23 1 0 0 −1 19.49±0.41 24 0 0 1 −1 18.97±0.45 25 0 1 1 0 19.11±0.47 26 0 0 0 0 20.21±0.05 27 0 1 −1 0 18.95±0.54 28 0 0 0 0 20.20±0.06 29 0 −1 0 −1 18.58±0.15 2.2.2 模型的建立及显著性检验
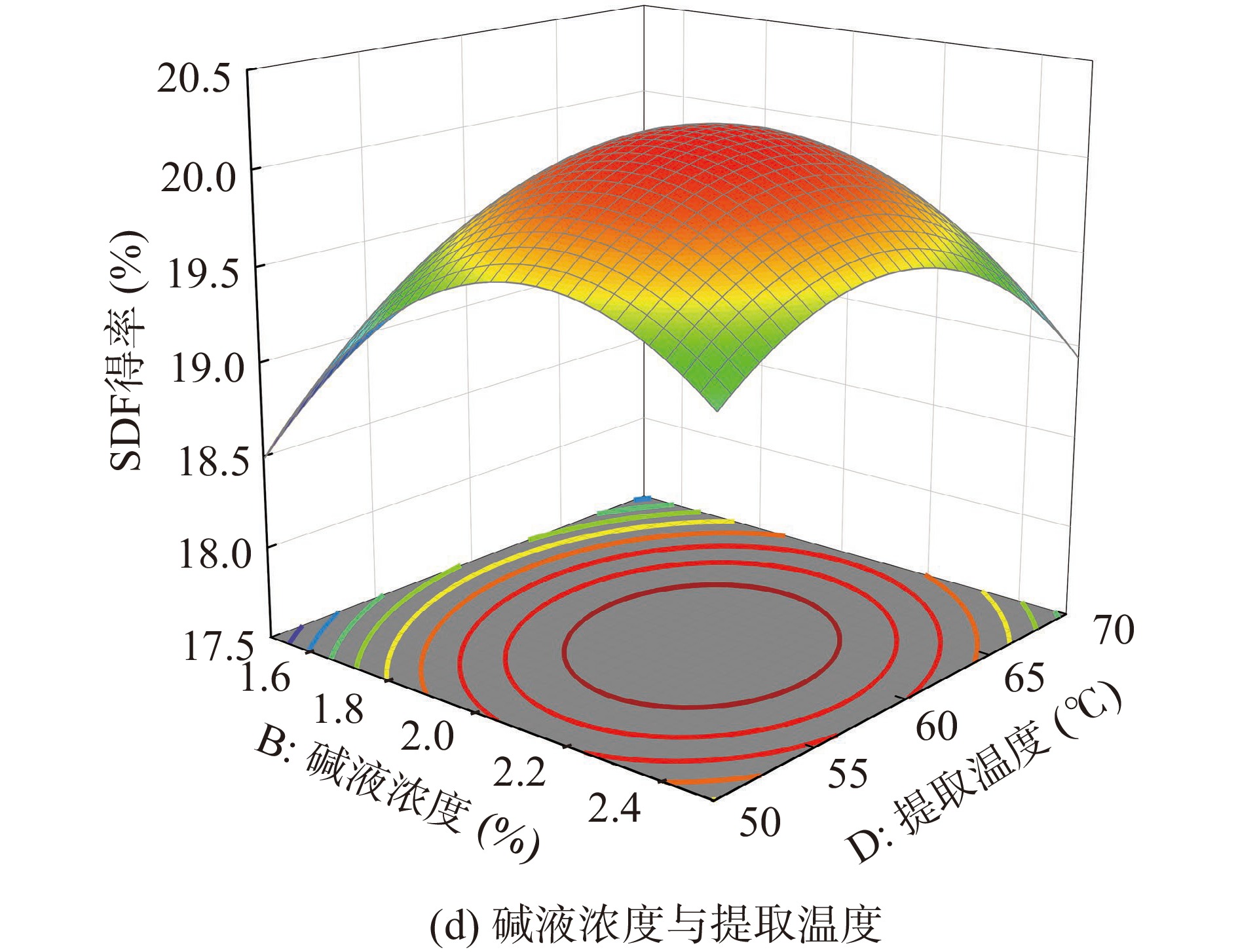
利用Design Expert 12对上表数据进行方差分析,结果如表3所示。通过拟合各因子,得到了SDF得率的多项式回归方程:Y=20.19+0.16A+0.26B−0.03C−0.03D+0.17AB+0.14AC−0.05AD+0.12BC−0.17BD+0.07CD−1.36A2−0.75B2−0.59C2−0.56D2,表明各因素对SDF得率的影响并不是线性关系。由方差分析可知,方差模型P值小于0.0001,R2为0.9793,R2adj为0.9586,且失拟项P=0.1043大于0.05这表明回归方程拟合较好且实验值与预估值具有高度相似性。线性回归系数A和B、交互作用系数AB、BD和二次相关系数(A2、B2、C2和D2)均达到极显著水平(P<0.01),表明料液比和碱液浓度与SDF得率相关性极显著。依据P值判断各因素对SDF得率影响大小的排列顺序为D<C<A<B,即提取温度<碱解时间<料液比<碱液浓度。
表 3 方差分析结果Table 3. Analysis of variance table方差来源 平方和 自由度 均方 F值 P值 显著性 模型 7.41 14 0.5294 47.25 <0.0001 ** A料液比 0.3008 1 0.3008 26.85 0.0001 ** B碱液浓度 0.7905 1 0.7905 70.57 <0.0001 ** C碱解时间 0.0127 1 0.0127 1.13 0.3055 D提取温度 0.0102 1 0.0102 0.9112 0.356 AB 0.1122 1 0.1122 10.02 0.0069 ** AC 0.0812 1 0.0812 7.25 0.0175 * AD 0.01 1 0.01 0.8926 0.3608 BC 0.0576 1 0.0576 5.14 0.0397 * BD 0.119 1 0.119 10.62 0.0057 ** CD 0.0169 1 0.0169 1.51 0.2396 A² 0.8379 1 0.8379 74.8 <0.0001 ** B² 3.64 1 3.64 325.19 <0.0001 ** C² 2.26 1 2.26 202.01 <0.0001 ** D² 2.04 1 2.04 182.01 <0.0001 ** 残差 0.1568 14 0.0112 失拟项 0.142 10 0.0142 3.82 0.1043 不显著 纯误差 0.0149 4 0.0037 总离差 7.57 28 R2 0.9793 R2adj 0.9586 注:*表示P<0.05,**表示P<0.01。 2.2.3 响应面优化提取SDF的工艺参数
用响应面中的Box-Behnken设计方法优化了SDF提取条件,通过生成三维响应曲面图,可视化了SDF得率和各因素水平之间的关系以及变量交互作用。如图5中的a、b、c和d所示为各因素间交互作用的3D图。响应面3D图的曲面坡度越陡峭,表示交互作用越显著[26],对比图中的a、b、c和d发现,响应曲面图坡度均较为陡峭,表明交互作用对SDF得率有明显的影响,其中最为显著的是曲面图d,即碱液浓度与提取温度的交互作用对得率的影响最为显著。随着碱液浓度和提取温度的增加,高粱乌米SDF得率先增加后减少,且碱液浓度相应曲面较陡峭,表明碱液浓度对SDF得率的影响大于提取温度。
2.2.4 模型验证
通过对初步试验结果的统计分析,响应面优化得到了最佳提取条件为:料液比1:21.40 g/mL,碱液浓度2.11%,碱解时间90.71 min,提取温度59.30 ℃,最大预测值为20.24%。在此条件下,进行验证实验,实验重复五次,得出SDF的平均得率为20.21%±0.08%,与预估值相差不大。表明响应面优化实验是有效的,建立的回归方程模型也是合理的。
2.3 理化性质分析
2.3.1 持水能力、持油能力和溶胀能力
持水能力、溶胀能力、持油能力是衡量膳食纤维理化性质的重要标准,其指数越大表明膳食纤维的生理活性越好[27]。由表4可知,高粱乌米SDF的持水能力、溶胀能力和持油能力分别为3.48±0.05 g/g、13.22±0.03 mL/g和1.50±0.07 g/g。郝晓华等[28]采用碱法提取橘皮SDF,其持水量和溶胀能力分别为1.21 g/g和2.32 mL/g,低于高粱乌米SDF的理化性质。
表 4 SDF的理化性质Table 4. Physicochemical properties of SDF样品 持水能力(g/g) 溶胀能力(mL/g) 持油能力(g/g) 高粱乌米SDF 3.48±0.05 13.22±0.03 1.50±0.07 以上结果表明,高粱乌米SDF具有良好的理化性质,尤其是具有较高的溶胀能力,这不仅可以加快肠道的蠕动及促进排便,同时还可增加饱腹感,达到预防便秘及减肥的效果[29]。综上所述,高粱乌米膳食纤维是一种潜在的功能食品,特别是在预防肥胖方面。
2.3.2 阳离子交换能力
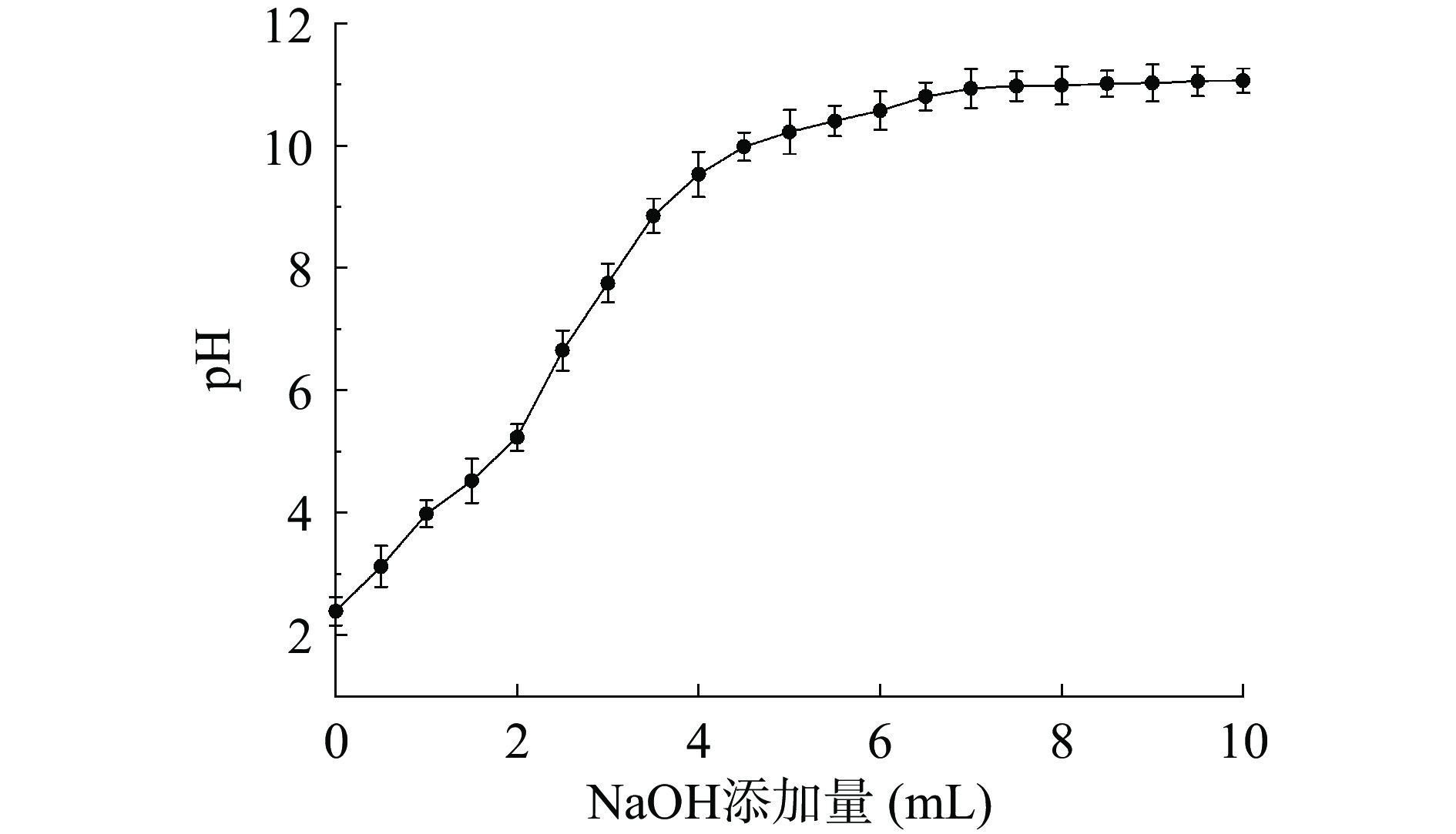
由图6可知,SDF的起始pH为2.39,随着NaOH的添加,SDF曲线整体呈先上升后趋于平缓的趋势。NaOH添加量在0~2 mL时,pH的变化比较缓慢。在2~4.5 mL时,pH上升较快,然而在4.5~10 mL时,pH上升缓慢并接近平缓。这可能是由于SDF结构中活性基团(羟基、羧基或氨基)暴露出来,可产生类似弱酸性阳离子交换树脂的作用[30],能与溶液中的Na+进行一定程度的可逆性交换。
2.4 体外抗氧化活性
2.4.1 羟基自由基清除能力的测定
羟基自由基是一种强氧化剂,可以攻击破坏细胞膜的细胞磷脂和大分子如脂质和核酸[31]。清除羟基自由基能有效减少氧化损伤,保护机体。图7中的结果表明,随着SDF质量浓度的增加,羟基自由基清除率呈上升趋势,并呈剂量依赖关系。在质量浓度为3.5 mg/mL时,SDF的清除率为62.02%,与VC的羟基自由基清除率(69.45%)相近。表明SDF具有较强的羟基自由基清除能力
2.4.2 DPPH自由基清除能力的测定
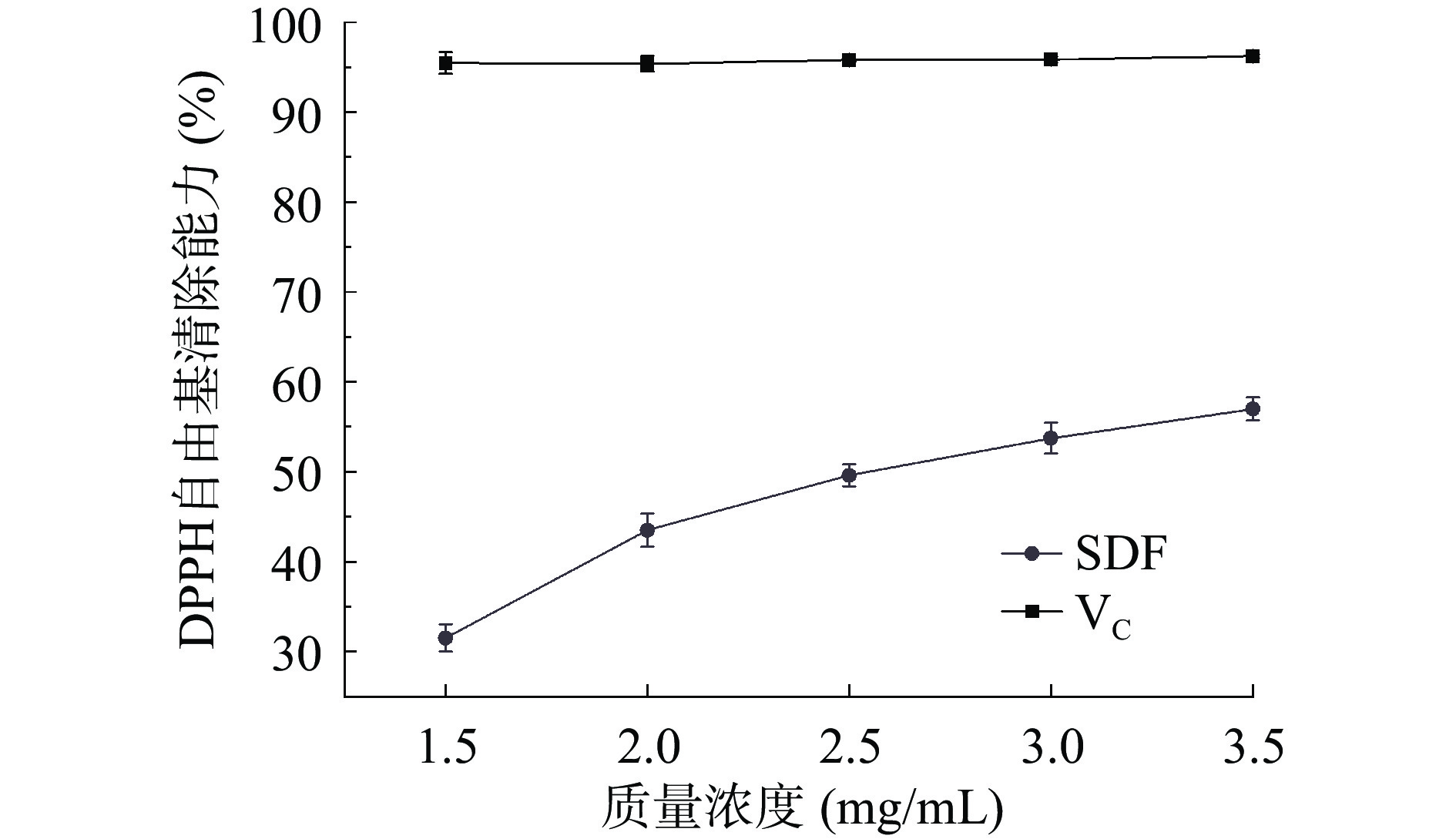
目前广泛应用DPPH自由基清除实验来评价抗氧化剂清除自由基活性[32]。图8显示,当质量浓度从1.5 mg/mL变化至3.5 mg/mL时,SDF对DPPH自由基清除能力是逐渐增强的,VC的DPPH清除率一直处于平稳状态。在质量浓度为3.5 mg/mL时,SDF清除率为56.98%,低于相同浓度VC清除率。周丽媛等[33]采用超微粉碎等方法制备的黑小麦麸皮SDF在质量浓度为30 mg/mL时,DPPH自由基清除率为34.65%,低于高粱乌米SDF清除率。表明SDF具有一定的DPPH自由基清除能力。
2.4.3 超氧阴离子清除能力的测定
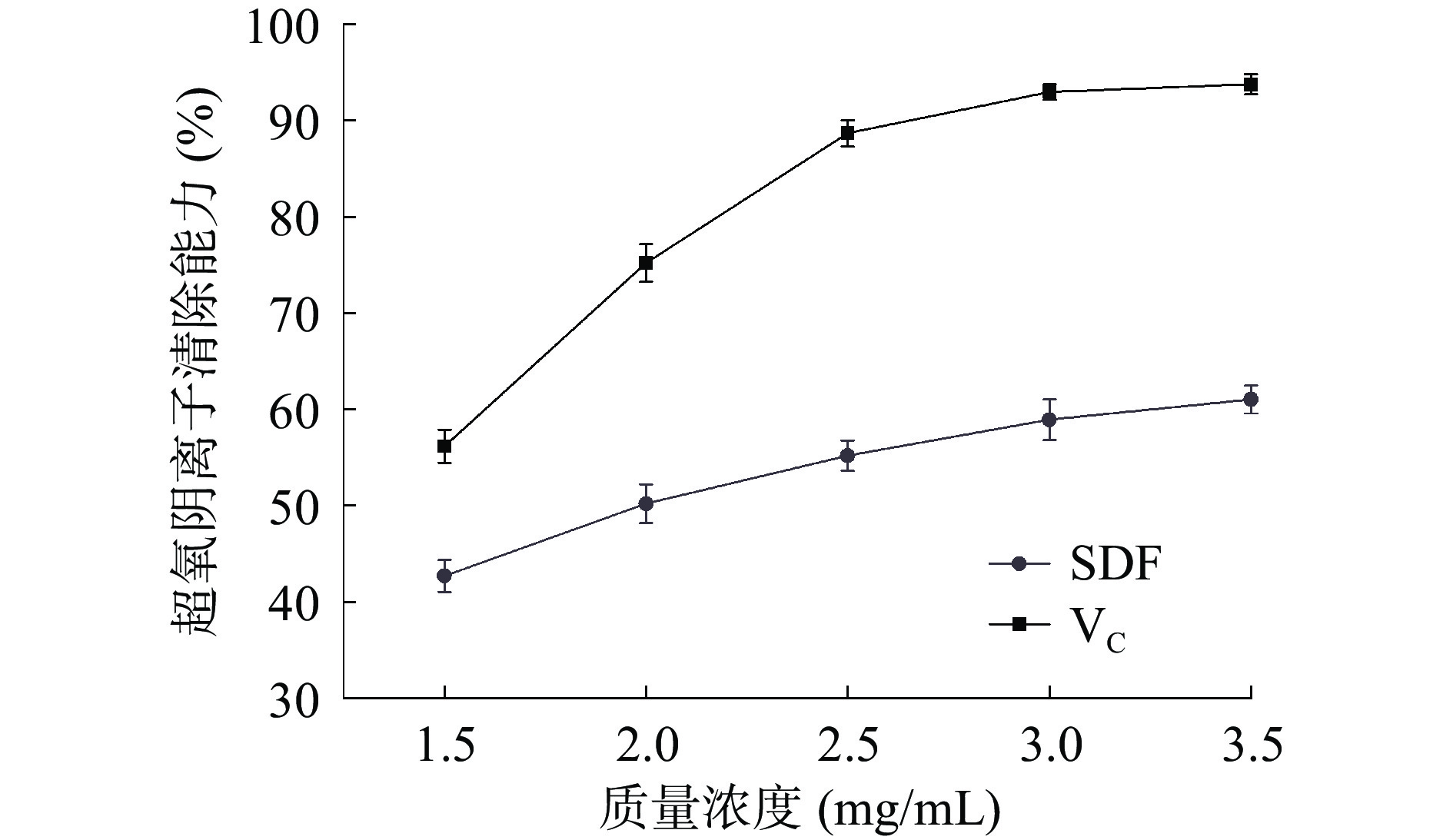
超氧阴离子自由基也是一种活性很强的氧自由基,可以与氨基酸、蛋白质、脂类发生氧化反应,对人体健康有害[34]。如图9所示,随着质量浓度的增加,VC和SDF对超氧阴离子清除能力是逐渐增强的,均与浓度呈良好的量效关系。当质量浓度为3.5 mg/mL时,VC和SDF清除率分别为93.76%和61.03%。李斌[35]采用酶法制备的豆渣SDF在质量浓度为25 mg/mL时,超氧阴离子自由基清除率为43.68%,低于SDF清除率。表明高粱乌米SDF具有良好的超氧阴离子清除能力。
2.4.4 还原能力
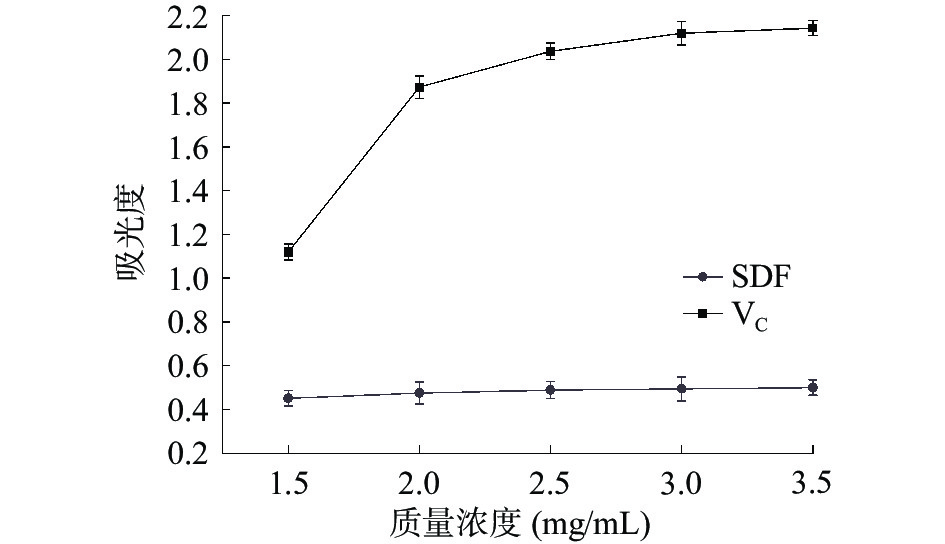
天然化合物的铁还原能力是通过自身还原产生电子来清除体内自由基的。这一指标是检测抗氧化剂活性的重要指标[36]。如图10所示,质量浓度从1.5 mg/mL变化至3.5 mg/mL时,VC和SDF对Fe3+的还原能力逐渐增强,。在质量浓度为3.5 mg/mL时,SDF的吸光度值为0.5,低于VC吸光值,但其吸光度值高于在相同质量浓度下的藜麦SDF[37],表明高粱乌米SDF具有良好的抗氧化活性。
3. 结论
本文采用响应面法优化了碱法提取高粱乌米SDF的最佳条件,得到的最佳工艺参数为料液比1:21.40 g/mL,碱液浓度2.11%,碱解时间90.71 min,提取温度59.30 ℃,SDF得率为20.21%±0.08%。同时,SDF的持水能力、持油能力和溶胀能力分别为3.48±0.05 g/g、1.50±0.07 g/g和13.22±0.03 mL/g,表明高粱乌米SDF具有良好的持水能力和溶胀能力,这使其具有预防或控制肥胖的潜力和可能性。此外,SDF对羟基自由基、DPPH自由基和超氧阴离子自由基均表现出较强的清除能力,在SDF质量浓度为3.5 mg/mL时,·OH、DPPH·和O2-·清除率分别为62.02%、56.98%和61.03%,还原能力为0.5,这表明SDF具有良好的抗氧化活性。综上所述,本文研究结果说明高粱乌米可溶性膳食纤维(SDF)是一种具有生物活性的保健化合物,可为高粱乌米的应用提供理论基础。
-
表 1 响应面试验的因素与水平
Table 1 Factors and levels of response surface test
水平 A料液比(g/mL) B碱液浓度(%) C碱解时间(min) D提取温度(℃) −1 1:15 1.5 60 50 0 1:20 2.0 90 60 1 1:25 2.5 120 70 表 2 Box-Behnken实验设计结果表
Table 2 Table of results of Box-Behnken experimental design
序号 A料液比 B碱液浓度 C碱解时间 D提取温度 SDF得率
(%)1 1 1 0 0 19.65±0.32 2 0 1 0 −1 19.47±0.28 3 0 0 −1 1 18.98±0.25 4 −1 0 −1 0 19.41±0.37 5 1 0 0 1 19.39±0.49 6 0 0 0 0 20.15±0.11 7 1 0 −1 0 19.29±0.47 8 −1 0 0 1 19.01±0.35 9 0 −1 1 0 18.37±0.33 10 1 0 1 0 19.48±0.39 11 0 0 0 0 20.11±0.15 12 1 −1 0 0 18.82±0.12 13 −1 −1 0 0 18.85±0.69 14 −1 0 1 0 19.03±0.53 15 −1 0 0 −1 18.91±0.87 16 0 0 1 1 19.09±0.43 17 0 −1 −1 0 18.69±0.58 18 0 0 −1 −1 19.12±0.29 19 −1 1 0 0 19.01±0.38 20 0 1 0 1 18.96±0.68 21 0 0 0 0 20.27±0.04 22 0 −1 0 1 18.76±0.43 23 1 0 0 −1 19.49±0.41 24 0 0 1 −1 18.97±0.45 25 0 1 1 0 19.11±0.47 26 0 0 0 0 20.21±0.05 27 0 1 −1 0 18.95±0.54 28 0 0 0 0 20.20±0.06 29 0 −1 0 −1 18.58±0.15 表 3 方差分析结果
Table 3 Analysis of variance table
方差来源 平方和 自由度 均方 F值 P值 显著性 模型 7.41 14 0.5294 47.25 <0.0001 ** A料液比 0.3008 1 0.3008 26.85 0.0001 ** B碱液浓度 0.7905 1 0.7905 70.57 <0.0001 ** C碱解时间 0.0127 1 0.0127 1.13 0.3055 D提取温度 0.0102 1 0.0102 0.9112 0.356 AB 0.1122 1 0.1122 10.02 0.0069 ** AC 0.0812 1 0.0812 7.25 0.0175 * AD 0.01 1 0.01 0.8926 0.3608 BC 0.0576 1 0.0576 5.14 0.0397 * BD 0.119 1 0.119 10.62 0.0057 ** CD 0.0169 1 0.0169 1.51 0.2396 A² 0.8379 1 0.8379 74.8 <0.0001 ** B² 3.64 1 3.64 325.19 <0.0001 ** C² 2.26 1 2.26 202.01 <0.0001 ** D² 2.04 1 2.04 182.01 <0.0001 ** 残差 0.1568 14 0.0112 失拟项 0.142 10 0.0142 3.82 0.1043 不显著 纯误差 0.0149 4 0.0037 总离差 7.57 28 R2 0.9793 R2adj 0.9586 注:*表示P<0.05,**表示P<0.01。 表 4 SDF的理化性质
Table 4 Physicochemical properties of SDF
样品 持水能力(g/g) 溶胀能力(mL/g) 持油能力(g/g) 高粱乌米SDF 3.48±0.05 13.22±0.03 1.50±0.07 -
[1] 石太渊, 于淼. 高粱乌米的营养功能与加工利用研究[J]. 农业科技与装备,2012(8):68−70. [SHI T Y, YU M. Nutritional functions and processing utilization of Sporisorium reilianum[J]. Agricultural Technology and Equipment,2012(8):68−70. doi: 10.3969/j.issn.1674-1161.2012.08.027 [2] 鲁明, 石太渊, 付欣, 等. 高粱黑粉菌的研究进展与开发前景[J]. 农业经济,2020(6):27−28. [LU M, SHI T Y, FU X, et al. Research progress and development prospects of Sporisorium black powder fungus[J]. Agricultural Economics,2020(6):27−28. doi: 10.3969/j.issn.1001-6139.2020.06.010 [3] GILL S K, ROSSI M, BAJKA B, et al. Dietary fibre in gastrointestinal health and disease[J]. Nature Reviews Gastroenterology & Hepatology,2020,18(2):1−16.
[4] O'GEADY J, O'CONNOR E M, SHANAHAN F. Review article: Dietary fibre in the era of microbiome science[J]. Alimentary Pharmacology & Therapeutics,2019,49(5):506−515.
[5] SOLIMAN G A. Dietary fiber, atherosclerosis, and cardiovascular disease[J]. Nutrients,2019,11(5):1155−1166. doi: 10.3390/nu11051155
[6] CHEN H, ZHAO C, LI J, et al. Effects of extrusion on structural and physicochemical properties of soluble dietary fiber from nodes of lotus root[J]. LWT,2018:204−211.
[7] DU X, BAI X, WEI G, et al. Properties of soluble dietary fibre from defatted coconut flour obtained through subcritical water extraction[J]. International Journal of Food Science & Technology,2019,54(4):1−15.
[8] Ul A H B, SAEED F, AHMED A, et al. Improving the physicochemical properties of partially enhanced soluble dietary fiber through innovative techniques: A coherent review[J]. Journal of Food Processing and Preservation,2019,43(4):1−12.
[9] MOCZKOWSKA M, KARP S, NIU Y, et al. Enzymatic, enzymatic-ultrasonic and alkaline extraction of soluble dietary fibre from flaxseed-a physicochemical approach[J]. Food Hydrocolloids,2019,90(5):105−112.
[10] 仝文玲, 郭玉如, 徐建国. 碱法和酶法提取方法对胡麻渣可溶性膳食纤维理化性质的影响[J]. 食品研究与开发,2019,40(23):93−97. [TONG W L, GUO Y R, XU J G. Effect of alkaline and enzymatic extraction methods on the physicochemical properties of soluble dietary fiber from flax residue[J]. Food Research and Development,2019,40(23):93−97. [11] CHEN H, XIONG M, BAI T, et al. Comparative study on the structure, physicochemical, and functional properties of dietary fiber extracts from quinoa and wheat[J]. Lebensmittel-Wissenschaft und-Technologie,2021,149(9):111816−111824.
[12] FJAB C, SY D, YMAB C, et al. Extraction optimization and constipation-relieving activity of dietary fiber from Auricularia polytricha[J]. Food Bioscience,2020,33:100506−100534. doi: 10.1016/j.fbio.2019.100506
[13] WANG L, XU H, YUAN F, et al. Preparation and physicochemical properties of soluble dietary fiber from orange peel assisted by steam explosion and dilute acid soaking[J]. Food Chemistry,2015,185:90−98. doi: 10.1016/j.foodchem.2015.03.112
[14] CHU J, ZHAO H, LU Z, et al. Improved physicochemical and functional properties of dietary fiber from millet bran fermented by Bacillus natto[J]. Food Chemistry,2019,294:79−86. doi: 10.1016/j.foodchem.2019.05.035
[15] 贾玮, 张焱茜, 石琳, 等. 海南红心木瓜膳食纤维提取及抗氧化活性测定[J]. 食品科技,2018,43(7):225−232. [JIA W, ZHANG Y X, SHI L, et al. Extraction of dietary fiber and determination of antioxidant activity of Hainan red papaya[J]. Food Science and Technology,2018,43(7):225−232. doi: 10.13684/j.cnki.spkj.2018.07.040 [16] YAN X, YE R, CHEN Y. Blasting extrusion processing: The increase of soluble dietary fiber content and extraction of soluble-fiber polysaccharides from wheat bran[J]. Food Chemistry,2015,180(8):106−115.
[17] 张云, 苗敬芝, 董玉玮, 等. 双酶法提取大蒜水溶性膳食纤维及其抗氧化活性分析[J]. 农产品加工,2021(18):15−17. [ZHANG Y, MIAO J Z, DONG Y W, et al. Analysis of garlic soluble dietary fiber and its antioxidant activity by dual enzyme extraction[J]. Agricultural Product Processing,2021(18):15−17. doi: 10.16693/j.cnki.1671-9646(X).2021.09.037 [18] 张博华, 张明, 杨立风, 等. 蔬菜复合可溶性膳食纤维酶法提取及抗氧化活性研究[J]. 中国果菜,2019,39(2):33−38. [ZHANG B H, ZHANG M, YANG L F, et al. Enzymatic extraction and antioxidant activity of complex soluble dietary fiber from vegetables[J]. China Fruit and Vegetable,2019,39(2):33−38. doi: 10.19590/j.cnki.1008-1038.2019.02.009 [19] 郭艳峰, 李晓璐. 菠萝叶可溶性膳食纤维碱法提取工艺的优化[J]. 保鲜与加工,2019,19(5):104−108. [GUO Y F, LI X L. Optimization of alkaline extraction process of soluble dietary fiber from pineapple leaves[J]. Preservation and Processing,2019,19(5):104−108. [20] 郭艳峰, 淮亚红. 碱法提取夏枯草膳食纤维的工艺优化及其性能测定[J]. 热带农业科学,2016,36(3):67−70. [GUO Y F, HUAI Y H. Process optimization of alkali extraction of dietary fiber from Prunella vulgaris and its performance determination[J]. Tropical Agricultural Science,2016,36(3):67−70. [21] HU H G, ZHAO Q L. Optimization extraction and functional properties of soluble dietary fiber from pineapple pomace obtained by shear homogenization-assisted extraction[J]. RSC Advances,2018,8(72):41117−41130. doi: 10.1039/C8RA06928J
[22] RATANASUMARN N, CHITPRASERT P. Cosmetic potential of lignin extracts from alkaline-treated sugarcane bagasse: Optimization of extraction conditions using response surface methodology[J]. International Journal of Biological Macromolecules,2020,153:138−145. doi: 10.1016/j.ijbiomac.2020.02.328
[23] 邹兰, 任国文, 李梁. 碱法制备苹果梨渣膳食纤维工艺优化及物化特性研究[J]. 粮食与油脂,2019,32(4):72−75. [ZOU L, REN G W, LI L. Process optimization and physicochemical characterization of dietary fiber preparation from apple pear pomace by alkali method[J]. Grain and Fats,2019,32(4):72−75. doi: 10.3969/j.issn.1008-9578.2019.04.021 [24] 李施瑶, 代玲敏, 范宜杰, 等. 化学法提取红树莓果渣可溶性膳食纤维的工艺优化[J]. 食品工业科技,2019,40(19):180−186. [LI S Y, DAI L N, FAN Y J, et al. Process optimization of soluble dietary fiber extraction from raspberry pomace by chemical method[J]. Food Industry Science and Technology,2019,40(19):180−186. doi: 10.13386/j.issn1002-0306.2019.19.030 [25] DONG J L, WANG L, JING L, et al. Structural, antioxidant and adsorption properties of dietary fiber from foxtail millet (Setaria italica) bran[J]. Journal of the Science of Food and Agriculture,2019,99(8):3886−3894. doi: 10.1002/jsfa.9611
[26] 安攀宇, 汪静心, 肖岚, 等. Plackett-Burman试验设计联用Box-Behnken响应面法优化脂肪替代物的制备[J]. 食品科学,2020,41(10):255−264. [AN P Y, WANG J X, XIAO L, et al. Plackett-Burman experimental design coupled with Box-Behnken response surface method to optimize the preparation of fat substitutes[J]. Food Science,2020,41(10):255−264. doi: 10.7506/spkx1002-6630-20190506-038 [27] ALFREDO V O, GABRIEL R R, LUIS C G, et al. Physicochemical properties of a fibrous fraction from chia (Salvia hispanica L. )[J]. LWT-Food Science and Technology,2009,42(1):168−173. doi: 10.1016/j.lwt.2008.05.012
[28] 郝晓华, 罗晓敏, 罗淑政, 等. 橘皮中可溶性膳食纤维理化性质的研究[J]. 中国饲料,2021(23):130−134. [HAO X H, LUO X M, LUO S Z, et al. Study on the physicochemical properties of soluble dietary fiber in orange peel[J]. China Feed,2021(23):130−134. doi: 10.15906/j.cnki.cn11-2975/s.20212325 [29] GE X, TIAN H, DING C, et al. Fecal microbiota transplantation in combination with soluble dietary fiber for treatment of slow transit constipation: A pilot study[J]. Archives of Medical Research,2016,47(3):236−242. doi: 10.1016/j.arcmed.2016.06.005
[30] HUANG J Y, LIAO J S, QI J R, et al. Structural and physicochemical properties of pectin-rich dietary fiber prepared from citrus peel[J]. Food Hydrocolloids,2020:106140.
[31] FENG S, CHENG H, XU Z, et al. Antioxidant and anti-aging activities and structural elucidation of polysaccharides from Panax notoginseng root[J]. Process Biochemistry,2019,78(5):189−199.
[32] 赵文俊, 陆思名, 彭东, 等. 美藤果粕可溶性膳食纤维的抗氧化及免疫活性评价[J]. 食品科学,2022,43(13):131−139. [ZHAO W J, LU S M, PENG D, et al. Evaluation of antioxidant and immunological activity of soluble dietary fiber from Maitake fruit meal[J]. Food Science,2022,43(13):131−139. doi: 10.7506/spkx1002-6630-20210713-143 [33] 周丽媛, 李宁阳, 徐晶晶, 等. 黑小麦麸皮可溶性膳食纤维改性制备及性质研究[J]. 中国粮油学报,2020,35(9):7−14. [ZHOU L Y, LI N Y, XU J J, et al. Preparation and properties of modified soluble dietary fiber from black wheat bran[J]. Chinese Journal of Cereals and Oils,2020,35(9):7−14. [34] 杭瑜瑜, 于淑池, 王和飞. 响应曲面法优化百香果皮可溶性膳食纤维的制备工艺及其理化性质研究[J]. 中国食品添加剂,2021,32(9):79−89. [HANG Y Y, YU S C, WANG H F. Optimization of soluble dietary fiber from passion fruit peel by response surface method and its physicochemical properties[J]. China Food Additives,2021,32(9):79−89. doi: 10.19804/j.issn1006-2513.2021.09.012 [35] 李斌. 豆渣蛋白肽与膳食纤维的提取及其功能研究[D]. 南宁: 广西大学, 2019. LI B. Extraction of soybean residue peptides and dietary fiber and its functional study[D]. Nanning: Guangxi University, 2019.
[36] YIN C, FAN X, FAN Z, et al. Optimization of enzymes-microwave-ultrasound assisted extraction ofLentinus edodes polysaccharides and determination of its antioxidant activity[J]. International Journal of Biological Macromolecules,2018,111:446−454. doi: 10.1016/j.ijbiomac.2018.01.007
[37] 王天, 江含秀, 路丽妮, 等. 藜麦可溶性膳食纤维提取工艺优化及其抗氧化活性研究[J]. 中国食品添加剂,2022,33(2):137−146. [WANG T, JIANG H X, LU L N, et al. Optimization of quinoa soluble dietary fiber extraction process and its antioxidant activity[J]. China Food Additives,2022,33(2):137−146. -
期刊类型引用(0)
其他类型引用(3)






 下载:
下载:








 下载:
下载:



