Optimization of Microwave Extraction of Active Ingredients Technology, Fingerprint Analysis and Anti-phytopathogenic Activity of Cremastra appendiculata (D. Don) Makino
-
摘要: 本文综合运用单因素和Box-Behnken响应面试验,以山慈菇提取率和其中3种主要化学成分:双[4-(葡萄糖氧)苄基-2-异丁基苹果酸酯-2-葡萄糖苷(dactylorhin A)、双[4-(葡萄糖氧)苄基]-2-异丁基苹果酸酯(militarine)和秋水仙碱的含量为综合权重指标,对其微波提取工艺进行考察。同时,利用高效液相色谱技术建立13批不同产地山慈菇的指纹图谱,明确其主要成分含量分布情况。最后,运用滤纸片扩散法,对制备的山慈菇提取物进行抗菌活性评价。结果表明:山慈菇的最佳微波提取工艺条件:乙醇浓度55%、料液比1:30 g/mL、提取时间17 min。在此条件下,山慈菇的提取率为12.83%。指纹图谱结果表明,山慈菇中3种化学成分的含量分布趋势一致,其中militarine为13批山慈菇中的共有化学成分,而dactylorhin A和秋水仙碱分别在1个产地样品中未检出,表明不同产地山慈菇中主要化学成分分布具有差异性。抗菌实验结果显示,山慈菇提取物对胶孢炭疽菌、辣椒疫霉菌、灰葡萄孢菌、茄链格孢菌、荧光假单胞菌、水稻白叶枯菌和禾谷镰孢菌均没有显示抗菌活性(抑菌圈小于6 mm),对雷尔氏菌具有较好的抑制活性(抑菌圈8.5 mm),表现出一定的抗菌选择性。本研究确定了微波提取山慈菇的最佳工艺,建立的山慈菇中3种成分同步含量分析方法稳定可行,研究结果可为山慈菇药材的质量标准建立和综合开发利用提供参考。Abstract: In this present paper, the optimization of microwave extraction (ME) of Cremastra appendiculata (D. Don) Makino was performed using the single factor design and response surface methodology. The ME extraction yield along with the contents of three major components of C. appendiculata Makino, including militarine, dactylorhin A, and colchicine was selected as the comprehensive indicators to evaluate the extraction process. Subsequently, the HPLC fingerprint of the above three components from 13 batches of C. appendiculata Makino was investigated. Finally, the anti-fungal activity of C. appendiculata Makino extract was evaluated by conducting a disk-diffusion method. The results demonstrated that the optimal ME technologies of C. appendiculata Makino were the ethanol concentration of 55%, the solid-liquid ratio of 1:30 g/mL, and the extraction time of 17 min. Under the above conditions, the extract yield was 12.83%. HPLC fingerprint analysis results showed that the contents of three major components displayed a consistent trend in all 13 tested samples. Militarine was found existed in 13 batches of C. appendiculata Makino, while dactylorhin A and colchicine were not detected in one sample. The results indicated a content difference in three active ingredients in C. appendiculata Makino from different areas. The anti-phytopathogenic activity results showed that the C. appendiculata Makino extract did not shown inhibitory activity against Colletotrichum gloeosporioides, Phytophthora capsica, Botrytis cinerea, Alternaria solani, Pseudomonas fluorescens, Xanthomnas oryzae, and Fusarium graminearum with their inhibition zones were less than 6 mm. However, the C. appendiculata Makino extract exhibited inhibitory activity toward to Ralstonia solanacearum with the diameter of the inhibition zone was 8.5 mm, showed antibacterial selectivity. In this study, the optimal ME technologies of C. appendiculata Makino was determined, and the established method the contents of three major components of C. appendiculata Makino was stable and feasible.These results can provide the basis for the quality control and comprehen-sive utilization of C. appendiculata Makinos.
-
山慈菇为兰科植物杜鹃兰(Cremastra appendiculata Makino)、独蒜兰(Pleione bulbocodioides Rolf)或云南独蒜兰(Pleione yunnanensis Rolfe)的干燥假鳞茎。《中华本草》记载,山慈菇药性甘、微辛、具有清热解毒和化痰散结功效,传统用于痈肿疔毒、痈疬痰核、蛇虫咬伤和癍瘕痞块等症的治疗[1]。现代药学研究发现,山慈菇还具有抗菌、降压及治疗痛风等多种药理活性[2-4]。文献报道,山慈菇中的化学成分主要包括菲类、联苄和丁二酸苄酯苷类[5-6]。其中,两种主要的丁二酸苄酯苷类成分:dactylorhin A和milita-rine具有显著改善实验动物学习记忆障碍和抗痴呆活性[7]。此外,山慈菇中还被报道含有秋水仙碱。该分子近年来也被证实具有抗肿瘤、抗血管生成、降压等活性[8-9]。目前,对山慈菇中活性成分的提取制备工艺研究较少,主要集中于总黄酮、总酚酸及多糖类成分[10-12],涉及的提取方法包括超声提取和回流提取法。整体上,对山慈菇中丁二酸苄酯苷和生物碱类活性成分的系统提取工艺研究比较缺乏,同时以上述3种成分为综合指标,开展山慈菇微波提取工艺研究尚未见报道。因此,聚焦山慈菇中多种活性成分,如何高效制备山慈菇提取物,充分开发其药用价值值得进一步关注。
微波提取是基于微波区域加热特点,对原料中目标分子进行选择性加热,促进其快速溶出的方法。具体来说,由于不同物质吸收微波能的能力不同,其产生的热能及传递给周围的热能也不同,这种差异使得提取体系中的目标分子被选择性加热,从而使被提取物质从基体或体系中分离出来。同时,在微波作用下,溶剂离子迁移的速度更快,增强了其对样品基体的渗透,从而缩短提取时间。因此,微波法可以用较少的溶剂,在较短的时间内获得较高的提取率。另外,与传统加热方法相比,微波法还不会破坏热敏性成分,有利于活性物质的提取[13-15]。因此,微波提取法已在多种中药提取物制备领域得到了广泛应用。如焦士龙[16]使用均匀设计法对丹参的微波提取工艺进行了优化;刘帅等[17]通过微波辅助提取法优化了提取薏苡仁中薏苡仁油的工艺。需要指出的是,微波法虽然有许多优点,但是电磁场的不均匀分布和材料的非均匀性会影响微波提取效果,同时过高的提取温度也容易导致溶质降解和超压问题[13-15]。因此,合理优化微波提取工艺条件是影响微波法应用的重要因素。通过文献调研,现阶段运用微波法优选山慈菇提取物的工艺研究还未见报道。
基于此,本文首先运用HPLC法建立山慈菇中3种成分(dactylorhin A、militarine和秋水仙碱)的同步含量分析方法,并构建13批不同产地山慈菇的指纹图谱。随后以提取率和山慈菇中3种化学成分含量进行综合权重分析,通过单因素和Box-Behnken响应面试验,考察不同乙醇浓度、料液比和提取时间对微波提取工艺的影响,优选其最佳工艺参数。最后,采用滤纸片扩散法,评价最佳工艺下制备的山慈菇提取物的抗植物病原菌活性。通过上述研究,旨在为山慈菇资源的综合利用提供参考。
1. 材料与方法
1.1 材料与仪器
实验用山慈菇药材 2020年7月,采购自湖南高桥中药材大市场。经长沙学院生物与环境工程学院陈建荣教授鉴定为中药兰科植物杜鹃兰(Cremastra appendiculata(D. Don)Makino)的假鳞茎部位。13批不同产地山慈菇药材 购自当地药材市场,具体来源见表1。
表 1 山慈菇样品产地信息Table 1. Origin information of C. appendiculata Makino编号 产地 编号 产地 S1 安徽 S8 四川 S2 安徽 S9 四川 S3 安徽 S10 四川 S4 甘肃 S11 云南 S5 河北 S12 云南 S6 河北 S13 云南 S7 四川 militarine标准品(纯度>98%)、dactylorhin A标准品(纯度>98%)、秋水仙碱标准品(纯度>98%) 均购自成都曼思特生物科技有限公司;ACCC 31200抗胶孢炭疽菌(Colletotrichum gloeosporioides)、ACCC 36278辣椒疫霉(Phytophthora capsica)、ACCC 36036灰葡萄孢(Botrytis cinerea)、ACCC 36023茄链格孢(Alternaria solani)、ACCC 61705雷尔氏菌(Ralstonia solanacearum)、ACCC 10190荧光假单胞(Pseudomonas fluorescens)、ACCC 11602水稻白叶枯(Xanthomnas oryzae)、ACCC 32250禾谷镰孢(Fusarium graminearum) 均来自中国农业微生物菌株保藏管理中心;酵母提取物、牛肉浸取物、酵母粉、葡萄糖、PDB液体培养基 均购自北京索莱宝科技有限公司;蛋白胨 购自上海盛思生化科技有限公司。
UWave-2000型多功能微波合成萃取仪 上海新仪微波化学科技有限公司;Waters e2695 高效液相色谱仪及2998 PDA检测器 美国Waters公司;N-1300V-W型旋转蒸发仪 埃朗科技国际贸易(上海)有限公司;KQ-400DE型数控超声波清洗器 昆山市超声仪器有限公司;SHZ-D(Ⅲ)型循环水式真空泵 巩义市予华仪器有限责任公司;ME204E型电子天平 梅特勒-托利多仪器有限公司;HX1002T型电子天平 慈溪市天东衡器厂;DFT-100型高速中药粉碎机 温岭市林大机械有限公司;DGG-9140BD型电热鼓风干燥箱 上海森信实验仪器有限公司;ZWM-u72-05型超纯水机 湖南中沃水务环保科技有限公司。
1.2 实验方法
1.2.1 山慈菇乙醇提取物的制备
取干燥后的山慈菇假鳞茎部位,置于粉碎机中粉碎,过60目筛,备用。称取样品粉末2.00 g,置于微波萃取仪配套的250 mL三颈烧瓶中,在微波功率400 W、提取温度50 ℃、升温时间3 min的固定条件下,以乙醇为提取溶剂,按单因素和响应面因素水平表的不同工艺参数分批进行微波提取,重复提取3次。将3次提取液合并、抽滤,所得滤液经旋转蒸发仪浓缩后转移至60 ℃烘箱烘干。烘干后,样品于−45 ℃冰箱预冷冻后,放置于真空冷冻干燥机进行冷冻干燥,最后制得浸膏,称重。提取率的计算公式如下:
1.2.2 山慈菇中3种主要化学成分HPLC含量分析方法的建立
1.2.2.1 液相色谱条件
以乙腈(A)-水(B)为流动相进行梯度洗脱。梯度条件为:(0 min,20:80(A:B);30 min,25:75(A:B))。流速1.0 mL/min,检测波长224 nm,柱温30 ℃,进样量10 μL。色谱柱:Agilent ZORBAX SB-C18(4.6 mm×250 mm,5 μm)。
1.2.2.2 供试品溶液配制
精密称取山慈菇粉末2.00 g,按“1.2.1”项下实验方法制备山慈菇浸膏,将其定容于10 mL容量瓶中,过0.45 μm微孔滤膜后待测。
1.2.2.3 标准品溶液的配制
精密称取militarine、dactylorhin A、秋水仙碱标准品适量,用适量溶剂溶解,分别制成含上述三种对照品质量浓度为0.2、0.025、0.08 mg/mL的对照品混合标准溶液。
1.2.2.4 方法学考察
精密度试验,按照“1.2.2.2”项下方法制备供试品溶液1份,在“1.2.2.1”项下色谱条件连续进样6次,计算供试品溶液中各共有峰相对保留时间和相对峰面积的RSD值。重复性试验,按照“1.2.2.2”项下方法平行制备6份供试品溶液,在“1.2.2.1”项下色谱条件测定,计算供试品溶液中各共有峰相对保留时间和相对峰面积的RSD值。稳定性试验,取同一供试品溶液在0、4、12、24 h分别进样,按“1.2.2.1”项下色谱条件测定。计算供试品溶液中各共有峰相对保留时间和相对峰面积的RSD值。
1.2.2.5 线性关系考察
对dactylorhin A、militarine、秋水仙碱的标品溶液及山慈菇样品进样分析,记录色谱图。通过对比样品和标准品的保留时间和UV紫外图谱,对共有峰进行确认。按“1.2.2.3”项下方法,制备分别含有dactylorhin A、militarine和秋水仙碱浓度依次为0、0.0131和0.0071 mg/mL;0.0063、0.0586和0.0209 mg/mL;0.0111、0.0851和0.0416 mg/mL;0.0173、0.1425和0.0645 mg/mL;0.0265、0.2108和0.0760 mg/mL的5种不同浓度混合对照品溶液,分别进样检测。以峰面积为纵坐标(y),浓度(x)为横坐标,计算3种指标成分的线性回归方程。
1.2.3 单因素筛选微波提取山慈菇活性成分提取工艺条件
为了筛选乙醇浓度对微波提取山慈菇活性成分的影响,以提取率为指标,固定提取时间15 min,料液比1:25 g/mL,进行不同乙醇浓度(35%、45%、55%、65%、75%)单因素实验;为了筛选提取时间对微波提取山慈菇活性成分的影响,以提取率为指标,固定乙醇浓度55%,料液比1:25 g/mL,进行不同提取时间(10、13、15、17、20 min)单因素实验;为了筛选料液比对微波提取山慈菇活性成分的影响,以提取率为指标,固定乙醇浓度55%和提取时间15 min,进行不同料液比(1:15、1:20、1:25、1:30、1:35 g/mL)单因素实验。
1.2.4 响应面优化微波提取山慈菇活性成分提取工艺
在单因素实验结果基础上,按“1.2.1”项下实验方法,以乙醇浓度、料液比、微波提取时间为响应因素,以提取率、militarine、dactylorhin A和秋水仙碱含量为响应值,进行响应面试验,响应面采用的因素水平如表2所示。
表 2 响应面试验因素水平设计Table 2. Factors and levels design of response surface test水平 A乙醇浓度(%) B料液比(g/mL) C提取时间(min) −1 35 1:25 13 0 45 1:30 15 1 55 1:35 17 1.2.5 13批山慈菇样品含量测定及指纹图谱的建立
按“1.2.2.2”项下方法制备13个不同产地山慈菇供试品溶液,按“1.2.2.1”项下色谱条件进样测定,计算各样品中militarine、dactylorhin A和秋水仙碱含量。利用“中药指纹图谱相似度评价系统(2012A)”软件,采用自动匹配法生成13批山慈菇样品的共有特征图谱,通过与对照指纹图谱比较,进行相似度评价。
1.2.6 山慈菇提取物抗植物病原菌活性评价
1.2.6.1 菌种活化及菌悬液制备
根据菌株特点,分别将胶孢炭疽菌、辣椒疫霉、灰葡萄孢、茄链格孢菌接种到PDB液体培养基;雷尔氏菌、荧光假单胞分别接种到NA液体培养基;水稻白叶枯菌接种到LB液体培养基上;禾谷镰孢菌接种YPG培养基上。然后将各培养基置于28 ℃、245 r/min的气浴恒温振荡器中培养12 h。用接种环挑取已活化的单克隆菌体置于含有9 mL生理盐水的离心管内,摇匀,制成菌悬液,备用。
1.2.6.2 提取液抗植物病原菌活性测定
采用滤纸扩散法对山慈菇提取液进行抗菌实验。具体方法如下:用打孔器将滤纸片制成含有6.0 mm小孔形状后,高压灭菌备用。向PDB液体培养基中分别加入胶孢炭疽菌、辣椒疫霉、灰葡萄孢、茄链格孢菌的菌种悬液各50 μL;NA液体培养基中分别加入雷尔氏菌、荧光假单胞的菌悬液各50 μL;LB液体培养基中加入水稻白叶枯菌的菌悬液50 μL;YPG培养基中加入禾谷镰孢菌的菌悬液50 μL,摇匀后倒平板,待其冷凝后,取备用的滤纸片贴在平板上。将山慈菇提取物用二甲基亚砜配制成0.5 g/mL溶液,并取0.25 mL点在滤纸中心,每个培养皿放置3片,每个菌种重复3次实验,并以二甲基亚砜作为对照。培养48 h后观察记录实验结果,比较抑菌圈的大小。
1.3 数据处理
单因素实验结果图采用Origin 2021软件进行分析处理。响应面试验利用Design Expert 8.0.6.1软件中的Box-Behnken法进行试验设计及数据分析。指纹图谱通过中药指纹图谱相似度评价系统(2012A)进行分析。
2. 结果与分析
2.1 山慈菇样品中3种主要化学成分分析
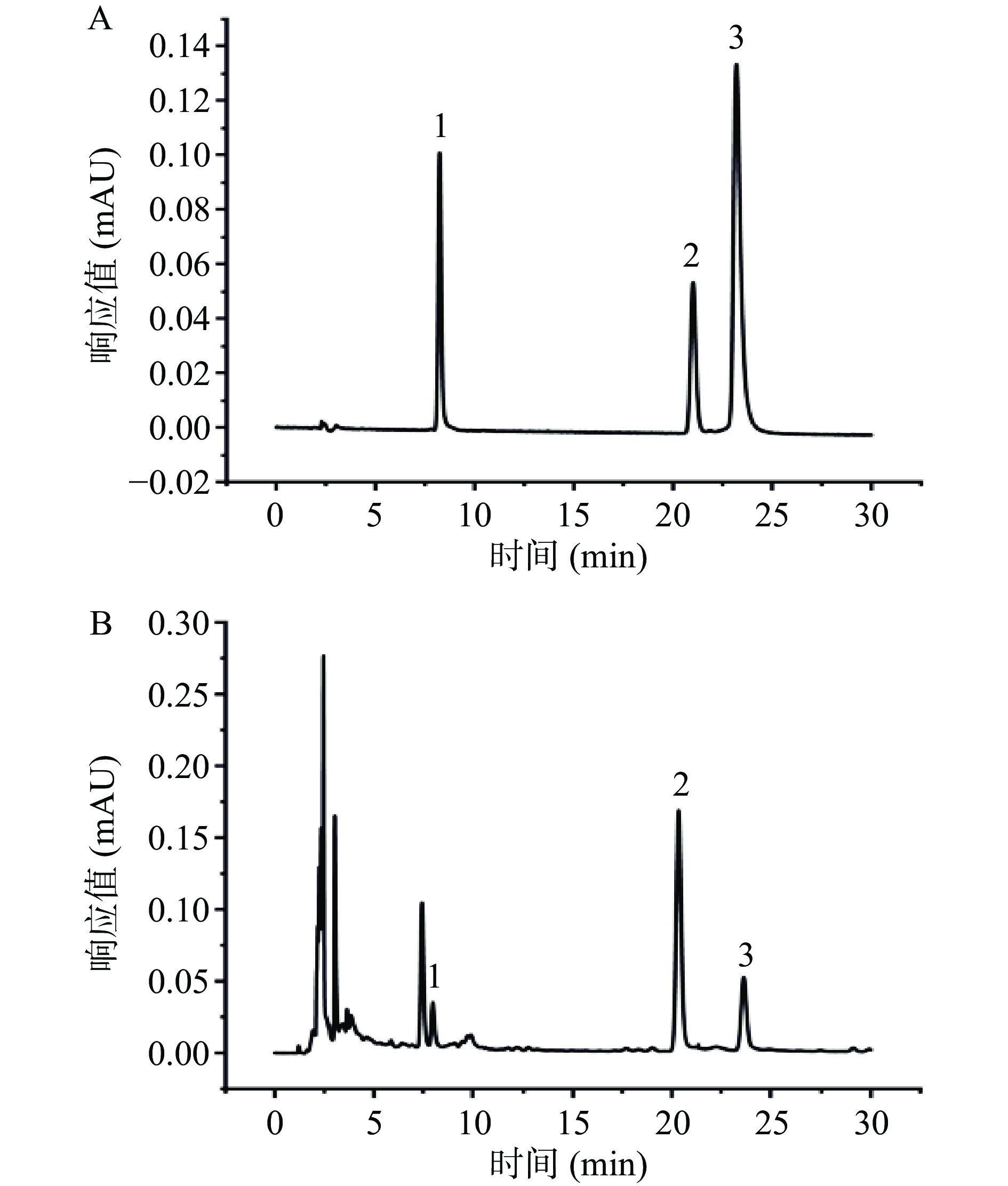
按“1.2.2.1”项下色谱条件将混合对照品和山慈菇样品分别进样。通过对比各色谱峰的保留时间和紫外吸收特征,最终确认1号峰为dactylorhin A,2号峰为militarine,3号峰为秋水仙碱,色谱图见图1 。
2.2 方法学考察结果与标准曲线的绘制
2.2.1 方法学考察结果
精密度试验,计算供试品溶液中各共有峰相对保留时间的RSD均小于1.1%,相对峰面积的RSD均小于2.4%,表示仪器精密度良好。重复性试验,计算供试品溶液中各共有峰相对保留时间的RSD均小于1%,相对峰面积的RSD均小于3.5%,表明提取和检测方法重复性良好。稳定性试验,计算供试品溶液中各共有峰相对保留时间的RSD均小于1.5%,相对峰面积的RSD均小于3.5%,表明供试品溶液在24 h内稳定。
2.2.2 标准曲线的绘制
通过对系列质量浓度的混合对照品溶液进行测定,以峰面积为纵坐标(y),浓度(x)为横坐标,计算3种指标成分的回归方程,结果见表3。从结果可以看出,militarine、dactylorhin A和秋水仙碱的决定系数(R2)分别为0.9796、0.9662、0.9857,说明这3种主要化学成分在0.0131~0.2108、0~0.0265、0~0.0265 mg/g范围内线性关系良好。
表 3 山慈菇中3种化学成分线性关系考察结果Table 3. Investigation results of linear relationship of three chemical components in Cremastra appendiculata Makino指标成分 回归方程 线性范围(mg/g) 决定系数(R2) militarine y=21179905.98x−58615.41 0.0131~0.2108 0.9796 dactylorhin A y=12153222.22x+19139.89 0~0.0265 0.9662 秋水仙碱 y=23638668.29x+154550.73 0~0.0265 0.9857 2.3 单因素实验结果
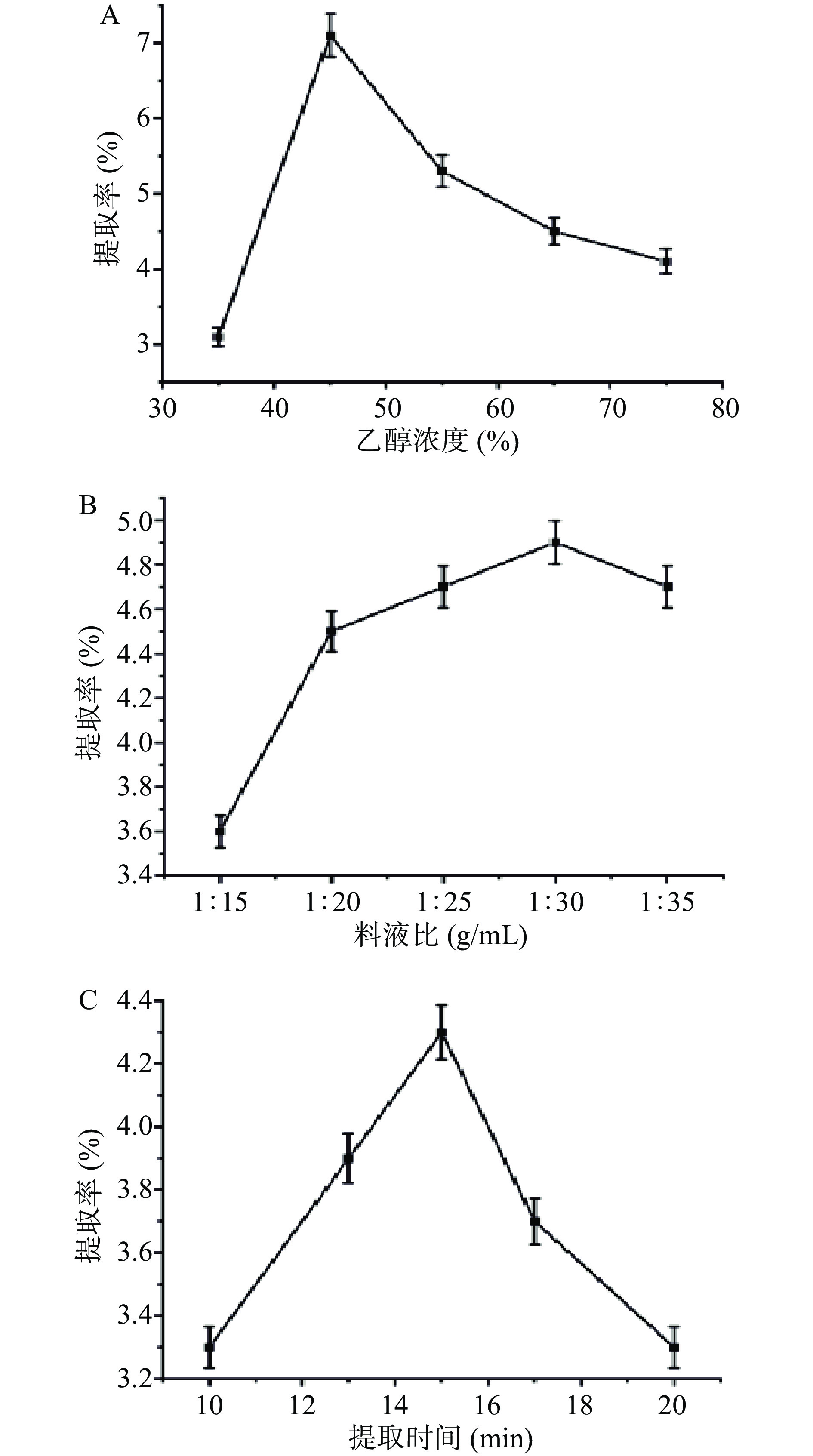
按“1.2.3”项下实验条件进行微波提取山慈菇活性成分工艺的单因素条件优选,结果见图2。
由图可知,乙醇浓度在35%~45%区间时,提取率明显增加,且在浓度为45%时提取率达到最大值,而浓度在45%~75%区间时,提取率呈下降趋势。分析原因,这可能与乙醇浓度的变化会改变溶剂的物理性质,如密度、动态粘度和介电常数,进而改变化合物的溶解度有关[18]。当料液比为1:15~1:20 g/mL时,提取率明显增加,在1:20~1:30 g/mL时增加较缓慢,在1:30 g/mL时达到最大值后呈下降趋势,这可能与传质原理一致。具体来说,传质过程驱动力是固体和液体本体之间的浓度梯度,当使用较高的料液比时,浓度梯度更大。此外,萃取物与溶剂的相互作用可能会改变活性系数,从而影响山慈菇提取率[19]。当提取时间为10~15 min时,提取率急剧增加,且出现曲线峰值,提取率在15 min达到最大值;提取时间在超过15 min时,提取率开始下降。分析原因,这可能因为随着提取时间的延长,化合物逐渐溶解释放到溶质中,提取率升高,时间增加到一定程度后,化合物被破坏,故提取率下降[20]。因此,可以选择35%、45%、55%三种不同乙醇浓度;1:25、1:30、1:35 g/mL三种不同料液比和13、15、17 min三种不同提取时间作为后续优化实验参数。
2.4 响应面优化试验结果
在单因素实验结果基础上,以乙醇浓度、料液比、提取时间为响应因素,以提取率、militarine、dactylorhin A和秋水仙碱含量为响应值,采用Box-Behnken设计-响应面法设计3因素3水平工艺优选实验,进一步考察多种因素交互作用对制备山慈菇提取物的影响。结果见表4。
表 4 响应面试验设计与结果Table 4. Box-Behnken design and corresponding experimental results序号 A B C 提取率
(%)militarine含
量(mg/g)dactylorhin A
含量(mg/g)秋水仙碱
含量(mg/g)综合评
分(P)1 0 0 0 12.33 2.653 0.823 0.626 0.6826 2 1 0 −1 10.04 3.025 1.000 0.937 0.8605 3 0 0 0 12.54 2.235 0.710 0.570 0.5950 4 0 0 0 12.54 2.760 0.900 0.511 0.6785 5 −1 0 1 4.10 1.060 0.265 0.249 0.2539 6 0 −1 1 6.55 1.620 0.450 0.451 0.4226 7 0 −1 −1 5.41 1.380 0.385 0.330 0.3435 8 0 1 1 12.08 2.225 0.730 0.533 0.5877 9 −1 −1 0 2.58 0.525 0.105 0.105 0.1134 10 1 −1 0 8.45 2.275 0.775 0.646 0.6362 11 0 0 0 13.32 2.985 0.989 0.554 0.7383 12 0 0 0 10.04 2.020 0.645 0.552 0.5488 13 −1 0 −1 6.41 1.300 0.380 0.318 0.3319 14 1 1 0 10.28 0.835 1.060 0.869 0.6510 15 0 1 −1 11.83 2.375 0.750 0.683 0.6535 16 1 0 1 10.08 3.200 1.085 0.968 0.9101 17 −1 1 0 4.95 0.780 0.095 0.178 0.1595 2.4.1 权重分析法
采用Hassan[21]法,对表4中各组指标数据进行综合权重分析,将每个指标进行归一化处理。对于取值越大越好的指标,归一值的计算公式为:di=(Yi−Ymin)/(Ymax−Ymin)。对于取值越小越好的指标,归一值的计算公为:di=(Ymax−Yi)/(Ymax−Ymin)。基于此,对各指标归一化值给予不同的权重系数:militarine、dactylorhin A和秋水仙碱三种成分的含量为主指标,权重系数设置为0.3;山慈菇提取率为次指标,权重系数设为0.1[22-23]。因此,确定最终的综合评分值(P)=0.1×提取率+0.3×(A/Amax)+0.3×(B/Bmax)+0.3×(C/Cmax)。其中,Amax~Cmax分别为各成分对应的最高含量。综合权重分析的结果见表4。
2.4.2 数据处理与分析
使用Design-Expert 8.0.6软件对表4数据进行处理,计算回归系数,得山慈菇微波提取综合评分的二次多项回归模型:P=0.65+0.27A+0.067B−0.002C−0.008AB+0.032AC−0.036 BC−0.086A2−0.17B2+0.026C2。山慈菇提取工艺优化的方差分析结果见表5。
表 5 回归模型的方差分析Table 5. Variance analysis of the fitted regression model方差来源 平方和 自由度 均方 F值 P值 模型 0.81 9 0.090 13.14 0.0013** A 0.60 1 0.60 87.74 <0.0001** B 0.036 1 0.036 5.21 0.0564 C 0.0000285 1 0.0000285 0.004137 0.9505 AB 0.0002449 1 0.0002449 0.036 0.8558 AC 0.00407 1 0.00407 0.59 0.4672 BC 0.005249 1 0.005249 0.76 0.4117 A2 0.031 1 0.031 4.49 0.0719 B2 0.13 1 0.13 18.28 0.0037** C2 0.002875 1 0.002875 0.42 0.5389 残差 0.048 7 0.006889 失拟项 0.025 3 0.008432 1.47 0.3492 纯误差 0.023 4 0.005732 总和 0.86 16 注:**表示差异极显著,P<0.01;*表示差异显著,P<0.05。 F值和P值可以用来表示模型的显著性,F值越大,模型显著性检验多元相关系数P值越小,表明该模型显著性越好。由表5可知,二次多项式拟合模型极显著(P=0.0013),相关系数为R2=0.9441,而失拟项 P =0.3492>0.05,差异不显著,说明模型的理论与实际的拟合性较好,该模型可以很好地反映出实验真实值。一次项A和二次项B2对综合评分有极显著影响(P<0.01)。通过F值可以判断在本实验中3个因素对综合评分的影响大小依次为:乙醇浓度>液料比>提取时间。
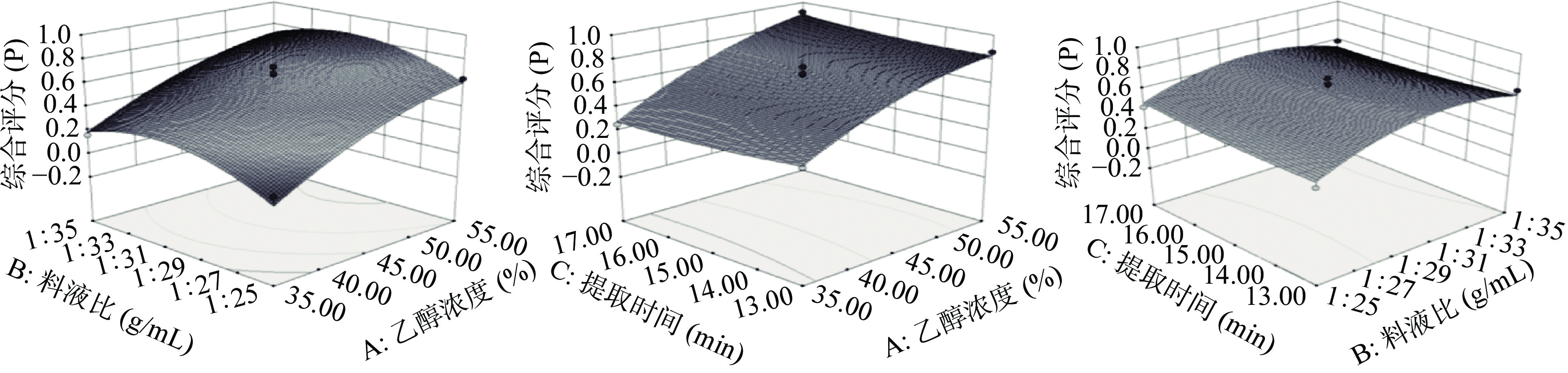
利用Design-Expert 8.0.6软件对上述回归方程作3D曲面图,结果见图3。可以看出,相比料液比,乙醇浓度对应响应面坡度陡峭,提示乙醇浓度比料液比对综合评分的影响更明显;同理,与提取时间相比,料液比对响应面图的影响更大,表示料液比对综合评分的影响更明显,与表5结果相同。
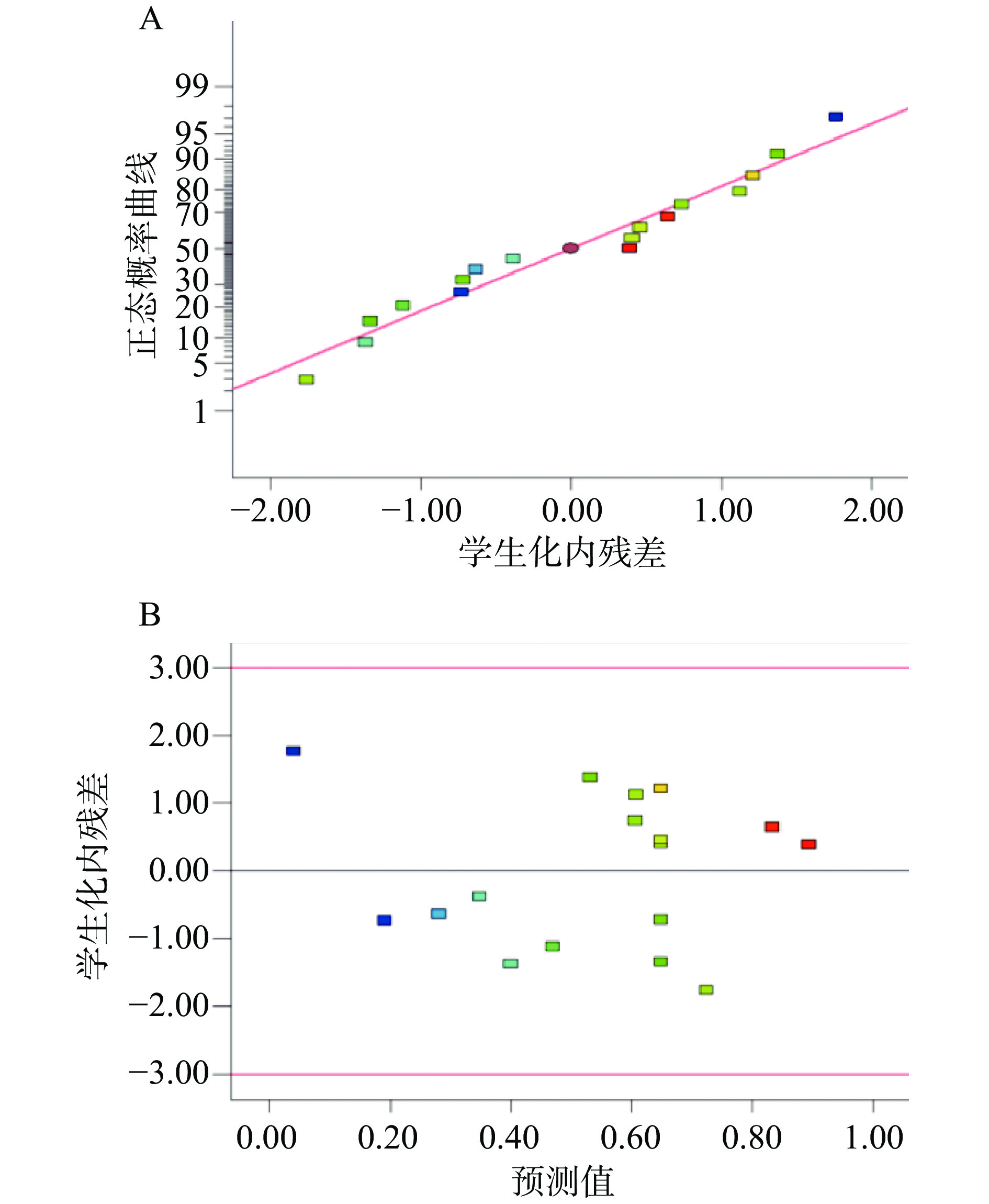
进一步对模型进行残差分析,以判断建立的响应面优化模型的准确性。残差正态分布图见图4(A),预测值与残差见图4(B)。
由图4(A)可知,该模型残差拟合曲面图中各散点分布符合线性态势且呈正态概率分布。由图4(B)可知,经过响应面试验优化之后,预测值的内部优化残差呈现散点式的随机分布,说明残差的方差齐性符合要求。因此,试验拟合的数值模型是可行的。
综上,各因素对综合评分的主要效应关系为乙醇浓度>料液比>提取时间。根据响应面法试验得到的最佳提取工艺为:乙醇浓度55.00%、料液比1:30.34 g/mL、提取时间17.00 min,综合评分0.8948。
2.4.3 验证试验
为检验上述微波提取工艺条件的可靠性,在最佳提取工艺条件下进行3次验证性实验,结果取平均值。最终考虑实验的可行性,将最佳提取工艺参数调整为:乙醇浓度55%、料液比1:30 g/mL、提取时间17 min。在该提取条件下山慈菇提取率为12.83%,militarine含量为3.3023 mg/g、dactylorhin A含量为1.1138 mg/g、秋水仙碱含量为0.8802 mg/g,综合评分值可达0.9032。该结果与理论预测值接近,说明运用响应面分析法提供的模型准确可靠。
2.5 13批不同产地山慈菇样品含量测定结果及指纹图谱相似性评价
2.5.1 13批不同产地山慈菇样品含量测定结果
按“1.2.2.1”项下色谱条件对不同产地山慈菇进行含量测定,结果见表6。结果表明,13批样品中,3种化学成分在11批样品中同时被检测出,而dactylorhin A在S1样品、秋水仙碱在S13样品中未被发现。从含量高低来看,13批山慈菇样品中3种化学成分的含量分布趋势一致,militarine为主要成分,含量在1.289~7.234 mg/g之间;其次为dactylorhin A,含量在0.208~1.857 mg/g之间,而秋水仙碱的含量相对较低,含量在0.151~2.782 mg/g之间。从产地来看,S10(四川)样品中3种成分的含量最高,而S13(云南)样品中3种成分的含量最低。不同产地来源山慈菇样品中3种成分的含量差异分析除了与不同产地的土壤环境、气候因素关系外,还可能与药材保存条件、采收时期甚至药材基源存在一定联系,上述问题有待进一步研究。
表 6 不同产地13批山慈菇中3种化学成分含量测定结果Table 6. Determination results of 3 chemical components in 13 batches of Cremastra appendiculata Makino from different habitats成分 含量(mg/g) S1 S2 S3 S4 S5 S6 S7 S8 S9 S10 S11 S12 S13 militarine 4.122 4.626 2.141 2.823 3.499 2.744 5.111 2.861 4.776 7.234 2.675 4.639 1.289 dactylorhin A - 1.828 0.840 1.770 0.795 1.032 1.051 0.796 1.258 1.857 1.328 1.399 0.208 秋水仙碱 0.517 0.916 0.151 0.548 0.671 0.477 1.176 0.407 0.828 2.782 0.333 0.803 - 注:“-”表示未检出。 2.5.2 山慈菇指纹图谱相似性评价结果
利用“中药指纹图谱相似度评价系统(2012A)”软件,采用自动匹配法生成共有特征图谱,确定共有峰,并分析各样品之间共有峰和相似度(图5)。以最佳微波提取工艺条件下制备的样品作为对照,对 13批山慈菇样品进行指纹图谱分析。结果发现,S1~S13相似度均≥0.924(表7)。
表 7 13批山慈菇样品的指纹图谱与对照指纹图谱相似度评价结果Table 7. Evaluation results of similarity between fingerprints of 13 batches of Cremastra appendiculata Makino samples and control fingerprints样品 相似度 S1 S2 S3 S4 S5 S6 S7 S8 S9 S10 S11 S12 S13 对照 S1 1.000 0.978 0.975 0.944 0.989 0.975 0.991 0.987 0.990 0.973 0.999 0.987 0.991 0.994 S2 0.978 1.000 1.000 0.929 0.971 0.959 0.973 0.968 0.969 0.963 0.979 0.967 0.968 0.982 S3 0.975 1.000 1.000 0.924 0.967 0.954 0.969 0.964 0.966 0.956 0.975 0.963 0.965 0.978 S4 0.944 0.929 0.924 1.000 0.942 0.93 0.944 0.938 0.938 0.939 0.948 0.935 0.934 0.952 S5 0.989 0.971 0.967 0.942 1.000 0.972 1.000 0.999 0.981 0.978 0.992 0.978 0.979 0.993 S6 0.975 0.959 0.954 0.930 0.972 1.000 0.973 0.968 0.996 0.992 0.979 0.997 0.991 0.989 S7 0.991 0.973 0.969 0.944 1.000 0.973 1.000 0.999 0.983 0.98 0.994 0.980 0.981 0.994 S8 0.987 0.968 0.964 0.938 0.999 0.968 0.999 1.000 0.978 0.972 0.988 0.976 0.977 0.990 S9 0.990 0.969 0.966 0.938 0.981 0.996 0.983 0.978 1.000 0.987 0.990 1.000 0.999 0.995 S10 0.973 0.963 0.956 0.939 0.978 0.992 0.98 0.972 0.987 1.000 0.982 0.987 0.977 0.990 S11 0.999 0.979 0.975 0.948 0.992 0.979 0.994 0.988 0.990 0.982 1.000 0.987 0.989 0.997 S12 0.987 0.967 0.963 0.935 0.978 0.997 0.980 0.976 1.000 0.987 0.987 1.000 0.998 0.993 S13 0.991 0.968 0.965 0.934 0.979 0.991 0.981 0.977 0.999 0.977 0.989 0.998 1.000 0.992 对照 0.994 0.982 0.978 0.952 0.993 0.989 0.994 0.990 0.995 0.990 0.997 0.993 0.992 1.000 2.6 山慈菇提取物抗植物病原菌活性评价结果
一般地,抑菌圈直径大于8 mm表示抑菌效果明显,抑菌圈直径为6~8 mm表示抑菌效果一般,小于6 mm则表示没有抑菌作用[24]。按“1.2.6”项下进行实验,由图6及表8结果可知,山慈菇提取液处理雷尔氏菌48 h后,抑菌圈直径为8.5 mm,说明其对该菌具有明显的抑制活性。但是,山慈菇提取液对其它7株植物病原菌(胶孢炭疽菌、辣椒疫霉、灰葡萄孢、茄链格孢、荧光假单胞、水稻白叶枯、禾谷镰孢)菌种处理48 h后,抑菌圈均小于6 mm,说明其对上述菌株无抑菌活性,提示山慈菇提取物在抗植物病原菌活性上显示了一定的选择性。
表 8 山慈菇提取物抗植物病原菌抑菌圈直径Table 8. Diameter of inhibition zone of phytopathogenic bacteria in the extract of Cremastra appendiculata Makino菌种编号 抑菌圈直径(mm) ACCC 31200 抗胶孢炭疽菌
(Colletotrichum gloeosporioides)<6 ACCC 36278辣椒疫霉
(Phytophthora capsica)<6 ACCC 36036灰葡萄孢
(Botrytis cinerea)<6 ACCC 36023茄链格孢
(Alternaria solani)<6 ACCC 61705雷尔氏菌
(Ralstonia solanacearum)8.5 ACCC 10190荧光假单胞
(Pseudomonas fluorescens)<6 ACCC 11602水稻白叶枯
(Xanthomnas oryzae)<6 ACCC 32250禾谷镰孢
(Fusarium graminearum)<6 3. 讨论与结论
本课题考察了甲醇-水、乙腈-水两种流动相体系的分离效果,发现以乙腈(A)-水(B)为流动相时分离效果最好。同时,参考相关文献[25-27]考察了(0 min,20:80;30 min,55:45;35 min,55:45)、(0 min,20:80;30 min,40:60)、(0 min,20:80;60 min,52:48)等多种洗脱梯度条件。最终发现,在梯度条件为(0 min,20:80;30 min,25:75)时山慈菇样品中各组分分离效果最佳。此外,还对柱温、流速进行了考察,发现当柱温设置30 ℃、流速为1.0 mL/min时色谱峰的分离度最好。前期有文献[25]报道了山慈菇中两种化学成分dactylorhin A 和militarine的含量分析方法,也得出了它们为山慈菇中主要化学成分的结论。本文进一步建立了同步分析dactylorhin A、militarine和秋水仙碱3种成分的HPLC分析方法,丰富了含量分析指标。
本文采用单因素和响应面试验优化提取工艺,得到微波提取山慈菇活性成分最佳提取工艺条件为乙醇浓度55%、料液比1:30 g/mL、提取时间17 min。验证实验结果与预测值接近,表明运用Box-Behnken响应面法获得的模型准确可靠。
对13批不同产地山慈菇进行HPLC含量测定及指纹图谱分析发现,不同产地山慈菇中3种主要成分的含量分布趋势一致,但是3种成分之间的含量具有一定差异。另外,2份样品中还且存在dactylorhin A、秋水仙碱未检出的现象。这种含量差异与药材的生长环境、采收时间等有关。从山慈菇药材的道地性来看,市面上山慈菇质量层次不齐,有伪劣山慈菇存在,如山兰、光慈菇。从质量标准来看,20版药典中尚没有对山慈菇进行指标性成分的含量分析标准。结合文献及本文文献结果,dactylorhin A、militarine和秋水仙碱为山慈菇主要活性成分,且具有一定的含量。是否能将上述3种化合物作为质量标志物建立山慈菇的质量标准,需要进一步从药理角度阐述它们的含量高低与山慈菇药用活性功能之间的联系。另外,通过对山慈菇样品进行抗植物病原菌活性评价发现其提取物仅对雷尔氏菌有较强抑制作用,显示了一定的选择性,但抑菌机制尚不清楚,也有待进一步研究。
综上,本研究建立了山慈菇中3中成分的HPLC分析方法并优选了其微波提取工艺。同时,采用滤纸片扩散法,评价了山慈菇提取物的抗植物病原菌活性。上述研究结果可山慈菇资源的质量标准就建立和综合利用提供参考。
-
表 1 山慈菇样品产地信息
Table 1 Origin information of C. appendiculata Makino
编号 产地 编号 产地 S1 安徽 S8 四川 S2 安徽 S9 四川 S3 安徽 S10 四川 S4 甘肃 S11 云南 S5 河北 S12 云南 S6 河北 S13 云南 S7 四川 表 2 响应面试验因素水平设计
Table 2 Factors and levels design of response surface test
水平 A乙醇浓度(%) B料液比(g/mL) C提取时间(min) −1 35 1:25 13 0 45 1:30 15 1 55 1:35 17 表 3 山慈菇中3种化学成分线性关系考察结果
Table 3 Investigation results of linear relationship of three chemical components in Cremastra appendiculata Makino
指标成分 回归方程 线性范围(mg/g) 决定系数(R2) militarine y=21179905.98x−58615.41 0.0131~0.2108 0.9796 dactylorhin A y=12153222.22x+19139.89 0~0.0265 0.9662 秋水仙碱 y=23638668.29x+154550.73 0~0.0265 0.9857 表 4 响应面试验设计与结果
Table 4 Box-Behnken design and corresponding experimental results
序号 A B C 提取率
(%)militarine含
量(mg/g)dactylorhin A
含量(mg/g)秋水仙碱
含量(mg/g)综合评
分(P)1 0 0 0 12.33 2.653 0.823 0.626 0.6826 2 1 0 −1 10.04 3.025 1.000 0.937 0.8605 3 0 0 0 12.54 2.235 0.710 0.570 0.5950 4 0 0 0 12.54 2.760 0.900 0.511 0.6785 5 −1 0 1 4.10 1.060 0.265 0.249 0.2539 6 0 −1 1 6.55 1.620 0.450 0.451 0.4226 7 0 −1 −1 5.41 1.380 0.385 0.330 0.3435 8 0 1 1 12.08 2.225 0.730 0.533 0.5877 9 −1 −1 0 2.58 0.525 0.105 0.105 0.1134 10 1 −1 0 8.45 2.275 0.775 0.646 0.6362 11 0 0 0 13.32 2.985 0.989 0.554 0.7383 12 0 0 0 10.04 2.020 0.645 0.552 0.5488 13 −1 0 −1 6.41 1.300 0.380 0.318 0.3319 14 1 1 0 10.28 0.835 1.060 0.869 0.6510 15 0 1 −1 11.83 2.375 0.750 0.683 0.6535 16 1 0 1 10.08 3.200 1.085 0.968 0.9101 17 −1 1 0 4.95 0.780 0.095 0.178 0.1595 表 5 回归模型的方差分析
Table 5 Variance analysis of the fitted regression model
方差来源 平方和 自由度 均方 F值 P值 模型 0.81 9 0.090 13.14 0.0013** A 0.60 1 0.60 87.74 <0.0001** B 0.036 1 0.036 5.21 0.0564 C 0.0000285 1 0.0000285 0.004137 0.9505 AB 0.0002449 1 0.0002449 0.036 0.8558 AC 0.00407 1 0.00407 0.59 0.4672 BC 0.005249 1 0.005249 0.76 0.4117 A2 0.031 1 0.031 4.49 0.0719 B2 0.13 1 0.13 18.28 0.0037** C2 0.002875 1 0.002875 0.42 0.5389 残差 0.048 7 0.006889 失拟项 0.025 3 0.008432 1.47 0.3492 纯误差 0.023 4 0.005732 总和 0.86 16 注:**表示差异极显著,P<0.01;*表示差异显著,P<0.05。 表 6 不同产地13批山慈菇中3种化学成分含量测定结果
Table 6 Determination results of 3 chemical components in 13 batches of Cremastra appendiculata Makino from different habitats
成分 含量(mg/g) S1 S2 S3 S4 S5 S6 S7 S8 S9 S10 S11 S12 S13 militarine 4.122 4.626 2.141 2.823 3.499 2.744 5.111 2.861 4.776 7.234 2.675 4.639 1.289 dactylorhin A - 1.828 0.840 1.770 0.795 1.032 1.051 0.796 1.258 1.857 1.328 1.399 0.208 秋水仙碱 0.517 0.916 0.151 0.548 0.671 0.477 1.176 0.407 0.828 2.782 0.333 0.803 - 注:“-”表示未检出。 表 7 13批山慈菇样品的指纹图谱与对照指纹图谱相似度评价结果
Table 7 Evaluation results of similarity between fingerprints of 13 batches of Cremastra appendiculata Makino samples and control fingerprints
样品 相似度 S1 S2 S3 S4 S5 S6 S7 S8 S9 S10 S11 S12 S13 对照 S1 1.000 0.978 0.975 0.944 0.989 0.975 0.991 0.987 0.990 0.973 0.999 0.987 0.991 0.994 S2 0.978 1.000 1.000 0.929 0.971 0.959 0.973 0.968 0.969 0.963 0.979 0.967 0.968 0.982 S3 0.975 1.000 1.000 0.924 0.967 0.954 0.969 0.964 0.966 0.956 0.975 0.963 0.965 0.978 S4 0.944 0.929 0.924 1.000 0.942 0.93 0.944 0.938 0.938 0.939 0.948 0.935 0.934 0.952 S5 0.989 0.971 0.967 0.942 1.000 0.972 1.000 0.999 0.981 0.978 0.992 0.978 0.979 0.993 S6 0.975 0.959 0.954 0.930 0.972 1.000 0.973 0.968 0.996 0.992 0.979 0.997 0.991 0.989 S7 0.991 0.973 0.969 0.944 1.000 0.973 1.000 0.999 0.983 0.98 0.994 0.980 0.981 0.994 S8 0.987 0.968 0.964 0.938 0.999 0.968 0.999 1.000 0.978 0.972 0.988 0.976 0.977 0.990 S9 0.990 0.969 0.966 0.938 0.981 0.996 0.983 0.978 1.000 0.987 0.990 1.000 0.999 0.995 S10 0.973 0.963 0.956 0.939 0.978 0.992 0.98 0.972 0.987 1.000 0.982 0.987 0.977 0.990 S11 0.999 0.979 0.975 0.948 0.992 0.979 0.994 0.988 0.990 0.982 1.000 0.987 0.989 0.997 S12 0.987 0.967 0.963 0.935 0.978 0.997 0.980 0.976 1.000 0.987 0.987 1.000 0.998 0.993 S13 0.991 0.968 0.965 0.934 0.979 0.991 0.981 0.977 0.999 0.977 0.989 0.998 1.000 0.992 对照 0.994 0.982 0.978 0.952 0.993 0.989 0.994 0.990 0.995 0.990 0.997 0.993 0.992 1.000 表 8 山慈菇提取物抗植物病原菌抑菌圈直径
Table 8 Diameter of inhibition zone of phytopathogenic bacteria in the extract of Cremastra appendiculata Makino
菌种编号 抑菌圈直径(mm) ACCC 31200 抗胶孢炭疽菌
(Colletotrichum gloeosporioides)<6 ACCC 36278辣椒疫霉
(Phytophthora capsica)<6 ACCC 36036灰葡萄孢
(Botrytis cinerea)<6 ACCC 36023茄链格孢
(Alternaria solani)<6 ACCC 61705雷尔氏菌
(Ralstonia solanacearum)8.5 ACCC 10190荧光假单胞
(Pseudomonas fluorescens)<6 ACCC 11602水稻白叶枯
(Xanthomnas oryzae)<6 ACCC 32250禾谷镰孢
(Fusarium graminearum)<6 -
[1] 国家药典委员会. 中华人民共和国药典: 一部[M]. 北京: 中国医药科技出版社, 2015: 32 Chinese Pharmacopoeia Commission. Pharmacopoeia of the People’s Republic of China: One[M]. Beijing: China Medical Science Press, 2015: 32.
[2] 李琦, 陈宇纵, 幸海量. 山慈菇的化学成分及药理作用研究进度[J]. 药学实践杂志,2014,32:250−253. [LI Q, CHEN Y Z, XING H L. Research progress of Shancigu on chemical composition and pharmacological effects[J]. Journal of Pharmaceutical Practice,2014,32:250−253. [3] SHIM J S, KIM J H, LEE J, et al. Anti-angiogenic activity of a homoisoflavanone from Cremastra appendiculata[J]. Planta Medica,2004,70(2):171−173. doi: 10.1055/s-2004-815496
[4] SUN L N. Research progress on chemical constituents and pharmacological activities of pseudo phosphorous stem of Cremastra appendiculata[J]. Chinese Traditional and Herbal Drugs,2018:5672−5682.
[5] 薛震, 李帅, 王素娟, 等. 山慈菇Cremastra appendiculata化学成分[J]. 中国中药杂志,2005,30(7):511−513. [XUE Z, LI S, WANG S J, et al. Studies on chemical constituents from the corm of Cremastra appendiculata[J]. China J Chin Mater Med,2005,30(7):511−513. doi: 10.3321/j.issn:1001-5302.2005.07.009 [6] LIU L, LI J, ZENG K W, et al. Three new phenanthrenes from Cremastra appendiculata (D. Don) Makino[J]. Chinese Chemical Letters,2013,24(8):737−739. doi: 10.1016/j.cclet.2013.03.045
[7] 韩少伟, 王超, 崔保松, 等. 独蒜兰中丁二酸苄酯苷类化学成分的研究[J]. 中国中药杂志,2015,40(5):908−914. [HAN S W, WANG C, CUI B S, et al. Studies on glucosyloxybenzyl 2-isobutylmalates of Pleione bulbocodioides[J]. China J Chin Mater Med,2015,40(5):908−914. [8] 郭淳, 龚永杰, 孙放, 等. 山慈菇水煎剂对人乳腺癌T-47D细胞增殖和迁移的影响[J]. 中医学报,2017,32(10):1832−1835. [GUO C, GONG Y J, SUN F, et al. Effect of iphigenia decoction on proliferation and migration of human breast cancer cell line T-47D[J]. Journal of Chinese Medicine,2017,32(10):1832−1835. doi: 10.16368/j.issn.1674-8999.2017.10.482 [9] LIU J, HE C, TANG Y, et al. Cremastra appendiculata (D. Don) Makino, a potential anti-tumor traditional Chinese medicine[J]. Journal of Ethnopharmacology,2021:114357.
[10] 凌永梅, 谢典, 朱聪, 等. 山慈菇中总酚酸的提取工艺优化[J]. 江西科技师范大学学报,2021(6):106−110. [LING Y M, XIE D, ZHU C, et al. Optimization of extraction process of total phenolic acids from Cremastrae pseudobulbus[J]. Journal of Jiangxi Normal University of Science and Technology,2021(6):106−110. doi: 10.3969/j.issn.1007-3558.2021.06.020 [11] 王萌萌, 谢典, 周育芳, 等. 山慈菇中总黄酮的提取工艺优化[J]. 中国药房,2019,30(14):1949−1952. [WANG M M, XIE D, ZHOU Y F. Optimization of the extraction technology of total flavonoids from Typhonium divaricatum[J]. Chinese Pharmacy,2019,30(14):1949−1952. [12] 王静, 肖秋肖, 肖红琴, 等. 响应面法优化山慈菇多糖的水提醇沉法工艺[J]. 贵州农业科学,2021,49(7):134−141. [WANG J, XIAO Q X, XIAO H Q, et al. Optimization of water-extraction and alcohol-precipitation method for Cremastra appendiculata polysaccharide by response surface method[J]. Guizhou Agricultural Sciences,2021,49(7):134−141. doi: 10.3969/j.issn.1001-3601.2021.07.022 [13] ANI A, IOAN C, VASILE L. Microwave extraction of active principles from medicinal plants[J]. UPB Scientific Bulletin, Series B,2012,74(2):1454−2331.
[14] DELAZAR A, NAHAR L, HAMEDEYAZDAN S, et al. Microwave-assisted extraction in natural products isolation[J]. Natural Products Isolation,2012:89−115.
[15] LETALLIER M, BUDZINSKI H. Microwave assisted extraction of organic compounds[J]. Analusis,1999,27(3):259−270. doi: 10.1051/analusis:1999116
[16] 焦士龙. 微波提取中药有效成分实验研究[D]. 天津: 天津大学, 2006: 130 JIAO S L. Experimental study on microwave extracting efficacious components from Chinese herbal medicine[D]. Tianjin: Tianjin University, 2006, 130.
[17] 刘帅, 高丽莉, 潘丹阳. 微波辅助提取薏苡仁油工艺优化[J]. 食品工业科技,2019,40(8):145−150. [LIU S, GAO L L, PAN D Y. optimization of microwave-assisted extraction technique of cox seed oil[J]. Science and Technology of Food Industry,2019,40(8):145−150. doi: 10.13386/j.issn1002-0306.2019.08.025 [18] ELBOUGHDIRI N. Effect of time, solvent-solid ratio, ethanol concentration and temperature on extraction yield of phenolic compounds from olive leaves[J]. Engineering, Technology & Applied Science Research,2018,8(2):2805−2808.
[19] RADOJKOVIĆ M, ZEKOVIĆ Z, JOKIĆ S, et al. Optimization of solid-liquid extraction of antioxidants from black mulberry leaves by response surface methodology[J]. Food Technology and Biotechnology,2012,50(2):167−176.
[20] LI J, LIU Y, FAN L, et al. Antioxidant activities of polysaccharides from the fruiting bodies of Zizyphus jujuba cv. Jinsixiaozao[J]. Carbohydrate Polymers,2011,84(1):390−394. doi: 10.1016/j.carbpol.2010.11.051
[21] 吴伟, 崔光华, 陆彬. 试验设计中多指标的优化: 星点设计和总评“归一值”的应用[J]. 中国药学杂志,2000(8):26−29. [WU W, CUI G H, LU B. Optimization of multiple variables: Application of central composite design and overall desirability[J]. Chinese Journal of Pharmaceuticals,2000(8):26−29. [22] 文冉, 吕青涛, 李娜, 等. 基于综合加权评分-Box-Behnken响应面法优化半枝莲的提取工艺[J]. 中药材,2020,43(5):1181−1185. [WEN R, LÜ Q T, LI N, et al. Optimization of extraction process of Scutellaria barbata based on box-behnken response surface methodology combined with comprehensive weighted scoring analysis[J]. Chinese Medicinal Materials,2020,43(5):1181−1185. [23] 唐鹏程, 王文渊, 雷干农, 等. 综合评分法优化橘皮中有效成分的提取工艺[J]. 食品研究与开发,2021,42(15):79−83. [TANG P C, WANG W Y, LEI G N, et al. Optimization of extraction technology for active components of orange peel by comprehensive scoring[J]. Food Research and Development,2021,42(15):79−83. doi: 10.12161/j.issn.1005-6521.2021.15.013 [24] 廖建良, 吴国祥, 曾令达, 等. 沉香提取物的抑菌活性[J]. 江苏农业科学,2013,41(6):285−287. [LIAO J L, WU G X, ZENG L D, et al. Antibacterial activity of agarwood extract[J]. Jiangsu Agricultural Sciences,2013,41(6):285−287. doi: 10.3969/j.issn.1002-1302.2013.06.105 [25] 崔保松, 宋杰, 李帅, 等. RP-HPLC同时测定山慈菇药材中dactylorhin A和militarine的含量[J]. 中国中药杂志,2013,38(24):4347−4350. [CUI B S, SONG J, LI S, et al. Determination of dactylorhin A and militarine in three varieties of Cremastrae pseudobulbus/Pleiones pseudobulbus by HPLC[J]. China J Chin Mater Med,2013,38(24):4347−4350. [26] 吕林锋, 蒋永海, 朱希, 等. 山慈菇HPLC指纹图谱质量评价[J]. 中国现代应用药学,2016,33(10):1276−1280. [LÜ L F, JIANG Y H, ZHU X, et al. Study on HPLC fingerprints of Cremastrae pseudobulbus pleiones pseudobulbus[J]. Chin J Mod Appl Pharm,2016,33(10):1276−1280. doi: 10.13748/j.cnki.issn1007-7693.2016.10.013 [27] 管伦兴, 储益平. 云南丽江山慈菇品种考证及有效成分秋水仙碱含量的研究[J]. 中药与临床,2015,6(3):1−3. [GUAN L X, CHU Y P. Species textual researchand study on colchicines content of Shancigu in Lijiang of Yunnan[J]. Chin J New Drugs Clin Rem,2015,6(3):1−3. -
期刊类型引用(16)
1. 孙细珍,熊亚青,倪兴婷,李强. 吡嗪类化合物对酱香型白酒香气特征的影响分析. 食品与发酵工业. 2025(01): 305-311 .  百度学术
百度学术
2. 王高伟,曹润洁,陈双,徐岩. 采用顶空固相微萃取结合全二维气相色谱飞行时间质谱解析不同等级中高温大曲的挥发性组分差异特征. 食品与发酵工业. 2025(02): 285-292 .  百度学术
百度学术
3. 王娜,沈毅,庄园,程伟,罗森,张亚东,刘子轩,刘冰,高红波. 气相色谱-串联质谱同时测定白酒中20种吡嗪类化合物. 食品科学. 2025(05): 30-37 .  百度学术
百度学术
4. 蒋倩儿,梁会朋,李琳琳,钟俊辉,刘军峰. 芽孢杆菌在白酒酿造过程中的应用研究进展. 食品工业科技. 2025(08): 391-401 .  本站查看
本站查看
5. 杨瑞政. 白酒及原料检验准确性的影响因素及控制策略探讨. 食品安全导刊. 2024(07): 149-151 .  百度学术
百度学术
6. 杨沙,罗玉航,张季,侯睿. 高效液相色谱法同时测定不同年份酱香型白酒中12种吡嗪化合物含量. 食品安全质量检测学报. 2024(12): 220-229 .  百度学术
百度学术
7. 缪坤辰,张梦梦,赵巧珍,吕志远,吕晓凤,任广花. 两种功能麸曲混合应用对芝麻香型白酒酿造的影响. 酿酒科技. 2024(07): 74-82 .  百度学术
百度学术
8. 王宏雨,翁梦婷,孔子浩,张迪. 发酵处理对广叶绣球菌挥发性成分及风味的影响. 菌物学报. 2024(08): 154-170 .  百度学术
百度学术
9. 陈艳,王孝彦,刘冲,杨沙,张季. GC-MS/MS法同时测定年份酱香型白酒中19种吡嗪类和呋喃类化合物. 中国酿造. 2024(09): 241-248 .  百度学术
百度学术
10. 何艳艳,刘俊男,李瑞杰,丁润月,杨阳,李姝,赵侨,钟小忠,王松涛,周嘉裕. 酱香型白酒风味及其关键物质分析技术研究进展. 中国酿造. 2024(11): 1-7 .  百度学术
百度学术
11. 薛锡佳,程伟,陈雪峰,兰伟,李娜,李瑞龙,潘天全,代森. 馥合香型白酒酿造过程中四甲基吡嗪的检测及其溯源分析. 中国酿造. 2024(12): 38-44 .  百度学术
百度学术
12. 吕晓凤,孟武,刘玉涛,张梦梦,卢春玲,李强,邱振清,石林,赵巧珍,缪坤辰. 功能菌添加对芝麻香原酒中吡嗪类化合物含量的影响研究. 食品安全质量检测学报. 2023(07): 155-163 .  百度学术
百度学术
13. 陈荻,杨康卓,刘志鹏,赵东,郑佳. 包包曲风味萃取方式的对比及GC×GC-TOFMS在其风味化合物鉴定中的应用. 酿酒科技. 2023(06): 71-76 .  百度学术
百度学术
14. 苏泽佳,卢斌,李志溥,熊若冰,白卫东,梁景龙,赵文红. 12种市售豉香型白酒挥发性风味物质的分析. 中国酿造. 2023(08): 234-241 .  百度学术
百度学术
15. 秦炳伟,吕志远,张梦梦,刘阳晴雪,刘玉涛,王文洁,胥鑫钰,李小杰,崔新莹,商海林,王瑞明,高红波,宋妍妍. 顶空固相微萃取-全二维气相色谱-飞行时间质谱解析泉香型白酒的风味物质. 食品与发酵工业. 2023(18): 289-296 .  百度学术
百度学术
16. 陈心雨,刘念,王超凯,张磊,李觅,常少健,蔡海燕,彭奎. 高温大曲中美拉德反应的研究进展. 食品与发酵科技. 2023(06): 109-112 .  百度学术
百度学术
其他类型引用(1)





 下载:
下载:



 下载:
下载:



