Effects of Camel Milk on Glucolipid Metabolism in Mice with Nonalcoholic Fatty Liver Disease
-
摘要: 目的:探究骆驼乳对高脂高糖高胆固醇饮食诱导的非酒精性脂肪性肝病(Non-alcoholic Fatty Liver Disease,NAFLD)小鼠糖脂代谢的影响。方法:将50只C57BL6/J雄性小鼠随机分为对照组(NC)、模型组(Mod)、对照骆驼乳组(NCM,3 g·kg−1 bw)、骆驼乳组(CaM,3 g·kg−1 bw)和水飞蓟素组(PC,200 mg·kg−1 bw)。试验12周,建立NAFLD模型,骆驼乳组和水飞蓟素组小鼠在每日固定时间分别灌胃相应剂量的骆驼乳和水飞蓟素。通过测定小鼠体重、空腹血糖、血清生化指标、胰岛素抵抗指数、胰岛素敏感指数、经口葡萄糖耐量及胰岛素耐量,探讨骆驼乳对高脂高糖高胆固醇饮食诱导的NAFLD小鼠糖脂代谢的影响。结果:骆驼乳能显著抑制NAFLD小鼠体重和血糖的升高,并且可以显著降低小鼠血清中总甘油三酯(total triglycerides,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low density lipoprotein cholesterin,LDL-c)、肿瘤坏死因子(tumor necrosis factor,TNF-α)、瘦素(leptin,LEP)和胰岛素(insulin,INS)水平(P<0.05),显著提高小鼠血清中脂联素(adiponectin,ADPN)水平(P<0.05)。骆驼乳组小鼠糖耐量显著升高,胰岛素抵抗减轻,胰岛素敏感度增加(P<0.05),糖脂代谢能力增强。结论:骆驼乳对高脂高糖高胆固醇饮食诱导的NAFLD小鼠糖脂代谢具有调节作用。骆驼乳可能通过减轻小鼠胰岛素抵抗,促进血清脂质转运,增强NAFLD小鼠糖脂代谢能力。
-
关键词:
- 非酒精性脂肪性肝病 /
- 骆驼乳 /
- 高糖高脂高胆固醇饮食 /
- 糖脂代谢 /
- C57BL/6J小鼠
Abstract: Objective: This study was designed to explore the effect of camel milk on glucose and lipid metabolism metabolism in mice with nonalcoholic fatty liver disease induced by high fat, high sugar and high cholesterol diet. Methods: 50 C57BL6/J male mice were randomly divided into control group (NC), model group (Mod), control camel milk group (NCM, 3g·kg−1 bw), camel milk group (CaM, 3 g·kg−1 bw) and silymarin group (PC, 200 mg·kg−1 bw). The model of nonalcoholic fatty liver was established for 12 weeks. The mice in the camel milk group and the silymarin group were gavaged with the corresponding doses of camel milk and silymarin at a fixed time every day, respectively. Body weight, fasting blood glucose, serum biochemical, insulin resistance and insulin sensitivity, oral glucose tolerance and insulin tolerance were measured to investigate the effect of camel milk on glucolipid metabolism in mice with non-alcoholic fatty liver disease induced by high fat, high sugar, and high cholesterol diet. Results: Camel milk significantly inhibited the increase of body weight and blood sugar of NAFLD mice and notably reduced the levels of total triglyceride (TG), total cholesterol (TC), low-density lipoprotein cholesterol (LDL-c), tumor necrosis factor (TNF-α), leptin (LEP) and insulin (INS) (P<0.05). While the adiponectin (ADPN) levels in mice serum was increased (P<0.05). In the camel milk group, the glucose tolerance were significantly increased, insulin resistance was reduced, and insulin sensitivity was significantly improved (P<0.05), indicating glucose and lipid metabolism was enhanced. Conclusion: Camel milk had a modulatory role in glucose and lipid metabolism in NAFLD mice induced by high-fat, high-sugar and high-cholesterol diet, which would increase the glucose and lipid metabolism by alleviating insulin resistance and promoting serum lipid transport. -
非酒精性肝病(Non-alcoholic Fatty Liver Disease,NAFLD)是全球常见且可预防的肝脏疾病之一,由于患病人数基数大,也成为世界卫生组织面临的一大社区卫生挑战[1]。根据肝脏疾病的严重程度可以将肝病大致分为脂肪肝、肝炎、肝硬化和肝癌,而NAFLD属于脂肪肝的一种[2]。NAFLD是在没有酒精摄入的情况下,脂质在肝脏过渡沉积导致的。NAFLD是代谢紊乱综合征的体现,与肥胖、2型糖尿病、心脑血管病相关[3-4]。随着生活水平的提高,NAFLD逐渐引起人们的注意。运动减少体重、冷刺激、局部热疗以及使用临床药物可缓解肝脏脂质沉积,但此类方法有一定的局限性,且临床药物一般具有一定的肾毒性[5-6]。因此,开发天然的功能性食品用以缓解肝脏脂质沉积,辅助治疗非酒精性脂肪肝是必要的。
骆驼乳因其产量极少而被称作“沙漠白金”,是一种营养均衡的全价食品,并且具有抗过敏、抗氧化、降压等生物学功能。自古以来,骆驼就是亚洲和非洲的干旱地区的役用牲畜。因为骆驼乳中有丰富的免疫球蛋白Ig-G、Ig-A和各类维生素(维生素A、维生素B2、维生素C和维生素E,其中维生素C含量最高),脂肪酸和胆固醇含量较少,且没有β乳球蛋白而缺少过敏原,所以在这些地区,骆驼乳常被用作治疗哮喘、水肿和糖尿病[7-9]。从骆驼乳中分离出的多个菌种具有显著的抗氧化活性,在活性氧(ROS)大量存在对机体产生威胁时,骆驼乳能够作为抗氧化剂保护机体免受氧化损伤[10]。用瑞士乳杆菌和嗜热链球菌发酵的酸骆驼乳可以有效抑制血管紧张素抑制酶(ACE)的作用[11-12]。此外,骆驼乳还可以保护肾脏、肝脏功能[13-16]。骆驼乳可以通过激活Nrf2/HO-1通路和AKT/eNOS/NO通路保护肾脏免受氧化应激伤害,能够激活IL-17通路和TNF通路治疗酒精性肝病且效果显著[17]。Ⅱ型糖尿病是典型的代谢紊乱疾病,在病发前有明显的胰岛素抵抗,血糖不稳定。骆驼乳能够有效地调节血糖,改善机体胰岛素抵抗,防止Ⅱ型糖尿病的发生[18-19]。同时发现,经过骆驼乳治疗的Ⅱ型糖尿病小鼠血清中低密度脂蛋白(LDL-c)水平、总甘油三酯(TG)水平、总胆固醇(TC)水平显著降低,且显著提高了高密度脂蛋白(HDL-c)水平,有效缓解了小鼠胰岛素抵抗症状[20]。NAFLD是Ⅱ型糖尿病的诱发因素之一,预防NAFLD可有效降低Ⅱ型糖尿病发病几率,也可减少心血管疾病和其他各类糖脂代谢疾病,所以对NAFLD的防治有重要意义。
与前人研究相比,本实验通过饲喂C57BL/6J小鼠高糖高脂高胆固醇饲料12周,建立NAFLD模型。同时每天给骆驼乳组小鼠灌胃骆驼乳,观察NAFLD小鼠各项生理生化指标的变化情况,以研究骆驼乳对NAFLD小鼠糖脂代谢的影响。此外还总结讨论了C57BL/6J小鼠在NAFLD模型中的应用情况及其在该疾病模型中的典型特点,为揭示骆驼乳缓解高脂高糖高胆固醇诱导的C57BL/6J小鼠非酒精性脂肪肝作用机制提供基础依据。
1. 材料与方法
1.1 材料与仪器
SPF级雄性C57BL/6J小鼠 斯贝福(北京)生物技术有限公司,生产许可证号:SCXK(京)2019-0010,试验动物饲养于IVC动物试验系统中;骆驼乳 采自内蒙古自治区阿拉善盟阿拉善右旗牧区,取骆驼哺乳期鲜乳置于液氮速冻后运回实验室-80 ℃冻藏;高脂高糖高胆固醇饲料(45%脂肪,17%果糖,1.25%胆固醇,TP32003)及低脂饲料 南通特洛菲饲料科技有限公司,生产许可证号:苏饲证(2014)06092;小鼠高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-c)ELISA试剂盒ml037765、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-c)ELISA试剂盒ml037825、白细胞介素6(interleukin,IL-6)ELISA试剂盒ml063159、肿瘤坏死因子α(tumor necrosis factor-alpha,TNF-α)ELISA试剂盒 ml002095、瘦素(leptin,LEP)ELISA试剂盒ml002287、脂联素(adiponectin,ADPN)ELISA试剂盒ml057809、胰岛素(insulin,INS)ELISA试剂盒ml001983 上海酶联生物科技有限公司;小鼠总甘油三酯(total triglycerides,TG)试剂盒A110-1-1、总胆固醇(total cholesterol,TC)试剂盒A111-1-1 南京建成生物工程研究所。
5810R台式高速冷冻离心机 德国Eppendorf公司;SCIENTZ-10N冷冻干燥机 上海东芝电器厂;SynergyH1酶标仪 BioTek Instruments;立式压力灭菌锅SQ510C 上海申安医疗器械厂;AUUC-CHEKR Performa罗氏血糖仪 罗氏诊断产品(上海)有限公司。
1.2 实验方法
1.2.1 骆驼乳预处理
取冷冻骆驼乳,冷水解冻后离心(4 ℃,5000 r·min−1,30 min)去乳脂,冷冻干燥,过筛分装,4 ℃保存。
1.2.2 分组与采样
为了更好地探究骆驼乳对NAFLD小鼠的影响,以水飞蓟素为阳性对照药物,同时对比骆驼乳对低脂饮食状态下小鼠的影响,50只SPF级雄性C57BL/6J小鼠随机分配至5组:对照组(NC)、模型组(Mod)、对照骆驼乳组(NCM)、骆驼乳组(CaM)和水飞蓟素组(PC)。分组后分笼饲养,适应性喂养1周,自由饮用灭菌蒸馏水(121 ℃,20 min)。分别在适应性喂养的第3 d、第5 d和第6 d,用TP32003低脂饲料替换NC组和NCM组大约30%的基础饲料,用TP32003高脂高糖高胆固醇饲料替换Mod组、CoM组和PC组大约30%的基础饲料,第7 d将所有组的基础饲料完全替换为相应的TP32003低脂饲料和TP32003高脂饲料。控制室温20±1 ℃,相对湿度55%±5%,人工光照,12 h昼夜循环。本实验方案开展前已获得内蒙古农业大学“乳品生物技术与工程”教育部重点实验室动物使用许可(许可证号:SYXK 蒙 2020-0002)。
以冻干粉计灌胃剂量。骆驼乳粉、水飞蓟素皆用0.2%的羧甲基纤维素(Carboxymethocel,CMC)溶液混悬灌胃。对照骆驼乳组、骆驼乳组每日两次(9:00和16:00)灌胃骆驼乳,每日总剂量为:3.0 g·kg−1 bw;水飞蓟素组每日两次(9:00和16:00)灌胃水飞蓟素,每日总剂量为:0.2 g·kg−1 bw;对照组与模型组每日一次(9:00)灌胃羧甲基纤维素,每日总剂量为:0.15 mL·d−1 bw,如表1。
表 1 动物分组和处理Table 1. Animal grouping and handling组别 简称 动物数量
(只)是否过渡
饲养饲料(2~13周) 灌胃试验 对照组 NC 10 是 低脂饲料 0.15 mL CMC 模型组 Mod 10 是 高脂高糖高
胆固醇饲料0.15 mL CMC 对照骆驼乳组 NCM 10 是 低脂饲料 骆驼乳
(剂量3.0 g·kg−1)骆驼乳组 CaM 10 是 高脂高糖
高胆固醇饲料骆驼乳
(剂量3.0 g·kg−1)水飞蓟素组 PC 10 是 高脂高糖
高胆固醇饲料水飞蓟素
(剂量200 mg·kg−1)试验周期结束,小鼠禁食不禁水12 h。采取封闭环境吸入异氟烷方式麻醉小鼠,摘眼球取血后颈椎脱臼处死。血液室温静置1 h,离心(4 ℃,3000 r·min−1,20 min)取上层血清,小管分装液氮速冻,−80 ℃冻藏以备后续试验;解剖小鼠,取肝脏、胰腺、肾脏、脾脏。血清用于测定各项血清指标,各脏器组织用于计算脏器指数。
1.2.3 体重、空腹血糖测定及脏器指数的测定
取每周固定时间,小鼠禁食不禁水12 h测定小鼠体重,尾尖取血测定空腹血糖值(Fasting blood glucose,FBG)。
解剖小鼠后,取小鼠的肝脏、胰腺、肾脏和脾脏称重,计算脏器指数,计算公式如下:
脏器指数=脏器鲜重(g)小鼠第12周体重(g)×100 1.2.4 血清指标检测
取出预先分装的血清小管置于冰水混合物中,待血清消融立即进行各项血清ELISA检测。严格按照试剂盒说明书,分别检测血脂四项(HDL-c、LDL-c、TG、TC)、炎症指标(IL-6、TNF-α)、胰岛素(INS)、瘦素(LEP)和脂联素(APDN)。
1.2.5 胰岛素敏感指数和胰岛素抵抗指数
用胰岛素稳态模型计算各组小鼠的胰岛素抵抗指数(HOMA-IRI)和胰岛素敏感指数(HOMA-ISI)[20]。
HOMA−IRI=FBG×Fins22.5 HOMA−ISI=ln(1FBG×Fins) 式中:FBG为小鼠空腹血糖;Fins为小鼠空腹胰岛素。
1.2.6 经口糖耐量和胰岛素耐量测定
经口糖耐量试验(Oral glucose tolerance test,OGTT):灌胃骆驼乳12周后,各组小鼠禁食不禁水12 h,经口给予30%葡萄糖溶液1.5 g·kg−1,测定0、30、60、90、120 min时的血糖值,计算曲线下面积(Aare under the curve,AUC)。
胰岛素耐量试验(Insulin tolerance test,ITT):灌胃骆驼乳12周后,各组小鼠禁食不禁水12 h,腹腔注射胰岛素(0.5 U·kg−1),测定0、30、60、90、120 min时的血糖值,计算AUC。
1.3 数据处理
结果用“平均值±标准差”表示,采用SPSS 23统计软件对结果进行统计分析。服从正态分布且方差齐次的数据用单因素方差方法分析,两两比较采用LSD多重检验。采用Graphpad prism 9.0软件进行绘图。所有图、表的显著性都使用字母标注法,不同字母之间具有显著性差异(P<0.05)。
2. 结果与分析
2.1 骆驼乳对非酒精性脂肪肝小鼠体重、血糖和内脏指数的影响
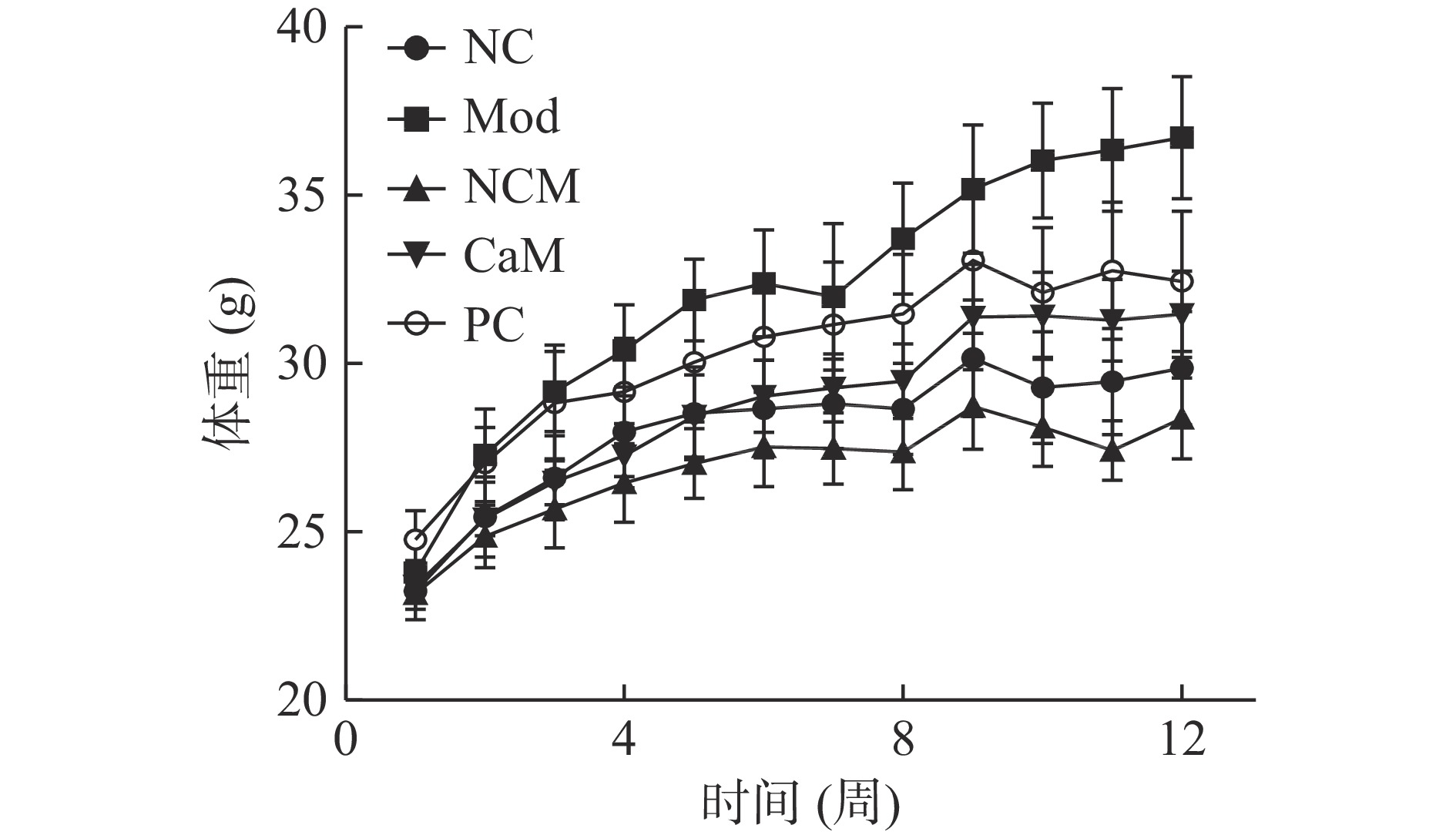
图1是各个组小鼠体重的变化曲线。由图1可得,随着试验时间延长Mod组小鼠体重增长显著高于其他各组(P<0.05)。与Mod组相比,CaM组和PC组小鼠的体重增长被有效抑制(P<0.05)。此外,与NC组小鼠相比,骆驼乳可以显著抑制NCM组小鼠体重的增加(P<0.05)。第12周Mod组小鼠的体重达到了最高(表2),而与Mod组小鼠相比,骆驼乳和水飞蓟素显著的降低了小鼠的体重(表2)(P<0.05)。
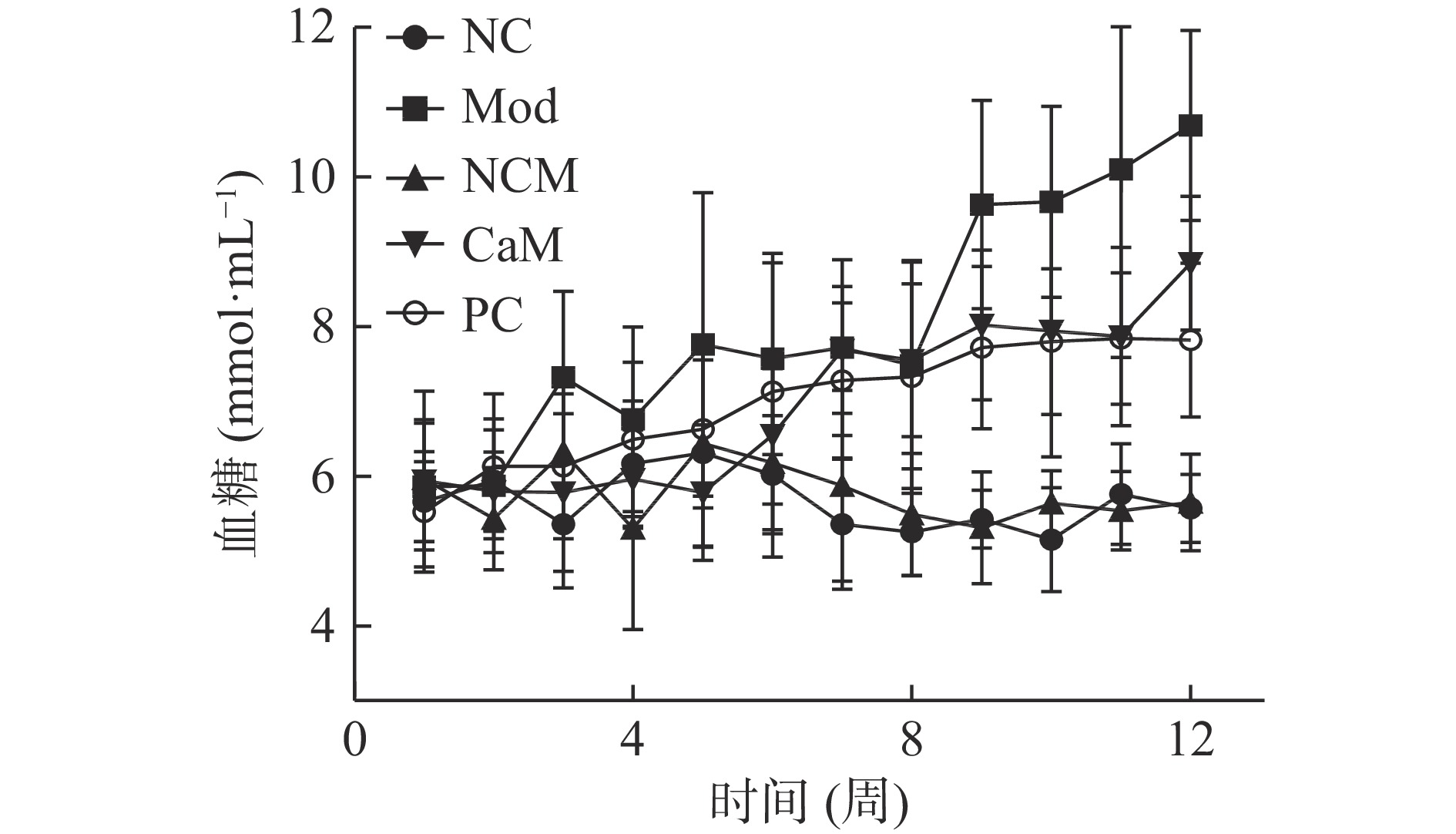
图2是各个组小鼠血糖的变化曲线。由图2可知,随着试验时间延长Mod组小鼠血糖的增长都显著高于其他各组(P<0.05),虽然变化不稳定,但总体呈增高趋势。与Mod组相比,CaM组和PC组小鼠血糖的增长被有效抑制(P<0.05)。第12周Mod组小鼠血糖都达到了最高(表2),而与Mod组小鼠相比,骆驼乳和水飞蓟素显著降低了小鼠血糖(表2)(P<0.05)。
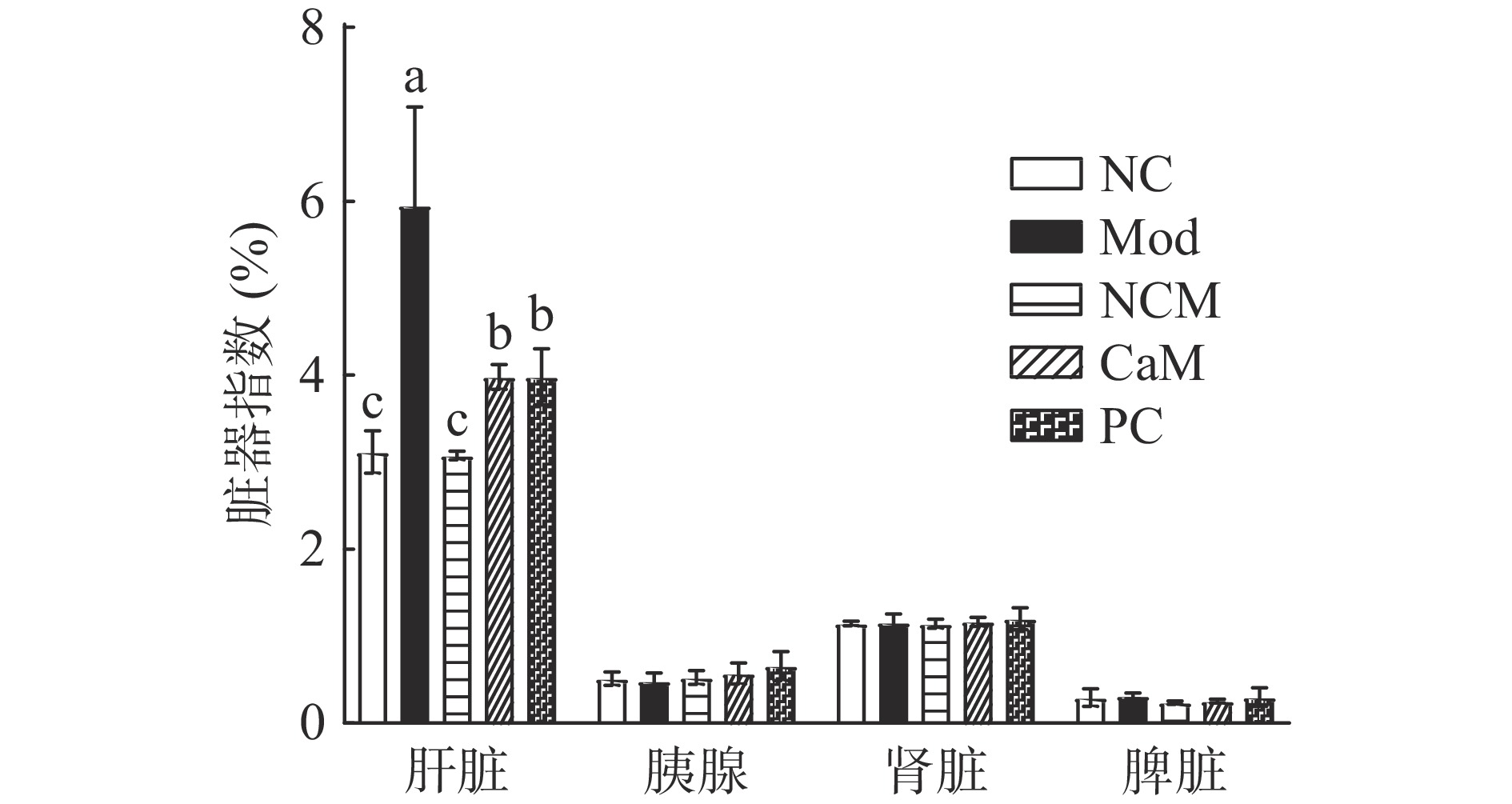
NAFLD最直接的表现就是肝脏重量异常增大,可以通过肝脏指数来初步判断NAFLD。图3是各组小鼠的脏器指数,Mod组肝脏指数最高(5.590%),CaM组(3.981%)和PC(3.982%)组肝脏指数显著低于Mod组,NC组(3.119%)和NCM组(3.078%)最低。其他脏器的脏器指数没有显著差异(P>0.05),说明造模成功。
2.2 骆驼乳改善非酒精性小鼠的胰岛素耐量和糖耐量
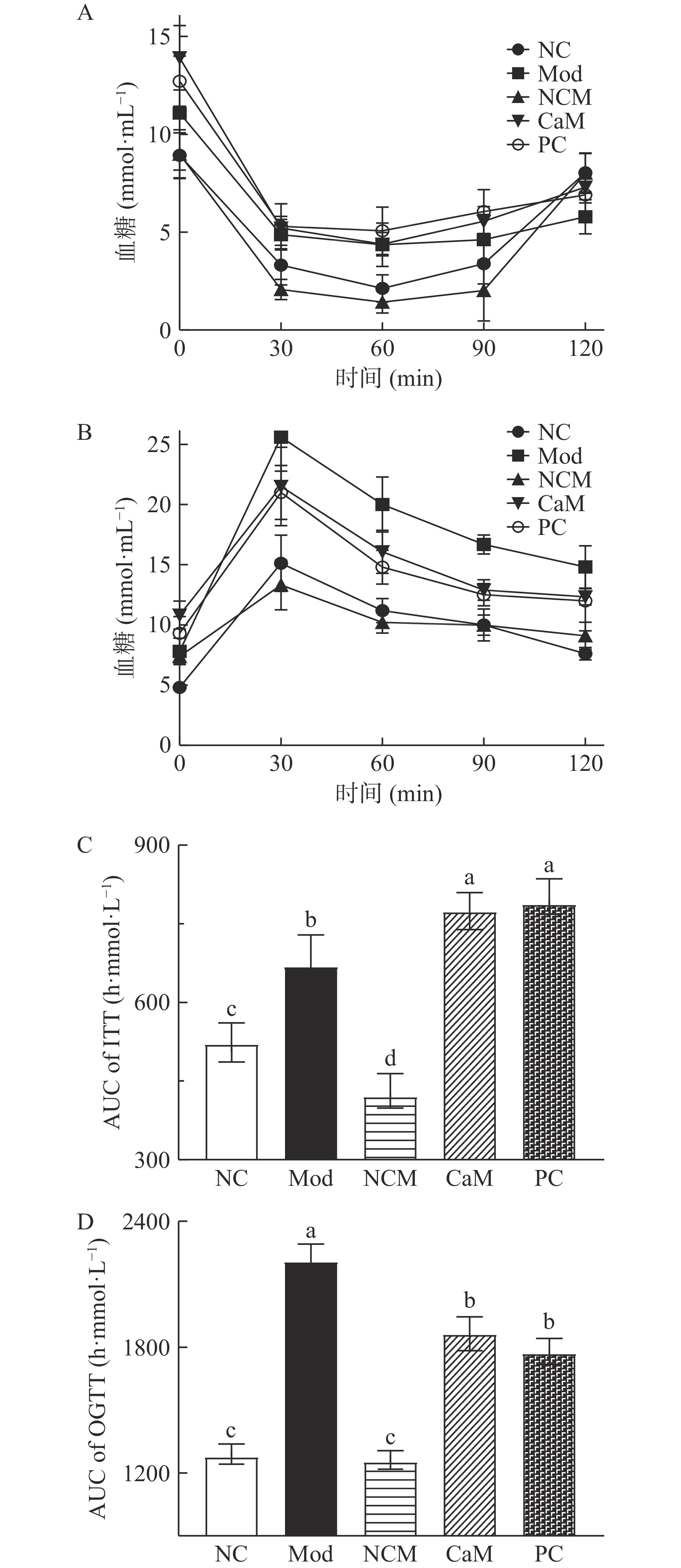
糖尿病是非酒精性脂肪肝常见的伴随代谢障碍疾病,病人糖耐量和胰岛素耐量受损,有明显的胰岛素抵抗[21]。如图4A所示,Mod组小鼠的胰岛素耐量严重受损,在0、30、60、90 min时Mod组小鼠的血糖值明显高于NC组和NCM组小鼠的血糖值。与预期相反,通过计算ITT曲线下面积(图4C)发现,骆驼乳和水飞蓟素干预并没有减少小鼠胰岛素耐量受损程度。从图4B可知,Mod组小鼠的糖耐量遭受损害,在30、60、90、120 min时Mod组小鼠的血糖值明显高于其他各组,而骆驼乳和水飞蓟素不同程度的调节了小鼠的糖耐量。与Mod组相比,CaM组和PC组OGTT曲线下面积显著降低(图4D)(P<0.05)。CaM组和PC组之间没有明显差异(P>0.05)。说明骆驼乳和水飞蓟素可有效减少机体的葡萄糖输出量。
NAFLD小鼠糖代谢紊乱,血糖居高不下,高血糖促进胰岛素过量分泌,在高脂高糖高胆固醇饲料诱导下,小鼠胰岛素抵抗,所以Mod组小鼠血清胰岛素含量显著高于除PC组外的其他各组(表3)(P<0.05)。Mod组小鼠有明显的胰岛素抵抗和较低的胰岛素敏感。在骆驼乳的干预下,与Mod组相比,CaM组小鼠血清胰岛素显著降低,胰岛素抵抗改善,胰岛素敏感提高(P<0.05)。NC组和NCM组的血清胰岛素最低,并且胰岛素抵抗不明显,胰岛素敏感较高,两个组之间没有显著差异(P>0.05)(表3)。说明骆驼乳可以调节小鼠糖代谢,减轻机体对胰岛素的抵抗,增加机体对胰岛素的敏感度。
表 3 各组小鼠血清胰岛素含量、胰岛素抵抗指数和胰岛素敏感指数Table 3. Insulin level in serum, HOMA-IRI and HOMA-IRI in each group of mice组别 胰岛素
(mIU·L−1)胰岛素抵抗指数
(HOMA-IRI)胰岛素敏感指数
(HOMA-ISI)NC 10.171±0.268c 2.517±0.201c −4.034±0.079a Mod 10.638±0.354b 5.067±0.725a −4.727±0.146c NCM 9.927±0.139d 2.493±0.294c −4.021±0.120a CaM 9.779±0.167d 3.846±0.391b −4.456±0.105b PC 14.536±0.350a 5.056±0.717a −4.726±0.135c 表 4 各组小鼠血清TC、TG、HDL-c/TC、LDL-c水平Table 4. TC, TG, HDL-c/TC, LDL-c level in serum in each group of mice组别 NC Mod NCM CaM PC TC(mmol·L−1) 3.490±0.546c 6.576±1.383a 3.767±0.428c 4.689±0.435b 5.005±0.776b TG(mmol·L−1) 0.931±0.241ab 1.053±0.141a 1.007±0.178a 0.803±0.322b 0.763±0.135c HDL-c/TC 4.029±0.691a 2.131±0.480c 3.689±0.539a 2.903±0.348b 2.059±0.419c LDL-c(mmol·L−1) 10.063±0.229ab 10.362±0.146a 10.186±0.173ab 9.231±0.553b 10.296±0.277a 表 5 各组小鼠血清IL-6和TNF-α水平Table 5. IL-6 and TNF-α level in serum in each group of mice组别 IL-6(pg·mL−1) TNF-α(pg·mL−1) NC 13.776±0.268bc 10.903±0.174a Mod 14.546±0.286a 10.982±0.240a NCM 13.974±0.067b 10.739±0.109bc CaM 13.699±0.290c 10.672±0.657c PC 10.526±0.185d 9.833±0.177d 2.3 骆驼乳对非酒精性脂肪肝小鼠血脂四项的影响
临床常用血脂四项初步评判脂代谢障碍患者疾病的严重程度,并且认为HDL-c/TC更有临床意义[20]。由表4可知,与NC组相比,NCM组各项指标无显著差异(P>0.05)。与NC组相比,Mod组血清TC水平和LDL-c水平显著升高,HDL-c/TC水平显著降低(P<0.05),血清TG水平没有显著差异(P>0.05),说明Mod组小鼠体内脂代谢紊乱。在骆驼乳和水飞蓟素干预12周后,与Mod组相比,CaM组血清TC、TG、LDL-c水平显著降低,HDL-c水平显著升高(P<0.05),PC组小鼠血清TC、TG水平显著降低(P<0.05),HDL-c水平和LDL-c水平没有显著差异(P>0.05),两组小鼠脂质代谢有所改善。说明骆驼乳可以调节小鼠机体脂代谢能力,缓解小鼠机体脂代谢紊乱。
2.4 骆驼乳对非酒精性脂肪肝小鼠脂代谢的影响
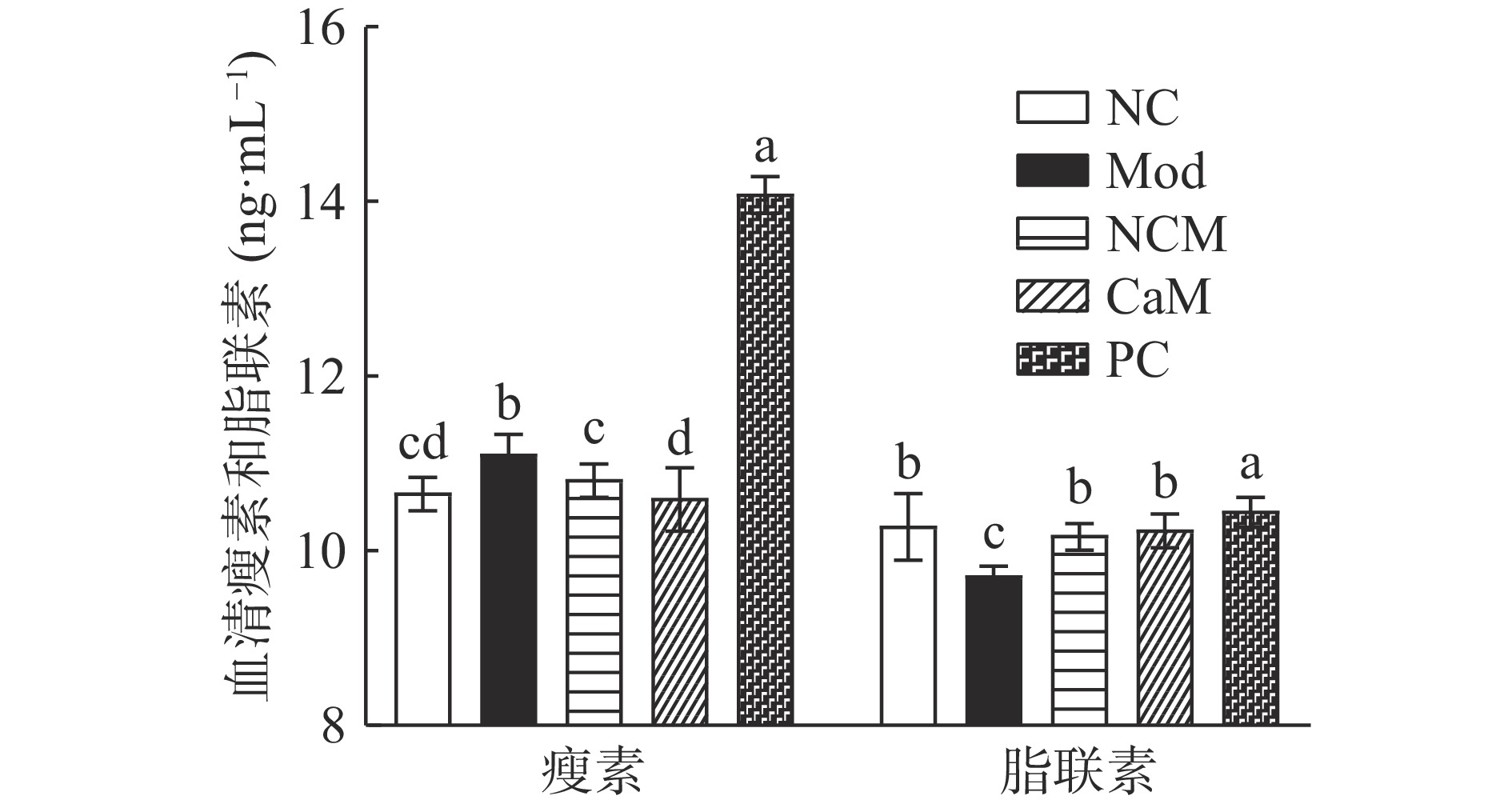
瘦素是一种由脂肪组织分泌的,含量和脂肪组织大小呈正相关的激素,可以调节机体新陈代谢。当机体处于低能量状态(饥饿)时,血清中瘦素水平降低,刺激动物觅食。反之,血清中瘦素水平升高,抑制动物进食欲望,进行负反馈调节[22]。与NC组相比,Mod组的血清瘦素水平显著升高(11.128 ng·mL−1)(P<0.05),NCM组血清瘦素水平无显著差异(P>0.05)。与Mod组相比,在骆驼乳和水飞蓟素干预后,CaM组小鼠血清瘦素水平显著降低(10.627 ng·mL−1)(P<0.05),PC组小鼠血清瘦素水平极显著升高(14.110 ng·mL−1)(P<0.01),这与Alnafea等[23]的研究结果一致,如图5。
脂联素是一种由脂肪细胞分泌的胰岛素增敏激素,可以有效改变机体胰岛素抵抗[24]。与NC组相比,Mod组小鼠血清脂联素水平显著降低(9.736 ng·mL−1)(P<0.05),NCM组无显著差异(P>0.05)。在骆驼乳和水飞蓟素干预后,与Mod组相比,CaM组和PC组小鼠血清脂联素水平显著升高(10.263、10.479 ng·mL−1)(P<0.05)。说明Mod组小鼠有胰岛素抵抗现象,在骆驼乳和水飞蓟素干预后,胰岛素抵抗减轻,这与骆驼乳减少胰岛素抵抗指数减少(P<0.05),增加胰岛素敏感指数的结果相符合(图5)。这进一步解释了骆驼乳能有效地调节小鼠机体脂代谢能力,缓解小鼠机体脂代谢紊乱。
2.5 骆驼乳缓解非酒精性脂肪肝小鼠炎症
在没有酒精的参与下,肝脏脂质严重积累会引发非酒精脂肪性肝炎。同时,血清中IL-6和TNF-α水平会升高[25]。表5是各组小鼠血清IL-6和TNF-α水平;与NC组相比,Mod组小鼠血清IL-6水平显著升高(P<0.05),而血清TNF-α水平与NC组无显著差异(P>0.05),表明Mod组小鼠体内产生了轻微炎症。与NC组相比,NCM组血清IL-6水平无显著差异,而血清TNF-α水平显著降低(P<0.05)。骆驼乳和水飞蓟素干预12周后,与Mod组相比,CaM组和PC组小鼠血清IL-6和TNF-α水平显著下降(P<0.05)。证明骆驼乳减轻了小鼠机体的炎症反应。
3. 讨论
C57BL6/J小鼠被称为饮食诱导肥胖小鼠(Diet-induced obesity mice,DIO),用高脂饲料喂养易形成胰岛素抵抗和高胰岛素血症,是代谢敏感综合症敏感动物,常常用于代谢综合症的研究和代谢综合症的造模[26]。胰岛素抵抗会刺激脂肪肝形成,所以也常用于脂肪肝造模。马媛媛等[27]为了研究通过胃切除术实现身体减重时,采用C57BL6/J小鼠高脂饮食诱导4周,成功建立了肥胖小鼠模型。张晶晶等[28]用高脂诱导C57BL6/J小鼠,成功建立了肥胖模型,发现高脂饮食诱导10周,肥胖小鼠成模率高,且发现模型组体重、体脂、血脂四项等指标与对照组有显著差异,评定C57BL6/J小鼠为稳定的单纯性肥胖症造模物种。何静等[20,29]采用高脂高糖饮食联合STZ诱导C57BL6/J小鼠构建了稳定的糖尿病研究模型。为了改良高脂高糖饮食,李美蕖等[30]使用C57BL6/J小鼠建立了NAFLD模型,建立的模型出现肝细胞脂肪病变,细胞核坏死和炎细胞聚集等病症。综合以上文献调查,本研究选用C57BL6/J小鼠为试验对象,采用高脂高糖高胆固醇饮食诱导12周的方法,建立了稳定的NAFLD模型。建立的模型NAFLD症状严重,各项血清指标与上述文献中报道的相符合,具有一定的研究意义。
体重增加,空腹血糖居高不下,肝脏体积异常增大都是NAFLD的显著特征[31]。长期过度摄入高脂饮食,肝脏工作负荷加大[32]。当肝脏脂代谢和高脂食物摄入动态平衡被打破时,脂质在肝脏中过渡沉积,进一步导致肝脏脂代谢紊乱,使得肝脏功能受损,并且影响肝脏糖代谢[32-34]。机体对胰岛素敏感度下降,产生胰岛素抵抗现象,引发高血糖症[20]。本次研究结果显示,Mod组小鼠体重异常增加,小鼠空腹血糖水平长期处于高位,肝脏指数增大,胰岛素抵抗明显;这说明Mod组小鼠糖脂代谢紊乱,机体调节糖脂代谢能力减弱且对胰岛素抵抗,并伴有一定的与糖尿病相关的高血糖症,这与李晓晓等[35]试验结果一致。经过骆驼乳和水飞蓟素干预后,小鼠体重异常增长和空腹血糖升高的趋势得到显著抑制,肝脏指数接近正常。CaM组小鼠和PC组小鼠的胰岛素抵抗显著缓解,对胰岛素敏感度显著增加,对葡萄糖的耐量增加。这些实验结果说明骆驼乳和水飞蓟素切实有效地减轻了小鼠NAFLD的相关症状,调节了肝脏糖脂代谢功能,减轻了肝脏重量。
NAFLD发展严重会引起非酒精性肝炎(Non-Alcoholic Steatoepatitis,NASH)。初期表现为血清瘦素水平、IL-6水平和TNF-α水平显著升高,血清脂联素水平降低[21]。在本次试验中,与NC组比,Mod组小鼠血清IL-6水平和瘦素水平显著增加,血清脂联素水平显著降低,说明Mod组小鼠身体有一定的炎症反应,且机体对胰岛素敏感度降低。在骆驼乳干预后,小鼠血清IL-6水平、TNF-α水平显著降低,血清脂联素水平升高。这表明经过骆驼乳干预12周,小鼠炎症反应减轻,机体对胰岛素敏感度增加,对胰岛素抵抗减弱,进而缓解了NAFLD。
4. 结论
在骆驼乳的干预下,高脂高糖高胆固醇饮食诱导的NAFLD C57BL6/J小鼠各项生理生化指标得到显著改善,小鼠机体对胰岛素的敏感度提高,对葡萄糖耐量增加,进而使得小鼠的糖脂代谢功能增强,小鼠机体炎症反应减少,有效缓解非酒精性脂肪肝向非酒精性脂肪性肝炎的进程。
在我国西北戈壁地区,骆驼乳是牧民重要的优质乳源和经济来源。该研究为骆驼乳开发和利用提供了重要的理论依据。但本研究存在以下不足:未能阐述骆驼乳缓解NAFLD的具体代谢通路、缺乏蛋白质水平和RNA水平的相关依据。所以后续试验可利用组学技术筛选关键的代谢通路,增加蛋白质水平和RNA水平骆驼乳缓解NAFLD的有效证据。
-
表 1 动物分组和处理
Table 1 Animal grouping and handling
组别 简称 动物数量
(只)是否过渡
饲养饲料(2~13周) 灌胃试验 对照组 NC 10 是 低脂饲料 0.15 mL CMC 模型组 Mod 10 是 高脂高糖高
胆固醇饲料0.15 mL CMC 对照骆驼乳组 NCM 10 是 低脂饲料 骆驼乳
(剂量3.0 g·kg−1)骆驼乳组 CaM 10 是 高脂高糖
高胆固醇饲料骆驼乳
(剂量3.0 g·kg−1)水飞蓟素组 PC 10 是 高脂高糖
高胆固醇饲料水飞蓟素
(剂量200 mg·kg−1)表 2 第12周各组小鼠的体重和血糖
Table 2 Body weight and blood glucose of mice in each group at week 12
表 3 各组小鼠血清胰岛素含量、胰岛素抵抗指数和胰岛素敏感指数
Table 3 Insulin level in serum, HOMA-IRI and HOMA-IRI in each group of mice
组别 胰岛素
(mIU·L−1)胰岛素抵抗指数
(HOMA-IRI)胰岛素敏感指数
(HOMA-ISI)NC 10.171±0.268c 2.517±0.201c −4.034±0.079a Mod 10.638±0.354b 5.067±0.725a −4.727±0.146c NCM 9.927±0.139d 2.493±0.294c −4.021±0.120a CaM 9.779±0.167d 3.846±0.391b −4.456±0.105b PC 14.536±0.350a 5.056±0.717a −4.726±0.135c 表 4 各组小鼠血清TC、TG、HDL-c/TC、LDL-c水平
Table 4 TC, TG, HDL-c/TC, LDL-c level in serum in each group of mice
组别 NC Mod NCM CaM PC TC(mmol·L−1) 3.490±0.546c 6.576±1.383a 3.767±0.428c 4.689±0.435b 5.005±0.776b TG(mmol·L−1) 0.931±0.241ab 1.053±0.141a 1.007±0.178a 0.803±0.322b 0.763±0.135c HDL-c/TC 4.029±0.691a 2.131±0.480c 3.689±0.539a 2.903±0.348b 2.059±0.419c LDL-c(mmol·L−1) 10.063±0.229ab 10.362±0.146a 10.186±0.173ab 9.231±0.553b 10.296±0.277a 表 5 各组小鼠血清IL-6和TNF-α水平
Table 5 IL-6 and TNF-α level in serum in each group of mice
组别 IL-6(pg·mL−1) TNF-α(pg·mL−1) NC 13.776±0.268bc 10.903±0.174a Mod 14.546±0.286a 10.982±0.240a NCM 13.974±0.067b 10.739±0.109bc CaM 13.699±0.290c 10.672±0.657c PC 10.526±0.185d 9.833±0.177d -
[1] HUANAN C, SANGSANG L, AMOAH A N, et al. Relationship between triglyceride glucose index and the incidence of non-alcoholic fatty liver disease in the elderly: A retrospective cohort study in China[J]. BMJ Open,2020,10(11):1−8. doi: 10.1136/bmjopen-2020-038271corr1
[2] LIU Y, WANG W. Sex-specific contribution of lipid accumulation product and cardiometabolic index in the identification of nonalcoholic fatty liver disease among Chinese adults[J]. Lipids Health Dis,2022,21(1):1−8. doi: 10.1186/s12944-021-01613-7
[3] HU X, ZHOU R, LI H, et al. Alterations of gut microbiome and serum metabolome in coronary artery disease patients complicated with non-alcoholic fatty liver disease are associated with adverse cardiovascular outcomes[J]. Front Cardiovasc Med,2021,8:1−19.
[4] YUN C H, JHUANG J R, TSOU M T. Pericardial fat, thoracic peri-aortic adipose tissue, and systemic inflammatory marker in nonalcoholic fatty liver and abdominal obesity phenotype[J]. Sci Rep,2022,12(1):1−9. doi: 10.1038/s41598-021-99269-x
[5] LI Y, WANG D, PING X, et al. Local hyperthermia therapy induces browning of white fat and treats obesity[J]. Cell,2022,185(6):949−966. doi: 10.1016/j.cell.2022.02.004
[6] ALLAHYARI M, SAMADI-NOSHAHR Z, HOSSEINIAN S, et al. Camel milk and allopurinol attenuated adenine-induced acute renal failure in rats[J]. Iranian Journal of Science and Technology, Transactions A:Science,2021,45(5):1539−1548. doi: 10.1007/s40995-021-01155-8
[7] KHALESI M, SALAMI M, MOSLEHISHAD M, et al. Biomolecular content of camel milk: A traditional superfood towards future healthcare industry[J]. Trends in Food Science & Technology,2017,62:49−58.
[8] SARIN S K, KUMAR M, ESLAM M, et al. Liver diseases in the Asia-Pacific region: A lancet gastroenterology & hepatology commission[J]. The Lancet Gastroenterology & Hepatology,2020,5(2):167−228.
[9] AYOUB M A, PALAKKOTT A R, ASHRAF A, et al. The molecular basis of the anti-diabetic properties of camel milk[J]. Diabetes Res Clin Pract,2018,146:305−312. doi: 10.1016/j.diabres.2018.11.006
[10] CHEN Y Z, LI C, GU J, et al. Anti-oxidative and immuno-protective effect of camel milk on radiation-induced intestinal injury in C57BL/6 J mice[J]. Dose Response,2021,19(1):1−8.
[11] ALHAJ O A, METWALLI A A, ISMAIL E A, et al. Angiotensin converting enzyme-inhibitory activity and antimicrobial effect of fermented camel milk (Camelus dromedarius)[J]. International Journal of Dairy Technology,2018,71(1):27−35. doi: 10.1111/1471-0307.12383
[12] YAHYA M A, ALHAJ O A, AL-KHALIFAH A S. Antihypertensive effect of fermented skim camel (Camelus dromedarius) milk on spontaneously hypertensive rats[J]. Nutr Hosp,2017,34(2):416−421. doi: 10.20960/nh.1163
[13] ALMNAIZEL A T, AL-KHALIFAH A S, ALHAJ O A, et al. Hypocholesterolemic effect of camel milk on rats fed a high-cholesterol diet[J]. Emirates Journal of Food and Agriculture,2018,30(4):288−294. doi: 10.9755/ejfa.2018.v30.i4.1664
[14] KHAN M Z, XIAO J, MA Y, et al. Research development on anti-microbial and antioxidant properties of camel milk and its role as an anti-cancer and anti-hepatitis agent[J]. Antioxidants,2021,10(5):1−16.
[15] IBRAHIM M A B, WANI F A, RAHIMAN S. Hepatorprotective effect of olive oil and camel milk on acetaminophen-induced liver toxicity in mice[J]. Medical Science and Public Health,2017,6:168−171.
[16] EL-FAKHARANY E M, EL-BAKY N A, LINJAWI M H, et al. Influence of camel milk on the hepatitis C virus burden of infected patients[J]. Exp Ther Med,2017,13(4):1313−1320. doi: 10.3892/etm.2017.4159
[17] ARAB H H, EID A H, GAD A M, et al. Inhibition of oxidative stress and apoptosis by camel milk mitigates cyclosporine-induced nephrotoxicity: Targeting Nrf2/HO-1 and AKT/eNOS/NO pathways[J]. Food Sci Nutr,2021,9(6):3177−3190. doi: 10.1002/fsn3.2277
[18] HUSSAIN H, WATTOO F H, WATTOO M H S, et al. Camel milk as an alternative treatment regimen for diabetes therapy[J]. Food Sci Nutr,2021,9(3):1347−1356. doi: 10.1002/fsn3.2078
[19] KHAN F B, ANWAR I, REDWAN E M, et al. Camel and bovine milk lactoferrins activate insulin receptor and its related AKT and ERK1/2 pathways[J]. J Dairy Sci,2022,105(3):1848−1861. doi: 10.3168/jds.2021-20934
[20] 何静, 高婉婷, 海勒, 等. 驼乳对2型糖尿病小鼠肝脏损伤的保护作用[J]. 中国食品学报,2019,19(7):36−41. [HE J, GAO W T, HAI L, et al. Protective effect of camel milk on liver injury in type 2 diabetic mice[J]. Chinese Journal of Food Science,2019,19(7):36−41. doi: 10.16429/j.1009-7848.2019.07.005 [21] VILALTA A, GUTIERREZ J A, CHAVES S, et al. Adipose tissue measurement in clinical research for obesity, type 2 diabetes and NAFLD/NASH[J]. Endocrinol Diabetes Metab,2022:1−9.
[22] ZHANG Q, WANG J, HUANG F, et al. Leptin induces NAFLD progression through infiltrated CD8+ T lymphocytes mediating pyroptotic-like cell death of hepatocytes and macrophages[J]. Dig Liver Dis,2021,53(5):598−605. doi: 10.1016/j.dld.2020.10.025
[23] ALNAFEA H M, KORISH A A. Activation of the peroxisome proliferator-activated receptors (PPAR-alpha/gamma) and the fatty acid metabolizing enzyme protein CPT1A by camel milk treatment counteracts the high-fat diet-induced nonalcoholic fatty liver disease[J]. PPAR Res,2021,2021:1−12.
[24] KIM Y, LIM J H, KIM E N, et al. Adiponectin receptor agonist ameliorates cardiac lipotoxicity via enhancing ceramide metabolism in type 2 diabetic mice[J]. Cell Death Dis,2022,13(3):282−302. doi: 10.1038/s41419-022-04726-8
[25] MONDAL A, BOSE D, SAHA P, et al. Lipocalin 2 induces neuroinflammation and blood-brain barrier dysfunction through liver-brain axis in murine model of nonalcoholic steatohepatitis[J]. J Neuroinflammation,2020,17(1):201−216. doi: 10.1186/s12974-020-01876-4
[26] 江云, 高月求, 朱明清, 等. C57BL/6小鼠非酒精性脂肪肝模型的建立研究[J]. 蚌埠医学院学报,2018,43(5):573−576. [JIANG Y, GAO Y Q, ZHU M Q, et al. Establishment of nonalcoholic fatty liver model in C57BL/6 mice[J]. Journal of Bengbu Medical College,2018,43(5):573−576. doi: 10.13898/j.cnki.issn.1000-2200.2018.05.003 [27] 马媛媛, 葛圣金. 高质饮食诱导C57BL/6J小鼠肥胖及减重手术模型的建立[J]. 复旦学报(医学版),2022,49(1):88−94. [MA Y Y, GE S J. Establishment of obesity and weight loss surgery model in C57BL/6J mice induced by high quality diet[J]. Fudan J Med,2022,49(1):88−94. doi: 10.3969/j.issn.1672-8467.2022.01.012 [28] 张晶晶, 赵文欣, 李佳潞, 等. C57BL/6J 小鼠构建肥胖动物模型评价[J]. 医学食疗与健康,2021,9:7−9. [ZHANG J J, ZHAO W X, LI J L, et al. Evaluation of obesity animal model constructed by C57BL/6J mice[J]. Medical Dietotherapy and Health,2021,9:7−9. [29] 李想, 吕琴, 吴秋月, 等. 高脂高糖饮食联合STZ诱导C57BL/6J品系小鼠构建糖尿病肾病模型的研究[J]. 重庆医学,2022,51(1):16−20. [LI X, LÜ Q, WU Q Y, et al. Establishment of diabetic nephropathy model in C57BL/6J mice induced by high-fat and high-sugar diet combined with STZ[J]. Chongqing Medical Journal,2022,51(1):16−20. doi: 10.3969/j.issn.1671-8348.2022.01.004 [30] 李美蕖, 田书云, 张迪. 非酒精性脂肪肝C57BL/6J小鼠模型建立[J]. 山东化工,2021,50(20):162−167. [LI M Q, TIAN S Y, ZHANG D. Establishment of C57BL/6J mouse model of nonalcoholic fatty liver disease[J]. Shandong Chemical Industry,2021,50(20):162−167. doi: 10.3969/j.issn.1008-021X.2021.20.058 [31] 马浩鑫, 朱桂达, 张晓霞, 等. 一种非酒精性脂肪肝小鼠模型的建立方法[J]. 安徽农业科学,2021,49:80−85. [MA H X, ZHU G D, ZHANG X X, et al. Establishment of a mouse model of non-alcoholic fatty liver disease[J]. Journal of Anhui Agricultural Sciences,2021,49:80−85. doi: 10.3969/j.issn.0517-6611.2021.01.021 [32] LOOMBA R, FRIEDMAN S L, SHULMAN G I. Mechanisms and disease consequences of nonalcoholic fatty liver disease[J]. Cell,2021,184(10):2537−2564. doi: 10.1016/j.cell.2021.04.015
[33] DU T, FANG Q, ZHANG Z, et al. Lentinan protects against nonalcoholic fatty liver disease by reducing oxidative stress and apoptosis via the PPARalpha pathway[J]. Metabolites,2022,12(1):55. doi: 10.3390/metabo12010055
[34] ZHU S, ZHANG J, WANG W, et al. Blockage of NDUFB9-SCD1 pathway inhibits adipogenesis[J]. Journal of Physiology and Biochemistry,2022,78(2):377−388. doi: 10.1007/s13105-022-00876-7
[35] 李晓晓, 魏承亮, 刘朝奇, 等. 木瓜发酵物通过miR-350-3p/TLR4信号通路改善小鼠非酒精性脂肪性肝炎[J]. 中药新药与临床药理,2022,33(4):419−426. [LI X X, WEI C L, LIU C Q, et al. Papaya fermentation improves nonalcoholic steatohepatitis in mice by miR-350-3p /TLR4 signaling pathway[J]. New Drugs and Clinical Pharmacology of Traditional Chinese Medicine,2022,33(4):419−426. doi: 10.19378/j.issn.1003-9783.2022.04.001 -
期刊类型引用(3)
1. 董欢欢,杨梅,周莹,张媛,管咏梅,段炫彤,陈丽华,朱卫丰. 葛粉对小鼠糖脂代谢紊乱的改善作用研究. 时珍国医国药. 2024(03): 513-518 .  百度学术
百度学术
2. 郝世奇,李雅菲,吕浩迪,李琳,Tuyatsetseg Jambal,吉日木图,明亮. 基于脂质组学研究骆驼乳对小鼠非酒精性脂肪肝的缓解作用. 中国食品学报. 2024(06): 128-141 .  百度学术
百度学术
3. 姚怀兵,李娜,梁小瑞,郝泽林,闫慧,赵仲凯,刘颖,马强,王玉琢,陈钢粮,杨洁. 新疆双峰驼产奶性状与体尺、体重及血液理化指标的测定及相关性分析. 中国畜牧兽医. 2023(08): 3210-3220 .  百度学术
百度学术
其他类型引用(2)





 下载:
下载:



 下载:
下载:



