Extraction of Polysaccharide from Zingiber officinale Roscoe and Its Regulatory Effect on Intestinal Flora in Diabetic Mice
-
摘要: 目的:研究生姜多糖对高脂饮食(High-fat diet,HFD)和小剂量链脲佐菌素(Streptozotocin,STZ)联合诱导的2型糖尿病(Type 2 diabetes,T2D)小鼠肠道菌群的调节作用。方法:采用热水浸提乙醇沉淀的方法,从生姜中提取出多糖,通过单因素实验和正交试验优化提取条件,随后选择最佳的脱蛋白方法得到生姜多糖(Ginger polysaccharide,GP),并通过测定GP对2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸二铵盐(2,2'-Azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)自由基和羟基自由基的清除能力,评价了其体外抗氧化能力。随后,通过高脂饮食和STZ建立2型糖尿病小鼠模型,测定各组小鼠的空腹血糖(Fasting blood glucose,FBG)浓度和糖化血清蛋白(Glycated serum protein,GSP)水平,采用16S rRNA高通量测序技术分析糖尿病小鼠的肠道菌群组成。结果:GP最优提取工艺为料液比1:20 g/mL、提取温度90 ℃、提取时间1 h;采用Sevag试剂处理5次进行脱蛋白得到GP,得率为2.91%±0.25%,其中GP中总糖含量为43.44%±0.99%;当GP浓度达到4 mg/mL时,GP对ABTS+自由基和羟基自由基的清除率分别为66.09%和65.73%;在GP的干预下,显著降低了糖尿病小鼠FBG浓度和GSP水平(P<0.05),16S rRNA测序结果表明,GP改变了糖尿病小鼠的肠道菌群组成和相对丰度,增加了阿德勒克氏菌属(Adlercreutzia)、阿克曼菌属(Akkermansia)和乳酸杆菌属(Lactobacillus)等有益菌的相对丰度,降低了普雷沃氏菌属(Prevotella)等有害菌的相对丰度。结论:通过热水浸提法提取和Sevag脱蛋白所得生姜多糖能改变糖尿病小鼠肠道菌群的组成,该研究结果为生姜多糖预防和治疗T2D提供了理论依据。Abstract: Objectives: To investigate the regulatory effect of ginger polysaccharides on the intestinal flora of mice with type 2 diabetes (T2D) induced by the combination of a high-fat diet (HFD) and low-dose streptozotocin (STZ). Methods: Polysaccharides were extracted from ginger by hot water extraction and ethanol precipitation. Single-factor experiments and an orthogonal experiment were used to optimize the extraction conditions, and then the best deproteinization method was selected to obtain ginger polysaccharide (GP). The scavenging ability of GP to 2,2'-diazo-bis-3-ethylbenzothiazoline-6-sulfonic diammonium salt (ABTS+) free radicals and hydroxyl radicals evaluated its antioxidant capacity in vitro. Subsequently, a type 2 diabetes mouse model was established by a high-fat diet and STZ. The fasting blood glucose (FBG) concentration and glycated serum protein (GSP) level of mice in each group were measured. The composition of the intestinal flora of diabetic mice was analyzed by 16S rRNA high-throughput sequencing technique. Results: The optimum extraction process of GP was as follows: The ratio of material to water was 1:20 g/mL, the extraction temperature was 90 ℃, the extraction time was 1 h, and Sevag reagent was used 5 times to deproteinize to obtain GP, the yield was 2.91%±0.25%, of which the total sugar content was 43.44%±0.99%. At the concentration of 4 mg/mL in GP, the scavenging rates of ABTS+ free radical and hydroxyl free radical by GP were 66.09% and 65.73% respectively. After the intervention of GP, FBG concentration and GSP level in the diabetic mice were significantly reduced (P<0.05). The 16S rRNA sequencing results showed that GP altered the gut microbiota composition and relative abundance in diabetic mice, and the relative abundance of beneficial bacteria such as Adlercreutzia, Akkermansia and Lactobacillus increased, while the relative abundance of harmful bacteria such as Prevotella decreased. Conclusions: Ginger polysaccharides obtained by hot water extraction and Sevag deproteinization could alter the composition of the intestinal flora in diabetic mice. The results of this study would provide a theoretical basis for ginger polysaccharide in the prevention and treatment of T2D.
-
Keywords:
- ginger polysaccharide /
- extraction /
- antioxidant activity /
- diabetes /
- iintestinal flora
-
糖尿病(Diebetes mellitus,DM)是一组以高血糖为特征的代谢性疾病,由胰岛素作用缺陷、胰腺细胞胰岛素分泌缺陷或两者兼有引起[1]。糖尿病患者的慢性高血糖可导致多种长期并发症,包括对神经、血管、眼睛、心脏和肾脏等多个器官的损害[2]。当前,糖尿病已经成为危害人类健康仅次于癌症、心血管疾病的三位常见慢性病[3]。肠道菌群对宿主的健康具有重要意义,具有防御病原体入侵、促进物质代谢、合成维生素和抗肿瘤等功能[4]。肠道菌群的生物失调与2型糖尿病的发生关系密切[5]。Larsen等[6]研究显示,糖尿病与非糖尿病患者肠道菌群存在明显不同,其中糖尿病患者肠道中厚壁菌门相对丰度明显下降,变形菌门则高度富集。此外,常用于治疗2型糖尿病的口服药物二甲双胍,已被发现可以通过调节肠道微生物群来改善2型糖尿病患者的血糖[7]。
2020年发布的《中国2型糖尿病防治指南》提出,饮食运动干预及服用二甲双胍对2型糖尿病患者血糖具有较好的控制作用,当饮食和运动无法有效地控制血糖时应及时给予口服降血糖药[8]。现有常用降血糖药物主要包括噻唑烷二酮类、格列奈类、磺脲类和双胍类,大多数降血糖药物都有不良反应,如低血糖、体重增加或胃肠道不适[9]。而从天然植物中提取的活性成分用于治疗糖尿病,具有作用功效温和持久、毒副作用较低,并可有效延缓并发症的发生和发展。
多糖作为天然药物中降血糖的活性成分之一[10],在经过肠道时起到益生的作用,一方面作为益生菌生长的碳源,另一方面通过益生菌作用于多糖所产生的代谢产物来对肠道菌群进行调控[11]。生姜(Zingiber officinale Rosc.)是一种药食两用的植物[12],在食品[13]和医药[14]领域有着广泛的应用,古人常以生姜为原料制作姜茶,用于驱寒和治疗风寒等[15],生姜在现代主要用于缓解孕妇的恶心和呕吐,且在2型糖尿病、高脂血症、超重和肥胖症等的临床应用中具有抗炎和代谢等作用[16]。生姜多糖是生姜中的重要组成成分,含量约为5.97%[17],具有抗氧化[18]、免疫调节[18]、抗肿瘤[19]、抗凝血[20]和降血糖[21]等多种生物活性。目前国内外关于生姜多糖对糖尿病患者肠道菌群是否具有调节作用尚未研究。本文研究生姜多糖的提取工艺及其对糖尿病小鼠肠道菌群的调节作用,为糖尿病的预防和治疗提供了理论依据。
1. 材料与方法
1.1 材料与仪器
生姜(Zingiber officinale Roscoe) 购自山东潍坊农贸市场;苯酚 上海安谱实验科技股份有限公司;D101、AB-8、S-8、NKA-9大孔树脂 购自北京索莱宝科技有限公司;考马斯亮蓝G250染料试剂、链脲佐菌素(STZ) 购自上海源叶生物科技有限公司;雄性昆明小鼠 四周龄,20~22 g,无特定病原体(Specific pathogen free,SPF)级,30只(许可证号:SYXK(苏)2011-0036),购自北京维通利华实验动物技术有限公司;60%脂肪供能高脂饲料 南京协同医药生物工程有限责任公司;糖化血清蛋白(Glycated serum protein,GSP)测定试剂盒 南京建成生物工程研究所。
Eppendorf 5804R冷冻离心机 德国Eppendorf公司;Christ ALPHA 1-4 LD plus冷冻干燥机 德国Christ 公司; Heidolph旋转蒸发仪 德国海道尔夫公司;InfiniteF200多功能酶标仪 瑞士Tecan公司;AUUC-CHEK血糖仪 德国罗氏诊断公司。
1.2 实验方法
1.2.1 生姜多糖的提取条件优化
1.2.1.1 单因素实验
生姜多糖的提取参考文献[22-24]的方法并稍作修改。新鲜生姜洗净后,切成薄片后晒干,利用打粉机将干生姜片磨成粉,过80目筛,得到生姜粉,取适量生姜粉,按照1:10料液比加入80%乙醇,在50 ℃磁力搅拌器中充分搅拌2 h,抽滤,收集滤渣,滤渣用80%乙醇重复处理一次,60 ℃烘箱干燥结束后,冷却至室温,得到生姜预处理粉,装入自封袋中并贮存于4 ℃。称取一定量的生姜预处理粉,根据料液比(1:10、1:20、1:30、1:40、1:50 g/mL)加入蒸馏水(使用锡纸盖在容器表面,防止溶剂挥发损失),在一定的温度(60、70、80、90、100 ℃)下提取一定的时间(1、1.5、2、2.5、3 h),离心(8000 r/min,10 min)后收集上清液,沉淀重复处理一次,合并两次提取液,真空抽滤后收集滤液,使用旋转蒸发仪在55 ℃条件下浓缩体积至原来的1/4,多次少量加入相当于浓缩液体积4倍的无水乙醇,4 ℃条件下静置12 h,离心(8000 r/min,10 min)收集沉淀,沉淀置于60 ℃烘箱干燥,得到生姜粗多糖,称重计算得率。
生姜粗多糖得率 (%)=C1C0×100 式中:C0—生姜粉的质量(g);C1—生姜粗多糖的质量(g)。
1.2.1.2 生姜多糖提取的正交试验
根据单因素实验结果,分别选择料液比、提取温度和提取时间3个因素中的3个水平,并以多糖得率为指标,采用正交设计助手设计实验。正交试验因素水平见表1。
表 1 正交试验因素水平设计Table 1. Factor level of orthogonal experimental design因素 水平 1 2 3 A:料液比(g/mL) 1:10 1:20 1:30 B:提取温度(℃) 80 90 100 C:提取时间(h) 1 2 3 1.2.2 生姜多糖脱蛋白
1.2.2.1 大孔吸附树脂法脱蛋白
大孔树脂预处理[25]:分别称取一定量的4种树脂(D101、AB-8、S-8和NKA-9),用95%乙醇浸泡树脂24 h,过滤后用去离子水反复冲洗树脂至无乙醇味,且冲洗液无白色浑浊;树脂用5% NaOH溶液浸泡24 h,去离子水反复冲洗至pH呈中性;再用5% HCl溶液浸泡处理24 h,去离子水反复冲洗至pH呈中性,最后用蒸馏水浸泡放入4 ℃冰箱低温保存备用。
装柱及上样[26]:树脂装柱至预定柱体积后,再用蒸馏水反复过柱,直至柱内树脂充分压紧;测定生姜多糖溶液中多糖及蛋白含量,将生姜多糖溶液以1 mL/min上样完毕后,再用2倍柱体积的蒸馏水以1 mL/min洗脱,收集洗脱液;测定洗脱液中多糖及蛋白质含量。
1.2.2.2 Sevag法脱蛋白
Sevag法[24]:使用通过正交试验优化得到的生姜多糖提取条件,得到生姜多糖提取液,抽滤收集滤液,55 ℃旋蒸浓缩后,加入1/4体积的Sevag试剂(氯仿:正丁醇=4:1(v/v))脱蛋白,80%乙醇4 ℃醇沉过夜,离心(8000 r/min,10 min)取沉淀,沉淀用水复溶后,50 ℃旋蒸除去有机试剂,将剩余液倒入平板中,−20 ℃预冻后,置于真空冷冻干燥机中干燥,得到生姜多糖GP。向一定体积的生姜多糖提取液中加入1/4体积的Sevag试剂,37 ℃振摇20 min,8000 r/min离心10 min取上清液;采用Sevag试剂处理多次,直至无明显沉淀出现;每次离心完,取少量上清液,测定多糖及蛋白质含量,重复测定3次。计算多糖的损失率及蛋白的脱除率。
多糖损失率 (%)= 脱蛋白前溶液中多糖含量 − 脱蛋白后溶液中多糖含量 脱蛋白前溶液中多糖含量 ×100 蛋白脱除率 (%)= 脱蛋白前溶液中蛋白含量 − 脱蛋白后溶液中蛋白含量 脱蛋白前溶液中蛋白含量 ×100 1.2.2.3 总糖含量测定
采用苯酚-硫酸法[27]测定总糖含量。反应体系为1 mL葡萄糖标准溶液(0、40、80、120、160、100 μg/mL),6%苯酚溶液0.5 mL,2.5 mL浓硫酸。室温下静置40 min,吸取100 μL样液,在490 nm波长下测定OD值,以OD值为纵坐标,葡萄糖浓度为横坐标,绘制得到标准曲线的回归方程为:y=0.0043x−0.0053,R2=0.9992,其中x(μg/mL)为葡萄糖标准溶液的浓度,y为490 nm下测定的吸光度值。
将样品配制成100 μg/mL的溶液,取样品溶液1 mL,按照标准曲线的测定方法测定多糖样品的吸光度值。将测得的吸光度值代入标准曲线中,即可计算出样品中总糖含量(%),以蒸馏水作为空白对照,平行3次。
1.2.2.4 蛋白质含量测定
采用考马斯亮蓝法[28]测定蛋白质的含量。反应体系为20 μL牛血清白蛋白标准溶液(0、20、40、60、80、100 μg/mL),200 μL考马斯亮蓝G250试剂。室温静置5 min后,在600 nm处测定OD值,以蛋白质浓度为横坐标,OD值为纵坐标绘制得到标准曲线的回归方程为:y=0.0024x−0.0004,R2=0.9985,其中x(μg/mL)为牛血清白蛋白标准溶液的浓度,y为600 nm下测定的吸光度值。
配制1 mg/mL的多糖样品溶液,按照标准曲线的测定方法测定多糖样品的吸光度值。将测得的吸光度值代入标准曲线中,即可计算出样品中蛋白质含量(%),以蒸馏水作为空白对照,平行3次。
1.2.3 生姜多糖的抗氧化活性测定
1.2.3.1 生姜多糖对ABTS+自由基的清除能力
参考文献[29]报道并做适当修改。配制7 mmol/L ABTS溶液和2.45 mmol/L过硫酸钾溶液,并将两者等体积混合均匀后,室温避光放置12 h,生成蓝绿色的ABTS+自由基;使用前用磷酸盐缓冲液(pH7.4)将ABTS工作液稀释到吸光值为0.70±0.02(734 nm波长),配制成ABTS工作液;取200 μL ABTS工作液与20 μL不同浓度(0.25、0.5、0.75、1.0、1.5、2.0 mg/mL)样品溶液混合均匀后室温避光放置6 min后测定734 nm处的吸光值;以蒸馏水代替样品溶液作为空白对照,以VC作为阳性对照,平行测定3次。
ABTS+自由基清除率(%)=(1−A2−A1A0)×100 式中:A0—水代替样品的吸光值;A1—PBS代替ABTS工作液的吸光值;A2—样品吸光值。
1.2.3.2 生姜多糖对羟基自由基的清除能力
参考文献[30]报道并做适当修改。将100 μL FeSO4溶液(6 mmol/L)、100 μL不同浓度的样品溶液(0.25、0.5、1.0、2.0、4.0 mg/mL)和100 μL H2O2溶液(6 mmol/L),混匀;静置10 min后,再加入100 μL水杨酸溶液(6 mmol/L),混匀;37 ℃水浴处理30 min后,测定510 nm处的吸光值;以VC为阳性对照组,蒸馏水为空白对照,平行测定3次。
羟基自由基清除率(%)=(1−A2−A1A0)×100 式中:A0—蒸馏水代替样品测定的吸光值;A1—蒸馏水代替H2O2测定的吸光值;A2—样品溶液的吸光值。
1.2.4 动物实验设计
南京农业大学实验动物中心培训记录号(20201229091),动物实验方案经南京农业大学实验动物中心批准,实验过程严格遵守实验动物福利与伦理要求。
30只四周龄雄性昆明小鼠(20~22 g,SPF级),饲养于南京农业大学实验动物中心,动物房保持温度(25±2) ℃,每12 h光照与黑暗交替。实验小鼠适应环境一周后,随机分成3组,每组10只小鼠。分组及给药的情况为:正常组(Normal control group,NC组),给与普通饲料,自由饮水,每天灌胃0.2 mL的生理盐水,连续灌胃9周;模型组(Model group,MOD组),给与高脂饲料,自由饮水,每天灌胃0.2 mL的生理盐水,连续灌胃9周;生姜多糖组(Ginger polysaccharide group,GP组),给与高脂饲料,自由饮水,每天灌胃0.2 mL的生姜多糖溶液(50 mg/kg体重),连续灌胃9周。
实验进行到第五周时,前1 d MOD组和GP组小鼠禁食不禁水12 h后,腹腔注射80 mg/kg体重STZ溶液(0.1 mol/L、pH4.4柠檬酸缓冲溶液配制,置于冰上),一周后,使用便携式血糖仪测定小鼠的空腹血糖,空腹血糖水平≥11.1 mmol/L,则认为2型糖尿病小鼠造模成功[31]。第九周时,实验小鼠禁食不禁水12 h后,摘眼球取血,脱颈处死小鼠,解剖小鼠取出结肠及结肠内容物,结肠内容物于-80 ℃保存。血液低温静置0.5 h后,4 ℃离心10 min(3000×g),取上层血清置于4 ℃保存,随后采用血糖仪和试剂盒分别测定小鼠空腹血糖浓度和糖化血清蛋白水平。将小鼠结肠内容物送样给南京派森诺公司,进行16S rRNA的V3~V4区的PCR扩增,扩增引物序列为F:ACTCCTACGGGAGGCAGCA; R:TCGGACTACHVGGGTWTCTAAT,采用Illumina平台进行测序。
1.3 数据处理
实验数据以平均值±标准差的形式表示,采用SPSS 26软件对数据进行统计分析,各组间差异采用单因素方差分析法(One way ANOVA)进行分析,使用Duncan法来评估统计学差异,P<0.05则认为在统计学上存在差异。
2. 结果与分析
2.1 生姜多糖提取工艺的单因素实验
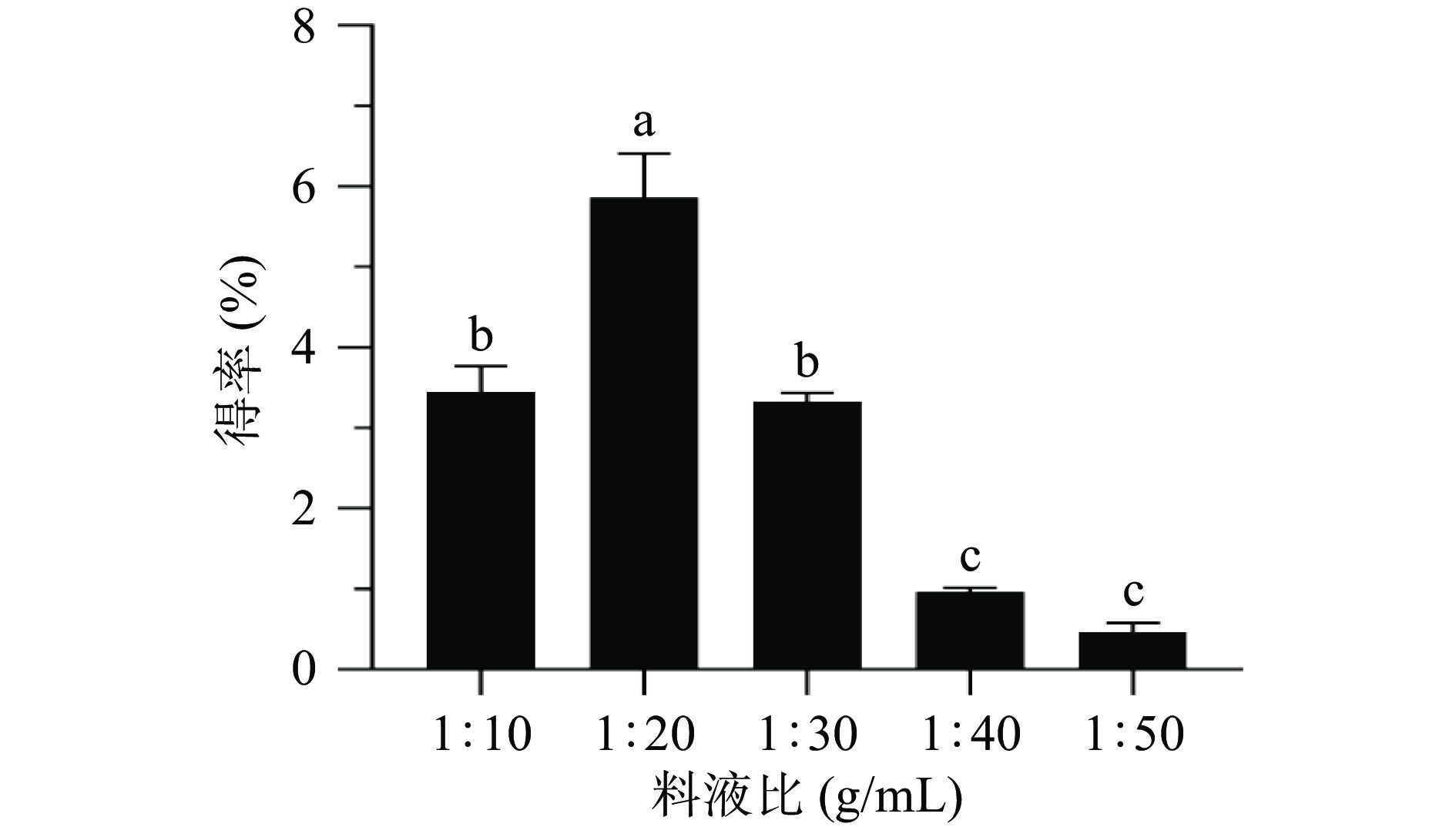
2.1.1 料液比对生姜多糖得率的影响
由图1可知,当料液比从1:10到1:20 g/mL的过程中,多糖得率增加,并在1:20 g/mL达到最大值,当料液比从1:20到1:50 g/mL的过程中,多糖得率逐渐减小,出现这种现象的原因[32-33]可能是随着溶剂比例的增加,生姜内部组织细胞和外部溶剂之间的浓度差增加,使多糖快速扩散和溶解,多糖溶出量增加,当溶剂超过一定比例后,多糖溶出量减少,可能是由于过多的溶剂会造成细胞破裂时的阻力增加,从而降低多糖的溶出。因此选择料液比1:20 g/mL用于后续实验。
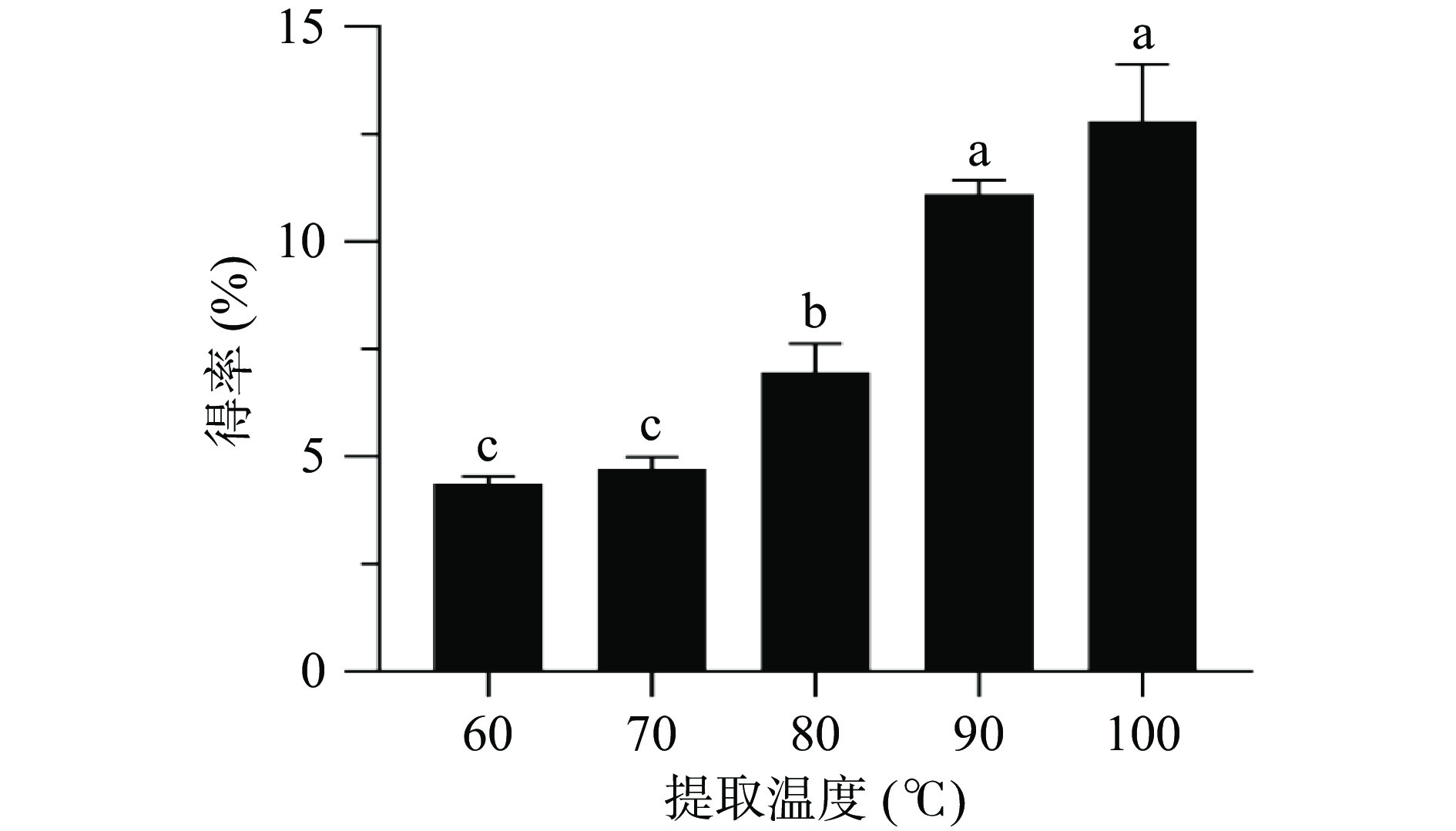
2.1.2 提取温度对生姜多糖得率的影响
由图2可知,随着提取温度的升高,多糖得率也随之增加,当温度高于90 ℃时,多糖得率增加变缓,且与100 ℃时多糖的得率无显著性差异,其原因可能由于温度升高,分子运动速度变快,导致多糖在溶剂中扩散、溶解速度加快,使多糖更容易从细胞内转移到溶剂中,因此多糖得率增加[34];当温度高于90 ℃时,长时间过高的温度一方面会造成生姜中其他物质扩散到溶剂中,导致溶剂对多糖的溶解度达到饱和,另一方面可能会导致部分多糖发生降解,从而使多糖得率增加变缓[35-36]。为了节约能源和避免高温对多糖结构的破坏等,因此选择提取温度90 ℃用于后续实验。
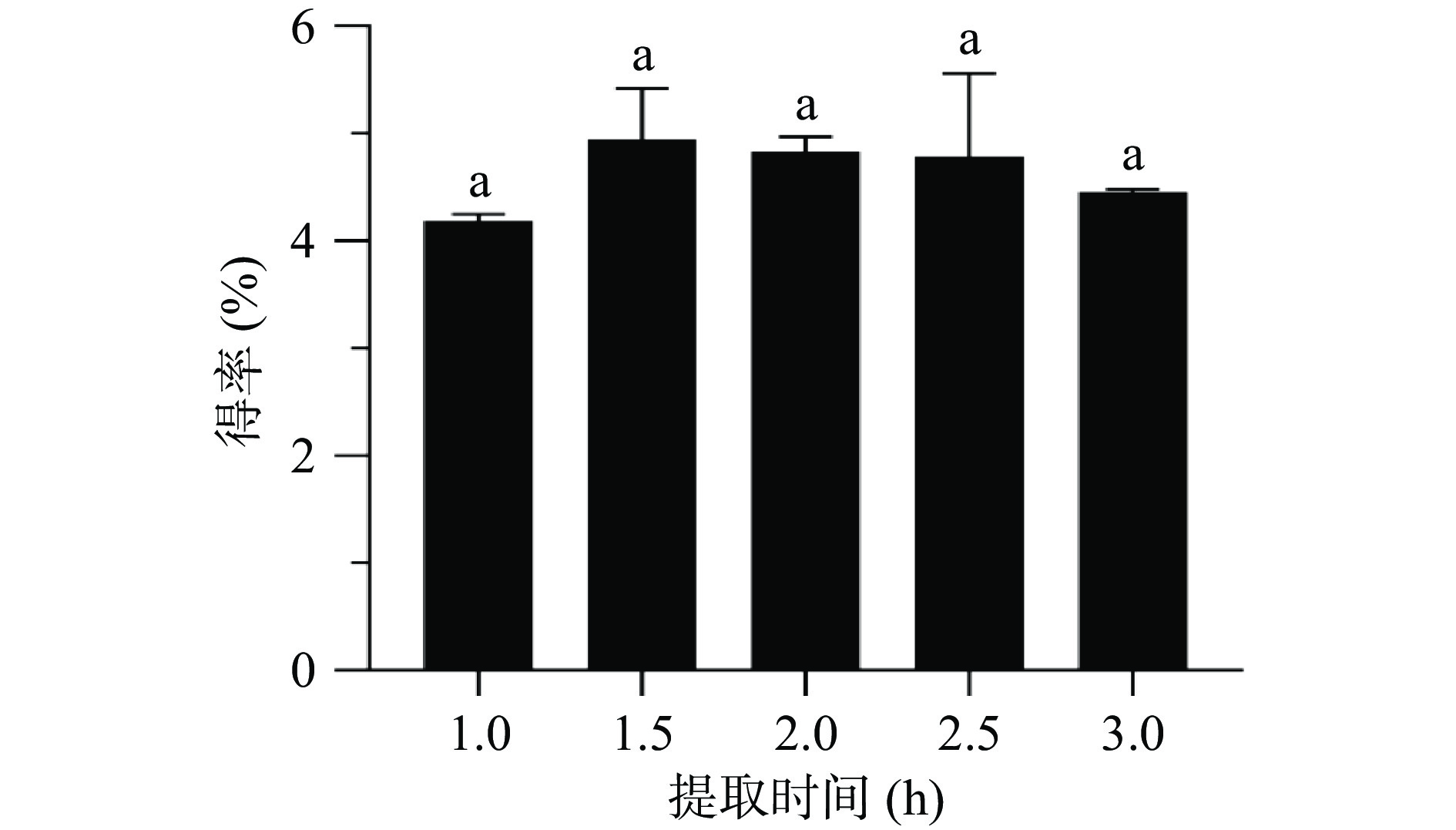
2.1.3 提取时间对生姜多糖得率的影响
由图3可知,随着提取时间的延长,多糖得率先增加后减少,并在提取时间为1.5 h达到最大值,但各组之间差异不显著。原因可能是提取时间的延长会导致生姜多糖在溶剂中扩散和溶解达到平衡,并且长时间提取会造成生姜中其他物质的溶出[37],从而导致多糖得率下降。继续增加提取时间只会增加成本和延长提取周期,因此选择提取时间为1 h用于后续实验。
2.2 生姜多糖提取的正交试验
根据单因素实验结果,确定了生姜多糖提取的料液比、温度和时间3个因素的3个水平,并采用L9(34)正交表进行实验。通过表2的极差分析可得,三个因素对生姜多糖得率的影响顺序为:提取温度>料液比>提取时间,同时可得生姜多糖提取的最优组合为A2B3C1,即料液比1:20 g/mL、温度100 ℃、时间1 h,此时生姜多糖得率为15.37%±0.66%;通过表3的方差分析可得,料液比和提取温度对于生姜多糖得率均有显著性差异(P<0.05),而提取时间对于生姜多糖得率没有显著性差异。考虑到提取温度过高会造成成本和能耗的增加以及多糖的降解,将正交试验结果各因素经过多重比较后,结果如表4所示,最优组合应为A2B2C1,即料液比1:20 g/mL,提取温度90 ℃,时间1 h。在该条件下进行实验,生姜粗多糖得率为16.25%±3.89%。
表 2 正交试验结果Table 2. Results of orthogonal experimental design实验号 因素 多糖得率(%) A:料液比 B:提取温度 C:提取时间 1 1 1 1 7.58±0.74 2 1 2 2 8.07±0.48 3 1 3 3 10.32±1.71 4 2 1 2 9.77±0.62 5 2 2 3 15.29±0.50 6 2 3 1 15.37±0.66 7 3 1 3 9.03±0.74 8 3 2 1 11.83±0.94 9 3 3 2 15.45±0.83 k1 8.657 8.793 11.593 k2 13.477 11.730 11.097 k3 12.103 13.713 11.547 R 4.820 4.920 0.496 表 3 正交试验结果方差分析Table 3. ANOVA of orthogonal experimental design results因素 偏差平方和 自由度 F比 F临界值 显著性 A 36.998 2 82.035 19.000 * B 36.764 2 81.517 19.000 * C 0.451 2 1.000 19.000 误差 0.45 2 总和 74.663 8 表 4 正交试验结果多重比较 (Tukey法)Table 4. Multiple comparisons of orthogonal experimental design results (Tukey)因素 水平 1 2 3 A a b ab B a ab b C a a a 注:不同的字母表示在统计学上具有显著性差异(P<0.05)。 2.3 生姜多糖脱蛋白
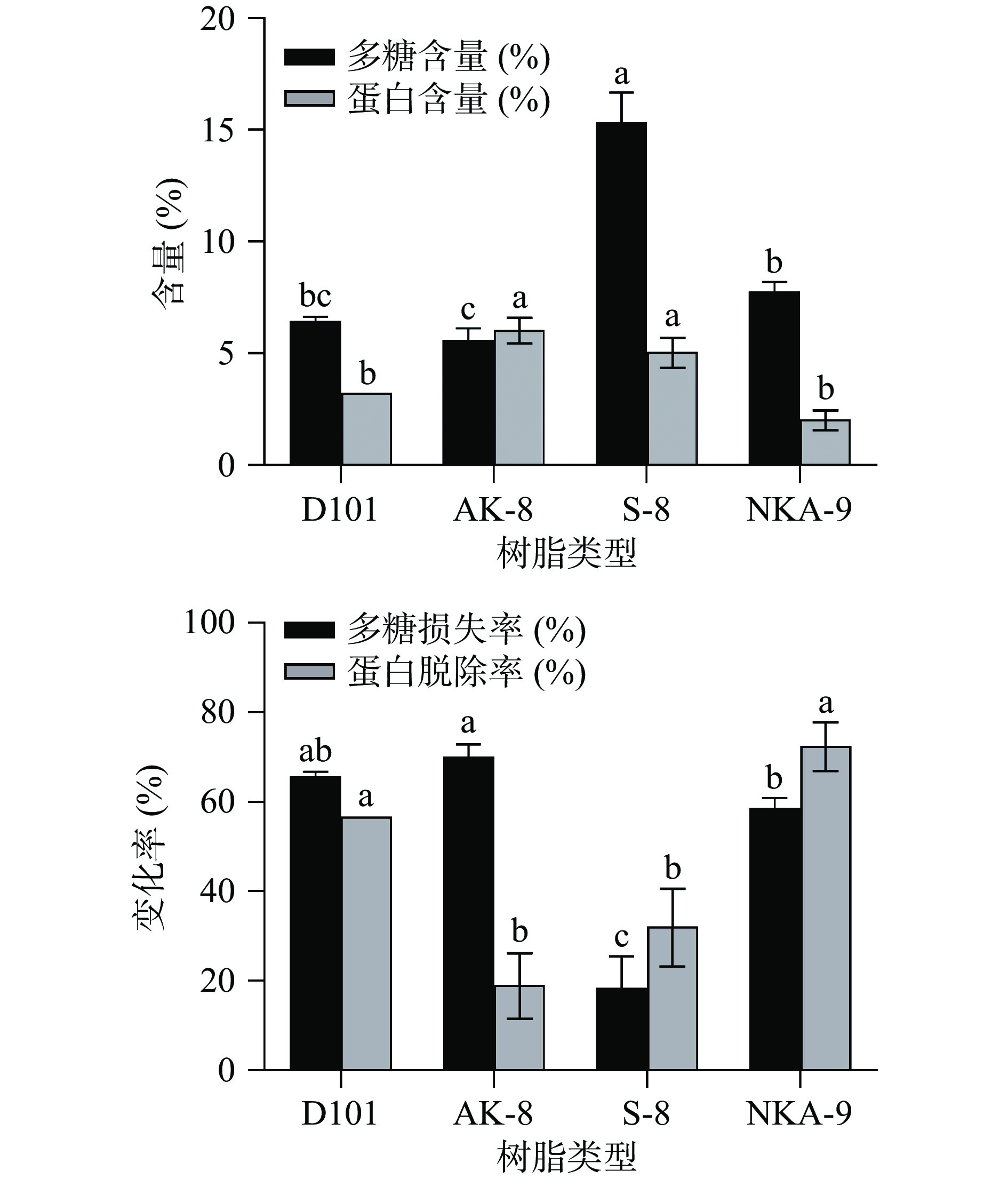
2.3.1 大孔吸附树脂法
由图4可知,使用S-8树脂处理后,生姜多糖中多糖含量最高,为15.33%,多糖损失率为18.44%,蛋白含量为5.08%,蛋白脱除率为32.21%;使用NKA-9树脂处理后,生姜多糖中蛋白含量最低,为2.06%,蛋白脱除率为72.51%,多糖含量为7.78%,多糖损失率为58.63%。以上结果表明,NKA-9树脂具有较强的脱除生姜多糖溶液中蛋白的能力,但是同时也会造成多糖的大量损失。李守鹏[26]比较了盐酸法、三氯乙酸法、Sevag法和大孔树脂法四种生姜多糖脱蛋白方法,以S-8型大孔树脂的效果最好,蛋白脱除率为82.45%,多糖损失率为10.53%。这与本文的实验结果有所差异,可能与生姜的产地、品种、采摘时间和提取条件不同有关。
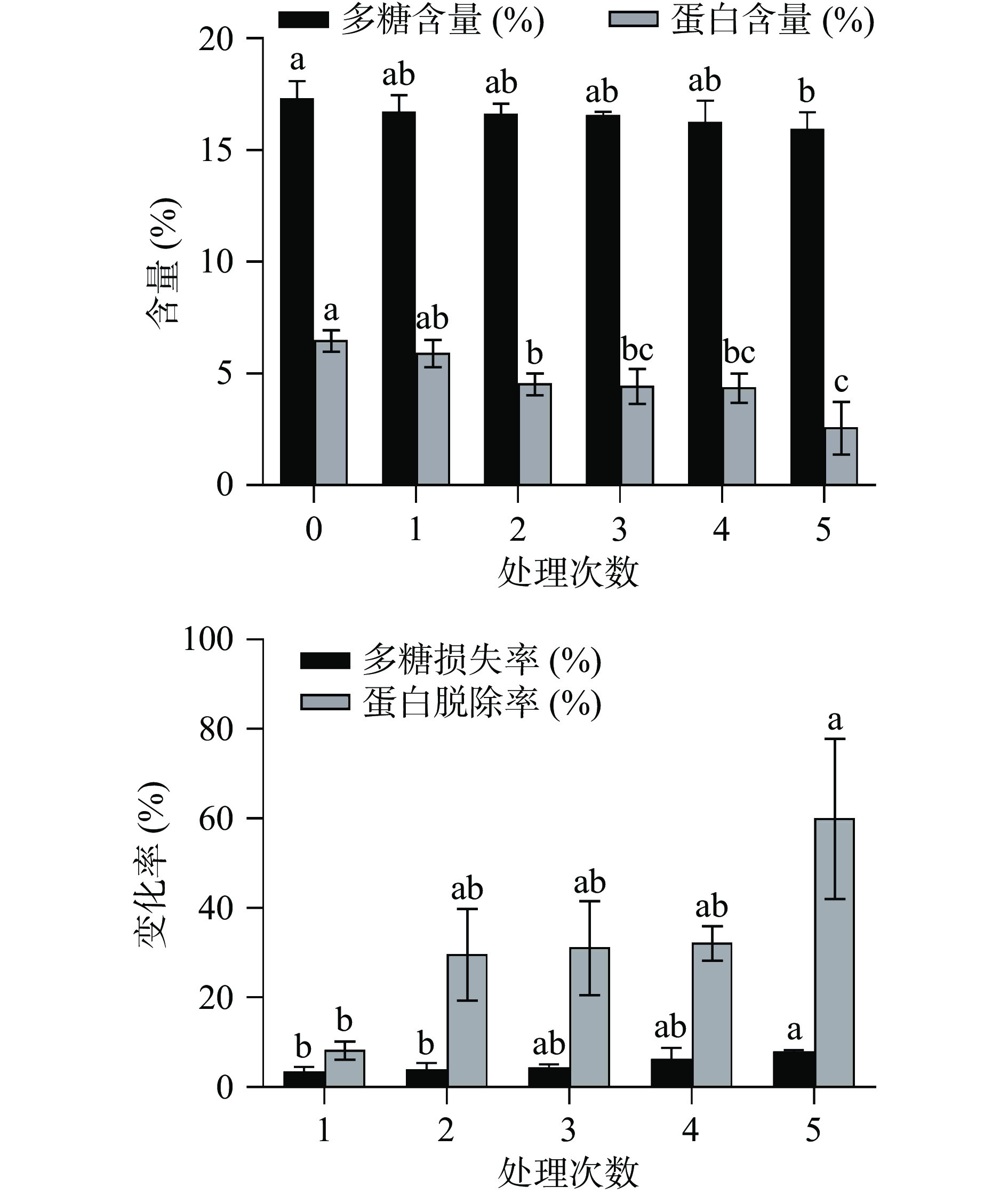
2.3.2 Sevag法
由图5可知,随着Sevag试剂处理次数的增加,生姜多糖中蛋白质的含量逐渐减少,处理次数达到5次时,蛋白含量为2.59%,蛋白脱除率为60.15%,同时生姜多糖中多糖含量逐渐减少,多糖含量为15.96%,多糖损失率为7.93%。结果表明,Sevag试剂在沉淀蛋白质的同时,也会吸附一定量的多糖,造成多糖的损失。这与前人的研究结果一致,王琳炜[24]采用Sevag法脱除霍山铁皮石斛粗多糖溶液中的蛋白质,随着脱蛋白次数的增加,蛋白脱除率和多糖损失率也随之升高,当Sevag试剂处理8次后,蛋白脱除率和多糖损失率分别为82.67%和32.72%。巩晓佩[38]同样采用Sevag法脱除红枣粗多糖中的蛋白质,Sevag试剂处理次数越多,脱蛋白效果越好,但多糖的损失随之增加,采用Sevag试剂处理6次后,蛋白的脱除率为74.53%,多糖的保留率为70.87%。综合考量生姜多糖脱蛋白后的多糖损失率和蛋白脱除率,最终采用Sevag法脱蛋白。经Sevag法脱蛋白后,生姜多糖的得率为2.91%±0.25%,并测得其中总糖含量为43.44%±0.99%。
2.4 生姜多糖的抗氧化活性
由图6可知,当生姜多糖浓度在0.25~4 mg/mL的范围内,其对ABTS+自由基和羟基自由基的清除能力随着浓度的增加而增强。生姜多糖和VC清除ABTS+自由基的IC50值分别为1.92和0.053 mg/mL。生姜多糖清除羟基自由基的IC50值为2.08 mg/mL,VC为0.54 mg/mL。在之前的研究中,当夏枯草多糖PV-P1为4 mg/mL时,对ABTS+自由基的清除率为30.3%[29],而相同浓度下,生姜多糖对ABTS+自由基的清除率明显高于PV-P1为66.09%。孙明杰等[39]研究发现茯苓多糖PCP-2浓度为4 mg/mL时,对羟基自由基的清除率为45.15%,低于相同浓度下生姜多糖对羟基自由基的清除率为65.73%。宋丽丽等[40]研究发现小黄姜多糖对ABTS+自由基和羟基自由基具有较强的清除活性。以上结果表明生姜多糖对ABTS+自由基和羟基自由基具有较强的清除活性。
2.5 生姜多糖对糖尿病小鼠血糖的调节作用
糖尿病治疗的关键在于能有效地控制血糖,而糖化血清蛋白水平能反映出机体过去1~3周血糖的平均水平[41]。由表5可知,当实验进行到第9周时,生姜多糖组小鼠的FBG浓度和GSP水平均与模型组小鼠小鼠存在显著性差异(P<0.05),而与正常组小鼠无显著性差异。实验结果表明生姜多糖能够有效地降低糖尿病小鼠的血糖,使其达到正常水平。
表 5 不同组中小鼠空腹血糖和糖化血清蛋白水平Table 5. Fasting blood glucose and glycated serum protein levels of mice in different groups组别 FBG (mmol/L) GSP (mmol/L) NC 6.54±0.38b 4.59±0.13b MOD 14.08±2.54a 5.46±0.18a GP 6.29±0.31b 4.53±0.19b 注:NC 正常组,MOD 模型组,GP 生姜多糖组;FBG 空腹血糖,GSP 糖化血清蛋白;不同的字母表示在统计学上具有显著性差异(P<0.05)。 2.6 糖尿病小鼠属水平上肠道微生物组成分析
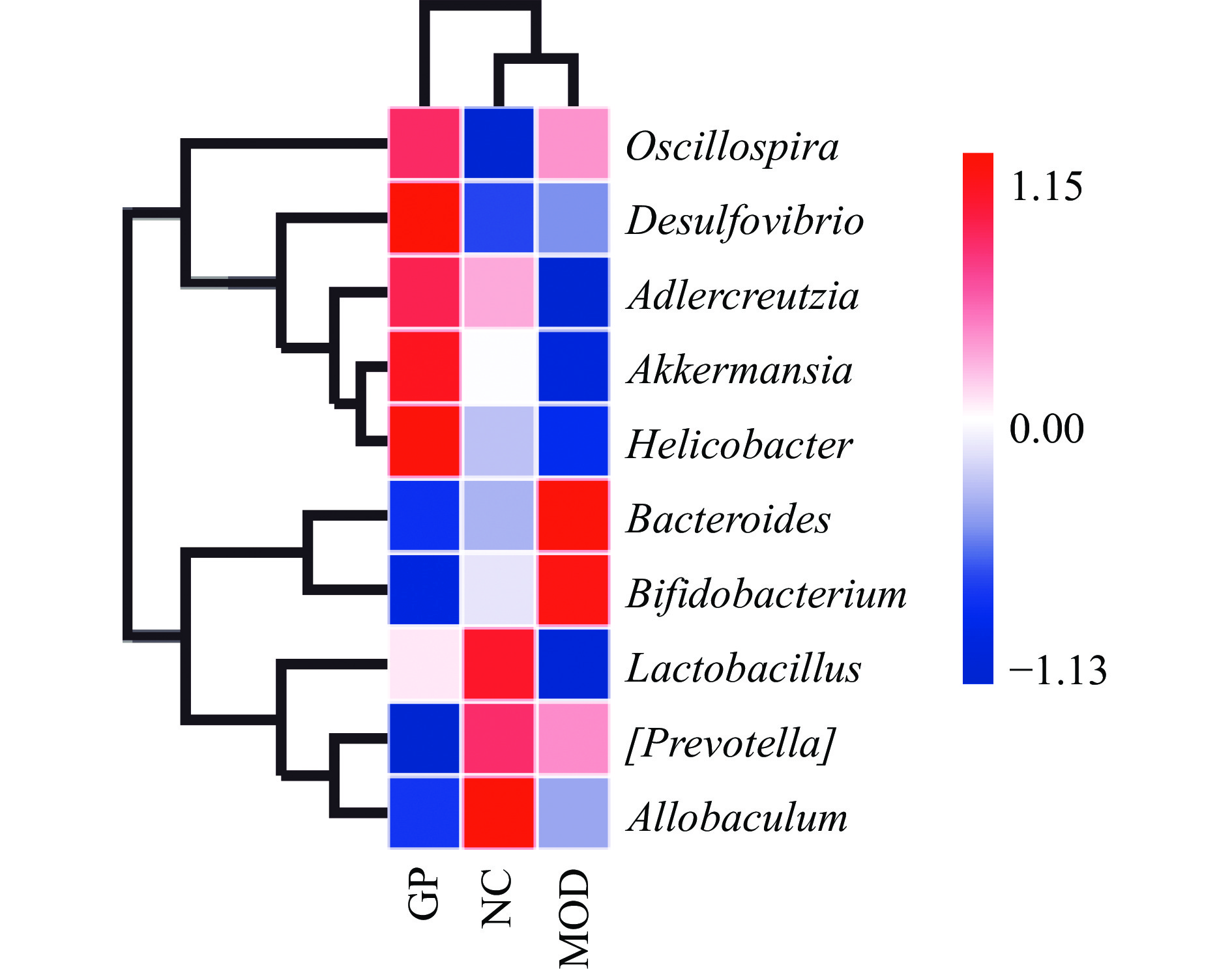
由图7可知,在属水平上,各处理组的肠道微生物主要包括:颤螺菌属(Oscillospira)、脱硫弧菌属(Desulfovibrio)、阿德勒克氏菌属(Adlercreutzia)、阿克曼菌属(Akkermansia)、幽门螺杆菌属(Helicobacter)、拟杆菌属(Bacteroides)、双歧杆菌属(Bifidobacterium)、乳酸杆菌属(Lactobacillus)、普雷沃氏菌属(Prevotella)和别样棒菌属(Allobaculum)。与模型组相比,在生姜多糖组中丰度增加的肠道菌群有:颤螺菌属(Oscillospira)、脱硫弧菌属(Desulfovibrio)、阿德勒克氏菌属(Adlercreutzia)、阿克曼菌属(Akkermansia)、幽门螺杆菌属(Helicobacter)和乳酸杆菌属(Lactobacillus),丰度降低的肠道菌群有:拟杆菌属(Bacteroides)、双歧杆菌属(Bifidobacterium)、普雷沃氏菌属(Prevotella)和别样棒菌属(Allobaculum)。表明生姜多糖能改变糖尿病小鼠中肠道菌群的组成。
3. 讨论与结论
多糖的提取是其研究和应用的基础,成熟的提取技术对多糖的纯度至关重要,从而影响后续结构和活性的研究。热水浸提法是多糖提取的传统方法,王晓梅等[42]通过水提醇沉法提取生姜多糖,在最优提取条件下多糖得率为7.58%;本研究中,同样采用该方法进行生姜多糖的提取,经过单因素实验和正交试验得到最优提取条件为料液比1:20 mg/mL,提取温度90 ℃,时间1 h。在该条件下进行实验,多糖得率为16.25%,与之前的研究相比,显著提高了生姜多糖的得率。此外,在本研究中采用Sevag法去除生姜多糖中的蛋白质,将蛋白含量由6.49%减少至2.59%,而多糖损失率仅为7.93%。随后,通过测定生姜多糖对ABTS+自由基和羟基自由基的清除能力,证明生姜多糖具有较强的抗氧化能力。这与Hou等[18]研究结果一致,表明生姜多糖具有应用于食品和药品等领域的潜力。
肠道菌群是人体内最复杂和种群数量最多的微生物聚集地,在正常人体的肠道内存在的主要肠道菌属有:拟杆菌属、双歧杆菌属、真杆菌属、梭菌属、消化球菌属、消化链球菌属和瘤胃球菌属[43]。肠道菌群失衡与许多疾病的发生密切相关。多糖作为一种大分子物质,已有研究表明其可能通过网格蛋白介导从而进入肠道,进而发挥其益生作用[44],Dong等[45]研究发现与2型糖尿病模型组小鼠相比,黑种草种子多糖显著增加f_Muribaculaceae_Unclassified和拟杆菌门的丰度。本研究中,生姜多糖有效地降低了小鼠的血糖水平,并增加了有益菌颤螺菌属(Oscillospira)、阿德勒克氏菌属(Adlercreutzia)、阿克曼菌属(Akkermansia)和乳酸杆菌属(Lactobacillus)的丰度,降低了有害菌普雷沃氏菌属(Prevotella)的丰度。其中颤螺菌属(Oscillospira)与肥胖有关,且与抑制肥胖的菌株小克里斯滕森氏菌(Christensenella minuta)高度正相关,此外,高动物脂肪饮食会造成颤螺菌属(Oscillospira)的丰度大大增加[46];阿德勒克氏菌属(Adlercreutzia)是一种能产生短链脂肪酸并具有抗炎作用的细菌[47];阿克曼菌属(Akkermansia)是一种黏蛋白降解菌,定值于肠道的黏膜层,能增强肠道屏障功能,与多种疾病呈负相关,如炎症性肠病(IBD)、肥胖和糖尿病等[48];普雷沃氏菌属(Prevotella)被证实会诱导胰岛素抵抗[49],此外,在伴随有高血压的糖尿病以及伴随有高血压和高血脂的糖尿病中,普雷沃氏菌属(Prevotella)的丰度增加[50]。综上,经热水浸提法提取和Sevag法脱蛋白所得的生姜多糖能改变糖尿病小鼠肠道内肠道菌群的组成,增加相关有益菌的丰度,发挥降血糖的作用。
-
表 1 正交试验因素水平设计
Table 1 Factor level of orthogonal experimental design
因素 水平 1 2 3 A:料液比(g/mL) 1:10 1:20 1:30 B:提取温度(℃) 80 90 100 C:提取时间(h) 1 2 3 表 2 正交试验结果
Table 2 Results of orthogonal experimental design
实验号 因素 多糖得率(%) A:料液比 B:提取温度 C:提取时间 1 1 1 1 7.58±0.74 2 1 2 2 8.07±0.48 3 1 3 3 10.32±1.71 4 2 1 2 9.77±0.62 5 2 2 3 15.29±0.50 6 2 3 1 15.37±0.66 7 3 1 3 9.03±0.74 8 3 2 1 11.83±0.94 9 3 3 2 15.45±0.83 k1 8.657 8.793 11.593 k2 13.477 11.730 11.097 k3 12.103 13.713 11.547 R 4.820 4.920 0.496 表 3 正交试验结果方差分析
Table 3 ANOVA of orthogonal experimental design results
因素 偏差平方和 自由度 F比 F临界值 显著性 A 36.998 2 82.035 19.000 * B 36.764 2 81.517 19.000 * C 0.451 2 1.000 19.000 误差 0.45 2 总和 74.663 8 表 4 正交试验结果多重比较 (Tukey法)
Table 4 Multiple comparisons of orthogonal experimental design results (Tukey)
因素 水平 1 2 3 A a b ab B a ab b C a a a 注:不同的字母表示在统计学上具有显著性差异(P<0.05)。 表 5 不同组中小鼠空腹血糖和糖化血清蛋白水平
Table 5 Fasting blood glucose and glycated serum protein levels of mice in different groups
组别 FBG (mmol/L) GSP (mmol/L) NC 6.54±0.38b 4.59±0.13b MOD 14.08±2.54a 5.46±0.18a GP 6.29±0.31b 4.53±0.19b 注:NC 正常组,MOD 模型组,GP 生姜多糖组;FBG 空腹血糖,GSP 糖化血清蛋白;不同的字母表示在统计学上具有显著性差异(P<0.05)。 -
[1] MENINI S, IACOBINI C, VITALE M, et al. The inflammasome in chronic complications of diabetes and related metabolic disorders[J]. Cells,2020,9(8):1−27.
[2] UNAI G, ASIER B, SHIFA J, et al. Pathophysiology of type 2 diabetes mellitus[J]. International Journal of Molecular Sciences,2020,21(17):1−34.
[3] MIN X, LIU R, FU B, et al. Correlation analysis combined with a floating reference measurement to improve the prediction accuracy of glucose in scattering media[J]. Applied Spectroscopy,2017,71(9):2076−2082. doi: 10.1177/0003702817712227
[4] 尹军霞, 林德荣. 肠道菌群与疾病[J]. 生物学通报,2004,53(3):26−28. [YIN J X, LIN D R. Gut flora and disease[J]. Bulletin of Biology,2004,53(3):26−28. doi: 10.3969/j.issn.0006-3193.2004.03.013 [5] LI Y G, XU W Y, ZHANG F, et al. The gut microbiota-produced indole-3-propionic acid confers the antihyperlipidemic effect of mulberry-derived 1-deoxynojirimycin[J]. Msystems,2020,5(5):1−15.
[6] LARSEN N, VOGENSEN F K, VAN DEN BERG F W J, et al. Gut microbiota in human adults with type 2 diabetes differs from non-diabetic adults[J]. PloS One,2010,5(2):1−10.
[7] WU H, ESTEVE E, TREMAROLI V, et al. Metformin alters the gut microbiome of individuals with treatment-naive type 2 diabetes, contributing to the therapeutic effects of the drug[J]. Nature Medicine,2017,23(7):850−858. doi: 10.1038/nm.4345
[8] 中国2型糖尿病防治指南(2020年版)(上)[J]. 中国实用内科杂志, 2021, 41(8): 668−695 Guideline for the prevention and treatment of type 2 diabetes mellitus in China (2020 edition) (Part 1)[J]. Chinese Journal of Practical Internal Medicine, 2021, 41(8): 668−695.
[9] VIJAN S, SUSSMAN J B, YUDKIN J S, et al. Effect of patients' risks and preferences on health gains with plasma glucose level lowering in type 2 diabetes mellitus[J]. Jama Internal Medicine,2014,174(8):1227−1234. doi: 10.1001/jamainternmed.2014.2894
[10] 王秋霞, 贾美艳, 唐荣平, 等. 天然药物中降血糖成分的研究进展[J]. 中国民族民间医药杂志,2005,14(4):190−193, 248. [WANG Q X, JIA M Y, TANG R P, et al. The chemical constituents review of decreasing blood glucose in natural products[J]. Chinese Journal of Ethnomedicine and Ethnopharmacy,2005,14(4):190−193, 248. [11] 唐圆, 谢果珍. 多糖与肠道菌群的相互作用研究进展[J]. 现代农业科技,2020,49(9):225−227. [TANG G, XIE G Z. Research progress on interaction between polysaccharide and gut microbiota[J]. Modern Agricultural Science and Technology,2020,49(9):225−227. doi: 10.3969/j.issn.1007-5739.2020.09.135 [12] 单峰, 黄璐琦, 郭娟, 等. 药食同源的历史和发展概况[J]. 生命科学,2015,27(8):1061−1069. [SHAN F, HUANG L Q, GUO J, et al. History and development of "One Root of Medicine and Food"[J]. Chinese Bulletin of Life Sciences,2015,27(8):1061−1069. [13] 李大峰, 贾冬英, 姚开, 等. 生姜及其提取物在食品加工中的应用[J]. 中国调味品,2011,36(2):20−23, 39. [LI D F, JIA D Y, YAO K, et al. Applications of ginger and its extract in food processing[J]. China Condiment,2011,36(2):20−23, 39. doi: 10.3969/j.issn.1000-9973.2011.02.007 [14] SUGIMOTO N, KATAKURA M, MATSUZAKI K, et al. Ginger facilitates cell migration and heat tolerance in mouse fibroblast cells[J]. Molecular Medicine Reports,2021,23(4):1−8.
[15] 项佳媚, 许利嘉, 肖伟, 等. 姜的研究进展[J]. 中国药学杂志,2017,52(5):353−357. [XIANG J M, XU L J, XIAO W, et al. Research progress in Zingiber officinale[J]. Chinese Pharmaceutical Journal,2017,52(5):353−357. [16] RAAFAT M, EL-SAYED A S A, EL-SAYED M T. Biosynthesis and anti-mycotoxigenic activity of Zingiber officinale Roscoe-derived metal nanoparticles[J]. Molecules,2021,26(8):1−13.
[17] 赵文竹, 张瑞雪, 于志鹏, 等. 生姜的化学成分及生物活性研究进展[J]. 食品工业科技,2016,37(11):383−389. [ZHAO W Z, ZHANG R X, YU Z P, et al. Research progress in ginger chemical composition and biological activity[J]. Science and Technology of Food Industry,2016,37(11):383−389. doi: 10.13386/j.issn1002-0306.2016.11.070 [18] HOU M D, JUN G, LIU Z Q, et al. Antioxidant and immunomodulatory activitiesin vitro of a neutral polysaccharide from ginger (Zingiber officinale)[J]. Starch-Starke,2021,73(9−10):2100048. doi: 10.1002/star.202100048
[19] LIAO D W, CHENG C, LIU J P, et al. Characterization and antitumor activities of polysaccharides obtained from ginger (Zingiber officinale) by different extraction methods[J]. International Journal of Biological Macromolecules,2020,152:894−903. doi: 10.1016/j.ijbiomac.2020.02.325
[20] WANG C F, HE Y X, TANG X Z, et al. Sulfation, structural analysis, and anticoagulant bioactivity of ginger polysaccharides[J]. Journal of Food Science,2020,85(8):2427−2434. doi: 10.1111/1750-3841.15338
[21] CHEN X H, WANG Z R, KAN J Q. Polysaccharides from ginger stems and leaves: Effects of dual and triple frequency ultrasound assisted extraction on structural characteristics and biological activities[J]. Food Bioscience,2021,42:101166. doi: 10.1016/j.fbio.2021.101166
[22] 冯鑫, 夏宇, 陈贵堂, 等. 生姜皮多糖的分离纯化及其结构组成分析[J]. 食品科学,2017,38(6):185−190. [FENG X, XIA Y, CHEN G T, et al. Purification and structural analysis of polysaccharide from ginger peels[J]. Food Science,2017,38(6):185−190. doi: 10.7506/spkx1002-6630-201706029 [23] 陈丽娟. 银耳多糖快速提取及可控降解的研究[D]. 广州: 华南理工大学, 2017 CHEN L J. Research on fast extraction and controlled degradation of polysaccharide from tremella[D]. Guangzhou: South China University of Technology, 2017.
[24] 王琳炜. 霍山铁皮石斛多糖DOPA-1的结构特征及对HepG2细胞凋亡的影响[D]. 镇江: 江苏大学, 2017 WANG L W. Structural characterization of polysaccharide DOPA-1 isolated from Dendrobium officinale Kimura et Migo in Huoshan and its apoptosis effect on HepG2 cell[D]. Zhenjiang: Jiangsu University, 2017.
[25] 杨永涛. 罗布麻总黄酮的提取、分离纯化及其抗氧化性能研究[D]. 广州: 华南理工大学, 2018 YANG Y T. Study on extraction, purification and antioxidant activity of total flavonoids from Apocynum venetum[D]. Guangzhou: South China University of Technology, 2018.
[26] 李守鹏. 生姜中抗氧化成分的提取及其抗痴呆效果的研究[D]. 泰安: 山东农业大学, 2015 LI S P. Study on extraction and anti-dementia effects of antioxidant constituents from ginger[D]. Taian: Shandong Agricultural University, 2015.
[27] DUBOIS M, GILLES K A, HAMILTON J K, et al. Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry,1956,28(3):350−356. doi: 10.1021/ac60111a017
[28] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry,1976,72:248−254. doi: 10.1016/0003-2697(76)90527-3
[29] LI C, HUANG Q, FU X, et al. Characterization, antioxidant and immunomodulatory activities of polysaccharides from Prunella vulgaris Linn[J]. International Journal of Biological Macromolecules,2015,75:298−305. doi: 10.1016/j.ijbiomac.2015.01.010
[30] 沈赤. 绍兴黄酒多糖的分离提取、生物活性及其对肠道微生物的影响[D]. 无锡: 江南大学, 2014 SHEN C. The separation and extraction, biological activities of polysaccharides from Shanxing rice wine and their effects on intestinal microflora[D]. Wuxi: Jiangnan University, 2014.
[31] JIAO Y K, WANG X Q, JIANG X, et al. Antidiabetic effects of Morus alba fruit polysaccharides on high-fat diet- and streptozotocin-induced type 2 diabetes in rats[J]. Journal of Ethnopharmacology,2017,199:119−127. doi: 10.1016/j.jep.2017.02.003
[32] 王昭珺, 刘晓风, 徐也. 兰州百合芯多糖的提取工艺及其体外抗氧化活性[J]. 现代食品科技,2020,36(9):219−227, 201. [WANG Z J, LIU X F, XU Y. Extraction process of polysaccharides from Lanzhou Lily Cores and evaluation of their antioxidant activity in vitro[J]. Modern Food Science and Technology,2020,36(9):219−227, 201. doi: 10.13982/j.mfst.1673-9078.2020.9.0258 [33] 朱成香. 黄精多糖抗铅-镉复合重金属致肝损伤药效学评价及作用机制研究[D]. 贵阳: 贵州师范大学, 2021 ZHU C X. Pharmacodynamic evaluation and mechanism study of Polygonatum polysaccharide on liver injury induced by lead-cadmium complex heavy metals[D]. Guiyang: Guizhou Normal University, 2021.
[34] 宋振康. 元蘑多糖的提取及其缓解体力疲劳功能的研究[D]. 长春: 长春工业大学, 2021 SONG Z K. Extraction and alleviate physical fatigue of polysaccharide from Hohenbuehelia serotina[D]. Changchun: Changchun University Of Technology, 2021.
[35] 夏宇. 生姜皮多糖的分离纯化、结构分析及其抗氧化活性研究[D]. 南京: 南京农业大学, 2016 XIA Y. Research on extraction, purification, structural analysis and antioxidant activity of polysaccharides from the ginger skin[D]. Nanjing: Nanjing Agricultural University, 2016.
[36] 李波, 张亚茹, 周娅丽, 等. 灵芝三萜和多糖提取工艺研究[J]. 食用菌,2022,44(2):54−57. [LI B, ZHANG Y R, ZHOU Y L, et al. Study on extraction technology of triterpenes and polysaccharides from Ganoderma lucidum[J]. Edible Fungi,2022,44(2):54−57. doi: 10.3969/j.issn.1000-8357.2022.02.018 [37] 马丽媛, 尚尔坤, 张金凤, 等. 超声波辅助复合酶法提取芦荟多糖的研究[J]. 中国食品添加剂,2022,33(3):51−56. [MA L Y, SHANG E K, ZHANG J F, et al. Study on the extraction of aloe polysaccharide by ultrasound assisted compound enzyme[J]. China Food Additives,2022,33(3):51−56. doi: 10.19804/j.issn1006-2513.2022.03.008 [38] 巩晓佩. 硫酸化修饰红枣多糖的结构表征及生物活性的研究[D]. 石河子: 石河子大学, 2021 GONG X P. Study on the structure characterization and biological activity of sulfated modified jujube polysaccharide[D]. Shihezi: Shihezi University, 2021.
[39] 孙明杰, 张越, 姚亮, 等. 茯苓多糖的分离纯化、组成及其抗氧化活性研究[J]. 安徽中医药大学学报,2022,41(1):86−91. [SUN M J, ZHANG Y, YAO L, et al. Isolation, purification, composition, and antioxidant activity of Poria cocos polysaccharides[J]. Journal of Anhui University of Chinese Medicine,2022,41(1):86−91. doi: 10.3969/j.issn.2095-7246.2022.01.017 [40] 宋丽丽, 闻格, 霍姗浩, 等. 小黄姜多糖的分离纯化及其结构特征及抗氧化活性研究[J]. 食品与发酵工业,2020,46(12):73−79. [SONG L L, WEN G, HUO S H, et al. Isolation, purification, structural characterization and antioxidant activity of polysaccharide from Zingiber officinale Roscoe[J]. Food and Fermentation Industries,2020,46(12):73−79. doi: 10.13995/j.cnki.11-1802/ts.023519 [41] BAI Z Y, MENG J X, HUANG J X, et al. Comparative study on antidiabetic function of six legume crude polysaccharides[J]. International Journal of Biological Macromolecules,2020,154:25−30. doi: 10.1016/j.ijbiomac.2020.03.072
[42] 王晓梅, 张忠山, 郑卫红, 等. 生姜多糖的提取纯化工艺及鉴定[J]. 中国调味品,2011,36(5):44−46, 51. [WANG X M, ZHANG Z S, ZHENG W H, et al. Extraction, purification and identification of polysaccharide from ginger[J]. China Condiment,2011,36(5):44−46, 51. doi: 10.3969/j.issn.1000-9973.2011.05.013 [43] GUARNER F, MALAGELADA J R. Gut flora in health and disease[J]. Lancet,2003,361(9356):512−519. doi: 10.1016/S0140-6736(03)12489-0
[44] 郑子明. 香菇多糖药代动力学及其体内吸收代谢机制研究[D]. 武汉: 华中科技大学, 2019 ZHENG Z M. Study on pharmacokinetics of polysaccharide from Lentinus edodes and its mechanism of absorption and metabolism in vivo[D]. Wuhan: Huazhong University of Science and Technology, 2019.
[45] DONG J, LIANG Q X, NIU Y, et al. Effects of Nigella sativa seed polysaccharides on type 2 diabetic mice and gut microbiota[J]. International Journal of Biological Macromolecules,2020,159:725−738. doi: 10.1016/j.ijbiomac.2020.05.042
[46] KONIKOFF T, GOPHNA U. Oscillospira: A central, enigmatic component of the human gut micropiota[J]. Trends in Microbiology,2016,24(7):523−524. doi: 10.1016/j.tim.2016.02.015
[47] WEI X Y, TAO J H, XIAO S W, et al. Xiexin Tang improves the symptom of type 2 diabetic rats by modulation of the gut microbiota[J]. Scientific Reports,2018,8(1):1−12.
[48] OTTMAN N, GEERLINGS S Y, AALVINK S, et al. Action and function of Akkermansia muciniphila in microbiome ecology, health and disease[J]. Best Practice & Research Clinical Gastroenterology,2017,31(6):637−642.
[49] PEDERSEN H K, GUDMUNDSDOTTIR V, NIELSEN H B, et al. Human gut microbes impact host serum metabolome and insulin sensitivity[J]. Nature,2016,535(7612):376−381. doi: 10.1038/nature18646
[50] LIU F P, LING Z X, XIAO Y H, et al. Alterations of urinary microbiota in type 2 diabetes mellitus with hypertension and/or hyperlipidemia[J]. Frontiers in Physiology,2017(8):1−11.
-
期刊类型引用(1)
1. 郭元新,郭宇,朱凤,张瑶,王东旭,叶华,俞玥. 微波联合金属离子对麦胚中肽的富集研究. 食品工业科技. 2023(01): 217-223 .  本站查看
本站查看
其他类型引用(2)






 下载:
下载:





 下载:
下载:



