Effect of Mangiferin on the Glycolipid Metabolism Disorder in T2DM Rats and Its Mechanism
-
摘要: 为探讨芒果苷改善大鼠2型糖尿病(type 2 diabetes mellitus,T2DM)糖脂代谢紊乱的作用及潜在机制,将T2DM大鼠随机分为模型对照组、二甲双胍组(100 mg/kg)及芒果苷低、中、高剂量组(50、100、200 mg/kg),另设正常对照组,10只/组;灌胃给药,1次/d,持续8周。评价空腹血糖(fasting blood glucose,FBG)、空腹胰岛素(fasting insulin,FINS)、胰岛素抵抗指数(insulin resistance index,HOMA-IR)及血清游离脂肪酸(free fatty acid,FFA)、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)等指标,并检测肝组织谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)及胰岛素受体底物1(insulin receptor substrate 1,IRS-1)/蛋白激酶B(protein kinase B,Akt)/葡萄糖转运蛋白4(glucose transporter 4,Glut4)信号通路相关mRNA和蛋白表达。结果发现,芒果苷可以改善T2DM大鼠毛色、活动及精神等一般状态,减缓体重下降趋势;与模型对照组比较,经芒果苷治疗8周后,各治疗组大鼠FBG、FINS、HOMA-IR及血清FFA、TG、TC含量均显著或极显著降低(P<0.05,P<0.01);各治疗组大鼠肝组织GSH-Px、CAT、SOD活力显著或极显著高于模型对照组(P<0.05,P<0.01),而MDA含量极显著降低(P<0.01);与模型对照组比较,芒果苷低、中、高剂量组大鼠肝组织IRS-1 mRNA表达无显著差异(P>0.05),Akt、Glut4 mRNA及p-IRS-1(Tyr)、Akt、Glut4蛋白表达显著或极显著增加(P<0.05,P<0.01),而p-IRS-1(Ser)蛋白表达显著或极显著降低(P<0.05,P<0.01)。上述结果表明,芒果苷具有改善T2DM大鼠糖脂代谢紊乱的作用,该作用与抗氧化应激及调节IRS-1/Akt/Glut4信号通路有关。
-
关键词:
- 芒果苷 /
- 2型糖尿病 /
- 糖脂代谢 /
- 氧化应激 /
- 胰岛素受体底物1/蛋白激酶B/葡萄糖转运蛋白4信号通路
Abstract: To investigate the effect of mangiferin on the glycolipid metabolism disorder in type 2 diabetes mellitus (T2DM) rats and its underlying mechanism, T2DM rats were randomly divided into model control group, metformin group (100 mg/kg), and low-, medium- and high-dose mangiferin groups (50, 100 and 200 mg/kg), 10 rats in each group, and a normal control group was set (10 healthy rats). The rats were intragastrically administered with the different agents once a day, successively for 8 weeks. The levels of fasting blood glucose (FBG) and fasting insulin (FINS) were determined, the insulin resistance index (HOMA-IR) was calculated, the contents of serum free fatty acid (FFA), triglyceride (TG) and total cholesterol (TC) were measured, the activities of glutathione peroxidase (GSH-Px), catalase (CAT) and superoxide dismutase (SOD) and the content of malondialdehyde (MDA) in the liver tissue of rats were tested, and the mRNA and proteins related to the insulin receptor substrate 1 (IRS-1)/protein kinase B (Akt)/glucose transporter 4 (Glut4) signaling pathway in the liver tissue of rats were detected. The results showed that mangiferin could improve the general status of T2DM rats, including their hair color, activity and spirits, and slow down the trend of weight loss. Compared with those in the model control group, the contents of FBG, FINS, HOMA-IR and serum FFA, TG and TC in the mangiferin-treated groups were significantly or extremely significantly decreased after the intragastric administration of mangiferin for 8 weeks (P<0.05, P<0.01). The activities of GSH-Px, CAT and SOD in the liver tissue of rats in the mangiferin-treated groups were significantly or extremely significantly higher than those in the model control group (P<0.05, P<0.01), while the content of MDA in the liver tissue of rats was extremely significantly lower than that in the model control group (P<0.01). The expression of IRS-1 mRNA in the liver tissue of rats in the low-, medium- and high-dose mangiferin groups was not significantly different from that in the model control group (P>0.05), the expression levels of Akt, Glut4 mRNA, and p-IRS-1 (Tyr), Akt and Glut4 proteins increased significantly or extremely significantly (P<0.05, P<0.01), while the expression of p-IRS-1 (Ser) protein decreased significantly or extremely significantly compared with that in the model control group (P<0.05, P<0.01). The above results indicate that mangiferin can improve the glycolipid metabolism disorder in T2DM rats, which may be related to its antioxidant stress and regulation on the IRS-1/Akt/Glut4 signaling pathway. -
2型糖尿病(type 2 diabetes mellitus,T2DM)是一类常见的内分泌疾病,持续性的血糖升高是其主要特征,而机体产生胰岛素抵抗和(或)胰岛素分泌相对减少是导致血糖升高的重要原因[1]。饮食结构的改变及以静坐为主的生活方式使T2DM的发病率逐年增加,在全球已经形成流行趋势,T2DM患者数量在2040年预计将高达6.42亿[2]。T2DM患者常伴有脂代谢紊乱,而脂代谢紊乱又会使胰岛素抵抗程度加重,长期的糖脂代谢紊乱可导致血管、微血管受损,进而危及脑、心、足、肾、眼等多种器官和组织,对人类健康和生命造成巨大威胁[3]。所以,积极探索同时具有调节糖代谢紊乱和脂代谢紊乱的生物活性物质,对T2DM的治疗具有重要意义[4-5]。
芒果苷(mangiferin)属于多酚酸类化合物,其主要存在于漆树科植物芒果的果实、树皮、叶,鸢尾科植物射干的茎、叶、花,及百合科植物知母的地上部分、根茎等中。芒果苷的药理作用广泛,具有保肝、抗肿瘤、调节免疫力、抗病毒、神经保护及抗炎、抗氧化等多种活性,同时,芒果苷的安全性也得到一致认可[6]。近年来,芒果苷的抗糖尿病作用也逐渐被人们所关注。芒果苷可以降低糖尿病小鼠的血糖水平,也可以抑制胰岛细胞凋亡及保护糖尿病小鼠肾脏损伤[7]。芒果苷也能够提高机体对葡萄糖的利用能力,促进肌、肝糖原的合成,从而改善糖脂代谢紊乱[8-9]。氧化应激、胰岛素受体底物1(insulin receptor substrate 1,IRS-1)/蛋白激酶B(protein kinase B,Akt)/葡萄糖转运蛋白4(glucose transporter 4,Glut4)信号通路受阻是T2DM糖脂代谢紊乱发生的重要病理生理机制[10-11]。迄今为止,芒果苷改善T2DM大鼠糖脂代谢紊乱作用与氧化应激、IRS-1/Akt/Glut4信号通路是否有关,未见报道。
本研究采用高糖高脂饲料喂养联合腹腔注射链脲佐菌素(streptozotocin,STZ)法建立大鼠T2DM模型,灌胃给予芒果苷治疗后,通过评价空腹血糖(fasting blood glucose,FBG)、空腹胰岛素(fasting insulin,FINS)、胰岛素抵抗指数(insulin resistance index,HOMA-IR)及血清游离脂肪酸(free fatty acid,FFA)、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)等指标,明确芒果苷在该T2DM模型中是否同样具有改善糖脂代谢紊乱作用;在此基础上,进一步检测肝组织氧化应激标志物、IRS-1/Akt/Glut4信号通路相关基因及蛋白表达等指标,探讨芒果苷对氧化应激及IRS-1/Akt/Glut4信号通路的影响,初步阐明其改善T2DM糖脂代谢紊乱作用的分子机制,以期为芒果苷用于T2DM糖脂代谢紊乱的治疗提供科学的实验依据。
1. 材料与方法
1.1 材料与仪器
清洁级SD雄性大鼠,体重180~220 g,共80只 由吉林大学实验动物中心提供,动物合格证号:SCXK(吉)2021-0001;实验动物自由饮水、摄食,在22~25 ℃恒温环境下饲养,室内间隔12 h明暗自动切换。标准饲料与高糖高脂饲料 均购于长春亿斯实验动物公司,高糖高脂饲料在59%标准饲料基础上,添加20%蔗糖、10%猪油、10%蛋黄粉及1%胆固醇。本项研究经吉林市化工医院伦理委员会审批通过(2020101301),并按照3R原则给予使用的实验动物人道关怀。
芒果苷(纯度≥95%)(批号20201214) 购于西安瑞尔丽生物工程有限公司;二甲双胍片(规格0.25 g/片)(批号20210125) 购于上海施贵宝制药有限公司;STZ(批号V900890) 美国Sigma公司;0.1 mol/L柠檬酸-柠檬酸钠缓冲液(pH4.5)(批号GL1720) 北京百奥莱博科技公司;FINS及FFA含量检测试剂盒(批号ml302840、ml092767) 上海酶联生物科技有限公司;谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)活力及丙二醛(malondialdehyde,MDA)含量检测试剂盒(批号SP12672、SP13470、SP12914、SP30131) 武汉赛培生物科技有限公司;RNA提取试剂盒、逆转录试剂盒及SYBR Green Master Mix(批号10606ES60、11119ES60、11198ES03) 上海翌圣生物科技公司;IRS-1、p-IRS-1(Tyr)、p-IRS-1(Ser)、Akt及Glut4多克隆抗体(批号ab52167、ab4873、ab5599、ab8805、ab33780) 美国Abcam公司;β肌动蛋白(β-actin)多克隆抗体及山羊抗兔IgG二抗(批号20536-1-AP、PR30012) 武汉三鹰生物技术有限公司。
稳悦智佳型血糖仪 美国Johnson公司;5424R型低温高速离心机 德国Eppendorf公司;Multiskan FC型全波长酶标仪 美国Thermo公司;7170A型全自动生化仪 日本日立公司;UV-9000型紫外可见分光光度计 上海元析仪器有限公司;7500型实时定量PCR仪 美国ABI公司;Mini-PROTEAN型蛋白电泳及Mini Trans-Blot型转移系统 美国Bio-Rad公司;Image Station 2000MM型成像系统 美国Kodak公司。
1.2 实验方法
1.2.1 大鼠T2DM模型建立、分组及给药
大鼠T2DM模型建立参考胡吉蕾等[12]的方法。SD大鼠适应环境7 d后,按体重随机分为正常对照组(n=10)和高糖高脂组(n=70),正常对照组大鼠用标准饲料喂养,高糖高脂组大鼠用高糖高脂饲料喂养。4周后,禁食不禁水12 h,高糖高脂组大鼠腹腔注射用0.1 mol/L柠檬酸-柠檬酸钠缓冲液(pH4.5)配制的浓度为1%的STZ溶液(35 mg/kg),正常对照组大鼠腹腔注射等体积的0.1 mol/L柠檬酸-柠檬酸钠缓冲液(pH4.5)。注射完成3 d后,尾静脉采血检测高糖高脂组大鼠FBG含量,当FBG含量≥16.7 mmol/L时视为建模成功,共成模54只(成模率77.14%)。去除FBG含量最高及最低的大鼠各2只,剩余50只大鼠随机分为模型对照组、二甲双胍组及芒果苷低、中、高剂量组,10只/组。二甲双胍组大鼠灌胃给予二甲双胍(100 mg/kg),芒果苷低、中、高剂量组大鼠灌胃给予芒果苷(50、100、200 mg/kg),正常对照组及模型对照组大鼠灌胃蒸馏水,灌胃体积均为10 mL/kg,1次/d,持续8周;其中二甲双胍的给药剂量参考文献[13],芒果苷的给药剂量参考文献[14]并结合预实验结果进行设定。给药期间观察各组大鼠一般状态,并于给药前及给药2、4、8周称量各组大鼠体重。
1.2.2 FBG、FINS含量测定及HOMA-IR计算
于给药前及给药2、4、8周用血糖仪检测各组大鼠FBG含量。末次给药结束后,麻醉大鼠并腹主动脉取血,离心分离血清;剖取肝脏组织,用生理盐水冲去残留血迹,在−80 ℃冰箱中保存。FINS含量检测采用ELISA法进行[15],操作步骤参考FINS含量检测试剂盒的说明书指南。
1.2.3 血清FFA、TG及TC含量测定
各组大鼠血清FFA含量测定采用ELISA法,操作步骤参考FFA含量检测试剂盒的说明书指南;血清TG、TC含量测定使用全自动生化分析仪进行[16]。
1.2.4 肝组织GSH-Px、CAT、SOD活力及MDA含量测定
从−80 ℃冰箱中取相同部位肝脏组织,精确称取100 mg,加入9倍(重量体积比)预冷至4 ℃的生理盐水,在冰上匀浆后制备10%肝组织匀浆液,离心取上清。分别通过GSH-Px、CAT、SOD活力及MDA含量检测试剂盒测定肝组织GSH-Px、CAT、SOD活力及MDA含量[17]。
1.2.5 肝组织IRS-1、Akt及Glut4 mRNA表达测定
取冻存的肝组织,用RNA提取试剂盒提取总RNA后,逆转录为cDNA。PCR扩增以cDNA为模板,PCR引物序列如表1所示,并由上海捷瑞生物工程有限公司合成。扩增反应条件为:95 ℃、35 s;95 ℃、5 s,56 ℃、1 min,共循环40次。每个样品均进行3次重复实验,以β-actin为内参基因,采用2−ΔΔCt法计算IRS-1、Akt及Glut4 mRNA表达量[18]。
表 1 PCR引物序列Table 1. PCR primer sequence基因名称 引物序列(5’-3’) 产物大小(bp) IRS-1 正向引物:TTCAAGGAGGTCTGGCAGGTTATC 109 反向引物:TCACAAAGCTGATGGTCTTGCTG Akt 正向引物:TTTGGGAAGGTGATTCTGGTG 152 反向引物:CGTAAGGAAGGGATGCCTAGAGTT Glut4 正向引物:CCCCATTCCCTGGTTCATT 140 反向引物:GACCCATAGCATCCGCAAC β-actin 正向引物:GCCTTCCTTCTTGGGTAT 98 反向引物:GGCATAGAGGTCTTTACGG 1.2.6 肝组织p-IRS-1(Tyr)、p-IRS-1(Ser)、Akt及Glut4蛋白表达测定
精确称取肝组织100 mg,剪碎后加入蛋白酶抑制剂及细胞裂解液,置于冰水浴上匀浆,通过Bradford法测总蛋白浓度。采用常规方法进行SDS-PAGE电泳及转膜等操作[19],IRS-1、p-IRS-1(Tyr)、p-IRS-1(Ser)、Akt及Glut4等抗体的稀释比例均为1:1000,β-actin的稀释比例为1:2500,IgG二抗的稀释比例为1:5000。最后经ECL显色、曝光后,使用Image Pro Plus 6.0软件测定目的蛋白灰度值。
1.3 数据处理
用SPSS22.0软件开展统计学分析工作,数据均通过“
2. 结果与分析
2.1 芒果苷对T2DM大鼠一般状态及体重的影响
正常对照组大鼠二便及饮食、饮水量无异常,毛发有光泽,活动灵活,精神良好。模型对照组大鼠二便及饮食、饮水量增加,毛发枯黄、杂乱且脱毛,活动量减少、行动迟缓,精神萎靡。二甲双胍组及芒果苷低、中、高剂量组大鼠二便及饮食、饮水量有降低趋势,毛色、活动及精神等方面均有改善,且随着治疗时间的延长,改善效果越为明显。芒果苷对T2DM大鼠体重的影响,如表2所示。给药前,与正常对照组比较,模型对照组大鼠体重显著降低(P<0.05);与模型对照组比较,二甲双胍组及芒果苷低、中、高剂量组大鼠体重无显著变化(P>0.05)。在整个给药周期中,正常对照组大鼠体重稳步增长,模型对照组大鼠体重持续下降,与正常对照组比较,模型对照组大鼠体重在给药2周、4周及8周时均极显著降低(P<0.01);与模型对照组比较,二甲双胍组、芒果苷高剂量组大鼠在给药4周、8周及芒果苷中剂量组在给药8周时体重均显著或极显著增加(P<0.05,P<0.01),结果表明芒果苷可以减缓T2DM大鼠体重下降的趋势。
表 2 芒果苷对T2DM大鼠体重的影响(n=10,g)Table 2. Effect of mangiferin on body weight in T2DM rats (n=10, g)分组 体重 给药前 给药2周 给药4周 给药8周 正常对照组 415.78±48.59 454.52±51.62 481.39±53.14 534.69±44.78 模型对照组 371.33±32.10* 356.25±47.91** 302.89±36.98** 268.52±27.15** 二甲双胍组 362.67±34.13 381.59±34.23 351.35±42.19# 332.46±31.28## 芒果苷低剂量组 378.68±41.29 358.09±32.54 310.97±37.33 287.12±29.13 芒果苷中剂量组 363.47±40.84 357.84±43.81 332.01±38.07 303.38±36.02# 芒果苷高剂量组 369.83±33.25 366.15±45.06 337.90±25.69# 329.71±33.53## 注:与正常对照组比,*P<0.05,**P<0.01;与模型对照组比,#P<0.05,##P<0.01;表3及图1~图5同。 2.2 芒果苷对T2DM大鼠FBG含量的影响
高血糖是T2DM的主要特征之一,芒果苷对T2DM大鼠FBG含量的影响,如表3所示。正常对照组大鼠FBG含量一直处于低水平,模型对照组大鼠FBG含量一直处于高水平,两组大鼠血糖含量间存在极显著差异(P<0.01)。各给药组大鼠FBG含量随着给药时间的延长逐渐降低,与模型对照组比较,二甲双胍组、芒果苷中、高剂量组大鼠从给药2周、芒果苷低剂量组从给药4周开始FBG含量降低幅度均有显著或极显著差异(P<0.05,P<0.01),该结果表明芒果苷具有降低T2DM大鼠FBG含量的作用,且该作用具有剂量及时间依赖性。
表 3 芒果苷对T2DM大鼠FBG含量的影响(n=10,mmol/L)Table 3. Effect of mangiferin on FBG contents in T2DM rats (n=10, mmol/L)分组 FBG 给药前 给药2周 给药4周 给药8周 正常对照组 5.39±0.28 5.41±0.32 5.27±0.45 5.48±0.56 模型对照组 24.25±3.31** 23.18±2.26** 24.22±3.54** 21.66±3.12** 二甲双胍组 23.62±3.17 18.09±2.11## 12.39±1.02## 7.43±0.87## 芒果苷低剂量组 24.16±2.94 22.75±2.48 20.54±2.35# 14.91±1.53## 芒果苷中剂量组 22.97±2.64 19.35±1.51## 15.61±1.79## 10.85±1.24## 芒果苷高剂量组 23.48±3.78 19.12±2.05## 14.57±1.33## 9.06±1.30## 2.3 芒果苷对T2DM大鼠FINS含量及HOMA-IR值的影响
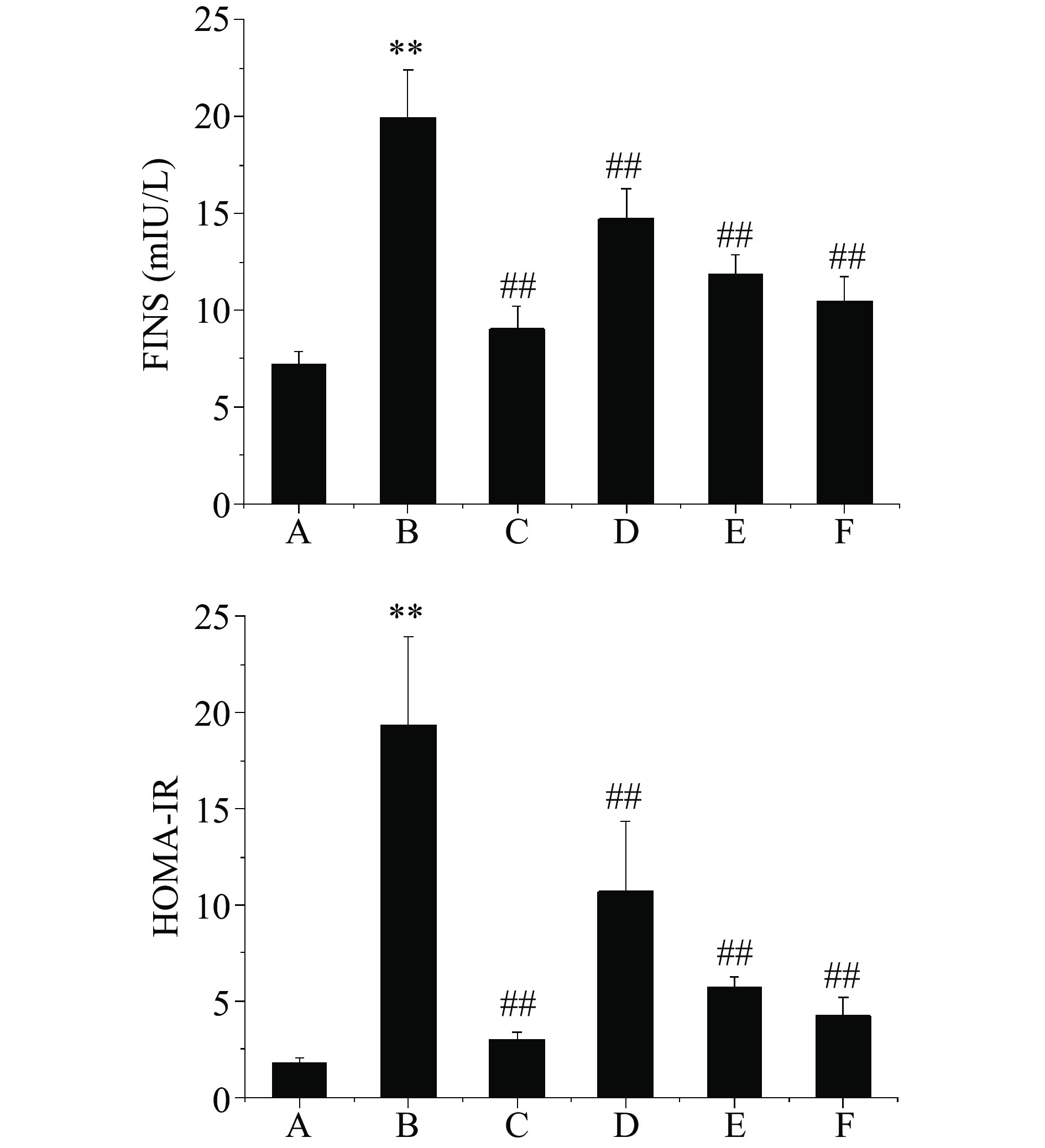
芒果苷对T2DM大鼠FINS含量及HOMA-IR值的影响,如图1所示。模型对照组大鼠FINS含量及HOMA-IR值极显著高于正常对照组(P<0.01),提示T2DM大鼠存在胰岛素抵抗。经过8周的治疗,二甲双胍组及芒果苷低、中、高剂量组大鼠FINS含量及HOMA-IR值均极显著低于模型对照组(P<0.01),提示芒果苷能够改善T2DM大鼠的胰岛素抵抗状态。胰岛素抵抗在T2DM患者中发病率超过80%,主要表现为胰岛素靶组织中胰岛素利用和摄取葡萄糖能力的减弱,胰岛素受体减少或敏感性降低是引起胰岛素抵抗的重要原因,常常表现为FINS含量及HOMA-IR值异常升高[20]。胰岛素抵抗是导致糖脂代谢紊乱的主要原因,而减弱胰岛素抵抗有助于改善T2DM糖脂代谢紊乱症状[21]。
2.4 芒果苷对T2DM大鼠血清FFA、TG及TC含量的影响
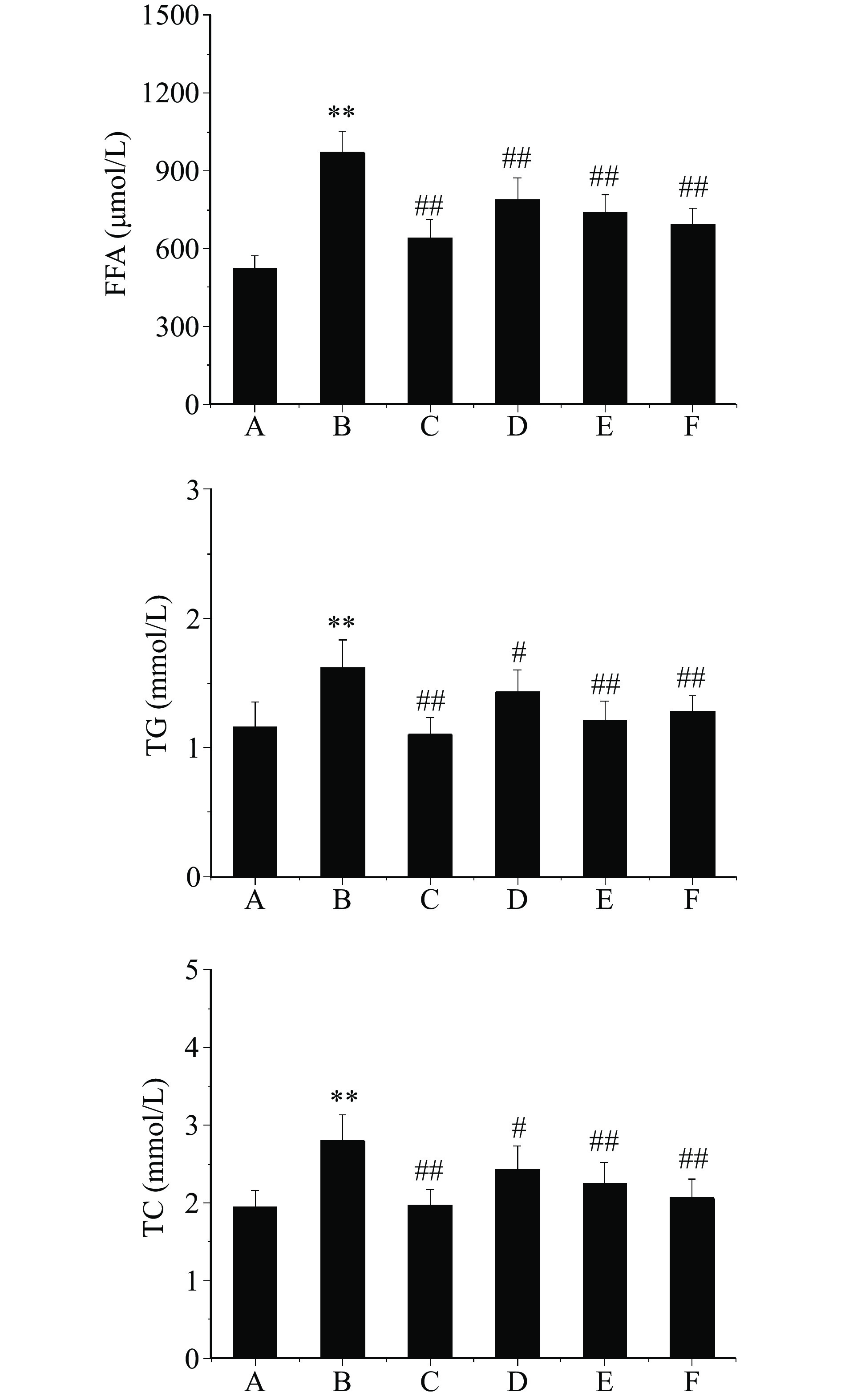
本研究结果发现,与正常对照组比较,模型对照组大鼠血清FFA、TG及TC含量均极显著升高(P<0.01);与模型对照组比较,经二甲双胍及芒果苷治疗8周后,各治疗组大鼠血清FFA、TG及TC含量均显著或极显著降低(P<0.05,P<0.01)。芒果苷对T2DM大鼠血清FFA、TG及TC含量的影响,见图2。T2DM常伴有脂代谢紊乱,被认为是一种慢性代谢性疾病[22]。FFA、TG、TC含量与脂代谢异常水平呈正相关,可以有效反映机体脂代谢紊乱的严重程度。秦帅等[23]研究发现,青钱柳可以降低自发性2型糖尿病小鼠血清FFA、TG及TC含量,进而调节脂代谢紊乱。本研究结果同样表明,芒果苷可以有效改善T2DM大鼠脂代谢紊乱。
2.5 芒果苷对T2DM大鼠肝组织GSH-Px、CAT、SOD活力及MDA含量的影响
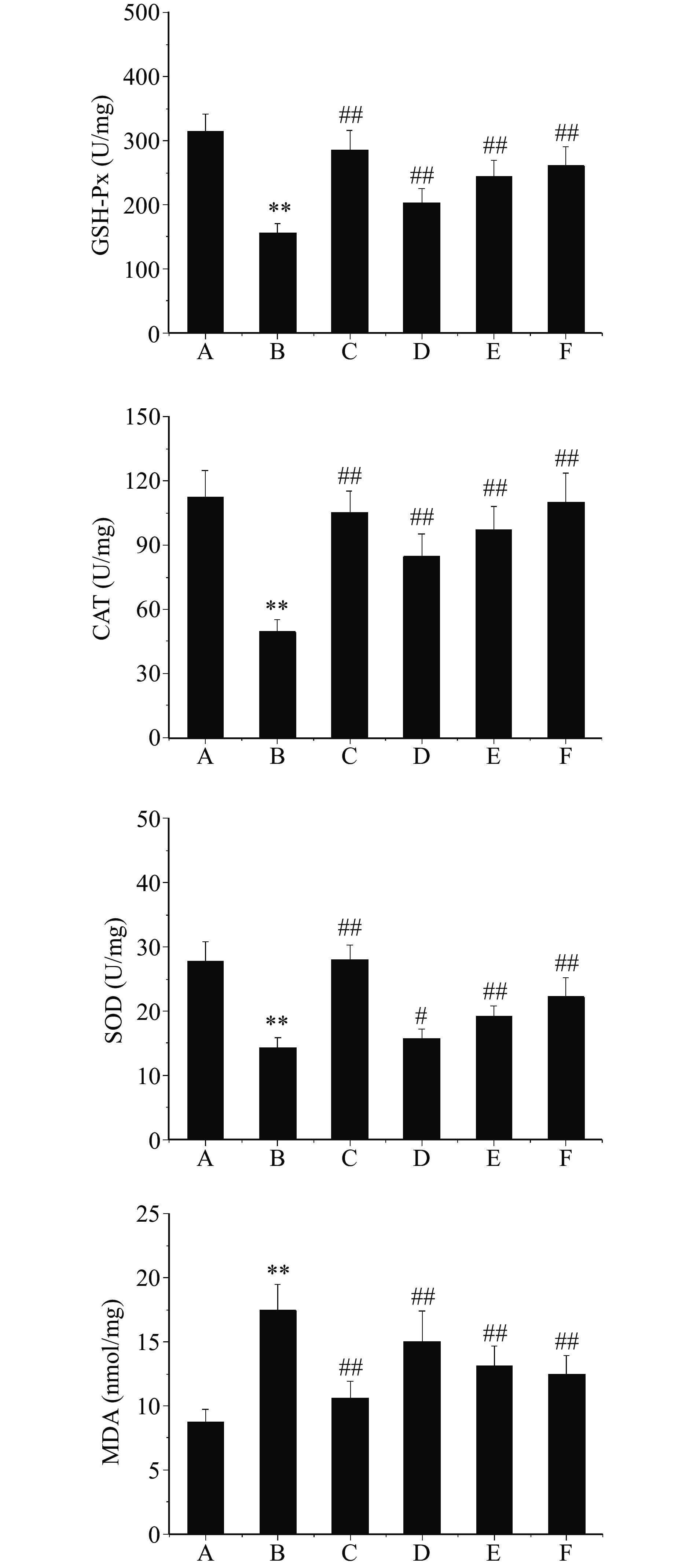
芒果苷对T2DM大鼠肝组织GSH-Px、CAT、SOD活力及MDA含量的影响,如图3所示。与正常对照组比较,模型对照组大鼠肝组织GSH-Px、CAT、SOD活力极显著降低(P<0.01),而MDA含量极显著增加(P<0.01);与模型对照组比较,二甲双胍组及芒果苷低、中、高剂量组大鼠肝组织GSH-Px、CAT、SOD活力显著或极显著增加(P<0.05,P<0.01),而MDA含量极显著降低(P<0.01),表明芒果苷改善T2DM大鼠糖脂代谢紊乱作用与抗氧化应激有关。氧化应激与T2DM引起的糖脂代谢紊乱密切相关。氧化应激可以直接造成胰岛β细胞凋亡,也可以通过多种信号分子影响胰岛素的分泌,导致胰岛素抵抗,进而发生糖脂代谢紊乱;糖脂代谢紊乱又可以增加氧的消耗,促进活性氧(reactive oxygen species,ROS)的生成,从而反向影响糖脂代谢,加重糖脂代谢紊乱程度[24]。GSH-Px、CAT及SOD是机体维持氧化抗氧化系统平衡的重要酶类,MDA为氧化应激反应的终产物,其含量高低是衡量机体氧化损伤程度的重要指标[25-26]。Al-Saeedi等[27]研究发现,芒果苷可以通过Nrf2信号通路保护内皮细胞免受脱氧雪腐镰刀菌烯醇诱导的氧化应激损伤;Zhang等[28]研究证实,芒果苷能够通过下调血管通透性和抗氧化损伤对脓毒症相关急性肺损伤和肾损伤起到治疗作用,可见芒果苷无论是在体内、还是在体外模型中均表现出了明确的抗氧化应激作用,与本研究的结果相符。
2.6 芒果苷对T2DM大鼠肝组织IRS-1、Akt及Glut4 mRNA表达的影响
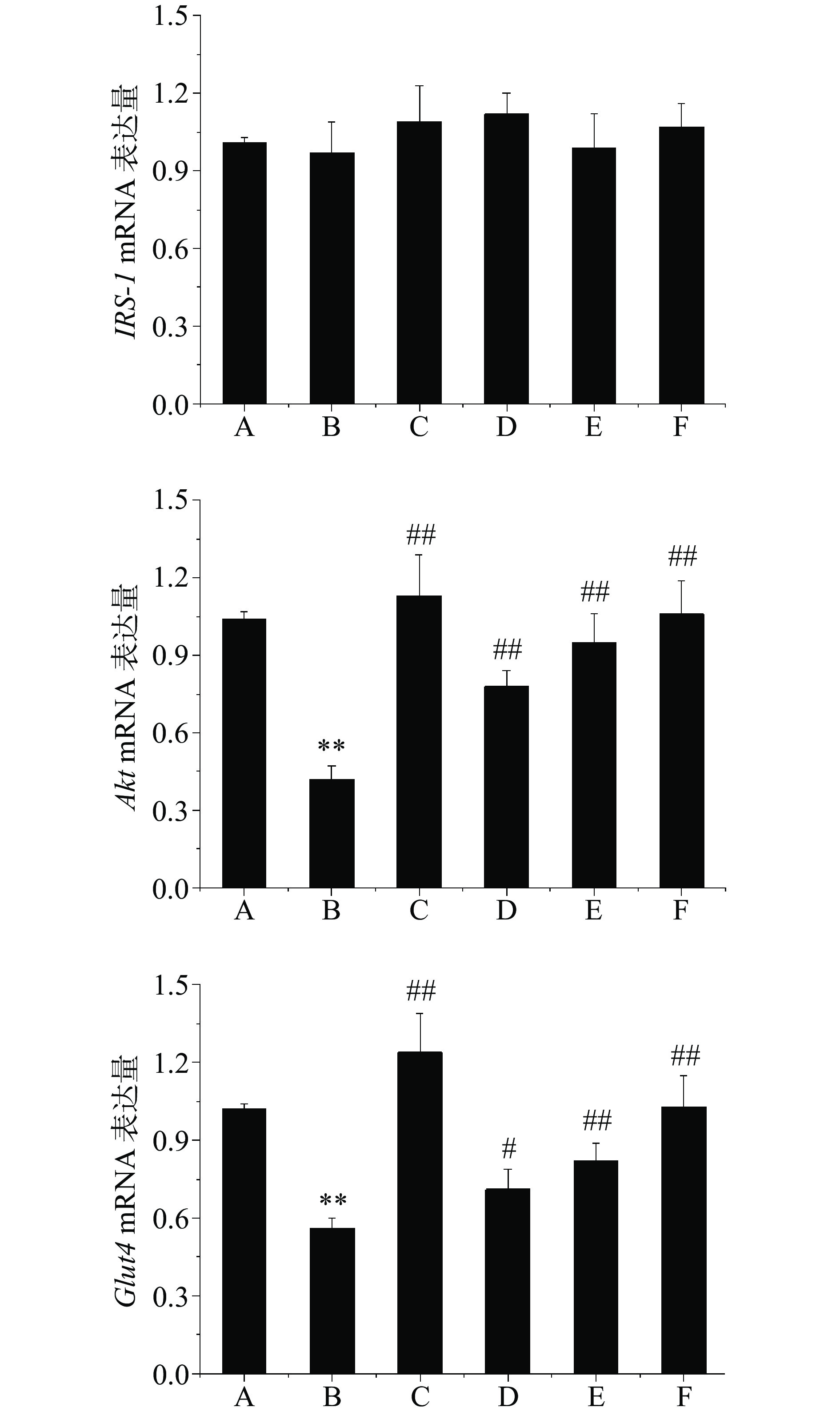
本研究采用实时定量PCR法检测了各组大鼠肝组织IRS-1、Akt及Glut4 mRNA表达量,结果如图4所示。肝组织IRS-1 mRNA表达量在各组大鼠中均无显著差异(P>0.05);模型对照组大鼠肝组织Akt及Glut4 mRNA表达量极显著低于正常对照组(P<0.01);经二甲双胍及芒果苷治疗8周后,肝组织Akt及Glut4 mRNA表达量较模型对照组显著或极显著增加(P<0.05,P<0.01),结果表明芒果苷可以在基因水平上促进Akt及Glut4 mRNA表达,但对IRS-1 mRNA表达无明显影响。
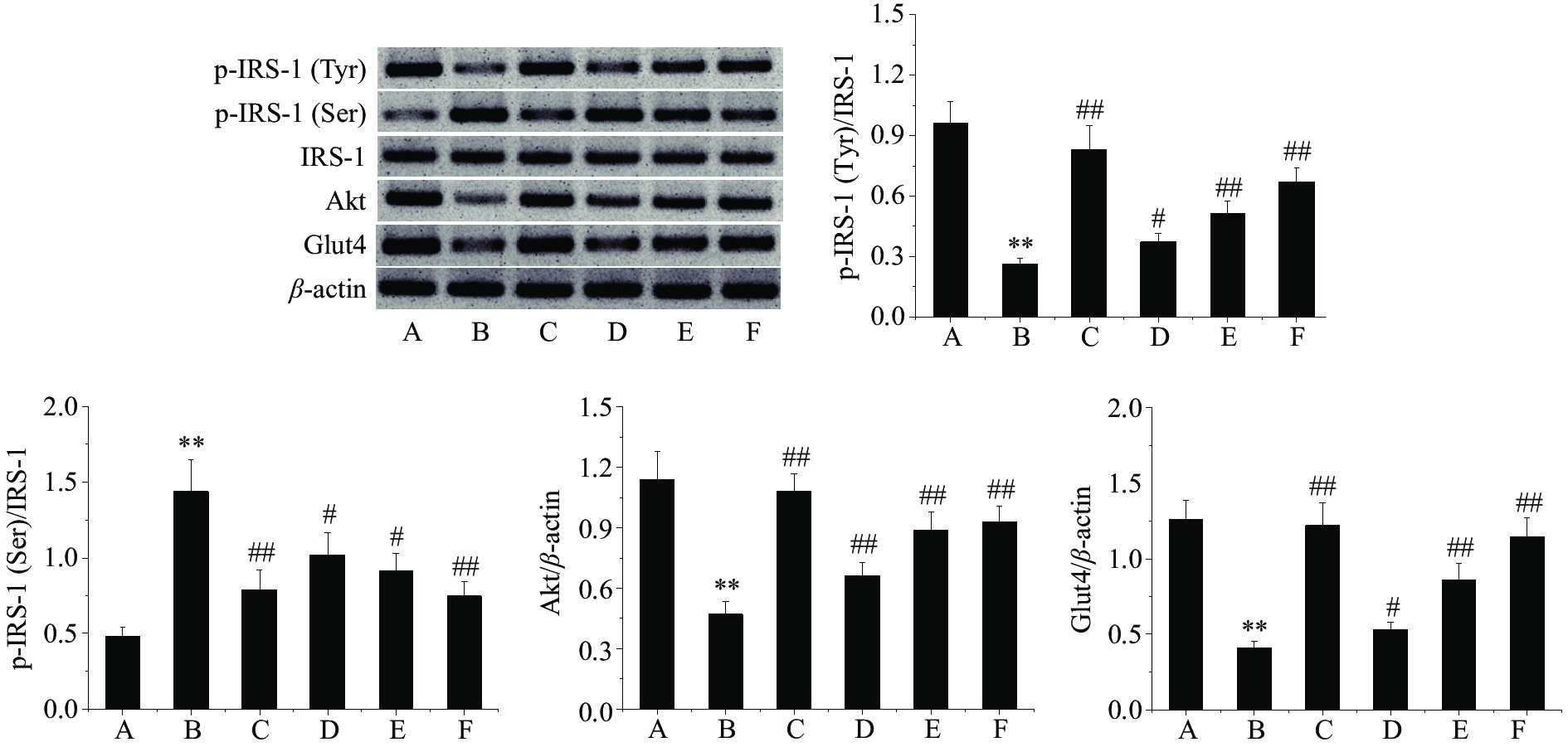
2.7 芒果苷对T2DM大鼠肝组织p-IRS-1(Tyr)、p-IRS-1(Ser)、Akt及Glut4蛋白表达的影响
采用Western blot法检测各组大鼠肝组织中p-IRS-1(Tyr)、p-IRS-1(Ser)、Akt及Glut4蛋白表达量,结果如图5所示。模型对照组大鼠肝组织p-IRS-1(Tyr)、Akt及Glut4蛋白表达极显著低于正常对照组(P<0.01),而p-IRS-1(Ser)蛋白表达极显著高于正常对照组(P<0.01);经二甲双胍及芒果苷治疗8周后,肝组织p-IRS-1(Tyr)、Akt及Glut4蛋白表达较模型对照组均显著或极显著增加(P<0.05,P<0.01),而p-IRS-1(Ser)蛋白表达显著或极显著低于模型对照组(P<0.05,P<0.01)。IRS-1/Akt/Glut4信号通路是胰岛素在肝组织中发挥生理效应的主要信号通路,任一环节出现问题均有可能引起胰岛素抵抗的发生,进而影响体内的糖脂代谢[29]。IRS-1是最先发现的胰岛素受体底物,主要分布在肝脏、脂肪等组织中,在正常生理条件下,胰岛素和其受体结合后通过IRS-1和Akt将信号传递给Glut4,使IRS-1/Akt/Glut4信号通路活化,发挥相应的生物学功能[30]。高血糖及氧化应激均可以促进IRS-1的丝氨酸磷酸化进程,抑制IRS-1的酪氨酸磷酸化进程,从而限制IRS-1与胰岛素受体的结合,减少Akt及Glut4的表达,抑制IRS-1/Akt/Glut4信号通路的激活,最终影响糖脂代谢[31]。毛蕊异黄酮可以通过降低T2DM大鼠肝组织IRS-1的丝氨酸磷酸化表达,减轻胰岛素抵抗并使糖脂代谢稳态得以恢复[32]。翻白草总黄酮也具有改善胰岛素抵抗及糖脂代谢紊乱作用,其机制与抗氧化应激及活化IRS-1/Akt/Gltu4信号通路有关[33]。本研究结果同样表明,激活IRS-1/Akt/Glut4信号通路是芒果苷发挥改善T2DM大鼠糖脂代谢紊乱作用的潜在机制。
3. 讨论与结论
在多项研究中,芒果苷均被证实具有较好的改善糖代谢及脂代谢紊乱的作用。研究发现[34],芒果苷可以降低娠期糖尿病小鼠的血糖含量,增加胰岛素敏感性,改善糖代谢紊乱,进而增加胎重及胎儿存活率。王晓波等[35]证实,芒果苷能够通过提高抗氧化酶活性、减少脂质过氧化物生成及促进糖原合成等途径,改善胰岛素抵抗性HepG2细胞的糖代谢过程。在小鼠肝脏脂质代谢紊乱模型中,芒果苷可以通过调控沉默信息调节因子-1/腺苷酸活化蛋白激酶/固醇调节元件结合蛋白-1c信号通路,降低血清TG、TC和FFA含量,改善脂代谢紊乱[36]。临床研究结果也发现,高血脂患者在连续给予芒果苷治疗12周后,TG、FFA含量明显降低,高血脂症状得到一定程度的缓解[37]。本研究选择的是经典的T2DM建模方法,高糖高脂饮食可以诱发糖脂代谢紊乱,然后通过小剂量STZ损伤胰岛β细胞功能,该法可以较好地模拟人类T2DM的发病特点,应用广泛[38]。本研究结果同样证实,给予T2DM大鼠芒果苷8周后,低、中、高剂量组的芒果苷均可以有效降低FBG、FINS含量及HOMA-IR值,同时也能使血清FFA、TG及TC含量下降,表明芒果苷具有改善T2DM大鼠糖脂代谢紊乱作用。
氧化应激可直接损伤胰岛减弱β细胞功能,加重外周组织胰岛素抵抗程度,引起糖脂代谢紊乱[39]。在大鼠骨髓间充质干细胞缺氧损伤模型中,芒果苷表现出了较强的缺氧保护作用及抗氧化能力,可以降低细胞内MDA含量,增加SOD、CAT活性[40]。芒果苷也能够降低高糖诱导的INS-1细胞ROS及MDA含量,通过抗氧化应激作用减少INS-1细胞凋亡的发生[41]。本研究结果发现,芒果苷可以增加T2DM大鼠肝组织GSH-Px、CAT、SOD活力,降低MDA含量,具有抗氧化应激作用,进而改善T2DM大鼠糖脂代谢紊乱。氧化应激也可以通过阻碍IRS-1/Akt/Glut4信号通路的活化,使胰岛素敏感性下降,诱发糖脂代谢紊乱[42]。黎梓霖等[43]发现,芒果苷可以调控胰岛素抵抗的HepG2细胞的IRS-1、Akt及Glut4 mRNA表达,进而降低细胞内葡萄糖及TG、TC含量,缓解糖脂代谢异常状态。在棕榈酸酯诱导的C2C12细胞胰岛素抵抗模型中,加入不同浓度的芒果苷处理24 h,发现Akt、Glut2和Glut4蛋白表达明显增加,随后刺激胰岛素对葡萄糖的摄取能力以降低细胞内葡萄糖含量;同时,也可以降低细胞内FFA及TG的积累,改善脂代谢[44]。本研究结果发现,T2DM大鼠经芒果苷治疗后,其在基因水平上可以促进肝组织Akt及Glut4 mRNA表达;在蛋白水平上,芒果苷可以增加肝组织p-IRS-1(Tyr)、Akt及Glut4表达,减少p-IRS-1(Ser)表达,表明芒果苷改善T2DM大鼠糖脂代谢紊乱作用与调节IRS-1/Akt/Glut4信号通路有关。
综上所述,本研究结果证实芒果苷具有改善T2DM大鼠糖脂代谢紊乱作用,并进一步发现该作用与抗氧化应激及调节IRS-1/Akt/Glut4信号通路有关。上述研究结果,可为T2DM糖脂代谢紊乱的临床治疗及相关药物的筛选提供实验依据及思路,而芒果苷改善T2DM大鼠糖脂代谢紊乱作用是否涉及其他机制还有待于课题组的深入研究。
-
表 1 PCR引物序列
Table 1 PCR primer sequence
基因名称 引物序列(5’-3’) 产物大小(bp) IRS-1 正向引物:TTCAAGGAGGTCTGGCAGGTTATC 109 反向引物:TCACAAAGCTGATGGTCTTGCTG Akt 正向引物:TTTGGGAAGGTGATTCTGGTG 152 反向引物:CGTAAGGAAGGGATGCCTAGAGTT Glut4 正向引物:CCCCATTCCCTGGTTCATT 140 反向引物:GACCCATAGCATCCGCAAC β-actin 正向引物:GCCTTCCTTCTTGGGTAT 98 反向引物:GGCATAGAGGTCTTTACGG 表 2 芒果苷对T2DM大鼠体重的影响(n=10,g)
Table 2 Effect of mangiferin on body weight in T2DM rats (n=10, g)
分组 体重 给药前 给药2周 给药4周 给药8周 正常对照组 415.78±48.59 454.52±51.62 481.39±53.14 534.69±44.78 模型对照组 371.33±32.10* 356.25±47.91** 302.89±36.98** 268.52±27.15** 二甲双胍组 362.67±34.13 381.59±34.23 351.35±42.19# 332.46±31.28## 芒果苷低剂量组 378.68±41.29 358.09±32.54 310.97±37.33 287.12±29.13 芒果苷中剂量组 363.47±40.84 357.84±43.81 332.01±38.07 303.38±36.02# 芒果苷高剂量组 369.83±33.25 366.15±45.06 337.90±25.69# 329.71±33.53## 注:与正常对照组比,*P<0.05,**P<0.01;与模型对照组比,#P<0.05,##P<0.01;表3及图1~图5同。 表 3 芒果苷对T2DM大鼠FBG含量的影响(n=10,mmol/L)
Table 3 Effect of mangiferin on FBG contents in T2DM rats (n=10, mmol/L)
分组 FBG 给药前 给药2周 给药4周 给药8周 正常对照组 5.39±0.28 5.41±0.32 5.27±0.45 5.48±0.56 模型对照组 24.25±3.31** 23.18±2.26** 24.22±3.54** 21.66±3.12** 二甲双胍组 23.62±3.17 18.09±2.11## 12.39±1.02## 7.43±0.87## 芒果苷低剂量组 24.16±2.94 22.75±2.48 20.54±2.35# 14.91±1.53## 芒果苷中剂量组 22.97±2.64 19.35±1.51## 15.61±1.79## 10.85±1.24## 芒果苷高剂量组 23.48±3.78 19.12±2.05## 14.57±1.33## 9.06±1.30## -
[1] LIMA J E B F, MOREIRA N C S, SAKAMOTO-HOJO E T. Mechanisms underlying the pathophysiology of type 2 diabetes: From risk factors to oxidative stress, metabolic dysfunction, and hyperglycemia[J]. Mutat Res Genet Toxicol Environ Mutagen,2022,874−875:503437. doi: 10.1016/j.mrgentox.2021.503437
[2] MCMEEKIN P, GEUE C, MOCEVIC E, et al. The cost of prevalent and incident cardiovascular disease in people with type 2 diabetes in Scotland: Data from the Scottish Care Information-Diabetes Collaboration[J]. Diabet Med,2020,37(11):1927−1934. doi: 10.1111/dme.14253
[3] MAYBERRY L S, BERG C A, GREEVY R A, et al. Assessing helpful and harmful family and friend involvement in adults' type 2 diabetes self-management[J]. Patient Educ Couns,2019,102(7):1380−1388. doi: 10.1016/j.pec.2019.02.027
[4] WANG S, REN H, ZHONG H, et al. Combined berberine and probiotic treatment as an effective regimen for improving postprandial hyperlipidemia in type 2 diabetes patients: A double blinded placebo controlled randomized study[J]. Gut Microbes,2022,14(1):2003176. doi: 10.1080/19490976.2021.2003176
[5] ZHANG S S, ZHANG N N, GUO S, et al. Glycosides and flavonoids from the extract of Pueraria thomsonii Benth leaf alleviate type 2 diabetes in high-fat diet plus streptozotocin-induced mice by modulating the gut microbiota[J]. Food Funct,2022,13(7):3931−3945. doi: 10.1039/D1FO04170C
[6] 杨海光, 方莲花, 杜冠华. 芒果苷的药理作用研究进展[J]. 中国药理学通报,2016,32(1):5−8. [YANG H G, FANG L H, DU G H. Research progress of pharmacological effects of mangiferin[J]. Chinese Pharmacological Bulletin,2016,32(1):5−8. doi: 10.3969/j.issn.1001-1978.2016.01.002 [7] 唐绍微, 窦茜茜, 莫金秋, 等. 芒果苷及其衍生物对糖尿病小鼠的降糖作用[J]. 医药导报,2018,37(4):441−444. [TANG S W, DOU Q Q, MO J Q, et al. Hypoglycemic effect of mangiferin and its derivates on diabetic mice[J]. Herald of Medicine,2018,37(4):441−444. [8] 林华, 牛艳芬, 李玲, 等. 芒果苷对四氧嘧啶糖尿病小鼠的降糖作用研究[J]. 天然产物研究与开发,2016,28(10):1647−1651, 1525. [LIN H, NIU Y F, LI L, et al. Hypoglycemic effects of mangiferin in alloxan-induced diabetic mice[J]. Natural Product Research and Development,2016,28(10):1647−1651, 1525. doi: 10.16333/j.1001-6880.2016.10.028 [9] 林华, 牛艳芬, 王芳, 等. 芒果苷对糖尿病小鼠糖脂代谢的影响[J]. 中药药理与临床,2012,28(6):41−44. [LIN H, NIU Y F, WANG F, et al. Effects of mangiferin on blood glucose and blood lipids metabolism in alloxan diabetic mice[J]. Pharmacology and Clinics of Chinese Materia Medica,2012,28(6):41−44. doi: 10.13412/j.cnki.zyyl.2012.06.015 [10] YANG X, ZHANG P, ZHANG F, et al. Protective effect of hypoglycemic granule against diabetes-induced liver injury by alleviating glycolipid metabolic disorder and oxidative stress[J]. J Cell Biochem,2020,121(5−6):3221−3234. doi: 10.1002/jcb.29588
[11] MIAO M, DAI Y, RUI C, et al. Dietary supplementation of inulin alleviates metabolism disorders in gestational diabetes mellitus mice via RENT/AKT/IRS/GLUT4 pathway[J]. Diabetol Metab Syndr,2021,13(1):150. doi: 10.1186/s13098-021-00768-8
[12] 胡吉蕾, 郑乐愉, 唐薇, 等. 赶黄草水提物对高脂饮食联合STZ诱导的Ⅱ型糖尿病大鼠的降血糖作用[J]. 现代食品科技,2020,36(2):25−31. [HU J L, ZHENG L Y, TANG W, et al. Hypoglycemic effects of extracts of Penthorum chinense Pursh in high fat diet and streptozotocin-induced type Ⅱ diabetic rats[J]. Modern Food Science and Technology,2020,36(2):25−31. doi: 10.13982/j.mfst.1673-9078.2020.2.005 [13] 诸夔妞, 田莎莎, 王辉, 等. 绞股蓝总皂苷调节NF-κB信号通路改善糖尿病大鼠胰岛素敏感性的实验研究[J]. 中国中药杂志,2021,46(17):4488−4496. [ZHU K N, TIAN S S, WANG H, et al. Study on effect of gypenosides on insulin sensitivity of rats with diabetes mellitus via regulating NF-κB signaling pathway[J]. China Journal of Chinese Materia Medica,2021,46(17):4488−4496. [14] 楚策, 赵燕燕, 周程艳. 芒果苷对大鼠酒精性肝炎的保护作用研究[J]. 天然产物研究与开发,2018,30(5):753−760. [CHU C, ZHAO Y Y, ZHOU C Y. Protective effect of mangiferin on alcoholic hepatitis in rats[J]. Natural Product Research and Development,2018,30(5):753−760. doi: 10.16333/j.1001-6880.2018.5.005 [15] 韩淑英, 姜妍, 王志路, 等. 荞麦花叶黄酮对2型糖尿病大鼠肝损伤及IRS-2、PI3K、NF-κB表达的影响[J]. 中国药理学通报,2013,29(11):1582−1586. [HAN S Y, JIANG Y, WANG Z L, et al. Effects of flavones of buckwheat flower and leaf on IRS-2, PI3K, NF-κB expressions and its protection on liver injury in T2DM rats[J]. Chinese Pharmacological Bulletin,2013,29(11):1582−1586. doi: 10.3969/j.issn.1001-1978.2013.11.025 [16] HSIEH P S, HO H H, TSAO S P, et al. Multi-strain probiotic supplement attenuates streptozotocin-induced type-2 diabetes by reducing inflammation and β-cell death in rats[J]. PLoS One,2021,16(6):e0251646. doi: 10.1371/journal.pone.0251646
[17] HU R, WANG M Q, NI S H, et al. Salidroside ameliorates endothelial inflammation and oxidative stress by regulating the AMPK/NF-κB/NLRP3 signaling pathway in AGEs-induced HUVECs[J]. Eur J Pharmacol,2020,867:172797. doi: 10.1016/j.ejphar.2019.172797
[18] 胡名媛, 王锋, 马永建, 等. 鱼油对KKAy糖尿病小鼠糖代谢及PI3K/Akt信号通路的影响[J]. 食品科学,2018,39(11):126−131. [HU M Y, WANG F, MA Y J, et al. Effect of fish oil on glucose metabolism and PI3K/Akt signaling pathway in diabetic KKAy mice[J]. Food Science,2018,39(11):126−131. doi: 10.7506/spkx1002-6630-201811020 [19] 雷槟恺, 李顺昌, 高德润, 等. Nrf2/HO-1通路在有氧运动干预2型糖尿病大鼠骨骼肌氧化应激中的作用[J]. 中国康复医学杂志,2022,37(3):289−295. [LEI B K, LI S C, GAO D R, et al. The role of Nrf2/HO-1 pathway in aerobic exercise intervention on oxidative stress of skeletal muscle in type 2 diabetic rats[J]. Chinese Journal of Rehabilitation Medicine,2022,37(3):289−295. doi: 10.3969/j.issn.1001-1242.2022.03.001 [20] ZHOU X, LUO M, ZHOU S, et al. Plasma alarin level and its influencing factors in obese newly diagnosed type 2 diabetes patients[J]. Diabetes Metab Syndr Obes,2021,14:379−385. doi: 10.2147/DMSO.S290072
[21] ZHENG Z G, ZHU S T, CHENG H M, et al. Discovery of a potent SCAP degrader that ameliorates HFD-induced obesity, hyperlipidemia and insulin resistance via an autophagy-independent lysosomal pathway[J]. Autophagy,2021,17(7):1592−1613. doi: 10.1080/15548627.2020.1757955
[22] WANG T, CHEN Y, LI Y, et al. TRPV1 protect against hyperglycemia and hyperlipidemia induced liver injury via OPA1 in diabetes[J]. Tohoku J Exp Med,2022,256(2):131−139. doi: 10.1620/tjem.256.131
[23] 秦帅, 秦灵灵, 吴丽丽, 等. 青钱柳对糖尿病小鼠肝脏糖脂代谢影响及机制研究[J]. 世界科学技术-中医药现代化,2020,22(10):3443−3449. [QIN S, QIN L L, WU L L, et al. Effect and mechanism of aqueous extract from Cyclocarya paliurus on glucose and lipid metabolism in the liver of diabetic mice[J]. Modernization of Traditional Chinese Medicine and Materia Medica-World Science and Technology,2020,22(10):3443−3449. [24] 姚欣卉, 李凤金, 白茹, 等. 芪黄消渴丸对2型糖尿病小鼠糖脂代谢及氧化应激的影响[J]. 中药材,2021(8):1971−1975. [YAO X H, LI F J, BAI R, et al. Effects of Qihuang Xiaoke Pill on glucose and lipid metabolism and oxidative stress in type 2 diabetic mice[J]. Journal of Chinese Medicinal Materials,2021(8):1971−1975. doi: 10.13863/j.issn1001-4454.2021.08.034 [25] 朱谋, 巩晓晨, 刘冬阳, 等. 人参皂苷Rb1对改善2型糖尿病大鼠糖脂代谢紊乱的作用[J]. 食品工业科技,2022,43(3):367−373. [ZHU M, GONG X C, LIU D Y, et al. Effect of ginsenoside Rb1 on the disorder of glucose and lipid metabolism in type 2 diabetic mice[J]. Science and Technology of Food Industry,2022,43(3):367−373. [26] 李姗姗, 田春雨, 张国伟, 等. 芍药苷对2型糖尿病模型大鼠心肌损伤的改善作用及机制研究[J]. 中国药房,2021,32(23):2846−2853. [LI S S, TIAN C Y, ZHANG G W, et al. Study on improvement effects and mechanism of paeoniflorin on myocardial injury in type 2 diabetic model rats[J]. China Pharmacy,2021,32(23):2846−2853. doi: 10.6039/j.issn.1001-0408.2021.23.06 [27] AL-SAEEDI F J. Mangiferin protect oxidative stress against deoxynivalenol induced damages through Nrf2 signalling pathways in endothelial cells[J]. Clin Exp Pharmacol Physiol,2021,48(3):389−400. doi: 10.1111/1440-1681.13432
[28] ZHANG D, HAN S, ZHOU Y, et al. Therapeutic effects of mangiferin on sepsis-associated acute lung and kidney injuries via the downregulation of vascular permeability and protection of inflammatory and oxidative damages[J]. Eur J Pharm Sci,2020,152:105400. doi: 10.1016/j.ejps.2020.105400
[29] 徐晶, 申丽媛, 屈清华. 基于PI3K/AKT通路探究柚皮素改善多囊卵巢综合征大鼠胰岛素抵抗的作用机制[J]. 天津医药,2022,50(3):270−275. [XU J, SHEN L Y, QU Q H. Study on the mechanism of naringenin improving insulin resistance in rats with polycystic ovary syndrome based on PI3K/AKT pathway[J]. Tianjin Medical Journal,2022,50(3):270−275. [30] PENG M F, TIAN S, SONG Y G, et al. Effects of total flavonoids from Eucommia ulmoides Oliv. leaves on polycystic ovary syndrome with insulin resistance model rats induced by letrozole combined with a high-fat diet[J]. J Ethnopharmacol,2021,273:113947. doi: 10.1016/j.jep.2021.113947
[31] OMOLAOYE T S, WINDVOGEL S L, PLESSIS S S. The effect of Rooibos (Aspalathus linearis), Honeybush (Cyclopia intermedia) and Sutherlandia (Lessertia frutescens) on testicular insulin signalling in streptozotocin-induced diabetes in Wistar rats[J]. Diabetes Metab Syndr Obes,2021,14:1267−1280. doi: 10.2147/DMSO.S285025
[32] 侯瑞英, 吴冬梅, 焦伟杰, 等. 毛蕊异黄酮改善2型糖尿病模型大鼠的糖脂代谢紊乱和代谢相关脂肪性肝病症状[J]. 中国病理生理杂志,2021,37(11):1965−1971. [HOU R Y, WU D M, JIAO W J, et al. Calycosin ameliorates glycolipid metabolism disorder and metabolic associated fatty liver disease symptoms in type 2 diabetic rats[J]. Chinese Journal of Pathophysiology,2021,37(11):1965−1971. doi: 10.3969/j.issn.1000-4718.2021.11.006 [33] 孔晓妮, 崔海燕, 周洪雷. 翻白草总黄酮对2型糖尿病db/db小鼠降血糖的作用机制[J]. 中国实验方剂学杂志,2021,27(3):78−84. [KONG X N, CUI H Y, ZHOU H L. Hypoglycemic effect of total flavonoids from Potentillae discoloris Herba in type 2 diabetic db/db mice[J]. Chinese Journal of Experimental Traditional Medical Formulae,2021,27(3):78−84. doi: 10.13422/j.cnki.syfjx.20210336 [34] SHA H, ZENG H, ZHAO J, et al. Mangiferin ameliorates gestational diabetes mellitus-induced placental oxidative stress, inflammation and endoplasmic reticulum stress and improves fetal outcomes in mice[J]. Eur J Pharmacol,2019,859:172522. doi: 10.1016/j.ejphar.2019.172522
[35] 王晓波, 徐英, 梁小红, 等. 芒果苷对胰岛素抵抗改善作用[J]. 中国公共卫生,2014,30(7):909−911. [WANG X B, XU Y, LIANG X H, et al. Effect of mangiferin on improvement of insulin resistance in vitro[J]. Chinese Journal of Public Health,2014,30(7):909−911. doi: 10.11847/zgggws2014-30-07-18 [36] LI J, LIU M, YU H, et al. Mangiferin improves hepatic lipid metabolism mainly through its metabolite-norathyriol by modulating SIRT-1/AMPK/SREBP-1c signaling[J]. Front Pharmacol,2018,9:201. doi: 10.3389/fphar.2018.00201
[37] NA L, ZHANG Q, JIANG S, et al. Mangiferin supplementation improves serum lipid profiles in overweight patients with hyperlipidemia: A double-blind randomized controlled trial[J]. Sci Rep,2015,5:10344. doi: 10.1038/srep10344
[38] REN Z, YANG Z, LU Y, et al. Anti-glycolipid disorder effect of epigallocatechin-3-gallate on high-fat diet and STZ-induced T2DM in mice[J]. Mol Med Rep,2020,21(6):2475−2483.
[39] LIAO J, GUO J, NIU Y, et al. Flavonoids from Lycium barbarum leaves attenuate obesity through modulating glycolipid levels, oxidative stress, and gut bacterial composition in high-fat diet-fed mice[J]. Front Nutr,2022,9:972794. doi: 10.3389/fnut.2022.972794
[40] 程建文, 赵劲民, 李晓峰, 等. 芒果苷对缺氧损伤骨髓间充质干细胞的保护作用[J]. 中国组织工程研究,2014,18(32):5091−5096. [CHEN J W, ZHAO J M, LI X F, et al. Mangiferin protects bone marrow mesenchymal stem cells against hypoxia[J]. Chinese Journal of Tissue Engineering Research,2014,18(32):5091−5096. doi: 10.3969/j.issn.2095-4344.2014.32.002 [41] 雷莉妍, 王瑞成, 唐志书, 等. 芒果苷对高糖诱导β细胞凋亡的影响及机制研究[J]. 中药材,2018,41(10):2423−2426. [LEI L Y, WANG R C, TANG Z S, et al. Effects and mechanism of mangiferin on apoptosis of pancreatic β Cells induced by high glucose[J]. Journal of Chinese Medicinal Materials,2018,41(10):2423−2426. [42] PARK J E, SON J, SEO Y, et al. HM-chromanone ameliorates hyperglycemia and dyslipidemia in type 2 diabetic mice[J]. Nutrients,2022,14(9):1951. doi: 10.3390/nu14091951
[43] 黎梓霖, 金惠杰, 方佳, 等. 芒果苷对胰岛素抵抗HepG2细胞糖脂代谢的影响[J]. 中国药房,2021,32(9):1082−1088. [LI Z L, JIN H J, FANG J, et al. Effects of mangiferin on glucose and lipid metabolism of insulin resistant HepG2 cells[J]. China Pharmacy,2021,32(9):1082−1088. doi: 10.6039/j.issn.1001-0408.2021.09.10 [44] ZHANG Q, KONG X, YUAN H, et al. Mangiferin improved palmitate-induced-insulin resistance by promoting free fatty acid metabolism in HepG2 and C2C12 cells via PPARα: Mangiferin improved insulin resistance[J]. J Diabetes Res,2019,2019:2052675.






 下载:
下载:

 下载:
下载:



