Study on the Biodegradability of Konjac Glucomannan/Curdlan Composite Aerogel
-
摘要: 本文以魔芋葡甘聚糖(KGM)和可得然胶(CUD)两种生物多聚物为基材,使用溶胶-凝胶法和真空冷冻干燥制备了不同质量比(KGM/CUD,1:0.6、1:0.9、1:1.2)的复合气凝胶。利用筛选出的四种优势菌株黑曲霉(Fen)、扩展青霉(L)、意大利青霉(B3)、芽孢杆菌(WE-3)对复合气凝胶进行降解,探究其降解形态、重量变化、微观形貌、分子变化、热稳定性及菌株生长适应性。结果表明,经不同种菌株降解后,气凝胶外观塌陷、皱缩、表面覆盖菌体;气凝胶被降解过程中可能由于KGM的强吸湿性而吸收环境中水分,促进了降解过程;降解后无新基团产生,多糖长链被降解为短链;电镜扫描图显示气凝胶多孔结构被破坏,三维网络结构坍塌;热力学分析表明气凝胶热稳定性明显降低;真菌Fen、L和B3适应于复合气凝胶环境的生长,细菌WE-3难以适应。本研究将为多糖复合材料的生物降解提供理论参考。Abstract: In this paper, konjac glucomannan (KGM) and curdlan (CUD) were used to prepare biomass aerogels with different mass ratios (KGM/CUD, K1C0.6, K1C0.9, K1C1.2) based on sol-gel and vacuum freeze-drying methods. The four dominant strains of Aspergillus niger (Fen), Penicillium expansum (L), P. italicum (B3) and Bacillus sp. (WE-3) were used to degrade the composite aerogel, and the degradation morphology, weight change, microscopic morphology, molecular change, thermal stability and strain growth adaptability were investigated. The results showed that the aerogels collapsed and shrinking with abundant thallus on the surface. During the degradation process of the aerogel, the water from the environment was absorbed by the hygroscopicity of KGM, and the degradation process would be accelerated. FTIR showed that the long chains of polysaccharides were degraded into short chains after degradation, and no new groups were produced. SEM pictures expressed that the porous structure of aerogel was destroyed and the three-dimensional network structure collapsed. DSC analysis showed that the thermal stability of aerogel significantly decreased. The fungi Fen, L and B3 were suitable for the growth of KC aerogel environment, while the bacteria WE-3 struggled to adapt. This research was expected to provide theoretical reference for the biodegradation of polysaccharide composites.
-
Keywords:
- konjac glucomannan /
- curdlan /
- polysaccharide /
- biomass aerogel /
- biodegradability
-
气凝胶(Aerogel)是一种以气相为分散介质、具有独特三维多孔结构的超轻质固体材料[1]。这种材料与其它轻质材料相比,具有超低密度、高孔隙率和高比表面积等优点,在食品包装[2]、生物医药[3]以及废水处理[4-5]等方面得到广泛使用。1931年,Kistler[6]首次采用无机氧化物通过溶胶-凝胶法和超临界萃取技术制备出了气凝胶。但由于无机气凝胶制备成本高,无机材料废弃后无法降解而造成环境污染等问题,而限制了其实际应用[7]。生物质(Biomass)是指一类来源丰富且可再生的资源和材料,包括多糖、蛋白质等生物聚合物,具有生物相容性高、安全无毒、可生物降解、易于进行化学或物理修饰等优点[8]。与一些无机气凝胶相比,生物质气凝胶具有更低的导热系数、低密度、更轻的重量,大多数可通过溶胶-凝胶技术和相分离法制备[9]。此外,生物质气凝胶因保持了生物质前体的生物活性和较好的生物相容性而使其在食品、生物医药等领域具有更加广阔的应用前景[10]。
近年来,人们对生物质气凝胶的兴趣迅速增加。Shi等[11]制备了壳聚糖基气凝胶并将其应用于药物传递。Nešić等[12]采用溶胶-凝胶和超临界萃取技术制备了具有抗菌性的果胶-TiO2纳米复合气凝胶用于食品包装。魔芋葡甘聚糖(Konjac glucomannan,KGM)作为一种植物多糖,具有良好的生相容性、易溶于水且能形成三维网状凝胶结构,是制备生物质气凝胶的理想材料[13]之一。可得然胶(Curdlan,CUD)是一种新型胞外多糖,具有由D-葡萄糖链组成的线性结构,具有良好的凝胶特性、持水性,且安全无毒,因此在食品工业中得到了广泛的应用[14]。Wang等[15]以KGM为基材加入小麦秸秆作为增强剂,所制备气凝胶的机械强度和热稳定性均得到改善。
随着生物质气凝胶的大量应用,其降解成为重要问题。生物质通常具有可生物降解性,但不同生物质材料的降解菌种、降解效果、产物形态及菌种适应性等均有待进一步研究。李静等[16]阐述了天然纤维素材料的生物降解过程尚不明确,菌群的人工调控缺乏理论依据。前人分别用黑曲霉侵蚀法和土埋法处理KGM基超强吸水材料,从降解形态和降解率方面初步解析了KGM的可生物降解性[17]。本研究以KGM和CUD制备不同质量比的魔芋葡甘聚糖/可得然胶(KC)复合气凝胶,将筛选出的优势菌株接种于气凝胶表面,通过扫描电镜、红外光谱、差式扫描量热法等手段表征气凝胶的降解产物,以期为生物质复合材料的生物降解的研究和应用提供理论依据。
1. 材料与方法
1.1 材料与仪器
魔芋葡甘聚糖 食品级,湖北强森魔芋科技有限公司;可得然胶 食品级,山东中科生物科技股份有限公司;葡萄糖和琼脂、无水磷酸氢二钾、七水硫酸镁、明胶 国药基团化学试剂有限公司;刚果红 天津市致远化学试剂有限公司。实验菌株:指状青霉Penicillium digitatum(P44)、黑曲霉Aspergillus niger(Fen)、扩展青霉P. expansum(L)、白地霉Geotrichum citri-aurantii(AY-1)、意大利青霉 P. italicum(B3)、贝莱斯芽孢杆菌Bacillus velezensis(W176)、芽孢杆菌Bacillus spp.(WE-3) 以上菌株均由华中农业大学园艺林学学院果树系采后生物学与技术实验室馈赠。
HH-2型数显恒温水浴锅 国华电器有限公司;SXJQ-1型数显调速搅拌器 西化仪科技有限公司;NL315SV-230 型真空冷冻干燥机 美国Avant公司;DSC1型差式扫描量热仪 METTLER TOLEDO;Thermo Scientific Nicolet iZ10傅里叶变换红外光谱仪 Thermo公司;JSM6390LV型扫描电镜 日本电子仪器有限公司;ME204型分析天平 上海梅特勒-托利多有限公司;HWS-250恒温培养箱 上海精宏实验设备有限公司;
1.2 实验方法
1.2.1 KC气凝胶的制备
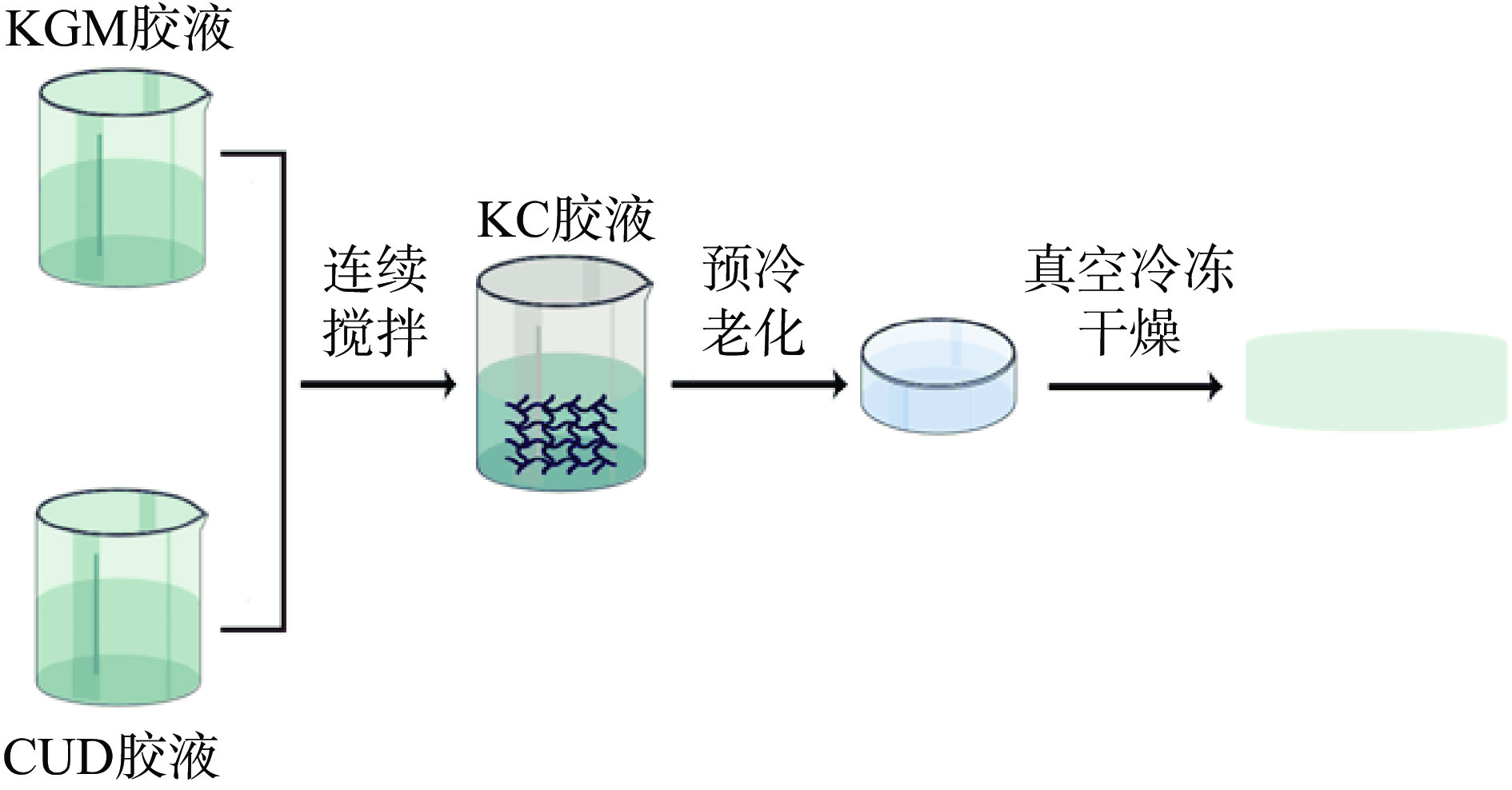
参考Wang等[18]的方法制备不同质量比(1:0.6、1:0.9、1:1.2)的KC复合气凝胶,气凝胶样品编码为K1C0.6、K1C0.9、K1C1.2。KGM胶液制备:将80 mL去离子水置于70 ℃恒温水浴锅中,待温度恒定后,在连续搅拌状态下加入一定质量的KGM,500 r/min连续搅拌1 h。CUD胶液制备:将一定质量的CUD于20 mL、25 ℃去离子水中分散30 min后,再置于60 ℃,300 r/min条件下连续搅拌30 min。随后将制备好的CUD胶液缓慢加入到70 ℃连续搅拌的KGM胶液中,900 r/min连续搅拌1 h,得到混合胶液。将混合胶液倒入模具中后,立即放入4 ℃冰箱中进行预冷冻老化处理2 h,再将其放入−25 ℃超低温冰箱中处理8 h。最后,将预冷冻后的样品置于真空冷冻干燥机内,在真空度1 Pa冷陷温度−55 ℃的条件下冷冻干燥24 h,得到KC复合气凝胶(图1)。
1.2.2 培养基的配制
马铃薯葡萄糖培养基(PDA)配制:新鲜马铃薯200 g/L、葡萄糖20 g/L、琼脂15 g/L。
刚果红培养基参考李建树等[19]的方法(略作改动)配制:磷酸氢二钾0.5 g/L、七水硫酸镁0.25 g/L、魔芋葡甘聚糖0.94 g/L、可得然胶0.94 g/L、刚果红0.3 g/L、明胶2 g/L、琼脂20 g/L,调pH7.0。
1.2.3 优势菌株的筛选
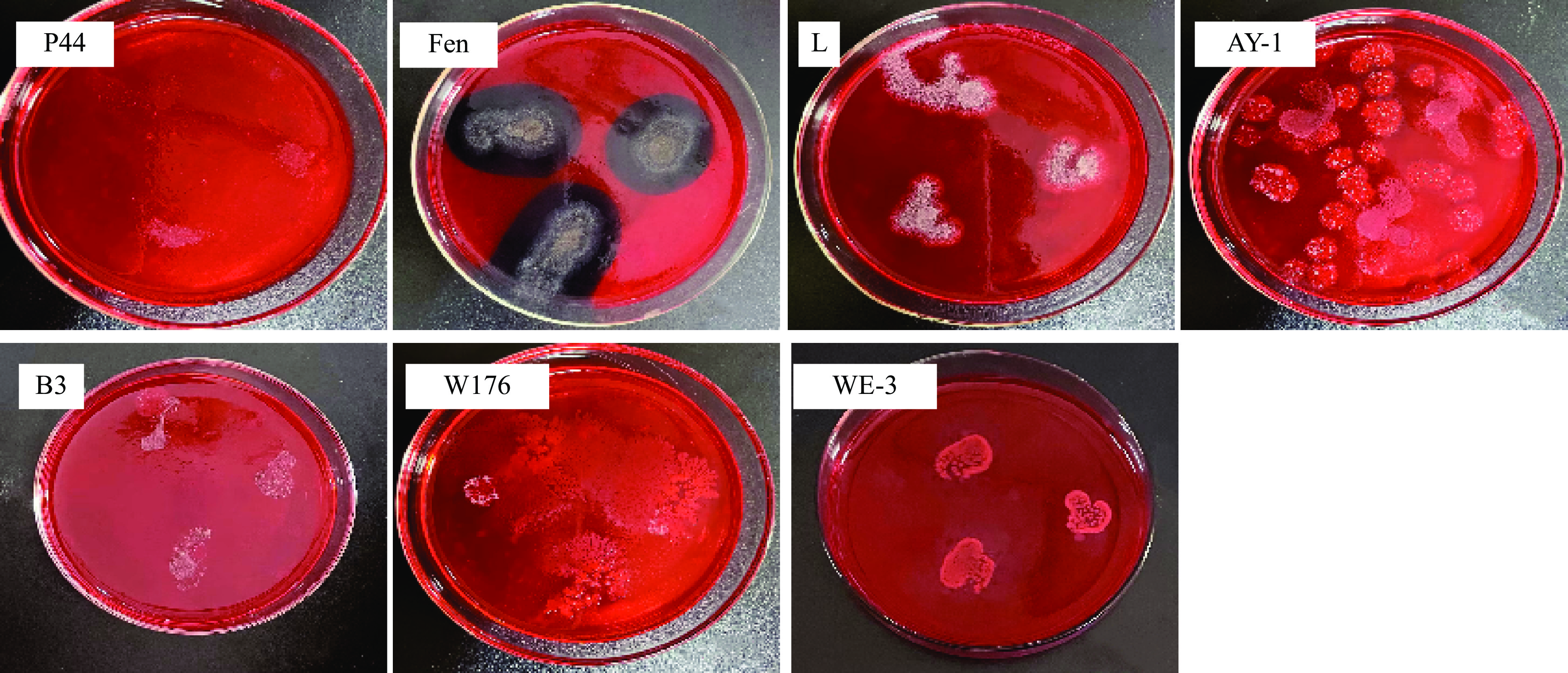
挑取活化的菌株(P44、Fen、L、AY-1、B3、W176、WE-3)分别配制106 CFU/mL的细胞悬浮液。依次点接5 μL到刚果红培养基平板上,待接种点干后封盖,25 ℃培养3 d,观察菌落生长情况。是否有菌落生长以及生长是否旺盛,代表菌株利用KGM和CUD多糖的情况,生长旺盛的菌株为初步优势菌,用于气凝胶降解实验。
1.2.4 降解效果测试
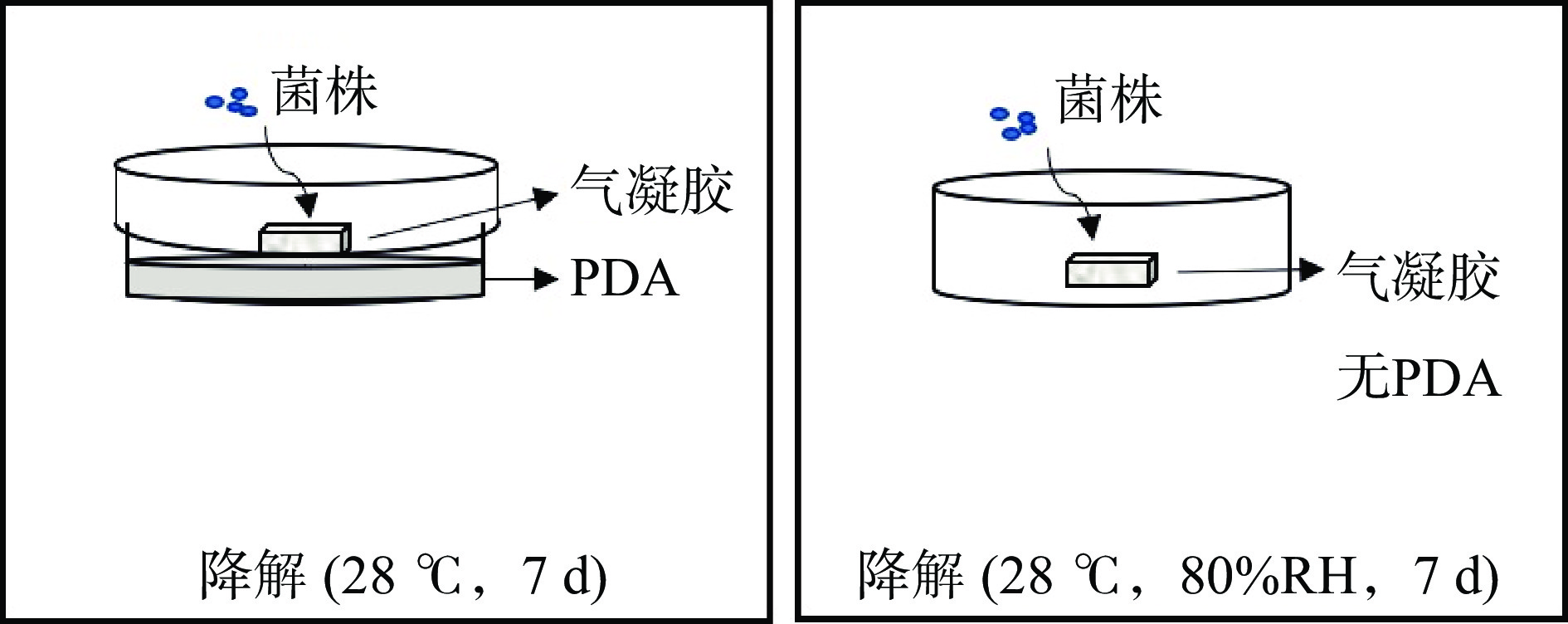
分别进行有PDA培养基和无培养基的降解实验,将切分好的气凝胶分别置于PDA平板上和无培养基的空白无菌培养皿上,挑取优势菌株接种于气凝胶表面。有培养基的处理封盖置于28 ℃培养7 d,无培养基的处理无需封盖,置于28 ℃、80%(RH)的恒温恒湿培养箱中培养7 d,记录降解情况(图2)。每个处理组重复三次。
另进行混合菌株处理气凝胶实验,采用无培养基的接种方式,先后将筛选出的优势菌株接种于同一块气凝胶,培养条件与无培养基的单一菌株处理相同。
1.2.5 降解产物表征
1.2.5.1 重量测定
称量接种前的气凝胶重量,记为m0。待培养7 d后,剥离气凝胶表面生长的菌体,称量气凝胶重量,记为m1。按下面公式计算重量变化率。每组样品测定三次平行。
1.2.5.2 微观结构观察
参考Wu等[20]的方法,将气凝胶切成5 mm×5 mm×1.5 mm大小的长方体,使用导电胶固定在样品台上,对样品台喷金后,通过扫描电子显微镜(SEM)分别在50×、100×、200×放大倍数下观察气凝胶降解前后的微观结构。降解后的气凝胶样品剥离表面菌丝后观察,每组样品重复三次。
1.2.5.3 傅里叶红外光谱(FTIR)测定
参考Satoru等[21]的方法,用傅里叶红外光谱仪记录了衰减全反射模式下气凝胶样品的红外图谱,其波数范围为4000~500 cm−1,分辨率为0.5 cm−1,降解后的气凝胶样品剥离菌丝后测定。
1.2.5.4 差示扫描量热(DSC)测定
参考杨靖等[22]的方法,切取3~5 mg的气凝胶样品,密封于铝坩埚内。在纯氮气条件下进行DSC扫描,设置温度为−25~500 ℃,升温速率10 ℃/min,氮气流量20 mL/min。以空铝坩埚作为空白对照,观察气凝胶降解前后的热稳性变化。降解后的气凝胶需要剥离表面菌丝后测定,每组样品重复三次。
1.2.6 菌株适应性
挑取气凝胶表面菌体制成玻片,光学显微镜下以50×、100×的放大倍数观察形态,以PDA培养基上生长的黑曲霉(Fen)、扩展青霉(L)、意大利青霉(B3)、芽孢杆菌(WE-3)作为对照,比较菌株在两种不同环境下的形态差异。
1.3 数据处理
采用Excel处理数据,数值部分以平均值±标准差表示,应用软件Origin 9.0制图。
2. 结果与分析
2.1 优势菌筛选及降解形态
经刚果红培养基培养3 d,Fen、L、B3的菌斑延伸正常,菌丝和产孢较旺盛,WE-3菌落扩展正常,初筛结果(图3)表明菌体在此无机物为主体的培养基上能充分利用KGM/CUD,降解获得糖分营养。P44、AY-1、W176生长力较为缓慢,不作为降解优势菌。
气凝胶在有培养基条件下降解7 d后,气凝胶表面及周围培养基上覆有大量菌体,气凝胶塌陷严重,体积骤减(图4)。表明Fen、L、B3、WE-3除了利用培养基中的营养物质外,也可能降解气凝胶中KGM和CUD多糖来获取营养。另外,KGM具有较强的亲水性,能从培养基中吸收大量水分,这也是气凝胶塌陷的原因之一[23],水分的存在有利于菌株生长,促进气凝胶的降解[24]。
无培养基的空白培养皿上进行的气凝胶降解实验如图5。观察发现,经过7 d培养,气凝胶表面覆盖大量菌体。相较于有PDA的处理,气凝胶塌陷程度较浅,但其体积发生了明显地皱缩。Fen、L、B3处理的气凝胶上有明显的相应菌落可见,WE-3处理无肉眼可见的细菌菌落,各处理因开盖培养,均被环境中灰霉寄生。表明Fen、L、B3以KGM和CUD作为营养来源,进行降解。混合菌处理的气凝胶可见Fen、L、B3菌丝和孢子,气凝胶结构塌陷,体积缩小,表明三种菌能够共生于气凝胶环境中。其中K1C0.6的体积明显减小,是因为KGM的含量相对较大,吸水能力更强[25],当样品吸收大量水分子,导致内部结构脆度降低,从而引起体积减小。曹庆龙等[26]优化了乳清分离蛋白-普鲁兰多糖复合气凝胶的性能,结果表明,普鲁兰多糖相对含量减少,气凝胶吸湿性减小。
2.2 重量变化率
无培养基下KC气凝胶的重量变化率如图6所示,所有处理组的气凝胶重量均呈现增加趋势,因为KGM具有较强的亲水性,降解过程暴露于80% RH,气凝胶不断吸收环境中的水分,导致气凝胶重量增加。其中K1C0.6增重明显大于K1C0.9和K1C1.2,体现了KGM含量高导致吸水作用更强。结合降解形态的结果可知,Fen、L、B3及混合菌株处理会引起气凝胶减重,增重现象是基于气凝胶吸收的水分和剥离后残留的菌体重量。此外,气凝胶中存在的大量水分促进了孔洞结构的破坏和孔壁多糖分子链的无序化,同时为菌株的生长提供了直接可利用的水分。
2.3 微观形貌
复合气凝胶K1C0.6、K1C0.9、K1C1.2微观结构均呈现完整连续的三维网状结构,孔结构排布整齐,三个配比的气凝胶结构未见明显差异(图7)。有序的网络结构是由于KGM和CUD多糖分子链的分子间相互作用在复合体系中有序分布所导致的[27]。气凝胶在制备过程中分别经过了预冷冻、冷冻干燥两个阶段,分布在多糖分子周围的水分子形成冰晶,在冷冻干燥阶段冰晶升华,孔隙逐渐被空气填充,三维网状结构维持原貌形成孔壁[28]。
KC气凝胶于培养基上降解7 d后如图7所示,孔结构完全消失,三维网状结构被完全破坏,Fen、L、B3处理的气凝胶表面覆有大量菌体,WE-3处理的气凝胶表面可见少量细菌,气凝胶呈皱缩状。微观形貌表明提供培养基供给菌生长使得菌株对气凝胶有非常明显的降解效果。经四种菌株处理的气凝胶与对照样品相比均出现明显的结构坍塌、外形皱缩现象。这是由于培养基提供给菌株足够的营养成分和较高的湿度环境,使得菌株生长更加旺盛。此外,当气凝胶与培养基接触时,培养基中的水分进入到气凝胶结构中,加速了气凝胶结构的坍塌,导致外形皱缩。
如图8所示为KC气凝胶在空白培养皿上完成降解实验后的扫描电镜图。气凝胶的孔结构被破坏,结构坍塌,表面覆有大量菌体。与图7相比,气凝胶存在不完整的三维网络结构,分布有被破坏的孔洞,WE-3处理组三维结构保留优于其它组。霉菌菌株及混合菌株对KC气凝胶的孔结构破坏最为严重,表明气凝胶能被霉菌菌株降解以此获取碳源营养,混合菌株表现出协同作用[29]。从电镜图片中可以看到被Fen、B3菌株处理的气凝胶样品结构破坏最严重,这与红外分析的结果相一致。据报道,芽孢杆菌具有广谱抗菌性,遂未将WE-3列为混合菌株之一[30]。作为孔壁的组成成分,KGM和CUD分子间主要以氢键相互作用,排列而成孔壁结构[31],菌株的降解作用破坏了KGM和CUD构成的三维空间网络结构。
2.4 红外光谱分析
KC复合气凝胶降解前后的红外光谱如图9所示,由于KGM和CUD之间形成了分子间氢键,未被菌株处理的气凝胶,在3331.37、3330.32、3319.75 cm−1的吸收峰代表-OH伸缩振动,2884.81、2886.49、2919.93 cm−1的吸收峰代表C-H伸缩振动,1022.92、1024.01、1023.82 cm−1的吸收峰代表C-O-C伸缩振动[32]。位于1634.98、1635.01、1634.58 cm−1处的吸收峰是由于O-H弯曲引起的,这是由于气凝胶中的水没有完全去除[33]。被菌株降解后的KC气凝胶样品中-OH的特征峰相比于未被降解的复合气凝胶样品,波数向低波数移动,波长变大。可能是环境中的水分子与KGM和CUD大分子发生的相互作用,氢键相互作用得以增强所致[18]。此外,降解后的复合气凝胶样品中C-H的特征吸收峰均在2880~2930 cm−1,相比于未被降解的复合气凝胶样品,吸收峰波数并未发生显著改变。经B3和混合菌株处理后的气凝胶样品与对照样品相比,C-O-C特征峰向高波数处移动,表明多糖链被降解有更多C-O-C官能团产生[34]。这为B3菌株和混合菌株对KC复合气凝胶的降解效果提供了证据。由于菌株在生长过程中产出的多种酶可将多糖长链酶解成短链[35],但末端没有出现新的基团,因此未出现新的特征峰。
混合菌株处理的气凝胶样品,降解后的红外图谱中羟基的特征峰位于3281.33、3274.40、3273.57 cm−1,向低波数移动。可能是降解过程中,所吸收的水分与KGM和CUD发生了相互作用,增强了氢键相互作用。而降解后的气凝胶样品中C-H的特征吸收峰在2924.50、2925.77、2924.03 cm−1,向高波数移动,可能是甲基作用增强所导致的[36]。
2.5 热稳定性分析
如图10所示,未经处理的K1C0.6、K1C0.9、K1C1.2气凝胶分别在71.91、75.88、72.38 ℃存在吸热峰,这一现象主要是由于气凝胶的网络结构以及气凝胶中残留的少量水分蒸发导致的[37]。在305.85、306.79、303.4 ℃产生的放热峰归因于复合气凝胶中KGM和CUD分子的热分解,在285.46、286.59、282.55 ℃分别出现了吸热峰,可能是由于KGM和CUD分子的吸热熔融[38]。分别被WE-3、B3、L、Fen降解后的复合气凝胶样品均出现了由于水分蒸发而产生的吸热峰,并且均在300 ℃左右出现了放热峰。经B3菌株处理的气凝胶样品出现第一个放热峰的温度低于对照组和其他三个处理组。这与电镜扫描和红外分析所表现出的结果相一致,被B3菌株处理的气凝胶结构破坏更严重。第二个放热峰均向低温度方向移动,可能因为WE-3、B3菌株破坏了气凝胶的网络结构,使其氢键相互作用转变导致放热峰值降低。此外,气凝胶被降解,多糖链断裂,产生分子量更小的多糖链。而被L、Fen菌株处理的气凝胶样品中只有K1C0.9的放热峰向低温度方向移动,这可能是KGM与CUD两种多糖比例不同所致。
经混合菌株降解后的气凝胶同样存在由于水分蒸发而导致的吸热峰,并且在273.27、283.29、294.98 ℃出现了放热峰。该放热峰明显向低温度方向移动,这与单一菌株处理的气凝胶所表现的结果相似,体现了混合菌株的协同降解作用。
2.6 生长适应性
为探究降解菌株在KC气凝胶上的生长适应性,以光学显微镜观察四种菌株在气凝胶上生长后细胞的形态是否有异常。如图11所示,在PDA培养基上正常生长的菌株作为对照组(CK),在气凝胶上生长7 d后的菌株形态与CK组无明显差异,菌株产孢丰富,分身孢子形态饱满。但WE-3处理组未观察到明显的芽孢杆菌形态,主要为来自环境中的灰霉B,进一步表明WE-3难以适应无培养基的KC气凝胶上的生长。B3、L、Fen均能够适应KC气凝胶这一环境,且形态不受影响。
在28 ℃,80% RH的条件下,KGM为KC气凝胶吸收空气中的水分,引起结构塌陷;菌株在生长过程中利用气凝胶中的水分,并吸收空气中的水和氧气,同时分泌糖苷水解酶[39]、果胶酶[40]、β-葡聚糖酶[41]等酶类物质将KGM和CUD中的多糖链酶解成短链,从而获得满足自身生长的营养,起到生物降解作用。
3. 结论
本文以扩展青霉(L)、意大利青霉(B3)、黑曲霉(Fen)、芽孢杆菌(WE-3)及混合菌株用于魔芋葡甘聚糖/可得然胶复合气凝胶(KC)降解,气凝胶均发生结构塌陷、皱缩,孔结构被破坏,表面着生大量菌体,WE-3难以适应此环境,以Fen、L、B3寄生降解能力为佳,混合菌株表现出协同降解作用。Fen、L、B3在KC气凝胶的降解过程中表现出生长适应性,形态与培养基上的生长无明显差异。红外结果揭示多糖长链被酶解成短链,氢键相互作用增强,无新基团出现。DSC表明降解后的气凝胶热稳定性下降。本研究将为多糖复合材料的降解提供可参考的优势菌株和理论依据。生物质材料具有可降解性,然而降解菌株的筛选优化、降解机制以及降解产物有待深入研究。
-
-
[1] ZHI D D, LI T, LI J Z, et al. A review of three-dimensional graphene-based aerogels: Synthesis, structure and application for microwave absorption[J]. Composites Part B,2021,211:108642. doi: 10.1016/j.compositesb.2021.108642
[2] DE OLIVEIRA J P, BRUNI G P, EL HALAL S L M, et al. Cellulose nanocrystals from rice and oat husks and their application in aerogels for food packaging[J]. International Journal of Biological Macromolecules,2018,124:175−184.
[3] VERONOVSKI A, TKALEC G, KNEZ Ž, et al. Characterization of biodegradable pectin aerogels and their potential use as drug carriers[J]. Carbohydrate Polymers,2014,113:272−278. doi: 10.1016/j.carbpol.2014.06.054
[4] YI L F, YANG J Y, FANG X, et al. Facile fabrication of wood-inspired aerogel from chitosan for efficient removal of oil from water[J]. Journal of Hazardous Materials,2020,385(C):121507.
[5] MOHAMMAD P, RAFFAELE M. Protein nanofibrils for next generation sustainable water purification[J]. Nature Communications,2021,12(1):3248. doi: 10.1038/s41467-021-23388-2
[6] KISTLER S S. Coherent expanded aerogels and jellies[J]. Nature,1931,127(3211):741.
[7] WEI G, ZHANG J M, USUELLI M, et al. Biomass vs inorganic and plastic-based aerogels: Structural design, functional tailoring, resource-efficient applications and sustainability analysis[J]. Progress in Materials Science,2021,125:100915.
[8] WANG Z H, SHEN D K, WU C F, et al. State-of-the-art on the production and application of carbon nanomaterials from biomass[J]. Green Chemistry,2018,20(22):5031−5057. doi: 10.1039/C8GC01748D
[9] LIU Q Z, YAN K, CHEN J H, et al. Recent advances in novel aerogels through the hybrid aggregation of inorganic nanomaterials and polymeric fibers for thermal insulation[J]. Aggregate,2021,2(2):e30.
[10] GARCÍA-GONZÁLEZ C A, ALNAIEF M, SMIRNOVA I. Polysaccharide-based aerogels-promising biodegradable carriers for drug delivery systems[J]. Carbohydrate Polymers,2011,86(4):1425−1438. doi: 10.1016/j.carbpol.2011.06.066
[11] SHI W, YERN C C, CHENG H C. Synthesis of chitosan aerogels as promising carriers for drug delivery: A review[J]. Carbohydrate Polymers,2020,231(10):115744.
[12] NEŠIĆ A, GORDIĆ M, DAVIDOVIĆ S, et al. Pectin-based nanocomposite aerogels for potential insulated food packaging application[J]. Carbohydrate Polymers,2018,195(4):128−135.
[13] 孙小华, 周丹, 柯炜昌, 等. 植物多糖干凝胶的制备及其力学性能[J]. 功能高分子学报,2012,25(2):195−201. [SUN Xiaohua, ZHOU Dan, KE Weichang, et al. Preparation and mechanical properties of polysaccharide cryogel[J]. Journal of Functional Polymers,2012,25(2):195−201. [14] ZHANG R R, EDGAR K J. Properties, chemistry, and applications of the bioactive polysaccharide curdlan[J]. Biomacromolecules,2014,15(4):1079−1096. doi: 10.1021/bm500038g
[15] WANG Y X, WU K, XIAO M, et al. Thermal conductivity, structure and mechanical properties of konjac glucomannan/starch based aerogel strengthened by wheat straw[J]. Carbohydrate Polymers,2018,197:284−291. doi: 10.1016/j.carbpol.2018.06.009
[16] 李静, 李明源, 王继莲, 等. 纤维素的微生物降解研究进展[J]. 食品工业科技,2022,43(9):396−403. [LI Jing, LI Mingyuan, WANG Jilian, et al. Research progress on microbial degradation of cellulose[J]. Science and Technology of Food Industry,2022,43(9):396−403. [17] 姜发堂. 高吸水性葡甘聚糖接枝共聚物的制备及其性能研究[D]. 武汉: 华中农业大学, 2007 JIANG Fatang. Preparation and characterization of the superabsorbent polymer from konjac glucomannan[D]. Wuan: Huazhong Agricultural University, 2007.
[18] WANG W L, FANG Y, NI X W, et al. Fabrication and characterization of a novel konjac glucomannan-based air filtration aerogels strengthened by wheat straw and okara[J]. Carbohydrate Polymers,2019,224(C):115129.
[19] 李建树, 孙丽坤, 韩向敏, 等. 高温纤维素降解微生物的筛选、鉴定及其酶活力测定[J]. 甘肃农业大学学报,2020,55(3):29−37. [LI Jianshu, SUN Likun, HAN Xiangmin, et al. Screening, identification and enzyme activity determination of high temperature cellulose degrading microorganism[J]. Journal of Gansu Agricultural University,2020,55(3):29−37. [20] WU K, FANG Y, WU H X, et al. Improving konjac glucomannan-based aerogels filtration properties by combining aerogel pieces in series with different pore size distributions[J]. International Journal of Biological Macromolecules,2020,166:1499−1507.
[21] SATORU T, ARATA K, YOSHIHIRO T, et al. Aldehyde approach to hydrophobic modification of chitosan aerogels[J]. Biomacromolecules,2017,18(7):2172−2178. doi: 10.1021/acs.biomac.7b00562
[22] 杨靖, 陈杰. 甲基修饰二氧化硅气凝胶的红外光谱和热分析研究[J]. 西安交通大学学报,2009,43(1):114−118. [YANG Jing, CHEN Jie. Fourier transform infrared spectroscopy and thermal analysis of silica aerogel modified by methyl groups[J]. Journal of Xi′an Jiaotong University,2009,43(1):114−118. doi: 10.3321/j.issn:0253-987X.2009.01.025 [23] 曹庆龙, 雷桥, 吴浩, 等. 影响普鲁兰多糖气凝胶性能的工艺参数[J]. 食品与发酵工业,2020,46(23):108−115. [CAO Qinglong, LEI Qiao, WU Hao, et al. Effect of process parameters on pullulan aerogel properties[J]. Food and Fermentation Industries,2020,46(23):108−115. [24] 侯海峰, 李群伟, 李晓梅. 温度和湿度对黄绿青霉菌生长和产毒的影响[J]. 中国地方病防治杂志,2010,25(2):104−106. [HOU Haifeng, LI Qunwei, LI Xiaomei. Effect of temperature and water activity on growth and toxin production of Penicillium citreoviride[J]. Chinese Journal of Control Endemic Disease,2010,25(2):104−106. [25] MOMTAZ M, CHEN J. High-performance colorimetric humidity sensors based on konjac glucomannan[J]. ACS Applied Materials & Interfaces,2020,12(48):54104−54116.
[26] 曹庆龙, 雷桥, 吴浩, 等. 乳清分离蛋白-普鲁兰多糖复合气凝胶的制备及性能优化[J]. 食品与发酵工业,2021,47(16):181−187. [CAO Qinglong, LEI Qiao, WU Hao, et al. Preparation and performance optimization of whey protein isolate pullulan composite aerogel[J]. Food and Fermentation Industries,2021,47(16):181−187. [27] 刘璐, 庞杰. 魔芋葡甘聚糖复合凝胶网络结构的研究进展[J]. 粮油食品科技,2021,29(2):129−134. [LIU Lu, PANG Jie. Research progress on material and composite structure of konjac glucomannan composite gel[J]. Science and Technology of Cereals, Oils and Foods,2021,29(2):129−134. [28] 周丹, 柯炜昌, 陈义坤, 等. 魔芋葡甘聚糖基干凝胶的制备与性能表征[J]. 功能材料,2013,44(S1):161−165. [ZHOU Dan, KE Weichang, CHEN Yikun, et al. Preparation and characterization of konjac glucomannan based dry gel[J]. Functional Materials,2013,44(S1):161−165. [29] KACMAREK S B, SIONKOWSKA M M, MAZUR O, et al. The role of microorganisms in biodegradation of chitosan/tannic acid materials[J]. International Journal of Biological Macromolecules,2021,184:584−592. doi: 10.1016/j.ijbiomac.2021.06.133
[30] CHEN K, TIAN Z H, HE H, et al. Bacillus species as potential biocontrol agents against citrus diseases[J]. Biological Control,2020,151:104419. doi: 10.1016/j.biocontrol.2020.104419
[31] 蒋明峰, 肖满, 倪学文, 等. 魔芋葡甘聚糖与可得然胶的相互作用[J]. 食品科学,2016,37(19):54−58. [JIANG Mingfeng, XIAO Man, NI Xuewen, et al. Interactions between konjac glucomannan and curdlan[J]. Food Science,2016,37(19):54−58. doi: 10.7506/spkx1002-6630-201619009 [32] CHEN Y L, SONG C Z, LÜ Y K, et al. Konjac glucomannan/kappa carrageenan interpenetrating network hydrogels with enhanced mechanical strength and excellent self-healing capability[J]. Polymer,2019,184(C):121913.
[33] 吴佳煜, 杨丹, 龚静妮, 等. 魔芋葡甘聚糖/κ-卡拉胶复合凝胶制备条件的优化[J]. 食品工业科技,2018,39(15):171−175, 188. [WU Jiayu, YANG Dan, GONG Jingni, et al. Optimization of preparation conditions of konjac glucomannan/κ-carrageenan composite gel[J]. Science and Technology of Food Industry,2018,39(15):171−175, 188. [34] 魏晓晓, 崔芃, 王大海, 等. 红外光谱法快速鉴别可降解一次性塑料制品[J]. 分析仪器,2022,36(1):36−41. [WEI Xiaoxiao, CUI Fan, WANG Dahai, et al. Rapid detection of composition of biodegradable plastic products by infrared spectroscopy[J]. Analytical Instrumentation,2022,36(1):36−41. [35] 吴迪, 王旭升, 于特, 等. β-葡聚糖酶降解黑木耳多糖工艺研究[J]. 食品研究与开发,2022,43(6):130−135. [WU Di, WANG Xusheng, YU Te, et al. Optimization of β-glucanase degradation of Auricularia auricula polysaccharides[J]. Food Research and Development,2022,43(6):130−135. [36] 沈鸿强, 尹屹梅, 张洪斌. 甲基纤维素(MC)疏水作用的电化学研究[J]. 化学学报,2005,63(17):1621−1625, 1550. [SHEN Hongqiang, YIN Qimei, ZHANG Hongbin. An electrochemical study of the hydrophobic interaction of methylcellulose[J]. Acta Chimica Sinica,2005,63(17):1621−1625, 1550. doi: 10.3321/j.issn:0567-7351.2005.17.013 [37] FANG Y, WANG W L, QIAN H, et al. Regular film property changes of konjac glucomannan/mung bean starch blend films[J]. Starch-Stä rke,2020,72(5-6):1900149.
[38] 王唯, 王浩, 匡映, 等. 魔芋葡甘聚糖-明胶-淀粉气凝胶过滤材料的结构与性能研究[J]. 食品工业科技,2021,42(15):48−55. [WANG Wei, WANG Hao, KUANG Ying, et al. Study on structure and properties of konjac glucomannan-gelatin-starch aerogels as filtration materials[J]. Science and Technology of Food Industry,2021,42(15):48−55. [39] 胡紫微, 李至敏, 张梦洁, 等. 指状青霉草酰乙酸水解酶的结构特征与原核表达分析[J]. 江西农业学报,2021,33(5):31−37. [HU Ziwei, LI Zhimin, ZHANG Mengjie, et al. Analysis of structural characteristics and prokaryotic expression of oxaloacetate hydrolase from Penicillium digitatum[J]. Acta Agriculturae Jiangxi,2021,33(5):31−37. [40] 钱鑫. 指状青霉侵染采后柑橘的机制研究[D]. 镇江: 江苏大学, 2020 QIAN Xin. Study on the mechanism of Penicillium digitatum infecting postharvest citrus[D]. Zhenjiang: Jiangsu University, 2020.
[41] 吴鹏, 姜坤, 刘丽, 等. 黑曲霉HS-5高产β-葡聚糖酶培养基配方的优化[J]. 中国酿造,2016,35(8):83−86. [WU Peng, JIANG Kun, LIU Li, et al. Optimization of medium formula for β-glucanase producing Aspergillus niger[J]. China Brewing,2016,35(8):83−86. -
期刊类型引用(2)
1. 安容慧,陈兴开,常子安,任紫烟,张婕,连欢,贾连文,杨相政. 采后不同时间压差预冷对水蜜桃货架品质和香气成分的影响. 食品工业科技. 2024(09): 317-324 .  本站查看
本站查看
2. 隋海涛,陈东杰,王凤丽,邹泽宇,郭风军,马倩倩,隋青,张长峰,孙崇德. 桃果实采后品质变化机制及调控技术研究进展. 中国果菜. 2024(12): 1-8+19 .  百度学术
百度学术
其他类型引用(2)





 下载:
下载:









 下载:
下载:



