Enzyme Catalytic Synthesis of Phosphatidylserine in Aqueous Phase through Immobilization of Phosphatidylcholine
-
摘要: 本文构建了一种固定化底物磷脂酰胆碱(phosphatidylcholine,PC)水相催化体系,磷脂酶D转化PC合成磷脂酰丝氨酸(phosphatidylserine,PS)新技术。探讨了沉淀剂种类、载体类型和底物初始添加量等主要因素,对固定化底物PC过程中PC吸附率的影响,获得了最佳工艺参数。在此基础上,进一步研究了固定化底物PC酶法合成PS的时间反应动力学和酶重复利用特性。结果表明,催化反应24 h后,PS得率为98.74%,磷脂酶D重复使用10次,PS得率仍然大于60%。文章还比较了固定化底物水相催化体系和双液相催化体系酶法合成PS效果,结果发现,固定化底物水相催化体系中PS得率和酶循环利用特性均优于双液相催化体系。本文研究结果为今后酶法改性PC合成PS提供了一种新的催化反应体系。
-
关键词:
- 磷脂酰胆碱(PC) /
- 磷脂酰丝氨酸(PS) /
- 酶法改性 /
- 固定化底物 /
- 双液相催化体系
Abstract: This work reported a novel technology on bioconversion of phosphatidylcholine (PC) into phosphatidylserine (PS) by phospholipase D (PLD) in an aqueous phase catalytic system through immobilization of substrate phosphatidylcholine (PC). The major factors affecting PC adsorption efficiency were investigated to obtain the optimal parameters, such as the kinds of precipitant reagents, carrier types, and substrate loading concentration. Furthermore, the time kinetics of PS catalytic synthesis by PLD through immobilization of substrate PC and the recycling utilization of enzyme PLD were also examined. Results showed that the yield of PS achieved 98.74% after 24 h reaction, and PLD had an excellent recycling utilization. When it was reused for 10 batches, PLD could still yield more than 60% of PS. In the end, the efficiency of PS catalytic synthesis by PLD was also compared between through immobilization of substrate PC and in two-liquid phase system. It was found that higher yield of PS and more excellent stability of PLD were achieved through immobilization of substrate PC than in two-liquid phase system. These findings would provide a novel catalytic system for PC bioconversion into PS in the future. -
磷脂酰丝氨酸(Phosphatidylserine,PS)是一种天然稀有磷脂,具有较强的生理活性[1]。研究表明,PS能修复大脑细胞损伤和提高记忆力功能,被誉为“大脑维生素”[1]。此外,PS还能预防老年痴呆[2],缓解抑郁症和治疗阿尔兹海默症[3-6]。目前,合成PS方法主要包括:溶剂提取法、化学合成法和生物酶转化法[7-9]。相较而言,生物酶法由于工艺绿色、副产物少等突出优势,成为PS合成的主要技术发展方向。文献大多报道采用磷脂酶D(Phospholipase D,PLD)催化磷脂酰胆碱(Phosphatidylcholine,PC)和L-丝氨酸,通过磷脂酰基转移反应,生成PS[10]。Adlercreutz等[11]以蛋黄PC为原料,利用磷脂酶D和脂肪酶的协同催化,将癸酸引入sn-1位,己酸引入sn-2位,成功合成了纯度大于99%、水溶性好的混酸磷脂酰胆碱。夏禹等[7]报道了磷脂酶D在双液相催化体系下,PLD酶法改性蛋黄PC,合成PS,产率74.8%。毛淑红等[12]报道了PLD水相催化PC,合成PS,最大产率为42.6%。然而,丝氨酸和磷脂酶D可溶于水相,而PC是脂溶性物质,可溶于有机溶剂相。经预实验发现,由于PC是两亲物质,与水混合在搅拌条件下,易形成乳化液,不利于油/水界面催化,此时PLD酶催化PC制备PS效率极低。因此,为了提高PS产率,常采用有机溶剂/水双相催化体系,进行酶促反应合成目标产物[13]。对于双液相催化体系而言,一方面,有机溶剂很容易毒害PLD,导致酶活力下降;另一方面容易发生副反应产生磷脂酸(Phosphatidic acid,PA),降低PS产率。为了解决上述有机溶剂体系中酶失活的问题。2019年,Li等[14]报道了在纯水溶液体系中,PLD介导的磷脂酰化反应,以预先吸附PC的载体作为“人工界面”,代替液体−液体体系。结果表明,PLD连续使用6批,PS产率仍达73.6%,这是迄今为止,最早报道的水相中游离酶在固/液界面催化生成PS,显示了潜在的工业化应用前景。
受上述工作启发,本文以河北美业斯维生物技术有限公司提供的粗蛋黄PC为研究对象,经TLC分离纯化、HPLC含量分析,样品PC纯度达98%。以纯化后蛋黄PC为原料,构建固定化底物PC,实现水相PLD催化合成PS新技术。因此,本文研究目的就是开发一种固定化底物PC,实现PLD水相催化制备PS。区别于文献报道的固定化PLD催化PC制备PS,本文创新之处在于,提出水相体系酶促反应制备PS,过程绿色环保、不使用有机溶剂,无需固定化PLD,经简单离心即可实现PLD分离和循环利用。本文主要研究内容包括;首先,采用沉淀吸附法,将PC固定在载体表面,重点探讨沉淀剂种类、载体类型和底物初始加入量对PC吸附率的影响。然后,加入PLD催化剂和L-丝氨酸,实现水相酶催化PC合成PS,研究酶促反应时间动力学和PLD重复利用特性。最后,初步比较了固定化底物PC水相催化体系和双液相催化体系中,PLD酶法合成PS效果。研究成果以期为固定化底物PC水相酶催化合成PS提供新方法和技术支撑。
1. 材料与方法
1.1 材料与仪器
蛋黄PC原料 由河北美业斯维生物技术有限公司提供,纯度为98%;乙醇、乙酸乙酯、丙酮、醋酸、醋酸钠等化学试剂均为分析纯 购于北京化工厂;硅胶 购于青岛海洋化工有限公司;苯(AR)、氧化铝、二氧化硅、活性炭、L-丝氨酸(AR)、异丙醇(HPLC级)、三乙胺(HPLC级)等 均购于上海阿拉丁试剂有限公司;大孔树脂 购于北京索莱宝科技有限公司;乙酸(HPLC级) 购于西陇化工股份有限公司;正己烷(HPLC级) 购于北京迈瑞达科技有限公司;微晶纤维素、PC标准品、PS标准品、磷脂酶D(≥50000 U/mL)等 均购于美国Sigma公司;甲醇(HPLC级) 购于美国Fisher公司;有机系微孔滤头(0.45 µm)、一次性无菌注射器(1 mL) 购于天津津腾实验设备有限公司。
SU 1510冷场发射扫描电镜(SEM) 日本株式会社日立公司;Alltech 1500型高效液相色谱仪配蒸发光检测器(HPLC-ELSD) 美国Alltech公司;AL204型分析天平 瑞士Mettler Toledota公司;3K15型冷冻离心机 美国Sigma公司;C-MAG型磁力搅拌器 德国IKA公司;KQ-300DE型台式数控超声波清洗器 东莞市科桥超声波设备有限公司。
1.2 实验方法
1.2.1 固定化底物PC的制备工艺
1.2.1.1 沉淀剂对PC吸附率的影响
假定载体和底物初始浓度不变,探讨不同沉淀剂对PC在载体上的吸附率影响,具体操作如下:称取50 mg PC原料,超声辅助条件下溶解于5 mL乙酸乙酯中。然后,加入100 mg硅胶载体,搅拌均匀,依次加入5 mL四种不同沉淀剂,即丙酮、乙醇、乙酸乙酯和丙酮-水混合溶液(1:1,v/v)等,37 ℃和200 r/min搅拌3 h,进行PC吸附。待吸附反应结束后,转速约为4000 r/min和15 ℃条件下,离心20 min,得到吸附PC载体材料。吸取上层清液,0.45 µm膜过滤,用于高效液相色谱-蒸发光检测(HPLC-ELSD)分析上清液PC含量,按公式(1)计算PC吸附率。
(1) 式中:m0表示PC初始加入量,mg;m1表示吸附3 h后上清液中PC质量,mg。
1.2.1.2 载体对PC吸附率的影响
假定底物初始浓度和沉淀剂不变,探讨不同吸附载体对PC吸附率的影响,具体操作如下:称取50 mg PC原料,超声辅助条件下溶解于5 mL乙酸乙酯中,然后,分别加入100 mg六种不同载体,如氧化铝、二氧化硅、硅胶、大孔树脂、活性炭和微晶纤维素等,搅拌均匀,之后加入5 mL丙酮,37 ℃和200 r/min搅拌3 h。反应结束后,3500×g和15 ℃条件下,离心20 min,获得吸附PC的载体材料。吸取上层清液,0.45 µm膜过滤,用于HPLC-ELSD分析上清液PC含量,按公式(1)计算PC吸附率。同时,采用场发射扫描电镜观察载体吸附PC后的形貌变化。
1.2.1.3 底物初始加入量对PC吸附率的影响
假定载体和沉淀剂不变,探讨不同底物初始加入量对PC吸附率的影响,具体操作如下:分别称取25、50、75、100和125 mg PC原料,超声辅助条件下溶解于5 mL乙酸乙酯中,加入100 mg硅胶载体,搅拌均匀,再加入5 mL丙酮,37 ℃和200 r/min搅拌3 h。在3500×g和15 ℃条件下,离心20 min,获得吸附PC的载体材料。吸取上层清液,0.45 µm膜过滤,用于HPLC-ELSD分析上清液PC含量,按公式(1)计算PC吸附率。
1.2.2 构建固定化底物PC水相酶催化合成PS新技术体系
在上述实验基础上,确定了最适沉淀剂(丙酮)、载体种类(胶硅)和底物初始加入量(50 mg)条件下,获得吸附PC的载体材料,构建固定化底物PC水相酶催化合成PS体系。具体操作如下:将100 mg吸附PC的载体均匀分散于10 mL浓度为0.2 mol/L和pH为5.5的醋酸缓冲液中(醋酸钠14.76 g和醋酸1.155 mL定容至1 L),之后加入1.3 g L-丝氨酸和1 mL PLD溶液(酶活为50 U/mL),在200 r/min和30 ℃条件下,酶催化反应24 h。反应结束后,离心分离PLD溶液和载体。用蒸馏水多次冲洗载体,离心,直至上清液无法检测出酶蛋白。分离出的酶液用于下一批次的催化反应。然后,用氯仿/甲醇混合溶液(1:1,v/v)作为洗脱液,浸泡载体,将载体上的磷脂产品完全洗脱下来,离心、0.45 µm膜过滤,滤液用于HPLC-ELSD分析磷脂产品组成和含量,用公式(2)计算PS得率。
(2) 进一步考察不同反应时间(4、8、12、16、20、24、36和48 h)下的PS得率,探讨固定化底物PC水相体系中,PLD催化合成PS的时间反应动力学。
同时对酶的重复利用效率进行测定,酶促反应结束后,离心得到上清液即为回收PLD酶液,直接用于下一批次反应。即,向酶液中添加100 mg吸附PC载体和1.3 g L-丝氨酸,在200 r/min和30 ℃条件下,反应24 h。重复循环反应10批次,考察固定化底物PC水相体系中,PLD的循环利用稳定性。
1.2.3 双液相体系中PLD催化PC合成PS
参考文献[11,13]对双液相体系中PLD催化PC合成PS进行考察。将100 mg底物PC在超声辅助下溶解于10 mL苯中,然后加入1.3 g L-丝氨酸和1 mL磷脂酶D溶液(酶活50 U/mL),200 r/min和30 ℃条件下,反应24 h。反应完成后,离心,分离水相和有机相。用蒸馏水多次洗涤有机相,直至洗出液中不能检出酶蛋白为止。有机相过0.45 µm膜,用HPLC-ELSD分析磷脂组成与含量,用公式(2)计算PS得率。
分离出的水相酶液用于下一批次酶促反应,考察酶的重复利用效率。在分离出的水相酶液中加入100 mg蛋黄PC、10 mL苯和1.3 g L-丝氨酸,同样条件下反应24 h,考察双液相体系中,PLD的循环利用稳定性。
1.2.4 扫描电镜(SEM)分析
采用SU 1510冷场发射扫描电镜(SEM)观察载体吸附PC前后的形貌特征。具体操作如下:将吸附PC的载体置于鼓风干燥箱中,60 ℃干燥5 h,然后置于电镜样品台上,用导电胶固定,进行表面喷金(Au/Pd)处理,进行SEM形貌观察。
1.2.5 HPLC-ELSD分析
底物PC吸附率和产物PS得率,均采用Alltech 1500型高效液相色谱仪配蒸发光检测器(HPLC-ELSD)进行定量分析。HPLC分析条件:ProntoSIL Si色谱柱(250 mm×4.0 mm×5 μm),进样量20 μL,柱温55 ℃,ELSD检测器,检测器温度95 ℃,气体流速2.5 L/min,流动相流速1 mL/min,梯度洗脱。流动相A:正己烷814.2 mL、异丙醇170.0 mL、乙酸15.0 mL和三乙胺0.8 mL;流动相B:异丙醇844.2 mL、超纯水140.0 mL、乙酸15.0 mL和三乙胺0.8 mL。洗脱程序:0~5 min流动相A 95%~80%;5~8.5 min流动相A 80%~60%;8.5~17.5 min流动相A 60%~0%;17.5~29 min流动相A 0%~95%。
1.3 数据处理
每个样品平行测3次,采用SPSS25软件进行方差分析,显著性水平为P<0.05。作图采用Origin 2021 b软件作图。
2. 结果与分析
2.1 建立分析PC与PS含量HPL-ELSD方法
首先,以正己烷为溶剂,配制浓度为48、96、144、192和240 μg/mL的PC标准液,以及浓度为50、100、150、200和250 μg/mL的PS标准液,进行混合标品HPLC分析,按照1.2.5条件,实现了PC和PS有效分离(图1a)。然后,以浓度对数值(lgM,M:μg/mL)为横坐标,相应峰面积对数值(lgA)为纵坐标,绘制PC和PS标准曲线(图1b、c)。最后,考察该方法检测分析PC和PS含量的精密度、稳定性和平均回收率。由图1可知,PC标准曲线方程为lgA=1.5516lgM+3.3188,R2=0.9997,该方法测定PC含量的精密度相对标准偏差(RSD)为0.68%,稳定性RSD为0.84%,平均回收率为99.68%。PS标准曲线方程为lgA=1.5361 lgM+3.3662,R2=0.9998,该方程测定PS含量的精密度RSD为0.30%,稳定性RSD为0.67%,平均回收率为99.70%。由此可见,该方法可以用来分析酶促反应过程中,PC转化率和PS得率的变化。
2.2 固定化底物PC的工艺优化
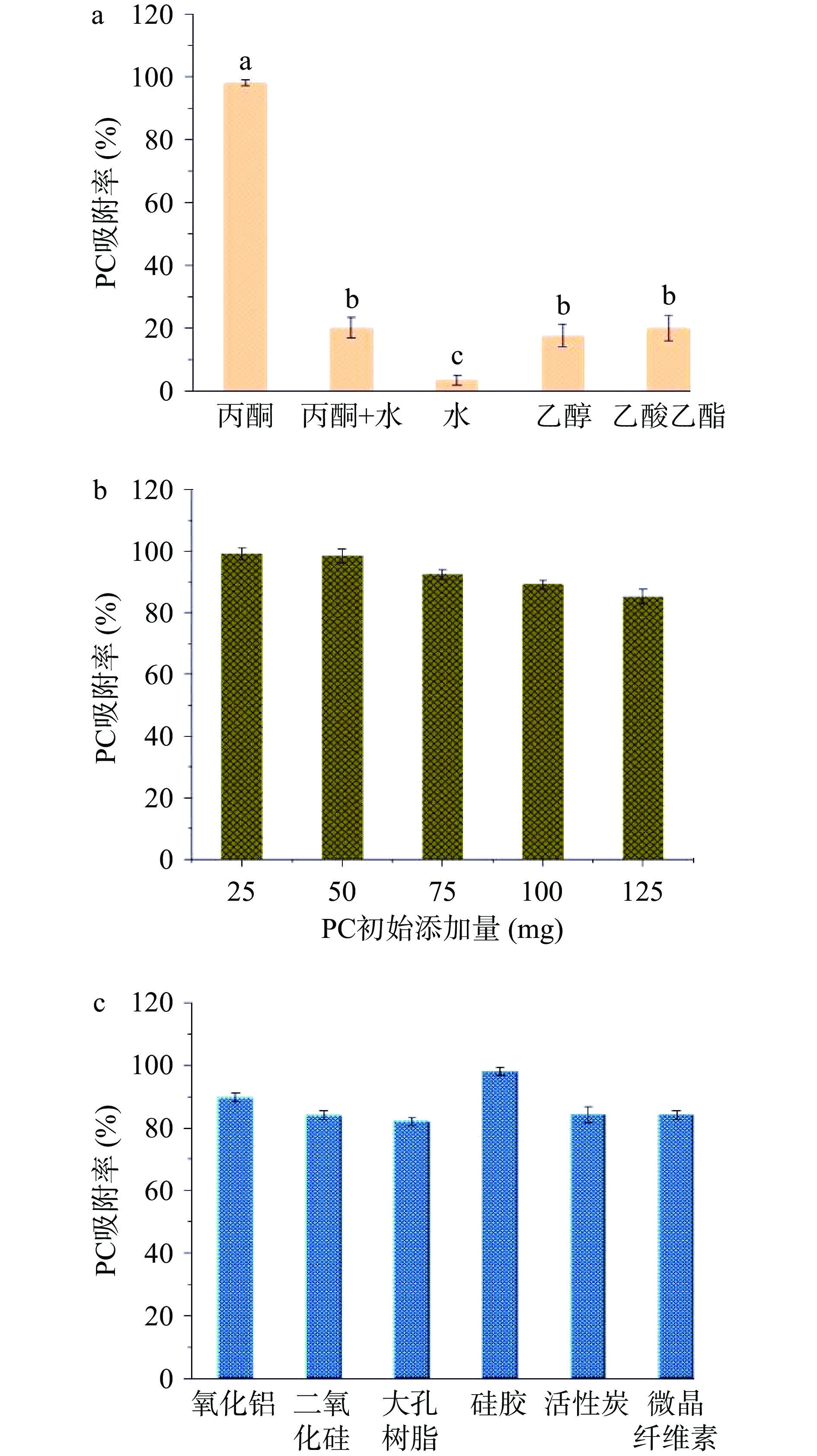
考察了固定化底物PC吸附率的3个主要影响因素:沉淀剂、载体和底物PC初始加入量。研究其中一个影响因素时,另外两个影响因素固定不变。实验结果见图2。
以硅胶为载体和底物PC初始添加量为50 mg时,由图2a可知,不同类型沉淀剂对PC吸附率影响显著(P<0.05)。丙酮为沉淀剂时,PC吸附率最高,达98%以上,原因可能是PC在丙酮中不溶解[15]。水和丙酮-水混合溶液作为沉淀剂时,PC吸附率很低,尤其是以水作为沉淀剂时,PC吸附率仅为3.54%,分析原因可能是PC在水溶液中形成了乳化现象,这与PC结构中既含有亲水端胆碱基团,又含有疏水端脂肪酸基团有关[16]。由于PC在乙醇和乙酸乙酯中均有一定溶解度,选择它们作为沉淀时,PC吸附率较低。因此,本实验最终选择丙酮作为吸附剂,进行后续实验。
以硅胶为载体,丙酮为沉淀剂,研究了不同底物初始添加量(25、50、75、100和125 mg)对PC吸附率的影响,结果见图2b。由图可知,底物添加量增大时,PC吸附率略有降低,但是,组间没有统计学上的差异(P>0.05)。分析原因可能是,当载体和沉淀剂确定后,底物添加量增大,将以絮状沉淀形式沉淀出来,不会在载体表面形成有效吸附。实验发现,PC初始添加量为25 mg时,离心后,载体表面看到少量黄色絮状沉淀。PC初始添加量为50 mg时,离心后,载体表面没有黄色絮状沉淀。当PC初始添加量增加到75 mg时,离心后,载体表面同样出现絮状PC沉淀,表明PC添加量为75 mg时,载体表面吸附已达到饱和状态。为了消除表面PC沉淀对实验的影响,后续实验过程中选择PC添加量为50 mg。
确定丙酮为沉淀剂和底物PC初始添加量为50 mg时,比较了6种吸附载体,如氧化铝、二氧化硅、硅胶、大孔树脂、活性炭和微晶纤维素等对PC吸附率的影响,结果见图2c。由图2c可以看出,硅胶作为载体时,PC吸附率最高,为98%。其它载体对PC的吸附率大致在80%~90%之间。统计学分析表明,不同载体类型对PC吸附率没有统计学上的差异(P>0.05)。这一实验结果与Li等[14]的研究结果相一致。
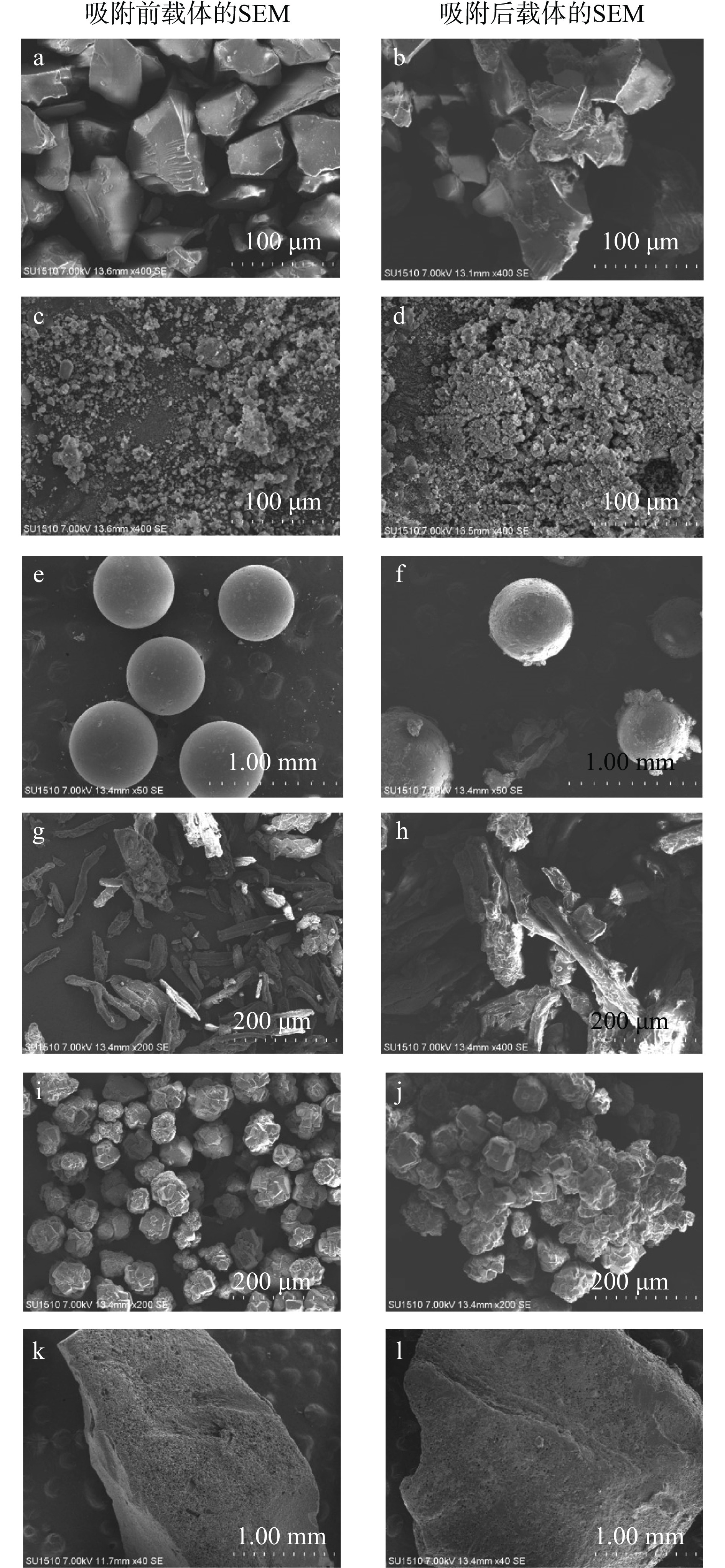
从6种不同载体吸附PC前后的SEM结果可知(图3),硅胶未吸附PC时,表面光滑、棱角轮廓清晰(图3a)。吸附PC后,硅胶表面可见均匀分布的PC颗粒(图3b)。对比分析图3c、d发现,二氧化硅未吸附PC时,呈均匀分散状态,吸附PC后,呈现黏连状态。图3e和f显示,大孔树脂未吸附PC时,呈球形,表面光滑,吸附PC后,球形表面粗糙,吸附大量的PC聚集体。微晶纤维素和氧化铝吸附PC,载体表面同样观察PC聚集体(图3g~j)。活性炭吸附PC后,载体微孔孔洞被堵塞,表面不能观察到PC聚集体(图3k、l),而磷脂酶D大小为7.6 nm×4.8 nm×5.7 nm[17],活性炭孔径为3.8 nm[18],酶无法进入活性炭孔径里,影响后续酶催化反应。因此,选用硅胶作为吸附载体,进行后续酶促反应。
2.3 固定化底物PC酶促反应体系合成PS
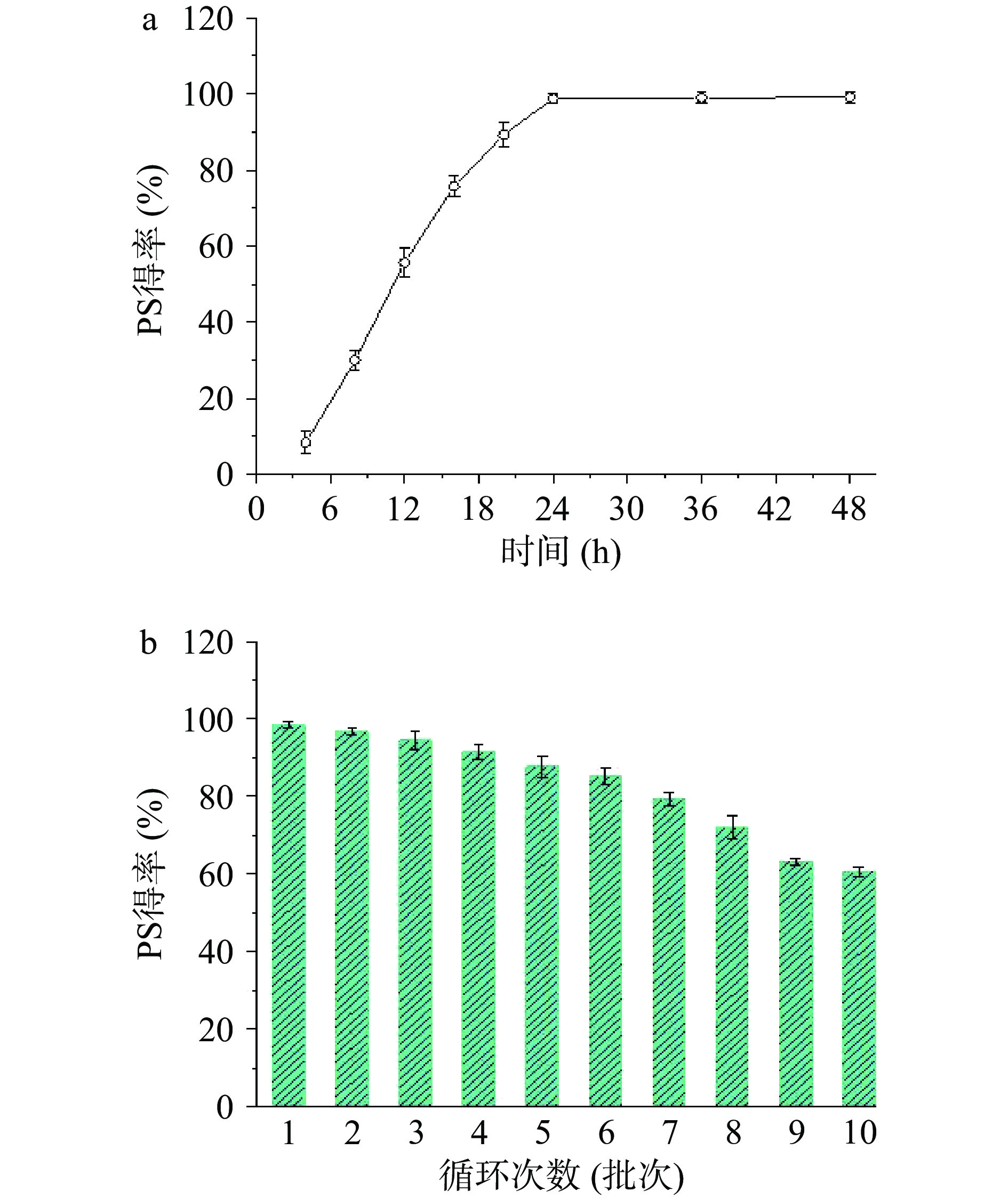
优化固定化底物PC工艺参数,获得最佳工艺参数:硅胶为载体(50 mg PC/100 g硅胶),丙酮为沉淀剂,底物PC初始加入量为50 mg。在此基础上,进一步构建固定化底物PC酶催化反应体系合成PS,研究时间反应动力学对PS得率的影响,以及酶的重复利用,结果见图4。
由图4a可知,反应24 h之前,PLD催化PC反应速率较快,PS得率随反应时间延长而增加,催化反应24 h时,PS得率最高,达98.74%。进一步延长反应时间至48 h,PS得率几乎保持不变,分析原因可能是酶催化活性位点达到饱和。这一结果与钱娟等[19]研究类似,文献作者指出,酶催化反应一定时间后,产物得率达到最大值,再继续延长反应时间,底物得率基本维持不变。
对于酶催化反应而言,酶的重复利用是影响操作成本的主要因素。本研究考察了固定化底物PC酶促反应体系合成PS反应中,PLD的重复利用性,结果见图4b。可以看出,PLD循环利用5批次,其催化效率几乎保持不变,PS得率为初始的93%,重复利用10批次,PS得率达60%以上,远高于文献报道的固定化PLD,在纯水相中催化PC合成PS活力,文献作者指出,固定化PLD在纯水相中重复利用5批次,PS得率为60%[20]。本文提出的固定化底物PC酶促反应生成PS,只需简单离心过滤,即可实现PLD分离和循环利用,操作简单,绿色环保,表现出潜在的应用前景,为后续进一步放大实验奠定了技术支撑。
2.4 双液相体系PLD催化PC合成PS
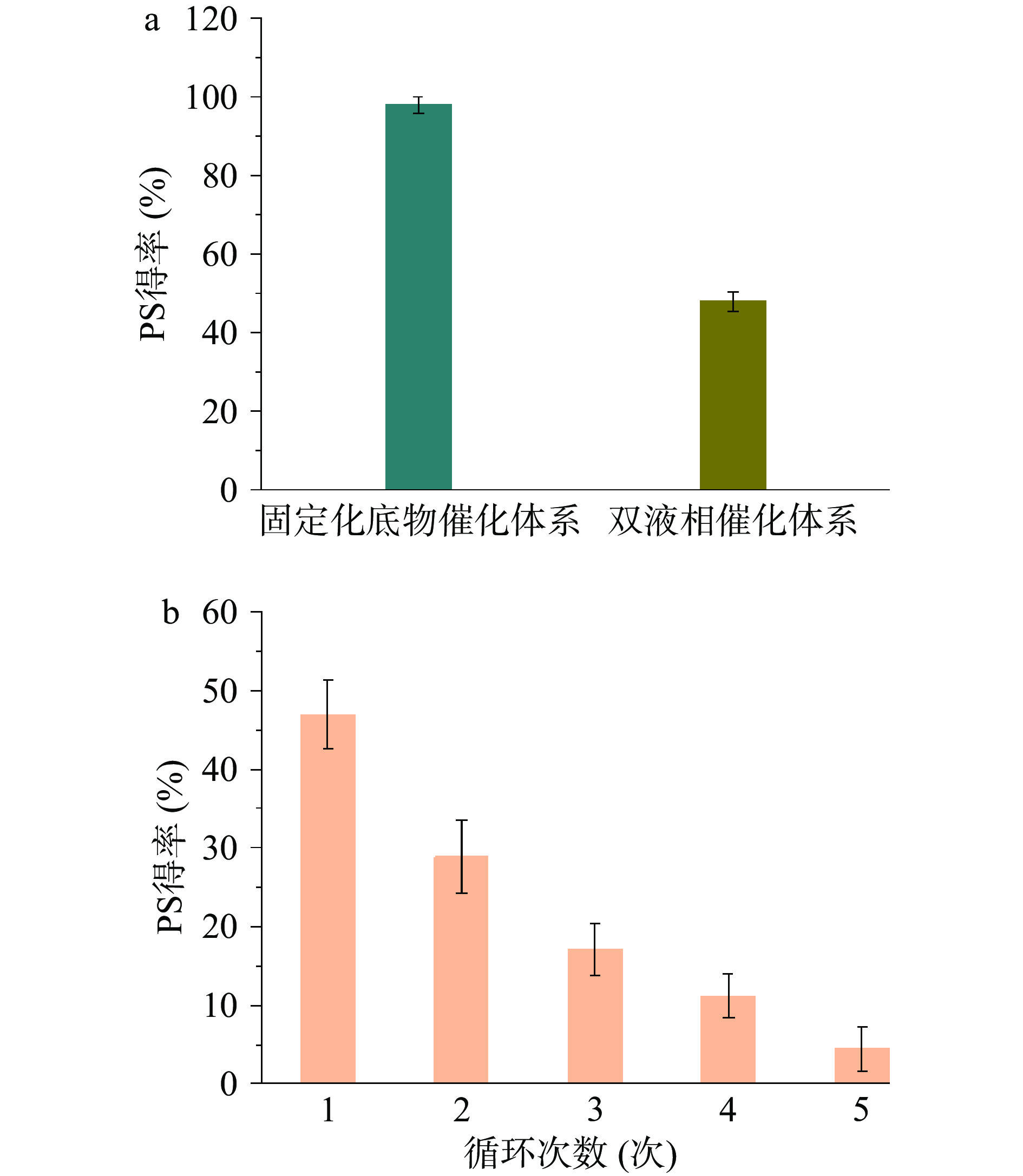
双液相体系是酶促反应常用的反应体系[13, 21]。本研究初步探索了双液相体系下,PLD催化PC合成PS效率,以及酶的循环利用性,结果见图5。
尽管双液相体系是使用PC作为底物,而固定化底物催化体系使用固定化PC作为底物,但是,在这两种不同体系中,都是采用PLD催化PC转化为PS。因此,以PS得率为指标,可以对这两种不同体系条件下,PC酶法转化PS效率进行比较。由图5可知,双液相催化体系和固定化底物催化体系相比,PLD在双液相催化体系中的催化活性和循环利用效率,远低于固定化底物催化体系。如图5a所示,双液相催化体系中,反应24 h,PLD催化PC合成PS产率约48%±2.63%,而相同条件下固定化底物催化体系,PS产率达98%±1.97%。双液相催化体系中,由于使用了有机溶剂,PLD易受有机溶剂毒害,引起酶蛋白变性失活,导致催化活力下降。因此,在双液相催化体系条件下,PLD循环5次后,PS得率仅为4.48%(图5b)。可以通过酶固定化和酶分子改造,来提高酶的有机溶剂耐受性和循环利用特性[22-24]。
3. 结论
本文建立了HPLC-ELSD分析PC和PS含量方法,回收率达99.6%以上,具有较高可行性,为酶促反应合成PS奠定了方法学。在此基础上,提出了固定化底物PC催化新技术,酶法合成PS,优化载体、沉淀剂、底物添加量等影响底物PC吸附效率的主要因素,获得了最佳工艺参数:沉淀剂为丙酮,载体为硅胶,底物初始添加量为50 mg/100 g载体。进一步研究了固定化底物催化体系中,酶促反应动力学和重复利用特性,反应24 h,PS得率达98.74%,PLD循环10批次,PS得率仍大于60%。然而,双液相催化体系中,PLD的活力和循环利用稳定性较差,反应24 h,PLD催化PC合成PS得率约48%,PLD循环5批次,PS得率仅为4.48%。由此可见,本文提出的固定化底物PC催化反应体系,酶法合成PS,酶促反应过程没有使用有机试剂,避免了有机试剂对酶活的毒害和产物PS的污染,只通过简单的分离即可实现游离酶的重复利用,大幅降低了操作成本,显示出较好的应用潜力。大豆和蛋黄磷脂均富含PC[25-26],未来通过固定化底物PC催化反应体系,结合分子生物技术,异源达PLD,开发就地产酶,就地酶法合成PS,为PS酶法生产指明了方向。
-
-
[1] WANG J, YU C, ZHUANG J, et al. The role of phosphatidylserine on the membrane in immunity and blood coagulation[J]. Biomarker Research,2022,10:4. doi: 10.1186/s40364-021-00346-0
[2] SOKOLOVA D, CHILDS T, HONG S. Insight into the role of phosphatidylserine in complement-mediated synapse loss in Alzheimer’s disease[J]. Faculty Reviews,2021,10:19.
[3] KANG E Y, CUI F, KIM H K, et al. Effect of phosphatidylserine on cognitive function in the elderly: A systematic review and meta-analysis[J]. Korean Journal of Food Science and Technology,2022,54(1):52−58.
[4] KIM H Y, HUANG B X, SPECTOR A A. Phosphatidylserine in the brain: Metabolism and function[J]. Progress in Lipid Research,2014,56:1−18. doi: 10.1016/j.plipres.2014.06.002
[5] AKITO K K, MASASHI S, RIKA E, et al. Soybean-derived phosphatidylserine improves memory function of the elderly Japanese subjects with memory complaints[J]. Journal of Clinical Biochemistry & Nutrition,2010,47(3):246−255.
[6] HIRAYAMA S, TERASAWA K, RABELER R, et al. The effect of phosphatidylserine administration on memory and symptoms of attention-deficit hyperactivity disorder: A randomized, double-blind, placebo-controlled clinical trial[J]. Journal of Human Nutrition & Dietetics,2014,27(S2):284−291.
[7] 夏禹, 张涛, 江波. 磷脂酶D的纯化及催化制备磷脂酰丝氨酸研究[J]. 中国油脂,2020,45(1):97−101. [XIA Y, ZHANG T, JIANG B. Purification of phospholipase D and catalytic preparation of phosphatidylserine[J]. China Oils and Fats,2020,45(1):97−101. doi: 10.12166/j.zgyz.1003-7969/2020.01.021 [8] 张群. 磷脂酰丝氨酸制备关键技术研究[J]. 食品与生物技术学报,2021,40(2):112. [ZHANG Q. Studies on the key technology of phosphatidylserine preparation[J]. Journal of Food Science and Biotechnology,2021,40(2):112. doi: 10.3969/j.issn.1673-1689.2021.02.016 [9] 周彦峰, 张涛, 江波, 等. 磷脂酰丝氨酸的酶法制备与分离研究进展[J]. 中国油脂,2018,43(10):53−57. [ZHOU Y, ZHANG T, JIANG B, et al. Advance in enzymatic preparation and separation of phosphatidylserine[J]. China Oils and Fats,2018,43(10):53−57. doi: 10.3969/j.issn.1003-7969.2018.10.011 [10] QIN W, WU C, SONG W, et al. A novel high-yield process of phospholipase D-mediated phosphatidylserine production with cyclopentyl methyl ether[J]. Process Biochemistry,2017,66:146−149.
[11] ADLERCREUTZ D, WEHTJE E. An enzymatic method for the synthesis of mixed-acid phosphatidylcholine[J]. Journal of the American Oil Chemists Society,2004,81(6):553−557. doi: 10.1007/s11746-006-0940-5
[12] 毛淑红, 马晓雨, 张朝晖, 等. 磷脂酶D在枯草芽胞杆菌中表达及酶法催化合成磷脂酰丝氨酸的研究[J]. 天津科技大学学报,2020,35(5):1−7. [MAO S, MA X, ZHANG Z, et al. Expression of phospholipase D in Bacillus subtilis and enzymatic synthesis of phosphatidylserine[J]. Journal of Tianjin University of Science & Technology,2020,35(5):1−7. doi: 10.13364/j.issn.1672-6510.20200037 [13] ZHANG Y, ZHU L, WU G, et al. A novel immobilized enzyme enhances the conversion of phosphatidylserine in two-phase system[J]. Biochemical Engineering Journal,2021,172:108035. doi: 10.1016/j.bej.2021.108035
[14] LI H, PANG Y, WANG X, et al. Phospholipase D encapsulated into metal-surfactant nanocapsules for enhancing biocatalysis in a two-phase system[J]. RSC Advances,2019,9:6548−6555. doi: 10.1039/C8RA09827A
[15] BAHARI M, VAZIRI A S, ALEMZADEH I. Extraction and purification of phosphatidylcholine and its potential in nanoliposomal delivery of Eucalyptus citriodora oil[J]. The Canadian Journal of Chemical Engineering,2021,100(10):2807−2814.
[16] EPAND R M, EPAND R F, HUGHES D W, et al. Phosphatidylcholine structure determines cholesterol solubility and lipid polymorphism[J]. Chemistry and Physics of Lipids,2005,135:39−53. doi: 10.1016/j.chemphyslip.2005.01.008
[17] LEIROS I, MCSWEENEY S, HOUGH E. The reaction mechanism of phospholipase D from Streptomyces sp. strain PMF. snapshots along the reaction pathway reveal a pentacoordinate reaction intermediate and an unexpected final product[J]. Journal of Molecular & Biology,2004,339:805−820.
[18] 李冰麟. 磷脂酶D催化磷脂酰基转移反应生产稀有及非天然磷脂的研究[D]. 西安: 西北大学, 2019. LI Binglin. Phospholipase D-catalyzed transphosphatidylation for production of naturally rare and non-natural phospholipids[D]. Xi’an: Northwest University, 2019.
[19] 钱娟, 庞洋, 王昕. 磷脂酶D的制备及催化磷脂酰胆碱合成磷脂酰丝氨酸[J]. 中国油脂,2017,42(9):66−71. [QIAN J, PANG Y, WANG X. Preparation of phospholipase D and catalytic synthesis of phosphatidylserine from phosphatidylcholine[J]. China Oils and Fats,2017,42(9):66−71. doi: 10.3969/j.issn.1003-7969.2017.09.013 [20] MAO S, ZHANG Z, MA X, et al. Efficient secretion expression of phospholipase D in Bacillus subtilis and its application in synthesis of phosphatidylserine by enzyme immobilization[J]. International Journal of Biological Macromolecules,2021,169:282−289. doi: 10.1016/j.ijbiomac.2020.12.103
[21] ALLEGRETTI C, GATTI FG, MARZORATI S, et al. Reactive deep eutectic solvents (RDESs): A new tool for phospholipase D-catalyzed preparation of phospholipids[J]. Catalysts,2021,11(6):655. doi: 10.3390/catal11060655
[22] ZHANG Y, ZHU L, WU G, et al. Design of amino-functionalized hollow mesoporous silica cube for enzyme immobilization and its application in synthesis of phosphatidylserine[J]. Colloids and Surfaces B:Biointerfaces,2021,202:111668. doi: 10.1016/j.colsurfb.2021.111668
[23] HOU H J, GONG J S, DONG Y X, et al. Phospholipase D engineering for improving the biocatalytic synthesis of phosphatidylserine[J]. Bioprocess and Biosystems Engineering,2019,42:1185−1194. doi: 10.1007/s00449-019-02116-7
[24] ZHANG H, CHU W, SUN J, et al. Combining cell surface display and DNA-shuffling technology for directed evolution of Streptomyces phospholipase D and synthesis of phosphatidylserine[J]. Journal of Agricultural and Food Chemistry,2019,67:13119−13126. doi: 10.1021/acs.jafc.9b05394
[25] 朱帅, 黄梦玲, 吴倩倩, 等. 蛋黄卵磷脂的结构, 提取, 功能与脂质体研究进展[J]. 粮油食品科技,2020,28(3):18−25. [ZHU S, HUANG M, WU Q, et al. State-of-the-art of egg yolk lecithin: Molecular structure, extraction strategies, bio-activities and liposome application[J]. Science and Technology of Cereals, Oils and Foods,2020,28(3):18−25. [26] 朱帅, 黄梦玲, 樊俐, 等. 富含不饱和脂肪酸蛋黄磷脂酰胆碱的提取与分子结构分析[J]. 粮油食品科技,2020,28(3):10−17. [ZHU S, HUANG M, FAN L, et al. Egg yolk phophatidylcholine enrichment in unsaturation fatty acids: Extraction and molecular structure[J]. Science and Technology of Cereals, Oils and Foods,2020,28(3):10−17. doi: 10.16210/j.cnki.1007-7561.2020.03.002








 下载:
下载:
 下载:
下载:



