Extraction Optimization by Response Surface Methodology and Physicochemical Properties of Total Flavonoids from Rostellularia procumbens (L.) Ness
-
摘要: 目的:采用响应面法优化爵床总黄酮的回流提取工艺,并对其进行稳定性和抗氧化活性考察。方法:以爵床为药材,选择不同的料液比、乙醇体积分数、提取时间和提取温度作为单因素,以爵床总黄酮提取量为指标,进行单因素考察;继而运用响应面法进行优化,获得最佳提取工艺。通过设定不同的温度、光照、pH以及金属离子等条件,考察爵床总黄酮的稳定性;通过对DPPH自由基清除率进行测定,评价其抗氧化活性。结果:爵床总黄酮提取工艺的最佳条件,料液比1:23 g/mL、乙醇体积分数55%、提取时间20 min、提取温度70 ℃;提取量为9.02 mg/g。稳定性试验结果表明,爵床总黄酮在30~90 ℃、pH4~9条件下较稳定,在金属离子Cu2+、Fe2+、Zn2+、Al3+、Ba2+条件下较不稳定。DPPH自由基清除率结果表明,爵床总黄酮对DPPH自由基的IC50为0.079 mg/mL。结论:响应面法优化爵床总黄酮回流提取工艺稳定、可靠,提取物具有一定的稳定性和抗氧化活性。Abstract: Objective: To optimize the reflux extraction technology by the response surface methodology and evaluate the stability and antioxidant activity of the total flavonoids from Rostellularia procumbens (L.) Ness. Methods: The best conditions of extracting total flavonoids from Rostellularia procumbens (L.) Ness were screened by the response surface methodology based on single factor experiments with the ratio of materials to liquid, ethanol volume fraction, extraction times and extraction temperature as factors with the yield of total flavonoids as index. Meanwhile, the stability was evaluated at different temperatures, light, pH and metal ions and the antioxidant activity was measured by scavenging of DPPH. Results: The results showed that optimal process obtained were as follows: Materials to liquid was 1:23 g/mL, ethanol volume fraction was 55%, extraction time was 20 min and extraction temperature was 70 ℃. The yield of total flavonoids was 9.02 mg/g. The total flavonoids from Rostellularia procumbens (L.) Ness under the optimal extraction process was stable at 30~90 ℃ and pH4~9 and not stable in metal ions of Cu2+, Fe2+, Zn2+, Al3+, Ba2+. IC50 of total flavonoids from Rostellularia procumbens (L.) Ness to DPPH free radical was 0.079 mg/mL. Conclusion: The reflux extraction technology by the response surface methodology was rational and feasible and the extract exhibited good stability and antioxidant activity.
-
爵床为爵床科爵床属植物爵床(Rostellularia procumbens (L.) Ness)的全草。临床主治感冒发热、咳嗽、咽喉肿痛、跌打损伤、毒蛇咬伤等。民间食疗方中,将其与红枣煎服,能够利水解毒,治疗前列腺炎。现代研究显示,爵床的主要有效成分为黄酮类[1]、木脂素类[2]等,具有抗肿瘤[3-5]、抗血小板聚集[6]、抗病毒[7-9]、抗炎镇痛[10]、抑制肾炎细胞增殖[11]等作用,有较高的药用研究价值。
目前对爵床总黄酮的研究较少,卢水木等[12]考察了4种显色方法对其含量测定的影响;周燕芳等[13]使用了大孔树脂对其进行分离、纯化,得率42.72%;但对爵床总黄酮提取工艺的研究未见相关文献报道。目前总黄酮的提取方法主要包括加热回流法[14]、超声波法[15]、冷浸法[16]、超声复合酶法[17]等,其中,加热回流法具有操作简便、溶剂可回收、提取量高的优点[18]。
因此,为了充分开发和更好地利用爵床资源,本研究以爵床为原料药材,采用加热回流的提取方法,设定不同单因素条件,考察其对爵床总黄酮提取效率的影响;采用Box-Behnken设计结合响应面分析的方法,优化获得最佳提取爵床总黄酮的工艺条件。进一步评价其稳定性及抗氧化活性,旨在为开发、利用爵床资源、新药研发、新型抗氧剂研发等方面提供基础理论依据。
1. 材料与方法
1.1 材料与仪器
爵床 采自河南省万仙山,采收时间8月,经新乡医学院闫福林教授鉴定为爵床(Rostellularia procumbens (L.) Ness);芦丁 标准品,中国食品药品检定所;1,1-二苯基-2-苦基肼自由基(DPPH) 合肥巴斯夫生物科技有限公司;无水乙醇 天津市大茂化学试剂厂;氢氧化钠、亚硝酸钠、氯化钾、氯化钠、硫酸锌、硫酸铜、氯化铁、硝酸铝、硫酸亚铁、硫酸锂、氯化镁、氯化钙、氯化钡 天津市德恩化学试剂有限公司。
DHG-9420 A型恒温干燥箱 上海一恒;R206型旋转蒸发仪 上海申生科技有限公司;T6紫外-可见分光光度仪 北京普析通用仪器有限责任公司;HHS数显恒温水浴锅 金坛市金南仪器厂。
1.2 实验方法
1.2.1 爵床总黄酮的提取
取爵床中药材,置于60 ℃恒温干燥箱干燥至恒重,粉碎后过40目筛,即得爵床粉末;精密称定爵床粉末3.0 g,置于100 mL圆底烧瓶中,设定不同的料液比,加入不同体积分数的乙醇溶液,设置不同提取时间,在不同提取温度的条件下,进行加热回流提取,抽滤后减压蒸发至适量,加乙醇定容至25 mL,即得爵床总黄酮供试品溶液。
1.2.2 单因素实验
1.2.2.1 料液比对爵床总黄酮提取量的影响
按1.2.1方法,固定乙醇体积分数60%,提取时间60 min,提取温度60 ℃,考察不同的料液比(1:5、1:10、1:15、1:20、1:25、1:30 g/mL)对爵床总黄酮提取量的影响。
1.2.2.2 乙醇体积分数对爵床总黄酮提取量的影响
在以上结果的基础上,固定料液比为1:20 g/mL,提取时间60 min,提取温度60 ℃,考察不同体积分数乙醇溶液(40%、50%、60%、70%、80%、90%)对爵床总黄酮提取量的影响。
1.2.2.3 提取时间对爵床总黄酮提取量的影响
在以上结果的基础上,固定料液比为1:20 g/mL、乙醇体积分数60%,提取温度60 ℃,考察不同提取时间(10、30、60、90、120、150 min)对爵床总黄酮提取量的影响。
1.2.2.4 提取温度对爵床总黄酮提取量的影响
在以上结果的基础上,固定料液比为1:20 g/mL、乙醇体积分数60%,提取时间30 min,考察不同提取温度(40、50、60、70、80、90 ℃)对爵床总黄酮提取量的影响。
1.2.3 响应面试验
采用Design-Expert 8.0.6软件,分别选取料液比(A)、乙醇体积分数(B)、提取时间(C)以及提取温度(D),按照表1,设定爵床总黄酮提取量作为响应值,进行响应面试验。
表 1 响应面试验因素和水平Table 1. Factors and levels of response surface test水平 因素 A料液比(g/mL) B乙醇体积分数(%) C提取时间(min) D提取温度(℃) −1 1:15 55 20 65 0 1:20 60 30 70 1 1:25 65 40 75 1.2.4 爵床总黄酮的测定
1.2.4.1 标准曲线的绘制
参照文献[19]绘制芦丁标准曲线,其线性关系为y=0.0129x−0.0387(R2=0.9998)。
1.2.4.2 样品总黄酮的测定
精密量取爵床总黄酮供试品溶液0.5 mL,置于10 mL具塞试管中,按照芦丁标准曲线的测定方法测定爵床总黄酮的浓度,根据下列公式计算爵床总黄酮提取量。
X(mg/g)=C×V×DW 式中:X:爵床总黄酮提取量(mg/g);C:爵床总黄酮供试品溶液浓度(mg/mL);V:爵床总黄酮供试品溶液体积(mL);D:爵床供试品溶液稀释倍数;W:爵床粉末取样量(g)。
1.2.5 稳定性试验
1.2.5.1 温度对爵床总黄酮稳定性的影响
取爵床总黄酮提取液7份,各10.0 mL,分别放置于30、40、50、60、70、80、90 ℃水浴中,加热60 min,取出后冷却至室温,计算爵床总黄酮保存率。爵床总黄酮保存率(%)=An/A0,An为稳定性试验后吸光度值,A0稳定性试验前吸光度值[20],考察温度对爵床总黄酮稳定性的影响。
1.2.5.2 光照对爵床总黄酮稳定性的影响
取爵床总黄酮提取液3份,各10.0 mL,分别放置在不同强度光照(室外自然光、室内自然光以及室内避光)条件下,室温、封口膜密封保存0、1、2、3、4、5、6、7 d,计算爵床总黄酮保存率,考察光照对爵床总黄酮稳定性的影响。
1.2.5.3 pH对爵床总黄酮稳定性的影响
取爵床总黄酮提取液12份,各5.0 mL,分别加入pH1、2、3、4、5、6、7、8、9、10、11、12的HCl或NaOH溶液5.0 mL,静置60 min,计算爵床总黄酮保存率,考察pH对爵床总黄酮稳定性的影响。
1.2.5.4 金属离子对爵床总黄酮稳定性的影响
取爵床总黄酮提取液12份,各10.0 mL,分别加入蒸馏水、0.1 mol/L的金属离子溶液(KCl、NaCl、ZnSO4、CuSO4、FeCl3、Al(NO3)3、FeSO4、Li2SO4、MgCl2、CaCl2、BaCl2)0.10 mL,静置时间60 min,计算爵床总黄酮保存率,考察金属离子对爵床总黄酮稳定性的影响。
1.2.6 DPPH自由基清除率的测定
参照文献[21]并加以调整,精密量取爵床总黄酮提取液0.1、0.2、0.3、0.4、0.5、0.75、1.0、1.5 mL,加水补足4.0 mL,根据爵床总黄酮提取量计算即得0.027、0.054、0.081、0.108、0.135、0.203、0.271、0.406 mg/mL的爵床总黄酮溶液,加入80 mg/L DPPH乙醇溶液2.0 mL、无水乙醇溶液2.0 mL,在25 ℃水浴中避光反应30 min,摇匀,在517 nm处测定吸光度值A1,以爵床总黄酮提取量对应浓度的抗坏血酸作为对照,进行DPPH自由基清除活性的测定。DPPH自由基清除率计算公式如下。
DPPH自由基清除率(%)=(1−A1−A0′A0)×100 式中,A0为蒸馏水加DPPH溶液测定吸光度值;A1为不同浓度爵床总黄酮溶液加DPPH溶液测定吸光度值;A0'为不同浓度爵床总黄酮溶液加蒸馏水测定吸光度值。
1.3 数据处理
所有试验平行3次进行测定,采用Microsoft Excel 2010、SPSS 22.0、Design-Expert 8.0.6进行试验数据处理、分析及绘图。
2. 结果与分析
2.1 单因素实验结果
2.1.1 不同料液比对爵床总黄酮提取量的影响
从图1可知:随着料液比的逐渐增大,爵床总黄酮的提取量先逐渐增大,后逐渐减小。当料液比为1:20 g/mL时,爵床总黄酮提取量达到最大值,为6.98 mg/g;而后再继续加大提取料液比,爵床总黄酮的提取量反而逐渐降低。其原因可能是:随着料液比的增加,样品与提取溶剂接触的比表面积增大[22],促进了爵床总黄酮的溶出,使其含量增加;而料液比过高,超过1:20 g/mL时,加大了非黄酮类的其他杂质的溶出;同时,可能由于长时间的溶剂接触,导致部分爵床总黄酮类化合物的结构遭到破坏,使得爵床总黄酮提取量降低[23]。因此,综合考虑选择将料液比1:15、1:20、1:25 g/mL作为水平因素进行响应面法试验。
2.1.2 不同乙醇体积分数对爵床总黄酮提取量的影响
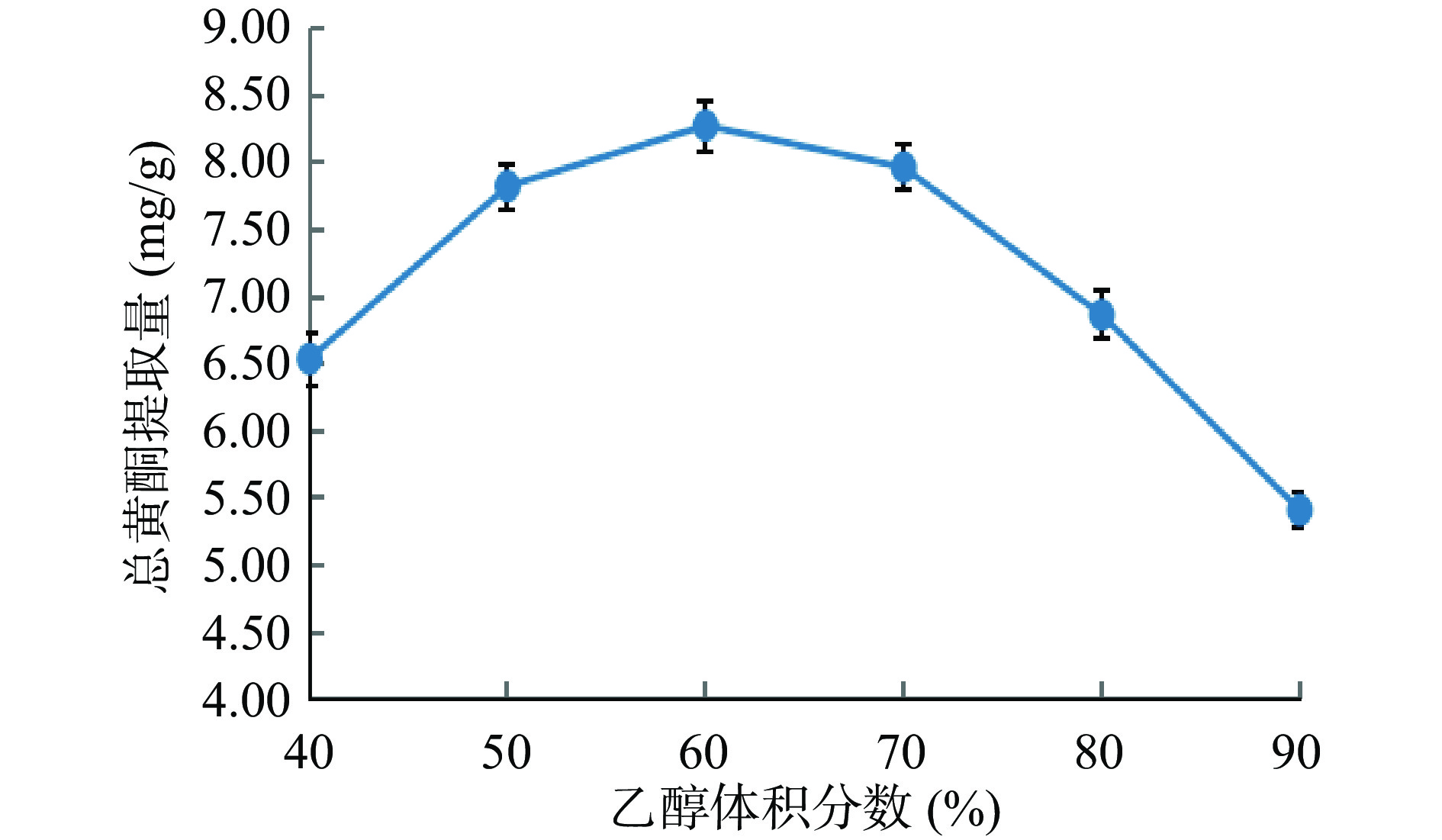
从图2可知:随着单因素乙醇体积分数的逐渐增大,爵床总黄酮的提取量先逐渐增大,后逐渐减小。当乙醇体积分数为60%时,爵床总黄酮的提取量达到最大值,为8.28 mg/g;而后继续增大,大于60%时,爵床总黄酮的提取量反而逐渐降低。这可能是因为:极性相似相溶,随着爵床总黄酮极性与乙醇体积分数极性越接近,即60%时,使得爵床总黄酮提取量最大;而随着极性差异的逐渐增加,即大于60%时,使得爵床总黄酮提取量反而减低;同时,随着乙醇体积分数的逐渐加大,可能会增加爵床总黄酮类化合物的溶解或分解,或者脂溶性杂质、色素、糖类、蛋白质等的溶出,导致爵床总黄酮提取量降低[24]。因此,选择55%、60%、65%的乙醇体积分数,作为水平因素进行响应面法试验。
2.1.3 不同提取时间对爵床总黄酮提取量的影响
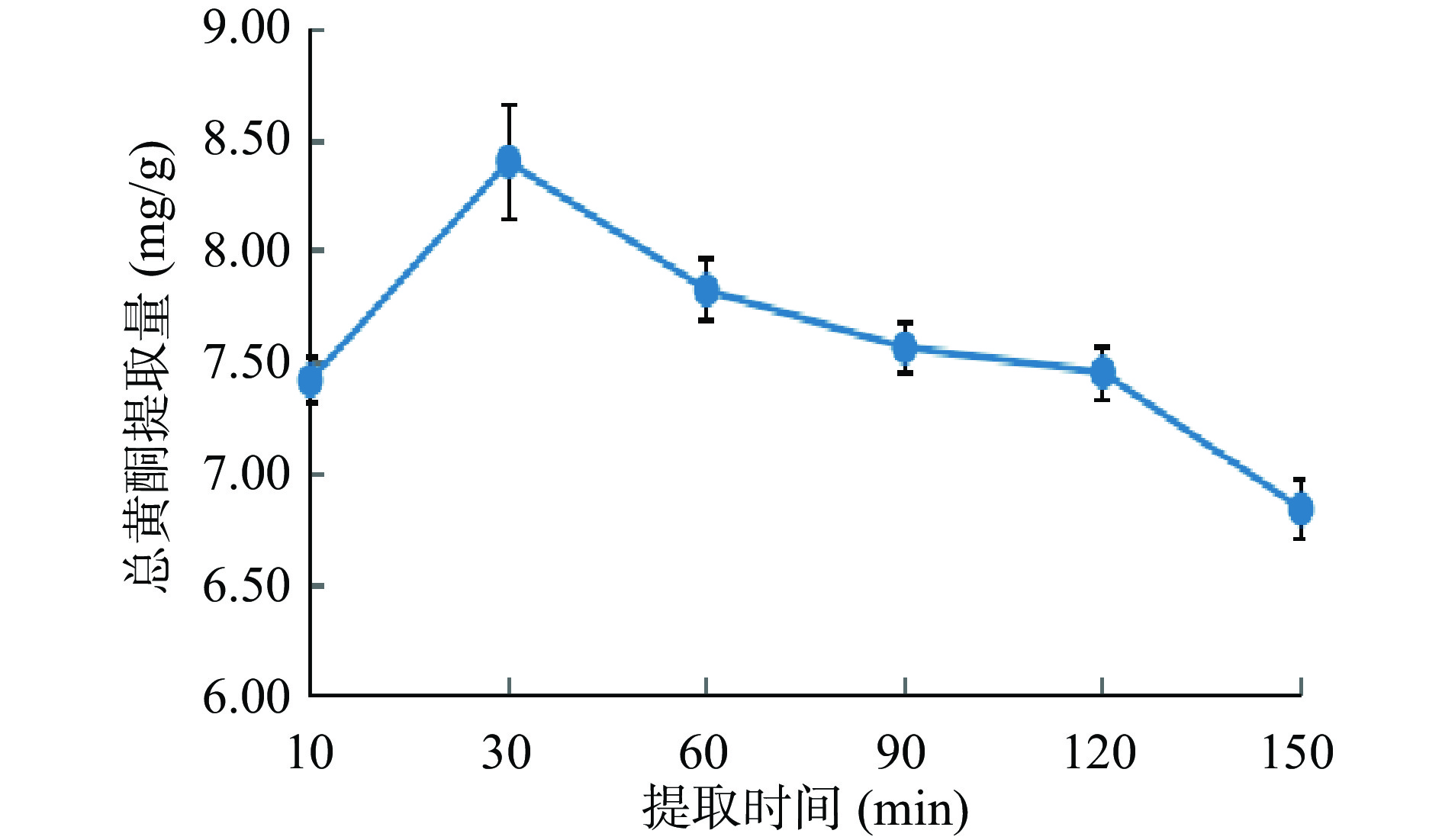
从图3可知:爵床总黄酮提取量随着提取时间的逐渐增加,先逐渐增大,后逐渐降低。在30 min时,达到最大值,为8.41 mg/g;随着提取时间的继续逐渐增大,爵床黄酮提取量反而逐渐降低。可能是因为:随着提取时间的不断延长,爵床总黄酮充分溶解而逐渐增大;但随着提取时间的继续延长,已经提取出的爵床总黄酮被氧化、分解、或者植物细胞中粘液等杂质溶出[25]导致爵床总黄酮提取量下降。因此,选择将提取时间设定为20、30、40 min,作为水平因素进行响应面法试验。
2.1.4 不同提取温度对爵床总黄酮提取量的影响
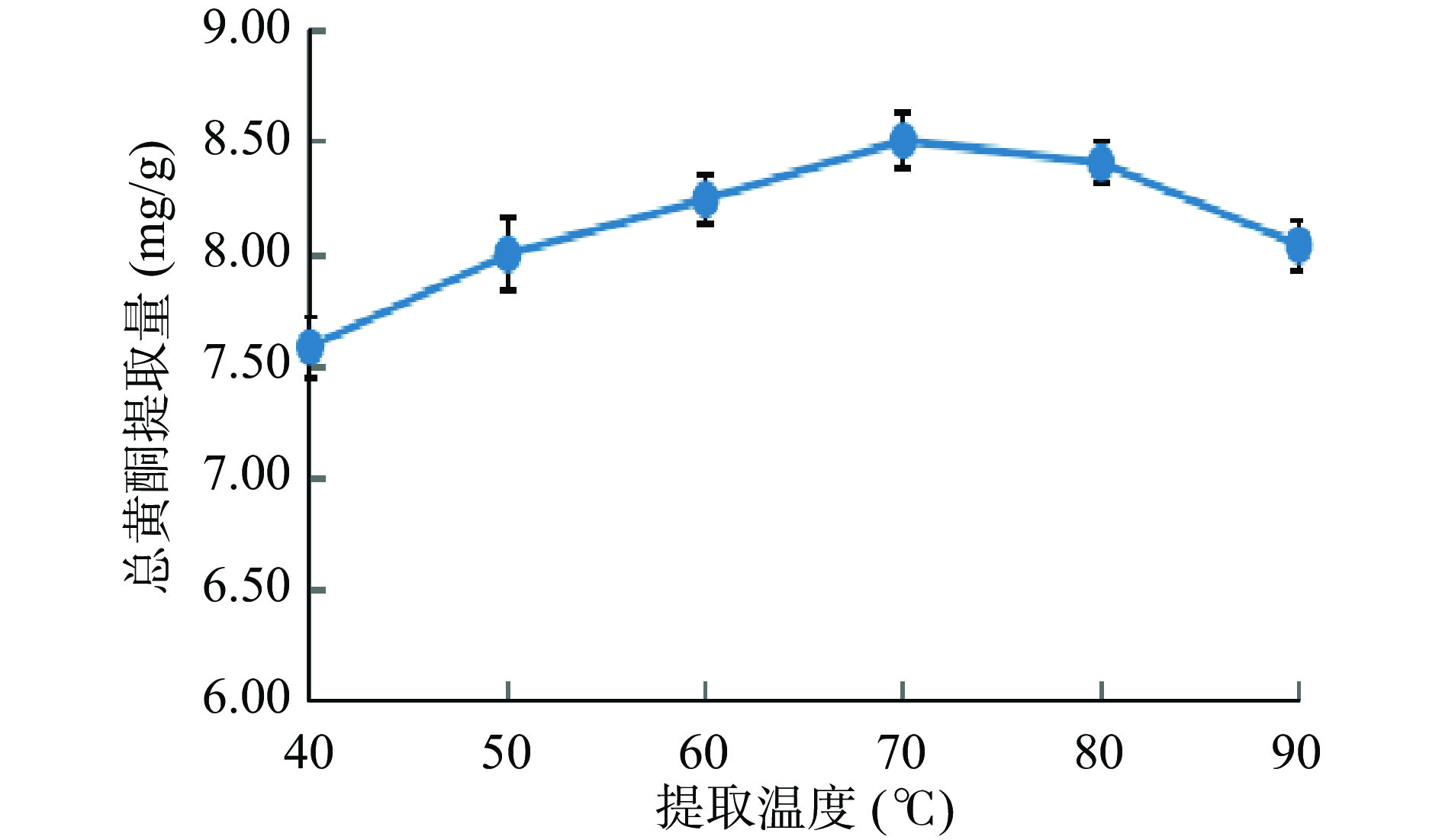
由图4可知:当提取温度为40~70 ℃时,爵床总黄酮提取量随着提取温度的逐渐升高而升高。当升高温度达到70 ℃时,爵床总黄酮提取量达到最大值,为8.51 mg/g。继续升高提取温度,高于80 ℃时,爵床总黄酮的提取量随着温度的逐渐升高反而逐渐降低。这可能是因为:随着温度的升高,导致爵床总黄酮类化合物分子运动增加,使其与溶剂接触程度增加,因而爵床总黄酮提取量增加;但温度较高,大于70 ℃时,可能导致部分非黄酮类化合物的溶出[26],使爵床总黄酮的提取量反而降低。因此,选择将提取温度设定为65、70、75 ℃作为进行响应面优化试验。
2.2 响应面优化试验结果
2.2.1 模型建立和显著性分析
采用Box-Behnken原理,设计四因素三水平,将爵床总黄酮提取量作为响应值,进行响应面试验。结果见表2。
表 2 响应面试验设计与结果Table 2. Design and results of response surface test编号 A B C D 总黄酮提取量(mg/g) 1 0 0 1 1 8.21±0.27 2 0 −1 −1 0 8.55±0.11 3 0 1 0 −1 7.55±0.21 4 0 0 1 −1 8.95±0.19 5 1 −1 0 0 8.98±0.07 6 0 1 0 1 6.58±0.15 7 0 −1 1 0 8.45±0.13 8 0 0 0 0 8.68±0.28 9 0 0 0 0 8.63±0.22 10 0 1 −1 0 7.33±0.21 11 1 1 0 0 6.45±0.19 12 0 0 0 0 8.96±0.28 13 0 0 0 0 8.80±0.19 14 −1 −1 0 0 7.60±0.20 15 −1 0 −1 0 8.28±0.14 16 0 −1 0 1 8.18±0.09 17 0 1 1 0 7.82±0.17 18 1 0 1 0 8.19±0.28 19 0 0 −1 1 8.24±0.21 20 −1 0 1 0 8.06±0.15 21 1 0 −1 0 8.56±0.27 22 0 −1 0 −1 8.19±0.31 23 −1 0 0 −1 7.87±0.24 24 1 0 0 −1 8.02±0.29 25 0 0 −1 −1 8.34±0.21 26 1 0 0 1 8.11±0.20 27 −1 0 0 1 7.79±0.10 28 −1 1 0 0 7.22±0.18 29 0 0 0 0 8.76±0.10 利用Design-Expert 8.0.6软件进行多元回归拟合,爵床总黄酮提取量Y与单因素A、B、C、D的二次回归方程为Y=8.77+0.12A−0.58B+0.032C−0.15D−0.54AB−0.038AC+0.042AD+0.15BC−0.24BD−0.16CD−0.47A2−0.75B2+0.0095C2−0.36D2,R2=0.9514。对回归模型进行方差分析,结果见表3。
表 3 回归模型方差分析Table 3. Analysis of variance of regression model方差来源 离均差平方和 自由度 均方 F值 P值 显著性 模型 11.08 14 0.79 19.56 <0.0001 ** A 0.19 1 0.19 4.57 0.0506 B 4.08 1 4.08 100.96 <0.0001 ** C 0.012 1 0.012 0.3 0.594 D 0.27 1 0.27 6.75 0.0211 * AB 1.16 1 1.16 28.57 0.0001 ** AC 0.0056 1 0.0056 0.14 0.7148 AD 0.0072 1 0.0072 0.18 0.679 BC 0.087 1 0.087 2.15 0.1645 BD 0.23 1 0.23 5.7 0.0317 * CD 0.1 1 0.1 2.53 0.1339 A2 1.44 1 1.44 35.69 <0.0001 ** B2 3.65 1 3.65 90.34 <0.0001 ** C2 0.0006 1 0.0006 0.014 0.9059 D2 0.84 1 0.84 20.7 0.0005 ** 残差 0.57 14 0.04 失拟项 0.5 10 0.05 3.1 0.1435 误差 0.065 4 0.016 总和 11.64 28 注:*表示差异显著,P<0.05;**表示差异极显著,P<0.01。 由表3可知,爵床总黄酮回归模型的P<0.0001,表明该模型结果极显著,而失拟项的P为0.1435>0.05,结果不显著,能够确定模型成立;模型的R2=0.9514,R2Adj=0.9027,表明模型的准确性和通用性较好;变异系数CV为2.48%<10.00%,表明该模型稳定性较好,可以用此模型对爵床总黄酮的最佳提取工艺条件来进行预测。
根据各影响因素的F值可知,不同单因素条件对爵床总黄酮提取量的影响程度不同,由高到低进行排序,依次为B>D>A>C,其中乙醇体积分数对爵床总黄酮提取量影响较大。模型一次项A、C,模型交互项AC、AD、BC、CD以及模型二次项C2,影响不显著(P>0.05);模型一次项D以及模型交互项BD,影响显著(P<0.05),模型一次项B,模型交互项AB以及模型二次项A2、B2、D2,影响极为显著(P<0.01)。
2.2.2 响应面交互作用分析
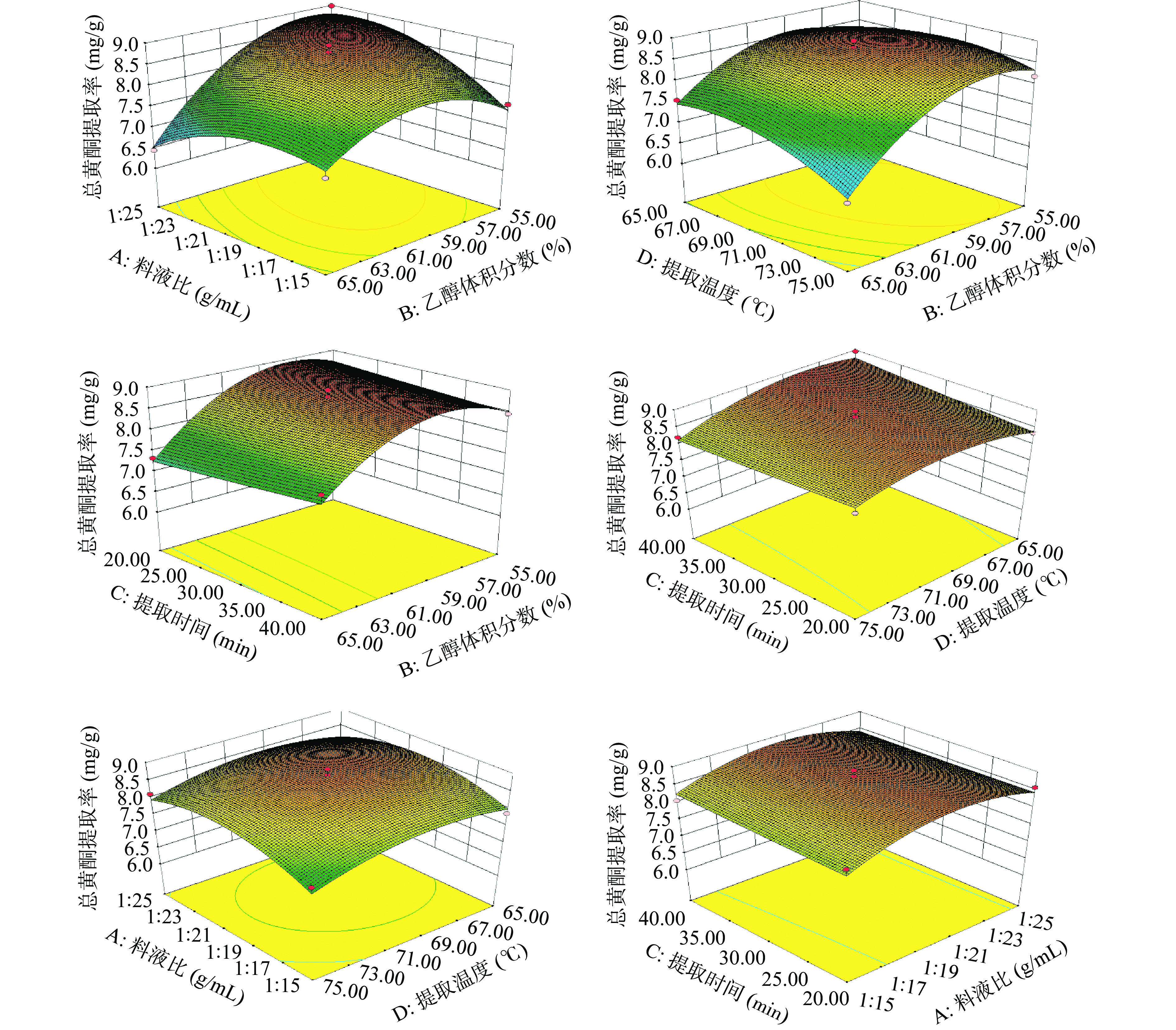
响应面图坡度越陡峭,表明响应值对某因素越敏感;反之亦然。各因素交互作用对爵床总黄酮提取量的响应面图,如图5所示。其中,料液比和乙醇体积分数、提取温度和乙醇体积分数交互作用显著。
2.3 最佳提取条件的确定及验证
通过Design-Expert 8.0.6软件对爵床总黄酮提取工艺条件进行分析预测,分别为料液比1:23.07 g/mL、乙醇体积分数56.23%、提取时间20.00 min、提取温度71.50 ℃。考虑实际情况,优化料液比1:23 g/mL、乙醇体积分数55%、提取时间20.00 min和提取温度70 ℃,分别为以此为提取条件进行爵床总黄酮的提取验证,实测值为9.02±0.02 mg/g,与模型预测值(9.07mg/g)进行对比,误差为0.55%,表明预测结果稳定可靠。
2.4 稳定性试验结果
2.4.1 温度对爵床总黄酮稳定性的影响
从图6可知:随着温度的逐渐升高,爵床总黄酮提取量变化差异不明显,表明爵床总黄酮在30~90 ℃的温度条件下结构性质稳定。因此,爵床总黄酮适宜在30~90 ℃温度下生产、贮存。
2.4.2 光照对爵床总黄酮稳定性的影响
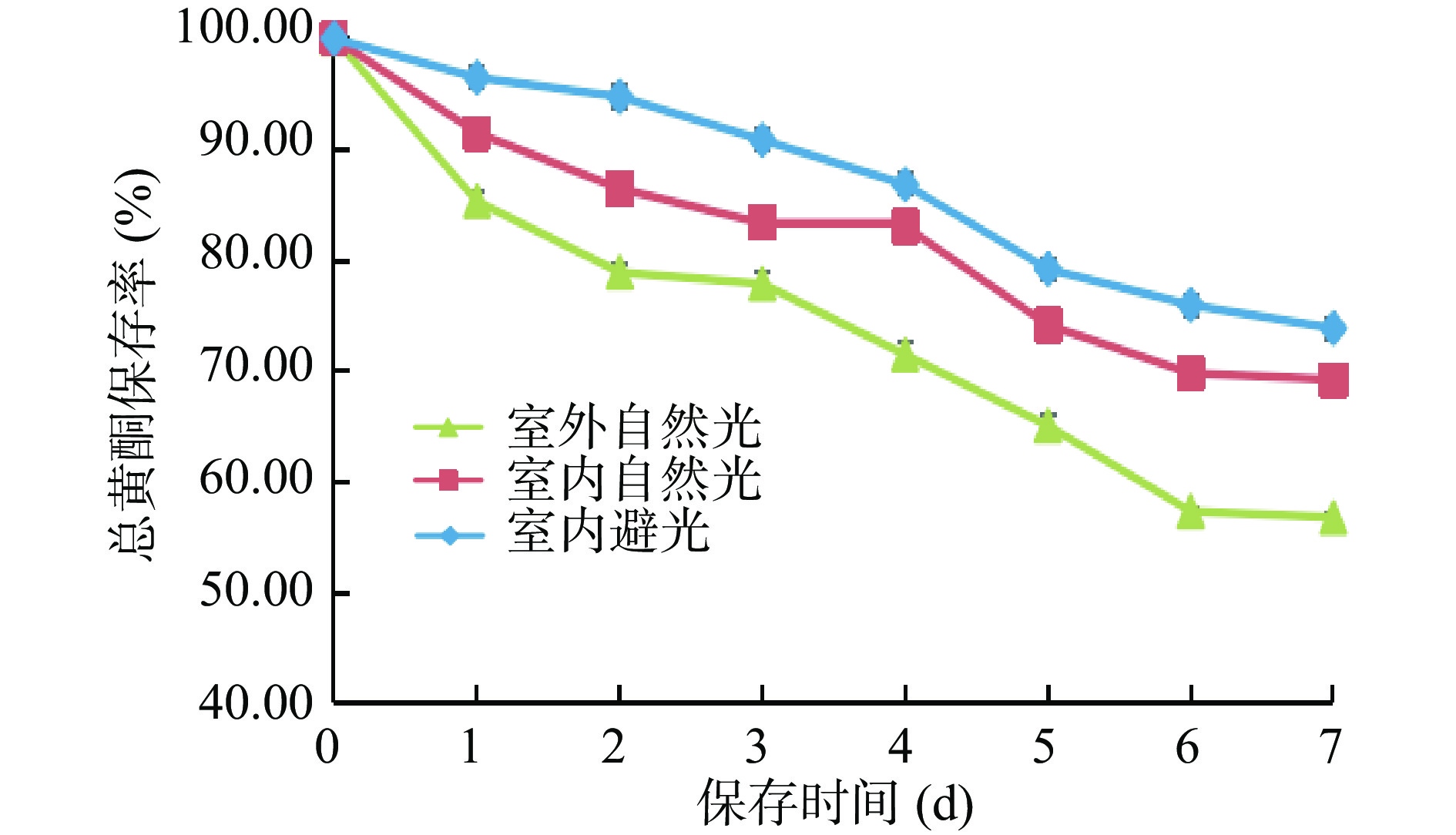
从图7可知:在室外自然光、室内自然光以及室内避光,三个光照条件下,随着放置时间的增加,爵床总黄酮保存率逐渐降低;随着三种光照强度的不同,爵床总黄酮保存率按照室内避光>室内自然光>室外自然光的顺序,逐渐降低。表明爵床总黄酮类化合物,见光后,结构性质不稳定,部分黄酮类化合物在光照的作用下分解或氧化,导致爵床总黄酮的含量下降,显示爵床总黄酮具有一定光敏性[27],其中的光敏成分,易遭受光照中紫外线破坏。因此爵床总黄酮在生产、贮存时,应避免长期存放、且需要注意避光保存。
2.4.3 pH对爵床总黄酮稳定性的影响
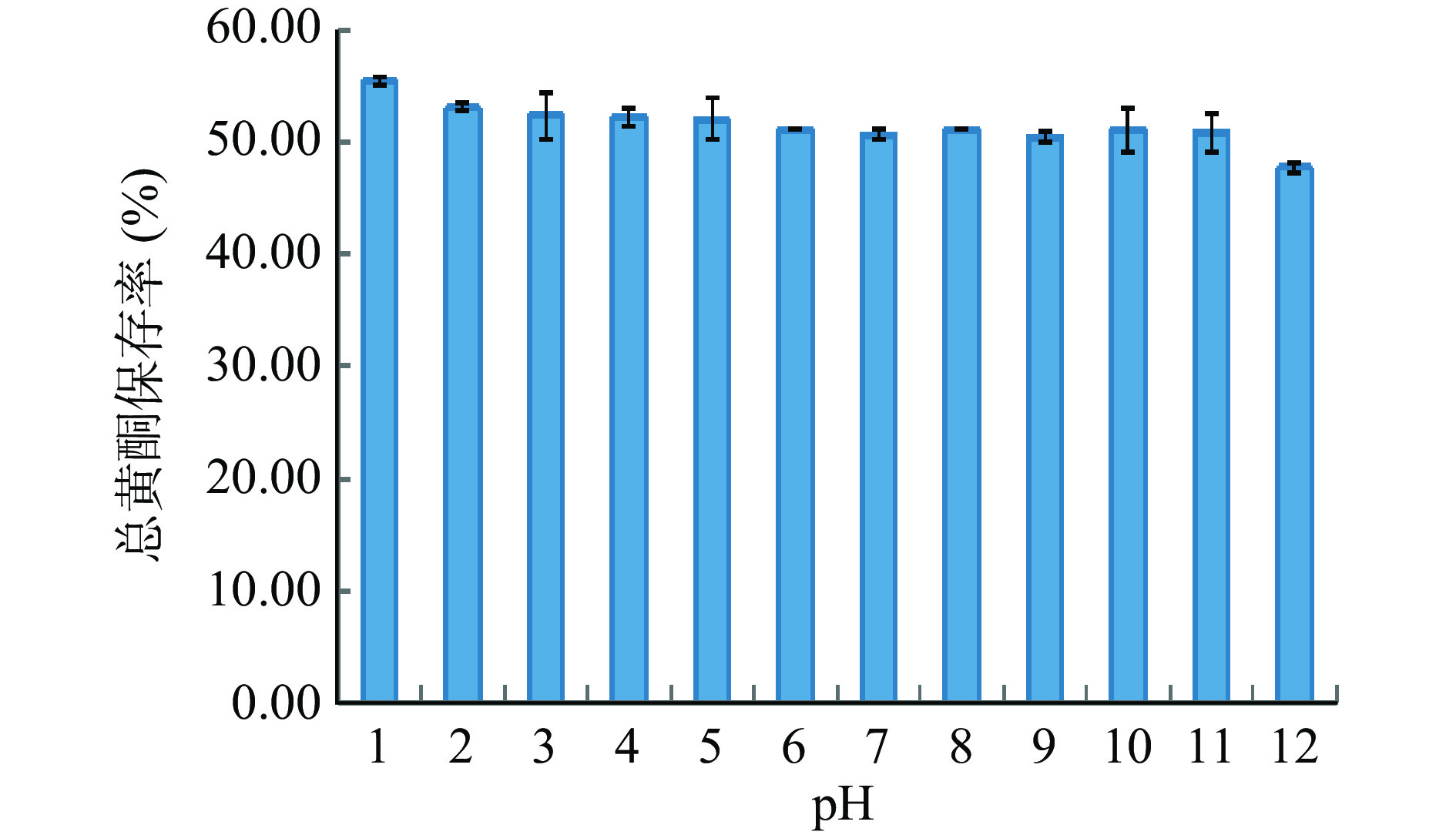
从图8可知:爵床总黄酮在pH4~9环境中趋于稳定。随着pH越小,酸性越强,爵床总黄酮保存率逐渐增大;随着pH越大,碱性越强,爵床总黄酮保存率逐渐降低。分析原因可能是因为爵床总黄酮化合物分子结构γ-吡喃酮环[28]上具有未共有电子对的1-位氧原子,能够与强酸发生反应,干扰黄酮类成分的测定导致爵床总黄酮的含量增大。还可能是由于爵床总黄酮类化合物分子结构中具有酚羟基,能够与碱发生酚羟基醚化反应,导致爵床总黄酮的含量降低[29]。因此爵床总黄酮在生产、贮存时,应避免强酸、强碱的影响。
2.4.4 金属离子对爵床总黄酮稳定性的影响
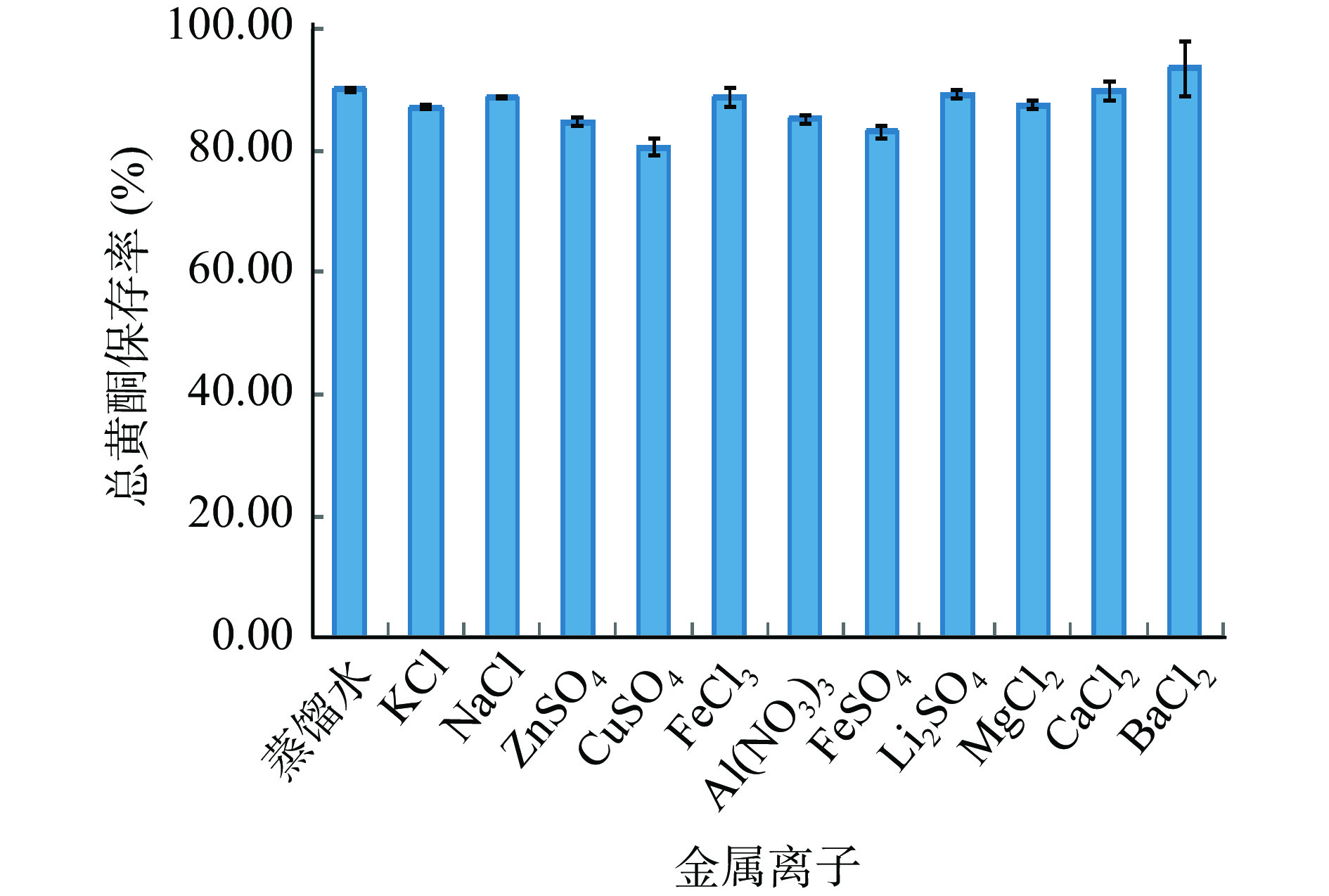
从图9可知:除Ba2+外,其它金属离子对爵床总黄酮含量均有不同程度的降低影响,其中Cu2+、Fe2+、Zn2+、Al3+影响较大,K+、Na+、Fe3+、Li2+、Mg2+、Ca2+影响较小。其原因可能是Cu2+、Fe2+、Zn2+、Al3+与爵床总黄酮中的邻二酚羟基反应生成不溶性络合物。Ba2+使爵床总黄酮含量有所增加,其原因可能是Ba2+与爵床总黄酮反应生成吸光度较强的杂质,干扰爵床总黄酮的测定[30]。因此爵床总黄酮在生产、贮存时,应避免Cu2+、Fe2+、Zn2+、Al3+、Ba2+的影响。
2.5 DPPH自由基清除率的测定
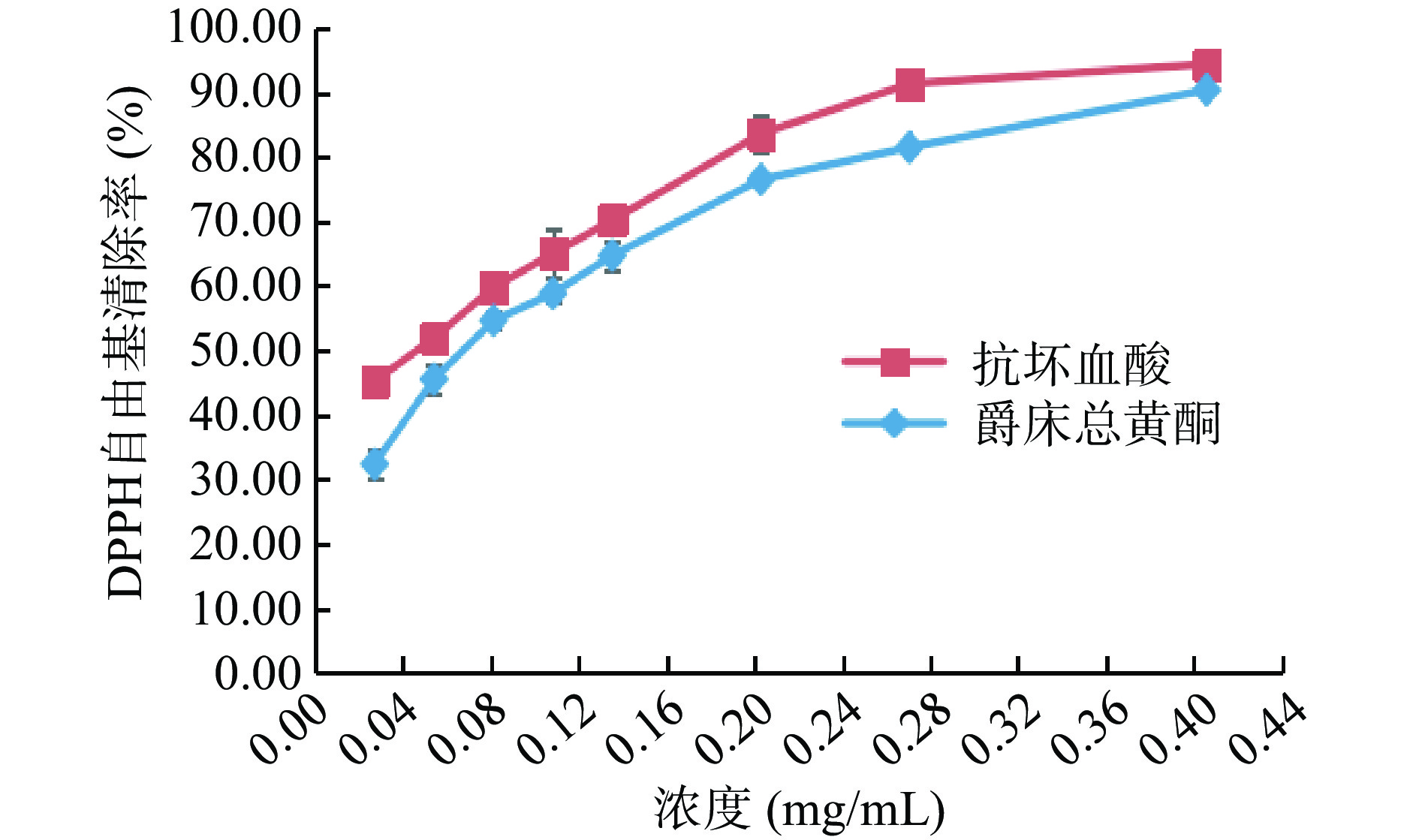
由图10可知,在选定浓度0.027~0.406 mg/mL的范围内,随浓度的逐渐增大,DPPH自由基清除率也逐渐增大,爵床总黄酮组弱于抗坏血酸对照组。当浓度增加至0.406 mg/mL时,爵床总黄酮组DPPH自由基清除率增加到了90.35%,抗坏血酸对照组DPPH自由基清除率增加到了94.37%。计算爵床总黄酮组IC50为0.079 mg/mL,抗坏血酸对照组IC50为0.047 mg/mL,是抗坏血酸对照组的1.68倍。相较抗坏血酸对照组,爵床总黄酮对DPPH自由基清除率虽不及对照组,但表现出一定的抗氧化活性。
3. 结论
通过单因素以及响应面试验,获得爵床总黄酮最佳提取条件为料液比1:23 g/mL、乙醇体积分数55%、提取时间20 min、提取温度70 ℃;提取量为9.02 mg/g。所获加热回流法法提取爵床总黄酮工艺稳定、可靠,能够为爵床总黄酮新药研发、产品开发等提供理论依据。
稳定性试验结果显示,爵床总黄酮在30~90 ℃、pH4~9下较稳定,在强酸、强碱、长时间光照以及金属离子Cu2+、Fe2+、Zn2+、Al3+、Ba2+下不稳定,为其在生产、贮存中爵床总黄酮原料药的稳定性提供保障依据。DPPH自由基清除率的测定结果表明,爵床总黄酮组IC50为79.1 μg/mL,相较抗坏血酸对照组,表现出一定的抗氧化活性,能够为爵床总黄酮在食品、药品等产品研发、新型抗氧剂研发等领域提供新的研究方向。
-
表 1 响应面试验因素和水平
Table 1 Factors and levels of response surface test
水平 因素 A料液比(g/mL) B乙醇体积分数(%) C提取时间(min) D提取温度(℃) −1 1:15 55 20 65 0 1:20 60 30 70 1 1:25 65 40 75 表 2 响应面试验设计与结果
Table 2 Design and results of response surface test
编号 A B C D 总黄酮提取量(mg/g) 1 0 0 1 1 8.21±0.27 2 0 −1 −1 0 8.55±0.11 3 0 1 0 −1 7.55±0.21 4 0 0 1 −1 8.95±0.19 5 1 −1 0 0 8.98±0.07 6 0 1 0 1 6.58±0.15 7 0 −1 1 0 8.45±0.13 8 0 0 0 0 8.68±0.28 9 0 0 0 0 8.63±0.22 10 0 1 −1 0 7.33±0.21 11 1 1 0 0 6.45±0.19 12 0 0 0 0 8.96±0.28 13 0 0 0 0 8.80±0.19 14 −1 −1 0 0 7.60±0.20 15 −1 0 −1 0 8.28±0.14 16 0 −1 0 1 8.18±0.09 17 0 1 1 0 7.82±0.17 18 1 0 1 0 8.19±0.28 19 0 0 −1 1 8.24±0.21 20 −1 0 1 0 8.06±0.15 21 1 0 −1 0 8.56±0.27 22 0 −1 0 −1 8.19±0.31 23 −1 0 0 −1 7.87±0.24 24 1 0 0 −1 8.02±0.29 25 0 0 −1 −1 8.34±0.21 26 1 0 0 1 8.11±0.20 27 −1 0 0 1 7.79±0.10 28 −1 1 0 0 7.22±0.18 29 0 0 0 0 8.76±0.10 表 3 回归模型方差分析
Table 3 Analysis of variance of regression model
方差来源 离均差平方和 自由度 均方 F值 P值 显著性 模型 11.08 14 0.79 19.56 <0.0001 ** A 0.19 1 0.19 4.57 0.0506 B 4.08 1 4.08 100.96 <0.0001 ** C 0.012 1 0.012 0.3 0.594 D 0.27 1 0.27 6.75 0.0211 * AB 1.16 1 1.16 28.57 0.0001 ** AC 0.0056 1 0.0056 0.14 0.7148 AD 0.0072 1 0.0072 0.18 0.679 BC 0.087 1 0.087 2.15 0.1645 BD 0.23 1 0.23 5.7 0.0317 * CD 0.1 1 0.1 2.53 0.1339 A2 1.44 1 1.44 35.69 <0.0001 ** B2 3.65 1 3.65 90.34 <0.0001 ** C2 0.0006 1 0.0006 0.014 0.9059 D2 0.84 1 0.84 20.7 0.0005 ** 残差 0.57 14 0.04 失拟项 0.5 10 0.05 3.1 0.1435 误差 0.065 4 0.016 总和 11.64 28 注:*表示差异显著,P<0.05;**表示差异极显著,P<0.01。 -
[1] 覃祝, 吴和珍, 苏文炀, 等. HPLC波长切换法同时测定爵床中5个黄酮类成分的含量[J]. 药物分析杂志,2015,35(12):2116−2120. [QIN Zhu, WU Hezhen, SU Wenyang, et al. HPLC wavelength switching for simultaneous determination of the contents for 5 flavonoids in Rostellularia[J]. Chin J Pharm Anal,2015,35(12):2116−2120. [2] 吴威巍, 缪刘萍, 王鑫杰. 爵床化学成分研究[J]. 中成药,2013,35(5):985−988. [WU Weiwei, MIAO Liuping, WANG Xinjie, et al. Chemical constituents from Justicia procumbens L doi: 10.3969/j.issn.1001-1528.2013.05.029 J]. Chinese Traditional Patent Medicin,2013,35(5):985−988. doi: 10.3969/j.issn.1001-1528.2013.05.029
[3] LEE J C, LEE C H, SU C L, et al. Justicidin A decreases the level of cytosolic Ku 70 leading to apoptosis in human colorectal cancer cells[J]. Carcinogenesis,2005,26(10):1716−1730. doi: 10.1093/carcin/bgi133
[4] SU C L, HUANG L L, HUANG L M, et al. Caspase-8 acts as a key upstream executor of mitochondria during justicidin A-induced apoptosis in human hepatoma cells[J]. FEBS Lett,2006,580(13):3185−3191. doi: 10.1016/j.febslet.2006.04.085
[5] HE X L, ZHANGP, DONG X Z, et al. JR6, a new compound isolated from Justicia procumbens, induces apoptosis in human bladder cancer EJ cells through caspasedependent pathway[J]. J Ethnopharmacol,2012,144(2):284−292. doi: 10.1016/j.jep.2012.09.010
[6] CHEN C C, HSIN W C, KO F N, et al. Antiplatelet arylnaphthalide lignans from Justicia procumbens[J]. J Nat Prod,1996,59(12):1149−1150. doi: 10.1021/np960443+
[7] ASANO J, CHIBA K, TADA M, et al. Antiviral activity of lignans and their glycosides from Justicia procumbens[J]. Phytochemistry,1996,42(3):713−717. doi: 10.1016/0031-9422(96)00024-6
[8] XU X Y, WANG D Y, KU C F, et al. Anti-HIV lignans from Justicia procumbens[J]. Chin J Nat Med,2019,17(12):945−952.
[9] ZHAO Y, KU C F, XU X Y, et al. Stable axially chiral isomers of arylnaphthalene lignan glycosides with antiviral potential discovered from Justicia procumbens[J]. J Org Chem,2021,86(8):5568−5583. doi: 10.1021/acs.joc.1c00068
[10] 梁生林, 钟卫华, 李庆耀, 等. 爵床提取物抗炎镇痛作用的实验研究[J]. 井冈山大学学报(自然科学版),2020,41(1):86−92. [LIANG Shenglin, ZHONG Weihua, LI Qingyao, et al. Experimentai studies on the anti-inflammatoryi and analgesic effect of Rostellularia procumbens extract[J]. Journal of Jinggangshan University (Natural Science),2020,41(1):86−92. [11] 付英杰, 李悦, 甘娇娥, 等. 爵床抑制肾炎细胞增殖的物质基础及作用机理[J]. 中成药,2018,40(4):783−787. [FU Yingjie, LI Yue, GAN Jiaoe, et al. The active substance of Rostellularia procunbens and its mechanism in inhibiting nephritis cell proliferation[J]. Chinese Traditional Patent Medicin,2018,40(4):783−787. doi: 10.3969/j.issn.1001-1528.2018.04.004 [12] 卢水木, 刘峰领, 张心意, 等. 爵床总黄酮含量测定方法及对羟基自由基的清除[J]. 西北民族大学学报(自然科学版),2014,35(1):22−26. [LU Shuimu, LIU Fengling, ZHANG Xinyi, et al. Determination method of total flavonoid content of the bed and scavenging of hydroxyl radicals[J]. Journal of Northwest University for Nationalities (Natural Science),2014,35(1):22−26. doi: 10.14084/j.cnki.cn62-1188/n.2014.01.006 [13] 周燕芳, 丁冬纯. AB-8大孔树脂分离纯化爵床总黄酮的研究[J]. 湖北农业科学,2009,48(12):3123−3126. [ZHOU Yanfang, DING Dongchun. Isolation and purification of total flavonoids from Acanthaceae by AB-8 resin[J]. Hubei Agricultural Sciences,2009,48(12):3123−3126. doi: 10.3969/j.issn.0439-8114.2009.12.068 [14] 马俊鹏, 马迪, 安晓晶, 等. 响应面法优化天山花楸总黄酮回流提取工艺[J]. 中成药,2017,39(3):509−512. [MA Junpeng, MA Di, AN Xiaojing, et al. Optimization of reflux extraction for total flavonoids from Sorbus tianshanica by response surface method[J]. Chinese Traditional Patent Medicin,2017,39(3):509−512. doi: 10.3969/j.issn.1001-1528.2017.03.013 [15] 陈建福, 陈健旋, 林媛, 等. 芥菜总黄酮超声辅助提取工艺优化及其脂质抗氧化研究[J]. 食品研究与开发,2021,42(8):93−100. [CHEN Jianfu, CHEN Jianxuan, LIN Yuan, et al. Optimization of ultrasound-assisted total flavonoid extraction from Brassica juncea and lipid antioxidant activity of the extract[J]. Food Research and Development,2021,42(8):93−100. doi: 10.12161/j.issn.1005-6521.2021.08.016 [16] 张建和, 符伟玉, 佘戟. 蜂胶醇冷浸法提取物中总黄酮含量的测定[J]. 广东医学院学报,2004(4):419−420. [ZHANG Jianhe, FU Weiyu, SHE Ji, et al. Determination of total flavonoid content in propolis alcohol cold-soaked extracts[J]. Journal of Guangdong Medical College,2004(4):419−420. [17] 张爱莲, 戚华溢, 叶其, 等. 爵床的化学成分研究(英文)[J]. 应用与环境生物学报,2006(2):170−175. [ZHANG Ailian, QI Huayi, YE Qi, et al. Chemical study on Rostellularia procumbens[J]. Chinese Journal of Applied & Environmental Biology,2006(2):170−175. doi: 10.3321/j.issn:1006-687X.2006.02.006 [18] 梁浩楠, 刘庆波, 凌佳音, 等. 酶法-超声提取白花蛇舌草总黄酮工艺研究[J]. 中国药学杂志,2021,56(13):1041−1047. [LIANG Haonan, LIU Qingbo, LING Jiayin, et al. Extraction of total flavonoids from Hedyotis diffusa by enzymatic-ultrasonic assisted method[J]. Chin Pharm J,2021,56(13):1041−1047. [19] 秦晶晶, 钱慧琴, 赵媛, 等. 柿叶总黄酮提取工艺优化及其抗氧化活性[J]. 食品工业科技,2020,41(13):32−38,45. [QIN Jingjing, QIAN Huiqin, ZHAO Yuan, et al. Optimization of the extraction technology of total flavonoids and in vitro antioxidant activity of extract from Persimmon leaves [J]. Science and Technology of Food Industry,2020,41(13):32−38,45. [20] 李可心, 张玉, 周冉冉, 等. 麻城黄金菊总黄酮提取工艺优化及稳定性分析[J]. 酿酒,2021,48(3):44−50. [LI Kexin, ZHANG Yu, ZHOU Ranran, et al. Optimization of extracting procedure and stability test of total flavonoids from Perennial Chamomile[J]. Liquor Making,2021,48(3):44−50. doi: 10.3969/j.issn.1002-8110.2021.03.017 [21] 桂利利, 吴正坤, 余惠凡, 等. 黄药叶总黄酮提取工艺优化及其抗氧化活性研究[J]. 食品研究与开发,2021,42(19):100−108. [GUI Lili, WU Zhengkun, YU Huifan, et al. Optimization of extraction and antioxidant activity of total flavonoids from Premna cavaleriei Levl. leaves[J]. Food Research and Development,2021,42(19):100−108. doi: 10.12161/j.issn.1005-6521.2021.19.015 [22] 许地元, 叶萍, 李海丽, 等. 苞叶雪莲总黄酮提取工艺优化及其粗提物抗肿瘤活性[J]. 江苏农业科学,2021,49(4):130−134. [XU Diyuan, YE Ping, LI Haili, et al. Optimization of total flavonoid extraction process of Saussurea obvallata and its anti-tumor activity of crude extracts[J]. Jiangsu Agricultural Sciences,2021,49(4):130−134. doi: 10.15889/j.issn.1002-1302.2021.04.025 [23] 许洪波, 李铂, 唐志书, 等. 拐枣中总黄酮提取工艺优化及其抗黄嘌呤氧化酶活性研究[J]. 天然产物研究与开发,2019,31(4):595−600,716. [XU Hongbo, LI Bo, TANG Zhishu, et al. Optimization of extraction of total flavonoids from Hovenia acerba and its xanthine oxidase inhibitory activity[J]. Nat Prod Res Dev,2019,31(4):595−600,716. [24] 黄桂丽, 吴牧容, 马佳佳, 等. 枇杷幼果总黄酮提取工艺优化及其抗氧化活性分析[J]. 食品安全质量检测学报,2020,11(10):3112−3118. [HUANG Guili, WU Murong, MA Jiajia, et al. Optimization of extraction process of total flavonoids from young loquat friut and analysis of its antioxidant activity[J]. Journal of Food Safety and Quaity,2020,11(10):3112−3118. [25] 林继辉, 谢冰冰, 冯庆玲, 等. 石仙桃总黄酮提取工艺及体外抗氧化性研究[J]. 云南民族大学学报(自然科学版),2022,31(4):385−394. [LIN Jihui, XIE Bingbing, FENG Qingling, et al. Study on ultrasonic-assisted extraction of total flavonoids and antioxidant activity from Pholidota chinensis Lindl[J]. Journal of Yunnan Nationalities University (Natural Sciences Edition),2022,31(4):385−394. [26] 李慧, 刘俊果, 冯方圆, 等. 桑葚中黄酮提取方法比较与优化及稳定性研究[J]. 应用化工,2021,50(10):2770−2774. [LI Hui, LIU Junguo, FENG Fangyuan, et al. Comparison and optimization of extraction methods of flavonoids from mulberry and its stability[J]. Applied Chemical Industry,2021,50(10):2770−2774. doi: 10.3969/j.issn.1671-3206.2021.10.031 [27] KHALIL N, BISHR M, DESOUKY S, et al. Ammi visnaga L. a potential medicinal plant: A review[J]. Molecules, 2020, 25(2).
[28] 何莉萍, 严碧云, 黄亚, 等. 荷叶总黄酮稳定性的研究[J]. 粮食与油脂,2017,30(2):80−82. [HE Liping, YAN Biyun, HUANG Ya, et al. Study on stability of total flavonoids from lotus leaf[J]. Cereals and Oils,2017,30(2):80−82. doi: 10.3969/j.issn.1008-9578.2017.02.020 [29] 黄琼, 谢向机, 林嘉丽, 等. 洛神花总黄酮提取工艺及其稳定性研究[J]. 保鲜与加工,2021,21(2):102−108. [HUANG Qiong, XIE Xiangji, LIN Jiali, et al. Study on extraction technology and stability of total flavonoids from Roselle[J]. Storage and Process,2021,21(2):102−108. doi: 10.3969/j.issn.1009-6221.2021.02.016 [30] 于晶, 郝再彬, 苍晶, 等. 黄酮类化合物的活性研究进展[J]. 东北农业大学学报,2021,21(2):102−108. [YU Jing, HAO Zaibin, CANG Jing, et al. Research development of flavonoids activity[J]. Journal of Northeast Agricultural University,2021,21(2):102−108. doi: 10.19720/j.cnki.issn.1005-9369.2008.12.028





 下载:
下载:




 下载:
下载:



