Optimization of Extraction Process of Essential Oil from Bergamot Peel and Analysis of Its Components and Antioxidant Activity
-
摘要: 本研究采用纤维素酶辅助水蒸气蒸馏提取法提取佛手果皮精油,在以酶解pH、酶添加量、酶解温度及酶解时间作为单因素分析的基础上,通过Box-Behnken响应面设计法进行提取工艺优化。利用气相色谱-质谱(Gas Chromatography-Mass Spectrometry,GC-MS)法分析提取的精油的化学组成,最后以ABTS+·和DPPH·清除率为指标,评价佛手果皮精油的抗氧化活性。结果表明,佛手果皮精油最佳提取工艺为:酶解pH5.2、酶添加量0.7%、酶解温度52 ℃、酶解时间2.1 h,此条件下精油得率为3.11%。从提取的果皮精油中共鉴定出42种化合物,其中乙酸芳樟酯的相对含量最高(14.72%),其次为d-柠檬烯(14.58%)、芳樟醇(8.89%)。抗氧化活性研究结果显示:该法提取的佛手果皮精油在试验浓度范围内具有良好的抗氧化活性,并呈现明显量效关系。当精油浓度为40 mg/mL时,其对ABTS+·的清除率为91.20%;浓度达70 mg/mL时,其对DPPH·的清除率达93.19%。此优化工艺精油得率高,且佛手果皮精油其可作为天然抗氧化剂进行开发。
-
关键词:
- 佛手果皮 /
- 精油提取 /
- 响应面优化 /
- 气相色谱-质谱法(GC-MS) /
- 抗氧化活性
Abstract: In this study, cellulase-assisted steam distillation was used to extract essential oil from bergamot peel. Based on the single factor analysis of enzymatic hydrolysis pH, enzymatic addition amount, enzymatic hydrolysis temperature and enzymatic hydrolysis time, the extraction process was optimized by using Box-Behnken response surface design method. Moreover, the chemical compositions of the extracted essential oil were analyzed by Gas chromatography-mass Spectrometry (GC-MS). Finally, the antioxidant activities of the essential oil was evaluated by the scavenging rates of ABTS+· and DPPH·. According to the research results, 3.11% yield of essential oil was achieved under the optimal extraction conditions: enzymatic hydrolysis of pH5.2, enzymatic dosage of 0.7%, enzymatic hydrolysis temperature of 52 ℃, and enzymatic hydrolysis time of 2.1 h. A total of 42 compounds were identified from the extracted peel essential oils. Among them, linalool acetate had the highest (14.72%) relative content, followed by d-limonene (14.58%) and linalool (8.89%). Besides, according to the results of antioxidant activity study, the essential oil extracted by this method presented good antioxidant activity in the experimental concentration range, and showed an obvious dose-effect relationship. The scavenging rate of ABTS+· reached 91.20% when the concentration of essential oil was 40 mg/mL; and the scavenging rate of DPPH· reached 93.19% when the concentration of essential oil was 70 mg/mL. Therefore, this optimized process has high yield of essential oil and can be developed as a natural antioxidant. -
佛手(Citrus medica L. var. sarcodactylis Swingle)为芸香科柑橘属植物,又名佛手柑、福寿橘等,因其形状似人手指肉条状而得名[1],主产于川、浙、闽粤等省[2]。佛手中含有多种活性物质,其中精油是富含于佛手果皮中并具有药理活性的主要成分之一[3]。现众多研究表明佛手精油具有抗氧化[4]、抑菌[5]、杀虫[6]、抗肿瘤[7]和抗抑郁[8]等功效,因此其被广泛开发应用为功能性食品[9-10]。
目前植物精油的提取多采用水蒸气蒸馏法,在此基础上应用超声波、微波及酶解等手段辅助提取是当前工艺优化研究的热点。酶辅助提取是利用酶的专一性,选择特定的酶水解植物细胞壁结构,促使被束缚在细胞中的活性物质更多溶出,因具有高效高产、绿色节能等特点被广泛应用于各类植物精油的提取[11]。吕橄等[12]采用纤维素酶辅助水蒸气蒸馏法提取柚皮精油,通过单因素和响应面优化后精油得率较传统水蒸馏法提高了180%。辜雪冬等[13]比较酶辅助和传统蒸馏方式对柠檬果皮精油得率的影响,结果表明酶辅助法提取效率更高。徐兴堂等[14]通过单因素实验优化兴安落叶松针叶精油提取工艺,发现混合酶预处理组的精油得率比未处理组提高了38.2%。因此,酶辅助提取具有较好的应用前景。
现有研究中,佛手精油提取多以整果作为原料[15-17],导致资源消耗大,生产效率低。因此,本研究单取佛手果皮作为研究对象,采用纤维素酶辅助水蒸气提取法,通过响应面法确定果皮精油的最佳提取工艺,提高精油得率的同时又做到节省原料,降低成本。并通过GC-MS法对其组成成分进行定性分析,同时以DPPH·和ABTS+·的清除试验评价果皮精油的抗氧化活性,为佛手果皮精油进一步开发研究提供基础理论数据。
1. 材料与方法
1.1 材料与仪器
新鲜佛手 八、九分熟,购自乐山市五通桥区佛手中药材专业合作社;纤维素酶(酶活≥10000 U/g)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2'-Azinobis-(3-ethylbenzothiazoline-6-sulphonate),ABTS)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl, DPPH) 上海麦克林生化科技有限公司;二氯甲烷(色谱纯)、过硫酸钾、氯化钠、无水硫酸钠、石油醚、无水乙醇(均为分析纯) 成都市科隆化学品有限公司;试验用水 超纯水。
Multiskan SkyHigh型全波长酶标仪 赛默飞世尔科技(中国)有限公司;DZKW-4型电热恒温水浴锅 北京中兴伟业世纪仪器有限公司;ZNHW2000ML型电热套 上海濮安生物科技有限公司;PSH-3G型pH计 上海仪电科学仪器股份有限公司;FW-200型高速万能粉碎机 北京中兴伟业仪器有限公司;DHG-9245A型电热鼓风干燥箱 上海一恒科学仪器有限公司;WP-UPT-20型超纯水仪 四川沃特尔水处理设备有限公司;SQP型电子分析天平 赛多利斯科学仪器(北京)有限公司。
1.2 实验方法
1.2.1 佛手果皮精油提取
切取佛手果皮,干燥粉碎过60目筛,得到佛手果皮粉末。称取佛手果皮粉末45.00 g于1000 mL圆底烧瓶中,加入7.2 g NaCl、360 mL超纯水,再加入一定量的纤维素酶,调节pH后用玻璃棒搅拌均匀,封口置于水浴锅中,设定温度和时间后进行酶解。酶解处理完成后,连接蒸馏装置,采用电热套加热至微沸保持,水蒸气蒸馏提取2 h,用分液漏斗收集冷凝液,静置24 h后水油分离,得到上层精油。加入适量无水硫酸钠去除少量水分,称重,计算精油得率。
1.2.2 单因素实验
1.2.2.1 酶解pH对精油得率的影响
设置酶解pH分别为4.5、5.0、5.5、6.0、6.5,酶添加量0.7%(w酶/w果皮粉末),酶解温度50 ℃,酶解时间1.5 h,按照1.2.1中所述方法进行佛手果皮精油提取,并计算精油得率。
1.2.2.2 酶添加量对精油得率的影响
设置酶添加量分别为0.4%、0.5%、0.6%、0.7%、0.8%,酶解pH5.0,酶解温度50 ℃,酶解时间1.5 h,按照1.2.1中所述方法进行佛手果皮精油提取,并计算精油得率。
1.2.2.3 酶解温度对精油得率的影响
设置酶解温度分别为40、45、50、55、60 ℃,酶解pH5.0,酶添加量0.7%,酶解时间1.5 h,按照1.2.1中所述方法进行佛手果皮精油提取,并计算精油得率。
1.2.2.4 酶解时间对精油得率的影响
设置酶解时间分别为0.5、1.0、1.5、2.0、2.5 h,酶解pH5.0,酶添加量0.7%,酶解温度50 ℃,按照1.2.1中所述方法进行佛手果皮精油提取,并计算精油得率。
1.2.3 响应面试验
在单因素实验结果的基础上,以得率为响应值,按照响应面(Response surface methodology,RSM)方法中的Box-Behnken Design(BBD)试验设计原理,设计对纤维素酶辅助提取佛手果皮精油工艺进行四因素三水平的响应面优化试验。试验因素及水平设计见表1。
表 1 Box-Behnken 设计因素与水平表Table 1. Factors and levels of Box-Behnken experimental design因素 水平 −1 0 1 A(酶解pH) 4.5 5.0 5.5 B(酶添加量/%) 0.6 0.7 0.8 C(酶解温度/℃) 45 50 55 D(酶解时间/h) 1.5 2.0 2.5 1.2.4 佛手果皮精油得率的计算
佛手果皮精油得率(%)=mM×100 式中:m表示提取到精油的质量,g;M表示加入果皮粉末的质量,g。
1.2.5 GC-MS分析佛手果皮精油成分
1.2.5.1 色谱条件
色谱柱:HP-5MS 石英毛细管柱(30 m×0.25 mm×0.25 μm);升温程序:初始温度40 ℃,保持5 min,以8 ℃/min升温至160 ℃,保持2 min,再以5 ℃/min升温至240 ℃,保持2 min,再以10 ℃/min升温至270 ℃,保持5 min。进样口温度270 ℃,载气为氦气,流量1.21 mL/min,进样量1 μL;分流比10:1。
1.2.5.2 质谱条件
电子轰击离子源;电子能量70 eV;离子源温度:200 ℃;接口温度260 ℃,溶剂延迟:2.30 min;扫描离子质量范围:35~500 amu。对照质谱库NIST17结合参考文献进行成分定性,使用面积归一化法计算佛手果皮各组分的相对含量。
1.2.6 佛手果皮精油对ABTS+·清除能力测定
参照刘欢等[18]的方法:配制7 mmol/L ABTS溶液,与2.55 mmol/L K2S2O8等体积混合后,置于黑暗处12 h即配制成ABTS储备液。然后用无水乙醇稀释到在734 nm处吸光值为0.7±0.02的ABTS工作液,备用。用无水乙醇将佛手果皮精油稀释成浓度为15、20、25、30、35、40 mg/mL的精油溶液,分别取各浓度精油溶液100 μL于96酶标孔板中,然后吸取上述ABTS工作液2 mL加入各孔。于黑暗处静置30 min,酶标仪测定其在734 nm处吸光值,每组做3个平行试验,取平均值Ac。用无水乙醇代替精油溶液作为空白对照测定其吸光值As。无水乙醇代替ABTS工作液测得吸光值Ax。以等浓度梯度的VC溶液作为阳性对照,清除率按下式计算:
R=As−(Ac−Ax)As×100 式中:R表示清除率,%;As表示空白组吸光值;Ac表示样品组吸光值;Ax表示无水乙醇代替ABTS工作液所得吸光值。
1.2.7 佛手果皮精油对DPPH·清除能力测定
参照李晓娇等[19]的方法:用无水乙醇将佛手果皮精油稀释成浓度为45、50、55、60、65、70 mg/mL精油溶液,移液枪移取各浓度精油溶液100 μL于离心管中,再移取配制好的1 mmol/L DPPH乙醇溶液2 mL,于暗处振荡反应30 min。酶标仪测定其在517 nm处吸光值,每组做3个平行试验,取平均值Aj。用无水乙醇代替精油溶液作为空白对照测定其吸光值Ak。无水乙醇代替DPPH乙醇溶液测得吸光值Ai。以等浓度梯度的VC溶液作为阳性对照,清除率按下式计算:
R=Ak−(Aj−Ai)Ak×100 式中:R表示清除率,%;Ak表示空白组吸光值;Aj表示样品组吸光值;Ai表示无水乙醇代替DPPH乙醇液所得吸光值。
1.3 数据处理
响应面分析采用软件Design-Expert 10软件。数据及显著性分析采用Excel、SPSS 25.0软件,以P<0.01表示极显著性差异,0.01<P<0.05表示显著性差异。作图采用Origin 2018软件。
2. 结果与分析
2.1 单因素实验结果
2.1.1 酶解pH对精油得率的影响
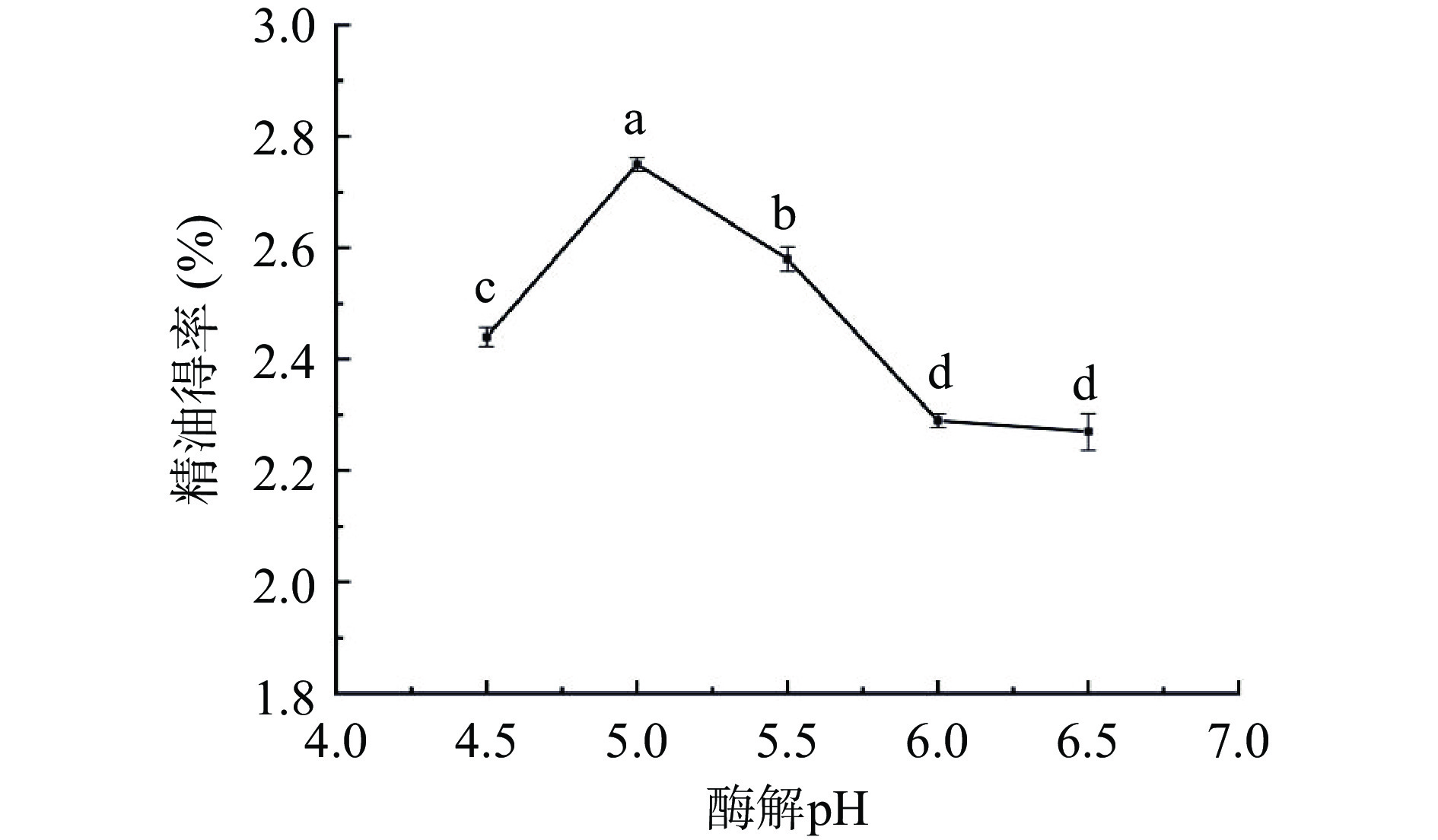
不同酶解pH处理对佛手果皮精油得率的影响如图1所示。当pH从4.5上升到5.0时,精油得率显著提高至2.75%(P<0.05)。但当进一步提高酶解pH时,精油得率却骤降,至pH为6.0时趋于平稳,当pH达到6.5时,精油得率最低,仅有2.26%。分析可能的原因是当pH达到5.0时,纤维素酶活性最大,当pH增大时,纤维素酶逐渐处于不适宜的环境下,其活性受到影响甚至失活,进而导致精油得率逐渐下降[20]。所以本试验中酶解pH范围选择在5.0左右为最佳。
2.1.2 酶添加量对精油得率的影响
不同酶添加量处理对佛手果皮精油得率的影响如图2所示。酶添加量在0.4%~0.6%范围内,精油得率涨幅不大,可能该范围内少量的纤维酶不能充分与底物反应。随着酶添加量持续增加到0.7%时,得率达最高为2.72%,显著高于其他水平(P<0.05)。在0.4%~0.7%的酶添加量范围内,此时底物浓度相对较高,酶促反应速度与酶添加量成正比,2 h内的精油得率也随之升高。当酶添加量在0.7%~0.8%范围内,得率略有下降,可能是由于酶添加量过大时,底物浓度相对较小,纤维素酶被饱和,酶添加量继续增加,反应速度也无法加快,不仅造成精油的损失,同时增添了不必要的生产成本[21]。因此,本试验中酶添加量范围选择0.7%左右为宜。
2.1.3 酶解温度对精油得率的影响
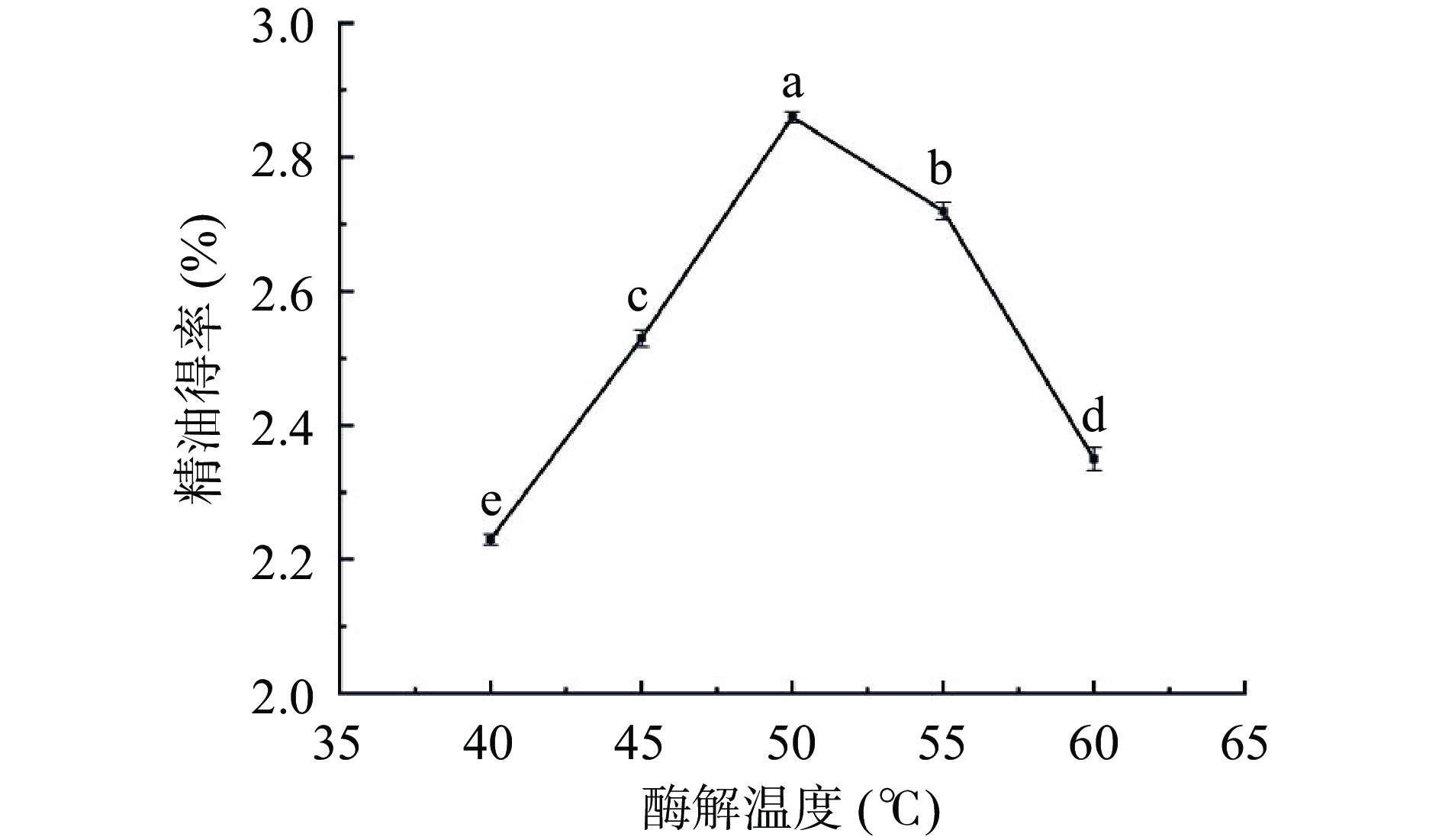
不同酶解温度处理对佛手果皮精油得率的影响如图3所示。在试验温度范围内,精油得率先增后降,其中酶解温度达到50 ℃时,得率达到最大值2.86%。当温度进一步升高时,精油得率逐渐下降,这是可能是由于温度越高,纤维素酶逐渐失活,进而导致得率降低[21]。所以本试验适宜的酶解温度范围为50 ℃左右。
2.1.4 酶解时间对精油得率的影响
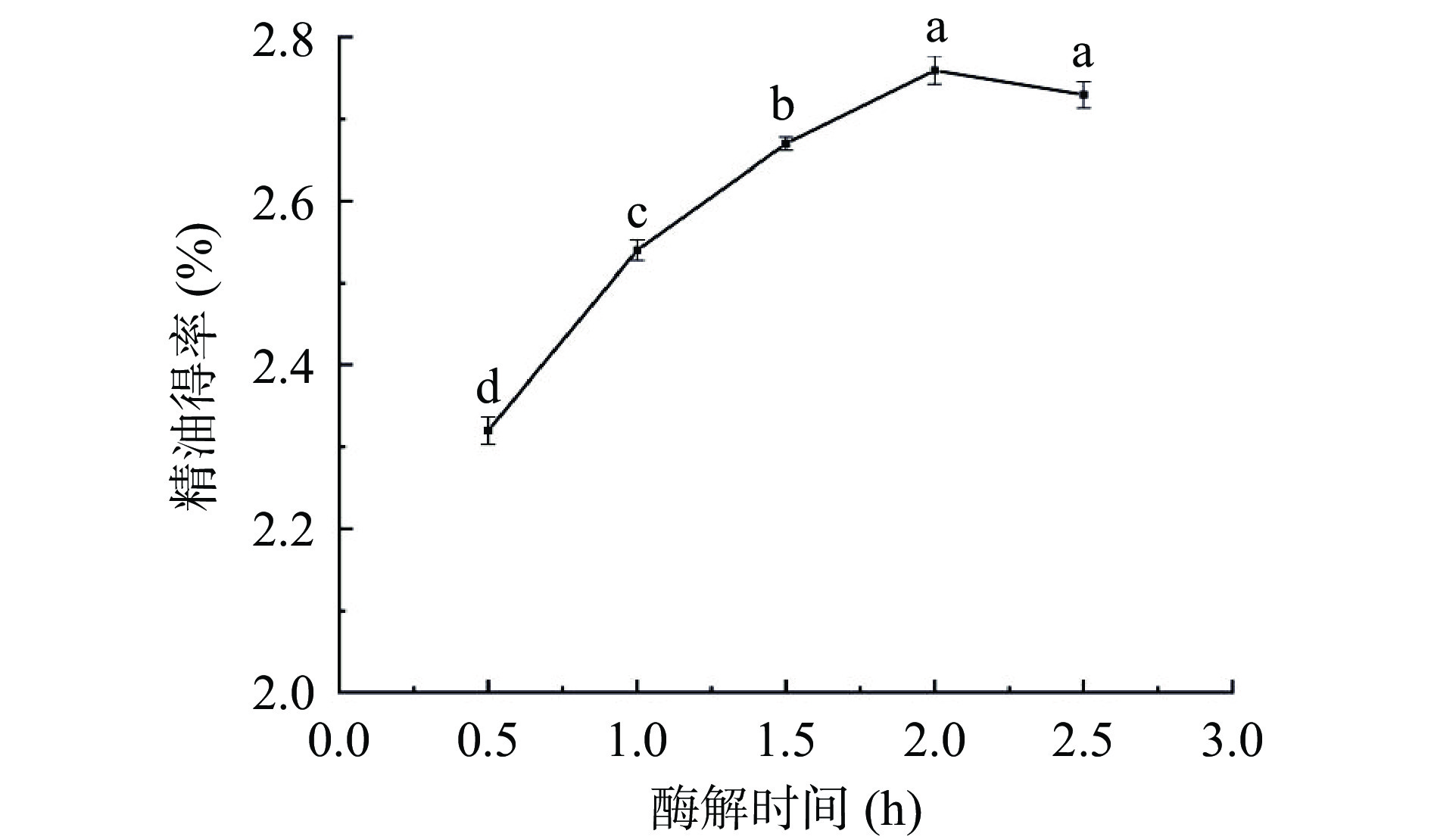
不同酶解时间处理对佛手果皮精油得率的影响如图4所示。在0.5~2.0 h时间范围内,精油得率随着时间推移而逐渐升高,当酶解时间达到2 h时,精油得率显著提升至2.76%(P<0.05)。但当继续增加酶解时间达到2.5 h后,发现精油得率略有下降,可能酶解反应完成后由于酶解时间过长,精油出现少许逸散[12],因此本试验的酶解时间在2 h左右为宜。
2.2 响应面优化试验结果
2.2.1 响应面试验设计与结果
在前期试验结果的基础上,根据Box-Behnken试验设计原理,进行四因素三水平试验设计,方案设计与结果见表2。
表 2 响应面试验设计及结果Table 2. Response surface test design and results试验编号 A B C D Y(精油
得率(%))1 −1 0 0 1 2.52 2 −1 −1 0 0 2.33 3 0 0 1 1 2.85 4 −1 1 0 0 2.65 5 0 0 1 −1 2.49 6 0 0 0 0 3.05 7 0 0 0 0 3.06 8 1 −1 0 0 2.78 9 0 0 −1 −1 2.22 10 0 0 −1 1 2.40 11 1 0 1 0 2.74 12 0 −1 0 −1 2.53 13 1 0 0 −1 2.51 14 −1 0 1 0 2.61 15 1 0 −1 0 2.44 16 0 0 0 0 3.02 17 1 0 0 1 2.85 18 0 0 0 0 3.06 19 −1 0 0 −1 2.4 20 0 1 0 1 2.92 21 0 0 0 0 3.04 22 0 −1 −1 0 2.33 23 −1 0 −1 0 2.26 24 0 1 0 −1 2.35 25 1 1 0 0 2.65 26 0 1 1 0 2.80 27 0 1 −1 0 2.38 28 0 −1 1 0 2.72 29 0 −1 0 1 2.63 2.2.2 模型的建立及方差分析
运用Design Expert软件对试验数据进行多元回归拟合,获得精油得率(Y)与酶解pH(A)、酶添加量(B)、酶解温度(C)及酶解时间(D)之间的二次回归拟合方程:
Y=3.05+0.10A+0.036B+0.18C+0.14D−0.11AB−0.012AC+0.055AD+7.500E−003BC+0.12BD+0.045CD−0.24A2−0.20B2−0.30C2−0.25D2
利用Design Expert 10.0软件对试验结果进行分析。响应面试验方差分析结果见表3。
表 3 响应面二次回归方程模型方差分析Table 3. Response surface quadratic regression equation model variance analysis方差来源 平方和 自由度 均方 F值 P值 显著性 模型 1.93 14 0.14 126.42 <0.0001 ** A 0.12 1 0.12 110.32 <0.0001 ** B 0.015 1 0.015 14.17 0.0021 ** C 0.40 1 0.40 364.09 <0.0001 ** D 0.23 1 0.23 213.66 <0.0001 ** AB 0.051 1 0.051 46.54 <0.0001 ** AC 6.250E-004 1 6.250E-004 0.57 0.4610 NS AD 0.012 1 0.012 11.12 0.0049 ** BC 2.250E-003 1 2.250E-003 0.21 0.6562 NS BD 0.055 1 0.055 50.77 <0.0001 ** CD 8.100E-003 1 8.100E-003 7.45 0.0163 * A2 0.36 1 0.36 335.42 <0.0001 ** B2 0.25 1 0.25 228.89 <0.0001 ** C2 0.58 1 0.58 535.50 <0.0001 ** D2 0.39 1 0.39 360.63 <0.0001 ** 残差 0.015 14 1.088E-003 失拟检验 0.014 10 1.411E-004 5.04 0.0665 NS 纯误差 1.120E-003 4 2.800E-004 总误差 1.94 28 注:“**”差异极显著(P<0.01);“*”差异显著((0.01<P<0.05);“NS”不显著(P>0.05)。 由方差分析可得,该模型的P<0.0001,说明该二次方程模型极显著,失拟项P>0.05不显著,说明该二次方程模型拟合度高,误差小,决定系数R2=0.9572,说明该回归模型的拟合情况良好,回归方程代表性好,95.72%的精油得率与各因素变量之间关系可以用此模型解释。模型校正系数Radj2=0.9843,与R2接近,表明实测值和模型预测值具有较好的相关性,该模型可信度较高,该回归方程模型可以用于优化佛手果皮精油提取工艺。
表3中F值大小代表各因素对精油得率影响的强弱,F值越大,其影响越强。表中各因素对佛手果皮精油得率的影响程度大小排序以此为酶解温度(C)>酶解时间(D)>酶解pH(A)>酶添加量(B)。其中A、B、C、D、AB、AD、BD、A2、B2、C2、D2对精油得率有极显著影响(P<0.01);CD对精油得率有显著影响(P<0.05)。
2.2.3 响应面分析及最优条件验证
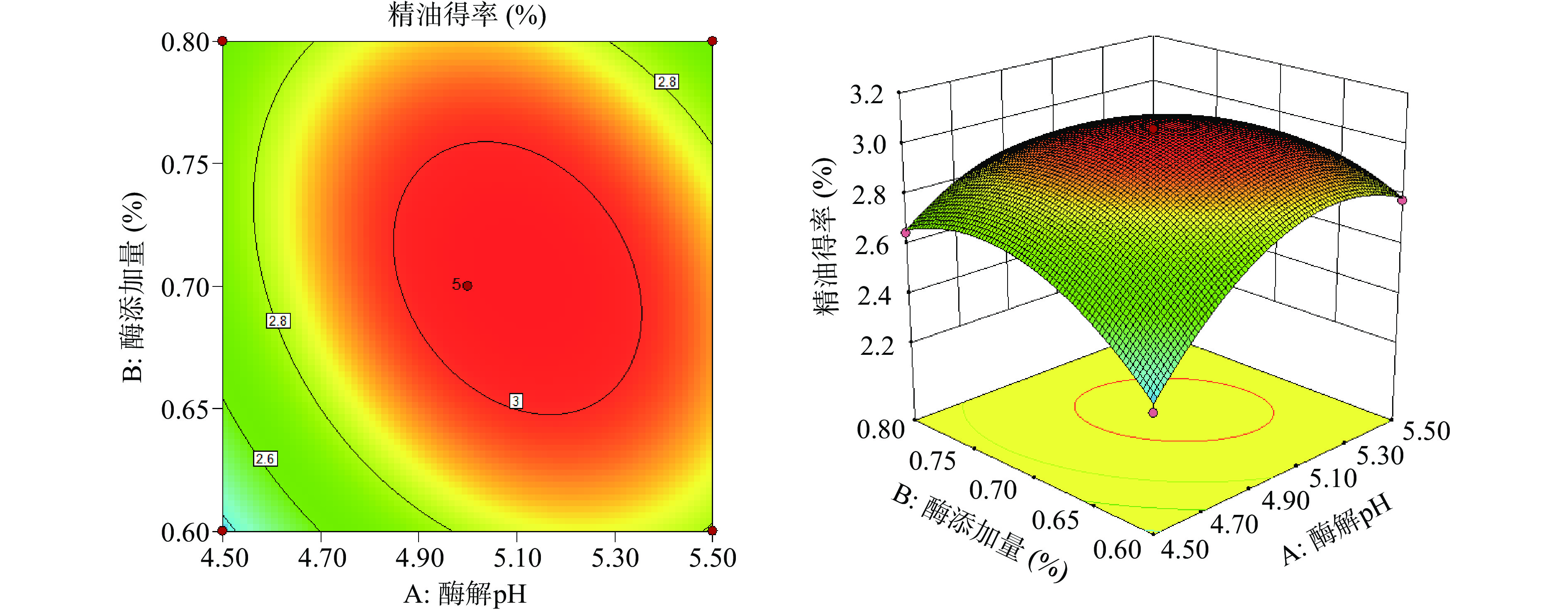
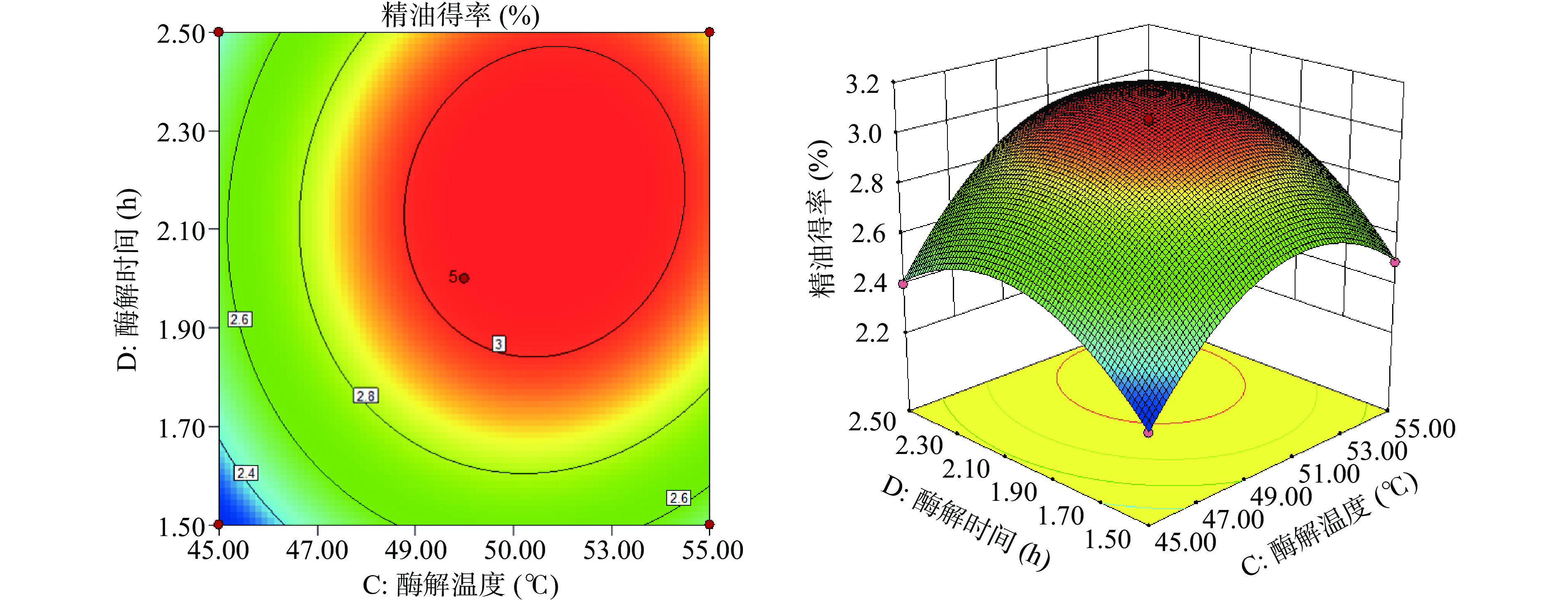
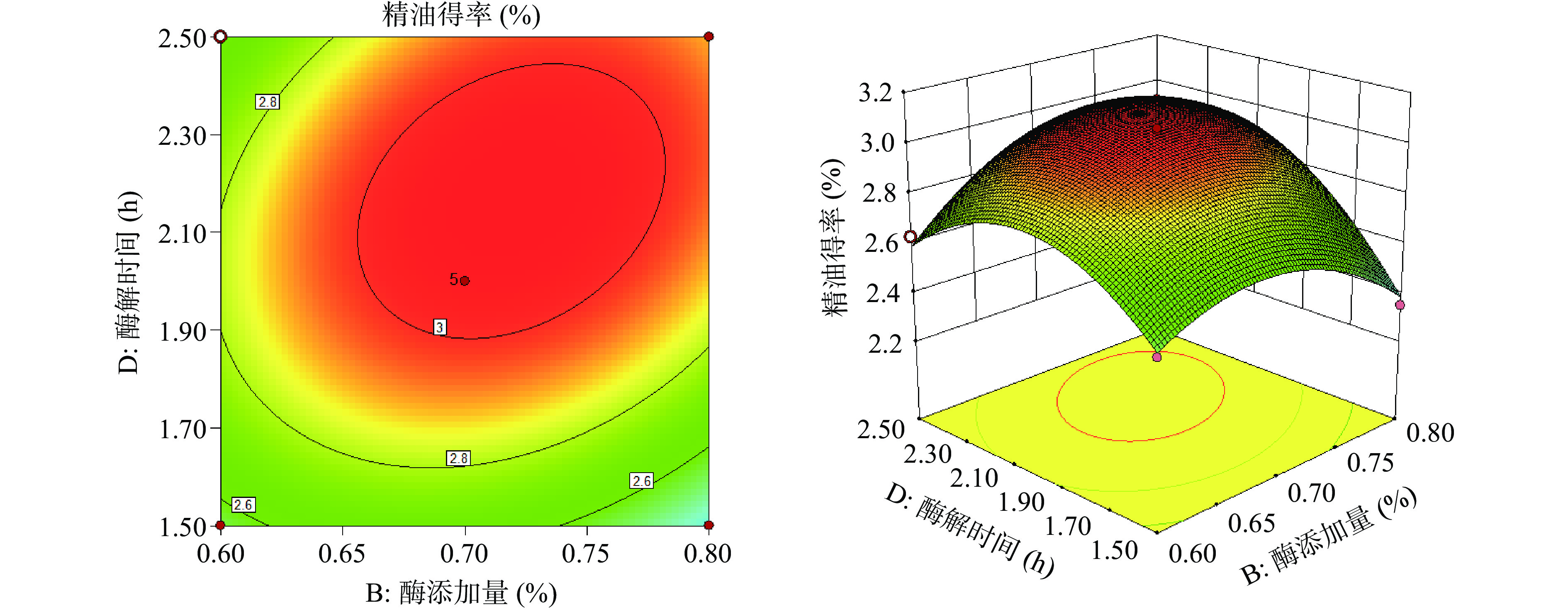
根据构建的回归模型作响应曲面图,考察佛手果皮精油各提取条件间交互作用与精油得率之间的响应曲面图,结果如图5~图8所示。等高线平面图中,等高线的中心区域佛手果皮精油得率最高,由中心向边缘逐渐降低。等高线呈椭圆形说明两因素之间交互作用较强,呈圆形则说明交互作用较弱。在3D响应图中,曲面越陡峭表示响应值变化越快,即两因素交互作用越显著。从图5~图8中可以得出,图5和图7中的等高线图呈椭圆形,且3D响应图中曲面最为陡峭,说明酶解pH和酶添加量两因素和酶添加量和酶解时间两因素之间均具有较强的交互作用,对精油得率的影响极显著。另外,酶解温度和酶解时间之间的3D响应图中的曲面也较为陡峭,表明这几组因素之间的交作用对精油得率的影响显著。
对回归方程进行求解,获得佛手果皮精油最佳提取工艺:酶解pH5.215、酶添加量0.701%、酶解温度52.327 ℃、酶解时间2.108 h。此时佛手果皮精油得到最大,为3.091%。为了方便试验操作,将最佳提取工艺修正成:酶解pH5.2、酶添加量0.7%、酶解温度52 ℃、酶解时间2.1 h。经过三次验证试验,佛手果皮精油平均得率为3.11%,说明该数学模型可靠。该工艺操作简便,绿色环保,纤维素酶产品性质稳定,易于获取且成本低廉,相对文献[22-23]所报道的有较高的提取率,因此该工艺具有较好的应用前景。
2.3 GC-MS结果分析
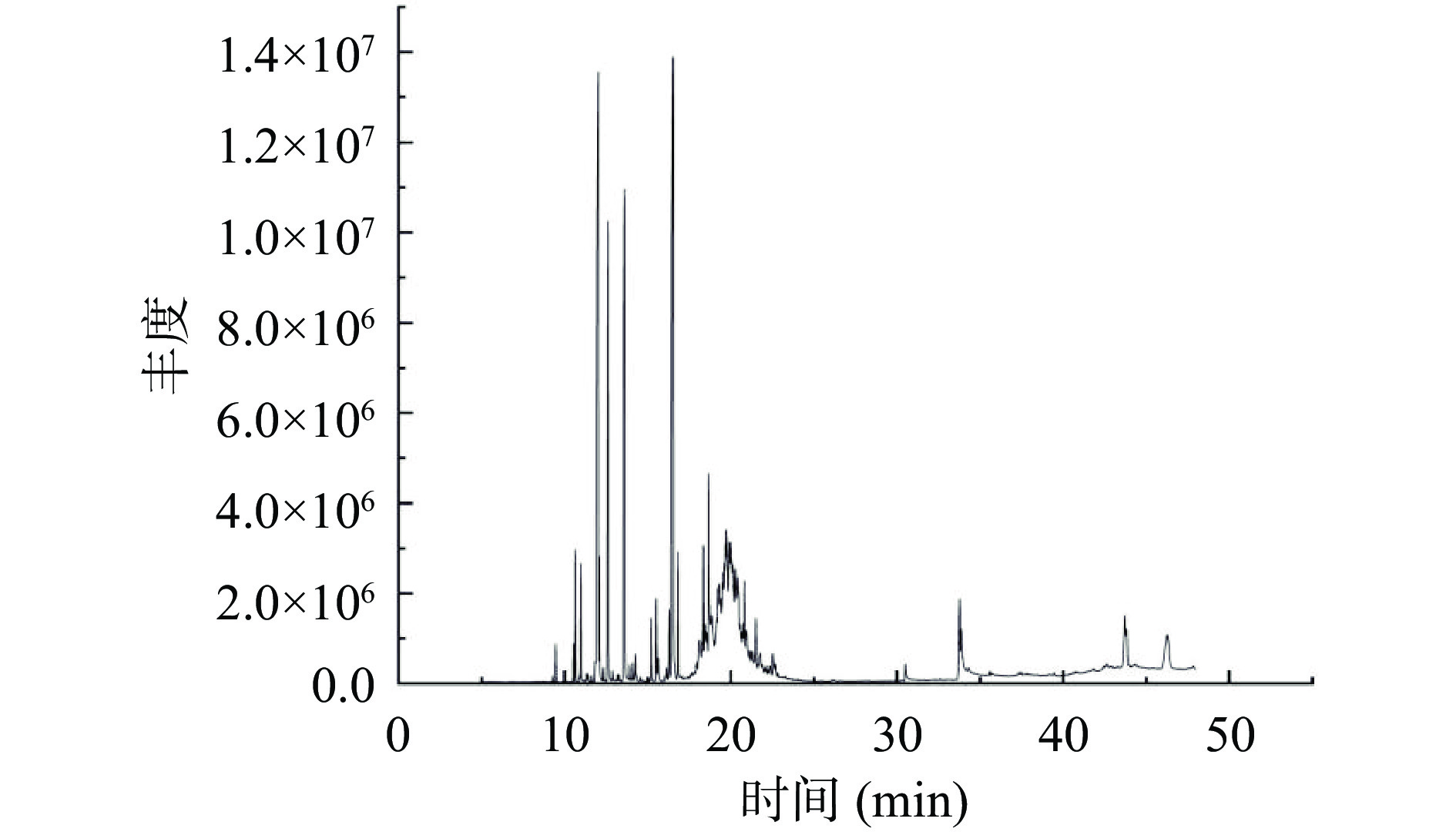
采用GC-MS对佛手果皮精油进行定性分析,精油总离子流图见图9。佛手果皮精油中共检测出42种化合物,占被检总量的92.55%,见表4。其中醇类化合物共18种,占相对总含量的36.70%;烃类化合物共11种,占相对总含量的26.21%,烃类化合物中萜烯烃类物质有8种,占相对总含量的23.83%;酯类化合物共6种,占相对总含量的23.09%。其余还有酸类化合物3种,占2.74%;醛类化合物3种,占2.05%;酚类化合物1种,占1.76%。
表 4 佛手果皮精油成分的GC-MS分析Table 4. GC-MS analysis of essential oil components of bergamot peel序号 留时间(min) 化合物名称 类别 分子式 CAS 相对含量(%) 1 9.454 (+)-α-蒎烯 萜烯烃 C10H16 7785-70-8 0.29 2 10.516 β-水芹烯 萜烯烃 C10H16 555-10-2 0.28 3 10.624 左旋-β-蒎烯 萜烯烃 C10H16 18172-67-3 1.04 4 10.959 β-月桂烯 萜烯烃 C10H16 123-35-3 0.91 5 11.830 邻-异丙基苯 芳香烃 C10H14 527-84-4 0.26 6 12.018 d-柠檬烯 萜烯烃 C10H16 5989-27-5 14.58 7 12.083 反式-β-罗勒烯 萜烯烃 C10H16 3779-61-1 0.92 8 12.619 γ-松油烯 萜烯烃 C10H16 99-85-4 5.18 9 13.608 芳樟醇 醇 C10H18O 78-70-6 8.89 10 14.249 1,2-二氢芳樟醇 醇 C10H20O 18479-51-1 0.18 11 15.201 (-)-4-萜品醇 醇 C10H18O 20126-76-5 0.50 12 15.515 α-松油醇 醇 C10H18O 10482-56-1 0.85 13 15.626 正癸醛 醛 C10H20O 112-31-2 0.30 14 16.105 橙花醇 醇 C10H18O 106-25-2 0.13 15 16.291 橙花醛 醛 C10H16O 106-26-3 0.79 16 16.532 乙酸芳樟酯 酯 C12H20O2 115-95-7 14.72 17 16.817 牻牛儿醛 醛 C10H16O 141-27-5 0.96 18 17.935 叶绿醇 醇 C20H40O 150-86-7 0.15 19 18.104 9-十七烷醇 醇 C17H36O 624-08-8 1.17 20 18.338 乙酸橙花酯 酯 C12H20O2 141-12-8 1.46 21 18.434 3,9-二乙基-6-羟基十三烷 醇 C17H36O 123-24-0 0.65 22 18.495 10-癸醇 醇 C19H40O 16840-84-9 0.46 23 18.673 乙酸香叶酯 酯 C12H20O2 105-87-3 2.70 24 18.845 顺式-7-十六烯 脂肪烯烃 C16H32 35507-09-6 1.94 25 19.279 甲基丙烯酸十四酯 酯 C18H34O2 2549-53-3 3.83 26 19.540 8-十六醇 醇 C16H34O 19781-83-0 2.78 27 19.724 己基癸醇 醇 C16H34O 2425-77-6 5.63 28 19.910 橙花叔醇 醇 C15H26O 7212-44-4 3.19 29 19.995 1,2-十六烷二醇 醇 C16H34O2 6920-24-7 3.04 30 20.125 5-十二烷醇 醇 C12H26O 10203-33-5 2.24 31 20.265 2-异丙基-5-甲基-1-庚醇 醇 C11H24O 91337-07-4 2.66 32 20.415 11-甲基十二烷醇 醇 C13H28O 85763-57-1 2.68 33 20.810 2,6-二叔丁基-4-甲基苯酚 酚 C15H24O 128-37-0 1.76 34 20.928 7-表-反式-倍半桧烯-水合物 醇 C15H26O 58319-05-4 1.24 35 21.145 3,7,11-三甲基-1-十二烷醇 醇 C15H32O 6750-34-1 0.26 36 21.508 (E)-α-没药烯 萜烯烃 C15H24 25532-79-0 0.63 37 21.761 2-辛基十二烷酸 酸 C20H40O2 40596-46-1 0.36 38 22.380 二十二碳烯酸丙酯 酯 C25H50O2 26718-94-5 0.17 39 22.685 大根香叶烷 烷烃 C15H30 645-10-3 0.18 40 30.501 抗坏血酸二棕榈酸酯 酯 C38H68O8 28474-90-0 0.21 41 33.778 共轭(9E,11E)-亚油酸 酸 C18H32O2 544-71-8 1.33 42 33.877 反式-9-十八碳烯酸 酸 C18H34O2 112-79-8 1.05 通过采用面积归一化法计算佛手果皮精油各组分的相对含量可以看出,占主要主导地位的乙酸芳樟酯(14.72%),具有保护心血管、神经细胞、抗炎和抗氧化等功效[24-29];其次是d-柠檬烯(14.58%),是目前被认为的柑橘类植物果皮中含量最多的物质[30],能够抗肿瘤、抗抑郁等[31-32];第三位是芳樟醇(8.89%),具有杀虫、抑氧化、镇静等作用[33-35]。本研究得出的三种主要成分结果与Li等[36]所报道的佛手果皮精油三种主要成分:d-柠檬烯(34.23%)、乙酸芳樟酯(27.69%)、芳樟醇(15.18%)结果相似,考虑由于提取时产生损失而导致三种成分相对含量均有不同程度的下降。同时Gioffre等[37]给出的结论也能够为本文结果提供支持。但与王春龙[38]报导的主要成分:d-柠檬烯和γ-松油烯;赵永艳[39]报道的主要成分:d-柠檬烯和萜品烯;林敏浩[16]报道的主要成分:d-柠檬烯和(E)-3,7-二甲基-2,6-辛二烯醛等结果不尽相同,因此可以断定佛手精油的主要组成成分因佛手种属、产地、气候、提取方法等存在差异而受到极大影响。
2.4 佛手果皮精油抗氧化活性分析
2.4.1 佛手果皮精油对ABTS+·的清除作用
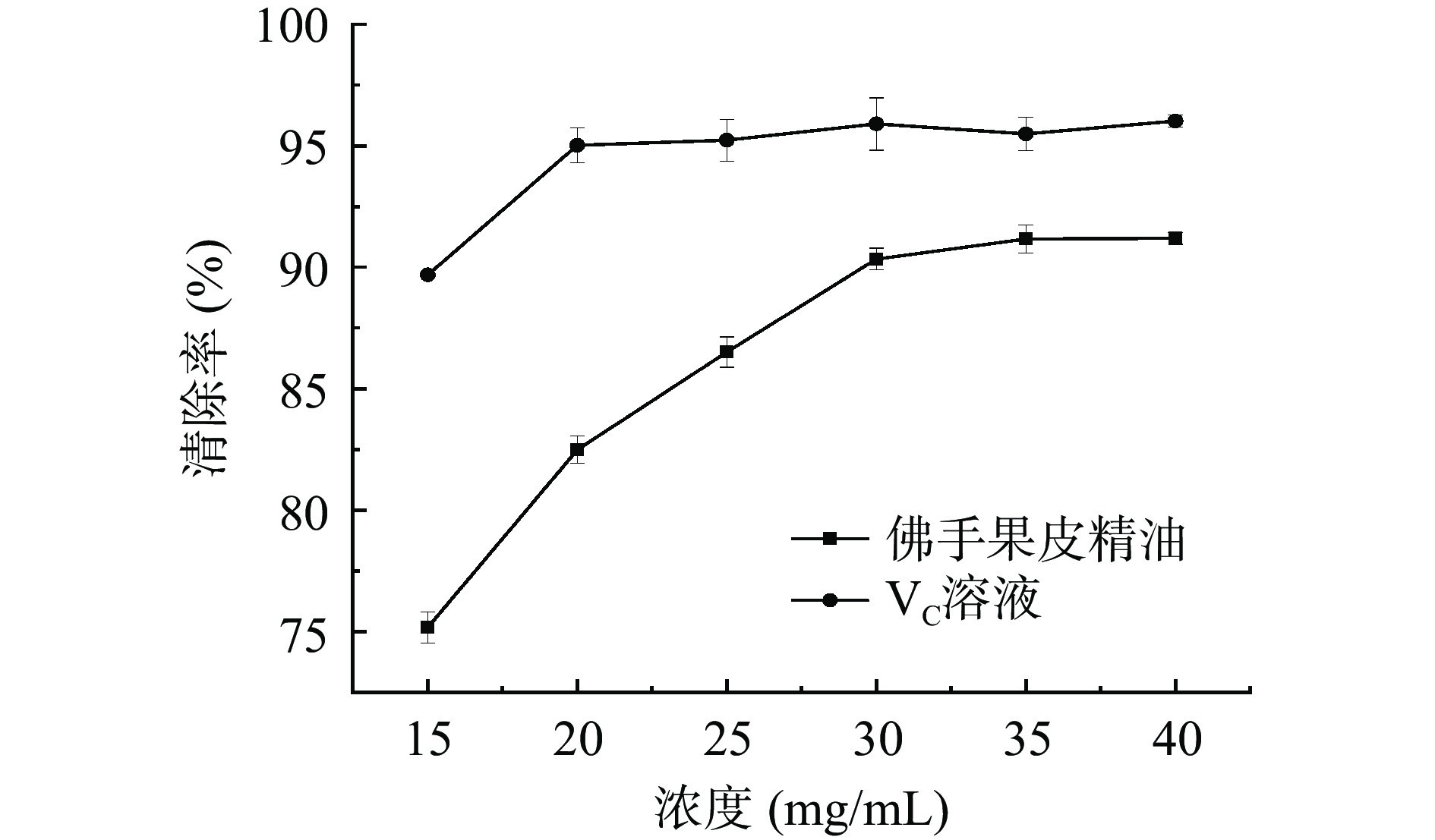
佛手果皮精油对ABTS+·清除能力如图10所示。在15~40 mg/mL浓度范围内,佛手果皮精油清除ABTS+·的能力与精油浓度呈正相关。15~30 mg/mL浓度范围内,随精油溶液浓度越大,其清除ABTS+·的能力明显增强。从30 mg/mL开始,清除率增长平缓,趋于稳定。当佛手精油浓度达到40 mg/mL时,其对ABTS+·的清除率高达91.20%。经Excel分析佛手果皮精油对ABTS+·半数清除率为5.043 mg/mL。Kivrak [40]曾报道含有高水平的乙酸芳樟酯和芳樟醇的Sevtopolis乳杆菌品种的薰衣草表现出较强的清除ABTS+·的能力,因此可以推断,佛手果皮精油具有较好的清除ABTS+·的能力与含有此二种成分相关。
2.4.2 佛手果皮精油对DPPH·的清除作用
佛手果皮精油对DPPH·清除能力如图11所示。在45~65 mg/mL浓度范围内,佛手果皮精油清除DPPH·的能力随着精油浓度的增加而明显增强。精油浓度为65 mg/mL时,清除率增长趋势开始减缓,当浓度为70 mg/mL,清除率达到最大93.19%。经Excel分析佛手果皮精油对DPPH·半数清除率为30.994 mg/mL前人研究表明芳樟醇、d-柠檬烯、γ-松油烯等具有较强的清除DPPH·的效果[41-42],因此佛手果皮精油良好的清除DPPH·的能力可能与其富含这些成分有关。
3. 结论
精油是佛手果皮中含量丰富且具有药理活性的主要成分之一,对佛手果皮精油的提取方法进行优化,从而提高精油得率具有很高的应用价值。本研究采用单因素实验和响应面分析对佛手果皮精油纤维素酶辅助的条件进行了优化,得到最佳工艺条件为:酶解pH5.2、酶添加量0.7%、酶解温度52 ℃、酶解时间2.1 h,在此条件下精油得率为3.11%。较先前文献提高了佛手精油的产量。由GC-MS结果可得,佛手果皮精油中分离出中42种化学组分,最为主要的是乙酸芳樟酯(14.72%)、d-柠檬烯(14.58%)和芳樟醇(8.89%)。从抗氧化活性试验中可以看出,佛手果皮精油具有良好的清除ABTS+·和DPPH·的能力,清除ABTS+·的能力优于清除DPPH·的能力。综上所述,佛手果皮精油是一种具有开发潜力的天然抗氧化剂,在功能性食品等领域具有极大的应用价值。本研究为进一步将佛手果皮精油开发为抗氧化产品提供理论和实践基础。
-
表 1 Box-Behnken 设计因素与水平表
Table 1 Factors and levels of Box-Behnken experimental design
因素 水平 −1 0 1 A(酶解pH) 4.5 5.0 5.5 B(酶添加量/%) 0.6 0.7 0.8 C(酶解温度/℃) 45 50 55 D(酶解时间/h) 1.5 2.0 2.5 表 2 响应面试验设计及结果
Table 2 Response surface test design and results
试验编号 A B C D Y(精油
得率(%))1 −1 0 0 1 2.52 2 −1 −1 0 0 2.33 3 0 0 1 1 2.85 4 −1 1 0 0 2.65 5 0 0 1 −1 2.49 6 0 0 0 0 3.05 7 0 0 0 0 3.06 8 1 −1 0 0 2.78 9 0 0 −1 −1 2.22 10 0 0 −1 1 2.40 11 1 0 1 0 2.74 12 0 −1 0 −1 2.53 13 1 0 0 −1 2.51 14 −1 0 1 0 2.61 15 1 0 −1 0 2.44 16 0 0 0 0 3.02 17 1 0 0 1 2.85 18 0 0 0 0 3.06 19 −1 0 0 −1 2.4 20 0 1 0 1 2.92 21 0 0 0 0 3.04 22 0 −1 −1 0 2.33 23 −1 0 −1 0 2.26 24 0 1 0 −1 2.35 25 1 1 0 0 2.65 26 0 1 1 0 2.80 27 0 1 −1 0 2.38 28 0 −1 1 0 2.72 29 0 −1 0 1 2.63 表 3 响应面二次回归方程模型方差分析
Table 3 Response surface quadratic regression equation model variance analysis
方差来源 平方和 自由度 均方 F值 P值 显著性 模型 1.93 14 0.14 126.42 <0.0001 ** A 0.12 1 0.12 110.32 <0.0001 ** B 0.015 1 0.015 14.17 0.0021 ** C 0.40 1 0.40 364.09 <0.0001 ** D 0.23 1 0.23 213.66 <0.0001 ** AB 0.051 1 0.051 46.54 <0.0001 ** AC 6.250E-004 1 6.250E-004 0.57 0.4610 NS AD 0.012 1 0.012 11.12 0.0049 ** BC 2.250E-003 1 2.250E-003 0.21 0.6562 NS BD 0.055 1 0.055 50.77 <0.0001 ** CD 8.100E-003 1 8.100E-003 7.45 0.0163 * A2 0.36 1 0.36 335.42 <0.0001 ** B2 0.25 1 0.25 228.89 <0.0001 ** C2 0.58 1 0.58 535.50 <0.0001 ** D2 0.39 1 0.39 360.63 <0.0001 ** 残差 0.015 14 1.088E-003 失拟检验 0.014 10 1.411E-004 5.04 0.0665 NS 纯误差 1.120E-003 4 2.800E-004 总误差 1.94 28 注:“**”差异极显著(P<0.01);“*”差异显著((0.01<P<0.05);“NS”不显著(P>0.05)。 表 4 佛手果皮精油成分的GC-MS分析
Table 4 GC-MS analysis of essential oil components of bergamot peel
序号 留时间(min) 化合物名称 类别 分子式 CAS 相对含量(%) 1 9.454 (+)-α-蒎烯 萜烯烃 C10H16 7785-70-8 0.29 2 10.516 β-水芹烯 萜烯烃 C10H16 555-10-2 0.28 3 10.624 左旋-β-蒎烯 萜烯烃 C10H16 18172-67-3 1.04 4 10.959 β-月桂烯 萜烯烃 C10H16 123-35-3 0.91 5 11.830 邻-异丙基苯 芳香烃 C10H14 527-84-4 0.26 6 12.018 d-柠檬烯 萜烯烃 C10H16 5989-27-5 14.58 7 12.083 反式-β-罗勒烯 萜烯烃 C10H16 3779-61-1 0.92 8 12.619 γ-松油烯 萜烯烃 C10H16 99-85-4 5.18 9 13.608 芳樟醇 醇 C10H18O 78-70-6 8.89 10 14.249 1,2-二氢芳樟醇 醇 C10H20O 18479-51-1 0.18 11 15.201 (-)-4-萜品醇 醇 C10H18O 20126-76-5 0.50 12 15.515 α-松油醇 醇 C10H18O 10482-56-1 0.85 13 15.626 正癸醛 醛 C10H20O 112-31-2 0.30 14 16.105 橙花醇 醇 C10H18O 106-25-2 0.13 15 16.291 橙花醛 醛 C10H16O 106-26-3 0.79 16 16.532 乙酸芳樟酯 酯 C12H20O2 115-95-7 14.72 17 16.817 牻牛儿醛 醛 C10H16O 141-27-5 0.96 18 17.935 叶绿醇 醇 C20H40O 150-86-7 0.15 19 18.104 9-十七烷醇 醇 C17H36O 624-08-8 1.17 20 18.338 乙酸橙花酯 酯 C12H20O2 141-12-8 1.46 21 18.434 3,9-二乙基-6-羟基十三烷 醇 C17H36O 123-24-0 0.65 22 18.495 10-癸醇 醇 C19H40O 16840-84-9 0.46 23 18.673 乙酸香叶酯 酯 C12H20O2 105-87-3 2.70 24 18.845 顺式-7-十六烯 脂肪烯烃 C16H32 35507-09-6 1.94 25 19.279 甲基丙烯酸十四酯 酯 C18H34O2 2549-53-3 3.83 26 19.540 8-十六醇 醇 C16H34O 19781-83-0 2.78 27 19.724 己基癸醇 醇 C16H34O 2425-77-6 5.63 28 19.910 橙花叔醇 醇 C15H26O 7212-44-4 3.19 29 19.995 1,2-十六烷二醇 醇 C16H34O2 6920-24-7 3.04 30 20.125 5-十二烷醇 醇 C12H26O 10203-33-5 2.24 31 20.265 2-异丙基-5-甲基-1-庚醇 醇 C11H24O 91337-07-4 2.66 32 20.415 11-甲基十二烷醇 醇 C13H28O 85763-57-1 2.68 33 20.810 2,6-二叔丁基-4-甲基苯酚 酚 C15H24O 128-37-0 1.76 34 20.928 7-表-反式-倍半桧烯-水合物 醇 C15H26O 58319-05-4 1.24 35 21.145 3,7,11-三甲基-1-十二烷醇 醇 C15H32O 6750-34-1 0.26 36 21.508 (E)-α-没药烯 萜烯烃 C15H24 25532-79-0 0.63 37 21.761 2-辛基十二烷酸 酸 C20H40O2 40596-46-1 0.36 38 22.380 二十二碳烯酸丙酯 酯 C25H50O2 26718-94-5 0.17 39 22.685 大根香叶烷 烷烃 C15H30 645-10-3 0.18 40 30.501 抗坏血酸二棕榈酸酯 酯 C38H68O8 28474-90-0 0.21 41 33.778 共轭(9E,11E)-亚油酸 酸 C18H32O2 544-71-8 1.33 42 33.877 反式-9-十八碳烯酸 酸 C18H34O2 112-79-8 1.05 -
[1] 王向平, 冯彬彬, 张建海. 药食两用药材佛手研究进展[J]. 农业与技术,2021,41(20):41−45. [WANG X P, FENG B B, ZHANG J H. Research progress of bergamot for both medicine and food[J]. Agriculture and Technology,2021,41(20):41−45. doi: 10.19754/j.nyyjs.20211030009 [2] 彭宝, 文瑶, 于荣敏, 等. 佛手多糖提取、结构表征及生物活性研究进展[J]. 食品与药品,2018,20(3):236−241. [PENG B, WEN Y, YU R M, et al. Research progress on extraction, structural characterization and bioactivity of bergamot polysaccharides[J]. Food and Drug,2018,20(3):236−241. doi: 10.3969/j.issn.1672-979X.2018.03.017 [3] 陈汉民, 许剑华, 张淑芝, 等. 佛手精油研究进展[J]. 农产品加工, 2017(14): 69-70, 74 CHEN H M, XU J H, ZHANG S Z, et al. Research progress of bergamot essential oil[J]. Products Processing, 2017, (14): 69-70, 74.
[4] LOMBARDO G E, CIRMI S, MUSUMECI L, et al. Mechanisms underlying the anti-inflammatory activity of bergamot essential oil and its antinociceptive effects[J]. Plants-basel,2020,9(6):704. doi: 10.3390/plants9060704
[5] KULKARNI S A, SELLAMUTHU P S, NAGARAJAN S K, et al. Antifungal activity of wild bergamot (Monarda fistulosa) essential oil against postharvest fungal pathogens of banana fruits[J]. South African Journal of Botany,2022,144:166−174. doi: 10.1016/j.sajb.2021.08.019
[6] GONZALEZ J O W, STEFANAZZI N, MURRAY A P, et al. Novel nanoinsecticides based on essential oils to control the German cockroach[J]. Journal of Pest Science,2015,88(2):393−404. doi: 10.1007/s10340-014-0607-1
[7] YE J C, LA S T, HSIAO M W. The effect of apoptosis in A549 lung cancer cells by bergamot essential oil[J]. Zeitschrift fur Arznei- & Gewurzpflanzen,2017,22(2):88−92.
[8] CHEN M L, CHEN Y E, LEE H F. The effect of bergamot essential oil aromatherapy on improving depressive mood and sleep quality in postpartum women: A randomized controlled trial[J]. Journal of Nursig Researh,2022,30(2):e201.
[9] 唐莹, 邹波, 余元善, 等. 佛手益生菌软糖的制备及其体外消化耐受性的分析[J]. 现代食品科技,2022,38(7):256−300. [TANG Y, ZOU B, YU Y S, et al. Preparation of bergamot probiotic fudge and analysis of its digestive tolerance in vitro[J]. Modern Food Science & Technology,2022,38(7):256−300. [10] 吴姗姗, 田文妮, 陆思名, 等. 酵母菌和乳酸芽孢杆菌发酵佛手果酒工艺[J]. 食品工业,2019,40(12):74−77. [WU S S, TIAN W N, LU S M, et al. Fermentation technology of bergamot wine by yeast and Bacillus lactis[J]. Food Industry,2019,40(12):74−77. [11] 李菀, 胡月, 李光霞, 等. 纤维素酶和果胶酶提取对甘草渣多糖抗氧化和抗肿瘤性能的影响[J]. 食品工业科技,2020,41(9):309−313,319. [LI W, HU Y, LI G X, et al. Effects of cellulase and pectinase extraction on antioxidant and antitumor properties of Glycyrrhiza uralensis polysaccharide[J]. Science and Technology of Food Industry,2020,41(9):309−313,319. doi: 10.13386/j.issn1002-0306.2020.09.050 [12] 吕橄, 陈斯婷, 武广珩, 等. 酶辅助水蒸气蒸馏法提取蜜柚柚皮精油及其抑菌活性研究[J]. 广东化工,2019,46(23):17−19, 33. [LÜ G, CHEN S T, WU G H, et al. Extraction of essential oil from pomelo peel by enzyme assisted steam distillation and its antibacterial activity[J]. Guangdong Chemical Industry,2019,46(23):17−19, 33. [13] 辜雪冬, 肖娟, 周康, 等. 纤维素酶辅助水蒸气蒸馏提取柠檬果皮精油工艺优化[J]. 食品与机械,2018,34(8):145−152. [GU D X, XIAO J, ZHOU K, et al. Optimization of cellulase assisted steam distillation for extracting essential oil from lemon peel[J]. Food and Machinery,2018,34(8):145−152. doi: 10.13652/j.issn.1003-5788.2018.08.029 [14] 徐兴堂, 张子东, 王玉红. 酶辅助水蒸气蒸馏法提取兴安落叶松针叶精油工艺[J]. 中国林副特产,2018(5):15−18. [XU X T, ZHANG Z D, WANG Y H, et al. Extraction of essential oil from Larix gmelini needles by enzyme assisted steam distillation[J]. Forest By-product and Speciality of China,2018(5):15−18. doi: 10.13268/j.cnki.fbsic.2018.05.005 [15] 邵子懿. 金佛手精油的提取和抗螨活性研究[D]. 上海: 上海应用技术大学, 2019 SHAO Z Y. Study on extraction and anti mite activity of essential oil from Jin bergamot[D]. Shanghai: Shanghai Institute of Technology, 2019.
[16] 林敏浩, 周爱梅, 杨慧, 等. 水蒸汽蒸馏法提取广佛手挥发精油及其组成分析[J]. 食品安全质量检测学报,2015,6(2):619−625. [LIN M H, ZHOU A M, YANG H, et al. Extraction and composition analysis of volatile essential oil from Guang bergamot by steam distillation[J]. Food Safety and Quality Detection Technology,2015,6(2):619−625. doi: 10.19812/j.cnki.jfsq11-5956/ts.2015.02.047 [17] 杨慧, 周爱梅, 林敏浩, 等. 佛手挥发精油提取及其药理研究进展[J]. 食品安全质量检测学报,2013,4(5):1347−1352. [YANG H, ZHOU A M, LIN M H, et al. Research progress on extraction and pharmacology of volatile essential oil from bergamot[J]. Food Safety and Quality Detection Technology,2013,4(5):1347−1352. doi: 10.19812/j.cnki.jfsq11-5956/ts.2013.05.009 [18] 刘欢, 赵巨堂, 何力, 等. 金盏花精油的微波辅助提取及其成分与抗氧化活性研究[J]. 食品工业科技,2022,43(10):180−188. [LIU H ZHAO J T, HE L, et al. Microwave assisted extraction of calendula essential oil and its components and antioxidant activity[J]. Science and Technology of Food Industry,2022,43(10):180−188. doi: 10.13386/j.issn1002-0306.2021060062 [19] 李晓娇, 李悦, 董锦, 等. 云南松针精油的提取及抗氧化活性研究[J]. 中国食品添加剂,2020,31(7):27−35. [LI X J, LI Y, DONG J, et al. Study on extraction and antioxidant activity of essential oil from Yunan Province[J]. China Food Additives,2020,31(7):27−35. doi: 10.19804/j.issn1006-2513.2020.07.005 [20] 杜兵兵. 纤维素酶辅助提取花椒挥发油工艺及其抗氧化作用的研究[J]. 中国调味品,2017,42(9):55−57. [DU B B. Study on cellulase assisted extraction of volatile oil from Zanthoxylum bungeanum and its antioxidant effect[J]. China Condiment,2017,42(9):55−57. doi: 10.3969/j.issn.1000-9973.2017.09.012 [21] 张雪松, 裴建军, 赵林果, 等. 酶法辅助提取桂花精油工艺优化[J]. 食品工业科技,2017,38(20):90−97. [ZHANG X S, PEI J J, ZHAO L G, et al. Optimization of enzymatic extraction of Osmanthus fragrans essential oil[J]. Science and Technology of Food Industry,2017,38(20):90−97. doi: 10.13386/j.issn1002-0306.2017.20.017 [22] XING C, QIN C Q, LI X Q, et al. Chemical composition and biological activities of essential oil isolated by HS-SPME and UAHD from fruits of bergamot[J]. LWT,2019,104:38−44. doi: 10.1016/j.lwt.2019.01.020
[23] SICARI V. Optimization of the supercritical carbon dioxide separation of bergapten from bergamot essential oil[J]. Journal of AOAC International,2018,101(1):293−297. doi: 10.5740/jaoacint.17-0190
[24] YU S H, YOU K S, GEUN H S. Protection of the neurovascular unit from calcium-related ischemic injury by linalyl acetate[J]. Chinese Journal of Physiology,2021,64(2):88−96. doi: 10.4103/cjp.cjp_94_20
[25] YOU K S, YU S H, A Y H, et al. Sex-specific susceptibility to type 2 diabetes mellitus and preventive effect of linalyl acetate[J]. Life Sciences,2020,260:118432. doi: 10.1016/j.lfs.2020.118432
[26] YU S H, YOU K S, A Y H, et al. Linalyl acetate prevents three related factors of vascular damage in COPD-like and hypertensive rats[J]. Life Sciences,2019,232:116608. doi: 10.1016/j.lfs.2019.116608
[27] KIM J R, KANG P, LEE H S, et al. Cardiovascular effects of linalyl acetate in acute nicotine exposure[J]. Environmental Health and Preventive Medicine,2017,22(1):42. doi: 10.1186/s12199-017-0651-6
[28] RAI V K, CHANDA D, CHANOTIYA C S, et al. A combination of linalool and linalyl acetate synergistically alleviates imiquimod-induced psoriasis-like skin inflammation in BALB/c mice[J]. Frontiers in Pharmacology,2022,13:913174. doi: 10.3389/fphar.2022.913174
[29] SHIN Y K, KWON S, HSIEH Y S, et al. Linalyl acetate restores colon contractility and blood pressure in repeatedly stressed-ulcerative colitis rats[J]. Environmental Health and Preventive Medicine,2022,27:27. doi: 10.1265/ehpm.22-00041
[30] 蓝宏彦, 吴燕飞, 何玉清. 橘皮精油中d-柠檬烯HPLC法分析[J]. 山东化工,2020,49(24):94−96. [LAN H Y, WU Y F, HE Y Q. Analysis of d-limonene in orange peel essential oil by HPLC[J]. Shandong Chemical Industry,2020,49(24):94−96. doi: 10.3969/j.issn.1008-021X.2020.24.035 [31] YE Z H, LIANG Z L, MI Q W, et al. Limonene terpenoid obstructs human bladder cancer cell (T24 cell line) growth by inducing cellular apoptosis, caspase activation, G2/M phase cell cycle arrest and stops cancer metastasis[J]. Journal of Buon,2020,25(1):280−285.
[32] ZHANG L L, YANG Z Y, FAN G, et al. Antidepressant-like effect of Citrus sinensis (L.) osbeck essential oil and its main component limonene on mice[J]. Journal of Agricultural and Food Chemistry,2019,67(50):13817−13828. doi: 10.1021/acs.jafc.9b00650
[33] FUJIWARA G M, ANNIES V, DE OLIVEIRA C F, et al. Evaluation of larvicidal activity and ecotoxicity of linalool, methyl cinnamate and methyl cinnamate/linalool in combination against Aedes aegypti[J]. Ecotoxicology and Environmental Safety A,2017,139:238−244. doi: 10.1016/j.ecoenv.2017.01.046
[34] 陈耕. 左旋芳樟醇的小鼠体内抗氧化及抗皮肤衰老活性研究[J]. 食品与机械,2021,37(2):169−172,185. [CHEN G. Study on antioxidation and anti skin aging activity of l-linalool in mice[J]. Food and Machinery,2021,37(2):169−172,185. doi: 10.13652/j.issn.1003-5788.2021.02.029 [35] LINCK V D, DA SILVA A L, FIGUEIRO M, et al. Inhaled linalool-induced sedation in mice[J]. Phytomedicine,2009,16(4):303−307. doi: 10.1016/j.phymed.2008.08.001
[36] LI Y, LIU S T, ZHAO C, et al. The chemical composition and antibacterial and antioxidant activities of five citrus essential oils[J]. Molecules,2022,27(20):7044. doi: 10.3390/molecules27207044
[37] GIOFFRE G, URSINO D, LABATE M L C, et al. The peel essential oil composition of bergamot fruit (Citrus bergamia, Risso) of Reggio Calabria (Italy): A review[J]. Emirates Journal of Food and Agriculture,2020,32(11):835−845.
[38] 王春龙, 罗禹, 段灵鑫, 等. GC-MS法比较分析不同产地川佛手精油成分[J]. 食品工业科技,2021,42(7):274−281. [WANG C L, LUO Y, DUAN L X, et al. Comparative analysis of essential oil components of Chuan bergamot from different producing areas by GC-MS[J]. Science and Technology of Food Industry,2021,42(7):274−281. doi: 10.13386/j.issn1002-0306.2020050372 [39] 赵永艳, 张军银, 彭腾, 等. 不同产地佛手的挥发油成分比较分析[J]. 中国药房,2020,31(4):423−428. [ZHAO Y Y, ZHANG J Y, PENG T, et al. Comparison and analysis of volatile oil components of bergamot from different producing areas[J]. Chinese Pharmacy,2020,31(4):423−428. doi: 10.6039/j.issn.1001-0408.2020.04.07 [40] KIVRAK S. Essential oil composition and antioxidant activities of eight cultivars of lavender and lavandin from western Anatolia[J]. Industry Crops and Products,2018,117:88−96. doi: 10.1016/j.indcrop.2018.02.089
[41] SEOL G H, KANG P, LEE H S, et al. Antioxidant activity of linalool in patients with carpal tunnel syndrome[J]. BMC Neurology,2016,16(1):17. doi: 10.1186/s12883-016-0541-3
[42] 陈晓晶, 黄文佳, 杜丽清. 柠檬果皮精油的成分分析及其抗氧化活性研究[J]. 广东化工,2021,48(8):89−92,74. [CHEN X J, HUANG W J, DU L Q. Component analysis and antioxidant activity of lemon peel essential oil[J]. Guangdong Chemical Industry,2021,48(8):89−92,74. doi: 10.3969/j.issn.1007-1865.2021.08.033 -
期刊类型引用(5)
1. 马卓云,王洪新. 岳西小黄姜精油提取优化及成分分析. 天然产物研究与开发. 2024(04): 562-571 .  百度学术
百度学术
2. 宋歌,邓雅楠,张春文,叶懿,严善春. 蒙古栎5-9月叶片精油化学成分及其抗氧化活性分析. 山东林业科技. 2024(05): 34-39+59 .  百度学术
百度学术
3. 王晨霞,黄东纬. 佛手有效成分提取及性能研究进展. 山东化工. 2024(22): 98-100+104 .  百度学术
百度学术
4. 廖惠平,谢勇辉,邓中华,吴东,李梦楚,黄文平. 精油分析技术的简述. 药品评价. 2023(05): 521-524 .  百度学术
百度学术
5. 李冬琳. 校园芳香园林植物的调查与应用——以韶关学院为例. 现代园艺. 2023(21): 23-24+27 .  百度学术
百度学术
其他类型引用(3)





 下载:
下载:






 下载:
下载:
