Effect of Different Oligosaccharides on Streptococcus mutans, Porphyromonas gingivalis and Clostridium nucleatus in Vitro
-
摘要: 为更好地了解功能性低聚糖对口腔微生物的影响,本文采用体外实验方法,研究不同低聚糖对变异链球菌、牙龈卟啉单胞菌和具核梭杆菌生长、产酸、粘附性和生物被膜形成量等的影响。胰蛋白胨大豆肉汤(Trypticase Soy Broth,TSB)培养基中加入不同浓度的低聚半乳糖、低聚木糖、低聚果糖和低聚异麦芽糖制备培养基培养变异链球菌、牙龈卟啉单胞菌和具核梭杆菌,测定细菌在培养基中48 h生长过程中的OD值、pH、黏附能力及生物被膜形成量等指标。比较分析不同低聚糖对细菌发酵前后生长、产酸及黏附能力等特性的影响。结果表明:四种低聚糖对三种病原菌均有不同程度的抑制作用。其中,低聚木糖对三种病原菌的生长抑制效果最强;浓度为0.5%的低聚木糖和低聚半乳糖即能明显抑制三种菌液的产酸能力;相比糖醇和其它低聚糖,低聚木糖浓度≥5%时,对三种病原菌的抑制率均大于60%;7%浓度的四种低聚糖对三种病原菌的黏附率均<50%;低聚半乳糖和低聚木糖浓度>5%时,对三种病原菌生物被膜的形成具有较好的抑制作用。与山梨糖醇相比,复配糖(低聚木糖、木糖醇、低聚半乳糖)对三种病原菌的生长抑制作用更为明显。Abstract: To provide a theoretical basis for the effects of functional oligosaccharides on the oral microorganisms, the efficacy of several oligosaccharides on the growth, acid production, adherence and biofilm formation of three cariogenic bacteria including Streptococcus mutans, Porphyromonas gingivalis, Fusobacterium nucleatum were investigated. The three cariogenic bacteria were cultured in TSB medium with xylooligosaccharides, galactooligosaccharides, fructooligosaccharide and isomaltooligosaccharide at the different concentrations, and the absorbance, pH, adhesiveness as well as biofilm formation inhibitory activity were measured for 48 h. The effects of different oligosaccharides on bacterial growth, acid production and adhesion were compared and analyzed. The results showed that four oligosaccharides had inhibitory effects on three kinds of cariogenic bacteria, and xylooligosaccharide had the highest inhibitory effect. Xylo-oligosaccharides and galactooligosaccharides at 0.5% concentration could significantly inhibit the acid production of the three cariogenic bacteria. Compared with xylitol and other oligosaccharides, the inhibition rate of xylo-oligosaccharide on the three pathogens was 60% higher when the xylo-oligosaccharide concentration was more than 5%. The adhesion rates of the four oligosaccharides at 7% concentration to the three cariogenic bacteria were all less than 50%. When the concentration of galactooligosaccharides and xylo-oligosaccharide was greater than 5%, the biofilm formation of the three cariogenic bacteria was inhibited well. By comparison with sorbitol, the combination use of xylo-oligosaccharide, xylitol, galactooligosaccharides had more obvious inhibition on the growth of the three pathogenic bacteria.
-
口腔是消化道的起始部分,营养的吸收从口腔咀嚼开始,口腔健康与人体健康息息相关[1],受口腔微生物的影响。口腔微生物的生态失衡会引起口腔疾病,如口臭[2]、龋齿、牙周炎等[3-4]。这些口腔疾病的发生也与饮食有关,蔗糖、葡萄糖以及淀粉等摄入容易引起牙齿中有害微生物的生长,导致牙齿脱矿[5]。链球菌属作为口腔浮游菌,早期定植在牙齿表面,变异链球菌(Streptococcus mutans)是致龋的主要微生物,能将口腔中残留的碳水化合物发酵产酸,并在牙齿表面形成一层粘附性菌斑,使产生的有机酸较长时间接触牙齿表面,造成牙齿硬组织损伤,形成龋洞,影响口腔健康。牙龈卟啉单胞菌(Porphyromonas gingivalis)是晚期定植细菌,具核梭杆菌(Fusobacterium nucleatum)能连接二者[6]。牙龈卟啉单胞菌和具核梭杆菌在牙周病中起主导作用[5-8];口腔微生物失衡也会引起慢性胃病、心血管疾病、糖尿病等系统性疾病[8-9]。近年来,口腔健康越来越受到人们的关注。目前研究发现,以糖醇代糖在预防龋病方面有较好的效果[10-12]。
低聚糖是指由2~10个单糖通过糖苷键聚合而成的具有多种生理活性的碳水化合物[13],分为普通低聚糖和功能性低聚糖(GB/T 35920-2018 低聚糖通用技术规则)。一般认为功能性低聚糖能特异性地诱导双歧杆菌生长,促进双歧杆菌发酵产生大量短链脂肪酸,抑制有害菌生长繁殖,降低有害菌和毒素在肠膜的附着力,具提高免疫力、降低血清胆固醇等作用[13]。随着消费者对食品功能需求的升级,功能性低聚糖(如低聚果糖、低聚异麦芽糖、低聚半乳糖等)[14]在食品行业中的应用也成为了研究热点,并应用于发酵乳制品、饮料、保健品、烘培等功能性食品中[15]。因此,从口腔健康角度出发,需要进一步探究不同低聚糖对口腔微生物的影响研究,为低聚糖在食品中更好地运用提供理论支撑。
本实验以变异链球菌、牙龈卟啉单胞杆菌和具核梭杆菌三种龋齿的主要致病菌作为主要指示菌,以口腔产品中常用的木糖醇、山梨糖醇为对照,研究低聚果糖、低聚异麦芽糖、低聚木糖和低聚半乳糖对变异链球菌、牙龈卟啉单胞菌和具核梭杆菌生长特性、产酸、抑制能力及粘附性等方面的影响,系统比较分析了几种低聚糖对口腔病原菌特性的影响,揭示了低聚糖对口腔病原菌的抑制作用,并展示了这些物质用于口腔护理产品的应用前景,为更好地了解功能性低聚糖对口腔微生物的影响提供理论依据。
1. 材料与方法
1.1 材料与仪器
变异链球菌 ATCC 55676、牙龈卟啉单胞菌 ATCCBAA-308、具核梭杆菌 ATCC25586 冻干粉 广东省微生物菌种保藏中心;植物乳杆菌(Lactobacillus plantarum)、干酪乳杆菌(Lactobacillus casei)冻干粉 北京科拓生物技术有限公司;脑心浸液培养基(Brain heart infusion,BHI)、胰蛋白胨大豆肉汤(Trypticase soy broth,TSB)、胰蛋白胨、植物(大豆)蛋白胨 、MRS肉汤培养基(de Man, Rogosa and sharpe broth,MRS) 北京陆桥技术股份有限公司;氯化钠 分析纯,源叶生物;磷酸氢二钾 分析纯,北京化工厂;磷酸二氢钾 分析纯,天津科密欧化学试剂有限公司;无水磷酸氢二钠 分析纯,天津永大化学试剂开发中心;无水乙醇 分析纯,罗恩试剂;低聚果糖、低聚半乳糖 纯度≥95%,量子高科广东生物有限公司;低聚异麦芽糖、低聚木糖 纯度≥95%,山东龙力生物科技股份有限公司;木糖醇 纯度≥95%,河南省安阳市豫鑫木糖醇科技有限公司;山梨糖醇 纯度≥95%,北京凤礼精求医药股份有限公司;生物被膜形成量/抑制能力检测(B601) 北仁化学科技(北京)有限公司;其他试剂 均为分析纯或国产生化试剂;水 实验室用二级水。
LKLCZ220A型亚泰科隆无菌操作台 北京亚泰科隆仪器技术有限公司;MLS-3780型高压灭菌锅 日本三洋(SANYO)公司;LRH-1500F生化培养箱 上海一恒科学仪器有限公司;Five Easy Plus pH计 梅特勒托利多科技(中国)有限公司;BIO-RAD xMarkTM 微孔板分光光度计 美国伯乐公司;S-403型电子天平(±0.001 g) 丹佛仪器(北京)有限公司。
1.2 实验方法
1.2.1 菌株的活化
将变异链球菌接入BHI培养基中37 ℃活化48 h,将活化的菌液取100 μL接入5 mL TSB培养基中37 ℃培养48 h,按此操作对菌株进行2次传代,使用第3代菌液进行后续试验。牙龈卟啉单胞菌和具核梭杆菌安瓿管中的菌种接入TSB培养基中37 ℃活化48 h,将活化的菌液取100 μL传入5 mL TSB培养基中37 ℃培养48 h,按此操作对菌株进行2次传代,使用第3代菌液进行后续试验。
1.2.2 菌悬液的制备
将传得的第3代变异链球菌、牙龈卟啉单胞菌、具核梭杆菌菌液3000×g离心15 min,去掉上清,无菌磷酸盐缓冲液洗菌2次,再加入3 mL磷酸盐缓冲液,对菌液进行计数,制备1×106 CFU/mL的标准菌悬液待用。
1.2.3 低聚糖对口腔病原菌生长特性的影响
分别用木糖醇,低聚半乳糖、低聚木糖、低聚果糖、低聚异麦芽糖和山梨糖醇替换TSB培养基中的葡萄糖制备培养基(糖醇和低聚糖浓度为1%)。制得培养基和TSB培养基(对照)中分别接种具核梭杆菌、变异链球菌和牙龈卟啉单胞菌菌悬液(接种量为1×106 CFU/mL),37 ℃培养36 h。培养期间每4 h取菌液样品,pH计测定菌液样品pH,紫外分光光度计测定菌液样品和空白对照的OD600值,以未接菌培养基为空白对照,记录数据。计算△OD,△OD=OD试验后−OD空白对照。
1.2.4 低聚糖对口腔病原菌产酸能力的测定
将木糖醇、低聚半乳糖、低聚木糖、低聚果糖、低聚异麦芽糖和山梨糖醇分别加入到TSB培养基(糖醇和低聚糖添加量分别为0.5%、1%、2%、5%和7%)中。制得培养基分别接种具核梭杆菌、变异链球菌和牙龈卟啉单胞菌菌悬液(接种量为1×106 CFU/mL),37 ℃培养48 h,空白培养基为对照,pH计测定菌液和对照pH,记录数据。计算△pH,△pH=pH对照−pH试验后
1.2.5 低聚糖对口腔病原菌生长抑制能力的测定
将木糖醇,低聚半乳糖、低聚木糖、低聚果糖、低聚异麦芽糖和山梨糖醇分别加入TSB培养基(糖醇和低聚糖添加量分别为2%、5%和7%)中,制得培养基分别接种具核梭杆菌、变异链球菌和牙龈卟啉单胞菌菌悬液(接种量为1×106 CFU/mL),37 ℃培养48 h,以空白培养基刚接菌时的OD值为空白对照,紫外分光光度计测定菌液和对照OD600值,记录数据。计算抑菌率:抑菌率(%)=(OD试验后−OD空白对照)/OD空白对照×100。
1.2.6 低聚糖对口腔病原菌粘附能力的影响
将木糖醇,低聚半乳糖、低聚木糖、低聚果糖、低聚异麦芽糖和山梨糖醇分别加入TSB培养基(糖醇和低聚糖添加量分别为2%、5%和7%)制备液体培养基,取3 mL培养基至试管中,分别接入50 μL变异链球菌、牙龈卟啉单胞菌和具核梭杆菌菌液,混合均匀。将接入菌液的试管1倾斜30°放置,37 ℃培养48 h后,轻轻将试管1翻转3次,将试管1菌液倒入试管2中;对试管1无黏附菌体侧加入3 mL 0.01 mol/L磷酸盐缓冲液,振荡5 s,将试管1中液体转移至试管3中;再将3 mL 0.01 mol/L磷酸盐缓冲液加入试管1中,将试管1中紧密黏附在试管壁的菌体全部刮下;试管2和试管3离心(3000×g,5 min),弃上清,再加入3 mL缓冲液,振匀。以磷酸盐缓冲液作为空白对照。取200 μL菌悬液加入96孔板中,用磷酸盐缓冲液调零,用分光光度仪于600 nm处测定试管1、试管2、试管3的吸光度值,每管设3个平行孔。黏附率(%)=A1/(A1+A2+A3)×100
1.2.7 低聚糖对口腔病原菌生物被膜形成量的抑制能力的测定
将木糖醇,低聚半乳糖、低聚木糖、低聚果糖分别加入添加了2%蔗糖的TSB培养基(糖醇和低聚糖添加量分别为2%、5%和7%)中,采用生物被膜形成量/抑制能力检测试剂盒测定生物膜形成量[16]。
1.2.8 低聚糖复配对细菌生长特性的影响
植物乳杆菌和干酪乳杆菌菌悬液的制备:植物乳杆菌和干酪乳杆菌接入MRS培养基中37 ℃活化24 h,将活化的菌液取100 μL接入5 mL MRS培养基中37 ℃培养24 h,按此操作对菌株进行2次传代,使用第3代菌液3000×g离心15 min,去掉上清,无菌磷酸盐缓冲液洗菌2次,再加入3 mL磷酸盐缓冲液,对菌液进行计数,制备1×106 CFU/mL的标准菌悬液待用。
结合上述结果,复配三种对病原菌有较好抑制作用的糖(5%低聚木糖、5%木糖醇、5%低聚半乳糖))加入TSB培养基后,分别接入1×106 CFU/mL的具核梭杆菌、变异链球菌、牙龈卟啉单胞菌、植物乳杆菌和干酪乳杆菌菌悬液,37 ℃培养48 h后,以空白培养基为空白对照,紫外分光光度计测定菌液和对照OD600值,pH计测定菌液和对照pH,记录数据。△pH=pH空白对照−pH试验后,△OD=OD试验后−OD空白对照。
1.3 数据处理
所有实验均重复3次,结果以平均值±标准差表示,采用SPSS Statistics 20.0进行数据统计分析,OriginPro 8.0软件作图。
2. 结果与分析
2.1 低聚糖对口腔病原菌的生长特性的影响
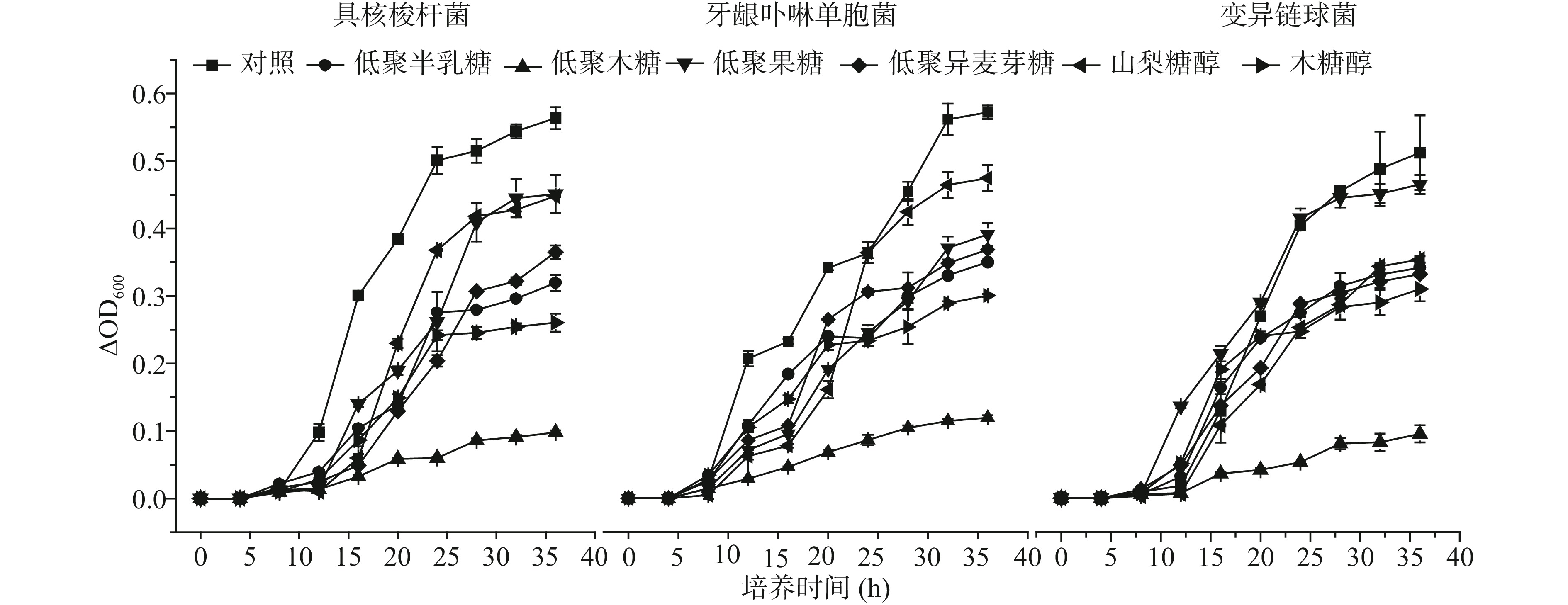
试验考察不同种类低聚糖对变异链球菌、牙龈卟啉单胞菌和具核梭杆菌生长的影响。如图1所示,不同种类低聚糖对三种菌的生长均有影响,其中低聚木糖组中具核梭杆菌、牙龈卟啉单胞菌和变异链球菌三株菌菌液△OD分别为0.098、0.120和0.095,均低于其他组别。表明低聚木糖对三种菌生长的影响比其他糖更为明显。进一步分析图1结果,可以看出不同糖对具核梭杆菌和牙龈卟啉单胞菌生长的影响不同,影响效果分别为葡萄糖<山梨糖醇<低聚果糖<低聚异麦芽糖<低聚半乳糖<木糖醇<低聚木糖;对变异链球菌生长的影响为葡萄糖<低聚果糖<山梨糖醇<低聚异麦芽糖<低聚半乳糖<木糖醇<低聚木糖。
图2显示不同培养时间低聚糖对三种菌液产酸的影响。结果表明低聚木糖组与其它组菌液的酸度差异显著,差异均具有统计学意义(P<0.05)。低聚木糖组菌液随培养时间的延长pH的变化最小,最低pH>6.0,均高于其它低聚糖和糖醇组。而低聚异麦芽糖、低聚半乳糖和低聚果糖培养24 h后,pH均低于5.0。OD值和pH的结果表明,与木糖醇和山梨糖醇相比,四种低聚糖中,低聚木糖对变异链球菌、牙龈卟啉单胞菌和具核梭杆菌的生长和产酸有一定的抑制作用。
2.2 不同浓度低聚糖对口腔病原菌产酸能力的影响
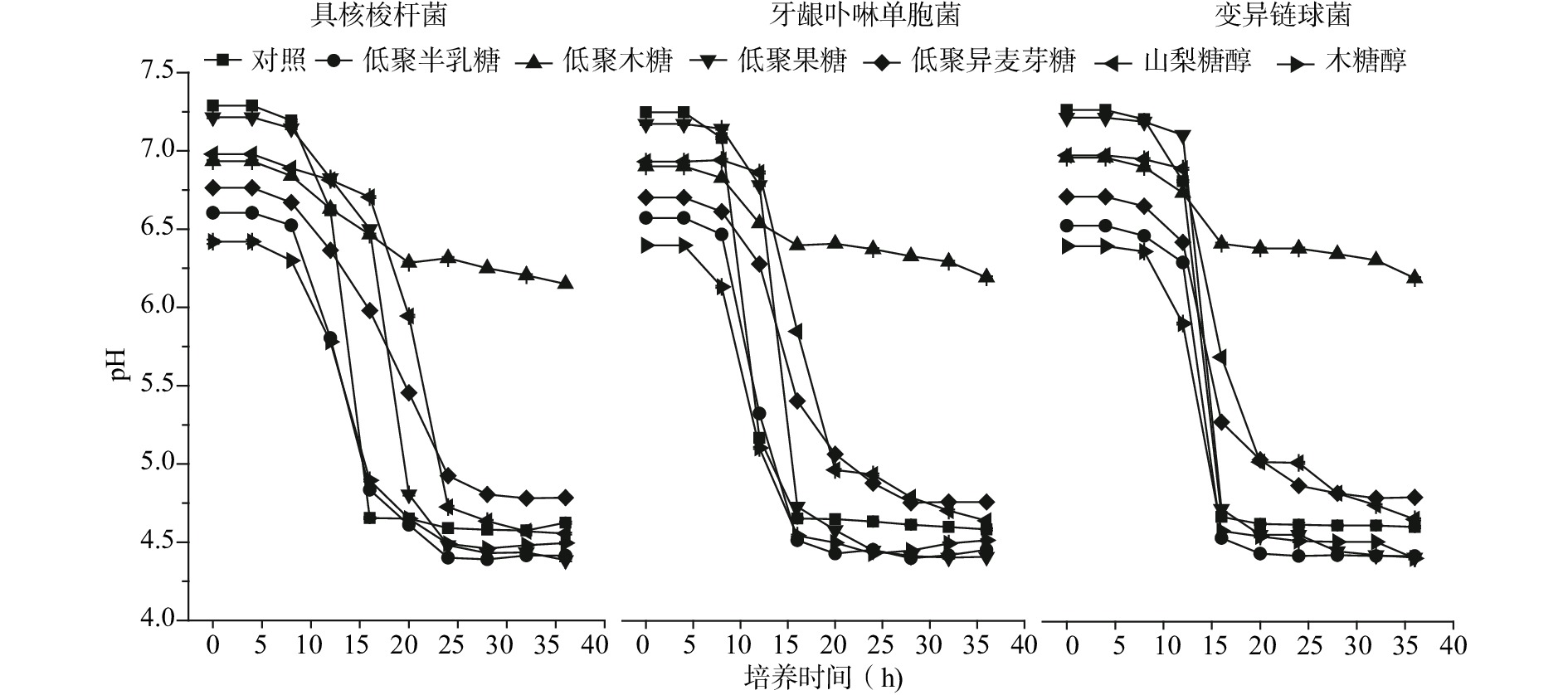
酸性的口腔病原菌菌斑与龋齿数量的增加相关[17-21],并且牙齿釉质脱矿(脱钙作用)的临界值为pH5.5[21-22],牙齿釉质结构在酸度小于5.5时就会发生脱矿化变得脆弱。微生物发酵会促进菌液酸化程度增加[23-25],引起菌液pH降低。实验中在TSB培养基中添加糖醇和低聚糖,探究不同浓度低聚糖和葡萄糖共发酵时对口腔病原菌产酸能力。图3显示了不同浓度(0%、0.5%、1%、2%、5%和7%)的低聚糖和糖醇对变异链球菌、牙龈卟啉单胞菌和具核梭杆菌三种口腔病原菌产酸特性的影响。结果表明,不同浓度的低聚糖和糖醇对菌液酸度有不同的影响。总体来说,添加浓度越高,菌液pH变化越小,即高质量浓度低聚糖可抑制菌体的生长及产酸。当低聚糖添加量≥5%时,它们对三种口腔病原菌产酸水平的抑制作用依次为低聚木糖>低聚半乳糖>低聚果糖>低聚异麦芽糖,差异有统计学意义(P<0.05),这也表明高浓度的四种低聚糖对三种口腔病原菌的产酸能力均有抑制。低聚木糖组和低聚半乳糖组能够显著抑制病原菌产酸,而且随着浓度增加,三种菌液△pH也在减小。其中,7%低聚木糖组的酸度变化最小,表明低聚木糖对变异链球菌、牙龈卟啉单胞菌和具核梭杆菌的产酸能力有明显的抑制作用,△pH分别为0.175、0.180和0.245。与0%组相比,pH的变化显著降低了93.93%、93.64%和91.40%(P<0.05)。并且低质量浓度(0.5%、1%)低聚木糖即能明显抑制病原菌的产酸能力,这一结果与林丹乐等[26]的研究结论一致。
2.3 低聚糖对口腔病原菌生长抑制能力的测定
由前文结果表明,糖浓度大于2%时,低聚糖对三种口腔致病菌的产酸能力抑制作用明显。为了更好探究,低聚糖对三株菌的作用,下文选择添加浓度为2%、5%、7%的木糖醇、山梨糖醇、低聚木糖、低聚半乳糖、低聚果糖和低聚异麦芽糖的培养基中接种3种口腔病原菌,于37 ℃培养48 h后,测定吸光度,计算抑菌率,结果见表1。随着糖醇和低聚糖浓度的增加,对三种菌生长的抑制作用也逐渐增强。其中,当低聚果糖和低聚木糖浓度≥5%时,对具核梭杆菌的抑制率>50%;低聚木糖的浓度≥5%时,对牙龈卟啉单胞菌和变异链球菌的抑制率>50%。Han等[5]研究发现,木糖醇能够抑制牙龈卟啉单胞菌脂多糖诱导的炎症细胞因子表达,防止龋齿和牙周炎等的发生,李维丹[27]的研究发现,糖醇类能够影响具核梭杆菌和牙龈卟啉单胞菌蛋白水解酶的活性,抑制其生长。低聚糖对具核梭杆菌和牙龈卟啉单胞菌的抑制作用也可能与此相关,但有待进一步的研究证明。
表 1 低聚糖对口腔病原菌的抑制率(%)Table 1. Inhibition rate of oligosaccharide on oral pathogenic bacteria (%)糖种类 具核梭杆菌 牙龈卟啉单胞菌 变异链球菌 2% 5% 7% 2% 5% 7% 2% 5% 7% 山梨糖醇 14.85±1.32bC 34.75±0.05aC 37.23±0.07aC 16.31±2.67bC 18.22±0.88bCD 22.61±1.27aE 28.81±3.98abC 35.28±2.99abC 41.06±1.81aB 木糖醇 24.66±3.08aB 22.87±0.85aD 23.96±0.99aD 27.06±3.19abB 32.75±0.14aB 28.67±1.37abD 30.72±1.53abC 41.95±8.58aC 41.06±1.81aB 低聚半乳糖 19.81±2.35bBC 20.59±2.97bD 38.92±0.36aC 25.78±3.21bcB 33.01±3.19bB 52.88±1.27aB 37.21±1.15abBC 36.94±1.98abC 43.24±0.64aB 低聚木糖 48.51±0.57cA 68.61±0.24bA 89.51±2.18aA 39.96±4.29bA 85.20±3.44aA 88.10±0.88aA 59.39±3.42cA 71.10±2.39bA 88.38±1.0aA 低聚果糖 18.45±4.06bBC 50.42±0.74aB 55.72±0.98aB 1.86±1.27cD 16.97±2.19bCD 34.43±1.63aC 28.99±2.03cC 54.78±0.75aB 44.52±0.91bB 低聚异麦芽糖 5.23±1.53aD 8.94±1.49aE 10.23±5.54aE 13.09±1.98aC 15.03±1.06aD 15.51±2.88aF 13.56±2.34bD 19.26±0.78aD 21.36±2.07aC 注:小写字母为组内方差分析,大写字母为组间方差分析,不同字母表明具有显著性差异(P<0.05),表2同。 2.4 低聚糖对口腔病原菌粘附能力的影响
粘附是一种直接的相互作用方式,也是微生物进入生物膜和侵袭宿主的第一步[28]。在酸性环境下,变异链球菌通过葡萄糖基转移酶和果糖基转移酶的作用产生细胞外聚合物,提高变异链球菌的黏附能力[29]。具核梭杆菌具有多种凝集素,主导菌属内和菌属间的黏附共聚并能与多种细菌发生黏附作用[30]。表2列出了低聚糖和糖醇对三种口腔病原菌菌液黏附能力影响试验的结果。不同低聚糖和糖醇对具核梭杆菌、牙龈卟啉单胞菌和变异链球菌菌液的黏附率影响并不完全随浓度增高而降低。对三个不同浓度进行比较,除低聚果糖外,7%浓度低聚糖和糖醇的菌液黏附率低于其它浓度的菌液黏附率,而且黏附率均<50%,即高浓度的低聚糖和糖醇的菌液黏附抑制率较高,差异有统计学意义(P<0.05)。相同糖浓度下,不同低聚糖对三种病原菌黏附性影响不同,其中,糖浓度为2%时,木糖醇对具核梭杆菌、牙龈卟啉单胞菌和变异链球菌的黏附率均<50%,分别为49.90%、35.34%和41.64%;糖浓度为5%时,低聚木糖和低聚半乳糖对具核梭杆菌和牙龈卟啉单胞菌的黏附率均<50%。
表 2 不同浓度低聚糖对三种病原菌黏附性的影响(%)Table 2. Effects of different concentrations of oligosaccharides on adhesion of three pathogenic bacteria (%)糖种类 具核梭杆菌 牙龈卟啉单胞菌 变异链球菌 2% 5% 7% 2% 5% 7% 2% 5% 7% 山梨糖醇 68.55±0.56aA 55.53±0.22bAB 42.49±0.30cA 46.96±0.09bC 59.73±0.04aA 46.68±0.22bA 56.76±0.37bA 66.32±0.14aA 48.90±0.09cA 木糖醇 49.90±0.14bD 55.66±0.60aAB 34.89±0.32cC 35.34±0.45bD 49.44±0.12aC 33.46±0.69cD 41.64±0.59bCD 51.68±0.21aD 24.77±0.97cD 低聚半乳糖 41.41±0.04aE 44.50±1.41aBC 36.41±0.39cB 41.47±0.04cC 49.31±0.09aC 41.00±0.78bB 56.69±0.06aA 56.09±0.61aC 39.63±1.62bB 低聚木糖 50.90±0.62aC 42.94±1.47bC 33.80±0.01cC 52.11±1.57aB 36.86±0.17bD 33.57±0.33cD 53.94±0.09bB 50.77±2.16aD 36.28±0.73bBC 低聚果糖 51.36±0.64aCD 31.43±9.11aD 37.04±0.40aB 31.28±0.33cE 50.62±1.53aC 40.19±1.87bBC 46.15±4.15bC 62.84±1.42aB 42.01±0.80bB 低聚异麦芽糖 53.25±0.30bB 65.08±1. 13aA 34.55±0.71cC 53.46±0.13aA 54.94±3.49aB 38.73±1.41bC 40.49±0.13aD 41.16±0.45aE 31.90±5.12aC 2.5 低聚糖对口腔病原菌生物被膜形成量的抑制作用
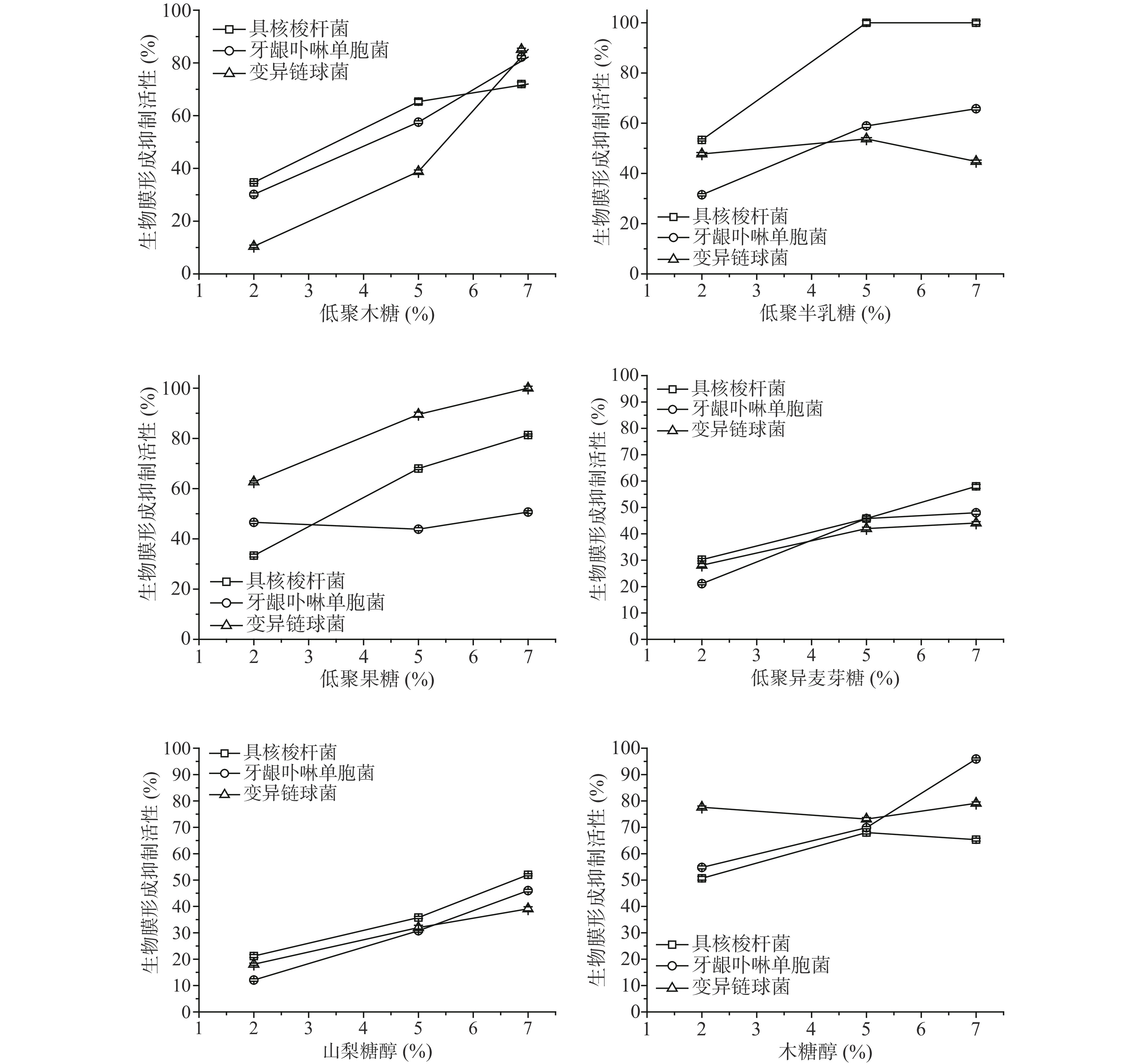
文献报道[31-32],木糖醇可以明显的抑制变异链球菌、牙龈卟啉单胞菌、具核梭酸杆菌生物膜的形成,能抑制多种菌属生物膜的构成,是有效的防龋齿甜味替代物[32]。结合上面试验结果,以糖醇为对照,进一步探究四种低聚糖对三种病原菌生物膜形成量的抑制作用。结果如图4所示,与山梨糖醇相比,添加浓度为2%的四种低聚糖对具核梭杆菌、牙龈卟啉单胞菌和变异链球菌3种菌液生物膜的形成有抑制作用,糖浓度≤7%时,抑制活性随浓度增大而升高,浓度达7%时,抑制活性最强。低聚半乳糖浓度为5%时,对具核梭杆菌的生物膜抑制达到了100.00%。7%的低聚果糖和低聚木糖对变异链球菌生物膜的抑制活性更大,抑制率分别为100.00%和85.07%,当低聚糖的浓度>2%时,对牙龈卟啉单胞菌生物膜生产量均有抑制作用,但木糖醇对牙龈卟啉单胞菌生物膜形成的抑制效果优于四种低聚糖。实验结果表明,抑制生物被膜形成影响细菌的生长。
2.6 低聚糖复配对细菌生长特性的影响
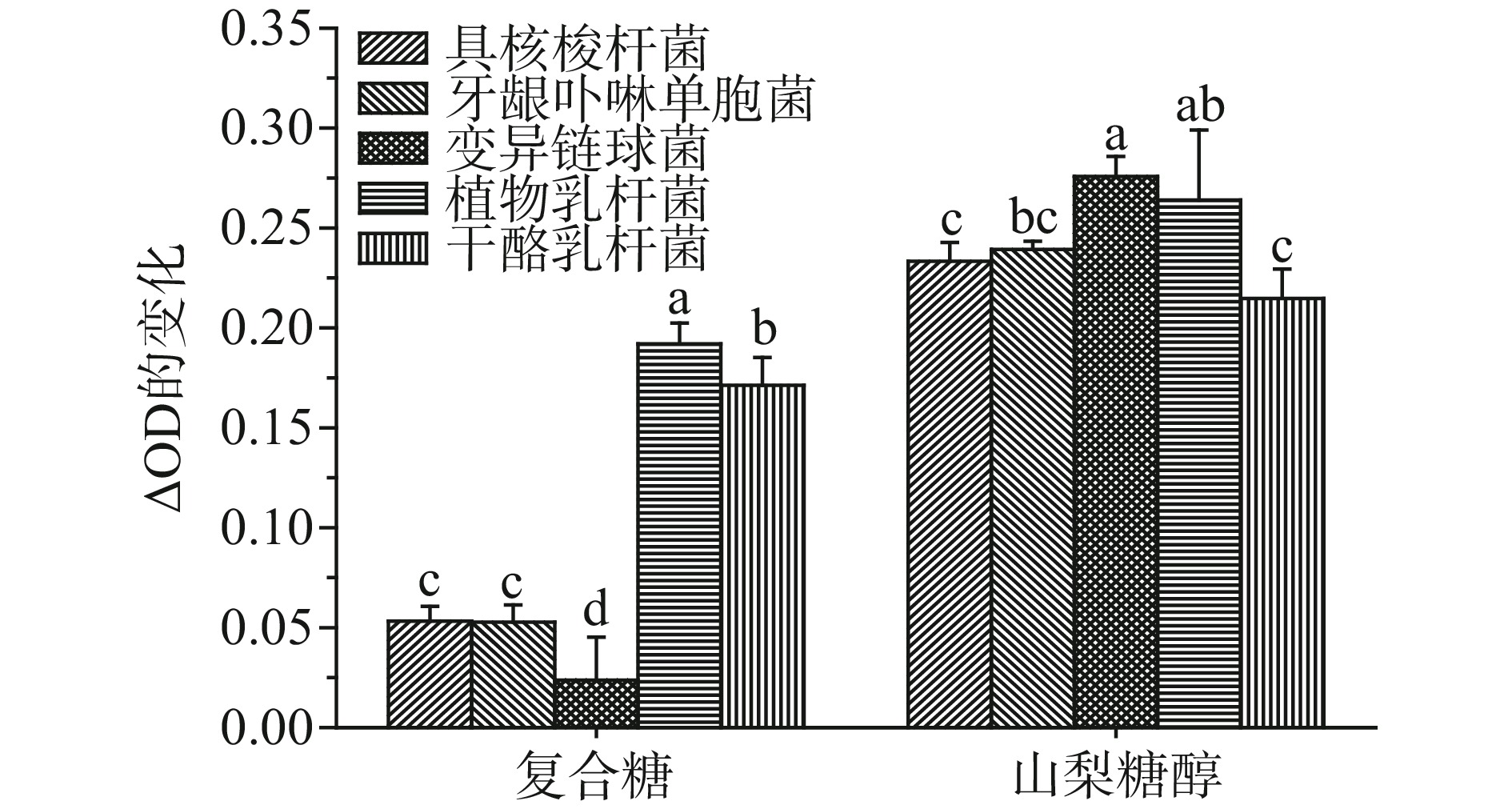
结合上述实验结果,实验中将对三种口腔病原菌有较好抑制作用的糖(低聚木糖、木糖醇和低聚半乳糖)按1:1:1的比例进行复配,探究低聚糖复配后对三种病原菌和益生菌(植物乳杆菌和干酪乳杆菌)生长特性的影响。本实验以作为漱口水中常用配料的山梨糖醇作为对比。由图5、图6可知,相比山梨糖醇,复配糖(5%低聚木糖、5%木糖醇和5%低聚半乳糖)对具核梭杆菌、牙龈卟啉单胞菌和变异链球菌3种菌的生长具有更强的抑制作用,在相同条件下培养48 h后,菌液△OD降低了77.00%~90.00%,△pH降低了57.00%~96.00%。这表明与山梨糖相比,复配糖对3种病原菌具有良好的抑菌性。植物乳杆菌和干酪乳杆菌在山梨糖和复配糖中均能生长,优于3种病原菌,低聚糖联用对病原菌生长的抑制作用更强。这表明与常用甜味剂的山梨醇相比,相同浓度的复配糖,对三种口腔致病菌有更好的抑制作用。如果在口腔护理产品中加入低聚糖类物质,可以对常见口腔致病菌有一定抑制作用,同时又能有助于口腔益生菌的增长,有利于平衡口腔微生物环境,具体影响也有待进一步的研究,但这也为口腔产品的研发提供一个新思路。
3. 结论
本研究考察了低聚木糖、低聚半乳糖、低聚果糖和低聚异麦芽糖对变异链球菌、牙龈卟啉单胞菌、具核梭杆菌三种病原菌生长、产酸、黏附特性和生物膜形成的影响。结果表明四种低聚糖对三种病原菌均有不同程度的抑制作用。其中,低聚木糖能够显著影响三种病原菌的生长;当培养基中有葡萄糖时,浓度低至0.5%的低聚木糖、低聚半乳糖即能明显抑制三种菌液的产酸能力,特别是低聚木糖,1%的低聚木糖即可以维持菌液酸度值大于牙釉质脱矿临界酸度值,其浓度越大对菌液产酸的抑制能力越强。粘附性和生物膜形成方面,相比木糖醇和其它低聚糖,低聚木糖对三种病原菌的黏附抑制率更大,对三种病原菌生物膜的抑制活性更强。试验中将多种低聚糖复配与山梨糖醇进行比较,发现复配糖对具核梭杆菌、牙龈卟啉单胞菌和变异链球菌的生长具有更强的抑制作用。
-
表 1 低聚糖对口腔病原菌的抑制率(%)
Table 1 Inhibition rate of oligosaccharide on oral pathogenic bacteria (%)
糖种类 具核梭杆菌 牙龈卟啉单胞菌 变异链球菌 2% 5% 7% 2% 5% 7% 2% 5% 7% 山梨糖醇 14.85±1.32bC 34.75±0.05aC 37.23±0.07aC 16.31±2.67bC 18.22±0.88bCD 22.61±1.27aE 28.81±3.98abC 35.28±2.99abC 41.06±1.81aB 木糖醇 24.66±3.08aB 22.87±0.85aD 23.96±0.99aD 27.06±3.19abB 32.75±0.14aB 28.67±1.37abD 30.72±1.53abC 41.95±8.58aC 41.06±1.81aB 低聚半乳糖 19.81±2.35bBC 20.59±2.97bD 38.92±0.36aC 25.78±3.21bcB 33.01±3.19bB 52.88±1.27aB 37.21±1.15abBC 36.94±1.98abC 43.24±0.64aB 低聚木糖 48.51±0.57cA 68.61±0.24bA 89.51±2.18aA 39.96±4.29bA 85.20±3.44aA 88.10±0.88aA 59.39±3.42cA 71.10±2.39bA 88.38±1.0aA 低聚果糖 18.45±4.06bBC 50.42±0.74aB 55.72±0.98aB 1.86±1.27cD 16.97±2.19bCD 34.43±1.63aC 28.99±2.03cC 54.78±0.75aB 44.52±0.91bB 低聚异麦芽糖 5.23±1.53aD 8.94±1.49aE 10.23±5.54aE 13.09±1.98aC 15.03±1.06aD 15.51±2.88aF 13.56±2.34bD 19.26±0.78aD 21.36±2.07aC 注:小写字母为组内方差分析,大写字母为组间方差分析,不同字母表明具有显著性差异(P<0.05),表2同。 表 2 不同浓度低聚糖对三种病原菌黏附性的影响(%)
Table 2 Effects of different concentrations of oligosaccharides on adhesion of three pathogenic bacteria (%)
糖种类 具核梭杆菌 牙龈卟啉单胞菌 变异链球菌 2% 5% 7% 2% 5% 7% 2% 5% 7% 山梨糖醇 68.55±0.56aA 55.53±0.22bAB 42.49±0.30cA 46.96±0.09bC 59.73±0.04aA 46.68±0.22bA 56.76±0.37bA 66.32±0.14aA 48.90±0.09cA 木糖醇 49.90±0.14bD 55.66±0.60aAB 34.89±0.32cC 35.34±0.45bD 49.44±0.12aC 33.46±0.69cD 41.64±0.59bCD 51.68±0.21aD 24.77±0.97cD 低聚半乳糖 41.41±0.04aE 44.50±1.41aBC 36.41±0.39cB 41.47±0.04cC 49.31±0.09aC 41.00±0.78bB 56.69±0.06aA 56.09±0.61aC 39.63±1.62bB 低聚木糖 50.90±0.62aC 42.94±1.47bC 33.80±0.01cC 52.11±1.57aB 36.86±0.17bD 33.57±0.33cD 53.94±0.09bB 50.77±2.16aD 36.28±0.73bBC 低聚果糖 51.36±0.64aCD 31.43±9.11aD 37.04±0.40aB 31.28±0.33cE 50.62±1.53aC 40.19±1.87bBC 46.15±4.15bC 62.84±1.42aB 42.01±0.80bB 低聚异麦芽糖 53.25±0.30bB 65.08±1. 13aA 34.55±0.71cC 53.46±0.13aA 54.94±3.49aB 38.73±1.41bC 40.49±0.13aD 41.16±0.45aE 31.90±5.12aC -
[1] 单贤文, 梁卫平, 何月华. 口腔健康状况与慢性胃炎的相关性[J]. 医疗装备,2021,34(14):101−102. [SHAN X W, LIANG W P, HE Y H. Relationship between oral health status and chronic gastritis[J]. Medical Equipment,2021,34(14):101−102. doi: 10.3969/j.issn.1002-2376.2021.14.052 [2] KILIAN M, CHAPPLE I L C, HANNIG M, et al. The oral microbiome-an update for oral healthcare professionals[J]. British Dental Journal,2016,221(10):657−666. doi: 10.1038/sj.bdj.2016.865
[3] 邓盟, 齐霞, 徐欣, 等. 人体口腔微生物宏基因组的研究进展[J]. 华西口腔医学杂志,2013,31(1):107−111. [DENG M, QI X, XU X, et al. Latest progress in unveiling the oral microbial metagenome[J]. West China Journal of Stomatology,2013,31(1):107−111. doi: 10.7518/hxkq.2013.01.027 [4] SAMPAIO-MAIA B, CALDAS I M, PERIRA M L, et al. The oral microbiome in health and its implication in oral and systemic diseases[J]. Advances in Applied Microbiology,2016:171−210.
[5] HAN S J, JEONG S Y, NAM Y J, et al. Xylitol inhibits inflammatory cytokine expression induced by lipopolysaccharide from Porphyromonas gingivalis[J]. Clinical and Diagnostic Laboratory Immunology,2005,12(11):1285−1291.
[6] 周琳, 蔡文静, 杨慧, 等. MTAN用于抑制血链球菌、具核梭杆菌、牙龈卟啉单胞菌混合菌的体外研究[J]. 安徽医科大学学报,2021,56(8):1328−1331. [ZHOU L, CAI W J, YANG H, et al. Vitro study of MTAN to inhibit the mixed bacteria solution of S. anguinis, F. nucleatum and P. gingivalis[J]. Acta Universitatis Medicinalis Anhui,2021,56(8):1328−1331. doi: 10.19405/j.cnki.issn1000-1492.2021.08.032 [7] SOJAR H T, SMITH D F. Porphyromonas gingivalis fimbriae carbohydrate specificity assessment by glycomics[J]. Fems Immunology and Medical Microbiology,2012,66(1):83−87. doi: 10.1111/j.1574-695X.2012.00989.x
[8] 蒋端, 申道南. 具核梭杆菌影响动脉粥样硬化的分子机制[J]. 口腔医学研究,2022,38(4):308−311. [JIANG D, SHEN D N. Research on molecular mechanism of effect of Fusobacterium nucleatum on atherosclerosis[J]. Journal of Oral Science Research,2022,38(4):308−311. doi: 10.13701/j.cnki.kqyxyj.2022.04.003 [9] 张程, 孙红英. 口腔微生物组与全身疾病的相关性[J]. 生理科学进展,2021,52(2):128−132. [ZHANG C, SUN H Y. Correlation between oral microbiome and systemic diseases[J]. Progress in Physiological Sciences,2021,52(2):128−132. doi: 10.3969/j.issn.0559-7765.2021.02.011 [10] 张佳丽, 姚军, 诸葛继娜, 等. 赤藓糖醇对牙周致病菌抗菌性能的影响[J]. 上海口腔医学,2019,28(4):362−367. [ZHANG J L, YAO J, ZHUGE J N, et al. Antibacterial activity of erythritol on periodontal pathogen[J]. Shanghai Journal of Stomatology,2019,28(4):362−367. doi: 10.19439/j.sjos.2019.04.005 [11] 李秀娟, 韩雪松, 钟滨, 等. 糖醇与龋病关系的研究进展[J]. 口腔医学,2013,33(10):713−714. [LI X J, HAN X S, ZHONG B, et al. Research progress on the relationship between sugar alcohols and caries[J]. Stomatology,2013,33(10):713−714. doi: 10.13591/j.cnki.kqyx.2013.10.016 [12] 黄晨辉, 王伟健, 杨圣辉. 异麦芽酮糖醇对变形链球菌生长、黏附和产酸影响的研究[J]. 现代口腔医学杂志,2008(4):362−364. [HUANG C H, WANG W J, YANG S H. Effect of isomalt on amount, adhesion, and pH value of Streptococcus mutans[J]. Journal of Modern Stomatology,2008(4):362−364. doi: 10.3969/j.issn.1003-7632.2008.04.008 [13] 董占能, 邢思敏. 一类新型保健食品——低聚糖[J]. 昆明理工大学学报,1998,6:68−72. [DONG Z N, XING S M. A norel healthful food—oligosaccharide[J]. Journal of Kunming University of Science and Technology,1998,6:68−72. [14] 邹月, 黄金凤, 魏琴. 功能性低聚糖的研究进展及应用现状[J]. 中国调味品,2021,46(2):180−185, 195. [ZOU Y, HUANG J F, WEI Q. Research progress and application status of functional oligosaccharides[J]. China Condiment,2021,46(2):180−185, 195. doi: 10.3969/j.issn.1000-9973.2021.02.039 [15] 肖敏. 功能性低聚糖及其生产应用[J]. 生物产业技术,2018,6:29−34. [XIAO M. Functional oligosaccharides and their production and application[J]. Bioindustry Technology,2018,6:29−34. [16] TSUKATANI T, SAKATA F, KURODA R. A rapid and simple measurement method for biofilm formation inhibitory activity using 96-pin microtiter plate lids[J]. World Journal of Microbiology & Biotechnology,2020,36(12):189.
[17] GAIKWAD S S, GHEWARE A, KAMATAGI L, et al. Dental caries and its relationship to malocclusion in permanent dentition among 12-15 year old school going children[J]. Journal of International Oral Health Jioh,2014,6(5):27−30.
[18] PINNA R, USAI P, FILIGHEDDU E, et al. The role of adhesive materials and oral biofilm in the failure of adhesive resin restorations[J]. American Journal of Dentistry,2017,30(5):285−292.
[19] ROSIER B T, DE JAGER M, ZAUAR E, et al. Historical and contemporary hypotheses on the development of oral diseases: are we there yet?[J]. Frontiers in Cellular and Infection Microbiology,2014,4(4):92.
[20] SAMPAIOMAIA S M. Acquisition and maturation of oral microbiome throughout childhood: An update[J]. Dental Research Journal,2014,11(3):291−301.
[21] TAHMASSEBI J F, DUGGAL M S. The effect of different methods of drinking on the pH of dental plaque in vivo[J]. International Journal of Paediatric Dentistry,2010,7(4):249−254.
[22] AL D A, ATWA R Y A, MOSTAFA M. Effect of honey in preventing gingivitis and dental caries in patients undergoing orthodontic treatment[J]. Saudi Dental Journal,2014,26(3):108−114.
[23] KARTHIKEYAN R, AMAECHI B T, RAWLS H R, et al. Antimicrobial activity of nanoemulsion on cariogenic Streptococcus mutans[J]. Archives of Oral Biology,2011,56(5):437−445.
[24] KRZYSCIAK W, JURCZAK A, KOSCIELNIAK D, et al. The virulence of Streptococcus mutans and the ability to form biofilms[J]. European Journal of Clinical Microbiology & Infectious Diseases,2014,33(4):499−515.
[25] DOMON H, HIYOSHI T, MAEKAWA T, et al. Antibacterial activity of hinokitiol against both antibiotic-resistant and -susceptible pathogenic bacteria that predominate in the oral cavity and upper airways[J]. Microbiology and Immunology,2019,63(6):213−222. doi: 10.1111/1348-0421.12688
[26] 林丹乐, 谢永婷, 王雪梅. 低聚木糖对变异链球菌生长和产酸影响的体外研究[J]. 中国实用口腔科杂志,2019,12(8):480−485. [LIN D L, XIE Y T, WANG X M. An in vitro study on the growth and acid production of Streptococcus mutans affected by xylooligosaccharides[J]. Chinese Journal of Practical Stomatology,2019,12(8):480−485. doi: 10.19538/j.kq.2019.08.007 [27] 李维丹. 赤藓糖醇对牙龈卟啉单胞菌的生长、黏附及胰酶样蛋白酶活性的影响分析[D]. 福州: 福建医科大学, 2016. LI W D. Analysis of the effect of erythritol on the growth, adhesion and activity of trypsin-like protease of Porphyromonas gingivalis[D]. Fuzhou: Fujian Medical University, 2016
[28] MARSH P D. Microbiology of dental plaque biofilms and their role in oral health and caries[J]. Dental Clinics of North America,2010,54(3):441−454. doi: 10.1016/j.cden.2010.03.002
[29] TAMURA S, YONEZAWA H, MOTEGI M, et al. Inhibiting effects of Streptococcus salivarius on competence-stimulating peptide-dependent biofilm formation by Streptococcus mutans[J]. Oral Microbiology and Immunology,2009,24(2):152−161. doi: 10.1111/j.1399-302X.2008.00489.x
[30] 李懿洋, 周学东. 具核梭杆菌与口腔常见微生物粘附作用的研究进展[J]. 口腔医学研究,2021,37(4):284−287. [LI Y Y, ZHOU X D. Overviews of research on coadherence between Fusobacterium nucleatum and common oral microorganisms[J]. Journal of Oral Science Research,2021,37(4):284−287. doi: 10.13701/j.cnki.kqyxyj.2021.04.002 [31] HARIRIAN H, AnDRUKHOV O, BERTL K, et al. Microbial analysis of subgingival plaque samples compared to that of whole saliva in patients with periodontitis[J]. Journal of Periodontology,2014,85(6):819−828.
[32] 郭宏磊, 王永兰, 靳趁心. 木糖醇对黏放线菌生长、产酸和黏附影响的实验研究[J]. 全科口腔医学电子杂志,2015,2(10):102−103. [GUO H L, WANG Y X, JIN C X. Experimental study on the effects of xylitol on Actinomycetes growth, acid production and adhesion[J]. General Journal of Stomatology,2015,2(10):102−103. -
期刊类型引用(2)
1. 陈晓,孙东方,孙萍,袁延祥,李斌,黄山. 三果汤对口腔致病菌抑制效果研究. 口腔护理用品工业. 2025(01): 34-37 .  百度学术
百度学术
2. 毛志成,张胜,李静,李亚男,候少华,张莉. 桂花提取物槲皮苷对牙龈卟啉单胞菌和具核梭杆菌体外抑菌功能的研究. 职业与健康. 2024(23): 3184-3187 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:


 下载:
下载:



