Optimization of Ultrasonic Assisted Extraction of Tibetan Sheep Skin Collagen Peptide by Response Surface Methodology and Its Antioxidant Activity in Vivo
-
摘要: 为明确超声辅助提取对藏羊皮胶原蛋白肽含量及功能活性的影响。试验采用响应面法研究了料液比、超声功率和超声时间3个因素,确定了胶原蛋白肽最佳超声辅助提取工艺;并对藏羊皮胶原蛋白肽进行了抗氧化能力分析,模拟消化过程中的还原力和·OH清除能力研究。结果表明:超声辅助处理能明显提高胶原蛋白肽含量,最佳超声提取工艺为料液比1:18、超声功率220 W,超声时间27 min,藏羊皮胶原蛋白肽含量为30.21%±1.67%。超声波辅助提取后胶原肽的还原力和·OH清除率为0.49和83.2%,与超声前的胶原肽相比分别提高了4%和38.3%,经胃肠消化后还原力和·OH均有一定程度的下降,但仍然具有较好的抗氧化活性。超声辅助提取藏羊皮胶原蛋白肽具有提高胶原蛋白肽含量和增强体内抗氧化活性的优势,为功能性产品的开发提供了数据参考。Abstract: In order to determine the effect of ultrasonic extraction on the content and functional activity of collagen peptide from Tibetan sheep skin, solid-liquid ratio, ultrasonic power and ultrasonic time were studied by response surface method to determine the best ultrasonic extraction process of collagen peptide. The antioxidant capacity, reduction power and ·OH scavenging ability of collagen peptide from Tibetan sheep skin was analyzed. The results showed that ultrasound-assisted treatment had significantly affected the content of collagen peptide and antioxidant activity. The optimal ultrasonic extraction conditions were solid-liquid ratio 1:18, ultrasonic power 220 W and ultrasonic time 27 min. The collagen peptide content of Tibetan sheep skin was 30.21%±1.67%. The reduction power and ·OH scavenging rate of collagen peptide after ultrasonic assisted extraction were 0.49 and 83.2%, which were increased by 4% and 38.3% compared with those before ultrasonic extraction, respectively. After gastrointestinal digestion, the reduction power and ·OH decreased to a certain extent, but still had good antioxidant activity. Ultrasound-assisted extraction of collagen peptide from Tibetan sheep skin has the advantages of increasing the content of collagen peptide and enhancing antioxidant activity in vivo, which provides data reference for the development of functional products.
-
藏羊(Tibetan sheep)主要分布在青藏高原,藏羊产量逐年增加,但对于藏羊皮的应用还处在皮革加工制品方向,产品附加值不高且加工过程对环境造成污染。青海省素有“中国藏羊之府”之称,藏羊总数占全国40%以上,藏羊皮富含胶原蛋白,如果从藏羊皮中提取胶原蛋白肽,所需设备简单,成本较低,只需配备必要的仪器就可以真正综合利用藏羊皮,使其变废为宝[1]。胶原蛋白肽(Collagen peptides)是胶原蛋白经化学法或生物酶法降解得到的一系列由氨基酸组成的产物,可进一步提高胶原蛋白的水溶性和生物活性[2],胶原蛋白肽易被人体吸收,能在人体内快速有效发挥其作用和功能[3]。
自由基的产生是正常有氧细胞代谢的结果,正常情况下机体内抗氧化系统可以提高自由基对机体损伤的抑制效果[4]。然而高浓度下的自由基可能会导致氧化应激,造成机体细胞代谢紊乱,甚至导致细胞死亡,引发患病状态[5]。氧化性损伤会随着时间累积,参与癌症、心血管和神经性疾病的发展以及衰老过程。同时,免疫系统也极易受到氧化剂和抗氧化剂平衡的影响,不受控制的自由基产生会损害免疫系统的功能和防御机制[6]。大量研究表明具有抗氧化活性的肽具有很强的自由基清除能力,可以参与到体内抗氧化的进程[7]。藏羊皮数量多,来源丰富,研究藏羊皮抗氧化肽的提取和理化性质,能更好地实现其增值利用,降低资源浪费和环境污染,超声波处理在不破坏原料性质的前提下,可加速分散组织和细胞结构,促进溶剂与细胞结合,加快酶与底物结合的效率,提高胶原蛋白肽含量[8],目前已有不少关于从牛皮、鱼皮等组织中提取胶原蛋白的研究报告,瞿怡等[9]利用超声波辅助法从牛皮中提取出胶原蛋白,比未超声处理的胶原提取率提高了13.58%;栾俊家等[10]采用酶解法从秋刀鱼中提取出抗氧化活性较强的胶原蛋白肽;Zou等[11]以中华鳖为原料研究了经超声波处理后的体外消化特性,结果表明超声波能显著提高胶原蛋白的得率,抗氧化性能也明显优于未经超声波处理的中华鳖。但从藏羊皮中提取胶原蛋白的报道并对其理化性质的研究较少。本文研究了响应面法优化超声辅助提取藏羊皮中的胶原蛋白肽的最佳工艺及对抗氧化活性的影响,并在模拟胃肠道消化过程中分析胶原蛋白肽的还原力和·OH的清除能力,以期为藏羊皮在食品抗氧化、功能食品、高附加值的抗氧化肽等方面的应用提供新思路。
1. 材料与方法
1.1 材料与仪器
藏羊皮 购于大通康鑫牛羊养殖基地,采集后用蒸馏水清洗处理,置于−20 ℃冷冻柜里保存备用;胃蛋白酶(100000 U/mg)、胰蛋白酶(25000 U/mg)、碱性蛋白酶(200000 U/g) 北京Solarbio科技有限公司:猪胆盐 国药集团化学试剂有限公司;其他试剂均为分析纯。
BS423S电子天平 深圳市新朗普电子科技有限公司;78-1磁力加热搅拌器 常州国华电器有限公司;JY92-IIN超声波细胞粉碎机 宁波新芝生物科技股份有限公司;TGL-16M高速离心机 上海卢湘仪离心机仪器有限公司;UV-3200 型紫外-可见分光光度计 上海美普达仪器有限公司;Milli-Q超纯水仪 广州皇河仪器科技有限公司;LC-162B冰箱 青岛海尔集团公司。
1.2 实验方法
1.2.1 藏羊皮营养成分的测定
水分含量测定:按照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》[11];灰分含量测定:按照GB 5009.4—2016《食品安全国家标准食品中灰分的测定》[12];脂肪含量测定:按照GB 5009.6—2016 《食品安全国家标准食品中脂肪的测定》[13];蛋白质含量测定:按照GB 5009.5—2016《食品安全国家标准食品中蛋白质的测定》[14]。
1.2.2 藏羊皮的预处理
用适量的清水清洗藏羊皮,剔除表皮毛发和皮下脂肪,将其剪成小块。浸入10%NaCl溶液[15]。将预处理后的藏羊皮去除脂肪,再用10倍体积的脱钙剂0.5 mol/L的EDTA-Na2溶液中进行脱钙处理,将预处理好的藏羊皮加入到0.5 mol/L的乙酸介质中进行溶胀,然后进行组织捣碎,得到匀浆液。
1.2.3 藏羊皮胶原蛋白肽的提取工艺流程及操作要点
向装有10 g 藏羊皮的烧杯中,加入一定量的去离子水,再按6000 U/g加0.3 g碱性蛋白酶,混匀用1.0 mol/L HCl调节pH为9.0,在40 ℃水浴锅中酶解4 h,保证反应过程pH稳定在约9.0,100 ℃灭酶10 min,冷却后,10000 r/min离心15 min,收集上清液冻干,即得藏羊皮胶原蛋白肽[16]。
1.2.4 单因素实验设计
精确称取藏羊皮匀浆液,置于超声波细胞破碎机中辅助提取,经碱性蛋白酶酶解后,分别对料液比、超声功率、超声时间三个因素进行梯度探讨。探究不同料液比(1:5、1:10、1:15、1:20、1:25)、超声功率(100、200、300、400、500 W)、超声时间(10、20、30、40、50 min)三个因素对胶原蛋白肽含量的影响,以Alcalase酶解蛋白肽为对照组,并以胶原蛋白肽含量作为单因素实验测定结果的判断指标[17],初定条件为:料液比为1:15(g/mL),超声功率200 W,超声时间30 min。
1.2.5 响应面优化试验设计
单因素实验基础上,选择料液比(A)、超声功率(B)和超声时间(C)为响应变量,胶原蛋白肽含量(R1)为响应值,试验因素水平设计见表1。
表 1 响应面试验因素水平设计Table 1. Factors and levels of response surface test水平 A B C 料液比(g/mL) 超声功率(W) 超声时间(min) −1 1:15 100 10 0 1:20 200 20 1 1:25 300 30 1.2.6 胶原蛋白肽含量测定
1.2.6.1 标准曲线的制作
精密称取(2.128 mg/mL)牛血清蛋白标准液0.0、0.5、1.0、1.5、2.0、2.5、3.0 mL,置于25 mL具塞离心管中,加去离子水至3 mL,再各加双缩脲试剂2 mL,摇匀混和30 s,静置10 min,以标准品0.0浓度为空白,按照分光光度法,在540 nm波长处测定吸光度。以浓度为x吸光度为y,绘制标准曲线[18]。在浓度0~3 mg/mL范围内回归方程为y=0.0871x−0.004,R2=0.9962。
1.2.6.2 胶原蛋白肽含量的测定
取2.5 mL样品溶液与2.5 mL三氯乙酸(10%)溶液摇匀,2000 r/min离心10 min后取上清液至50 mL容量瓶中,用5%的三氯乙酸定容,摇匀。取3 mL定容后的溶液与2 mL的双缩脲试剂混匀,静置后,3000 r/min离心10 min,紫外可见分光光度计在540 nm波长处测定吸收峰,根据标准曲线计算出样品溶液中样品水解液中的多肽含量[19]。
胶原蛋白肽含量(%)=(标准曲线对应的浓度1mg/mL)×100 1.2.7 消化实验
1.2.7.1 体外模拟胃液消化实验
将藏羊皮胶原蛋白肽配制为2、4、6、8、10、12 mg/mL不同浓度梯度的溶液,用1.0 mol/L HCl调节pH为2,按酶与底物1:40的比例加入胃蛋白酶,在恒温37 ℃水浴锅中消化2 h,100 ℃水浴灭酶,冷却至室温,8000 r/min离心10 min取上清,测定其还原性及对羟自由基的清除效果[20]。
1.2.7.2 体外模拟肠液消化实验
用1.0 mol/L NaOH将经过胃蛋白酶消化过的胶原蛋白肽水解液的pH调为7.5,按酶与底物1:25的比例加入胰蛋白酶和适量的牛胆盐恒温37 ℃消化2 h,100 ℃水浴灭酶,冷却至室温,8000 r/min离心10 min取上清,测定其还原性及对羟自由基的清除效果[21]。
1.2.8 抗氧化功能分析
1.2.8.1 还原力的测定方法
分别向试管中加入1 mL不同浓度的待测多肽溶液,与2.5 mL 0.2 mol/L pH6.6的磷酸盐缓冲溶液和2.5 mL(1%)铁氰化钾溶液混合均匀,在50 ℃恒温避光反应20 min,冷却后继续加入2 mL 10%三氯乙酸溶液,在8000 r/min条件下离心10 min,取2 mL上清液加入2 mL蒸馏水和0.4 mL 0.1 g/100 mL 三氯化铁,混匀后静置10 min,在700 nm处测定体系吸光度,用蒸馏水作为空白对照组,还原能力用吸光度(A700 nm) 表示[22]。
1.2.8.2 羟自由基清除率的测定方法
用超纯水将样品配制为 2、4、6、8、10、12 mg/mL的样品溶液,取2 mL样品加入500 μL 9 mmol/L水杨酸(乙醇溶液)、500 μL 9 mmol/L FeSO4, 溶液、500 μL 20 mmol/L H2O2溶液,混匀后37 ℃水浴 30 min,以6000 r/min离心10 min,在 510 nm处测吸光值 A1。采用下式计算·OH清除率[23]:
清除率(%)=(1−A1−A2A0)×100 (2) 式中:A0:蒸馏水取代样品所测吸光值;A1:酶解液在510 nm吸光值;A2:甲醇取代H2O2所测的吸光值。
1.3 数据处理
采用SPSS 22.0软件进行数据分析,运用单因素方差统计分析(ANOVA),以P<0.05表示数据间具有显著性差异。Design-Expert 11软件用于响应面分析,得出最优提取值,所有实验均重复3次,数据均以平均值±标准差表示。
2. 结果与分析
2.1 藏羊皮基本成分
将藏羊皮脱毛以后进行基础成分分析,由表2可知藏羊皮中蛋白质含量为21.2%,脂肪和灰分分别为15%和0.27%,藏羊皮中蛋白质含量较高,与鹿皮相比粗蛋白含量提高了4.99%[24],是鸡皮粗蛋白含量的2倍[25],因此藏羊皮可作为胶原蛋白肽的优质来源。
表 2 藏羊皮基本成分Table 2. Basic ingredients of Tibetan sheep skin指标 水分 灰分 蛋白质 脂肪 含量(%) 65.89±0.57 0.27±0.02 21.2±0.14 15.0±0.07 2.2 藏羊皮胶原蛋白肽提取工艺
2.2.1 料液比对胶原蛋白肽含量的影响
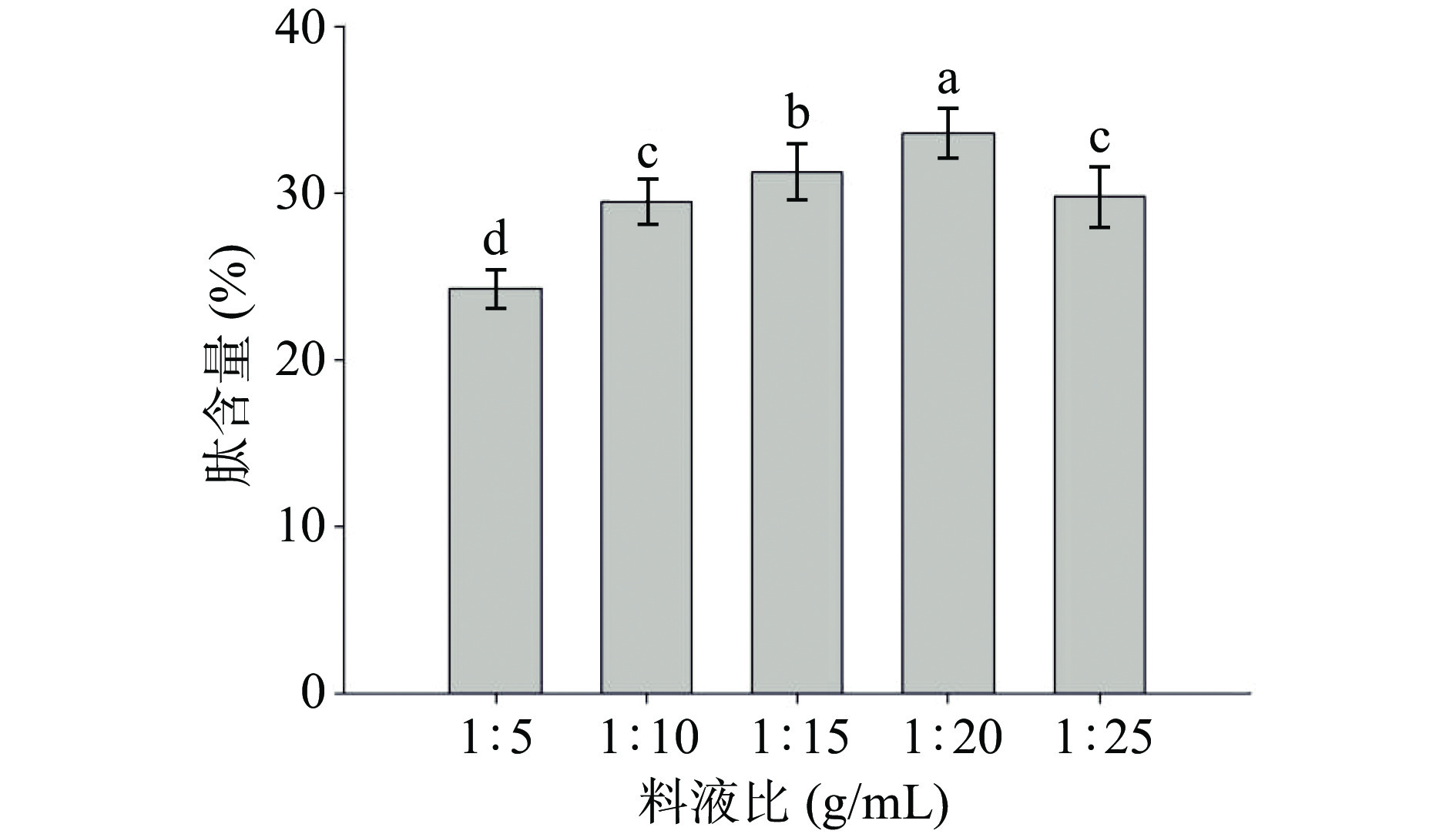
由图1可知,藏羊皮胶原蛋白肽含量随着料液比的增大呈现先上升后下降的趋势,当料液比达到1:20(g/mL)时,肽含量达到顶峰值33.4%。由于溶剂增多,藏羊皮匀浆液与溶剂的接触面积增大,酶与底物作用位点增多,胶原蛋白肽含量增加。之后随着过度增大料液比,胶原蛋白肽含量逐渐下降,可能由于溶剂比例继续增大,其他可溶性物质溶出,酶浓度降低,胶原蛋白肽含量下降,因此,最佳料液比选定为1:20(g/mL)。
2.2.2 超声功率对胶原蛋白肽含量的影响
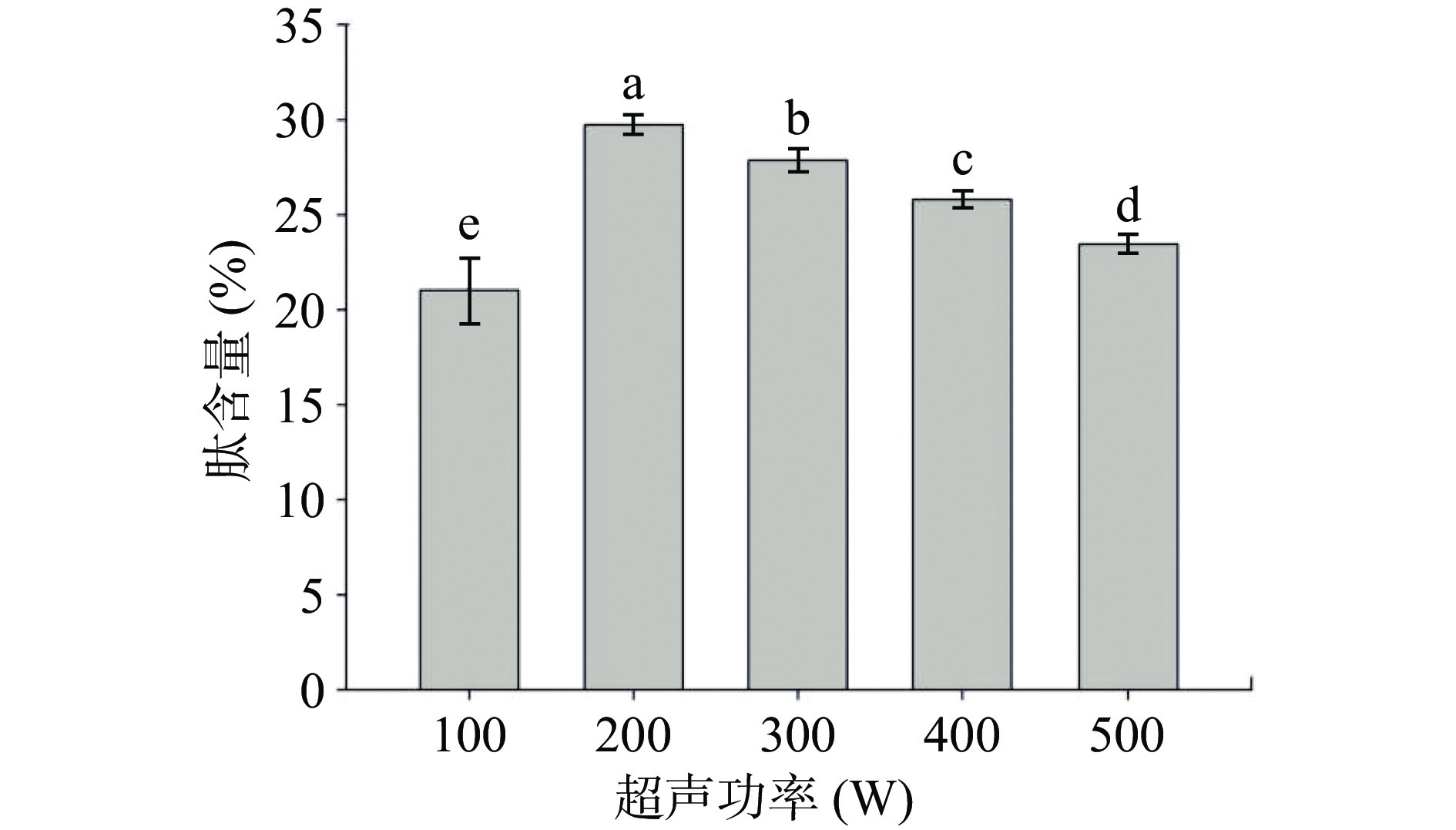
由图2可知,胶原蛋白肽含量在超声功率为100~200 W范围内呈现增长趋势,并在超声功率为200 W时达到峰值。随着超声功率在200~500 W内增加时,胶原蛋白肽含量开始下降。在一定超声功率范围内所产生的超声波使细胞的疏松程度增大,易暴露酶蛋白和底物蛋白分子内部的活性位点,胶原蛋白肽含量增多。然而过高的超声强功率,超声波的剪切力增强,使酶分子的构象和原料内部结构受到破坏[26],从而导致多肽含量下降。徐红萍等[27]采用超声波辅助酶解东海海参,当超声波功率为100 W时, 低聚肽含量最高可达到70.5%,超声功率的增强会破坏蛋白酶的结构,使低聚肽含量下降。综合实验结果,超声功率在200 W时更加合适。
2.2.3 超声时间对胶原蛋白肽含量的影响
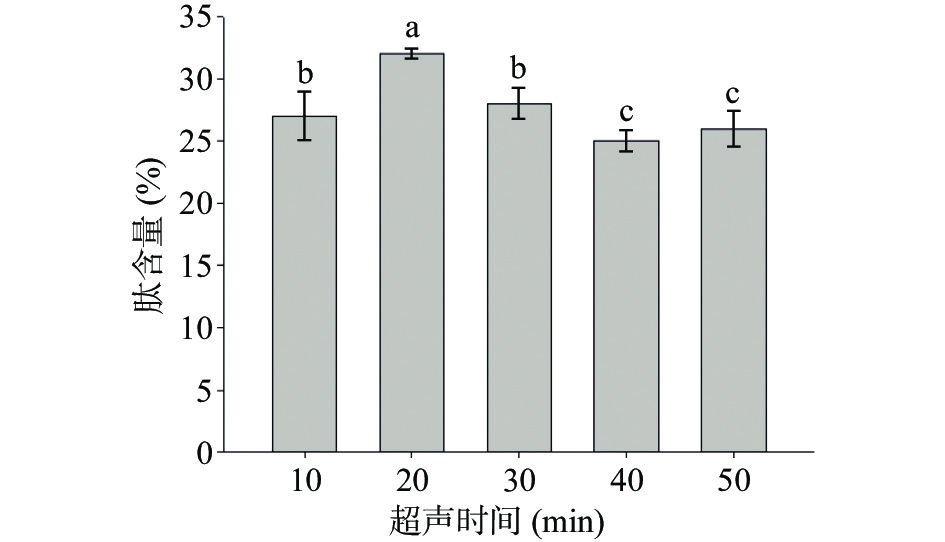
由图3可知,胶原蛋白肽含量随着超声时间延长整体呈现先上升后下降的趋势。超声时间10~20 min,胶原蛋白肽含量增加,由于超声时间的延长,产生了强烈的机械振动和空化作用,分子振动频率加快,有利于酶与样品融合,加快胶原蛋白肽的提取。超声时间大于20 min后,超声体系温度过高而降低酶的活性或破坏胶原蛋白的结构导致胶原蛋白肽含量开始下降[28],因此,初步选择超声时间20 min为试验最佳值。
2.3 响应面试验结果与分析
2.3.1 响应面模型设计与分析
依据单因素实验,由Box Behnken试验设计原理,以料液比、超声功率及超声时间3个因素,共17个试验点进行分析,结果见表3。
表 3 响应面分析方案及试验结果Table 3. Response surface analysis scheme and test results试验号 A 料液比 B 超声功率 C 超声时间 肽含量(%) 1 −1 0 1 24.89 2 0 1 1 28.39 3 0 0 0 31.98 4 −1 0 −1 25.31 5 0 −1 1 27.45 6 0 0 0 30.14 7 0 −1 −1 26.01 8 0 0 0 32.87 9 1 0 1 27.96 10 1 0 −1 26.39 11 −1 1 0 26.31 12 0 0 0 32.28 13 −1 −1 0 25.02 14 0 1 −1 30.9 15 1 1 0 26.98 16 0 0 0 30.71 17 1 −1 0 25.52 运用软件Design Expert,得到提取条件和胶原蛋白肽含量(R1)的回归方程为:
R1=31.60+0.67A+1.07B+0.01C+0.042AB+0.5AC−0.99BC−3.84A2−1.79B2−1.61C2
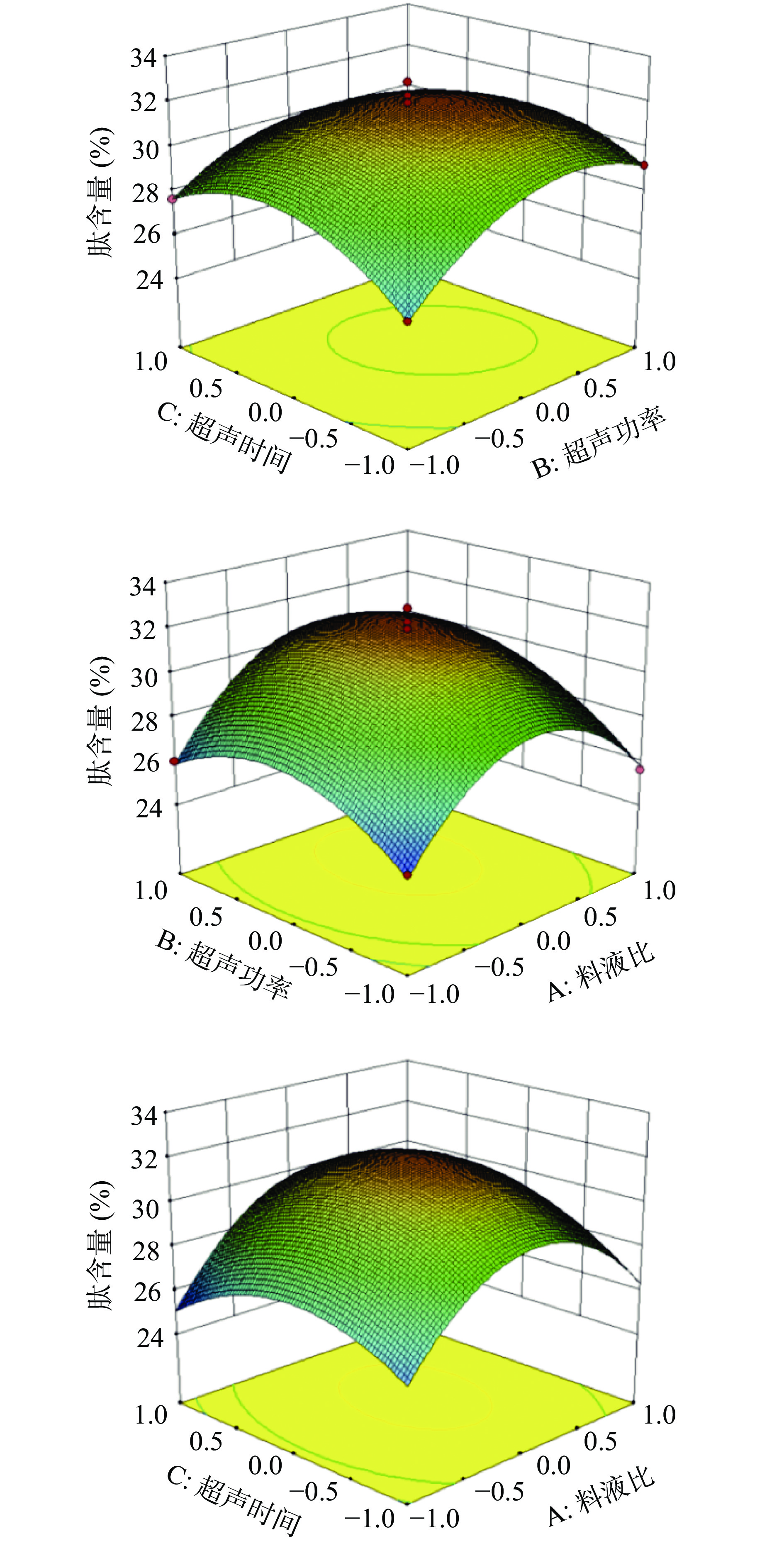
各因素对响应值的影响程度可由上式各系数绝对值大小反映:模型的二次项系数均是负数,其抛面开口朝下,有极大值点,因此可对其优化评价[29-30]。对上述模型展开方差分析,由表4可知,模型F值为10.86, P=0.0024<0.05,表明该二次方程模型极显著,失拟项P值为0.5745(P>0.05),失拟项不显著。决定系数R2=0.9718,说明影响胶原蛋白肽含量97.18%来源于超声功率、超声时间和料液比,预测值与实测值之间吻合较好。变异系数CV=2.42%,说明该模型可信度高能够较好地反映真实值[31], R2adj为0.9356,说明所选用的二次回归模型是适当的,该模型能够描述超声波辅助提取对藏羊皮胶原肽含量的变化关系,因此可用该回归方程优化实验方案。由F值可知,三个因素对胶原蛋白肽含量影响的主次顺序为:超声功率B>超声时间C>料液比A。为了更加直观地表现2个因素同时对胶原蛋白肽含量的影响,绘制响应面图(如图4)。由图4可以看出,料液比和超声时间、超声功率的交互作用不显著(P>0.05)。
表 4 胶原蛋白肽含量的响应面二次模型方差分析Table 4. Response surface quadratic model variance analysis of collagen peptide content来源 平方和 自由度 均方 F值 P值 显著性 模型 112.43 9 12.49 10.86 0.0024 ** A 3.54 1 3.54 3.07 0.1230 B 9.20 1 9.20 8.00 0.0255 * C 8.000 1 8.00 6.952 0.9797 AB 7.225 1 7.225 6.279 0.9391 AC 0.99 1 0.99 0.86 0.3845 BC 3.90 1 3.90 3.39 0.1082 A2 62.22 1 62.22 54.07 0.0002 ** B2 13.56 1 13.56 11.78 0.0110 * C2 10.97 1 10.97 9.53 0.0176 残差 8.06 7 1.15 失拟检验 2.91 3 0.97 0.75 0.5745 纯误差 5.14 4 1.29 总误差 120.48 16 R2=0.9718 R2adj=0.9356 注:**:差异极显著,P<0.01;*:差异显著,P<0.05。 2.3.2 实验验证
经软件分析该模型得到的最佳超声条件为料液比1:18.5、超声功率216 W,超声时间26.7 min时,其胶原蛋白肽含量为32.71%。参考实际操作料液比1:18、超声功率220 W,超声时间27 min测得胶原肽含量为30.21%±1.67%,与拟合模型的预测值接近,说明该模型合理,参数可靠,可以用来预测提取藏羊皮的最优工艺条件。与常规酶法提取藏羊皮胶原蛋白肽的含量(23.08%±0.56%)相比增高7%左右,说明该工艺可提高胶原蛋白肽含量。
2.4 藏羊皮胶原蛋白肽体外模拟胃、肠道消化中抗氧化活性变化
胶原蛋白肽的抗氧化活性可以有效清除产生的自由基,增强免疫力。胶原蛋白肽的抗氧化活性,在到达目标器官之前,它们很可能被内源性酶消化成为氨基酸,从而失去活性。因此,通过模拟胃肠道消化考察胶原肽的抗氧化性,了解抗氧化肽在消化过程中的活性变化对实际应用具有积极的意义[32]。
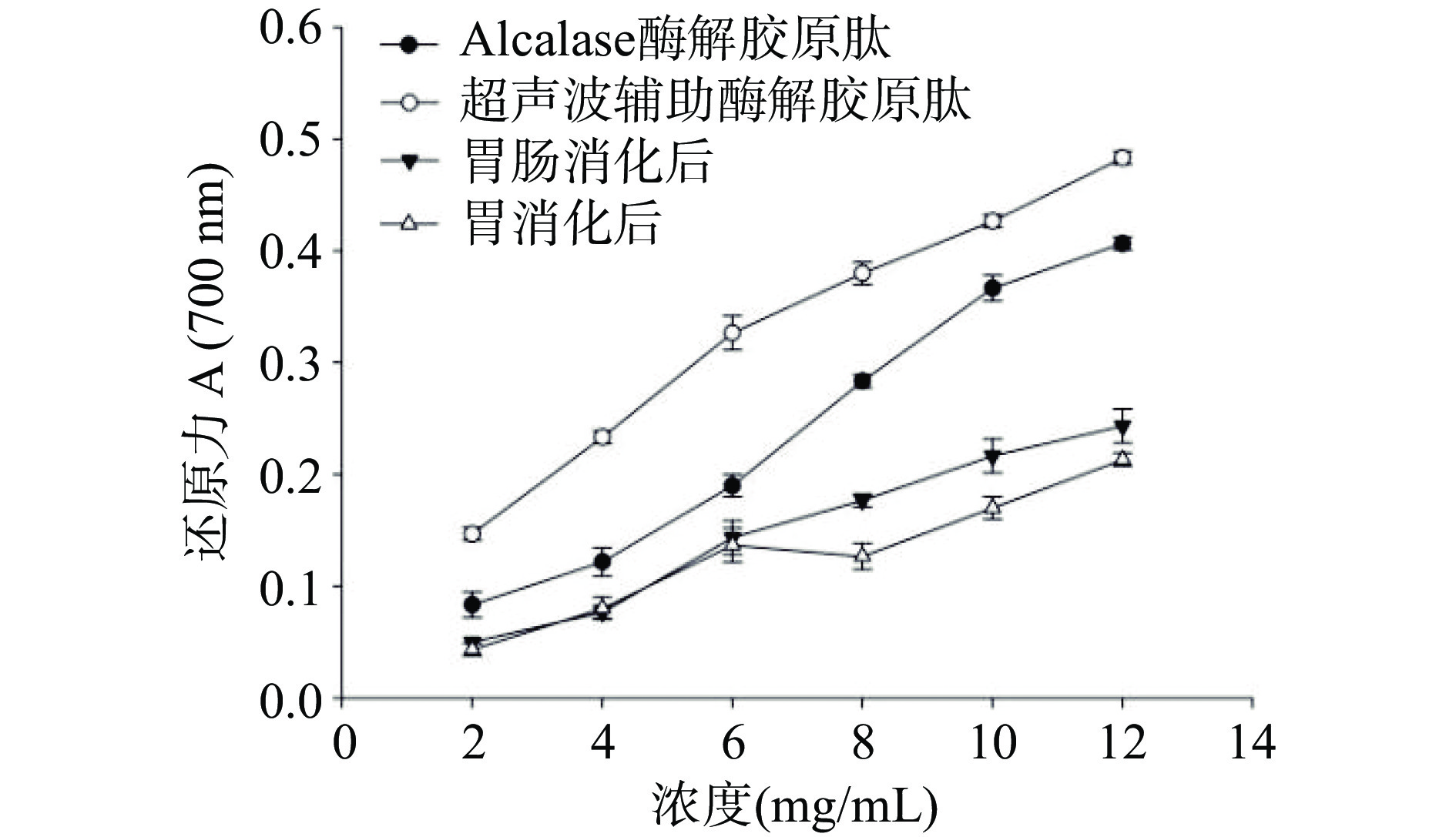
2.4.1 藏羊皮胶原蛋白肽的还原力
多肽的总还原能力可通过吸光度的大小来反映,并与吸光度数值呈正比。由图5可知,藏羊皮胶原蛋白肽的还原力与胶原蛋白肽的浓度有明显的量效关系。以响应面法优化所得最佳工艺制备的抗氧化肽,经超声波辅助酶解胶原肽能够显著提高藏羊皮酶解产物的还原力,且随着胶原蛋白肽浓度的增加,胶原蛋白肽的还原力持续增高,明显高于经Alcalase酶解的胶原蛋白肽。在浓度为12 mg/mL时经超声波辅助酶解胶原蛋白肽的还原力达到0.49,对照碱性蛋白酶处理组提高了0.1,这表明超声波处理过的藏羊皮酶解产物可以显著增强其还原力。郭佳俊等[33]以牛骨为原料,进行超声波辅助酶解处理,经体外抗氧化结果表明,经超声处理的牛骨胶原肽对DPPH自由基清除率和超氧阴离子自由基清除率显著高于未超声处理组。Yu等[34]研究了超声预处理对猪肝脏蛋白水解物的影响,超声预处理45 s的水解液对亚铁离子的螯合能力和还原能力最强。
此外,在体外模拟胃肠道消化过程中,经胃蛋白酶酶解胶原蛋白肽的还原力呈现下降的趋势,可能是由于胃蛋白酶将肽段水解为游离的氨基酸,胶原蛋白肽的含量降低,还原力减弱,且还原力的降低主要在胃消化阶段完成,说明胃蛋白酶对肽的酶解作用不利于还原力高的肽段的保留,可能是胰蛋白酶作用的酶切位点产生的多肽片段的还原能力较胃蛋白酶作用的酶切位点产生的多肽片段强[35]。在体外模拟胃肠道消化过程中,胰蛋白酶改变了胶原肽链的结构和延伸程度,导致活性下降。实验结果表明,藏羊皮胶原蛋白肽经胃蛋白酶和胰蛋白酶消化后抗氧化活性降低,但仍具有一定的消化耐受性,并保留一定的抗氧化活性。
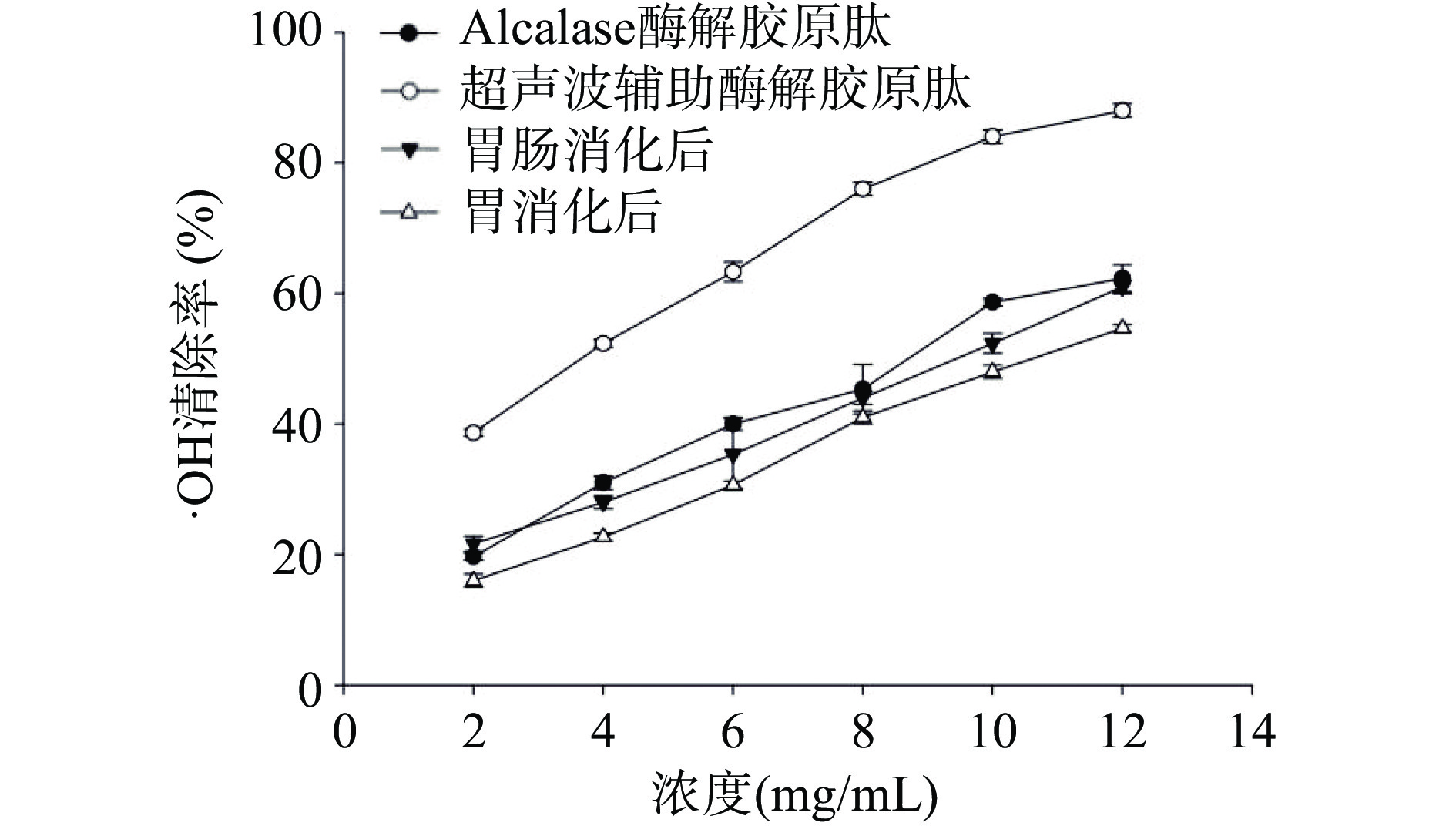
2.4.2 藏羊皮胶原蛋白肽的羟自由基清除能力
由图6可知,超声辅助能够提高藏羊皮胶原蛋白肽对·OH清除效果,且随着胶原蛋白肽浓度的升高对·OH清除能力不断上升[36],在浓度为12 mg/mL时经超声波辅助酶解胶原肽清除羟自由基的能力最强为83.2%,可能是因为超声波产生的空化效应和强烈振动,加速胶原分子的扩散和溶解,有利于更多酶切位点的暴露。经胃消化后的胶原蛋白肽,在酸性的环境下,胶原蛋白肽对·OH的清除能力明显下降,经胃肠道消化以后,在胰蛋白酶的作用下和适宜的pH环境中,对·OH的清除能力略高于模拟胃消化过程,这表明胆盐和胰蛋白酶能提高藏羊皮胶原蛋白肽对·OH的清除能力。研究发现,经胃肠道消化前后,胶原蛋白肽具有一定的肠道耐受能力。杨玉亮等[37]研究表明牦牛骨胶原蛋白肽经胃肠消化前后对·OH清除能力无明显差异,这与本文的研究结果有差异,可能是超声波产生的空化效应,使肽段的氨基酸序列发生断裂,在胃肠道中经胃蛋白酶和胰蛋白酶的作用,分解为单个氨基酸使·OH清除能力下降。
3. 结论
本研究利用超声波辅助酶法提取藏羊皮胶原蛋白肽,测定了藏羊皮的基本成分,优化胶原蛋白肽的提取工艺,考察了藏羊皮胶原蛋白肽模拟胃肠道前后的还原力和·OH清除能力。结果表明:超声波可以明显提高藏羊皮皮胶原蛋白肽的提取率,通过超声波辅助酶法得到了藏羊皮胶原蛋白肽的最佳提取条件:1:18、超声功率220 W,超声时间27 min,胶原蛋白肽含量为30.21%±1.67%。体外抗氧化活性研究表明,胶原蛋白肽具有较强的还原力和清除·OH的能力。
该研究为胶原蛋白多肽的综合研发提供理论依据,所有的抗氧化剂都必须经过胃肠道环境的消化,才能在体内发挥清除自由基的作用,而消化过程也会影响藏羊皮胶原蛋白肽抗氧化能力的保留率。通过体外模拟肠胃消化法可以评价胶原蛋白肽在胃肠消化模拟过程中还原能力的变化规律。但体内环境相当复杂多变,还受到原料品质、取样位置、冷冻时间等的影响,因此可通过进一步的动物实验、人体实验等进行验证探究。
-
表 1 响应面试验因素水平设计
Table 1 Factors and levels of response surface test
水平 A B C 料液比(g/mL) 超声功率(W) 超声时间(min) −1 1:15 100 10 0 1:20 200 20 1 1:25 300 30 表 2 藏羊皮基本成分
Table 2 Basic ingredients of Tibetan sheep skin
指标 水分 灰分 蛋白质 脂肪 含量(%) 65.89±0.57 0.27±0.02 21.2±0.14 15.0±0.07 表 3 响应面分析方案及试验结果
Table 3 Response surface analysis scheme and test results
试验号 A 料液比 B 超声功率 C 超声时间 肽含量(%) 1 −1 0 1 24.89 2 0 1 1 28.39 3 0 0 0 31.98 4 −1 0 −1 25.31 5 0 −1 1 27.45 6 0 0 0 30.14 7 0 −1 −1 26.01 8 0 0 0 32.87 9 1 0 1 27.96 10 1 0 −1 26.39 11 −1 1 0 26.31 12 0 0 0 32.28 13 −1 −1 0 25.02 14 0 1 −1 30.9 15 1 1 0 26.98 16 0 0 0 30.71 17 1 −1 0 25.52 表 4 胶原蛋白肽含量的响应面二次模型方差分析
Table 4 Response surface quadratic model variance analysis of collagen peptide content
来源 平方和 自由度 均方 F值 P值 显著性 模型 112.43 9 12.49 10.86 0.0024 ** A 3.54 1 3.54 3.07 0.1230 B 9.20 1 9.20 8.00 0.0255 * C 8.000 1 8.00 6.952 0.9797 AB 7.225 1 7.225 6.279 0.9391 AC 0.99 1 0.99 0.86 0.3845 BC 3.90 1 3.90 3.39 0.1082 A2 62.22 1 62.22 54.07 0.0002 ** B2 13.56 1 13.56 11.78 0.0110 * C2 10.97 1 10.97 9.53 0.0176 残差 8.06 7 1.15 失拟检验 2.91 3 0.97 0.75 0.5745 纯误差 5.14 4 1.29 总误差 120.48 16 R2=0.9718 R2adj=0.9356 注:**:差异极显著,P<0.01;*:差异显著,P<0.05。 -
[1] 高金龙. 山羊皮中胶原蛋白的提取及理化特性研究[D]. 呼和浩特: 内蒙古农业大学, 2010. GAO J L. Study on extraction and physicochemical properties of collagen from goat skin[D]. Hohhot: Inner Mongolia Agricultural University, 2010.
[2] HAJFATHALIAN M, GHELICHI S, GARCÍA-MORENO P J, et al. Peptides: Production, bioactivity, functionality, and applications[J]. Critical Reviews in Food Science and Nutrition,2018,58(18):3097−3129. doi: 10.1080/10408398.2017.1352564
[3] ZHAO X, ZHANG X, LIU D, Collagen peptides and the related synthetic peptides: A review on improving skin health[J]. Journal of Functional Foods, 2021, 86: 104680.
[4] WANG B, WANG Y M, CHI C F, et al. Isolation and characterization of collagen and antioxidant collagen peptides from scales of croceine croaker (Pseudosciaena crocea)[J]. Marine Drugs,2013,11(11):4641−4661. doi: 10.3390/md11114641
[5] GAO L, WANG Z, ZHENG L I, et al. The characterization of acid and pepsin soluble collagen from ovine bones (Ujumuqin sheep)[J]. Journal of Integrative Agriculture,2018,17(3):704−711. doi: 10.1016/S2095-3119(17)61751-9
[6] LEÓN LÓPEZ A, FUENTES JIMÉNEZ L, HERNÁNDEZ FUENTES A D, et al. Hydrolysed collagen from sheepskins as a source of functional peptides with antioxidant activity[J]. International Journal of Molecular Sciences,2019,20(16):3931. doi: 10.3390/ijms20163931
[7] SIBILLA S, GODFREY M, BREWER S, et al. An overview of the beneficial effects of hydrolysed collagen as a nutraceutical on skin properties: Scientific background and clinical studies[J]. The Open Nutraceuticals Journal,2015,8(1):29−42. doi: 10.2174/1876396001508010029
[8] 周婷, 卢方云, 黄瑾, 等. 响应面法优化超声辅助酶法制备无骨鸡爪胶原蛋白肽[J]. 食品工业科技,2021,42(19):182−189. [ZHOU T, LU F Y, HUANG J, et al. Optimization of ultrasound-assisted enzymatic preparation of boneless chicken claw collagen peptide by response surface methodology[J]. Science and Technology of Food Industry,2021,42(19):182−189. [9] 瞿怡, 苏寒雨, 刘文涛, 等. 超声波辅助法提取牛皮胶原蛋白[J]. 皮革科学与工程,2018,28(2):5−9. [QU Y, SU H Y, LIU W T, et al. Ultrasound-assisted extraction of collagen from bovine skin[J]. Leather Science and Engineering,2018,28(2):5−9. doi: 10.19677/j.issn.1004-7964.2018.02.001 [10] 栾俊家, 李学鹏, 励建荣, 等. 响应面法优化秋刀鱼酶解制备抗氧化活性肽的工艺[J]. 食品工业科技,2022,43(5):172−181. [LUAN J J, LI X P, LI J R, et al. Optimization of enzymatic hydrolysis process of antioxidant active peptides from Saury chinensis by response surface methodology[J]. Science and Technology of Food Industry,2022,43(5):172−181. [11] ZOU Y E, XU P, LI P, et al. Effect of ultrasound pre-treatment on the characterization and properties of collagen extracted from soft-shelled turtle (Pelodiscus sinensis)[J]. LWT-Food Science and Technology,2017,82:72−81. doi: 10.1016/j.lwt.2017.04.024
[12] 国家卫生和计划生育委员会. GB 5009.3-2016 食品安全国家标准食品中水分的测定[S]. 北京: 中国标准出版社, 2016. National Health and Family Planning Commission. GB 5009.3-2016 National standard for determination of moisture in food of national standard for food safety[S]. Beijing: Standards Press of China, 2016
[13] 国家卫生和计划生育委员会. GB 5009.4-2016 食品安全国家标准食品中灰分的测定[S]. 北京: 中国标准出版社, 2016. National Health and Family Planning Commission. GB 5009.4-2016 National standard for determination of ash content in national food safety standards[S]. Beijing: Standards Press of China, 2016.
[14] 国家食品药品监督管理总局, 国家卫生和计划生育委员会. GB 5009.6-2016 食品安全国家标准食品中脂肪的测定[S]. 北京: 中国标准出版社, 2016. State Food and Drug Administration, National Health and Family Planning Commission. GB 5009.6-2016 Determination of fat in national food safety standards[S]. Beijing: Standards Press of China, 2016.
[15] 国家食品药品监督管理总局, 国家卫生和计划生育委员会. GB 5009.5-2016 食品安全国家标准食品中蛋白质的测定[S]. 北京: 中国标准出版社, 2016. State Food and Drug Administration, National Health and Family Planning Commission. GB 5009.5-2016 Determination of protein in food of national standard for food safety[S]. Beijing: Standards Press of China, 2016.
[16] 王杉杉, 罗学刚, 苏峰丙, 等. 牦牛皮胶原蛋白的提取及性能分析[J]. 精细化工,2018,35(5):830−837. [WANG S S, LUO X G, SU F B, et al. Extraction and characterization of yak skin collagen[J]. Fine Chemicals,2018,35(5):830−837. doi: 10.13550/j.jxhg.20170573 [17] ANAND S, KAMATH S, CHUANG L, et al. Biochemical and thermo-mechanical analysis of collagen from the skin of Asian Sea bass (Lates calcarifer) and Australasian Snapper (Pagrus auratus), an alternative for mammalian collagen[J]. European Food Research and Technology,2013,236(5):873−882. doi: 10.1007/s00217-013-1950-9
[18] LUAN X X, FENG M Q, SUN J. Effect of Lactobacillus plantarum on antioxidant activity in fermented sausage[J]. Food Research International,2021,144:110351. doi: 10.1016/j.foodres.2021.110351
[19] 程妍. 骨胶原蛋白酶解工艺及骨营养粉对大鼠补钙功效的研究[D]. 兰州: 甘肃农业大学, 2009. CHENG Y. Study on osteosinolytic process and the effect of bone nutrition powder on calcium supplementation in rats[D]. Lanzhou: Gansu Agricultural University, 2009.
[20] 鲁伟, 任国谱, 宋俊梅. 蛋白水解液中多肽含量的测定方法[J]. 食品科学,2005(7):169−171. [LU W, REN G P, SONG J M. Determination of polypeptides in protein hydrolysate[J]. Food Science,2005(7):169−171. doi: 10.3321/j.issn:1002-6630.2005.07.039 [21] 曹振海, 乐彩虹, 陶宁萍, 等. 体外模拟消化对暗纹东方鲀鱼皮胶原蛋白肽结构特征及抗氧化活性的影响[J]. 食品与发酵工业,2021,47(23):61−69. [CAO Z H, LE C H, TAO N P, et al. Effects of simulated digestion in vitro on collagen peptide structure and antioxidant activity of Takifugu rubripes[J]. Food and Fermentation Industries,2021,47(23):61−69. doi: 10.13995/j.cnki.11-1802/ts.028686 [22] DING D, DU B, ZHANG C, et al. Isolation and identification of an antioxidant collagen peptide from skipjack tuna (Katsuwonus pelamis) bone[J]. RSC Advances,2019,9(46):27032−27041. doi: 10.1039/C9RA04665H
[23] OHATA M, UCHIDA S, ZHOU L, et al. Antioxidant activity of fermented meat sauce and isolation of an associated antioxidant peptide[J]. Food Chemistry,2016,194:1034−1039. doi: 10.1016/j.foodchem.2015.08.089
[24] 窦丹彤. 梅花鹿皮胶原蛋白肽制备及其活性研究[D]. 沈阳: 辽宁大学, 2021 DOU D T. Preparation of chicken skin collagen peptide and development of peptide rich drink[D]. Shenyang: Liaoning University, 2013.
[25] 曾庆冉. 鸡皮胶原蛋白肽的制备及其富肽饮品的开发[D]. 无锡: 江南大学, 2013. ZENG Q R. Preparation of chicken skin collagen peptide and development of peptide rich drink[D]. Wuxi: Jiangnan University, 2013.
[26] MOHAMMADI R, MOHAMMADIFAR M A, MORTAZAVIAN A M, et al. Extraction optimization of pepsin-soluble collagen from eggshell membrane by response surface methodology (RSM)[J]. Food Chemistry,2016,190:186−193. doi: 10.1016/j.foodchem.2015.05.073
[27] 徐红萍, 谢辉, 梁建灏, 等. 超声波辅助酶解制备东海海参胶原蛋白低聚肽及其活性的研究[J]. 浙江海洋大学学报(自然科学版),2018,37(5):388−393. [XU H P, XIE H, LIANG J H, et al. Preparation of collagen oligopeptide from sea cucumber by ultrasound-assisted enzymatic hydrolysis and its activity[J]. Journal of Zhejiang Ocean University (Natural Science),2018,37(5):388−393. doi: 10.3969/j.issn.1008-830X.2018.05.002 [28] TAN Y, CHANG S K C. Isolation and characterization of collagen extracted from channel catfish (Ictalurus punctatus) skin[J]. Food Chemistry,2018,242:147−155. doi: 10.1016/j.foodchem.2017.09.013
[29] YANG J, HUANG J, ZHU Z, et al. Investigation of optimal conditions for production of antioxidant peptides from duck blood plasma: Response surface methodology[J]. Poultry Science,2020,99(12):7159−7168. doi: 10.1016/j.psj.2020.08.060
[30] WANG D, ZHANG M, ZOU Y, et al. Optimization of flavourzyme hydrolysis condition for the preparation of antioxidant peptides from duck meat using response surface methodology[J]. The Journal of Poultry Science, 2018: 0160155.
[31] 苏继磊, 李姣, 陈敏, 等. 响应面法优化太平洋褶柔鱼肌肉蛋白水解物的抗氧化活性[J]. 食品科技,2021,46(6):121−128. [SU J L, LI J, CHEN M, et al. Optimization of antioxidant activity of muscle protein hydrolysates from Pleurophilus Pacific by response surface methodology[J]. Food Science and Technology,2021,46(6):121−128. [32] 云一卿, 胡虞帆, 杨留明, 等. 体外模拟胃肠消化对缢蛏抗氧化活性的影响[J]. 食品安全质量检测学报,2022,13(5):1423−1429. [YUN Y Q, HU Y F, YANG L M, et al. Effects of simulated gastrointestinal digestion on antioxidant activity of Sinonovacula constricta[J]. Journal of Food Safety and Quality,2022,13(5):1423−1429. [33] 郭佳俊, 袁江涛, 刘贵珊. 牛骨胶原蛋白肽的超声辅助提取及抗氧化活性研究[J/OL]. 食品与发酵工业: 1−11 [2023-04-26]. DOI: 10.13995/j.cnki.11-1802/ts.031714. GUO J J, YUAN J T, LIU G S. Ultrasound-assisted extraction and antioxidant activity of bovine bone collagen peptide [J]. Food and Fermentation Industry: 1−11 [2022-07-05]. DOI: 10.13995/j.nki.11-1802/TS.031714.
[34] YU H C, TAN F J. Effect of ultrasonic pretreatment on the antioxidant properties of porcine liver protein hydrolysates[J]. International Journal of Food Science & Technology,2017,52(6):1392−1399.
[35] HU Z, YANG P, ZHOU C, et al. Marine collagen peptides from the skin of Nile Tilapia (Oreochromis niloticus): Characterization and wound healing evaluation[J]. Marine Drugs,2017,15(4):102. doi: 10.3390/md15040102
[36] MARX J L. Oxygen free radicals linked to many diseases: The oxygen free radicals, although made as by-products of normal oxygen-using reactions, nevertheless have a wide potential for causing cell injury[J]. Science,1987,235(4788):529−531. doi: 10.1126/science.3810154
[37] 杨玉亮, 衣大龙, 刘春雨, 等. 体外模拟消化对牦牛骨胶原蛋白肽抗氧化活性的影响[J]. 食品与发酵工业,2021,47(13):769−784. [YANG Y L, YI D L, LIU C Y, et al. Effects of simulated digestion on antioxidant activity of yak ossein peptidein vitro[J]. Food and Fermentation Industries,2021,47(13):769−784. -
期刊类型引用(2)
1. 文华英,王傅玉,张玉红. 青稞蕨麻酵素发酵工艺优化及其品质评价. 中国酿造. 2024(02): 199-205 .  百度学术
百度学术
2. 董平,徐向波,周奎,曹娜娜,吴华昌,邓静. 沙米面包配方优化及其品质研究. 食品工业科技. 2024(14): 155-164 .  本站查看
本站查看
其他类型引用(3)





 下载:
下载:


 下载:
下载:



