Isolation of Pure Species of Wild Boletaceae and Optimization of Inducer for Triterpenoid Synthesis in Liquid Culture
-
摘要: 目的:为获得牛肝菌人工纯菌株,提高液态培养菌丝及产三萜类物质的能力。方法:以云南鲜野生牛肝菌子实体为研究对象,采用组织分离法进行母体纯菌株分离并鉴定;以金属离子Ca2+、亚油酸及香菇水提物作为诱导剂,研究其对液态菌丝体中三萜类物质含量的影响。结果:经多次分离纯化获得1株纯菌种NG-3,经 rDNA-ITS分子生物学鉴定,NG-3为暗褐网柄牛肝菌(Phlebopus portentosus);对NG-3菌丝体进行SEM观察,在培养8~16 d时,出现具有结实能力的锁状联合形态菌丝。对3种诱导剂进行了响应面法优化,得到的结果为Ca2+浓度12 mmol/L、亚油酸量4%、香菇水提物浓度150 mg/100 mL,此时三萜含量为6.77 mg/g,比未加诱导剂三萜含量提高了76.00%。结论:3种诱导剂复合使用能够促进三萜类物质合成,提高其含量,为解决野生资源不足、实现牛肝菌功能产品产业化提供技术参数。Abstract: Objective: To obtain artificial pure strain of porcini and improve the ability of liquid culture mycelium and production of triterpenoid. Methods: The fresh wild Boletaceae fruit bodies from Yunnan were used for the study, and the parent pure strain was isolated and identified by tissue isolation method; Ca2+, linoleic acid, and mushroom aqueous extract were used as inducing agents to study their effects on the content of triterpenoids in liquid mycelium. Results: A pure strain of NG-3 was obtained by multiple purifications and identified by rDNA-ITS molecular biology as Phlebopus portentosus; the mycelium of NG-3 was observed by SEM, and the lock-like joint morphology mycelium with the ability of fruiting appeared at 8-16 d of cultivation. Three inducers were optimized by response surface methodology. The results showed that the concentration of Ca2+ was 12 mmol/L, the amount of linoleic acid was 4%, and the concentration of mushroom aqueous extract was 155 mg/100 mL, at which time the triterpene content was 6.77 mg/g, which was 76% higher than the triterpene content without inducer. Conclusion: The combination of three inducers can promote the synthesis of triterpenoids and increase their content, which can provide technical parameters to solve the shortage of wild resources and realize the industrialization of functional products of Boletaceae.
-
Keywords:
- wild Boletaceae /
- pure parent strain /
- liquid mycelium /
- triterpenoids /
- inductor
-
牛肝菌(Boletaceae)是真菌界(Fungi)、担子菌门(Basidiomycotina)、伞菌纲(Agaricates)著名的食药野生真菌中四大名菌之一[1]。目前已知牛肝菌种类有28个属397种[2],可食用约200种[3],主要分布在我国西南部雨水充沛的热带地区,每年7~10月是采摘旺季。牛肝菌除含有大量人体必需氨基酸、矿物质等活性成分以外,代谢产物中含有多糖、酚类、甾体、生物碱[4-7]、萜类等多种天然活性物质[8]。萜类化合物(Terpenoids)是重要的生物活性成分,由多个异戊二烯(Isoprene,C5)结构单位构成,结构类型多样,包括单萜、倍半萜、二萜和三萜类[9-12],具有抗肿瘤[13-14]、抗炎[15-16]、降血糖[17-18]、抗氧化[19-20]、镇静催眠[21]等重要的药理功能,牛肝菌等大型食用真菌是新功能化合物的良好来源[22]。杨宏博等[23]对短柄粘盖牛肝菌进行研究,其中三萜成分含量在1.61%~4.72%。近年来,为提高真菌中的次级代谢产物含量及活性,常常通过物理诱导、化学诱导、生物诱导手段进行调控作用[24],从而促进次级代谢产物的合成。无机盐、生长因子及非必须生长因子是液态培养中常用的诱导因子,而无机盐则是牛肝菌菌丝液态培养中不可少的营养物质,是代谢途径中某些关键酶的激活剂,可以调节体内细胞的渗透压,维持结构的稳定;生长因子与牛肝菌代谢产物具有偶联关系。邓文静等[25]研究发现亚油酸诱导灵芝对三萜物质的含量促进作用较为明显。滕李铭等[26]研究了Ca2+浓度在200 mg/L时,对松杉灵芝的生物量有促进作用达到最大值,对牛肝菌三萜类诱导剂促进作用报道较少。
野生牛肝菌资源少,受地理位置与采摘季节的影响产量低、价格高。如获得人工分离纯菌株,以纯菌株进行液态培养牛肝菌菌丝体,高效富集代谢产物并获得功能化合物,可解决野生资源不足、实现功能产品产业化的问题。本研究采摘自云南的新鲜野生牛肝菌子实体,利用组织分离法进行母体纯菌株分离并鉴定,获得1株暗褐网柄牛肝菌(Phlebopus portentosus)。通过响应面法优化了Ca2+、亚油酸、香菇水提液诱导剂的添加量,为提高牛肝菌液态培养菌丝产三萜类化合物提供了方法,也为功能食品的开发提供新资源原料。
1. 材料与方法
1.1 材料与仪器
鲜野生牛肝菌子实体 暗褐网柄牛肝菌(Phlebopus portentosus),采摘于云南省楚雄彝族自治区禄丰县和南华县,无菌袋、冰袋封装;熊果酸标品 分析纯,阿拉丁试剂公司;香草醛 分析纯,天津市光复精细化工研究所;冰醋酸 分析纯,西陇科学股份有限公司;无水乙醇 分析纯,天津市富宇精细化工有限公司;GK2043(胶回收试剂盒)、GK1071(DNA提取试剂盒)、引物ITS1、ITS4 上海捷瑞生物工程有限公司合成。
723NUV5100型紫外可见分光光度计 上海精密科学仪器公司; JJ200型精密电子天平 美国双杰兄弟有限公司;SW- CJ-ECU型超净工作台 苏州其嘉净化设备有限公司;JY300C电泳仪、JY02G凝胶成像系统 北京君意电泳设备有限公司;Beckman-JT-25R高速冷冻离心机 美国贝克曼库尔特有限公司;ABI3730测序仪 北京东迅天地医疗仪器有限公司;JY92-IIN超声波细胞粉碎仪 宁波新芝生物科技股份有限公司;ES-2030型冷冻干燥仪、SU8010扫描电镜 日立公司。
1.2 实验方法
1.2.1 野生牛肝菌母体纯菌株分离纯化
将新鲜野生牛肝菌子实体用自来水冲洗数次,去除表面杂质,无菌水冲洗4遍,75%乙醇擦拭,再用无菌水冲洗数次,无菌纱布擦干子实体表面。采用组织分离法用无菌解剖刀将牛肝菌子实体纵切开后,将内部的组织切割成0.5 cm2左右的小块,接种于CPDA培养基中,25 ℃恒温避光培养5 d。待组织周围有菌丝长出后,挑取少许菌丝,采用点植法多次纯化培养,从平板菌落中挑选出产褐色色素,有牛肝菌气味的1株菌落,25 ℃避光培养15 d,观察菌落、菌丝及分生孢子颜色、形态,再转接至斜面试管待长出菌丝体后,4 ℃保存。
改良的马铃薯培养基配制:马铃薯200 g,D-麦芽糖20 g,酵母浸粉5 g,KH2PO4 3 g,MgSO4·7H2O 1.5 g,VB1 0.1 g,水1 L,pH自然。固体培养基CPDA:马铃薯200 g,葡萄糖20 g,KH2PO4 3 g,MgSO4·7H2O 1.5 g,VB1 1 mg,蛋白胨0.5 g,琼脂20 g,水1 L,pH自然。
1.2.2 基于rDNA ITS序列分析的分子鉴定
采用GK1071提取试剂盒,该纯化菌株进行DNA提取。使用真菌 ITS 鉴定通用引物:ITS1:5’-TCCGTAGGTGAACCTGCGG-3’ 和 ITS4:5’-TCCTCCGCTTATTGATATGC-3’对DNA的ITS片段进行PCR扩增。扩增体系为30 µL反应体系,包括:10×Taq Buffer 3 µL,dNTP 1 µL,2.5 U/µL TaqDNA聚合酶1 µL,上游引物(10 µmo/L)和下游引物(10 µmo/L)各1 µL,DNA模板2 µL,ddH2O补足至30 µL。反应条件:95 ℃预变性5 min、变性15 s、55 ℃退火15 s、72 ℃延伸45 s、保温5 min 35个循环。PCR扩增产物采用1%琼脂糖凝胶电泳体系检测,采用凝胶成像系统观察结果。PCR扩增产物用胶回收试剂盒GK2043回收,送到上海捷瑞生物工程有限公司进行测序。序列在GenBank中进行BLAST对比,选择同源性高于95%的序列,运用MEGA-X软件进行多重比较,通过NJ法构建系统发育树,并以bootstrap对发育树进行自举法检验1000次,从而确定菌株的亲缘关系及分类地位。
1.2.3 诱导剂配制
采用去离子水将培养基中CaCl2浓度配制成4、8、12、16、20 mmol/L的溶液;脂肪酸(v/v):亚油酸的添加量1%、2%、3%、4%、5%;营养因子(香菇提取液):鲜香菇加10倍水于组织粉碎机中粉碎成浆,在6000 r/min离心10 min去除沉淀物,在50 ℃烘干至恒重,得水提物干燥粉末,加入到1.2.1改良马铃薯培养基中,使得浓度为50、100、150、200、250 mg/100 mL。
1.2.4 单因素实验
在改良液态马铃薯培养基(g/L)中,牛肝菌NG-3接种量10%(v/v)、培养条件为29 ℃、摇床转速160 r/min、在装液量为100 mL/250 mL,培养10 d。在亚油酸添加量为4%、香菇水提物为150 mg/100 mL时,分别研究Ca2+浓度为4、8、12、16、20 mmol/L对液态培养产菌丝量及三萜含量的影响;在Ca2+浓度12 mmol/L、香菇水提物为150 mg/100 mL时,分别研究亚油酸浓度为1%、2%、3%、4%、5%对液态培养产菌丝量及三萜含量的影响;Ca2+浓度12 mmol/L、亚油酸添加量为4%时,分别研究香菇水提物浓度为50、100、150、200、250 mg/100 mL对菌株液态培养产菌丝量及三萜含量的影响。
1.2.5 响应面试验优化
以牛肝菌NG-3菌丝体三萜含量为指标,依据Box-Behnken Design设计原理,采用响应面优化法确定Ca2+、亚油酸、香菇水提物3个因素,诱导剂最优浓度,设计因素水平见表1。
表 1 响应面试验因素与水平Table 1. Response surface experiment factors and levels因素 水平 −1 0 1 A Ca2+(mmol/L) 8 12 16 B 亚油酸(%) 3 4 5 C 香菇水提物(mg/100 mL) 100 150 200 1.2.6 液态培养菌丝生物量的测定
将培养液置于离心管中,在离心转数5000 r/min条件下离心10 min收集菌丝球,再用去离子水洗涤菌丝球数次,转移至蒸发皿中,在60 ℃的鼓风干燥箱中干燥至恒重,称其重量计为菌丝量(g/100 mL)。
1.2.7 三萜类化合物的测定
1.2.7.1 标准曲线的绘制
准确称取熊果酸标准品10 mg,用无水乙醇配制成浓度为0.1 mg/mL的标准溶液,分别吸取标准溶液0、0.2、0.4、0.6、0.8、1.0 mL置于试管内,于60 ℃水浴锅中蒸干,加入0.4 mL的5%香草醛-冰醋酸溶液和1 mL 70%高氯酸,摇匀后于60 ℃水浴15 min,冷却至室温后再向其中分别加入5 mL 99%冰醋酸,摇匀后室温静置0.5 h,在546 nm下得到相应的吸光度值。以熊果酸含量(μg)为横坐标,吸光值为纵坐标,绘制标准曲线,回归方程为y=0.0075x−0.0012,R2=0.9994,表明熊果酸含量在20~100 μg范围内线性关系良好。
1.2.7.2 三萜类化合物的提取及测定
菌丝体中三萜的提取:按1.2.6方法得到干基菌丝体,研磨过60目筛,称取0.4 g菌丝粉末,加入4 mL 60%乙醇(v/v),采用超声波细胞粉碎机对菌丝体细胞破碎,工作总时间为5 min,离心机中12000 r/min离心10 min,收集上清液,菌丝残渣继续用3 mL 60%乙醇(v/v)用上述条件重复提取2次后,将3次上清液合并,用60%乙醇定容至10 mL,即为三萜提取液[27]。菌丝体中三萜的检测:采用香草醛-冰醋酸比色法[28],取0.2 mL的三萜提取液于具塞试管中,在546 nm下得到相应的吸光度值A,计算出三萜含量。
三萜含量(mg/g)=(A+b)N/1000aM 式中:A——所测样品吸光值;b——标准曲线方程截距;N——稀释倍数;a——标准曲线方程斜率;M——菌丝体质量(g/100 mL)。
1.3 数据处理
3次独立重复试验,每一实验数值表现为平均值±标准差(standard devitions, SD)作为数据的最终结果。采用Excel 2010、SPSS 22完成数据统计与显著性分析,Origin 2018绘制图表,P<0.05表示差异显著。
2. 结果与分析
2.1 母体纯菌株的分离筛选
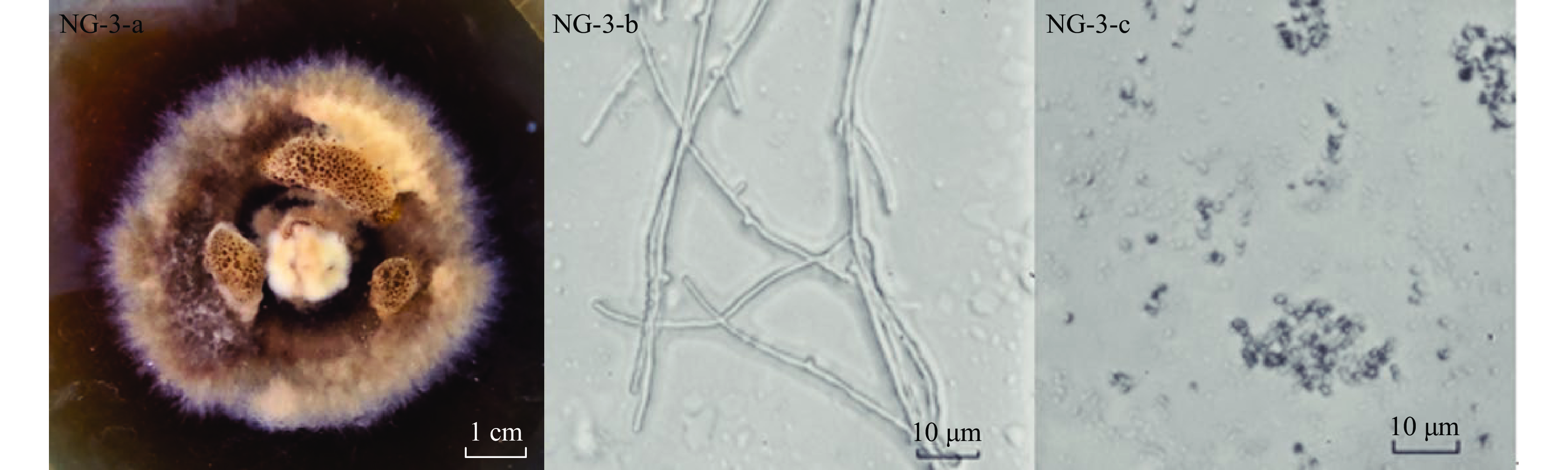
按1.2.1方法从野生牛肝菌中进行母体纯菌株分离,对其中NG-3菌株,在29 ℃培养16 d,平板生长的菌落形态、光学显微镜观察的菌丝、孢子形态,利用Motic Images Plus 2.0软件进行显微形态(10×100)拍摄,将菌株用双面刀片切成2 mm×5 mm的小条,加入2.5%、动物pH7.2、植物pH6.8戊二醛固定并置于4 ℃冰箱中1.5 h以上,用0.1 mol/L pH7.2磷酸盐缓冲溶液冲洗2~3次,每次10 min,分别用浓度为50%、70、90%的乙醇进行脱水各一次,每次10~15 min;100%的乙醇脱水2~3次,每次10~15 min,100%乙醇:叔丁醇=1:1一次;叔丁醇2次,每次15 min。将菌株放入−20 ℃的冰箱冷冻室30 min,放入冷冻干燥仪对菌株进行干燥4 h,将菌株观察面朝上,用导电胶带粘在扫描电镜样品台上,用离子溅射镀膜仪在菌株表面镀上一层100~150埃的金属膜,将处理好的菌株放入样品盒中待检。结果如图1所示。
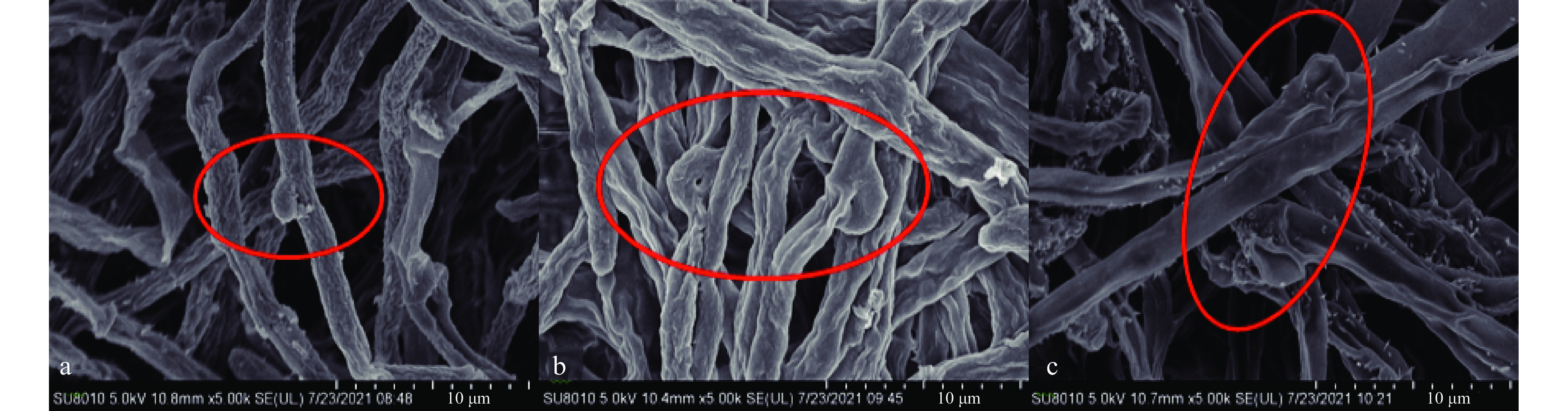
NG-3菌落生长缓慢,16 d后平板底部可见褐色色素产生,菌落表面有凸起及黄褐色小液滴,培养基变硬,有较明显的牛肝菌气味,菌丝直径1.5~3 μm。菌丝中的锁状联合发生在分化的第二阶段,属于一种独特的菌丝融合方式,为后续形成子实体打下基础。锁状联合是双核菌丝的鉴定标准,也是担子菌门的明显特征之一,根据《中国食药用菌学》对真菌异核菌丝锁状联合的描述[29-31],初步推测NG-3菌株为牛肝菌属。采用扫描电子显微镜(SEM),对在PDA培养基上培养8、16、24 d的NG-3进行菌丝体形态观察,如图2(a、b、c)所示,可见,培养8 d的菌丝锁状联合开始出现,16 d形成完全,24 d开始老化。
2.2 NG-3菌株分子生物学鉴定结果
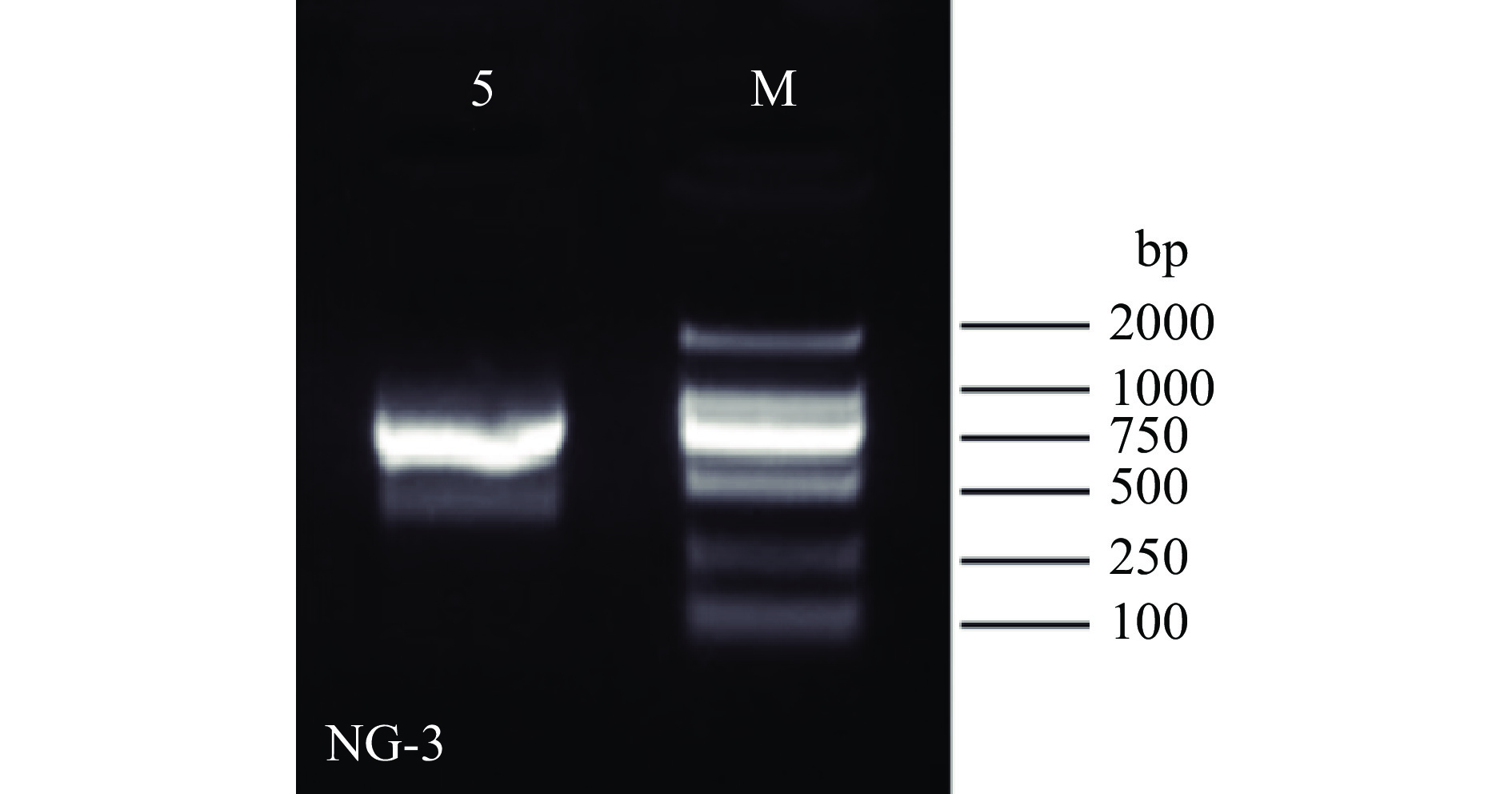
对NG-3菌株进行分子生物学鉴定,以引物ITS1和ITS4对内生真菌的DNA模板进行PCR扩增,NG-3序列长度为881 bp的特异性片段,ITS扩增产物电泳结果,如图3所示。
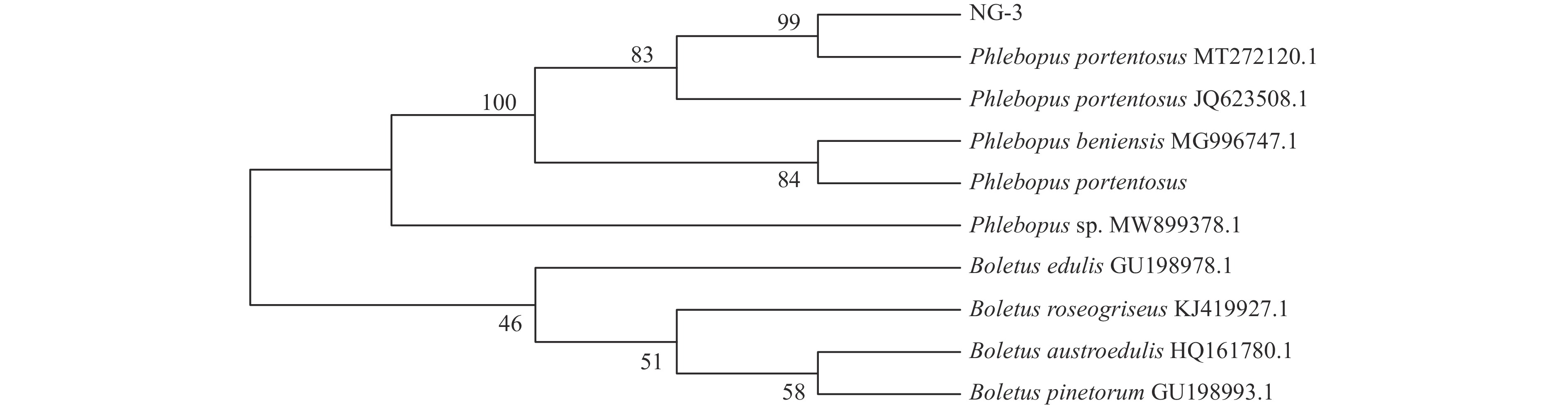
对菌株的NG-3系统发育树构建及分析,序列在NCBI库中进行在线BLAST比对,将测序得到的基因序列与数据库下载的相似序列合并构建系统发育树,采用MEGA-X软件,以neighbor-joining method(N-J法),自举法1000次对其检验进行种水平的鉴定。比对结果显示:在100条序列比对结果中,NG-3和99株暗褐网柄牛肝菌(Phlebopus portentosus)序列同源性在96%以上。系统发育树的树枝长度可以直观表达菌株间的遗传距离,聚类于同一支表示亲缘关系较近,结合形态学鉴定、BLAST序列的在线对比以及系统发育树的结果:NG-3与NCBI数据库中的Phlebopus portentosus序列聚类于同一支,自检支持率99%,鉴定该分离菌株为:暗褐网柄牛肝菌(Phlebopus portentosus),系统发育树如图4所示。
2.3 诱导剂对NG-3菌株液态培养产三萜含量的单因素实验
2.3.1 Ca2+浓度对菌丝量及三萜含量的影响结果
Ca2+可以改变细胞膜通透的程度,也是一些金属酶的活性中心[32],将亚油酸、香菇水提物、Ca2+添加到液态改良液态马铃薯培养基中,与未添加诱导剂的培养基进行液态摇床培养菌丝对照,Ca2+浓度对菌丝产量与三萜含量的影响结果,如图5所示。
由图5可知,随着培养基中Ca2+浓度的升高,与对照组相比,菌丝量和三萜含量均呈先升后降的趋势。在4、8、12、16 mmol/L对菌丝量起促进作用,分别比对照组提高1.9%、3.4%、8.1%、3.8%;在Ca2+浓度为4、8、12、16 mmol/L时,对菌丝中三萜合成起促进作用,分别比对照组提高4.4%、8.1%、23%、12.7%。在Ca2+浓度12 mmol/L时,菌丝量及三萜含量达到最高积累,分别为0.93 g/100 mL和4.73 mg/g,可能由于Ca2+可以促进合成三萜类酶的活性[32]。
2.3.2 亚油酸浓度对菌丝量及三萜含量的影响结果
在培养基中加入外源不饱和脂肪酸类物质,可以改变菌体细胞膜结构。将Ca2+、香菇水提物、亚油酸添加到改良液态马铃薯初始培养基中,与未添加诱导剂的培养基进行液态摇床培养菌丝对照,亚油酸浓度对菌丝产量与三萜含量的影响结果,如图6所示。
由图6可知,随着亚油酸添加量的增加,与对照组相比,菌丝量及三萜含量均呈上升趋势。通过添加1%、2%、3%、4%、5%浓度亚油酸的诱导作用,菌丝量分别比对照组提高5.8%、8.1%、11.6%、18.6%和5.8%,三萜含量分别比对照组提高7.3%、19.7%、50.1%、52.3%和16.6%。其中添加量为4%时,菌丝量及三萜含量的积累量均达到最高,分别为1.02 g/100 mL和5.89 mg/g。亚油酸分布于多种生物体内,能促进三萜合成途径中SQS和CYP51的基因表达,对三萜含量的积累起到促进作用[33]。
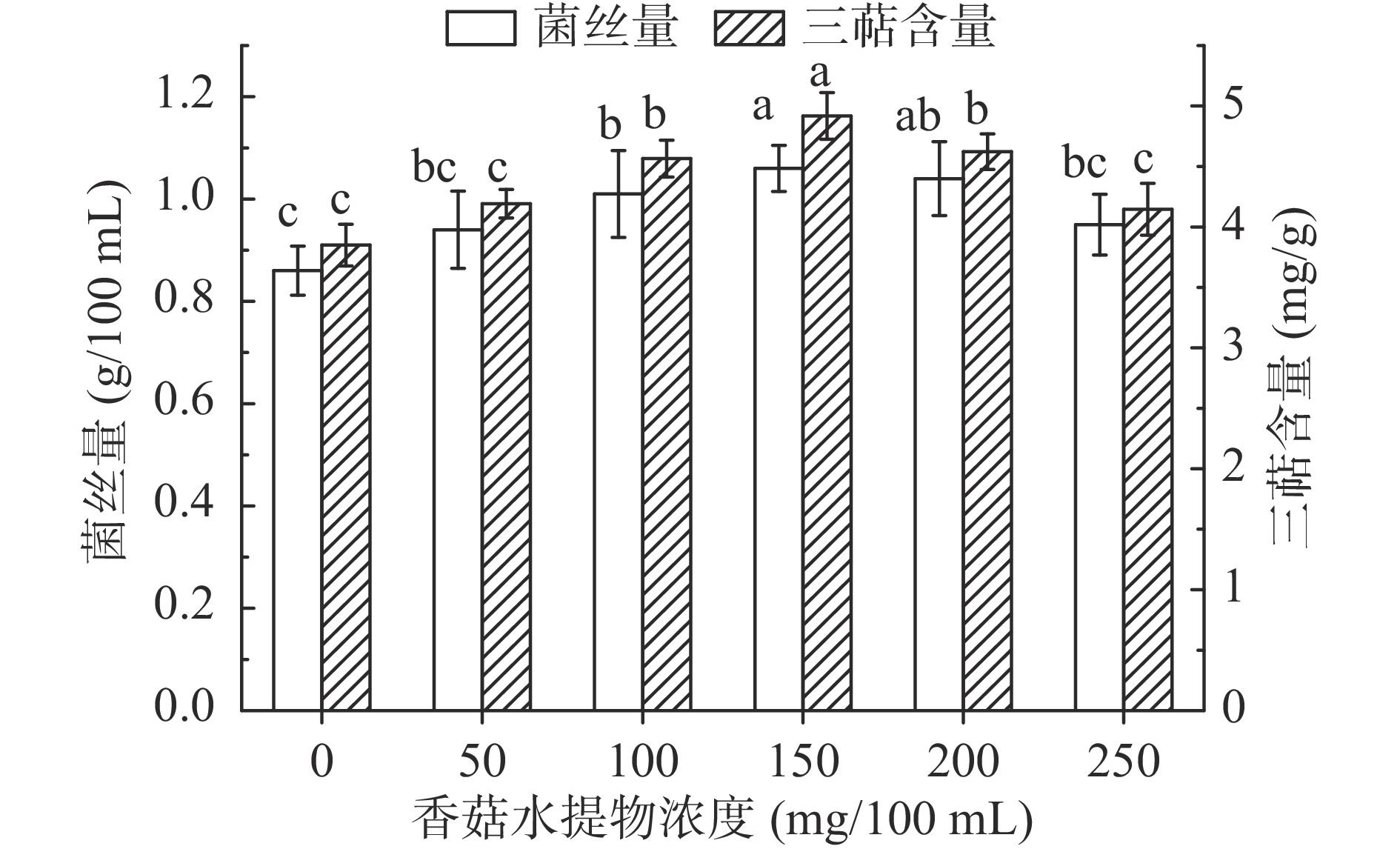
2.3.3 香菇水提物浓度对菌丝量及三萜含量的影响结果
选择香菇水提物作为营养因子,将Ca2+、亚油酸、香菇水提物,添加到改良液态马铃薯培养基中,与未添加诱导剂的培养基进行液态摇床培养菌丝对照,香菇水提物浓度对菌丝产量与三萜含量的影响结果,如图7所示。
由图7可知,随着香菇水提物浓度的增加,与对照组相比,香菇水提物对NG-3菌株产菌丝量及三萜含量的影响均为先上升后下降趋势,在浓度为50、100、150、200、250 mg/100 mL时,菌丝量与对照组相比分别提高了9.3%、17.4%、23.3%、20.9%、10.5%;三萜含量与对照组相比分别提高了8.9%、18.6%、27.7%、20.1%、7.7%;当香菇水提物浓度为150 mg/100 mL时,菌丝量和三萜含量分别达到1.06 g/100 mL和4.92 mg/g,香菇水提物中含有大量氨基酸与营养素,以辅酶或辅基的形式参与催化酶系活动,可作为液态培养的营养因子调控代谢产物的生物合成。
2.4 诱导剂对牛肝菌NG-3液态培养产三萜含量的响应面优化结果
2.4.1 响应面设计结果及方差分析
牛肝菌产三萜化合物与菌丝体的生长具有偶联关系,在单因素实验基础上,最终以获得三萜物质含量为指标,研究Ca2+浓度(A)、亚油酸添加量(B)和香菇水提物浓度(C)对三萜含量的影响,结果见表2。
表 2 响应面试验设计及结果Table 2. Response surface experimental design and results序号 A B C 三萜含量(mg/g) 1 0 1 1 5.63 2 1 0 1 4.03 3 0 0 0 6.69 4 1 −1 0 3.91 5 0 0 0 6.66 6 0 1 −1 4.24 7 −1 −1 0 4.31 8 −1 0 −1 4.29 9 0 −1 1 4.25 10 0 0 0 6.71 11 0 0 0 6.97 12 −1 0 1 4.79 13 0 −1 −1 4.68 14 1 1 0 4.58 15 −1 1 0 4.54 16 0 0 0 6.77 17 1 0 −1 4.28 对表2中数据进行多元回归拟合,得到三萜含量对Ca2+浓度(A)、亚油酸添加量(B)和香菇水提物浓度(C)的二次回归模型方程为:三萜含量=6.76−0.14A+0.23B+0.15C+0.11AB−0.19AC+0.46BC−1.39A2−1.04B2−1.02C2,对此模型进行方差分析结果,见表3。
表 3 响应面模型方差分析Table 3. Response surface model variance analysis方差源 平方和 自由度 均方 F值 P值 显著性 模型 20.78 9 2.31 110.85 <0.0001 *** A 0.16 1 0.16 7.66 0.0278 * B 0.42 1 0.42 20.31 0.0028 ** C 0.18 1 0.18 8.79 0.0210 * AB 0.048 1 0.048 2.32 0.1713 AC 0.14 1 0.14 6.75 0.0355 * BC 0.83 1 0.83 39.75 0.0004 *** A2 8.12 1 8.12 389.81 <0.0001 *** B2 4.52 1 4.52 217.04 <0.0001 *** C2 4.41 1 4.41 211.83 <0.0001 *** 残差 0.15 7 0.021 失拟误差 0.084 3 0.028 1.82 0.2829 Not significant 纯误差 0.062 4 0.015 总和 20.93 16 R2=0.9983 R2Adj=0.9841 变异系数=2.81% 注:***差异高度显著(P<0.001);**差异极显著(P<0.01);*差异显著(P<0.05)。 由表3可知,此二次多项式回归模型极显著(P<0.0001),失拟项不显著(P>0.05)。其次,该模型的决定系数R2=0.9983,能解释99.83%的响应值变化,校正决定系数R2adj=0.9841,两者数值均较高,证明该模型结果可靠,可对三萜含量进行分析和预测。由P值可知,Ca2+浓度、香菇水提物浓度对三萜含量影响差异显著(P<0.05)、亚油酸添加量对三萜含量影响差异极显著(P<0.01)。交互项AC影响差异显著(P<0.05)、BC影响差异高度显著(P<0.001),AB影响差异不显著(P>0.05)。各因素对牛肝菌NG-3液态培养菌丝体中三萜含量的影响顺序为:亚油酸添加量(B)>香菇水提物浓度(C)>Ca2+浓度(A)。
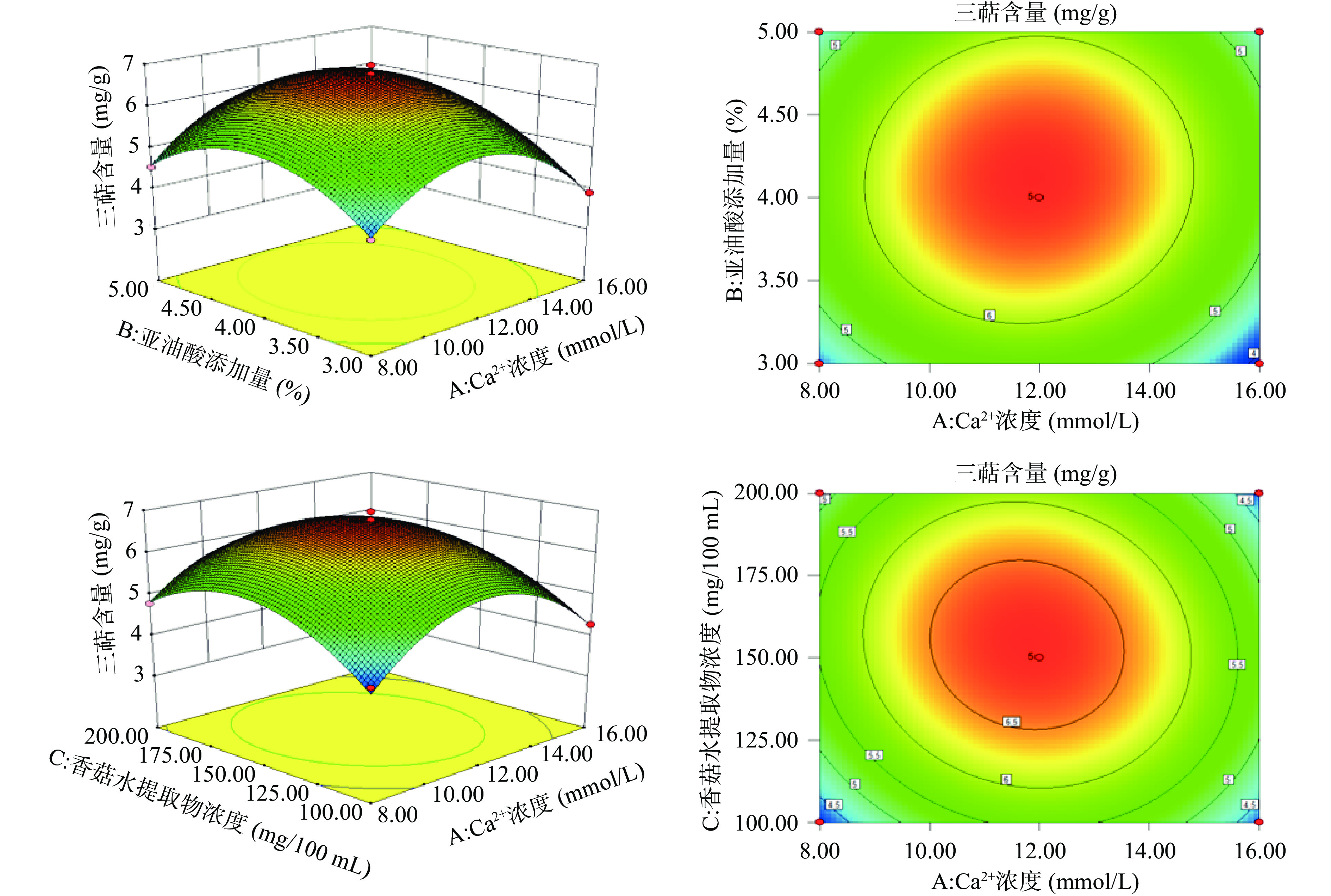
2.4.2 因素交互作用分析
Ca2+浓度、亚油酸添加量、香菇水提物浓度的增大,三萜含量有先增大后减小的趋势,各因素交互作用对三萜含量的影响,如图8所示。
由图8可知,Ca2+浓度、亚油酸添加量、香菇水提物浓度3个因素中两两交互时,对交互作用等高线进行比较,交互项AC、BC等高线图均为椭圆形,说明各交互作用项为显著,AB等高线图则趋于圆形,说明交互作用不显著,曲面坡度均陡峭,程度明显。其结论同表3方差分析结论一致。
通过 Design-expert 8.0.6软件分析,得到诱导NG-3液态培养产三萜的最佳复合诱导剂条件为:Ca2+浓度11.79 mmol/L、亚油酸添加量4.13%、香菇水提物浓度150.43 mg/100 mL,三萜含量的预测值为6.79 mg/g。对优化后的参数进行验证试验,将试验条件修改为:Ca2+浓度12 mmol/L、亚油酸添加量4%、香菇水提物浓度150 mg/100 mL,在此条件下,开展3次平行实验,三萜含量为6.77 mg/g,与预测值接近,比未添加3种诱导剂的对照组提高76.00%。
3. 结论
研究从野生牛肝菌子实体中,采用组织分离法获得1株母体纯菌株NG-3,经鉴定其为暗褐网柄牛肝菌(Phlebopus portentosus),为提高菌株NG-3培养液态菌丝体中三萜类物质的产量,研究了金属离子(Ca2+)、脂肪酸(亚油酸)及营养因子(香菇水提物)外援诱导剂对三萜类物质的产量的影响,采用响应面法优化了3种诱导剂的加量,结果得到Ca2+浓度12 mmol/L、亚油酸添加量4%、香菇水提物浓度150 mg/100 mL,三萜类物质含量为6.77 mg/g的诱导剂最佳添加量,比未添加3种诱导剂的对照组三萜类物质含量提高76.00%。为牛肝菌液态培养促进产三萜类活性物质提供了诱导工艺,为解决牛肝菌野生资源不足,实现人工纯种培养,为今后开发功能性食品提供新资源原料。
-
表 1 响应面试验因素与水平
Table 1 Response surface experiment factors and levels
因素 水平 −1 0 1 A Ca2+(mmol/L) 8 12 16 B 亚油酸(%) 3 4 5 C 香菇水提物(mg/100 mL) 100 150 200 表 2 响应面试验设计及结果
Table 2 Response surface experimental design and results
序号 A B C 三萜含量(mg/g) 1 0 1 1 5.63 2 1 0 1 4.03 3 0 0 0 6.69 4 1 −1 0 3.91 5 0 0 0 6.66 6 0 1 −1 4.24 7 −1 −1 0 4.31 8 −1 0 −1 4.29 9 0 −1 1 4.25 10 0 0 0 6.71 11 0 0 0 6.97 12 −1 0 1 4.79 13 0 −1 −1 4.68 14 1 1 0 4.58 15 −1 1 0 4.54 16 0 0 0 6.77 17 1 0 −1 4.28 表 3 响应面模型方差分析
Table 3 Response surface model variance analysis
方差源 平方和 自由度 均方 F值 P值 显著性 模型 20.78 9 2.31 110.85 <0.0001 *** A 0.16 1 0.16 7.66 0.0278 * B 0.42 1 0.42 20.31 0.0028 ** C 0.18 1 0.18 8.79 0.0210 * AB 0.048 1 0.048 2.32 0.1713 AC 0.14 1 0.14 6.75 0.0355 * BC 0.83 1 0.83 39.75 0.0004 *** A2 8.12 1 8.12 389.81 <0.0001 *** B2 4.52 1 4.52 217.04 <0.0001 *** C2 4.41 1 4.41 211.83 <0.0001 *** 残差 0.15 7 0.021 失拟误差 0.084 3 0.028 1.82 0.2829 Not significant 纯误差 0.062 4 0.015 总和 20.93 16 R2=0.9983 R2Adj=0.9841 变异系数=2.81% 注:***差异高度显著(P<0.001);**差异极显著(P<0.01);*差异显著(P<0.05)。 -
[1] PETRINI O. Fungal endophytes of tree leaves[C]//Andrews J H, Hirano S S. eds. Microbial ecology of leaves. New York: Springer-Verlag, 1991: 179-197.
[2] HALl I R, LYON A J E, WANG Y, et al. Ectomycorrhizal fungi with edible fruiting bodies 2. Boletus edulis[J]. Economic Botany,1998,52(1):44−56. doi: 10.1007/BF02861294
[3] 李泰辉, 宋斌. 中国牛肝菌已知种类[J]. 贵州科学,2003,3(21):78−86. [LI T H, SONG B. Known species of porcini in China[J]. Guizhou Sciences,2003,3(21):78−86. doi: 10.3969/j.issn.1003-6563.2003.02.017 [4] 秦如冰, 叶丽, 尹嘉梁, 等. 响应面法优化暗褐脉柄牛肝菌粗多糖提取工艺[J]. 食品工业,2022,43(6):199−203. [QIN R B, YE L, YIN J L, et al. Optimization of extraction technology of crude polysaccharide from Boletus vulgaris by response surface methodology[J]. Food Industry,2022,43(6):199−203. [5] 张凤明, 鲁斌, 于富强, 等. 暗褐网柄牛肝菌挥发性成分分析[J]. 食用菌,2021,43(3):8−11. [ZHANG F M, LU B, YU F Q, et al. Analysis of volatile constituents of Boletus aureus[J]. Edible Fungi,2021,43(3):8−11. [6] 柳成益, 杨梅, 黄中华, 等. 玫红脉柄牛肝菌生境调查及其子实体营养成分分析[J]. 食用菌学报,2021,28(4):91−97. [LIU C Y, YANG M, HUANG Z H, et al. Mei red veins handle porcini habitat investigation and its fruiting body nutrition analysis[J]. Journal of Edible Fungi,2021,28(4):91−97. doi: 10.16488/j.cnki.1005-9873.2021.04.012 [7] 王晶波, 刘婷婷, 任硕, 等. 5种云南牛肝菌营养成分和抗氧化活性分析与评价[J]. 中国食用菌,2020,39(10):87−91,99. [WANG J B, LIU T T, REN S, et al. Analysis and evaluation of nutrients and antioxidant activities of five species of porcini from Yunnan[J]. Edible fungi of China,2020,39(10):87−91,99. doi: 10.13629/j.cnki.53-1054.2020.10.019 [8] 伍燕, 汪伟, 王燕, 等. 2种牛肝菌分子鉴定及营养成分分析[J]. 现代食品科技,2021,37(9):102−108. [WU Y, WANG W, WANG Y, et al. Molecular identification and nutritional composition analysis of two kinds of porcini[J]. Modern Food Science and Technology,2021,37(9):102−108. doi: 10.13982/j.mfst.1673-9078.2021.9.0017 [9] 康宁, 王占斌, 李德海, 等. 粗毛纤孔菌三萜类化合物的诱导合成及其抗氧化功能分析[J]. 食品科学,2019,40(10):157−165. [KANG N, WANG Z B, LI D H, et al. Induced biosynthesis and antioxidant properties of triterpenoids in Inonotus hispidus[J]. Food Science,2019,40(10):157−165. doi: 10.7506/spkx1002-6630-20180530-430 [10] LEE M K, HUNG T M, CUONG T D, et al. Ergosta-7, 22-diene-2β, 3α, 9α-triol from the fruit bodies of Ganoderma lucidum induces apoptosis in human myelocytic HL-60 cells[J]. Phytotherapy Research:PTR,2011,25(11):1579−1585. doi: 10.1002/ptr.3447
[11] NAKATA T, YAMADA T, TAJI S, et al. Structure determination of inonotsuoxides A and B and in vivo anti-tumor promoting activity of inotodiol from the sclerotia of Inonotus obliquus[J]. Bioorganic & Medicinal Chemistry,2007,15(1):257−264.
[12] WANG Y, BAO L, YANG X, et al. Bioactive sesquiterpenoids from the solid culture of the edible mushroom Flammulina velutipes growing on cooked rice[J]. Food Chemistry,2012,132(3):1346−1353. doi: 10.1016/j.foodchem.2011.11.117
[13] YEH C T, RAO Y K, YAO C J, et al. Cytotoxic triterpenes from Antrodia camphorata and their mode of action in HT-29 human colon cancer cells[J]. Cancer Letters,2009,285(1):73−79. doi: 10.1016/j.canlet.2009.05.002
[14] MEHMET E D, GÜLSEN T C. Biologically active terpenoids from mushroom origin: A review[J]. Records of Natural Products,2015,9(4):456−483.
[15] 马传贵, 张志秀, 肖宝, 等. 灵芝三萜的生物活性及潜在应用研究[J]. 食药用菌,2022,30(3):197−201. [MA C G ZHANG Z X, XIANG B, et al. Bioactivity and potential application of triterpenes in Ganoderma lucidum[J]. Edible and Medicinal Fungi,2022,30(3):197−201. [16] CAI Z Y, SHENG Z X, YAO H. Pachymic acid ameliorates sepsis-induced acute kidney injury by suppressing inflammation and activating the Nrf2/HO-1 pathway in rats[J]. European Review for Medical and Pharmacological Sciences,2017,21(8):1924−1931.
[17] LI T H, HOU C C, CHANG C L T, et al. Anti-hyperglycemic properties of crude extract and triterpenes from Poria cocos[J]. Evidence-based Complementary and Alternative Medicine,2011,2011:128402.
[18] LEI R. Protective effect of ganoderic acid against the streptozotocin induced diabetes, inflammation, hyperlipidemia and microbiota imbalance in diabetic rats[J]. Saudi Journal of Biological Sciences,2019,26(8):1961−1972. doi: 10.1016/j.sjbs.2019.07.005
[19] YANG C, MENG Q, ZHANG Y, et al. Morelsins A-F, six sesquiterpenoids from the liquid culture of Morchella importuna[J]. Tetrahedron,2020,76(31-32):131356. doi: 10.1016/j.tet.2020.131356
[20] 何策, 王超, 陈纯, 等. 桑树桑黄总三萜提取工艺优化及其降血脂、抗氧化活性研究[J]. 食品工业科技,2021,42(7):208−215. [HE C, WANG C, CHENG C, et al. Optimization of extraction technology of total triterpenoids from mulberry yellow and its hypidemia and antioxidant activity[J]. Science and Technology of Food Industry,2021,42(7):208−215. [21] SHAH V K, CHOI J J, HAN J Y, et al. Pachymic acid enhances pentobarbital-induced sleeping behaviors via GABA[J]. Biomolecules & Therapeutics,2014,22(4):314−320.
[22] LI J L, WU H Y, WANG L, et al. Key taste components in two wild edible Boletus mushrooms using widely targeted metabolomics[J]. Biochemical Systematics and Ecology,2021,96:104268. doi: 10.1016/j.bse.2021.104268
[23] 杨宏博, 韩增华, 杨红, 等. 诱导发酵桦褐孔菌三萜类化合物合成及其抗氧化功能的研究[J]. 食品工业科技,2020,41(13):105−111. [YANF H B, HAN Z H, YANG H, et al. Biosynthesis and antioxidant activity of triterpenoids from Phorus betuloniae by induced fermentation[J]. Science and Technology of Food Industry,2020,41(13):105−111. doi: 10.13386/j.issn1002-0306.2020.13.017 [24] LIU Y N, TONG T, ZHANG R R, et al. Interdependent nitric oxide and hydrogen peroxide independently regulate the coix seed oil-induced triterpene acid accumulation in Ganoderma lingzhi[J]. Mycologia,2019,111(4):529−540. doi: 10.1080/00275514.2019.1615816
[25] 邓文静, 张宏意, 欧晓华, 等. 茉莉酸甲酯对广藿香JA信号转导途径及倍半萜合成途径关键基因表达的影响[J]. 广西植物,2021,41(4):559−566. [DEANG W J, ZHANG H Y, OU X H, et al. Effects of methyl jasmonate on expression of key genes in JA signal transduction pathway and sesquiterpene synthesis pathway in Pogostemon cablin[J]. Guangxi Botany,2021,41(4):559−566. doi: 10.11931/guihaia.gxzw202005056 [26] 滕李铭, 田雪梅, 吴芳, 等. 13种野生灵芝菌丝体中胞内三萜与多糖含量的比较[J]. 菌物学报,2021,40(7):1811−1819. [TENG L M, TIAN X M, WU F, et al. Comparison of intracellular triterpenoid and polysaccharide contents in mycelia of three wild Ganoderma lucidum species[J]. Chin J Mycelia,2021,40(7):1811−1819. doi: 10.13346/j.mycosystema.210005 [27] HATHAIRAT B, WARAPORN P. Stimulation of health-promoting triterpenoids accumulation in Centella asiatica (L.) urban leaves triggered by postharvest application of methyl jasmonate and salicylic acid elicitors[J]. Industrial Crops and Products,2020,146(3):112171−112179.
[28] 刘海良, 宋爱荣, 黄芳. 树舌灵芝发酵液中灵芝酸的提取及测定[J]. 食用菌学报,2008(3):68−71. [LIU H L, SONG A R, HUANG F. Extraction and determination of Ganoderma acid from Ganoderma lucidum fermentation broth[J]. Acta Edible Fungi,2008(3):68−71. doi: 10.3969/j.issn.1005-9873.2008.03.013 [29] 黄年来, 林志彬, 陈国良, 等. 中国食药用菌学(上下册)[M]. 上海: 上海科学技术文献出版社, 2010. HUANG N L, LIN Z B, CHEN G L, et al. Chinese journal of edible and medicinal microbiology[M]. Shanghai: Shanghai Scientific and Technical Literature Press, 2010.
[30] 王德遵, 张桂芳. 4种野生食用菌成分的测定与分析[J]. 牡丹江师范学院学报(自然科学版),2010(3):24−25. [WANG D Z, ZHANG G F. Determination and analysis of four wild edible fungi[J]. Journal of Mudanjiang Normal University (Natural Science Edition),2010(3):24−25. doi: 10.13815/j.cnki.jmtc(ns).2010.03.016 [31] 中国医学科学院药物研究所. 中草药现代研究[M]. 中国协和医科大学联合出版. 1995: 57. Institute of Materia Medica, Chinese Academy of Medical Sciences. Modern research on Chinese herbal medicine [M]. Joint Publication of Union Medical University of China. 1995: 57.
[32] BUSH D S. Calcium regulation in plant-cells and its role in signaling[J]. Annual Review of Liant Physiology and Plant Molecular Biology,1995,46:95−122. doi: 10.1146/annurev.pp.46.060195.000523
[33] NANO J L, NOBILI C, GIRARD-PIPAU F, et al. Effects of fatty acids on the growth of Caco-2 cells[J]. Prostaglandins, Leukotrienes and Essential Fatty Acids,2003,69(4):207−215. doi: 10.1016/S0952-3278(03)00083-8





 下载:
下载:




 下载:
下载:
