Research Progress on Modification and Application of Pea Protein in Food Field
-
摘要: 豌豆是人类饮食中高品质植物蛋白的重要来源,其蛋白质成分是低致敏性的,一些学者对豌豆蛋白功能性进行了部分研究,但依然缺乏改性方法对豌豆蛋白结构和特性影响的系统报道。为了扩展豌豆蛋白在食品工业领域的应用,本文介绍了物理改性、化学改性、酶法改性和复合改性方法对豌豆蛋白结构和功能性质的影响,同时介绍了豌豆蛋白在活性成分的封装、乳液、其他蛋白的替代以及食品的优化这些方面的研究进展,并对豌豆蛋白在食品工业的应用前景上进行了展望。Abstract: Pea is an important source of high-quality plant protein in human diet, and its protein components are hypoallergenic. Many scholars have conducted studies on the function of pea protein, while there is still a lack of systematic reports on the effects of modifications methods on the structure and properties of pea protein. In order to expand the application of pea protein in the food industry, the effects of physical modification, chemical modification, enzymatic modification and multiple modification on the structural and functional properties are reported in this study, as well as introduce the encapsulation of pea protein in active ingredients, emulsions, substitution of other proteins and optimization of food. Moreover, the prospect of application of pea protein in food industry is prospected.
-
随着人们越来越关注环境的可持续发展和食品安全的问题,人们对寻找动物蛋白质替代品的新蛋白质来源有着浓厚的兴趣,豌豆(Pisum sativum)蛋白具有低致敏性,高赖氨酸和色氨酸含量的特点,且胰蛋白酶抑制剂含量比大豆少5%~20%,有巨大的市场潜力[1-5]。在原料方面,豌豆蛋白的原料丰富,是世界上主要的豆科植物之一,全球年产量能达到1350万吨;在性质方面,豌豆蛋白呈现良好的分散性、稳定性、流动性等水溶性特性以及良好的凝胶性;在应用方面,豌豆蛋白在各种食品材料中有广泛的应用,如烘焙制品、乳制品、运动和临床营养产品等[6-8]。
目前豌豆蛋白的性质仍有很大的研究空间,例如其豆类风味和色度等,但国内系统总结豌豆蛋白改性与应用的文章仍未见报道,因此本文综述了豌豆蛋白在近些年来国内外食品领域较为新颖的改性手段与前沿应用,详细阐述了不同改性方法对豌豆蛋白结构与特性的影响,并对其在后续食品上的应用进行了总结,以便为后续豌豆蛋白的研究提供参考。
1. 豌豆蛋白的概述
豌豆蛋白主要包括四大类,主要组成部分及其分子特性如表1所示。本文介绍的改性与应用方法的原料主要为豌豆分离蛋白(PPI)、豌豆浓缩蛋白(PPC)和豌豆蛋白水解物(PPH)。有研究表明,豌豆蛋白具有抗氧化[9]、抗高血压[10]和调节肠道细菌活动[11-14]的能力。除营养价值外,豌豆蛋白还具有独特的功能特性,包括溶解性、乳化性和起泡性、凝胶性等[15]。良好的溶解性有助于生产饮料、婴幼儿奶粉、仿乳等需要速溶的食品;乳化性在其作为食品配料(牛奶、奶油、蛋黄酱、冰淇淋、黄油)的应用中起着重要的作用;起泡性在冰淇淋、蛋糕、面包和蛋白霜等食品中发挥关键作用;凝胶性与食品的感官和质地特性具有相关性[8]。
表 1 豌豆蛋白的组成及其分子特性Table 1. Composition and molecular characteristics of pea protein种类 含量 溶解性 蛋白质 斯韦德贝里
单位分子量
(kDa)球蛋白 55%~65% 盐溶 豆球蛋白
豌豆球蛋白
豌豆伴球蛋白11S
7S
8S320~410
150
180~210白蛋白 18%~25% 水溶 白蛋白 2S 68.5 醇溶谷蛋白 4%~5% 醇溶 醇溶谷蛋白 / / 谷蛋白 3%~4% 不溶 谷蛋白 / / 注:表中数据来源为Lu等[16]。 2. 豌豆蛋白的改性方法
2.1 物理改性
2.1.1 高温处理
在豌豆的物理改性中常见的高温处理有超高温处理、挤压以及喷雾干燥等。高温处理可以降低食品中的微生物含量;延长食品的保质期;改变食品的功能特性[17]。Trikusuma等[18]利用超高温(140 ℃,6 s)对豌豆分散体进行处理,首次发现了豌豆蛋白里含有2-乙酰基-1-吡咯啉香气化合物,并在豌豆中共鉴定出21种香气化合物(包括醇类、醛类、酮类、吡咯类、羧酸类、吡嗪类、呋喃类、内酯类和酚类)。他们的研究显示,豌豆蛋白的部分香气化合物含量在热处理过程中显著增加,并产生了维生素和酚类降解产物,这为豌豆蛋白产品的香气属性提供了新的认识,为优化豌豆蛋白产品的风味提供新的思路。
喷雾干燥是一种有前景的干粉控制生产技术,其优点是易操作和低成本[19]。在Burger等[20]的研究中,经喷雾干燥处理后的PPI的表面疏水性和粒径增大,当PPI在喷雾干燥前加热到变性温度以上时,其溶解度和乳化性显著降低,这为PPI储存与运输提供了依据。
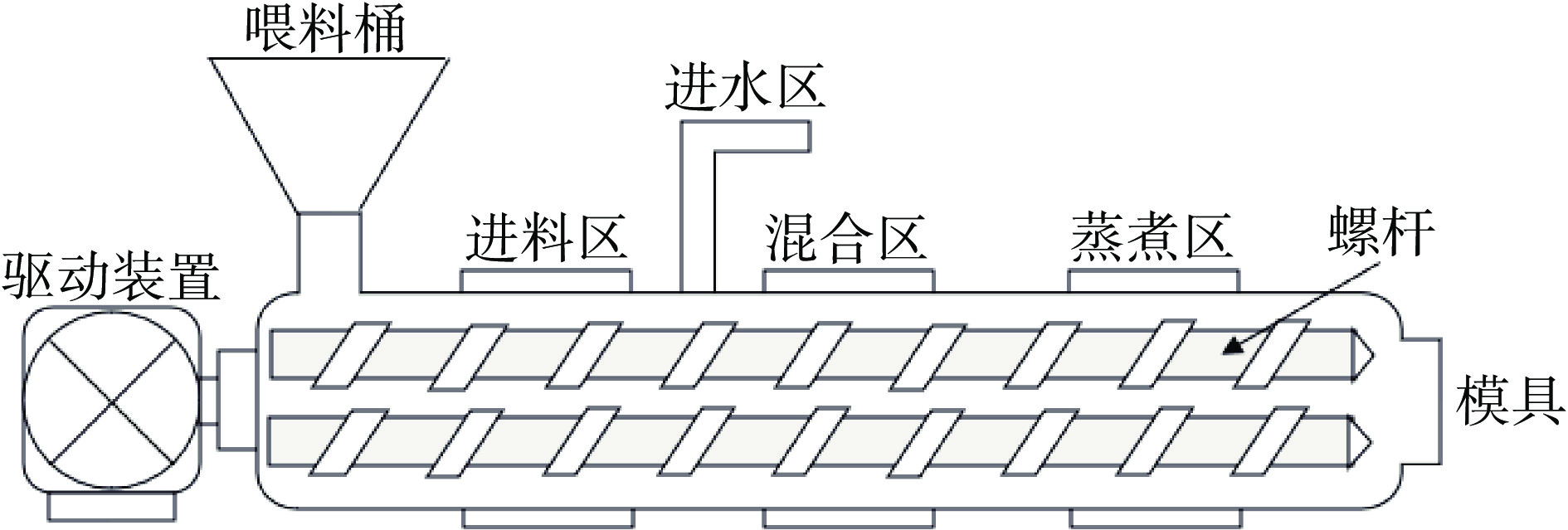
挤压机(挤压机结构示意图如图1所示)是一个复杂的改性过程。物料在喂料桶里以设定好的速率进料,物料在混合区与水充分混合,在蒸煮区受到高温,高压以及高剪切力作用,使得蛋白质分子结构变成熔融状态,最后根据不同水分含量选择不同的模具获得最终的产品。低水分挤压后的蛋白质二级结构发生变化,形成了更大的多孔蛋白聚集体,进而使得PPI溶解度降低[21]。高水分挤压后的蛋白在经过更长的冷却模具后,蛋白分子进行了定向重排,获得了更具类似肉的纤维结构的产品,由表2数据可以看出,对PPI进行高水分挤压处理,同样使得PPI的二级结构发生改变并降低了溶解度[22-23]。但相较于低水分挤压,高水分挤压获得的产品因其含水量较高,因此其在低温下储存和运输仍是一项难题。
表 2 物理方法对豌豆蛋白改性后的主要变化Table 2. Main changes of pea protein modified by physical method方法 条件 主要变化 参考文献 超高温 制备成分散体后预热到80 ℃,最后一个
加工温度下140 ℃持续6 s对豌豆蛋白饮料挥发性香气组成和感官结构影响显著 [18] 喷雾干燥 入口温度:165、180和195 ℃;
出口温度:80、87和97 ℃入口温度升高:
PPI的表面疏水性增大;
蛋白颗粒尺寸增大;
乳液滴尺寸增大[20] 双螺杆挤压 螺杆转速:400~700 min−1;
含水量:26%~35%;
末端桶的温度:130~170 ℃截面膨胀指数增大;
溶解度下降;
体积密度降低;
β-折叠和α-螺旋结构减少;
β-转角结构增加[21] 螺杆转速为:150 min−1;
含水量:55%;
末端桶的温度:100~160 ℃截面膨胀指数增大;
溶解度下降;
粘度随着温度高于100 ℃而下降[22] 螺杆转速为:300 min−1;
含水量:40%~60%;
末端桶的温度:175 ℃β-折叠和α-螺旋向β-转角和无规卷曲结构转变;
持水性下降;
乳化性和乳化稳定性提高[23] 超声处理 振幅:0、50%、100%;
处理时间:0、1、3和5 min;
强度:20~60 W·cm−2溶解度提高;
表面疏水性提高;
颗粒尺寸降低;
乳化活性提高[26] 功率:600 W;
处理时间:0~60 min;
频率:20 kHz30~40 min处理降低了α-螺旋,提高了β-折叠;
颗粒尺寸降低;
溶解度提高;
乳化活性提高[27] 振幅:0、30%、60%、90%;
处理时间:30 min;
强度:22~48 W·cm−2表面疏水性提高;
颗粒尺寸降低;
起泡能力增加[28] 微流化 压力30、60、90、120 MPa 溶解度提高;
颗粒尺寸降低;
荧光强度增加[29] 大气冷等离子体 频率为3.0 kHz的8.8 kV正弦电压 溶解度提高;
持水性提高;
持油性提高[33] 施加交流电源产生20 kHz正弦高压,
加入O3、NxOy、H2O2和OH等离子体O3和OH:
表面疏水性提高;
β-折叠含量显著增加;
凝胶性增强;
乳化性增强;
H2O2:
蛋白的白度增加[34] 频率为3.5 kHz,电压输出0~30 kV PPC可在变性温度下变性;
凝胶性增强;
持水性提高[35] 2.1.2 非高温处理
超声、微流化和大气冷等离子体则不属于高温处理,可以更好的维持产品的特性。超声波对蛋白质结构的影响与空化效应有关,空化效应会导致压差循环、剪切应力、湍流和温度升高[24-25]。超声分为探针式和波浴式,其结构示意图如图2所示。超声会导致蛋白质分子破碎,进而提高了PPI的乳化性和溶解度。Sha等[26]和李朝蕊等[27]重点研究了超声处理对PPI的乳化性的影响,研究表明超声后的PPI会形成相对刚性的界面膜,因此提高了乳液体系物理的稳定性。Xiong等[28]证明了超声处理不仅会改变PPI的结构,也会改善PPI的起泡性能。这为人们更好的了解PPI以及其在饮料工艺上的应用提供了依据。
微流化是一种高压均质化技术,在该技术中,由于高剪切应力、空化、膨胀和湍流,加压悬浮体被迫通过微通道,导致颗粒破碎[18-19],进而导致细乳液的形成。微流化处理的结构示意图如图3所示。传统微流化机器有着通道小、处理能力低、易堵塞等缺点,而He等[29]设计的新型微流化器避免了这些缺点,其研究发现,PPI在微流化的过程中被破坏了二硫键,促进了大的不溶性蛋白质分子或聚集体转化为可溶性颗粒,这使得PPI的溶解度得到了改善。大气冷等离子体作为一种新型的非热加工技术,具有处理时间短、对食品物理特性、风味和营养成分无热损害的优点[30-32]。Bußler等[33]和Bu等[34]研究了离子气体对PPI的结构和功能影响。研究结果显示,在对PPI进行大气等离子气体处理后,PPI的溶解度、持水和持油能力均得到提高,O3和OH处理使得PPI的凝胶性和乳化性显著增强,而H2O2处理可以提高PPI的白度,凝胶性和乳化性的改变可以提高其在食品中的应用价值,而白度的增加,提高了豌豆蛋白作为添加剂在食品中的可行性。Zhang等[35]在Bußler的研究基础上进一步探究发现了经大气等离子体处理后的PPC有着良好的凝胶性能,并具有较高的持水能力。
2.2 化学改性
2.2.1 酸碱化处理
pH偏移处理,即将蛋白质溶液置于极端酸性或极端碱性的pH条件下,使得蛋白质部分折叠,然后置于中性的pH环境,蛋白质重新折叠,形成具有独特表面性质的熔融球状构象[36]。Jiang等[37]的研究指出,利用碱移后的PPI可以更好的吸附脂肪球,其制成的乳液更均匀且不易氧化。这一改变可以使得PPI更好的适用于营养物质和一些食品药品的载体。Zhu等[38]的研究侧重于PPI的凝胶性,其研究首次报道了一种pH偏移处理制备的PPI凝胶,在pH为12时,延长PPI在碱液的时间(1、24和48 h),豌豆蛋白可形成三维凝固体,当pH降至中性时,凝固体结构仍保持不变。这种凝胶有着良好的弹性和持水性,可媲美一些动物蛋白凝胶,这为食品开发提供了一种新工艺。
2.2.2 糖基化反应
通过美拉德反应将多糖与植物蛋白结合,已成为一种改善蛋白质功能特性的绿色化学方法[39-40],在豌豆蛋白与多糖结合的研究中,Zha等[41-42]发现阿拉伯树胶与PPH和PPC偶联后,可以降低豆类风味,并改善PPH、PPC的溶解度、乳化性能和抗氧化活性,这个发现可以让极具营养价值的PPH、PPC更好的应用于食品中。在之后的研究中,Zha等[43]进一步使用了葡萄糖、乳糖和麦芽糊精与PPI进行偶联,偶联后的PPI的分子结构被打开,PPI的溶解度和豆类风味也得到了改善。除了上述糖类物质,脱酯化的高甲氧基柑橘果胶也能够改善PPI的溶解度[44]。这些结果都证明了豌豆蛋白作为食品或者生物原料的可行性。例如在豌豆蛋白基饮料的体系中,在酸性条件下添加卡拉胶与PPI可以形成可溶性静电复合物,这种复合物具有更小的粒径和更高的电荷量,可以显著提高PPI的乳化稳定性[45]。而Wei等[46]的研究也表明,4种多糖(玉米纤维胶、高甲氧基果胶、羧甲基纤维素和魔芋葡甘聚糖)在饮料体系中与PPI进行偶联,无论是自然pH环境还是酸性pH环境,PPI分散体的物理稳定性都得到了提高。豌豆蛋白和多糖的偶联,不仅改善了其原有的功能性(尤其是豆类风味的降低和溶解度的提高),可以使其在饮料行业得到一定应用。
2.2.3 官能团转化
脱酰胺化、磷酸化和酰化都属于对蛋白侧链的官能团进行修饰的改性方法。脱酰胺化目前普遍采用的是将谷氨酰胺和天冬酰胺残基中的酰胺变为羧基来增加蛋白质负电荷的方法[47]。Fang等[48]采用了谷氨酰胺对PPI进行脱酰胺,显著提高了PPI溶解度,减轻了豆类风味和苦味。磷酸化是一种费用低且高效的改善蛋白质功能特性的方法。在此过程中,磷酸化试剂选择性地与蛋白质侧链上的活性基团发生反应,从而引入多个带负电荷的磷酸基团,增强了蛋白质分子间的静电斥力,从而改善了豌豆蛋白的功能。PPI进行磷酸化处理后,溶解度、乳化性能、乳化稳定性、起泡性能和持油能力均有提高[49]。酰化改性不同于磷酸化,酰化是酰化剂与蛋白质氨基酸残基之间的亲核取代反应,可改善PPI的功能性质,酰化后的PPI溶解度、起泡能力和稳定性、乳状液稳定性和持水性都有所提高[50-51]。
2.3 酶法改性
2.3.1 酶交联
酶交联是一种安全、特殊的生物技术工具,用于调节豌豆蛋白的性质,同时能保持所需的质构特性[52]。Glusac等[53]使用酪氨酸酶交联豌豆蛋白,其研究结果表明交联后的豌豆蛋白乳液中,具有更好的稳定性、更大的粒径、更高的粘度和糊状结构,这对设计和配制酱料、奶酪和肉类替代品以及其它素食具有重要作用。谷氨酰胺转氨酶是目前研究较多的课题,谷氨酰胺转氨酶与豌豆蛋白交联后,可以改变蛋白分子的二级结构的组成、分子大小、表面疏水性以及游离巯基和氨基的含量,这些改变使得豌豆蛋白的持水能力得到提高[54]。而对豌豆蛋白深入研究就会发现,谷氨酰胺转氨酶对豌豆蛋白中的豌豆球蛋白影响是最为显著的,可使得豌豆球蛋白形成良好的凝胶。白蛋白的酶交联程度是弱于球蛋白的,所以其不足与形成凝胶[55]。随后Djoullah等[56]进一步使用二硫苏糖醇和热处理使得豌豆蛋白变性,虽然球蛋白和白蛋白的交联度都有提高,但白蛋白仍然不能形成良好的凝胶。同时Djoullah等[56]的研究也表明,变性后的球蛋白凝胶强度会出现矛盾的结果,因此谷氨酰胺转氨酶处理豌豆球蛋白的凝胶机制仍需进一步研究。
2.3.2 酶水解
酶水解已被证明是用于修饰定制蛋白制剂最有前途的方法之一,酶解通常会降低分子量,增加可电离基团的数量,并暴露隐藏在蛋白质核心中的疏水性基团[8,57-58]。García等[59]和Bajaj等[60]均以PPI为研究对象,选择了多种水解酶对PPI进行水解,大多数酶都能改善PPI的加工特性,尤其是可以改善PPI的溶解度和起泡能力,在感官特性方面,酶解后使得苦味发生显著变化。胰蛋白酶对PPC水解后,可改善其溶解度[61]。用碱性蛋白酶对豌豆蛋白进行水解,可改善其乳化性和起泡性[62-64]。
2.4 复合改性
复合改性则是根据不同改性方法的特性和所需产物的性质,使用多种改性方法联用的一种改性手段。本文介绍的复合改性大多介于上述物理改性、化学改性和酶法改性联用的基础之上。
在化学处理中,改变pH是一种传统的、简单的方法,广泛应用于动植物蛋白的一种处理手段,但其对豌豆蛋白的影响是有限的,和超声联合是一种更为有效的处理手段。Jiang等[65]在pH偏移的基础上进一步使用超声对PPI进行改性处理,结果显示,pH12偏移和超声联合处理成功地提高了PPI的溶解度,并显著减小了可溶性蛋白聚集体的尺寸,表面疏水性显著增强。
高压加工是一种非热食品加工技术,主要用于灭活食品中的营养微生物,Hall等[66]采用高压与热处理对豌豆蛋白进行处理,高压与热处理使得PPC的持水能力和凝胶性提高,溶解性降低,这在脂肪替代领域是一个可行的研究方向。
基于固体分散的喷雾干燥技术是一种优良的改性方法,可以改善低水溶性成分的溶解度,降低蛋白质的苦味[67]。Cui等[68-69]和Lan等[70]通过添加不同的多糖和化学试剂并对共混物进行喷雾干燥,进而观察PPI功能性的改变。在喷雾干燥过程中,多糖和化学试剂的加入改变了PPI的外部形态和分子间作用力,提高了溶解度,减少了豌豆蛋白产品的豆类风味,对PPI的结构没有明显影响,这可能对豌豆蛋白在饮料体系的应用中提供了帮助。
豌豆白蛋白与豌豆球蛋白在以微流化为主要处理手段的前提下,会有不同的结果。Djemaoune等[71]和Oliete等[72]分别研究了微流化对豌豆白蛋白和豌豆球蛋白的影响,豌豆白蛋白在调整pH后进行热处理,最后通过微流化来观察其性质的变化,不论pH如何变化,其溶解度均未有显著改变,而表面疏水性随着pH的不同有着不同程度的变化。豌豆球蛋白则在微流化处理后表现出溶解度增加的性质,但在干燥与微流化共同处理豌豆球蛋白后,会使其溶解度降低,但会提高其悬浮稳定性。这些发现对于在食品工业中使用豌豆球蛋白聚集体作为干粉末制备悬浮液、乳剂和凝胶具有决定性意义。
3. 豌豆蛋白在食品中的应用
豌豆蛋白因其良好的功能性,通过添加豌豆蛋白对食品进行强化或包埋活性物质,可以增加食品的营养全面性;改善食品的稳定性;延长食品的贮藏时间。豌豆蛋白在食品中的应用主要有以下几个:活性物质的包封作用、在食品乳液中的稳定作用、物质替代的作用以及食品强化剂方面的应用。
3.1 活性物质的包封作用
食品中有着很多的有益物质,例如多酚类,但因其易氧化,导致多酚不能很好的被人消化利用。单独的使用豌豆蛋白对活性物质进行包封已经有学者进行研究,Jansen-Alves等[73]采用了喷雾干燥的方法,利用豌豆蛋白和蜂胶提取物制备了二元复合物蜂胶微粒。研究指出,添加豌豆蛋白作为微胶囊的载体,不仅可以降低蜂胶的气味,还能保护其生物活性化合物。添加2%豌豆蛋白和5%蜂胶提取物的微粒包封效率最好,得率较高,对金黄色葡萄球菌和李斯特菌均有抑菌甚至杀菌的作用。这项研究证明了豌豆蛋白在包封食品体系上的可行性。
在三元复合物上,Guo等[74]对PPI也进行了一系列的研究,首先Guo等[74]利用Ca2+诱导在中性pH条件下制备了可以负载姜黄素的PPI-高甲氧基果胶复合物。静电相互作用是Ca2+桥的主要形成力,当Ca2+浓度为24 mmol/L时,Ca2+会降低PPI分子的表面疏水性,姜黄素与PPI的结合能力变弱,从而提高了封装能力和保护能力,使得复合物中姜黄素的包封率提高至97.33%±0.05%。随后Guo等[75]进一步探究了果胶类型和姜黄素浓度对配合物理化性质的影响,研究发现静电相互作用、疏水作用和氢键作用是诱导PPI-姜黄素-果胶三元复合物形成的主要力,说明了PPI-高甲氧基果胶复合物更适合作为姜黄素的递送载体。Guo等[76]的另一项研究则利用了pH驱动法制备了用于负载姜黄素的PPI-表面活性剂复合物,PPI-姜黄素-表面活性剂复合物的形成主要是氢键作用和疏水作用。研究表明,PPI-鼠李糖脂复合物具有较高的光稳定性和热稳定性,可以将姜黄素成功地包埋在配合物中并转变为非晶态,从而延缓姜黄素在肠道期的释放。在防止油脂氧化酸败的研究中,Lan等[77-78]研究了PPI和甜菜果胶在不同pH以及混合比例下对其复合物的影响,并进一步以PPI-甜菜果胶复合物为研究对象,利用复凝聚的方法制备了负载大麻籽油的PPI-甜菜果胶微胶囊。研究指出在pH为2.5时形成的胶凝液孔径均匀、内表面光滑,包封效率高;在壁芯比方面,1:1的壁芯比会使微胶囊表面油脂含量降低,进而降低大麻籽油的氧化稳定性。这些研究都足以证明豌豆蛋白在食品包封体系中的潜力。
3.2 食品乳液的稳定作用
在食品体系里面,许多食品包括两个不同的相,如分散在水中的油滴,称为水包油乳剂。豌豆蛋白作为蛋白质界面的主要稳定剂[79],是乳液体系中不可缺少的部分。Hinderink等[80]的研究则进一步证明,豌豆蛋白里不溶性制成的乳液的物理稳定性优于全组分的豌豆蛋白制成的乳液。其中不溶性豌豆蛋白稳定乳状液表现出较快的脂质氧化,但不影响其物理稳定性。相比之下,完整的豌豆蛋白乳状液在氧化条件下物理不稳定,但氧化产物积累最低。表明了豌豆分离蛋白的可溶性和不溶性部分可能存在拮抗作用,这对设计稳定的植物蛋白基乳液具有重要意义。而变性的豌豆蛋白也具有更好的乳液稳定性,Akkam等[81]采用pH偏移和超声联合方法制备了豌豆蛋白纳米乳液,相较于未经处理的豌豆蛋白,其具有持水性高、起泡性好、乳化性能好、颜色变化小、抗氧化能力强等特点,并能很好的保护维生素D。
在乳液的二元体系中,Dai等[82]以豌豆蛋白和葡萄籽原花青素为原料制备了胶体复合物,该复合物的相互作用主要为氢键作用,该复合物略微降低了乳液的等电点、热稳定性和盐稳定性,但提高了乳液的储存稳定性。在乳液的三元体系中,豌豆蛋白和多糖结合,也可以很好的提高乳液的稳定性。Yi等[83]的研究指出PPI和高甲氧基果胶制备的胶体颗粒在用于负载β-胡萝卜素的高内向Pickering乳液中,PPI-高甲氧基果胶胶体颗粒显著提高了高内向Pickering乳液的贮存稳定性。与对照组玉米油相比,PPI和PPI-高甲氧基果胶复合物稳定的高内向Pickering乳液均表现出更高的脂解程度,并可以增强β-胡萝卜素化学稳定性和控释性能。
由此可见,豌豆蛋白在维持乳液的稳定性方面有着非常重要的作用,可作为界面稳定剂。
3.3 物质替代的作用
豌豆蛋白因其良好的功能性,在食品体系当中可以适当的作为一些蛋白的替代品或强化某些食品的性质[84]。Kornet等[85]、Borderías等[86]和Öztürk-Kerimoğlu[87]使用PPI分别作为乳清蛋白、肌原纤维蛋白以及脂肪的替代物进行了研究。结果显示,在热固化凝胶中,PPI是乳清分离蛋白的合适替代品。8%和10%的PPI添加到鱼糜肌纤维蛋白中,可改善混合蛋白网络的固体性质和凝胶持久性。用豌豆蛋白和琼脂组成的凝胶体系完全替代脂肪,会使模型肉更柔软,更具粘性,可显著提高营养成分,降低总脂肪和热量值,同时增加总蛋白质含量。上述研究为改善豌豆的资源利用效率提供了依据,同时也证明了豌豆良好的功能性。豌豆蛋白和小麦面筋相结合,可以很好的模拟鸡肉的性质,Schreuders等[88]利用剪切诱导结构和加热结合的方法制备了PPI与小麦淀粉的共混物,产生了独特的纤维形态。以豌豆为基础的复合物与鸡肉的强度在同一范围内,这为PPI-小麦淀粉混合物的纤维肉类似物的制备提供了参考。
3.4 食品强化剂方面的应用
PPH对人体有很多有益的功效,López-Barón等[89]和Wee等[90]的研究均证明了PPH和变性后的PPI均可对小麦淀粉的水解有抑制作用,并可显著减少小麦淀粉释放葡萄糖的量,且几乎不会对产品质地和感官知觉产生影响,因此证明了豌豆蛋白有着良好的制备低血糖食品的潜力。在一些食品中添加豌豆蛋白,不仅可以丰富食品的营养全面性,还可对食品的性状进行改善,Beck等[91]首次研究了大米淀粉中豌豆蛋白和豌豆纤维的添加对最终产品特性的影响,大米淀粉与豌豆蛋白和豌豆纤维共混物的膨化率较纯大米淀粉显著提高,同时也丰富了该食品体系的营养成分。在食品强化方面,Shen等[92]证明添加顺序脱酰胺和偶联修饰的PPI的肉饼在保脂、保水、蒸煮率和质地柔软等方面具有优势。豌豆蛋白的添加可以提高海绵蛋糕面糊的流变性能,增加面糊的稳定性,且溶解度无显著差异[93]。
4. 结论与展望
豌豆蛋白作为一个营养丰富,性质良好的蛋白,在食品体系中发挥着重要作用。总体来讲,不同的改性方法各有优劣,物理改性安全无毒,但对机械设备的要求较高,导致其在大规模的工业生产中难以进行;化学改性具有成本低、反应时间短、设备需求量小、改性效果明显等优点,但在加工过程中容易产生有毒副产物;酶改性具有反应条件温和、反应特异性强等优点,但反应速率远远低于化学改性,导致生产周期更长,生产成本高;复合改性则可以考虑不同改性方式对豌豆蛋白的影响,进而选择不同的改性方式进行组合处理。
现阶段虽然对豌豆蛋白的研究较多,但对其性质和结构的研究还有待完善。如何在不影响豌豆蛋白功能性的前提下,改善豌豆蛋白的豆类风味和色度,决定其能否被广泛应用。而随着现在3D打印或4D打印方法在食品领域的不断探究,有效的预处理方法是豌豆蛋白可以适用的前提。综合来看,经过一种或者多种改性方法处理的豌豆蛋白,在功能性和食品应用方面都有着很大程度的提升,这为以后有关豌豆蛋白在未来食品的应用提供了全新的思路。可利用豌豆蛋白弥补人体对营养物质的需求;改善食品对稳定性与贮藏性的要求;代替动物蛋白以减轻对自然环境的影响。故今后应加大对豌豆蛋白功能性的研究、寻找多种处理豌豆蛋白的改性方法、改善豌豆蛋白的性质、扩大豌豆蛋白在食品领域里面的应用、增大豌豆商业价值以获得最大经济利益。
-
表 1 豌豆蛋白的组成及其分子特性
Table 1 Composition and molecular characteristics of pea protein
种类 含量 溶解性 蛋白质 斯韦德贝里
单位分子量
(kDa)球蛋白 55%~65% 盐溶 豆球蛋白
豌豆球蛋白
豌豆伴球蛋白11S
7S
8S320~410
150
180~210白蛋白 18%~25% 水溶 白蛋白 2S 68.5 醇溶谷蛋白 4%~5% 醇溶 醇溶谷蛋白 / / 谷蛋白 3%~4% 不溶 谷蛋白 / / 注:表中数据来源为Lu等[16]。 表 2 物理方法对豌豆蛋白改性后的主要变化
Table 2 Main changes of pea protein modified by physical method
方法 条件 主要变化 参考文献 超高温 制备成分散体后预热到80 ℃,最后一个
加工温度下140 ℃持续6 s对豌豆蛋白饮料挥发性香气组成和感官结构影响显著 [18] 喷雾干燥 入口温度:165、180和195 ℃;
出口温度:80、87和97 ℃入口温度升高:
PPI的表面疏水性增大;
蛋白颗粒尺寸增大;
乳液滴尺寸增大[20] 双螺杆挤压 螺杆转速:400~700 min−1;
含水量:26%~35%;
末端桶的温度:130~170 ℃截面膨胀指数增大;
溶解度下降;
体积密度降低;
β-折叠和α-螺旋结构减少;
β-转角结构增加[21] 螺杆转速为:150 min−1;
含水量:55%;
末端桶的温度:100~160 ℃截面膨胀指数增大;
溶解度下降;
粘度随着温度高于100 ℃而下降[22] 螺杆转速为:300 min−1;
含水量:40%~60%;
末端桶的温度:175 ℃β-折叠和α-螺旋向β-转角和无规卷曲结构转变;
持水性下降;
乳化性和乳化稳定性提高[23] 超声处理 振幅:0、50%、100%;
处理时间:0、1、3和5 min;
强度:20~60 W·cm−2溶解度提高;
表面疏水性提高;
颗粒尺寸降低;
乳化活性提高[26] 功率:600 W;
处理时间:0~60 min;
频率:20 kHz30~40 min处理降低了α-螺旋,提高了β-折叠;
颗粒尺寸降低;
溶解度提高;
乳化活性提高[27] 振幅:0、30%、60%、90%;
处理时间:30 min;
强度:22~48 W·cm−2表面疏水性提高;
颗粒尺寸降低;
起泡能力增加[28] 微流化 压力30、60、90、120 MPa 溶解度提高;
颗粒尺寸降低;
荧光强度增加[29] 大气冷等离子体 频率为3.0 kHz的8.8 kV正弦电压 溶解度提高;
持水性提高;
持油性提高[33] 施加交流电源产生20 kHz正弦高压,
加入O3、NxOy、H2O2和OH等离子体O3和OH:
表面疏水性提高;
β-折叠含量显著增加;
凝胶性增强;
乳化性增强;
H2O2:
蛋白的白度增加[34] 频率为3.5 kHz,电压输出0~30 kV PPC可在变性温度下变性;
凝胶性增强;
持水性提高[35] -
[1] JARPA-PARRA M. Lentil protein: A review of functional properties and food application. An overview of lentil protein functionality[J]. International Journal of Food Science & Technology,2018,53(4):892−903.
[2] JIANG R S, XIAO Z G, HUO J J, et al. Effects of rice bran content on plant-based simulated meat: From the aspects of apparent properties and structural characteristics[J]. Food Chemistry,2022,380:131842. doi: 10.1016/j.foodchem.2021.131842
[3] ZHAO H F, SHEN C, WU Z J, et al. Comparison of wheat, soybean, rice, and pea protein properties for effective applications in food products[J]. Journal of Food Biochemistry,2020,44(4):e13157.
[4] GORISSEN S H M, CROMBAG J J R, SENDEN J M G, et al. Protein content and amino acid composition of commercially available plant-based protein isolates[J]. Amino Acids,2018,50(12):1685−1695. doi: 10.1007/s00726-018-2640-5
[5] 夏轩泽, 李言, 钱海峰, 等. 豌豆蛋白乳化性及其改善研究进展[J]. 食品与发酵工业,2021,47(2):279−284. [XIA X Z, LI Y, QIAN H F, et al. Research progress on improvement the emulsification property of pea protein[J]. Food and Fermentation Industries,2021,47(2):279−284. doi: 10.13995/j.cnki.11-1802/ts.024730 [6] ARNTFIELD S D, MASKUS H D. Peas and other legume proteins[J]. Handbook of Food Proteins,2011:233−266.
[7] KOWALCZYK D, GUSTAW W, ŚWIECA M, et al. A study on the mechanical properties of pea protein isolate films[J]. Journal of Food Processing and Preservation,2014,38(4):1726−1736. doi: 10.1111/jfpp.12135
[8] GE J, SUN C X, CORKE H, et al. The health benefits, functional properties, modifications, and applications of pea (Pisum sativum L.) protein: Current status, challenges, and perspectives[J]. Comprehensive Reviews in Food Science and Food Safety,2020,19(4):1835−1876. doi: 10.1111/1541-4337.12573
[9] SUN W Q, XIONG Y L. Stabilization of cooked cured beef color by radical-scavenging pea protein and its hydrolysate[J]. LWT-Food Science and Technology,2015,61(2):352−358. doi: 10.1016/j.lwt.2014.12.048
[10] LIAO W, FAN H B, LIU P, et al. Identification of angiotensin converting enzyme 2 (ACE2) up-regulating peptides from pea protein hydrolysate[J]. Journal of Functional Foods,2019,60:103395. doi: 10.1016/j.jff.2019.05.051
[11] ŚWIĄTECKA D, MARKIEWICZ L H, WRÓBLEWSKA B. Experimental immunology pea protein hydrolysate as a factor modulating the adhesion of bacteria to enterocytes, epithelial proliferation and cytokine secretion–an in vitro study[J]. Central European Journal of Immunology,2012,37(3):227−231.
[12] SWIATECKA D, NARBAD A, RIDGWAY K P, et al. The study on the impact of glycated pea proteins on human intestinal bacteria[J]. International Journal of Food Microbiology,2011,145(1):267−272. doi: 10.1016/j.ijfoodmicro.2011.01.002
[13] 朱艳, 魏颖, 严建刚, 等. 发酵豌豆蛋白肽对盐酸林可霉素诱导的小鼠肠道菌群紊乱的调节作用[J]. 中国食品学报,2021,21(12):106−116. [ZHU Y, WEI Y, YAN J G, et al. Regulatory effect of fermented pea peptide on intestinal flora disturbance induced by lincomycin hydrochloride in mice[J]. Journal of Chinese Institute of Food Science and Technology,2021,21(12):106−116. [14] 李明亮, 严建刚, 朱艳, 等. 乳清蛋白和豌豆蛋白对抗生素致肠道菌群紊乱小鼠的调节作用[J]. 中国食品学报,2021,21(11):86−95. [LI M L, YAN J G, ZHU Y, et al. Regulatory effect of whey protein and pea protein on mice with intestinal flora disorder caused by antibiotics[J]. Journal of Chinese Institute of Food Science and Technology,2021,21(11):86−95. [15] BOUKID F, ROSELL C M, CASTELLARI M. Pea protein ingredients: A mainstream ingredient to (re)formulate innovative foods and beverages[J]. Trends in Food Science & Technology,2021,110:729−742.
[16] LU Z X, HE J F, ZHANG Y C, et al. Composition, physicochemical properties of pea protein and its application in functional foods[J]. Critical Reviews in Food Science and Nutrition,2020,60(15):2593−2605. doi: 10.1080/10408398.2019.1651248
[17] PENG W W, KONG X Z, CHEN Y M, et al. Effects of heat treatment on the emulsifying properties of pea proteins[J]. Food Hydrocolloids,2016,52:301−310. doi: 10.1016/j.foodhyd.2015.06.025
[18] TRIKUSUMA M, PARAVISINI L, PETERSON D G. Identification of aroma compounds in pea protein UHT beverages[J]. Food Chemistry,2020,312:126082. doi: 10.1016/j.foodchem.2019.126082
[19] BALDELLI A, ETAYASH H, OGUZLU H, et al. Antimicrobial properties of spray-dried cellulose nanocrystals and metal oxide-based nanoparticles-in-microspheres[J]. Chemical Engineering Journal Advances,2022,10:100273. doi: 10.1016/j.ceja.2022.100273
[20] BURGER T G, SINGH I, MAYFIELD C, et al. The impact of spray drying conditions on the physicochemical and emulsification properties of pea protein isolate[J]. LWT-Food Science and Technology,2022,153:112495. doi: 10.1016/j.lwt.2021.112495
[21] BECK S M, KNOERZER K, ARCOT J. Effect of low moisture extrusion on a pea protein isolate's expansion, solubility, molecular weight distribution and secondary structure as determined by Fourier transform infrared spectroscopy (FTIR)[J]. Journal of Food Engineering,2017,214:166−174. doi: 10.1016/j.jfoodeng.2017.06.037
[22] OSEN R, TOELSTEDE S, WILD F, et al. High moisture extrusion cooking of pea protein isolates: Raw material characteristics, extruder responses, and texture properties[J]. Journal of Food Engineering,2014,127:67−74. doi: 10.1016/j.jfoodeng.2013.11.023
[23] 张百汝, 王斌, 王琨, 等. 挤压处理对豌豆蛋白功能特性及结构的影响[J]. 食品与机械,2022,38(1):32−37. [ZHANG B R, WANG B, WANG K, et al. Effect of extrusion treatment on the functional properties and structure of pea protein[J]. Food & Machinery,2022,38(1):32−37. doi: 10.13652/j.issn.1003-5788.2022.01.004 [24] O'SULLIVAN J, MURRAY B, FLYNN C, et al. The effect of ultrasound treatment on the structural, physical and emulsifying properties of animal and vegetable proteins[J]. Food Hydrocolloids,2016,53:141−154. doi: 10.1016/j.foodhyd.2015.02.009
[25] OJHA K S, TIWARI B K, O'DONNELL C P. Chapter six-Effect of ultrasound technology on food and nutritional quality[M]. Toldrá F, Editor, Advances in Food and Nutrition Research: Academic Press, 2018: 207−240.
[26] SHA L, KOOSIS A O, WANG Q L, et al. Interfacial dilatational and emulsifying properties of ultrasound-treated pea protein[J]. Food Chemistry,2021,350:129271. doi: 10.1016/j.foodchem.2021.129271
[27] 李朝蕊, 韩馨蕊, 范鑫, 等. 超声对豌豆分离蛋白结构及乳化性能的调控效应[J]. 中国农业科学,2021,54(22):4894−4905. [LI C R, HAN X R, FAN X, et al. Regulation effects of ultrasound on the structure and emulsification properties of pea protein isolate[J]. Scientia Agricultura Sinica,2021,54(22):4894−4905. doi: 10.3864/j.issn.0578-1752.2021.22.015 [28] XIONG T, XIONG W W, GE M T, et al. Effect of high intensity ultrasound on structure and foaming properties of pea protein isolate[J]. Food Research International,2018,109:260−267. doi: 10.1016/j.foodres.2018.04.044
[29] HE X H, CHEN J, HE X M, et al. Industry-scale microfluidization as a potential technique to improve solubility and modify structure of pea protein[J]. Innovative Food Science & Emerging Technologies,2021,67:102582.
[30] MIAO W H, NYAISABA B, KODDY J, et al. Effect of cold atmospheric plasma on the physicochemical and functional properties of myofibrillar protein from Alaska pollock (Theragra chalcogramma)[J]. International Journal of Food Science & Technology,2020,55(2):517−525.
[31] MANDAL R, SINGH A, PRATAP SINGH A. Recent developments in cold plasma decontamination technology in the food industry[J]. Trends in Food Science & Technology,2018,80:93−103.
[32] 刘培玲, 张晴晴, 高增丽, 等. 乳清蛋白改性研究进展[J]. 食品科学,2021,42(23):333−348. [LIU P L, ZHANG Q Q, GAO Z L, et al. Advances in modification of whey proteins[J]. Food Science,2021,42(23):333−348. doi: 10.7506/spkx1002-6630-20201023-232 [33] BUßLER S, STEINS V, EHLBECK J, et al. Impact of thermal treatment versus cold atmospheric plasma processing on the techno-functional protein properties from Pisum sativum 'Salamanca'[J]. Journal of Food Engineering,2015,167:166−174. doi: 10.1016/j.jfoodeng.2015.05.036
[34] BU F, NAYAK G, BRUGGEMAN P, et al. Impact of plasma reactive species on the structure and functionality of pea protein isolate[J]. Food Chemistry,2021,371:131135.
[35] ZHANG S T, HUANG W J, FEIZOLLAHI E, et al. Improvement of pea protein gelation at reduced temperature by atmospheric cold plasma and the gelling mechanism study[J]. Innovative Food Science & Emerging Technologies,2021:67.
[36] WANG Q L, XIONG Y L. Processing, nutrition, and functionality of hempseed protein: A review[J]. Comprehensive Reviews in Food Science and Food Safety,2019,18(4):936−952. doi: 10.1111/1541-4337.12450
[37] JIANG J, ZHU B, LIU Y F, et al. Interfacial structural role of pH-shifting processed pea protein in the oxidative stability of oil/water emulsions[J]. Journal of Agricultural and Food Chemistry,2014,62(7):1683−1691. doi: 10.1021/jf405190h
[38] ZHU P N, HUANG W J, GUO X J, et al. Strong and elastic pea protein hydrogels formed through pH-shifting method[J]. Food Hydrocolloids,2021,117:106705. doi: 10.1016/j.foodhyd.2021.106705
[39] OLIVEIRA F, COIMBRA J, DE OLIVEIRA E B, et al. Food protein-polysaccharide conjugates obtained via the Maillard reaction: A review[J]. Critical Reviews in Food Science and Nutrition,2016,56(7):1108−1125. doi: 10.1080/10408398.2012.755669
[40] ROMÁN J K, WILKER J J. Cooking chemistry transforms proteins into high-strength adhesives[J]. Journal of the American Chemical Society,2019,141(3):1359−1365. doi: 10.1021/jacs.8b12150
[41] ZHA F C, YANG Z Y, RAO J J, et al. Gum arabic-mediated synthesis of glyco-pea protein hydrolysate via Maillard reaction improves solubility, flavor profile, and functionality of plant protein[J]. Journal of Agricultural and Food Chemistry,2019,67(36):10195−10206. doi: 10.1021/acs.jafc.9b04099
[42] ZHA F C, DONG S Y, RAO J J, et al. The structural modification of pea protein concentrate with gum arabic by controlled Maillard reaction enhances its functional properties and flavor attributes[J]. Food Hydrocolloids,2019,92:30−40. doi: 10.1016/j.foodhyd.2019.01.046
[43] ZHA F C, YANG Z Y, RAO J J, et al. Conjugation of pea protein isolate via Maillard-driven chemistry with saccharide of diverse molecular mass: Molecular interactions leading to aggregation or glycation[J]. Journal of Agricultural and Food Chemistry,2020,68(37):10157−10166. doi: 10.1021/acs.jafc.0c04281
[44] PILLAI P K S, MORALES-CONTRERAS B E, WICKER L, et al. Effect of enzyme de-esterified pectin on the electrostatic complexation with pea protein isolate under different mixing conditions[J]. Food Chemistry,2020,305:125433. doi: 10.1016/j.foodchem.2019.125433
[45] 沈可洁, 李兴飞, 华欲飞, 等. 豌豆分离蛋白/卡拉胶复合乳液的性质研究[J/OL]. 中国油脂: 1−8 [2022-12-23]. DOI: 10.19902/j.cnki.zgyz.1003-7969.220029. SHEN K J, LI X F, HUA Y F, et al. Study on the properties of emulsions stabilized by pea protein isolate/carrageenan complexes[J/OL]. China Oils and Fats: 1−8[2022-12-23]. DOI: 10.19902/j.cnki.zgyz.1003-7969.220029.
[46] WEI Y, CAI Z X, WU M, et al. Comparative studies on the stabilization of pea protein dispersions by using various polysaccharides[J]. Food Hydrocolloids,2020,98:105233. doi: 10.1016/j.foodhyd.2019.105233
[47] KUNARAYAKUL S, THAIPHANIT S, ANPRUNG P, et al. Optimization of coconut protein deamidation using protein-glutaminase and its effect on solubility, emulsification, and foaming properties of the proteins[J]. Food Hydrocolloids,2018,79:197−207. doi: 10.1016/j.foodhyd.2017.12.031
[48] FANG L Y, XIANG H, SUN-WATERHOUSE D X, et al. Enhancing the usability of pea protein isolate in food applications through modifying its structural and sensory properties via deamidation by glutaminase[J]. Journal of Agricultural and Food Chemistry,2020,68(6):1691−1697. doi: 10.1021/acs.jafc.9b06046
[49] LIU Y H, WANG D Z, WANG J H, et al. Functional properties and structural characteristics of phosphorylated pea protein isolate[J]. International Journal of Food Science & Technology,2019,55(5):2002−2010.
[50] SHEN Y T, LI Y H. Acylation modification and/or guar gum conjugation enhanced functional properties of pea protein isolate[J]. Food Hydrocolloids,2021,117:106686. doi: 10.1016/j.foodhyd.2021.106686
[51] SHAH N N, K V U, SINGHAL R S. Hydrophobically modified pea proteins: Synthesis, characterization and evaluation as emulsifiers in eggless cake[J]. Journal of Food Engineering,2019,255:15−23. doi: 10.1016/j.jfoodeng.2019.03.005
[52] ISASCHAR-OVDAT S, FISHMAN A. Crosslinking of food proteins mediated by oxidative enzymes–a review[J]. Trends in Food Science & Technology,2018,72:134−143.
[53] GLUSAC J, DAVIDESKO-VARDI I, ISASCHAR-OVDAT S, et al. Tyrosinase-crosslinked pea protein emulsions: Impact of zein incorporation[J]. Food Res Int,2019,116:370−378. doi: 10.1016/j.foodres.2018.08.050
[54] SHEN Y T, HONG S, SINGH G, et al. Improving functional properties of pea protein through "green" modifications using enzymes and polysaccharides[J]. Food Chemistry,2022,385:132687. doi: 10.1016/j.foodchem.2022.132687
[55] DJOULLAH A, DJEMAOUNE Y, HUSSON F, et al. Native-state pea albumin and globulin behavior upon transglutaminase treatment[J]. Process Biochemistry,2015,50(8):1284−1292. doi: 10.1016/j.procbio.2015.04.021
[56] DJOULLAH A, HUSSON F, SAUREL R. Gelation behaviors of denaturated pea albumin and globulin fractions during transglutaminase treatment[J]. Food Hydrocolloids,2018,77:636−645. doi: 10.1016/j.foodhyd.2017.11.005
[57] MEINLSCHMIDT P, SUSSMANN D, SCHWEIGGERT-WEISZ U, et al. Enzymatic treatment of soy protein isolates: Effects on the potential allergenicity, technofunctionality, and sensory properties[J]. Food Sci Nutr,2016,4(1):11−23. doi: 10.1002/fsn3.253
[58] SCHLEGEL K, SONTHEIMER K, HICKISCH A, et al. Enzymatic hydrolysis of lupin protein isolates-changes in the molecular weight distribution, technofunctional characteristics, and sensory attributes[J]. Food Science and Nutrition,2019,7(8):2747−2759. doi: 10.1002/fsn3.1139
[59] GARCÍA ARTEAGA V, APÉSTEGUI GUARDIA M, MURANYI I, et al. Effect of enzymatic hydrolysis on molecular weight distribution, techno-functional properties and sensory perception of pea protein isolates[J]. Innovative Food Science & Emerging Technologies,2020,65:102449.
[60] BAJAJ P, BHUNIA K, KLEINER L, et al. Improving functional properties of pea protein isolate for microencapsulation of flaxseed oil[J]. Journal of Microencapsulation,2017,34:1−36. doi: 10.1080/02652048.2016.1267811
[61] KLOST M, DRUSCH S. Functionalisation of pea protein by tryptic hydrolysis−Characterisation of interfacial and functional properties[J]. Food Hydrocolloids,2019,86:134−140. doi: 10.1016/j.foodhyd.2018.03.013
[62] 胡婷婷. 酶改性豌豆蛋白功能特性研究[D]. 郑州: 河南工业大学, 2012 HU T T. Functional porperties of pea proteins modified by enzyme[D]. Zhengzhou: Henan University of Technology, 2012.
[63] 郭兴凤, 崔会娟, 胡婷婷, 等. Alcalase改性豌豆蛋白功能性研究[J]. 粮食与油脂,2014,27(2):42−44. [GUO X F, CUI H J, HU T T, et al. Research on functional properties of pea proteins modified by alcalase[J]. Cereals & Oils,2014,27(2):42−44. doi: 10.3969/j.issn.1008-9578.2014.02.011 [64] 郭兴凤, 崔会娟, 胡婷婷, 等. 碱性蛋白酶改性对豌豆蛋白乳化性影响[J]. 粮食与油脂,2013,26(10):26−29. [GUO X F, CUI H J, HU T T, et al. Effect of alcalase modification of pea protein on emulsion properties of the products[J]. Cereals & Oils,2013,26(10):26−29. doi: 10.3969/j.issn.1008-9578.2013.10.007 [65] JIANG S S, DING J Z, ANDRADE J, et al. Modifying the physicochemical properties of pea protein by pH-shifting and ultrasound combined treatments[J]. Ultrason Sonochem,2017,38:835−842. doi: 10.1016/j.ultsonch.2017.03.046
[66] HALL A E, MORARU C I. Structure and function of pea, lentil and faba bean proteins treated by high pressure processing and heat treatment[J]. LWT-Food Science and Technology,2021,152:112349. doi: 10.1016/j.lwt.2021.112349
[67] PATEL B B, PATEL J K, CHAKRABORTY S, et al. Revealing facts behind spray dried solid dispersion technology used for solubility enhancement[J]. Saudi Pharmaceutical Journal,2015,23(4):352−365. doi: 10.1016/j.jsps.2013.12.013
[68] CUI L Q, KIMMEL J, ZHOU L, et al. Combining solid dispersion-based spray drying with cyclodextrin to improve the functionality and mitigate the beany odor of pea protein isolate[J]. Carbohydr Polym,2020,245:116546. doi: 10.1016/j.carbpol.2020.116546
[69] CUI L Q, KIMMEL J, ZHOU L, et al. Improving the functionality of pea protein isolate through co-spray drying with emulsifying salt or disaccharide[J]. Food Hydrocolloids,2021,113:106534. doi: 10.1016/j.foodhyd.2020.106534
[70] LAN Y, XU M W, OHM J B, et al. Solid dispersion-based spray-drying improves solubility and mitigates beany flavour of pea protein isolate[J]. Food Chemistry,2019,278:665−673. doi: 10.1016/j.foodchem.2018.11.074
[71] DJEMAOUNE Y, CASES E, SAUREL R. The effect of high-pressure microfluidization treatment on the foaming properties of pea albumin aggregates[J]. Journal of Food Science,2019,84(8):2242−2249. doi: 10.1111/1750-3841.14734
[72] OLIETE B, YASSINE S A, CASES E, et al. Drying method determines the structure and the solubility of microfluidized pea globulin aggregates[J]. Food Research International,2019,119:444−454. doi: 10.1016/j.foodres.2019.02.015
[73] JANSEN-ALVES C, MAIA D S V, KRUMREICH F D, et al. Propolis microparticles produced with pea protein: Characterization and evaluation of antioxidant and antimicrobial activities[J]. Food Hydrocolloids,2019,87:703−711. doi: 10.1016/j.foodhyd.2018.09.004
[74] GUO Q, SU J Q, XIE W F, et al. Curcumin-loaded pea protein isolate-high methoxyl pectin complexes induced by calcium ions: Characterization, stability and in vitro digestibility[J]. Food Hydrocolloids,2020,98:105284. doi: 10.1016/j.foodhyd.2019.105284
[75] GUO Q, SU J Q, SHU X, et al. Production and characterization of pea protein isolate-pectin complexes for delivery of curcumin: Effect of esterified degree of pectin[J]. Food Hydrocolloids,2020,105:105777. doi: 10.1016/j.foodhyd.2020.105777
[76] GUO Q, BAYRAM I, ZHANG W T, et al. Fabrication and characterization of curcumin-loaded pea protein isolate-surfactant complexes at neutral pH[J]. Food Hydrocolloids,2021,111:106214. doi: 10.1016/j.foodhyd.2020.106214
[77] LAN Y, OHM J B, CHEN B, et al. Phase behavior and complex coacervation of concentrated pea protein isolate-beet pectin solution[J]. Food Chemistry,2020,307:125536. doi: 10.1016/j.foodchem.2019.125536
[78] LAN Y, OHM J B, CHEN B, et al. Microencapsulation of hemp seed oil by pea protein isolate-sugar beet pectin complex coacervation: Influence of coacervation pH and wall/core ratio[J]. Food Hydrocolloids,2021,113:106423. doi: 10.1016/j.foodhyd.2020.106423
[79] SRIDHARAN S, MEINDERS M B J, BITTER J H, et al. Pea flour as stabilizer of oil-in-water emulsions: Protein purification unnecessary[J]. Food Hydrocolloids,2020,101:105533. doi: 10.1016/j.foodhyd.2019.105533
[80] HINDERINK E B A, SCHRÖDER A, SAGIS L, et al. Physical and oxidative stability of food emulsions prepared with pea protein fractions[J]. LWT-Food Science and Technology,2021,146:111424. doi: 10.1016/j.lwt.2021.111424
[81] AKKAM Y, RABABAH T, COSTA R, et al. Pea protein nanoemulsion effectively stabilizes vitamin D in food products: A potential supplementation during the COVID-19 pandemic[J]. Nanomaterials (Basel),2021,11(4):887. doi: 10.3390/nano11040887
[82] DAI T T, LI T, LI R Y, et al. Utilization of plant-based protein-polyphenol complexes to form and stabilize emulsions: Pea proteins and grape seed proanthocyanidins[J]. Food Chemistry,2020,329:127219. doi: 10.1016/j.foodchem.2020.127219
[83] YI J, GAN C, WEN Z, et al. Development of pea protein and high methoxyl pectin colloidal particles stabilized high internal phase pickering emulsions for β-carotene protection and delivery[J]. Food Hydrocolloids,2021,113:106497. doi: 10.1016/j.foodhyd.2020.106497
[84] 丁玲, 张丽芬, 赖少娟, 等. 植物蛋白在肉制品中的应用研究[J]. 食品研究与开发,2021,42(4):193−197. [DING L, ZHANG L F, FAN S J, et al. Application of plant protein in meat products[J]. Food Research and Development,2021,42(4):193−197. doi: 10.12161/j.issn.1005-6521.2021.04.033 [85] KORNET R, SHEK C, VENEMA P, et al. Substitution of whey protein by pea protein is facilitated by specific fractionation routes[J]. Food Hydrocolloids,2021,117:106691. doi: 10.1016/j.foodhyd.2021.106691
[86] BORDERÍAS A J, TOVAR C A, DOMÍNGUEZ-TIMÓN F, et al. Characterization of healthier mixed surimi gels obtained through partial substitution of myofibrillar proteins by pea protein isolates[J]. Food Hydrocolloids,2020,107:105976. doi: 10.1016/j.foodhyd.2020.105976
[87] ÖZTÜRK-KERIMOĞLU B. A promising strategy for designing reduced-fat model meat emulsions by utilization of pea protein-agar agar gel complex[J]. Food Structure,2021,29:100205. doi: 10.1016/j.foostr.2021.100205
[88] SCHREUDERS F K G, DEKKERS B L, BODNÁR I, et al. Comparing structuring potential of pea and soy protein with gluten for meat analogue preparation[J]. Journal of Food Engineering,2019,261:32−39. doi: 10.1016/j.jfoodeng.2019.04.022
[89] LÓPEZ-BARÓN N, SAGNELLI D, BLENNOW A, et al. Hydrolysed pea proteins mitigate in vitro wheat starch digestibility[J]. Food Hydrocolloids,2018,79:117−126. doi: 10.1016/j.foodhyd.2017.12.009
[90] WEE M S M, LOUD D E, TAN V W K, et al. Physical and sensory characterisation of noodles with added native and denatured pea protein isolate[J]. Food Chemistry,2019,294:152−159. doi: 10.1016/j.foodchem.2019.05.042
[91] BECK S M, KNOERZER K, FOERSTER M, et al. Low moisture extrusion of pea protein and pea fibre fortified rice starch blends[J]. Journal of Food Engineering,2018,231:61−71. doi: 10.1016/j.jfoodeng.2018.03.004
[92] SHEN Y T, HONG S, DU Z J, et al. Effect of adding modified pea protein as functional extender on the physical and sensory properties of beef patties[J]. LWT-Food Science and Technology,2022,154:112774. doi: 10.1016/j.lwt.2021.112774
[93] ASSAD BUSTILLOS M, JONCHÈRE C, GARNIER C, et al. Rheological and microstructural characterization of batters and sponge cakes fortified with pea proteins[J]. Food Hydrocolloids,2020,101:105553. doi: 10.1016/j.foodhyd.2019.105553
-
期刊类型引用(5)
1. 刘静,金娜,石春芹,李永双,邓清升,罗旋飞,刘艳,杨宝君,聂龙. 响应面法优化豌豆蛋白植物肉配方及其体外消化分析. 食品工业科技. 2024(08): 216-226 .  本站查看
本站查看
2. 白伟娟. 植物蛋白的制备技术及其在食品领域的应用. 食品工业. 2024(06): 252-256 .  百度学术
百度学术
3. 刘远琨,高婷婷,张丽,高泽岳,陈晨,乌玉洁,付宸睿. 挤压型植物基人造肉的来源及加工工艺研究进展. 粮食加工. 2024(04): 80-82+99 .  百度学术
百度学术
4. 温琦,翟金星,蒋微,翟秀超. 豌豆蛋白物理改性技术研究进展. 现代食品. 2024(13): 132-135 .  百度学术
百度学术
5. 蒋金栓,赵收,武世敏,臧庆佳,杨进洁,孙书宁,张树成. 脱酰胺酶处理改善豌豆分离蛋白功能特性及风味的研究. 黑龙江粮食. 2024(08): 82-84 .  百度学术
百度学术
其他类型引用(3)





 下载:
下载:

 下载:
下载:



