Changes of Structure and in Vitro Digestion Properties of Starches in Desi Chickpea Cells Induced by Thermal Treatment
-
摘要: 鹰嘴豆因其营养价值高,血糖生成指数低的特性,引起研究者的广泛关注。本研究以分离的Desi鹰嘴豆细胞为模拟鹰嘴豆全食品的模型,探究不同热加工处理下细胞内淀粉的结构及体外消化动力学的变化。结果表明,Desi鹰嘴豆细胞的抗热性较强,热处理后所有样品内淀粉的糊化均不彻底,存在一定的晶体结构。随着处理温度的升高,淀粉的糊化温度升高且焓值降低。100 ℃热处理的样品(100D,70D-100)未检测到明显的焓值变化(ΔH<1.0 J/g),而高压热处理的样品(Pre-D)却呈现两个吸热焓值变化。红外光谱和体外消化动力学结果显示,甲酯化程度低的细胞样品,其消化速率和消化程度相对较高。因此,相较于热加工后Desi鹰嘴豆细胞中残留的淀粉晶体结构,由加工过程引起的细胞壁完整性变化可能更大程度地影响其淀粉底物的体外消化特性。本研究为慢消化鹰嘴豆食品加工提供一定理论指导。Abstract: Chickpeas have attracted wide attention of researchers owing to their high nutritional value and low glycemic index. In present study, intact cells isolated from Desi chickpeas were set as the whole chickpea food model to reveal the structure and in vitro digestion kinetics changes of starches in Desi chickpeas subjected to different thermal treatments. The results showed that starch granules in all cell samples were not fully gelatinizatized with certain amounts of relative crystallinity remained, indicating the strong resistance of cells to the thermal treatment. With the temperature of thermal treatment increased, the gelatinization temperature of starches in cell samples enhanced and the enthalpy value decreased. And no significant changes was observed for the enthalpy value of cell samples treated with 100 ℃ including 100D and 70D-100 (ΔH<1.0 J/g), whereas two endothermic peaks were observed for the pressure-heated cell samples (Pre-D). The results of Fourier transform infrared spectroscopy and in vitro digestion kinetics showed that cell samples with lower methyl esterification degree exhibited relatively higher digestion rate and extent. This result indicated that the cell wall structural changes induced by different thermal processing would cause a remarkable impact on the enzyme susceptibility to starch substrates in cells when compared with the remained crystal structure of starches. This study would provide a theoretical basis for the processing of slowly digested chickpea foods.
-
Keywords:
- Desi chickpea /
- thermal treatment /
- cell wall /
- starch structure /
- in vitro digestion properties
-
根据报告显示,2021年全球的糖尿病患者数达5.37亿,预计2030年可达6.43亿,而中国的糖尿病患者人数已达1.409亿,位居世界第一[1]。淀粉是人体获取能量的主要碳水化合物,可显著影响人体的餐后血糖应答指数(Glycemic index, GI)。慢消化或抗性淀粉含量高的食物可以稳定餐后血糖应答,降低胰岛素的分泌[2-3]。杂豆是低GI食物的典型代表,适当增加杂豆食品的摄入能积极的维持人体血糖的正常水平及代谢,从而有效地预防糖尿病和肥胖症的发生。
鹰嘴豆(Cicer arietinum L.)作为杂豆的一种,因具有如鹰喙般的尖嘴而得名,是世界第三大食用豆类,40多个国家均有种植[4]。我国种植主要集中在新疆、青海、甘肃等地。鹰嘴豆可分为Kabuli和Desi[5]两种品类,其中Kabuli外形较圆,颗粒大颜色浅;而Desi则相反,体积小颜色深,表皮厚且粗糙[6]。鹰嘴豆富含碳水化合物、蛋白质、维生素等营养素,是优质的植物性食物来源[7]。淀粉是鹰嘴豆中最主要的碳水化合物,其含量高达40%~60%[8]。鹰嘴豆中淀粉的体外消化程度约为37%~60%[9],高于其他豆类,如扁豆、红豆,低于谷物,具有较低的血糖应答指数[3]。
鹰嘴豆中淀粉等营养物质被包裹在子叶细胞内,完整的细胞结构可以限制淀粉的糊化[10],同时阻碍酶与淀粉分子的接触,降低淀粉的水解效率[11-12]。通过松弛或溶解鹰嘴豆细胞间的中间薄层组织,可分离出完整的子叶细胞,同时降低对细胞壁的损伤[13-14]。Aguilera等[15]使用温和酸碱连续处理,从杂豆中分离出完整的细胞,保留了完整的细胞壁和淀粉颗粒结构。Dhital等[13]通过热处理分离杂豆细胞,发现细胞结构可以降低淀粉的消化特性。此外,不少研究者也采用了浸泡、热处理、机械/酶法破壁等方法探究了杂豆子叶细胞内淀粉的消化特性[16-19]。前期工作也发现热处理引起的Kabuli鹰嘴豆细胞壁渗透性的变化可能显著影响内含淀粉的消化特性[20]。然而,热处理下不同种的豆类细胞的变化存在一定的差异,且不同的加工程度也可能影响细胞内营养素的消化利用率。例如Bahattarai等[14]发现,与红芸豆相比,绿豆细胞壁更易破碎成较细的颗粒。Pallares等[21]发现,随着热处理时间(95 ℃,30~180 min)的延长,菜豆子叶细胞内淀粉水解率显著提高。这可能归因于热处理程度会引起细胞结构的变化,从而影响内含淀粉的体外消化特性,但相关机制研究仍然十分有限。
Desi是鹰嘴豆中体积较小的品类,富含纤维和抗氧化成分。与常用于加工即食的Kubali鹰嘴豆相比,Desi鹰嘴豆常被用作制粉的原料。因此探究不同加工条件下Desi鹰嘴豆中淀粉结构及体外消化性的变化规律,对于Desi鹰嘴豆功能食品及其配料的研发具有十分重要的意义。事实上,与此相关的研究报道十分缺乏。因此本研究以Desi鹰嘴豆为原料,采用分离的Desi鹰嘴豆细胞作为研究鹰嘴豆全食品的模型,通过不同的热处理方式分离或处理Desi细胞,探究细胞内淀粉结构及体外消化动力学的变化规律,以期为鹰嘴豆功能性食品的研发提供一定的理论指导。
1. 材料与方法
1.1 材料与仪器
Desi鹰嘴豆 新疆木垒县当地超市;猪胰酶(P1750,4×USP)、4-羟基苯甲酰肼(PAHBAH)、磷酸盐缓冲液 西格玛奥德里奇有限公司;总淀粉含量测定试剂盒 爱尔兰Megazyme 公司;碳酸钠(Na2CO3)、氢氧化钠(NaOH)等化学试剂 均为国产分析纯。
SQP 型电子分析天平 赛多利斯科学仪器公司;Leica DMI 4000 B型光学显微镜 德国Leica公司;D3024型离心机 美国Scilogex公司;DSC 200 F3型差示量热扫描仪 德国Netzsch公司;MR Hei-Tec型加热型磁力搅拌器 德国Heidolph公司;D8 Advance型X-射线衍射分析仪 德国Bruker公司;VERTEX 70型红外光谱仪 德国Bruker公司。
1.2 实验方法
1.2.1 热处理制备鹰嘴豆细胞样品
将Desi鹰嘴豆种子置于蒸馏水溶液中,4 ℃浸泡8 h去皮。将去皮的鹰嘴豆以1:10(w/v)的比例置于70、80、100 ℃的蒸馏水溶液中加热60 min,然后用研钵轻轻压碎,依次通过100和300目的筛网分离,收集保留在300目筛上的样品,并用流动的蒸馏水充分洗涤,冷冻干燥备用[13],分别对应得到热处理下70 ℃(70D)、80 ℃(70D)及100 ℃(100D)分离的Desi鹰嘴豆细胞。综合处理过程中各步骤的样品损失,在70、80、100 ℃下制备细胞样品的得率大约分别为20%、35%、45%。
如上步骤去除Desi鹰嘴豆外皮,然后将其分散于蒸馏水溶液(1:5, w/v),高压蒸煮30 min(0.15 MPa)。用研钵轻碾并依次通过100和300目筛网分离,收集保留于300目筛上的样品,并用流动蒸馏水充分洗涤,冷冻干燥备用,得到高压热处理分离的Desi细胞(Pre-D)。在高压蒸煮条件下制备的细胞样品的得率大约为55%。
将70 ℃条件下分离的鹰嘴豆细胞(5 g)与蒸馏水(1:10,w/v)混合,置于80 ℃及100 ℃水浴锅中,无搅拌加热30 min,冷冻干燥备用。70D-80:70 ℃热分离Desi鹰嘴豆细胞进行80 ℃热处理;70D-100:70 ℃热分离Desi鹰嘴豆细胞进行100 ℃热处理。
1.2.2 光学显微镜(Light microscope,LM)观察
将Desi鹰嘴豆细胞粉末样品与蒸馏水混合制备成0.6wt%的悬浮液,取小量样品置于载玻片,盖上盖玻片后置于载物台,调节亮度在普通光及偏振光下观察样品形貌并拍摄,放大倍数为200×。
1.2.3 X-射线衍射分析(X-ray diffractometry,XRD)
参照王苗苗等[22]的方法,使用D8 Advance型X-射线衍射仪分析细胞样品的晶体结构变化。衍射电压30 kV,电流40 mA,Cu Kα辐射(λ=0.154 nm),测量角度2θ=4~40°,步长间隔设置0.005°,扫描速率为2°/min。根据Lopez-Rubio等[23]的方法,通过Peakfit软件对5.6°、15.0°、17.0°、19.0°、21.6°、22.5°处2θ的衍射峰进行分峰,分别计算A型结晶度与B型结晶度,相对结晶度计算为A型结晶度与B型结晶度之和。
1.2.4 热力学性质分析(Differential scanning calorimeter,DSC)
参照Li等[20]的方法,使用DSC 200 F3型差示扫描量热仪分析样品的热力学性质。准确称取适量细胞样品和纯淀粉样品(约4 mg,以淀粉干基计算)置于铝盒中,加入去离子水(约12 mg)配制成悬浊液,密封后室温条件平衡12 h。以空的铝盒作为对照样,以10 ℃/ min 的速率升温,扫描温度为20~120 ℃。以内置软件NETZSCH Proteus Thermal Analysis分别计算起始糊化温度(To)、峰值糊化温度(Tp)、终止糊化温度(Tc)及热力学焓值(ΔH)变化。
1.2.5 傅里叶变换红外光谱(Fourier transform infrared spectrometer,FTIR)
参照李萍[24]的方法,使用具有金刚石晶体衰减的全反射单反射单元,将样品置于VERTEX 70型红外光谱仪进行扫描。室温条件下以4 cm−1的分辨率在4000~400 cm−1的范围内扫描32次。甲酯化程度计算为1745与997 cm−1处波数的比值,游离羧基计算为1630与997 cm−1处波数的比值。
1.2.6 体外消化动力学
根据Xiong等[11]报道的方法稍作修改后对样品进行体外消化测定。称取Desi细胞样品(100 mg,以淀粉干基计算)置于50 mL离心管,向内加入15 mL磷酸盐缓冲液,37 ℃水浴10 min后加入猪胰酶溶液(2mg/g淀粉干基),手动混合均匀并开始计时,在不同反应时间点(0~300 min)分别取出100 μL的酶解液置于冰浴的Na2CO3 溶液(0.5 mol/L,300 μL)中终止酶解,于2200×g下离心5 min。使用4-羟基苯甲酰肼(PAHBAH)试剂测定上清液中淀粉水解释放的麦芽糖总当量,并计算淀粉的水解率,计算公式为:
淀粉水解率(%)=上清液中麦芽糖的总当量×0.9淀粉干基×100 (1) 使用一级动力学方程拟合淀粉水解曲线,获取淀粉的消化速率常数。
C=1−e−kt (2) 公式中:t,消化反应时间(min);C,在固定消化反应时间(t)的消化程度;k,消化速率常数(min−1)。
1.3 数据分析
实验数据至少重复3次,数据以均值±标准差(Means±SD)表示,使用SPSS26、Excel 2019、OriginPro 9.0等软件对数据进行统计分析及制图,显著性水平设定为P<0.05。
2. 结果与分析
2.1 不同热处理下Desi鹰嘴豆细胞的形貌特征
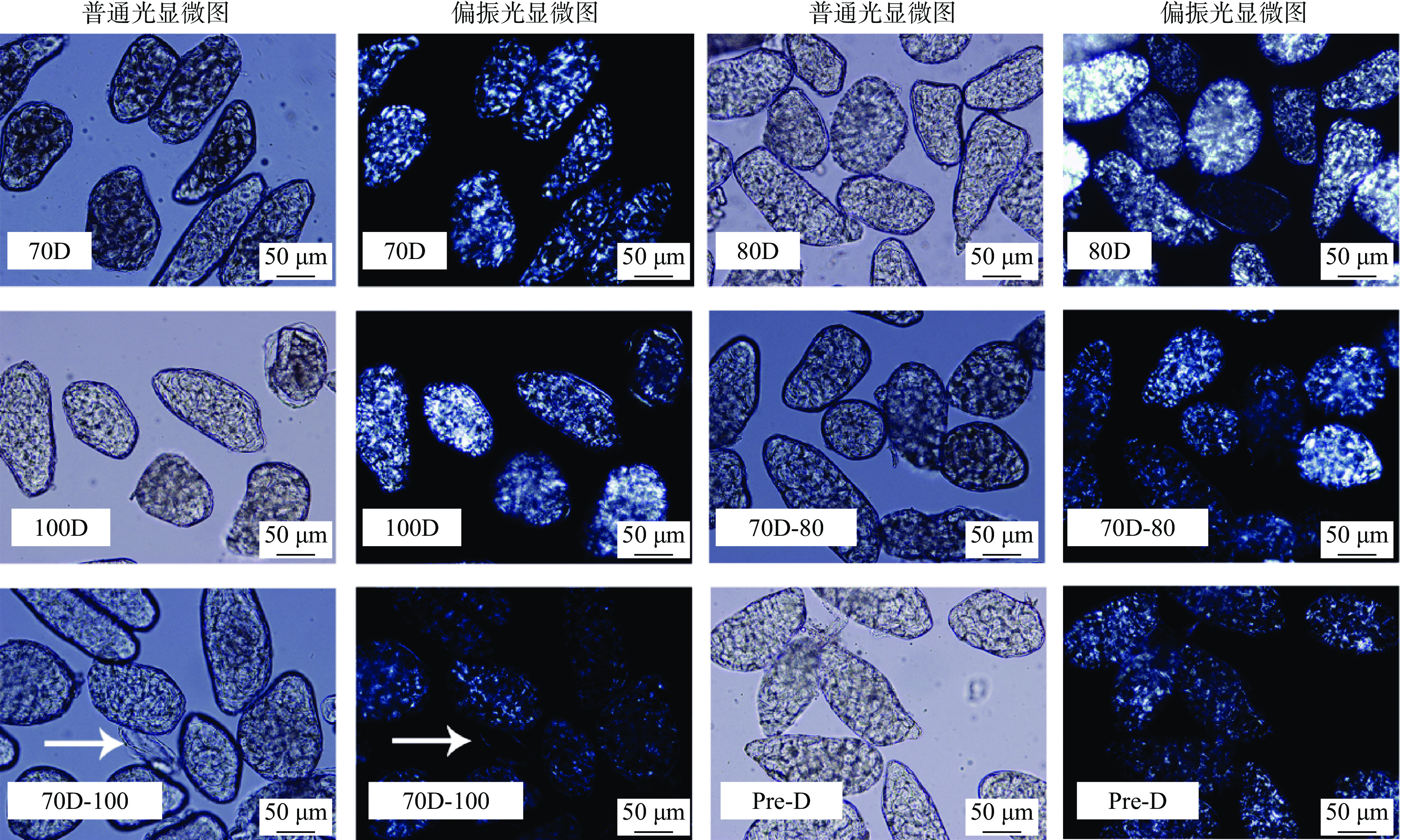
如图1所示,Desi鹰嘴豆细胞呈圆形或椭球型,尺寸为80~200 μm左右,与之前Kabuli鹰嘴豆的报道结果较一致[6,20],说明不同品种的鹰嘴豆细胞形态差异不大。热处理下70 ℃(70D)、80 ℃(70D)及100 ℃(100D)分离的Desi鹰嘴豆细胞大部分形态完整,淀粉包裹在细胞壁内,显微镜下可以观察到明显的“偏光十字”,这与之前有关Kabuli鹰嘴豆细胞的研究结果有一定的差异[20],100 ℃分离的Kabuli鹰嘴豆细胞的“偏光十字”现象已明显减弱。将样品进一步加热后,70D-80样品无显著变化,70D-100样品的细胞壁出现部分破裂,部分胞内组分溢出细胞外(70D-100箭头所示)。胞内淀粉颗粒的偏光十字相对减弱,溢出细胞外的颗粒无明显偏光十字(70D-100箭头所示),表明淀粉颗粒糊化程度增加。值得注意的是,高压热处理分离的Desi细胞仍然存在明显的双折射现象(Pre-D)。可见Desi鹰嘴豆细胞对温度的抵抗能力相对较强,这可能归因于Desi鹰嘴豆的纤维含量较高,从而在热处理条件下,对细胞内的淀粉有一定的保护作用[9]。
![]() 图 1 不同热处理Desi鹰嘴豆细胞的普通光及偏振光学显微图注:70D:70 ℃热分离Desi鹰嘴豆细胞;80D:80 ℃热分离Desi鹰嘴豆细胞;100D: 100 ℃热分离Desi鹰嘴豆细胞;70D-80: 70 ℃热分离Desi鹰嘴豆细胞进行80 ℃热处理;70D-100: 70 ℃热分离Desi鹰嘴豆细胞进行100 ℃热处理;Pre-D:高压加热分离Desi鹰嘴豆细胞;标尺(50 μm)。Figure 1. Light and polarized light microscopic images of chickpea cells (Desi) treated with different heat process
图 1 不同热处理Desi鹰嘴豆细胞的普通光及偏振光学显微图注:70D:70 ℃热分离Desi鹰嘴豆细胞;80D:80 ℃热分离Desi鹰嘴豆细胞;100D: 100 ℃热分离Desi鹰嘴豆细胞;70D-80: 70 ℃热分离Desi鹰嘴豆细胞进行80 ℃热处理;70D-100: 70 ℃热分离Desi鹰嘴豆细胞进行100 ℃热处理;Pre-D:高压加热分离Desi鹰嘴豆细胞;标尺(50 μm)。Figure 1. Light and polarized light microscopic images of chickpea cells (Desi) treated with different heat process2.2 热处理后Desi鹰嘴豆细胞内淀粉的晶体结构变化
X-射线衍射用于研究淀粉分子结晶度的类型和长程结构。A型结构在约15°和23°处2θ呈现强烈衍射峰,17°和18°处2θ显示出未分离的双衍射峰。B型结构在17°附近2θ有强衍射峰,15°、20°和22°附近2θ有弱衍射峰,约5.6°处2θ有特征衍射峰[25],而C型包含A和B型两种晶型,且根据A型和B型峰型的比例,又可进一步分为Ca(接近A型)、Cb(接近B型)和Cc(典型C型)三类[26]。不同热处理Desi鹰嘴豆细胞的X-射线衍射图及分峰相对结晶度如图2和表1所示。70 ℃分离的Desi鹰嘴豆细胞内淀粉颗粒表现出C型结晶(图2),与之前的报道相一致[6]。随着温度的升高,淀粉的峰型不变,相对结晶度从11.66%(70D)降低至9.48%(100D),且A型和B型的结晶度均有所降低。100 ℃分离的细胞(100D)内的淀粉仍保留一定的晶体结构,与光学显微镜的结果一致(图1)。与70D相比,进一步加热的细胞(70D-80,70D-100)内淀粉的C型结晶峰形更弱,结晶度也相应降低。此外,相较于70D-80样品而言,更高温度处理的样品(70D-100)A型结晶峰明显降低,B型结晶峰则无明显变化。经高压加热处理分离的细胞(Pre-D)内的淀粉呈现明显的Cb型结晶,且结晶度(8.55%)相较于70D-100有明显回升,这可能归因于更高温度或更高强度的热处理,使得淀粉糊化程度更高,且在冷却过程发生了部分淀粉回生现象,被破坏的直链和支链分子重新组合,形成有序的晶体结构[27-30]。
表 1 不同热处理Desi鹰嘴豆细胞中淀粉的相对结晶度Table 1. Relative crystallinity of starches in chickpea cells (Desi) treated with different heat processes2.3 热处理后Desi鹰嘴豆细胞内淀粉的热力学性质
不同热处理Desi鹰嘴豆细胞样品及纯淀粉颗粒的热力学温度(To、Tp、Tc)和焓值变化(ΔH)如表2所示。70~80 ℃处理的细胞内淀粉的热力学温度(To、Tp、Tc)均高于纯淀粉样品 (DS),表明其细胞样品中淀粉微晶解螺旋的难度更高,细胞组织结构阻碍了淀粉的糊化[22]。70~100 ℃处理的细胞样品中,70D呈现最低的糊化温度和最高的焓值变化,80 ℃处理的细胞中(80D,70D-80)淀粉糊化温度则有所升高,焓值有所降低,原因可能是更高温度的热处理破坏了淀粉中不稳定的微晶结构,余下更稳定的微晶结构的糊化需要更高的熔化温度[31],同时热处理破坏了淀粉分子的双螺旋结构,所以焓值(ΔH)降低,该结果与降低的结晶度一致(表1)。然而值得注意的是,100 ℃处理的样品(100D,70D-100)虽然未检测到明显的糊化温度及焓值变化(ΔH<1 J/g)(表2),但二者依然存在一定的相对结晶度(表1),这可能归因于焓值(ΔH)主要与淀粉分子熔融的双螺旋数量相关[32]。淀粉糊化是一种吸热转变,对应于支链淀粉双螺旋从半结晶解离结构为无定形构象。焓值的变化更主要的反映双螺旋的解旋,而非结晶结构的变化[33]。高压加热处理的细胞(Pre-D)内淀粉呈现两个吸热峰,峰I的热力学温度(To、Tp、Tc)显著低于其他细胞样品(P<0.05),峰II的热力学温度显著高于其他细胞样品(P<0.05)。峰I的形成可能归因于高压作用下,更多的水分子进入细胞内部,部分糊化的淀粉颗粒发生了回生现象[30]。此外,在压力的作用下,淀粉分子内部可能发生分子重组,使得部分稳定微晶结构的破坏需要更高的糊化温度。
表 2 不同热处理Desi鹰嘴豆细胞中淀粉的热力学性质Table 2. Thermal properties of starches in chickpea cells (Desi) treated with different heat processes样品 峰Ⅰ 峰Ⅱ To(℃) Tp(℃) Tc(℃) ΔH(J/g) To(℃) Tp(℃) Tc(℃) ΔH(J/g) 70D 74.77±0.06b 82.60±0.70b 97.90±2.26a 3.15±0.12b − − − − 80D 82.85±0.07a 90.50±0.00a 99.10±0.00a 1.24±0.04d − − − − 100D − − − − − − − − 70D-80 83.95±0.07a 89.60±0.00a 96.65±0.92a 1.09±0.02d − − − − 70D-100 − − − − − − − − Pre-D 49.55±1.34d 57.80±0.71d 68.85±1.20c 2.34±0.03c 104.4±0.20 110.1±0.03 112.0±0.72 2.04±0.03 DS 62.40±0.10c 68.97±0.15c 76.53±0.31b 9.45±0.25a − − − − 注:“−”表示本样品中未检测到变化。 2.4 不同热处理Desi鹰嘴豆细胞壁结构变化
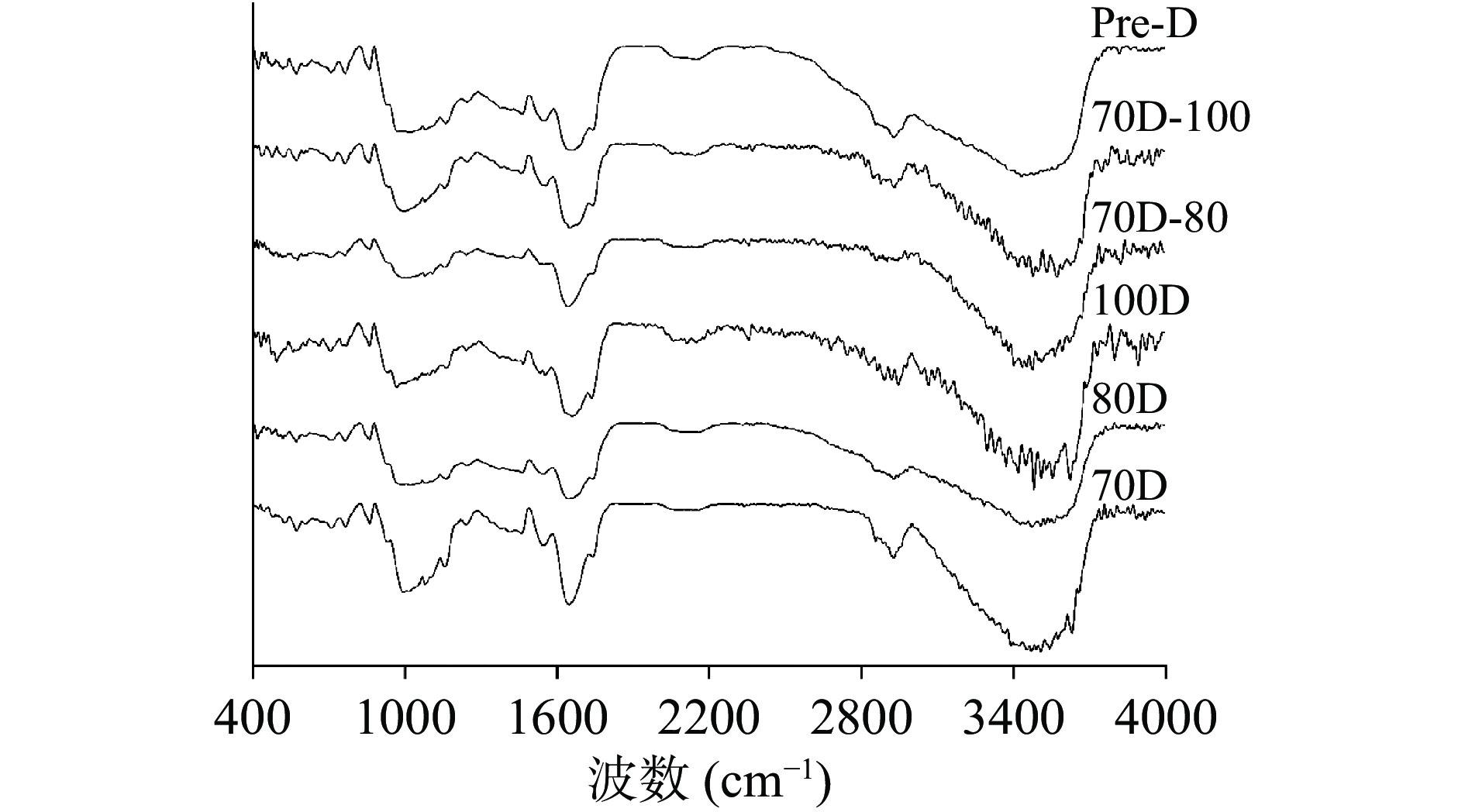
不同热处理Desi鹰嘴豆细胞样品的红外光谱及甲酯化程度如图3和表3所示,其甲酯化程度变化顺序为:70D(1.23)>70D-100(1.04)≈70D-80(1.03)≈80D(1.03)>Pre-D(1.01)>100D(0.93)。果胶是细胞壁多糖的主要成分之一,热处理可以通过去除二价阳离子,水解或β消除反应导致果胶分解,从而促使组织结构软化,细胞壁孔隙率增加[34],进而影响营养素的消化利用。由于果胶中半乳糖醛酸及其甲酯中原子基团的特定振动模式可引起吸收带的差异[35],因此红外线光谱(FTIR)可以根据其甲酯化程度(Methyl esterification, MED)来表征果胶的相关结构。1760~1745 cm−1处的酯羰基和1640~1620cm−1处的游离羧酸酯基团对于鉴定果胶中的结构和含量具有重要意义。由表3的结果可以看出,70 ℃分离的细胞样品(70D)的甲酯化程度值最高(1.23),表明细胞壁中的果胶解聚可能最少。并且随着处理温度的升高,细胞结构的甲酯化程度有所降低,说明细胞壁中果胶的解聚会随着处理温度的升高逐渐增加。然而,高压加热处理细胞样品(Pre-D)的甲酯化程度显著高于100 ℃分离的细胞样品(100D)(P<0.05),可能的原因是高压处理一定程度上影响了果胶中的β-消除反应,从而影响细胞壁组织的结构完整性变化[36]。
表 3 不同热处理Desi鹰嘴豆细胞的结构参数Table 3. Fourier transform infrared spectra parameters of chickpea cells (Desi) treated with different heat process样品 甲酯化程度 游离羧基 70D 1.23±0.01a 0.96±0.01a 80D 1.03±0.01b 0.94±0.01ab 100D 0.93±0.02c 0.83±0.01d 70D-80 1.03±0.03b 0.90±0.03c 70D-100 1.04±0.01b 0.91±0.03c Pre-D 1.01±0.01b 0.89±0.02c 2.5 体外消化动力学
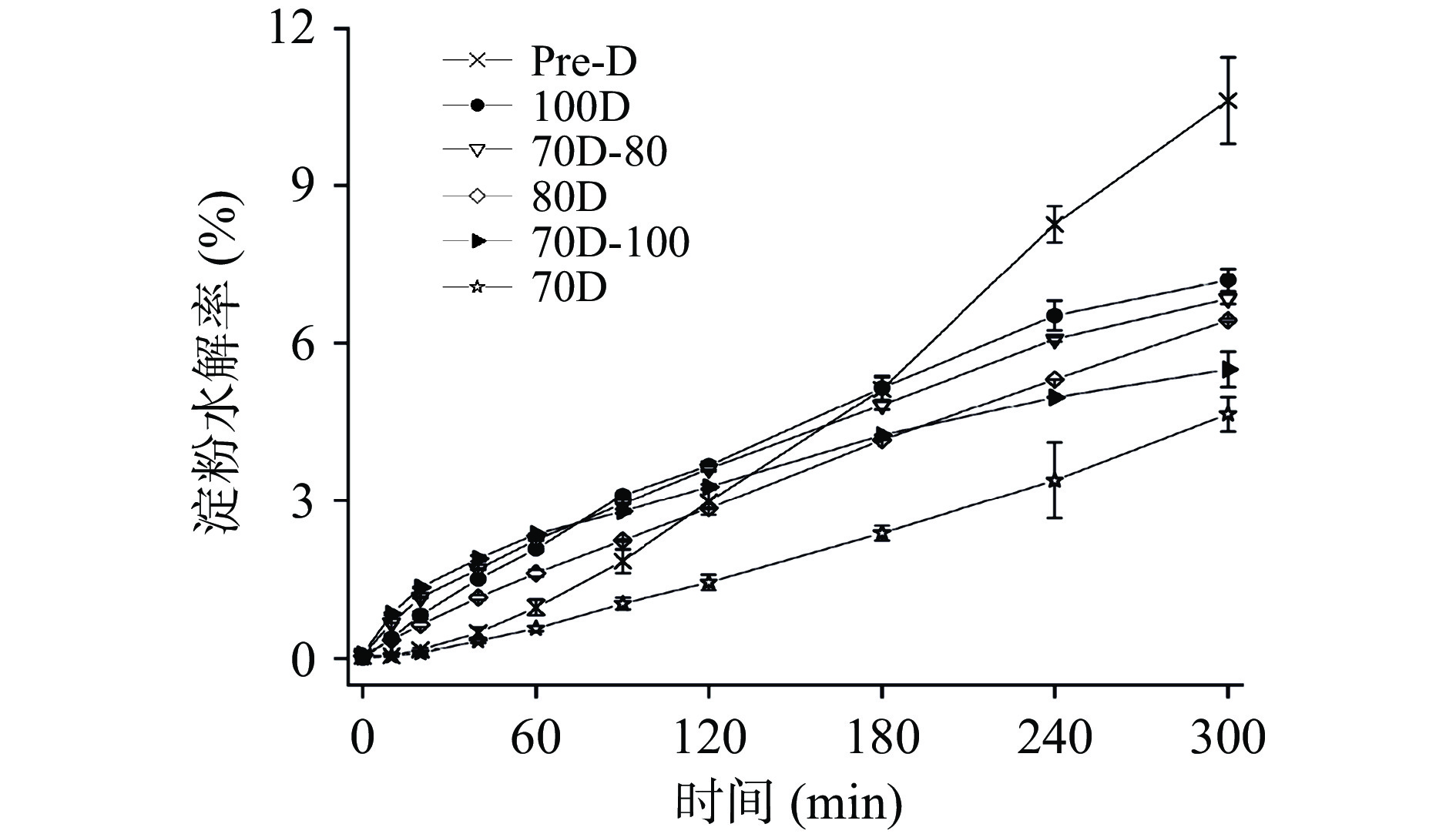
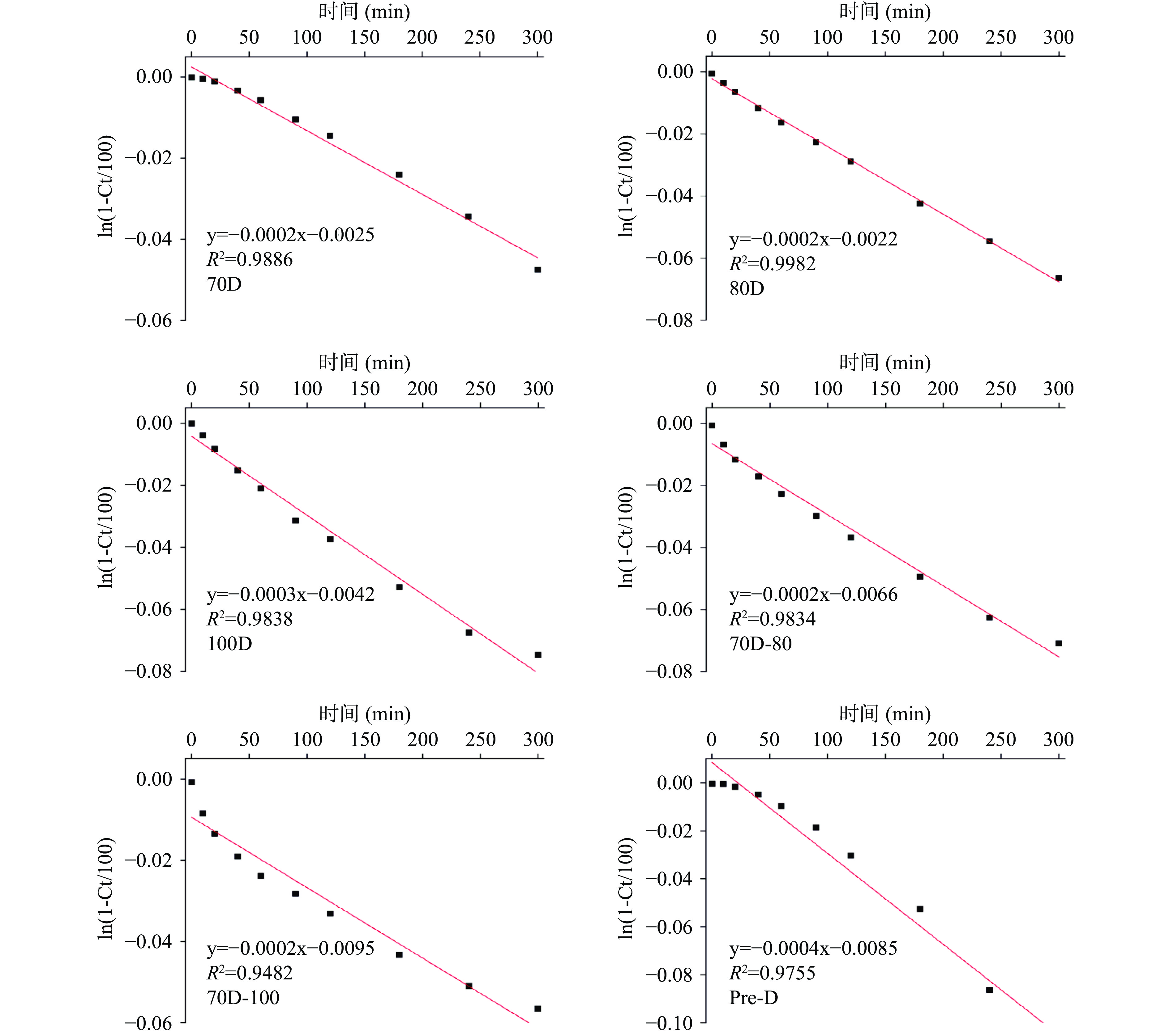
不同热处理的Desi鹰嘴豆细胞内淀粉的消化速率如表4所示,由表可知,消化速率的变化范围为0.0002~0.0004 min−1,其消化程度变化遵循以下顺序:Pre-D(0.0004 min−1,11.35%)>100D(0.0003 min−1,8.62%)>70D-100(0.0002 min−1,5.90%)≈70D-80(0.0002 min−1,5.89%)≈80D(0.0002 min−1,5.87%)>70D(0.0002 min−1,5.83%)。体外消化实验过程通过定时摇晃离心管以达到样品混合均匀的目的,避免搅拌过程对细胞壁的破坏。淀粉类食物的体外消化速率常数的拟合与选择的动力学模型相关,通常将淀粉基食品的消化过程表现为简单的衰减曲线,具有明显的一级动力学特征,其消化速率及消化程度可简单直接地描述体外消化过程中底物的降解规律。因为斜率对数的消化动力学模型(LOS)与本研究中的淀粉的消化曲线无法完全拟合,本研究中使用了Goni一阶动力学模型[37]来计算细胞体系下淀粉的消化速率常数。图 4为不同热处理 Desi 鹰嘴豆细胞中淀粉的消化曲线,图5为图4对应的一级动力学拟合图。结果显示,不同热处理的Desi鹰嘴豆细胞内淀粉的水解程度非常低,即使是Pre-D样品经300 min后淀粉水解程度仍低于15%(图4),与之前报道的Kabuli鹰嘴豆的水解程度有所差异[20]。一方面可能归因于品种之间的差异,Desi鹰嘴豆的组织结构相对坚硬和致密,其分离的细胞结构在热处理下的抵抗能力相对较强(由图1显微结果也可以看出)。另一方面完整的细胞壁结构可以限制胞内淀粉糊化,保留一定的晶体结构(从图1光学显微镜和表1相对结晶度可以看出),从而降低淀粉的消化。然而,与70D细胞样品相比,高压处理的细胞样品Pre-D的相对结晶度降低了约3%,而消化程度却升高了约6%;与100D细胞样品相比,Pre-D的相对结晶度无明显差异,但消化速率和消化程度却显著高于100D的样品(P<0.05),说明Desi鹰嘴豆细胞内淀粉结晶度的降低可能不是胞内淀粉水解程度的主要决定因素。研究发现Desi鹰嘴豆细胞内淀粉的消化速率变化趋势和甲酯化程度的变化顺序较为一致,细胞壁结构的甲酯化程度越低,样品的消化速率和消化程度越高,因此细胞壁结构的完整性变化可能更大程度地影响酶对细胞样品中淀粉底物作用的效率[38-39],从而影响鹰嘴豆组织结构中淀粉的消化特性[24]。
表 4 不同热处理Desi鹰嘴豆细胞中淀粉的消化速率及消化程度Table 4. Digestion rate and extent of starches in chickpea cells (Desi) treated with different heat processes样品 消化速率(k, min−1) 消化程度(C300, %) 70D 0.0002 5.83±0.01d 80D 0.0002 5.87±0.01c 100D 0.0003 8.62±0.02b 70D-80 0.0002 5.89±0.03c 70D-100 0.0002 5.90±0.01c Pre-D 0.0004 11.35±0.01a 注:C300代表300 min淀粉的消化程度。 3. 结论
本研究探讨了不同热处理下Desi鹰嘴豆细胞内淀粉结构及体外消化特性的变化规律。结果显示,不同热处理后Desi鹰嘴豆细胞内淀粉的结晶度均有所降低,但未完全糊化,保留了一定的晶体结构(>5%)。随着处理温度的升高,淀粉的糊化温度升高,焓值降低。不同的热处理可能引起淀粉颗粒内部晶体结构的差异性重组。红外光谱和体外消化动力学结果显示,细胞结构甲酯化程度低的样品,其消化速率和消化程度相对较高,表明热处理后Desi鹰嘴豆细胞内淀粉的晶体结构变化不是影响其消化速率的决定性因素,由热加工引起的细胞壁结构完整性变化可能更大程度地影响细胞内含淀粉的消化特性。因此,通过采用不同的加工方式来调节鹰嘴豆食物的组织结构变化,可以一定程度上调控食物基质中淀粉的消化特性,从而开发不同人群适用的鹰嘴豆功能性食品。此方面的研究还需要进一步的探索。
-
图 1 不同热处理Desi鹰嘴豆细胞的普通光及偏振光学显微图
注:70D:70 ℃热分离Desi鹰嘴豆细胞;80D:80 ℃热分离Desi鹰嘴豆细胞;100D: 100 ℃热分离Desi鹰嘴豆细胞;70D-80: 70 ℃热分离Desi鹰嘴豆细胞进行80 ℃热处理;70D-100: 70 ℃热分离Desi鹰嘴豆细胞进行100 ℃热处理;Pre-D:高压加热分离Desi鹰嘴豆细胞;标尺(50 μm)。
Figure 1. Light and polarized light microscopic images of chickpea cells (Desi) treated with different heat process
表 1 不同热处理Desi鹰嘴豆细胞中淀粉的相对结晶度
Table 1 Relative crystallinity of starches in chickpea cells (Desi) treated with different heat processes
表 2 不同热处理Desi鹰嘴豆细胞中淀粉的热力学性质
Table 2 Thermal properties of starches in chickpea cells (Desi) treated with different heat processes
样品 峰Ⅰ 峰Ⅱ To(℃) Tp(℃) Tc(℃) ΔH(J/g) To(℃) Tp(℃) Tc(℃) ΔH(J/g) 70D 74.77±0.06b 82.60±0.70b 97.90±2.26a 3.15±0.12b − − − − 80D 82.85±0.07a 90.50±0.00a 99.10±0.00a 1.24±0.04d − − − − 100D − − − − − − − − 70D-80 83.95±0.07a 89.60±0.00a 96.65±0.92a 1.09±0.02d − − − − 70D-100 − − − − − − − − Pre-D 49.55±1.34d 57.80±0.71d 68.85±1.20c 2.34±0.03c 104.4±0.20 110.1±0.03 112.0±0.72 2.04±0.03 DS 62.40±0.10c 68.97±0.15c 76.53±0.31b 9.45±0.25a − − − − 注:“−”表示本样品中未检测到变化。 表 3 不同热处理Desi鹰嘴豆细胞的结构参数
Table 3 Fourier transform infrared spectra parameters of chickpea cells (Desi) treated with different heat process
样品 甲酯化程度 游离羧基 70D 1.23±0.01a 0.96±0.01a 80D 1.03±0.01b 0.94±0.01ab 100D 0.93±0.02c 0.83±0.01d 70D-80 1.03±0.03b 0.90±0.03c 70D-100 1.04±0.01b 0.91±0.03c Pre-D 1.01±0.01b 0.89±0.02c 表 4 不同热处理Desi鹰嘴豆细胞中淀粉的消化速率及消化程度
Table 4 Digestion rate and extent of starches in chickpea cells (Desi) treated with different heat processes
样品 消化速率(k, min−1) 消化程度(C300, %) 70D 0.0002 5.83±0.01d 80D 0.0002 5.87±0.01c 100D 0.0003 8.62±0.02b 70D-80 0.0002 5.89±0.03c 70D-100 0.0002 5.90±0.01c Pre-D 0.0004 11.35±0.01a 注:C300代表300 min淀粉的消化程度。 -
[1] SUN H, SAEEDI P, KARURANGA S, et al. IDF diabetes atlas: Global, regional and country-level diabetes prevalence estimates for 2021 and projections for 2045[J]. Diabetes Research and Clinical Practice,2022,183:109119. doi: 10.1016/j.diabres.2021.109119
[2] LEHMANN U, ROBIN F. Slowly digestible starch–its structure and health implications: a review[J]. Trends in Food Science & Technology,2007,18(7):346−355.
[3] RIZKALLA S W, BELLISLE F, SLAMA G. Health benefits of low glycaemic index foods, such as pulses, in diabetic patients and healthy individuals[J]. British Journal of Nutrition,2002,88(S3):255−262. doi: 10.1079/BJN2002715
[4] 马宏, 赵雅霞, 杨美娟, 等. 浅析鹰嘴豆粉的营养功能性及其应用[J]. 农产品加工,2021(14):17−19, 21. [MA H, ZHAO Y X, YANG M J, et al. The analysis of the nutrition function and application of chickpea flour[J]. Farm Products Processing,2021(14):17−19, 21. doi: 10.16693/j.cnki.1671-9646(X).2021.07.034 [5] NAYYAR H, KAUR S, SINGH S, et al. Differential sensitivity of Desi (small-seeded) and Kabuli (large-seeded) chickpea genotypes to water stress during seed filling: effects on accumulation of seed reserves and yield[J]. Journal of the Science of Food and Agriculture,2006,86(13):2076−2082. doi: 10.1002/jsfa.2574
[6] 缪铭, 江波, 张涛. Kabuli和Desi品种鹰嘴豆淀粉结构及功能性质[J]. 吉林大学学报 (工学版),2008,38(6):1495−1500. [MIAO M, JIANG B, ZHANG T. Structure and functional properties of chickpea starches of Kabuli and Desi varieties[J]. Journal of Jilin University (Engineering and Technology Edition),2008,38(6):1495−1500. [7] KAUR R, PRASAD K. Technological, processing and nutritional aspects of chickpea (Cicer arietinum)-A review[J]. Trends in Food Science & Technology,2021,109:448−463.
[8] 熊玮彦. 蒸煮和湿热处理对杂豆细胞内淀粉结构及体外消化性的影响机制研究[D]. 广州: 华南理工大学, 2018. XIONG W Y. Mechanism for the structure features and digestion properties of starches in intact legume cells influenced by cooking and heat-moisture process[D]. Guangzhou: South China University of Technology, 2018.
[9] RAZA H. 不同加工方法对鹰嘴豆理化及功能特性的影响及其在酸奶中的应用[D]. 无锡: 江南大学, 2019. RAZA H. Physico-chemical and functional characterization of chickpea (Cicer arietinum L. ) using different processing methods and its utilization in yogurt[D]. Wuxi: Jiangnan University, 2019.
[10] GUO P, YU J, WANG S, et al. Insights into the starch gelatinization behavior inside intact cotyledon cells[J]. International Journal of Biological Macromolecules,2020,163:541−549. doi: 10.1016/j.ijbiomac.2020.06.238
[11] XIONG W, ZHANG B, DHITAL S, et al. Structural features and starch digestion properties of intact pulse cotyledon cells modified by heat-moisture treatment[J]. Journal of Functional Foods,2019,61:103500. doi: 10.1016/j.jff.2019.103500
[12] PäLCHEN K, BREDIE W L, DORINE D, et al. Effect of processing and microstructural properties of chickpea-flours on in vitro digestion and appetite sensations[J]. Food Research International,2022:111245.
[13] DHITAL S, BHATTARAI R R, GORHAM J, et al. Intactness of cell wall structure controls the in vitro digestion of starch in legumes[J]. Food & Function,2016,7(3):1367−1379.
[14] BHATTARAI R R, DHITAL S, WU P, et al. Digestion of isolated legume cells in a stomach-duodenum model: Three mechanisms limit starch and protein hydrolysis[J]. Food & Function,2017,8(7):2573−2582.
[15] AGUILERA J M, CADOCHE L, LóPEZ C, et al. Microstructural changes of potato cells and starch granules heated in oil[J]. Food Research International,2001,34(10):939−947. doi: 10.1016/S0963-9969(01)00118-1
[16] WüRSCH P, DEL VEDOVO S, KOELLREUTTER B. Cell structure and starch nature as key determinants of the digestion rate of starch in legume[J]. The American Journal of Clinical Nutrition,1986,43(1):25−29. doi: 10.1093/ajcn/43.1.25
[17] KAUR M, SANDHU K S, AHLAWAT R, et al. In vitro starch digestibility, pasting and textural properties of mung bean: Effect of different processing methods[J]. Journal of Food Science and Technology,2015,52(3):1642−1648. doi: 10.1007/s13197-013-1136-2
[18] KON S, WAGNER J, BECKER R, et al. Optimizing nutrient availability of legume food products[J]. Journal of Food Science,1971,36(4):636−639. doi: 10.1111/j.1365-2621.1971.tb15149.x
[19] ROVALINO-CORDOVA A M, FOGLIANO V, CAPUANO E. A closer look to cell structural barriers affecting starch digestibility in beans[J]. Carbohydr Polymers,2018,181:994−1002. doi: 10.1016/j.carbpol.2017.11.050
[20] LI P, ZHANG B, DHITAL S. Starch digestion in intact pulse cells depends on the processing induced permeability of cell walls[J]. Carbohydrate Polymers,2019,225:115204. doi: 10.1016/j.carbpol.2019.115204
[21] PALLARES A P, MIRANDA B A, TRUONG N Q A, et al. Process-induced cell wall permeability modulates the in vitro starch digestion kinetics of common bean cotyledon cells[J]. Food & Function,2018,9(12):6544−6554.
[22] 王苗苗, 丁丽, 张新, 等. 不同加工方式下芸豆子叶细胞内淀粉结构及体外消化特性的对比分析[J]. 现代食品科技,2021,37(1):101−110. [WANG M M, DING L, ZHANG X, et al. Comparative analysis of structural and in vitro digestion properties of starch in cotyledon cells of pinto bean processed by different methods[J]. Modern Food Science and Technology,2021,37(1):101−110. doi: 10.13982/j.mfst.1673-9078.2021.01.0123 [23] LOPEZ-RUBIO A, FLANAGAN B M, GILBERT E P, et al. A novel approach for calculating starch crystallinity and its correlation with double helix content: A combined XRD and NMR study[J]. Biopolymers,2008,89(9):761−768.
[24] 李萍. 杂豆细胞壁对胞内淀粉结构及消化性的影响机理研究[D]. 广州: 华南理工大学, 2019. LI P. Mechanistic study of the structural features and digestion properties of starches in intact pulse cells[D]. Guangzhou: South China University of Technology, 2019.
[25] ZOBEL H, YOUNG S, ROCCA L. Starch gelatinization: An X-ray diffraction study[J]. Cereal Chem,1988,65(6):443−446.
[26] SHAO Y, MAO L, GUAN W, et al. Physicochemical and structural properties of low-amylose Chinese yam (Dioscorea opposita Thunb.) starches[J]. International Journal of Biological Macromolecules,2020,164:427−433. doi: 10.1016/j.ijbiomac.2020.07.054
[27] WANG S, LI C, COPELAND L, et al. Starch retrogradation: A comprehensive review[J]. Comprehensive Reviews in Food Science and Food Safety,2015,14(5):568−585. doi: 10.1111/1541-4337.12143
[28] HOOVER R, HUGHES T, CHUNG H, et al. Composition, molecular structure, properties, and modification of pulse starches: A review[J]. Food Research International,2010,43(2):399−413. doi: 10.1016/j.foodres.2009.09.001
[29] HOOVER R. Composition, molecular structure, and physicochemical properties of tuber and root starches: A review[J]. Carbohydrate Polymers,2001,45(3):253−267. doi: 10.1016/S0144-8617(00)00260-5
[30] PRATIWI M, FARIDAH D N, LIOE H N. Structural changes to starch after acid hydrolysis, debranching, autoclaving-cooling cycles, and heat moisture treatment (HMT): A review[J]. Starch-Stä rke,2018,70(1−2):1700028.
[31] LI P, DHITAL S, FU X, et al. Starch digestion in intact pulse cotyledon cells depends on the extent of thermal treatment[J]. Food Chemistry,2020,315:126268. doi: 10.1016/j.foodchem.2020.126268
[32] DING L, HUANG Q, LI H, et al. Controlled gelatinization of potato parenchyma cells under excess water condition: Structural and in vitro digestion properties of starch[J]. Food & Function,2019,10(9):5312−5322.
[33] LI P, HE X, DHITAL S, et al. Structural and physicochemical properties of granular starches after treatment with debranching enzyme[J]. Carbohydrate Polymers,2017,169:351−356. doi: 10.1016/j.carbpol.2017.04.036
[34] WILLATS W G, ORFILA C, LIMBERG G, et al. Modulation of the degree and pattern of methyl-esterification of pectic homogalacturonan in plant cell walls: Implications for pectin methyl esterase action, matrix properties, and cell adhesion[J]. Journal of Biological Chemistry,2001,276(22):19404−19413. doi: 10.1074/jbc.M011242200
[35] MANRIQUE G D, LAJOLO F M. FT-IR spectroscopy as a tool for measuring degree of methyl esterification in pectins isolated from ripening papaya fruit[J]. Postharvest Biology and Technology,2002,25(1):99−107. doi: 10.1016/S0925-5214(01)00160-0
[36] DE ROECK A, SILA D N, DUVETTER T, et al. Effect of high pressure/high temperature processing on cell wall pectic substances in relation to firmness of carrot tissue[J]. Food Chemistry,2008,107(3):1225−1235. doi: 10.1016/j.foodchem.2007.09.076
[37] AL-RABADI G J, GILBERT R G, GIDLEY M J. Effect of particle size on kinetics of starch digestion in milled barley and sorghum grains by porcine alpha-amylase[J]. Journal of Cereal Science,2009,50(2):198−204. doi: 10.1016/j.jcs.2009.05.001
[38] ZHANG B, DHITAL S, GIDLEY M J. Densely packed matrices as rate determining features in starch hydrolysis[J]. Trends in Food Science & Technology,2015,43(1):18−31.
[39] XIONG W, ZHANG B, HUANG Q, et al. Variation in the rate and extent of starch digestion is not determined by the starch structural features of cooked whole pulses[J]. Food Hydrocolloids,2018,83:340−347. doi: 10.1016/j.foodhyd.2018.05.022







 下载:
下载:

 下载:
下载:



