Effects of Lactobacillus Fermentation on the Content and Composition of Black Rice Polyphenols
-
摘要: 以植物乳杆菌(Lactobacillus plantarum 115,LP)、嗜酸乳杆菌(Lactobacillus acidophilus 14,LA)、干酪乳杆菌(Lactobacillus casei GB,LC)、保加利亚乳杆菌(Lactobacillus bulgaricus 134,LB)、副干酪乳杆菌(Lactobacillus paracasei 37,LPC)和鼠李糖乳杆菌(Lactobacillus rhamnosus GG,LGG)为发酵菌种,研究乳杆菌发酵对黑米游离酚和结合酚的含量及组成的影响。结果表明,6株乳杆菌发酵均显著提高了黑米游离酚的含量,但不同乳杆菌发酵后提高的程度具有显著差异,其中提高最显著的是LB。不同乳杆菌发酵后黑米中9种游离态和结合态单体酚的含量变化存在显著差异,其中,6株乳杆菌发酵后黑米中游离态的香草酸和对羟基苯甲酸的含量均显著降低(P<0.05),LP菌株除外游离态咖啡酸的含量均显著提高(P<0.05),而6株乳杆菌发酵后结合态阿魏酸含量均显著降低(P<0.05)。该研究为黑米的高效利用和天然活性产品的开发提供参考。Abstract: With L. plantarum (Lactobacillus plantarum 115, LP), L. acidophilus (Lactobacillus acidophilus 14, LA), L. casei (Lactobacillus casei GB, LC), L. Bulgaria (Lactobacillus bulgaricus 134, LB), L. paracasei (Lactobacillus paracasei 37, LPC) and L. rhamnosus (Lactobacillus rhamnosus GG, LGG) as fermentation species, the effect of Lactobacillus fermentation on the content and composition of free phenol and bound phenol of black rice was studied. The results showed that all six strains of Lactobacillus fermentation significantly increased the content of black rice free phenol, but the degree of improvement after different Lactobacillus fermentation varied significantly, among which the most significant improvement was conducted by LB. There were significant differences between the contents of nine free and bound monomers in black rice after fermentation of Lactobacillus. The results also revealed that the contents of free vanillic acid and p-hydroxybenzoic acid were significantly reduced (P<0.05), simultaneously, the contents of free caffeic acid were significantly increased except LP (P<0.05), while bound ferulic acid were all significantly reduced (P<0.05) after fermentation by 6 strains of Lactobacillus. This study can be helpful to the efficient utilization of black rice and the development of naturally active products.
-
Keywords:
- Lactobacillus /
- black rice /
- free phenols /
- bound phenols
-
黑米是一种被誉为“世界米中之王”的珍贵稻米品种,其种皮中富集的花色苷使其呈现出棕色或黑色,我国有373个黑米类别,其中最有代表性的是阳县黑米,蛋白质含量9.56%~11.80%,植物脂肪含量2.37%~2.80%[1]。
近年来,黑米活性物质相关的研究证实了黑米中含有丰富的植物多酚,包括花色苷类、黄酮类和酚酸类等,研究表明黑米中植物多酚含量在2.3~4.8 mg/g之间,是植物多酚含量最高的稻米品种[2-3]。植物多酚以游离态和结合态两种形式存在,大部分游离酚在人体内可以直接被小肠内酯酶水解后被人体吸收[4],而结合酚不能直接被人体分解利用,需要被肠道微生物水解为小分子物质后,才有可能被人体吸收[5-6]。姚芳等[7]研究表明德氏乳杆菌发酵提高了大麦多酚提取液的抗氧化活性。张慧芸等[8]研究表明德氏乳杆菌(Lactobacillus delbrueckii)发酵提高了小米、燕麦、黑米和高粱米四种谷物的提取多酚含量。Huang等[9]研究表明微生物发酵显著影响酚类物质在肠道消化过程中的生物利用度。Dordevic等[10]研究发现,鼠李糖乳杆菌发酵能够促进荞麦、小麦胚芽、大麦和黑麦多酚的释放,使游离酚含量提高和抗氧化活性增强。目前乳杆菌发酵提高谷物活性的相关研究主要集中在发酵对乙醇提取的游离酚含量及抗氧化活性的影响等方面,且涉及的菌株较少,而不同乳杆菌发酵对多酚的影响间的差异性,以及乳杆菌发酵对谷物中游离态多酚和结合态多酚的含量及其单体酚组成的影响相关的研究鲜有报道。
本研究以谷物发酵常用的植物乳杆菌(Lactobacillus plantarum 115,LP)、嗜酸乳杆菌(Lactobacillus acidophilus 14,LA)、干酪乳杆菌(Lactobacillus casei GB,LC)、保加利亚乳杆菌(Lactobacillus bulgaricus 134,LB)、副干酪乳杆菌(Lactobacillus paracasei 37,LPC)和鼠李糖乳杆菌(Lactobacillus rhamnosus GG,LGG)为发酵菌种,以黑米为原料,研究不同乳杆菌发酵对游离态和结合态黑米多酚含量及其单体酚的组成及含量变化的影响,旨在为黑米的高效利用和开发黑米发酵产品提供研究基础。
1. 材料与方法
1.1 材料与仪器
洋县黑米粉 市售;植物乳杆菌(Lactobacillus plantarum 115,LP)、嗜酸乳杆菌(Lactobacillus acidophilus 14,LA)、干酪乳杆菌(Lactobacillus casei GB,LC)、保加利亚乳杆菌(Lactobacillus bulgaricus 134,LB)、副干酪乳杆菌(Lactobacillus paracasei 37,LPC)、鼠李糖乳杆菌(Lactobacillus rhamnosus GG,LGG) 华南理工大学食品科学与工程学院保存菌种;没食子酸、对羟基苯甲酸、儿茶酸、咖啡酸、阿魏酸、间香豆酸、槲皮素 标准品,麦克林试剂公司;原儿茶酸、香草酸、对香豆酸 标准品,纯度≥98%,德斯特生物技术有限公司;其他试剂均为国产分析纯。
SW-CJ-ECU超净工作台 苏州净化设备有限公司;LRH-70生化培养箱 上海恒科仪器有限公司;DGX-9243B-2干热灭菌器 上海福玛实验设备有限公司;SX-24L手提式高压蒸汽灭菌锅 上海申安医疗器械厂;TGL-16gR冷冻离心机 上海安亭科学仪器厂;紫外可见分光光度计 岛津仪器(苏州)有限公司;水浴振荡器 上海博迅医疗生物仪器股份有限公司;Ultimate 3000 UHPLC-Q Exactive液质联用仪 赛默飞世尔科技公司。
1.2 实验方法
1.2.1 菌种活化
菌粉按照1×107 CFU/mL接种于MRS液体培养基中,在37 ℃条件下培养活化12 h,得到活化菌液,在无菌环境下取样,测定活化菌液的活菌数[11]。
1.2.2 黑米粉发酵方法
将黑米粉在160 ℃下干热灭菌2 h,冷却后在无菌环境下将黑米粉与无菌水按黑米粉:水=1:3(m/m)的比例混合调成米浆。按照米浆体积加入初始活菌数为5×107 CFU/mL的活化菌液。称取1.2.1中制备的活化菌液,5000 r/min离心5 min去上清液,沉淀用1 mL无菌生理盐水重悬后接种到米浆中,置于37 ℃恒温培养箱中培养36 h[12]。另外,对照组不接种乳杆菌,其它处理相同。
1.2.3 黑米发酵粉的制备
发酵36 h后的黑米浆液在−60 ℃条件下冷冻干燥40 h后,磨碎过40目筛,密封后常温保存用于后续实验分析。
1.2.4 发酵黑米粉脱脂处理
取6株乳杆菌发酵后冻干的黑米粉,按照发酵黑米粉:石油醚=1:10(m/m)的比例添加到烧杯中,用保鲜膜封口后磁力搅拌30 min,过滤,滤渣重复上述操作一次,过滤后滤渣在37 ℃烘箱中烘干残留的石油醚溶剂,回收脱脂发酵黑米粉,磨碎过40目筛,装在封口袋中常温保存待测[13]。
1.2.5 多酚提取
1.2.5.1 游离酚的提取
称取1 g脱脂黑米粉,按照脱脂黑米粉:70%乙醇溶液=1:25(m/m)的比例,于37 ℃水浴,130 r/min振荡提取3 h,过滤,滤液即为游离酚提取液,密封避光,4 ℃冰箱保存待测[14-15]。
1.2.5.2 结合酚的提取
将提取游离态多酚过程中得到的滤渣放置于37 ℃烘箱中烘干20 h,取残渣0.5 g,加入20 mL 4 mol/L NaOH,在37 ℃,200 r/min条件下振荡2 h后得到水解液。之后用5 mol/L的浓盐酸溶液调节水解液的pH至4.5~5.5之间,将水解液在5000 r/min,4 ℃的条件下离心20 min,收集上清液,按照上清液:无水乙醇=2:1(w/w)的比例加入无水乙醇,振荡1 min,在5000 r/min,4 ℃的条件下离心15 min,收集上清液,得到结合酚提取液,密封避光,4 ℃冰箱保存待测[16]。
1.2.6 多酚含量的测定
多酚含量的测定采用福林酚试剂法,制备没食子酸标准曲线,方法如下:按照表1加入对应的50 μg/mL没食子酸标液、去离子水和稀释1倍的福林酚试剂后,混匀,反应5 min后加入4 mL 7.5%的Na2CO3溶液,摇匀后静置60 min,以1号管调零,测定反应液在765 nm的吸光值。以没食子酸浓度为横坐标,以吸光值为纵坐标,得到没食子酸标准曲线:y=0.0246x+0.0491,R2=0.9986。各样品多酚含量的测定结果以每g发酵脱脂黑米粉中含有的mg没食子酸当量表示(mg GAE/g DW)[17]。
表 1 没食子酸标曲加液表Table 1. Addition of gallic acid standard curve编号 1 2 3 4 5 6 没食子酸标液(mL) 0.0 0.2 0.4 0.6 0.8 1 去离子水(mL) 1.0 0.9 0.8 0.6 0.4 0 福林酚试剂(mL) 1.0 1.0 1.0 1.0 1.0 1.0 没食子酸含量(μg) 0.0 10 20 30 40 50 将提取的游离酚和结合酚提取液稀释5倍后用于多酚含量的测定,取1 mL稀释多酚提取液,加入1 mL稀释1倍的福林酚试剂,混匀,反应5 min后向反应体系中加入4 mL 7.5%的Na2CO3溶液,摇匀,室温下避光静置60 min后,测定反应液在765 nm的吸光值,代入没食子酸标准曲线计算含量。
1.2.7 多酚组成的测定
1.2.7.1 对照品及样品处理
用甲醇配制没食子酸、原儿茶酸、对羟基苯甲酸、香草酸、咖啡酸、反式对香豆酸、阿魏酸、和3-羟基肉桂酸8种酚酸,以及儿茶素和槲皮素2种黄酮,共10种目标物混合标准品,各目标物含量均为100 μg/mL,然后再用甲醇逐步稀释,配制系列混合标准品溶液,浓度分别为0.01、0.1、0.5、1、2.5 μg/mL,分别经0.22 μm微孔滤膜过滤后,直接进样LC-MS测试。样品经0.22 μm微孔滤膜过滤后,直接进样测试。
1.2.7.2 色谱条件
色谱系统:Waters e2695分离系统和Waters 2998 PDA紫外检测系统;色谱柱:Eclipse Plus C18 100 mm×4.6 mm,3.5 μm;进样量:5.0 μL;柱温:30 ℃;流动相:A:0.1%甲酸水溶液;B:乙腈;梯度洗脱条件见表2[18-19]。
表 2 洗脱梯度Table 2. Elution gradient时间(min) 流速(mL/min) A(%) B(%) 0 0.8 95 5 1 0.8 95 5 10 0.8 90 10 16 0.8 85 15 20 0.8 80 20 26 0.8 65 35 30 0.8 65 35 35 0.8 95 5 40 0.8 95 5 1.2.7.3 质谱条件
离子源:HESI;鞘气速率:负离子30 mL/min;辅助气速率:10 mL/min;喷雾电压:负离子2.8 kV;毛细管温度:300 ℃;S-lens:50%;扫描模式:全扫描;扫描范围:130~310 m/z,分辨率70000。
数据分析方法:通过目标物的负离子的提取离子流图来进行定量分析,根据系列混合标准品的积分结果绘制各目标物的标准曲线,再依据酚酸标准品的保留时间和光谱图确定样品中该酚酸的峰面积,利用外标法代入标准曲线求出样品中酚酸含量。
1.3 数据处理
设置3组平行实验,使用IBM SPSS Statistics 26进行方差分析和显著性检验,使用Origin 2021绘制图表。
2. 结果与分析
2.1 乳杆菌发酵对黑米游离酚及结合酚含量的影响
2.1.1 乳杆菌发酵对黑米游离酚含量的影响
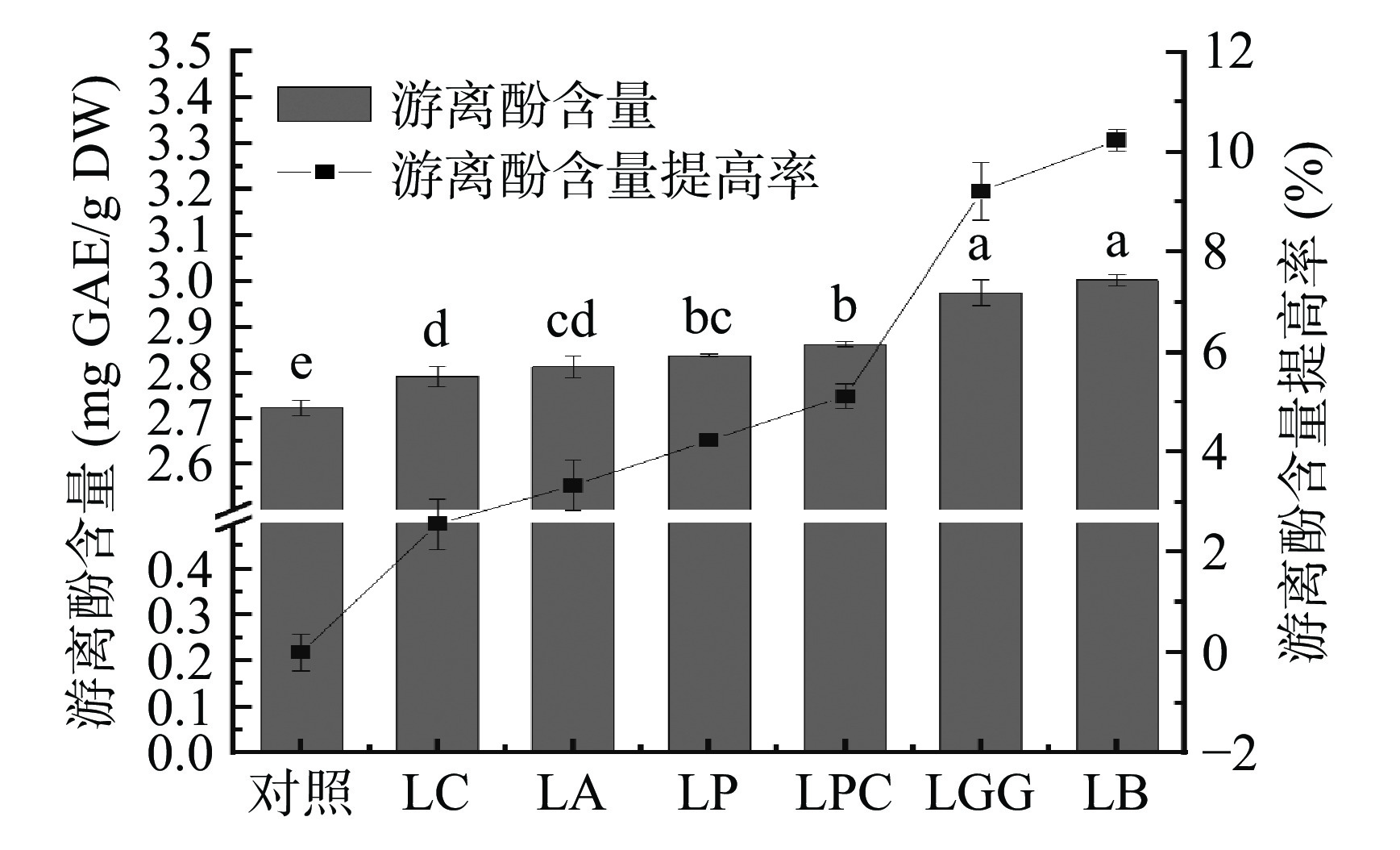
黑米中的酚类物质以游离态和结合态两种形态存在,不同形态的酚类化合物表现出不同的生物利用度和生物活性[20]。为了研究乳杆菌发酵对黑米多酚类物质的影响,本研究提取了发酵前后的游离酚和结合酚并测定其含量,结果见图1和图2。
如图1所示,与对照组相比,LC、LA、LP、LPC、LGG、LB这6株乳杆菌发酵黑米中的游离酚分别提高了2.6%、3.3%、4.2%、5.1%、9.2%、10.2%,其中LB发酵后黑米中游离酚含量提高最显著(P<0.05),其次是LGG。乳杆菌发酵提高游离酚含量可能是由于发酵过程产生的淀粉酶、纤维素酶等水解酶促进了游离酚的提取[21]。此外,乳杆菌发酵后游离酚含量的提高也可能与发酵过程中产生的单宁酶有关,单宁酶可以将复杂单宁降解为游离酚[22]。目前乳杆菌发酵对黑米多酚的影响相关的研究报道较少,其中李涛涛[23]研究发现乳杆菌发酵过程中游离酚含量与发酵体系中淀粉酶活力之间具有显著的正相关性,因此猜测不同乳杆菌发酵后黑米游离酚含量的提高程度可能与不同乳杆菌的产酶特性相关。
2.1.2 乳杆菌发酵对黑米结合酚含量的影响
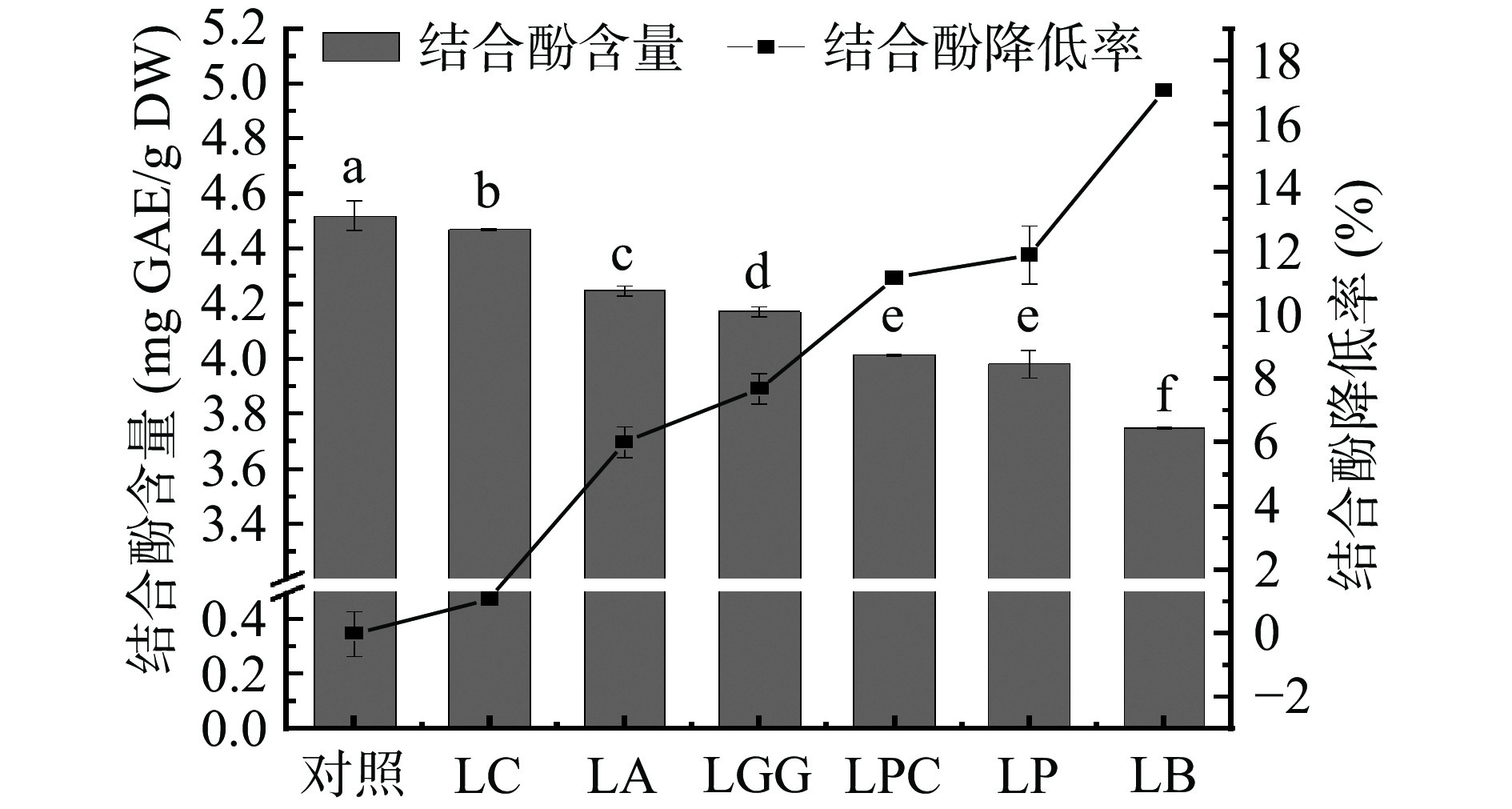
如图2所示,与未发酵黑米相比,LC、LA、LGG、LPC、LP、LB六株乳杆菌发酵黑米中的结合酚分别降低了1.8%、6.0%、7.7%、11.2%、11.9%、17.1%,与发酵黑米中游离酚含量之间呈现极显著负相关(相关系数r=0.785,P<0.01),表明乳杆菌在发酵过程中促进了结合酚向游离酚的转化。研究表明,结合酚与糖类、蛋白质或脂类等大分子以物理或化学作用相结合,乳杆菌在发酵过程中产生的α-半乳糖苷酶、β-葡萄糖苷酶等可以将结合酚水解成苷元,再进一步水解成游离酚[24],因此猜测不同乳杆菌发酵后结合酚含量降低程度不同可能与不同乳杆菌产α-半乳糖苷酶和β-葡萄糖苷酶等酶的特性有关。
2.1.3 乳杆菌发酵对黑米游离酚占总酚比例的影响
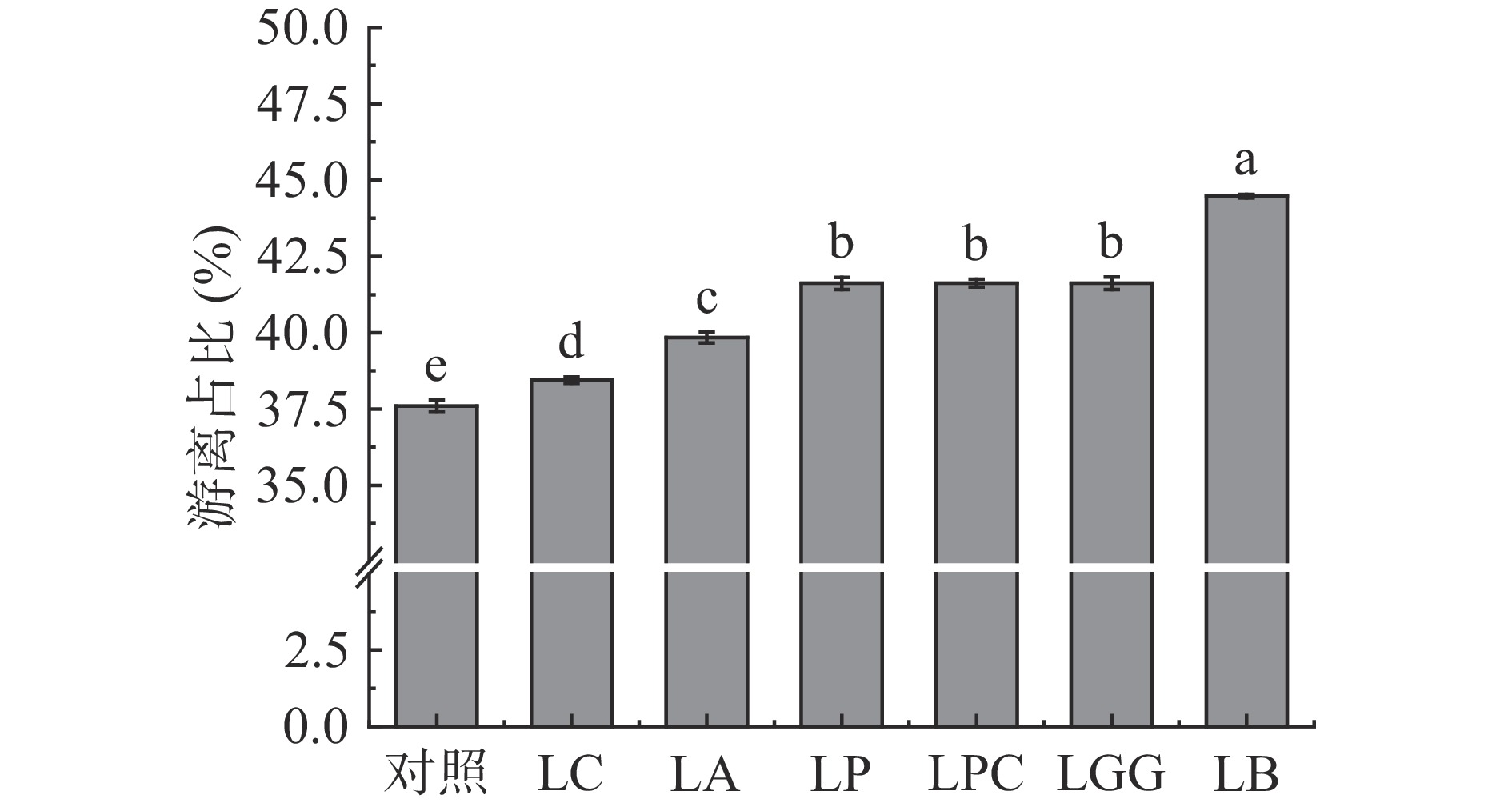
6株乳杆菌发酵后,黑米中游离酚占总酚的比例见图3。
由图3可知,LC、LA、LP、LPC、LGG、LB六株乳杆菌发酵后,黑米中游离酚占总酚的比例从37.6%分别上升到38.5%、39.8%、41.6%、41.6%、41.6%、44.5%,而结合酚占总酚比例从62.4%分别下降到61.5%、60.2%、58.4%、58.4%、58.4%、55.5%,表明乳杆菌发酵促进黑米结合酚向游离酚转化的过程,提高了黑米游离酚占总酚的比例。游离酚相对于结合酚,更容易被人体代谢吸收,具有更高的生物利用度[25-26],因此乳杆菌发酵提高了黑米多酚物质的生物利用度。
2.2 乳杆菌发酵对黑米游离酚和结合酚组成及含量的影响
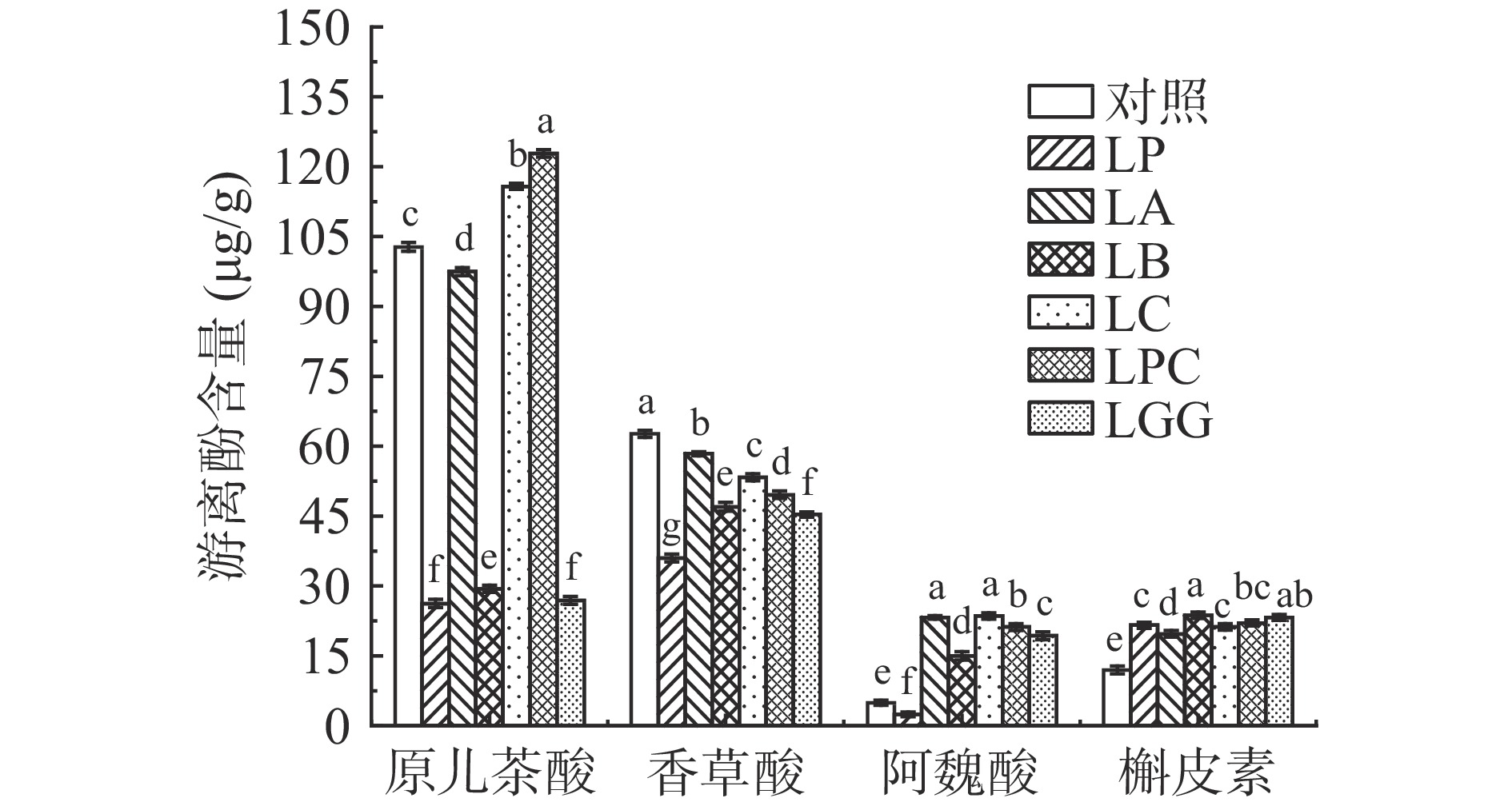
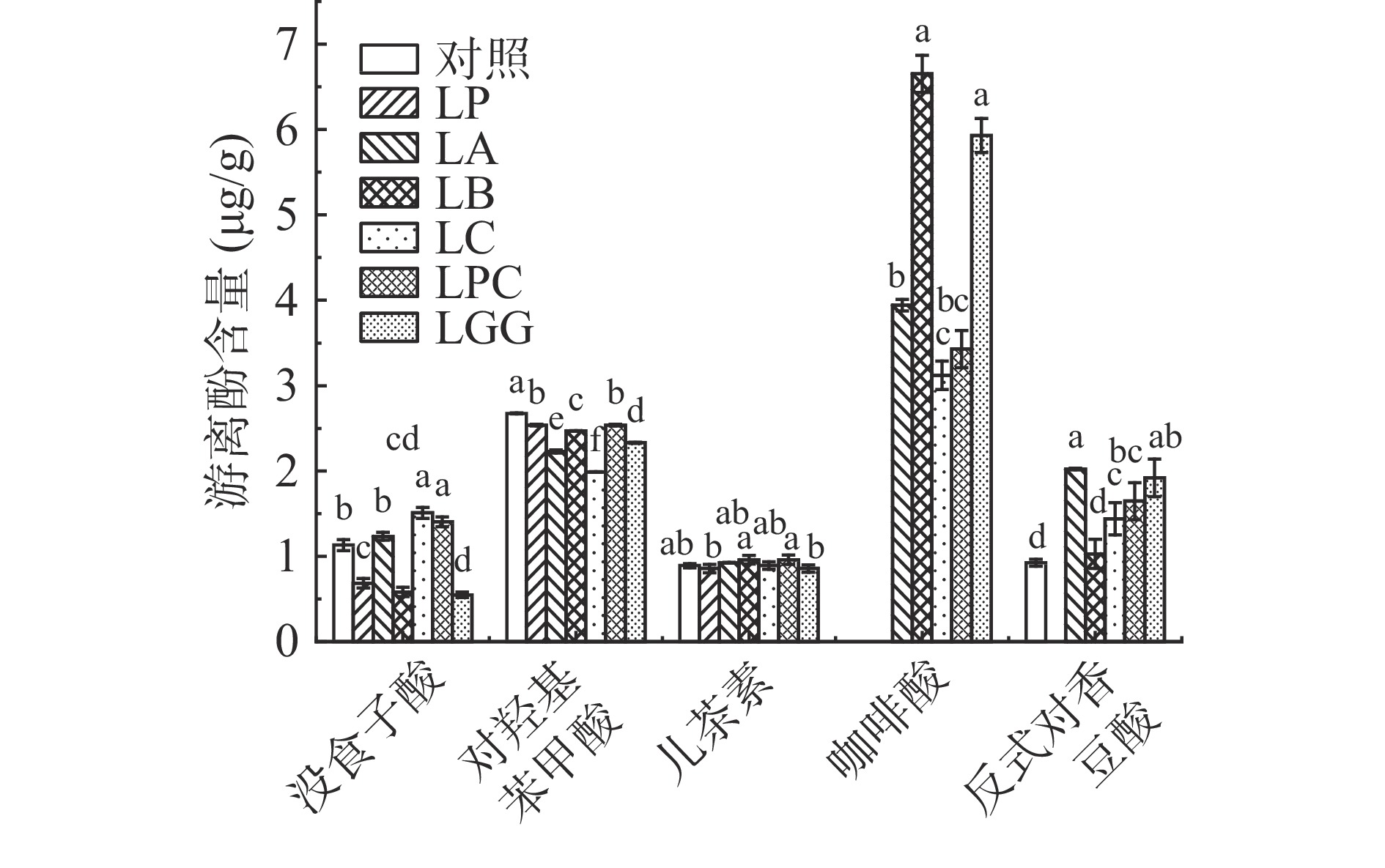
对发酵前后黑米游离多酚和结合多酚提取液中的10种多酚类物质,包括没食子酸、原儿茶酸、对羟基苯甲酸、香草酸、咖啡酸、反式对香豆酸、阿魏酸、和3-羟基肉桂酸8种酚酸,以及儿茶素和槲皮素2种黄酮,进行定性定量分析,结果见图4、图5、图6和图7。
2.2.1 乳杆菌发酵对黑米游离酚组成及含量的影响
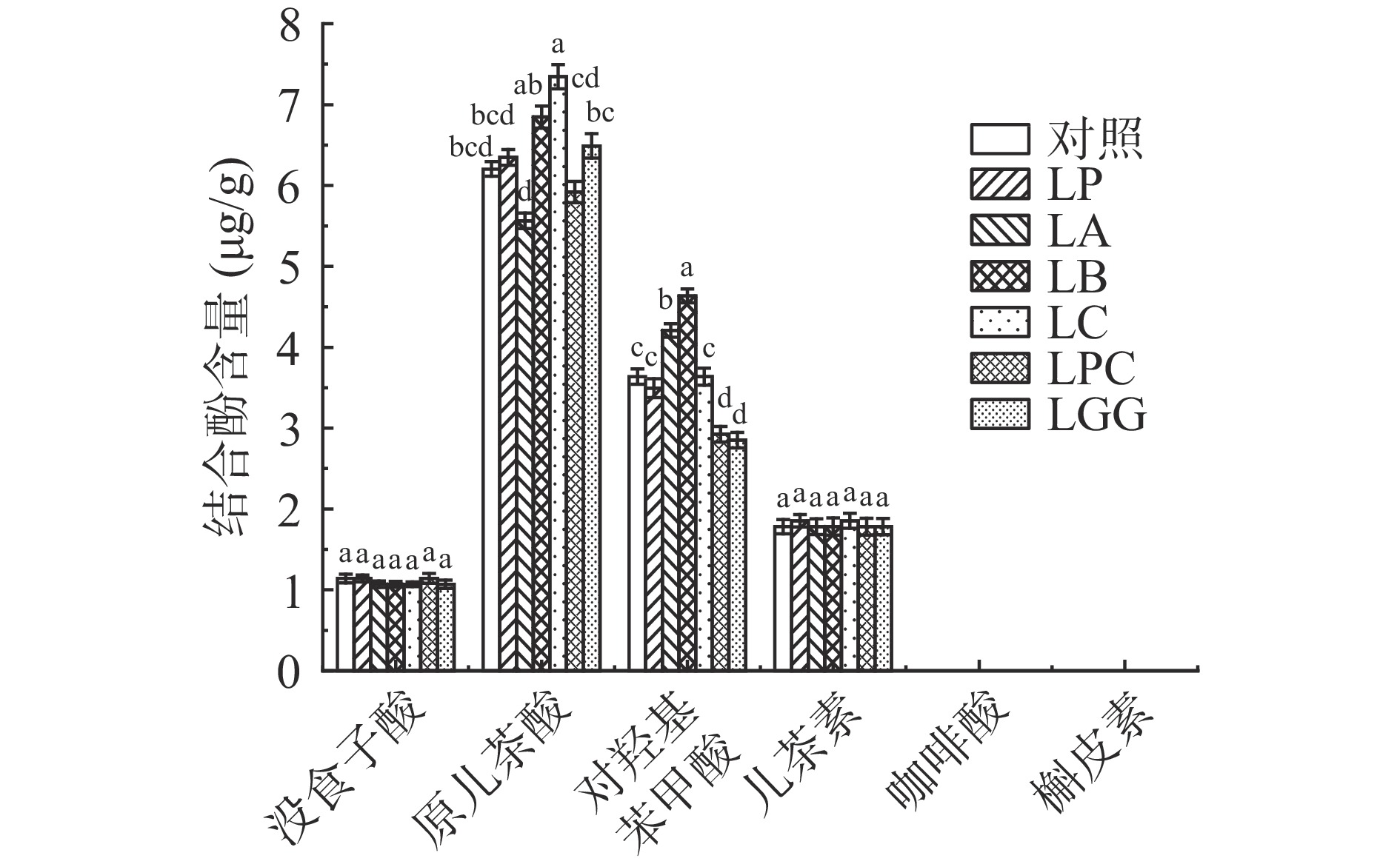
由图4和图5所示,在未发酵对照组黑米游离酚提取液中这10种检测的酚类物质除了3-羟基肉桂酸和咖啡酸无法检出,其余8种含量由高到低分别是原儿茶酸(102.8 μg/g)、香草酸(62.7 μg/g)、槲皮素(12.0 μg/g)、阿魏酸(4.9 μg/g)、对羟基本苯甲酸(2.7 μg/g)、没食子酸(1.1 μg/g)、儿茶素(0.9 μg/g)、反式对香豆酸(0.9 μg/g)。不同乳杆菌发酵后黑米游离多酚的含量存在显著差异(P<0.05)。其中六株乳杆菌发酵后含量均提高的是槲皮素,含量提高了将近一倍,并且在黑米结合酚中也没有检测出槲皮素,表明增加的槲皮素是在这六株乳杆菌发酵过程中新生成的。王储炎等[27]用副干酪乳杆菌发酵蓝莓的研究也得出了乳杆菌发酵可以提高槲皮素含量的结论。而咖啡酸,在未发酵的黑米游离酚提取液中没有检出,除了LP,其他五株菌种发酵后都检出了咖啡酸,并且在黑米结合酚中也无法检出咖啡酸,说明这五株乳杆菌发酵过程中都生成了咖啡酸。王储炎等[27]的研究结果也表明接种嗜酸乳杆菌发酵能提高蓝莓中游离咖啡酸的含量。而LP发酵后没有检测出咖啡酸的原因是LP能够降解咖啡酸,Gaur等[28]研究表明,LP在发酵过程中将咖啡酸降解得到了乙烯基苯酚、乙烯基儿茶酚、乙烯基愈创木酚。
6株乳杆菌发酵后含量均降低的是游离态香草酸和对羟基苯甲酸,表明这6株乳杆菌在发酵过程中降解或转化了香草酸和对羟基苯甲酸;而Liu等[29]研究表明,用LP和LA混合发酵米糠后,米糠中游离的香草酸含量下降了,也验证了这一结论。
发酵后游离态原儿茶酸、没食子酸、阿魏酸和反式对香豆酸的含量变化在不同乳杆菌菌种间有很大差异。其中,LC和LPC发酵后黑米游离酚中的原儿茶酸含量分别提高了12.7%和19.5%,而LP、LA、LB和LGG发酵后降低了74.5%、5.1%、71.4%和73.8%,LP发酵后原儿茶酸含量降低的原因是LP发酵过程中将原儿茶酸转化生成了儿茶酚[30]。关于没食子酸,LP、LB和LGG发酵后分别降低了39.4%、48.5%和51.5%,相反LA、LC、LPC发酵后分别提高了9.1%、33.4%和24.3%。目前不同乳杆菌发酵对酚酸和黄酮的作用相关的研究报道较少,其中,有研究发现LP发酵过程中合成了能够分解单宁和没食子酸的脱羧酶[31],这可能是LP发酵后黑米中没食子酸含量降低的原因。游离态阿魏酸的含量除了LP外,其他五株菌种发酵后提高了将近三倍。游离态反式对香豆酸LP发酵后无法检出,而其他五株菌种发酵后含量均提高了。Rodriguez等[22]的研究发现,植物乳杆菌在发酵过程中产生的酚酸脱羧酶降解了对香豆酸和阿魏酸,因此LP发酵后黑米中游离态阿魏酸和反式对香豆酸含量降低可能是因为这两者被LP发酵过程中合成的酚酸脱羧酶降解了。
2.2.2 乳杆菌发酵对黑米结合酚组成和含量的影响
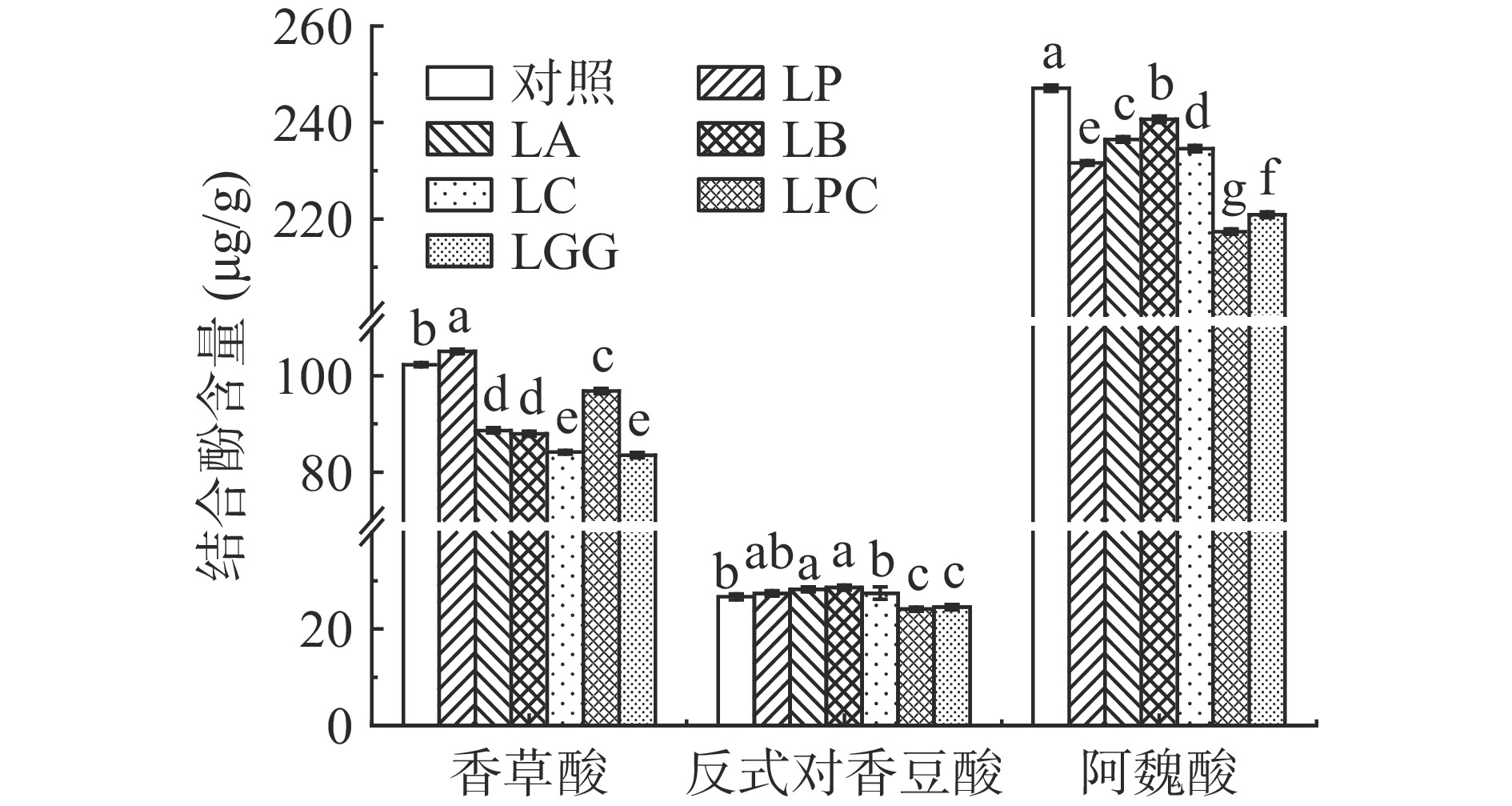
乳杆菌发酵对黑米中结合酚组成及含量影响的实验结果见图6和图7。
由图6和图7可知,在未发酵对照组黑米结合酚提取液中这10种检测的酚类物质除了3-羟基肉桂酸、咖啡酸和槲皮素无法检出,其余7种含量由高到低分别是阿魏酸(247.09 μg/g)、香草酸(102.3 μg/g)、反式对香豆酸(26.7 μg/g)、原儿茶酸(6.2 μg/g)、对羟基苯甲酸(3.6 μg/g)、儿茶素(1.9 μg/g)、没食子酸(1.1 μg/g)。不同乳杆菌发酵后对黑米结合酚的含量存在显著差异(P<0.05)。其中6株乳杆菌发酵后含量均没有显著性变化的是没食子酸和儿茶素(P>0.05),含量均降低的是阿魏酸。由图4可知,除了LP,其它5株乳杆菌发酵后游离酚中的阿魏酸含量均提高了,表明很可能是经过LB、LPC、LGG、LC和LA的作用,部分结合态的阿魏酸释放出来变成了游离态的阿魏酸。
发酵后结合态香草酸、原儿茶酸和对羟基苯甲酸的含量在6株菌种间有很大差异。其中关于香草酸,除了LP发酵后含量提高,其他5株菌种发酵后含量均降低,对比发酵后游离态香草酸的含量也降低,表明很有可能是6株乳杆菌在发酵过程中代谢了部分香草酸,而不是从结合态转化成游离态[29]。关于对羟基苯甲酸,LA和LB菌株发酵后含量显著提高(P<0.05),分别提高了16.9%和28.8%,LPC和LGG发酵后含量显著降低(P<0.05),分别降低了18.8%和20.8%。关于原儿茶酸,LC菌株发酵后显著提高(P<0.05),提高了18.5%,其他5株菌株发酵后没有显著差异(P>0.05)。
3. 结论
通过研究6株乳杆菌发酵对黑米游离酚和结合酚组成及含量的影响发现,6株乳杆菌发酵均能显著提高游离酚含量,降低结合酚含量,但不同乳杆菌发酵后提高游离酚含量的程度具有显著差异(P<0.05),提高程度顺序为:LB>LGG>LPC>LP>LA>LC。HPLC分析结果显示,不同乳杆菌发酵后黑米中游离酚和结合酚中的不同单体酚的含量变化存在显著差异,其中,6株乳杆菌发酵后黑米中游离态香草酸和对羟基苯甲酸的含量均显著降低(P<0.05),LP菌株除外游离态咖啡酸的含量均显著提高(P<0.05),而6株乳杆菌发酵后结合态阿魏酸含量均显著降低(P<0.05)。乳杆菌发酵后显著提高了黑米中生物利用度高的游离酚的含量,为黑米的高效利用和天然活性产品的开发提供了新的思路。
-
表 1 没食子酸标曲加液表
Table 1 Addition of gallic acid standard curve
编号 1 2 3 4 5 6 没食子酸标液(mL) 0.0 0.2 0.4 0.6 0.8 1 去离子水(mL) 1.0 0.9 0.8 0.6 0.4 0 福林酚试剂(mL) 1.0 1.0 1.0 1.0 1.0 1.0 没食子酸含量(μg) 0.0 10 20 30 40 50 表 2 洗脱梯度
Table 2 Elution gradient
时间(min) 流速(mL/min) A(%) B(%) 0 0.8 95 5 1 0.8 95 5 10 0.8 90 10 16 0.8 85 15 20 0.8 80 20 26 0.8 65 35 30 0.8 65 35 35 0.8 95 5 40 0.8 95 5 -
[1] 罗建华, 王继忠, 韩小丽. 浅谈洋县黑米发展优势及利用[J]. 中国稻米,2015,21(3):90−93. [LUO Jianhua, WANG Jizhong, HAN Xiaoli. Development advantages and utilization of black rice in yangxian county[J]. China Rice,2015,21(3):90−93. doi: 10.3969/j.issn.1006-8082.2015.03.034 [2] 李静, 焦雪, 华泽田, 等. 20种黑米的总酚含量与抗氧化活性[J]. 食品工业科技,2017,38(20):25−29. [LI Jing, JIAO Xue, HUA Zetian, et al. Total phenolic contents of 20 varieties of black rice and antioxidant activities[J]. Science and Technology of Food Industry,2017,38(20):25−29. doi: 10.13386/j.issn1002-0306.2017.20.006 [3] 叶玲旭, 刘兴训, 周素梅, 等. 不同颜色糙米的酚类物质组成及抗氧化活性分析[J]. 食品与发酵工业,2016,42(9):75−80. [YE Lingxu, LIU Xingxun, ZHOU Sumei, et al. Phenolic compounds and antioxidant activity of brown rice in different color of bran[J]. Food and Fermentation Industries,2016,42(9):75−80. doi: 10.13995/j.cnki.11-1802/ts.201609013 [4] GURUKAR M S A, CHILKUNDA N D. Morus alba leaf bioactives modulate peroxisome proliferator activated receptor gamma in the kidney of diabetic rat and impart beneficial effect[J]. Journal of Agricultural and Food Chemistry,2018,66(30):7923−7934. doi: 10.1021/acs.jafc.8b01357
[5] RECHNER A R, SMITH M A, KUHNLE G, et al. Colonic metabolism of dietary polyphenols: Influence of structure on microbial fermentation products[J]. Free Radical Biology and Medicine,2004,36(2):212−225. doi: 10.1016/j.freeradbiomed.2003.09.022
[6] GIBSON G R, HUTKINS R, SANDERS M E, et al. The international scientific association for probiotics and prebiotics (isapp) consensus statement on the definition and scope of prebiotics[J]. Nature Reviews Gastroenterology & Hepatology,2017,14(8):491−502.
[7] 姚芳, 肖香, 董英. 大麦乳酸菌发酵液粉中多酚的提取及其抗氧化性研究[J]. 食品工业科技,2017,38(10):211−216, 235. [YAO Fang, XIAO Xiang, DONG Ying. Extraction and antioxidant activity of polyphenols from barley Lactobacillus fermented solution[J]. Science and Technology of Food Industry,2017,38(10):211−216, 235. doi: 10.13386/j.issn1002-0306.2017.10.032 [8] 张慧芸, 陈俊亮, 康怀彬. 发酵对几种谷物提取物总酚及抗氧化活性的影响[J]. 食品科学,2014,35(11):195−199. [ZHANG Huiyun, CHEN Junliang, KANG Huaibin. Effect of fermentation on total polyphenol content and antioxidant activity of cereal extract[J]. Food Science,2014,35(11):195−199. doi: 10.7506/spkx1002-6630-201411039 [9] HUANG S, MA Y, ZHANG C, et al. Bioaccessibility and antioxidant activity of phenolics in native and fermented Prinsepia utilis Royle seed during a simulated gastrointestinal digestion in vitro[J]. Journal of Functional Foods,2017,37:354−362. doi: 10.1016/j.jff.2017.08.004
[10] DORDEVIC T M, SILER-MARINKOVIC S S, DIMITRIJEVIC-BRANKOVIC S I. Effect of fermentation on antioxidant properties of some cereals and pseudo cereals[J]. Food Chemistry,2010,119(3):957−963. doi: 10.1016/j.foodchem.2009.07.049
[11] GB 4789.35-2016 食品微生物学检验 乳酸菌检验[S]. 北京: 中国标准出版社, 2016 GB 4789.35-2016 Food microbiological test lactic acid bacteria test[S]. Beijing: Standards Press of China, 2016.
[12] 梁言. 乳杆菌与酵母发酵籼米粉浆及制备米发糕的研究[D]. 广州: 华南理工大学, 2019 LIANG Yan. Study on the fermentation of indica rice flour slurry by Lactobacillus and yeast and the preparation of fermented rice cake[D]. Guangzhou: South China University of Technology, 2019.
[13] 陈金玉, 曲金萍. 酶解制备苦荞蛋白抗氧化肽及其分离纯化研究[J]. 食品研究与开发,2020,41(12):14−20. [CHEN Jinyu, QU Jinping. Preparation and purification of antioxidant peptides from tartary buckwheat protein by enzymatic hydrolysis[J]. Food Research and Development,2020,41(12):14−20. doi: 10.12161/j.issn.1005-6521.2020.12.003 [14] PEDRO A C, GRANATO D, ROSSO N D. Extraction of anthocyanins and polyphenols from black rice (Oryza sativa L.) by modeling and assessing their reversibility and stability[J]. Food Chemistry,2016,191:12−20. doi: 10.1016/j.foodchem.2015.02.045
[15] RAMON G M, GOMEZ M E, ROSALES C N, et al. Extraction, identification and quantification of polyphenols from spent coffee grounds by chromatographic methods and chemometric analyses[J]. Waste Management,2019,96:15−24. doi: 10.1016/j.wasman.2019.07.009
[16] 刘燕. 双菌发酵燕麦改善多酚抗氧化活性及其体外消化特性[D]. 广州: 华南理工大学, 2019 LIU Yan. Improving phenolic bioactivity in double-strain fermented oats and their characteristics in vitro digestion[D]. Guangzhou: South China University of Technology, 2019.
[17] BEI Q, LIU Y, WANG L, et al. Improving free, conjugated, and bound phenolic fractions in fermented oats (Avena sativa L.) with monascus anka and their antioxidant activity[J]. Journal of Functional Foods,2017,32:185−194. doi: 10.1016/j.jff.2017.02.028
[18] SAPNA I, KAMALJIT M, PRIYA R, et al. Milling and thermal treatment induced changes on phenolic components and antioxidant activities of pigmented rice flours[J]. Journal of Food Science and Technology-Mysore,2019,56(1):273−280. doi: 10.1007/s13197-018-3487-1
[19] SUMCZYNSKI D, KOTÁSKOVÁ E, DRUŽBÍKOVÁ H, et al. Determination of contents and antioxidant activity of free and bound phenolics compounds and in vitro digestibility of commercial black and red rice (Oryza sativa L.) varieties[J]. Food Chemistry,2016,211:339−346. doi: 10.1016/j.foodchem.2016.05.081
[20] AURA A M, MARTIN-LOPEZ P, O'LEARY K A, et al. In vitro metabolism of anthocyanins by human gut microflora[J]. European Journal of Nutrition,2005,44(3):133−142. doi: 10.1007/s00394-004-0502-2
[21] 贝琦. 燕麦发酵多酚释放与转化及生物活性增强的研究[D]. 广州: 华南理工大学, 2018 BEI Qi. Study on release and transformation of phenolics in monascus fermented oats and their bioactivity[D]. Guangzhou: South China University of Technology, 2018.
[22] RODRIGUEZ H, CURIEL J A, MARIA LANDETE J, et al. Food phenolics and lactic acid bacteria[J]. International Journal of Food Microbiology,2009,132(2-3):79−90. doi: 10.1016/j.ijfoodmicro.2009.03.025
[23] 李涛涛. 益生菌复合发酵促进玫瑰花渣多酚含量及生物活性研究[D]. 北京: 北京林业大学, 2019 LI Taotao. Study on promoting polyphenol content and biological activities of rose residue by probiotics compound fermentation[D]. Beijing: Beijing Forestry University, 2019.
[24] WILKINSON A P, GEE J M, DUPONT M S, et al. Hydrolysis by lactase phlorizin hydrolase is the first step in the uptake of daidzein glucosides by rat small intestine in vitro[J]. Xenobiotica,2003,33(3):255−264. doi: 10.1080/0049825021000058088
[25] DAY A J, CAÑADA F J, DÍAZ J C, et al. Dietary flavonoid and isoflavone glycosides are hydrolysed by the lactase site of lactase phlorizin hydrolase[J]. FEBS Letters,2000,468(2-3):166−170. doi: 10.1016/S0014-5793(00)01211-4
[26] WEINERT C H, WIESE S, RAWEL H M, et al. Methylation of catechins and procyanidins by rat and human catechol-o-methyltransferase: Metabolite profiling and molecular modeling studies[J]. Drug Metabolism and Disposition,2012,40(2):353−359. doi: 10.1124/dmd.111.041871
[27] 王储炎, 张继刚, 杨柳青, 等. 3种乳酸菌发酵对蓝莓多酚、原花青素含量及抗氧化活性的影响[J]. 食品科学,2020,41(24):87−94. [WANG Chuyan, ZHANG Jigang, YANG Liuqing, et al. Comparative effects of fermentation with three species of lactic acid bacteria on polyphenol and proanthocyanidin contents and antioxidant activity of blueberry fruit[J]. Food Science,2020,41(24):87−94. doi: 10.7506/spkx1002-6630-20200326-387 [28] GAUR G, OH J-H, FILANNINO P, et al. Genetic determinants of hydroxycinnamic acid metabolism in heterofermentative lactobacilli[J]. Applied and Environmental Microbiology,2020,86(5):15.
[29] LIU L, ZHANG R, DENG Y, et al. Fermentation and complex enzyme hydrolysis enhance total phenolics and antioxidant activity of aqueous solution from rice bran pretreated by steaming with alpha-amylase[J]. Food Chemistry,2017,221:636−643. doi: 10.1016/j.foodchem.2016.11.126
[30] LANDETE J M, CURIEL J A, RODRIGUE Z H, et al. Study of the inhibitory activity of phenolic compounds found in olive products and their degradation by Lactobacillus plantarum strains[J]. Food Chemistry,2008,107(1):320−326. doi: 10.1016/j.foodchem.2007.08.043
[31] SAEZ G D, FLOMENBAUM L, ZARATE G. Lactic acid bacteria from argentinean fermented foods: Isolation and characterization for their potential use as starters for fermentation of vegetables[J]. Food Technology and Biotechnology,2018,56(3):398−410.
-
期刊类型引用(3)
1. 路晓,李文钊,徐艳朋,李玉爽,王智珍,张亚旭,刘馨阳,阮美娟. 不同预处理对六种药食同源食材加工特性及其饼干品质影响研究. 食品与发酵工业. 2024(12): 258-265 .  百度学术
百度学术
2. 邱心茹,张源,蒋远帅,高文慧,刘友雪,衣春颖,李悦,孔峰. 鸡骨粉理化性质及其对全麦饼干品质的影响. 食品科技. 2024(06): 147-152 .  百度学术
百度学术
3. 傅新征,林思琦,罗培轩. 响应面法优化超声波辅助酸酶法制备荸荠抗性淀粉工艺. 湖北民族大学学报(自然科学版). 2024(04): 551-558 .  百度学术
百度学术
其他类型引用(5)





 下载:
下载:
 下载:
下载:
