Process Optimization and Functional Properties of Peony Seeds Protein
-
摘要: 以酶水解-超声辅助碱溶酸沉法提取蛋白工艺为基础,初步对牡丹籽中粗蛋白进行分离提取。通过单因素实验和响应面试验,考察料液比、超声温度、酶用剂量、超声时间四个因素对牡丹籽粕蛋白提取率的影响,确定最佳提取工艺,并测定其功能特性。结果表明,酶水解-超声辅助碱溶酸沉法提取牡丹籽粕蛋白最优工艺条件为:料液比为1:9.8(w/v),超声温度为49.5 ℃,酶用剂量为1.9%,超声时间为119 min。在此条件下,蛋白质提取率达到90.95%。此时所得蛋白与常规法提取蛋白相比,氨基酸种类齐全、必需氨基酸含量均有所提高,功能特性如持水性、吸油性、乳化性皆优于常规法提取蛋白的功能特性,且乳化的稳定性更优,由此推测可作为食品加工乳化剂。因此酶水解-超声辅助碱溶酸沉法提取的牡丹籽粕蛋白具有更高的营养价值和更好的功能特性。Abstract: On the basis of enzymatic hydrolysis and ultrasound-assisted extraction of protein by alkaline solution and acid precipitation, the crude protein from peony seeds was initially separated and extracted. The effects of solid-liquid ratio, ultrasonic temperature, enzyme dosage and ultrasonic time on the extraction rate of peony seed meal protein were investigated by single factor experiments and response surface experiment. The optimal extraction process was determined and its functional characteristics were determined. The optimal extraction conditions of peony seed meal protein by enzymatic hydrolysis and ultrasound-assisted alkaline solubilization and acid precipitation were as follows: Solid-liquid ratio was 1:9.8, ultrasonic temperature was 49.5 ℃, enzyme dosage was 1.9%, and ultrasonic time was 119 min. Under these conditions, the extraction yield of protein reached 90.95%. At this time, compared with the conventional method of protein extraction, the protein obtained had a complete range of amino acids, the content of essential amino acids was improved, and the functional properties such as water holding capacity, oil absorption and emulsification were better than those of the conventional method, and the emulsification stability was better. Therefore, it was speculated that the protein could be used as a food processing emulsifier. Therefore, the peony seed meal protein extracted by enzymatic hydrolysis and ultrasound-assisted alkaline solution and acid precipitation method had higher nutritional value and better functional characteristics.
-
油用牡丹(Paeonia suffruticosa Andr.)是一种新兴木本油料作物,主要分布于我国山东省等内陆地区,种植面积广泛,据统计,截止到2019年6月牡丹籽年产量24000万公斤[1]。压榨法作为传统提取工艺,是目前国内常用的榨油方法之一。除此之外,还有微波辅助提取、超声波辅助提取等方法也在实践研究中。牡丹籽油中含有大量的不饱和脂肪酸,其中多不饱和脂肪酸含量约占2/3[2]。牡丹籽经榨油后易产生大量的籽粕,但是这些籽粕仅用于饲料或者丢弃处理,针对目前作为牡丹籽油副产品之一的牡丹籽粕的开发利用,研究发现,牡丹籽粕富含脂类、蛋白质和多糖等成分。潘婷婷等[3]发现牡丹籽粕中蛋白质富集(含量可达28%以上),氨基酸种类齐全,具有降低胆固醇、抗氧化、改善心血管疾病等对人体健康有益的作用,可用于天然植物蛋白的开发利用。因此促进牡丹籽粕蛋白的深加工与应用,具有极高的经济与营养保健价值。
目前应用最广泛的植物蛋白提取技术主要有以下几种:碱溶酸沉法、酶提取法、有机溶剂提取法、盐溶提取法和反胶束提取法等[4],其中碱溶酸沉法应用最为广泛,但蛋白提取率往往不高。在常规法提取的基础上辅以超声波能改变蛋白空间结构或聚集方式,促进蛋白溶出、疏水基团暴露,从而提高蛋白的提取率。同时酶水解通过改变氨基酸残基或多肽链引起蛋白分子空间结构和理化性质改变,从而获得较好的营养和功能特性,具有步骤简单、条件温和、专一性强等优点。对牡丹籽粕的研究中,和蛋白质比较,对脂类和多糖的文献报道较多。徐玥等[5]发现使用碱溶酸沉法提取牡丹籽粕中蛋白的最佳条件为料液比1:12、45 ℃、pH8.5下提取1 h,蛋白质的含量可达73%。王敏等[6]也使用碱溶酸沉法,结果发现蛋白提取率为56.77%,并且发现在高温条件、pH为3.0~9.0的时候牡丹籽粕蛋白有良好的抗氧化性能。本研究以脱脂牡丹籽粕为原料,重点研究酶水解-超声辅助碱溶酸沉法对蛋白提取率的影响,将本法提取蛋白同常规碱溶酸沉法提取牡丹籽粕蛋白和大豆分离蛋白进行理化性质和氨基酸组成的比较,从而为牡丹籽粕蛋白的提取提供理论基础。
1. 材料与方法
1.1 材料与仪器
牡丹籽粕 市售;糖化酶(80 U/g) 生化试剂,夏盛(北京)生物科技开发有限公司;氢氧化钠、盐酸、石油醚、硼酸 上海杰星生物科技公司;所有分离用有机溶剂等 均为国产分析纯。
KQ-250B超声清洗器 杭州宝珀超声波科技有限公司;Centrifuge 5810R高速冷冻离心机 湖南凯达科学仪器有限公司;Labconoo FreeZone 6L台式冻干机 北京亚星仪科科技发展有限公司;DFT-100手提式高速中药粉碎机 青岛聚创嘉恒分析仪器有限公司。
1.2 实验方法
1.2.1 牡丹籽粕蛋白等电点测定
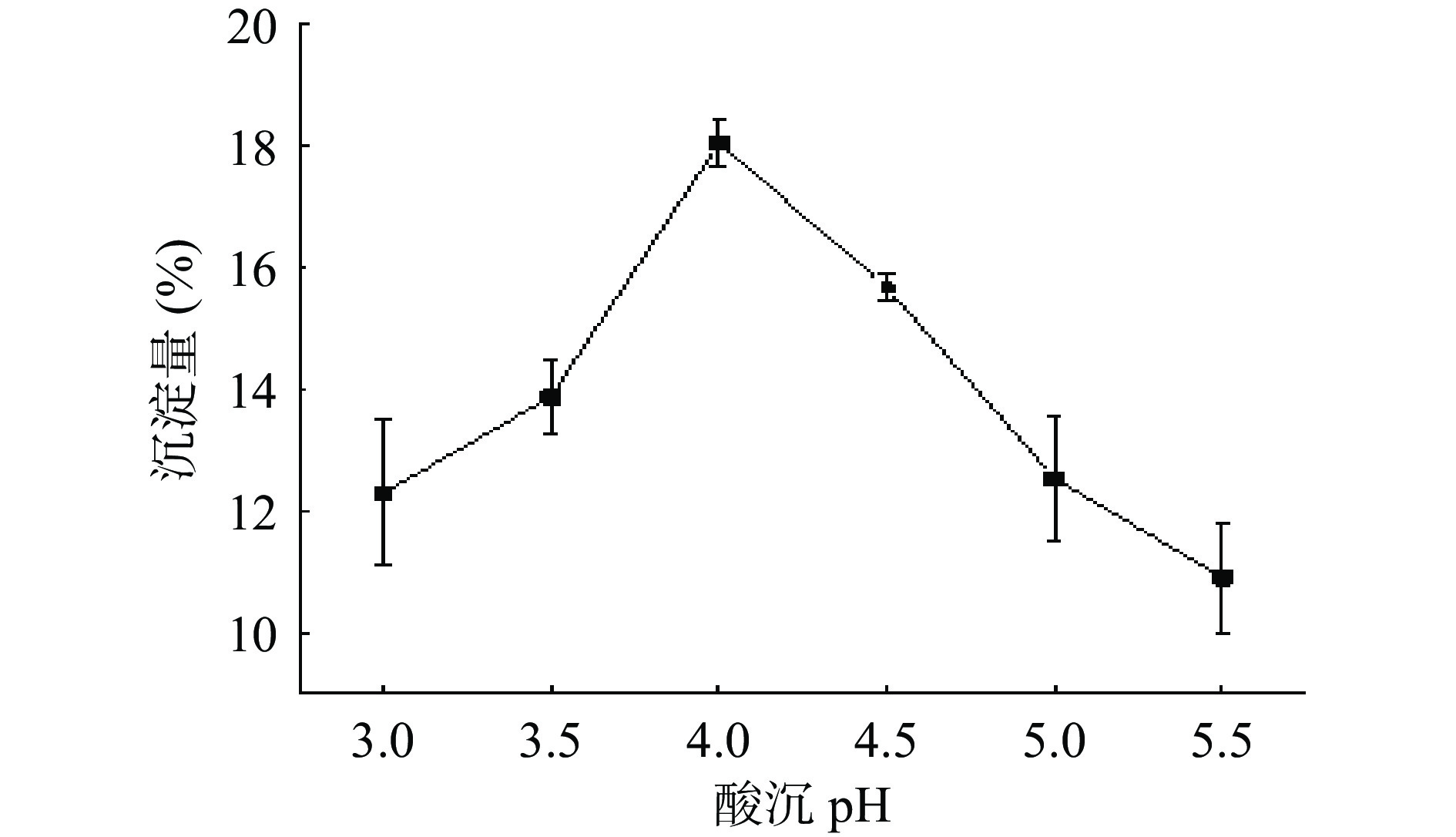
于250 mL烧杯中称取适量脱脂牡丹种子粉,按适当液固比加入蒸馏水,用0.5 mol/L氢氧化钠调节pH至10.0,于超声清洗器中50 ℃超声恒温反应100 min。4800 r/min离心15 min,取15 mL上清液将其分成6等份,用0.5 mol/L盐酸调节酸沉液pH至3.0、3.5、4.0、4.5、5.0、5.5,再4800 r/min离心20 min。称量剩余沉淀,将沉淀中的牡丹种子蛋白产量与对应酸度作关系图。反复1次,牡丹种子蛋白等电点是沉淀量最优时的pH。
1.2.2 牡丹籽粕蛋白提取工艺
酶水解-超声辅助碱溶酸沉法:将牡丹籽粕洗净后置于烘箱中55 ℃干燥,冷却后粉碎、过200目筛,加入石油醚脱脂,加入不同pH碱液配制成不同的分散液,搅拌均匀,接着在超声波200 W、一定的温度和时间下超声辅助碱提,然后5000 r/min下离心20 min,收集上清液。使用HCl调节pH至等电点,离心后沉淀复溶,调节pH,加入一定剂量的糖化酶酶解一定时间,沸水浴灭酶,再将pH调节至中性,高速离心后洗涤沉淀,并进行冷冻干燥,即为牡丹籽粕蛋白[4-6]。
常规法提取:牡丹籽经55 ℃烘干12 h,剥壳,将所得牡丹籽粕烘干粉碎,加入石油醚脱脂,加入不同pH碱液配制成不同的分散液,搅拌均匀。50 ℃水浴2 h,4000 r/min离心15 min,收集上清液;4 mol/L盐酸调节pH至等电点,离心后沉淀复溶,调节pH至中性,4000 r/min 离心15 min弃上清。将所得沉淀进行冷冻干燥,过40目筛得牡丹籽蛋白。
1.2.3 单因素实验设计
单因素实验主要研究料液比、碱提pH、超声温度、超声时间、酶解时间、酶用剂量、酶解pH七个因素对牡丹籽粕蛋白提取率的影响。设计各单因素条件为:料液比(w/v)1:1、1:5、1:10、1:15、1:20;碱提pH8.0、9.0、10.0、11.0、12.0;超声温度40.0、45.0、50.0、55.0、60.0 ℃;超声时间60.0、80.0、100.0、120.0、140.0 min;酶解pH3.0、3.5、4.0、4.5、5.0;酶解时间0.5、1.0、1.5、2.0、2.5 h;酶用剂量1.0%、2.0%、3.0%、4.0%、5.0%。基本条件设定为:料液比1:10、碱提pH10.0、超声温度50.0 ℃、超声时间100.0 min、酶解pH4.0、酶解时间1.5 h、酶用剂量2.0%,进行牡丹籽粕蛋白提取,测定蛋白提取率。采用控制变量法,分别考察各因素对蛋白提取率的影响,每组实验重复3次。常规碱溶酸沉法则不使用超声波仪器,其余条件相同。
1.2.4 响应面试验设计
根据单因素实验优化结果,试验设计的因素水平见表1,选取对蛋白提取率影响显著的料液比、超声温度、酶用剂量、超声时间为因素,采用Box-Benhnken中心组合设计实验,进行4因素3水平分析实验,确定最佳工艺参数,利用响应面试验设计进行实验优化,建立牡丹籽粕蛋白提取率的二次多项式数学模型[7]。
表 1 Box-Benhnken试验设计的因素水平Table 1. Factors and levels of Box-Benhnken experimental design编码 A料液比 B 超声温度(℃) C酶用剂量(%) D 超声时间(min) −1 1:5 45.0 1.0 100.0 0 1:10 50.0 2.0 120.0 1 1:15 55.0 3.0 140.0 1.2.5 牡丹籽粕蛋白质提取率测定
蛋白质含量的测定使用凯氏定氮法,具体操作参照参考文献[8]。
蛋白中提取率(%)=上清液蛋白质量(mg/mL)脱脂牡丹籽粕蛋白质量(mg/mL)×100 1.2.6 牡丹籽粕蛋白功能性质测定
1.2.6.1 持水性测定
称取1.0 g牡丹籽粕蛋白样品于离心管中,加入20 mL蒸馏水搅拌均匀,调节pH至8.0,置于50 ℃水浴中保温20 min,冷却至室温。3000 r/min离心5 min,弃去上清液,测定离心管和残留物的质量[9],按下式计算持水性。
持水性=弃去上清液后离心管质量−离心管与样品总质量牡丹籽蛋白质量 1.2.6.2 吸油性测定
称取0.5 g牡丹籽粕蛋白,加入5.0 mL大豆油混匀,室温下静置30 min,5000 r/min离心15 min,测量游离油体积[10],则样品的吸油性为:
吸油性(mL/g)=5.0−游离油体积牡丹籽蛋白质量 1.2.6.3 乳化性和乳化稳定性测定
乳化性测定[11]:称取1.0 g牡丹籽粕蛋白分散于25 mL蒸馏水中,加5 mL大豆油,2000 r/min搅拌成匀浆,后3000 r/min离心5 min,则样品乳化性为:
乳化性(%)=乳化层高度(mm)离心管中液体总高度(mm)×100 乳化稳定性测定[12]:将以上乳化样品置于80 ℃水浴中保温30 min,冷水冲洗冷却15 min, 3000 r/min离心5 min,则样品乳化稳定性为:
乳化稳定性(%)=保持乳化状态的液层高度(mm)原乳化层高度(mm)×100 1.2.6.4 起泡性和泡沫稳定性测定
称取1.5 g牡丹籽粕蛋白溶于50 mL去离子水中,调节pH至中性,搅拌10 min,定容至100 mL作为测试液,1000 r/min搅拌3 min,记录上层出现的泡沫体积(mL),静置30 min后再次记录上层泡沫体积(mL),并按以下公式计算[13]:
起泡性(%)=上层泡沫体积100×100 泡沫稳定性(%)=静置30min后上层泡沫体积上清层泡沫体积×100 1.2.6.5 氨基酸组分测定
使用氨基酸全自动分析仪,根据 GB 5009.124-2016 对制备得到的牡丹籽粕蛋白进行水解氨基酸组成分析[14]。
1.3 数据处理
所有试验测定均重复3次。测定结果表示为平均值±标准差(SD)。使用SPSS statistics 23对试验数据进行方差分析确定差异显著性。图表使用Origin 2018和Excel进行绘制。
2. 结果与分析
2.1 牡丹籽粕蛋白等电点
由图1可发现,当溶液pH=4.0时,牡丹种子蛋白沉淀量最大,因此牡丹籽蛋白等电点为4.0。
2.2 各因素对蛋白质提取率的影响
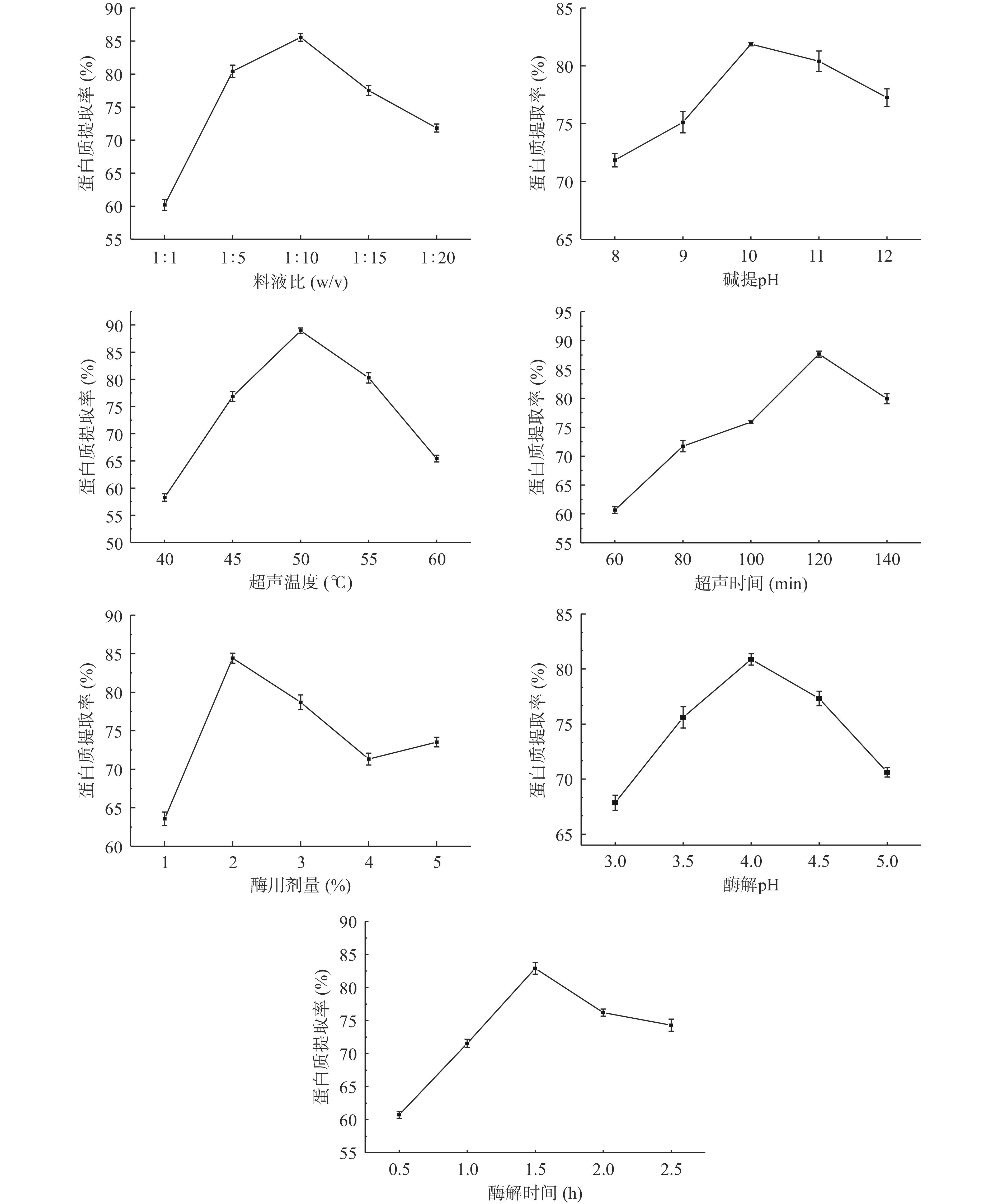
溶剂比例的增加能提高提取目标物在物料中的浓度差,从而不断提高提取效率。料液比对牡丹籽粕蛋白质提取率的影响如图2所示:料液比在1:1~1:20之间时,牡丹籽粕蛋白提取率先增加后降低。当料液比为1:10时,蛋白提取率最高,达到85.56%。当底物浓度过高时,易造成体系粘度过大,分子扩散受到阻碍,水分活度变弱,影响蛋白溶出,对水解反应产生一定抑制作用,因此蛋白提取率较低[15]。但随着溶剂比例的增加,牡丹籽粕与溶剂充分接触,使蛋白质易于溶解到提取液中,从而提高蛋白质分散效率,促使蛋白提取率升高。但过大的料液比反而降低了蛋白质提取率,可能是因为在浓度过低的分散体系中易导致处理时溶质丢失[16]。考虑后续成本和用水量,因此,选取料液比1:5、1:10、1:15进一步实验。
随着氧化还原电位水碱性增强,当碱提pH在8.0~10.0之内时,一些具有极性基团的蛋白质分子二级键发生解离,使同样的电荷体出现在其他蛋白质分子表面,促使蛋白质分子被二级键增溶,从而发生分离[17]。当pH为10.0时,蛋白提取率达到81.88%。但随着溶剂碱性增加,蛋白提取率反而呈现降低趋势,这可能是因为过碱条件会破坏蛋白质的次级键,使蛋白质二、三级结构解体引起极端变性;同时部分蛋白质发生水解,引起脱氨、脱羧、肽键断裂反应[18]。故推测溶剂酸碱性对牡丹蛋白的提取呈现出双向调节作用,因此碱提pH10.0时较合适。
各单因素对牡丹籽粕蛋白质提取率的影响如图2所示,由图2可知,超声温度对蛋白质提取率有一定影响。随着试验过程处理温度的上升,蛋白提取率先升高后降低。提取率在50 ℃时最大,达到88.93%,可能是因为随着提取温度的升高,分子间的布朗运动不断增强,使细胞壁的渗透性不断增强,促进蛋白质溶解,也增加水分子的热运动,增大蛋白质与水分子接触概率,从而提高蛋白提取率[19]。但温度超过50 ℃后,蛋白因过热发生变性,部分溶解的蛋白质出现交联聚合现象,易与不溶物质一起被离心去除,导致上清液中蛋白质含量降低,提取率减小。因此,选取超声温度45、50、55 ℃进一步实验。
超声提取时间对牡丹籽粕蛋白提取率影响显著。当超声处理120 min时,蛋白提取率最高达到87.66%,这是因为牡丹籽粕在溶液中需一定时间溶胀,待溶胀充分后才有利于蛋白提取。随着提取时间增加,超声波机械与空化作用的影响,会增加碱液对原料细胞的渗透,使牡丹籽粕蛋白尽可能溶解在溶剂中,目标提取物得以释放,提取率持续增加[20]。但当处理时间过长时,蛋白产量开始随着时间的推移而降低,可能因为超声对物料的空泡效应持续增强,使部分蛋白质性质发生变化或开始水解。因此,选取超声时间100、120、140 min进一步实验。
随着酶用剂量增加,牡丹籽粕蛋白提取率也随之增加。在2%酶用剂量时,蛋白提取率最高达到84.42%,这可能是因为酶用量的增加,增加了酶与底物结合的概率,从而提高水解度。继续添加酶用量后蛋白质提取率变化并不大,原因可能是酶本身也是蛋白质,是被作用的类似物质,酶浓度过大时,添加过多的蛋白酶会抑制酶的催化能力作用,使底物与酶结合过程中阻碍作用增大。因此,选取酶用量1%、2%、3%进一步实验。
酶解pH和酶解时间对牡丹籽粕蛋白提取率影响不大,均呈现先上升后降低的趋势。当pH为4.0时,能增强蛋白质和水之间的相互作用,使其溶解性提高,蛋白提取率达到82.88%;此后,随pH增大,酶活性逐渐降低,蛋白提取率也随之降低,推测pH过高或过低都对酶的活性造成一定影响,故本试验过程中选择pH4.0作为酶解最佳pH。当酶解1.5 h时,蛋白提取率最高达到82.92%。适当延长酶解时间可以充分发挥酶的功能,使蛋白成分完全被析出。此后处理的时间越久,提取率降低,但幅度不大,推测可能伴随逆反应增多引起的。所以选择的酶解时间是1.5 h。
2.3 响应面试验优化设计
2.3.1 模型的建立及显著性检验
选取料液比、超声温度、酶用剂量、超声时间四个单因素设计实验。根据单因素实验结果,采用Box-Benhnken中心组合试验,考察各个因素对蛋白质提取率的影响,进行4因素3水平的响应面优化试验,响应面优化试验设计及结果见表2。
表 2 响应面优化试验设计及结果Table 2. Response surface optimization experimental design and results实验号 A B C D 蛋白质提取率(%) 1 −1 −1 0 0 83.56 2 1 −1 0 0 78.81 3 −1 1 0 0 73.64 4 1 1 0 0 80.23 5 0 0 −1 −1 83.65 6 0 0 1 −1 78.33 7 0 0 −1 1 79.51 8 0 0 1 1 80.41 9 −1 0 0 −1 80.60 10 1 0 0 −1 78.59 11 −1 0 0 1 78.85 12 1 0 0 1 77.04 13 0 −1 −1 0 83.24 14 0 1 −1 0 80.44 15 0 −1 1 0 80.66 16 0 1 1 0 80.72 17 −1 0 −1 0 82.91 18 1 0 −1 0 82.44 19 −1 0 1 0 81.24 20 1 0 1 0 82.58 21 0 −1 0 −1 80.64 22 0 1 0 −1 77.42 23 0 −1 0 1 77.55 24 0 1 0 1 80.85 25 0 0 0 0 90.89 26 0 0 0 0 90.33 27 0 0 0 0 92.18 28 0 0 0 0 91.33 29 0 0 0 0 92.25 通过Design-Expert软件对表2中的数据进行多元回归拟合分析后,牡丹籽粕蛋白质提取率的预测回归模型为:
Y(%)=91.40−0.092A−0.93B−0.69C−0.42D+2.83AB+0.45AC+0.05AD+0.71BC+1.63BD+1.56CD−5.8A2−6.14B2−3.84C2−6.68D2
方差分析见表3,是响应面结果的方差分析。预测值与真实值之间具有较好的相关性,R2=0.9596,R2Adj=0.9193,这进一步表明该模型具有良好的拟合度和较小的实验误差。该回归方程可用于酶法辅助超声提取牡丹籽粕中蛋白的过程进行初步分析和预测。二次回归方程中AB、A2、B2、C2和D2对蛋白质提取率的影响极显著(P<0.01),B、BD和CD差异显著(P<0.05),其他差异均无统计学意义(P>0.05)。因此,各测试因子对响应值的影响显示出二次抛物线关系。此外,在料液比、超声温度、酶用剂量、超声时间这四个关键因素中,对蛋白质提取率的影响顺序为:超声温度(B)>酶用剂量(C)>超声时间(D)>料液比(A)。失拟项P=0.1486> 0.05,表明未知干扰因素对测试结果的影响很小,模型拟合良好,测试误差小。以上建立的模型可用来显示每个因素和响应值之间的差异。
表 3 方差分析Table 3. Analysis of variance来源 平方和 自由度 均方 F值 P值 显著性 模型 632.36 14 45.17 26.94 <0.0001 ** A 0.10 1 0.10 0.061 0.8082 B 10.38 1 10.38 6.19 0.0261 * C 5.67 1 5.67 3.38 0.0872 D 2.10 1 2.10 1.25 0.2819 AB 32.15 1 32.15 19.17 0.0006 ** AC 0.82 1 0.82 0.49 0.4961 AD 0.01 1 0.01 5.963E-003 0.9395 BC 2.04 1 2.04 1.22 0.2881 BD 10.63 1 10.63 6.34 0.0246 * CD 9.67 1 9.67 5.77 0.0308 * A2 218.18 1 218.18 130.11 <0.0001 ** B2 244.61 1 244.61 145.87 <0.0001 ** C2 95.88 1 95.88 57.18 <0.0001 ** D2 289.52 1 289.52 172.66 <0.0001 ** 残差 23.48 14 1.15 失拟 20.74 10 1.34 3.03 0.1486 纯误差 2.74 4 0.69 总和 655.83 28 注:*差异显著,P<0.05;**差异极显著,P<0.01。 2.3.2 验证试验
通过Design-Expert V8.0.6软件响应面优化试验,对各工艺参数进行优化分析后,牡丹籽粕蛋白提取率(预测值)为91.49%,其对应的因素为料液比1:9.82、超声温度49.51 ℃、酶用剂量1.89%、超声时间118.87 min。根据实际应用情况,测试该方法的最佳有效性,将牡丹籽粕蛋白提取的最优条件修正值定为:料液比设定为1:9.8(w/v),超声温度设定为49.5 ℃,酶用剂量1.9%,超声时间设定为119 min。在最佳工艺条件下设定最佳工艺参数,并进行3次平行实验,牡丹籽粕蛋白提取率分别为90.85%、89.68%、92.33%,平均值为90.95%±1.18%,接近模型的预测值,表明使用Box-Benhnken中心组合获得的工艺参数和响应面分析准确可靠,具有一定的应用价值。
2.4 牡丹籽粕蛋白氨基酸组分分析
对牡丹籽粕蛋白氨基酸组成进行测定,比较常规碱溶酸沉和酶水解-超声辅助碱溶酸沉法对牡丹籽粕蛋白氨基酸组成成分的影响(表4)。由表4可知,牡丹籽粕蛋白中氨基酸种类齐全,酶水解-超声辅助碱溶酸沉法制备的牡丹籽粕蛋白各氨基酸含量均高于常规碱溶酸沉,且总含量更高,达到88.17 g·(100 g)−1,因此酶水解-超声辅助碱溶酸沉法明显优于常规碱溶酸沉。牡丹籽粕蛋白经酶解超声碱提后,其中必需氨基酸总含量明显上升,达到25.79 g·(100 g)−1,这提高了牡丹籽粕蛋白的营养价值。氨基酸的种类和比例在很大程度上决定了蛋白或多肽的特性,包括其抗氧化特性[21]。彭吟雪等[22]研究表明,蛋氨酸和半胱氨酸因其具有亲核性,可作为氢受体提高抗氧化活性。牡丹籽粕蛋白中蛋氨酸和半胱氨酸提高明显,故推测其抗氧化性可能有所提高[23-25]。
表 4 常规碱溶酸沉与酶水解-超声辅助碱溶酸沉法制备牡丹籽粕蛋白氨基酸组分的比较 (g·(100 g)−1)Table 4. Comparison of amino acid components of peony seed protein prepared by conventional alkali-soluble acid precipitation and enzymatic hydrolysis-ultrasound-assisted alkali-soluble acid precipitation (g·(100 g)−1)氨基酸种类 常规碱溶酸沉 酶水解-超声辅助碱溶酸沉法 天冬氨酸Asp 7.13±0.58b 8.28±0.42a 苏氨酸Thr 2.46±0.27a 2.94±0.36a 丝氨酸Ser 3.90±0.39b 4.56±0.78a 谷氨酸Glu 18.62±0.45b 21.93±0.91a 甘氨酸Gly 3.42±0.61b 4.88±0.53a 丙氨酸Ala 3.22±0.18b 4.61±0.47a 半胱氨酸Cys 0.71±0.93a 1.38±0.63a 缬氨酸Val 3.68±0.42b 4.97±0.58a 蛋氨酸Met 1.62±0.92a 1.76±0.24a 异亮氨酸Ile 2.87±0.31b 4.16±0.72a 亮氨酸Leu 6.69±0.67b 7.72±0.49a 酪氨酸Tyr 1.94±0.47a 2.33±0.22a 苯丙氨酸Phe 2.71±0.26b 3.96±0.15a 赖氨酸Lys 1.56±0.74a 2.04±0.45a 组氨酸His 1.98±0.58b 2.36±0.70a 精氨酸Arg 5.72±0.23a 6.15±0.68a 脯氨酸Pro 3.57±0.83b 4.14±0.41a 总氨基酸(TAA) 71.80±0.52b 88.17±0.51a 必需氨基酸(EAA) 21.59±0.45b 27.55±0.46a EAA/TAA 30.07±0.86b 31.25±0.90a 注:同行肩标小写字母不同表示差异显著(P<0.05);表5同。 2.5 牡丹籽粕蛋白功能性质分析
对牡丹籽粕蛋白功能特性进行分析,比较大豆分离蛋白与常规碱溶酸沉、酶水解-超声辅助碱溶酸沉法对其功能特性的影响(表5)。
表 5 常规碱溶酸沉、酶水解-超声辅助碱溶酸沉法制备牡丹籽粕蛋白及大豆分离蛋白功能特性的比较Table 5. Comparison of functional characteristics of peony seed protein and soybean protein isolate prepared by conventional alkali-soluble acid precipitation, enzymatic hydrolysis-ultrasonic-assisted alkali-soluble acid precipitation项目 常规碱溶酸沉 酶水解-超声辅助
碱溶酸沉法大豆分离蛋白 持水性(g/g) 9.42±0.51b 16.59±0.68a 3.87±0.75c 吸油性(mL/g) 1.58±0.23b 2.57±0.32a 1.60±0.97b 乳化性(%) 26.71±0.48b 35.93±0.56a 17.46±0.48c 乳化稳定性(%) 68.66±0.71b 75.52±0.43a 22.38±0.55c 起泡性(%) 36.78±0.14b 40.58±0.55a 42.07±0.37a 泡沫稳定性(%) 68.03±0.34a 63.18±0.28b 68.86±0.74a 大豆分离蛋白与常规碱溶酸沉制备的牡丹籽粕蛋白持水能力均低于酶水解-超声辅助碱溶酸沉法,超声辅助有助于提高牡丹籽粕蛋白持水性,这可能是因为在恒温水浴中,适当升高温度能直接使蛋白质组成和构造分子变得舒展膨松,超声波处理使蛋白充分由大分子解离为小分子,蛋白分子亲水基团暴露在表面,因此与水组分子间的相互结合作用力增强,形成网状结构从而获得更高的蛋白持水性[26]。大豆分离蛋白与常规碱溶酸沉制备的蛋白吸油能力要比酶水解-超声辅助碱溶酸沉法的稍低,推测可能由于超声波处理使蛋白中的疏水充分外露,增强了与油分子的相互作用,使吸油能力增强,从而吸油性增强[27]。相关研究[28]表明乳化性能和分子中疏水基与亲水基的比例及溶解度有关,且超声辅助更有利于乳化性及其稳定性的增强,这可能是因为超声辅助提取使蛋白间肽键断裂、疏水基团充分暴露,引起表面活性及吸附力增强,从而具有良好的乳化性。当大量蛋白分子进入油水界面时,降低了界面张力,疏水基团向里包裹在蛋白表面起到保护作用,从而提高乳化稳定性[29]。考虑牡丹籽粕蛋白乳化功效和乳化稳定性能,它可被认为是一种优良的食品加工乳化剂。此外,牡丹籽粕蛋白具有低起泡性,其发泡性能的主要影响因素有蛋白质分子柔性、疏水性、电荷和极性基团的类型[30]。由表5可看出,酶水解-超声辅助碱溶酸沉法的起泡性高于常规碱溶酸沉,但低于大豆分离蛋白的起泡性,这可能是因为超声处理使蛋白在起泡过程使蛋白分子结构完全展开,促使与水分子相互作用形成薄膜,从而增加了起泡性[31-32]。但常规碱溶酸沉泡沫稳定性更好,这可能是因为超声辅助碱提牡丹籽粕蛋白水解度更高,水解使蛋白空间结构发生改变,分子间相互作用力减小,薄膜难以长时间维持,因此影响泡沫稳定性。
3. 结论
与已有研究相比,本研究使用酶水解-超声辅助碱溶酸沉法提取牡丹籽粕蛋白比酶水解-碱溶酸沉法提取牡丹籽粕蛋白的提取率更高。根据中心组合设计原理,在单因素实验的基础上,设计4因素3水平的响应面优化试验,并以料液比1:9.8(w/v)、超声温度49.5 ℃、酶用剂量1.9%、超声时间119 min为条件,得到牡丹籽粕蛋白提取最佳制备工艺条件。在此条件下牡丹籽粕蛋白提取率达到90.95%,接近预测值91.49%,证明了所获得的实验结果可靠。
试验研究发现,牡丹籽粕蛋白等电点为4.0,此时蛋白沉淀量最大。现有研究大多以常规碱溶酸沉法来制备牡丹籽粕蛋白,但与其相比而言,本研究使用的酶水解-超声辅助碱溶酸沉法制备的牡丹籽粕蛋白具有更好的持水、吸油、乳化等功能特性,且超声辅助碱提后,牡丹籽粕蛋白必需氨基酸组分均有所提高,从而很大程度上改善了蛋白的营养价值,为牡丹籽粕蛋白的综合利用提供了更广泛的理论基础。
-
表 1 Box-Benhnken试验设计的因素水平
Table 1 Factors and levels of Box-Benhnken experimental design
编码 A料液比 B 超声温度(℃) C酶用剂量(%) D 超声时间(min) −1 1:5 45.0 1.0 100.0 0 1:10 50.0 2.0 120.0 1 1:15 55.0 3.0 140.0 表 2 响应面优化试验设计及结果
Table 2 Response surface optimization experimental design and results
实验号 A B C D 蛋白质提取率(%) 1 −1 −1 0 0 83.56 2 1 −1 0 0 78.81 3 −1 1 0 0 73.64 4 1 1 0 0 80.23 5 0 0 −1 −1 83.65 6 0 0 1 −1 78.33 7 0 0 −1 1 79.51 8 0 0 1 1 80.41 9 −1 0 0 −1 80.60 10 1 0 0 −1 78.59 11 −1 0 0 1 78.85 12 1 0 0 1 77.04 13 0 −1 −1 0 83.24 14 0 1 −1 0 80.44 15 0 −1 1 0 80.66 16 0 1 1 0 80.72 17 −1 0 −1 0 82.91 18 1 0 −1 0 82.44 19 −1 0 1 0 81.24 20 1 0 1 0 82.58 21 0 −1 0 −1 80.64 22 0 1 0 −1 77.42 23 0 −1 0 1 77.55 24 0 1 0 1 80.85 25 0 0 0 0 90.89 26 0 0 0 0 90.33 27 0 0 0 0 92.18 28 0 0 0 0 91.33 29 0 0 0 0 92.25 表 3 方差分析
Table 3 Analysis of variance
来源 平方和 自由度 均方 F值 P值 显著性 模型 632.36 14 45.17 26.94 <0.0001 ** A 0.10 1 0.10 0.061 0.8082 B 10.38 1 10.38 6.19 0.0261 * C 5.67 1 5.67 3.38 0.0872 D 2.10 1 2.10 1.25 0.2819 AB 32.15 1 32.15 19.17 0.0006 ** AC 0.82 1 0.82 0.49 0.4961 AD 0.01 1 0.01 5.963E-003 0.9395 BC 2.04 1 2.04 1.22 0.2881 BD 10.63 1 10.63 6.34 0.0246 * CD 9.67 1 9.67 5.77 0.0308 * A2 218.18 1 218.18 130.11 <0.0001 ** B2 244.61 1 244.61 145.87 <0.0001 ** C2 95.88 1 95.88 57.18 <0.0001 ** D2 289.52 1 289.52 172.66 <0.0001 ** 残差 23.48 14 1.15 失拟 20.74 10 1.34 3.03 0.1486 纯误差 2.74 4 0.69 总和 655.83 28 注:*差异显著,P<0.05;**差异极显著,P<0.01。 表 4 常规碱溶酸沉与酶水解-超声辅助碱溶酸沉法制备牡丹籽粕蛋白氨基酸组分的比较 (g·(100 g)−1)
Table 4 Comparison of amino acid components of peony seed protein prepared by conventional alkali-soluble acid precipitation and enzymatic hydrolysis-ultrasound-assisted alkali-soluble acid precipitation (g·(100 g)−1)
氨基酸种类 常规碱溶酸沉 酶水解-超声辅助碱溶酸沉法 天冬氨酸Asp 7.13±0.58b 8.28±0.42a 苏氨酸Thr 2.46±0.27a 2.94±0.36a 丝氨酸Ser 3.90±0.39b 4.56±0.78a 谷氨酸Glu 18.62±0.45b 21.93±0.91a 甘氨酸Gly 3.42±0.61b 4.88±0.53a 丙氨酸Ala 3.22±0.18b 4.61±0.47a 半胱氨酸Cys 0.71±0.93a 1.38±0.63a 缬氨酸Val 3.68±0.42b 4.97±0.58a 蛋氨酸Met 1.62±0.92a 1.76±0.24a 异亮氨酸Ile 2.87±0.31b 4.16±0.72a 亮氨酸Leu 6.69±0.67b 7.72±0.49a 酪氨酸Tyr 1.94±0.47a 2.33±0.22a 苯丙氨酸Phe 2.71±0.26b 3.96±0.15a 赖氨酸Lys 1.56±0.74a 2.04±0.45a 组氨酸His 1.98±0.58b 2.36±0.70a 精氨酸Arg 5.72±0.23a 6.15±0.68a 脯氨酸Pro 3.57±0.83b 4.14±0.41a 总氨基酸(TAA) 71.80±0.52b 88.17±0.51a 必需氨基酸(EAA) 21.59±0.45b 27.55±0.46a EAA/TAA 30.07±0.86b 31.25±0.90a 注:同行肩标小写字母不同表示差异显著(P<0.05);表5同。 表 5 常规碱溶酸沉、酶水解-超声辅助碱溶酸沉法制备牡丹籽粕蛋白及大豆分离蛋白功能特性的比较
Table 5 Comparison of functional characteristics of peony seed protein and soybean protein isolate prepared by conventional alkali-soluble acid precipitation, enzymatic hydrolysis-ultrasonic-assisted alkali-soluble acid precipitation
项目 常规碱溶酸沉 酶水解-超声辅助
碱溶酸沉法大豆分离蛋白 持水性(g/g) 9.42±0.51b 16.59±0.68a 3.87±0.75c 吸油性(mL/g) 1.58±0.23b 2.57±0.32a 1.60±0.97b 乳化性(%) 26.71±0.48b 35.93±0.56a 17.46±0.48c 乳化稳定性(%) 68.66±0.71b 75.52±0.43a 22.38±0.55c 起泡性(%) 36.78±0.14b 40.58±0.55a 42.07±0.37a 泡沫稳定性(%) 68.03±0.34a 63.18±0.28b 68.86±0.74a -
[1] 周天华, 刘玉梅, 张利, 等. 新资源牡丹籽油研究进展与前景[J]. 菏泽学院学报,2020,42(2):100−103. [ZHOU T H, LIU Y M, ZHANG L, et al. Research progress and prospect of new resource peony seed oil[J]. Journal of Heze University,2020,42(2):100−103. doi: 10.3969/j.issn.1673-2103.2020.02.021 [2] 昝丽霞, 陈君红, 霍科科, 等. 牡丹籽油脂肪酸成分分析及微胶囊化工艺优化[J]. 粮食与油脂,2018,31(11):32−35. [ZAN L X, CHEN J H, HUO K K, et al. Analysis of fatty acid composition of peony seed oil and optimization of microencapsulation process[J]. Grain and Oil,2018,31(11):32−35. [3] 潘婷婷, 惠苗娟, 刘光伟. 牡丹饼粕基本营养成分分析[J]. 养殖与饲料,2021,20(4):22−24. [PAN T T, HUI M J, LIU G W. Analysis of basic nutritional components of peony cake meal[J]. Cultivation and Feed,2021,20(4):22−24. [4] 高蕾蕾. 牡丹籽蛋白的理化和功能特性及多肽的抗氧化活性研究[D]. 济南: 齐鲁工业大学, 2018. GAO L L. Physicochemical and functional properties of peony seed protein and antioxidant activity of polypeptides[D]. Jinan: Qilu University of Technology, 2018.
[5] 徐玥, 张存劳, 杨耿, 等. 碱提酸沉法提取牡丹籽饼中蛋白质的研究[J]. 中国油脂,2019,44(8):28−30,40. [XU Y, ZHANG C L, YANG G, et al. Study on extraction of protein from peony seed cake by alkaline extraction and acid precipitation[J]. China Oils and Fats,2019,44(8):28−30,40. [6] 王敏, 李聪, 舒羽, 等. 油用牡丹籽粕蛋白及其酶解产物的功能性质研究[J]. 中国油脂,2020,45(5):67−71. [WANG M, LI C, SHU Y, et al. Functional properties of oil peony seed meal protein and its enzymatic hydrolysis products[J]. China Oils and Fats,2020,45(5):67−71. [7] 李加兴, 房惠芳, 陈选, 等. 牡丹籽粕蛋白提取工艺优化及其等电点分析[J]. 食品与机械,2014,30(3):147−150. [LI J X, FANG H F, CHEN X, et al. Optimization of the extraction process of peony seed meal protein and analysis of its isoelectric point[J]. Food and Machinery,2014,30(3):147−150. [8] 宋红卫, 张惠喜, 孙启亮. 牡丹籽粕——蛋白质饲料新资源[J]. 饲料博览,2020(6):3. [SONG H W, ZHANG H X, SUN Q L. Peony seed meal-a new protein feed resource[J]. Feed Expo,2020(6):3. [9] 庞雪风, 胡传荣, 胡晚华, 等. 糖化酶辅助制备高纯度牡丹籽蛋白的研究[J]. 中国油脂,2013,38(11):28−31. [PANG X F, HU C R, HU W H, et al. Study on the preparation of high-purity peony seed protein assisted by saccharification enzymes[J]. China Oil and Fats,2013,38(11):28−31. [10] 赵璇. 洋葱蛋白及多肽的制备及其体外抗氧化活性评价[J]. 中国调味品,2020,45(2):112−115. [ZHAO X. Preparation of onion proteins and polypeptides and evaluation of their antioxidant activity in vitro[J]. China Condiments,2020,45(2):112−115. [11] 慕运动. 响应面方法及其在食品工业中的应用[J]. 郑州工程学院学报,2001(3):91−94. [MU Y D. Response surface methodology and its application in food industry[J]. Journal of Zhengzhou Institute of Technology,2001(3):91−94. [12] 李凤霞, 刘洪泉, 陈守江. 芝麻蛋白功能性质的研究[J]. 粮油加工,2007(1):52−54,56. [LI F X, LIU H Q, CHEN S J. Study on the functional properties of sesame protein[J]. Grain and Oil Processing,2007(1):52−54,56. [13] 熊拯, 陈敏娥, 张炳亮. 油茶籽粕蛋白质提取工艺及功能特性研究[J]. 粮油食品科技,2013,21(1):27−30. [XIONG Z, CHEN M E, ZHANG B L. Research on protein extraction process and functional properties of camellia oleifera seed meal[J]. Cereals, Oils and Food Science and Technology,2013,21(1):27−30. [14] 林晓明. 芝麻饼粕蛋白质的制备及其功能性质的研究[D]. 镇江: 江苏大学, 2013: 23−25. LIN X M. Preparation and functional properties of sesame meal protein[D]. Zhenjiang: Jiangsu University, 2013: 23−25.
[15] 顾振宇, 江美都, 付道才, 等. 大豆分离蛋白乳化性的研究[J]. 中国粮油学报,2000(3):34−37. [GU Z Y, JIANG M D, FU D C, et al. Study on the emulsification of soybean protein isolate[J]. Chinese Journal of Cereals and Oils,2000(3):34−37. [16] NAIR B M, OSTE R, ASP N G, et al. Enzymatic hydrolysis of food protein for amino acid analysis. I. Solubilization of the protein[J]. Journal of Agricultural and Food Chemistry,1976,24(2):386−389. doi: 10.1021/jf60204a043
[17] 庞雪风, 胡传荣, 何东平, 等. 不同酶解程度牡丹籽蛋白与大豆分离蛋白功能特性的比较[J]. 中国油脂,2014,39(9):23−26. [PANG X F, HU C R, HE D P, et al. Comparison of the functional properties of peony seed protein and soybean protein isolate with different enzymatic hydrolysis degrees[J]. China Oil and Fats,2014,39(9):23−26. [18] 宋艳秋, 吴苏喜, 肖志红. 牡丹籽蛋白的制备工艺优化及功能性质评价[J]. 中国油脂,2015,40(7):26−30. [SONG Y Q, WU S X, XIAO Z H. Optimization of preparation process and evaluation of functional properties of peony seed protein[J]. China Oils and Fats,2015,40(7):26−30. doi: 10.3969/j.issn.1003-7969.2015.07.006 [19] 范三红, 刘艳荣, 原超. 南瓜籽蛋白质的制备及其功能性质研究[J]. 食品科学,2010,31(16):97−100. [FAN S H, LIU Y R, YUAN C. Preparation and functional properties of pumpkin seed protein[J]. Food Science,2010,31(16):97−100. [20] 王文高, 陈正行, 姚惠源. 不同蛋白酶提取大米蛋白质的研究[J]. 粮食与饲料工业,2002(2):41−42. [WANG W G, CHEN Z X, YAO H Y. Study on the extraction of rice protein with different proteases[J]. Food and Feed Industry,2002(2):41−42. [21] 邓茂林, 朱位秋. 酶作用下肽键断裂的随机动力学[C]//郑州: 中国力学学会学术大会, 2009. DENG M L, ZHU W Q. Stochastic kinetics of peptide bond cleavage under the action of enzymes[C]//Zhengzhou: Academic Conference of the Chinese Society of Mechanics, 2009.
[22] 彭吟雪, 张莹, 刘祥龙, 等. 超声辅助碱溶酸沉法提取美藤果蛋白的工艺研究[J]. 粮食与油脂,2018,31(5):66−70. [PENG Y X, ZHANG Y, LIU X L, et al. Study on the extraction process of Metonia fruit protein by ultrasonic-assisted alkali dissolution and acid precipitation method[J]. Food and Oil,2018,31(5):66−70. [23] 许英一, 江成英, 吴红艳. 超声波辅助碱法提取紫花苜蓿叶蛋白的工艺研究[J]. 食品工业,2013,34(8):14−16. [XU Y Y, JIANG C Y, WU H Y. Study on the extraction of alfalfa leaf protein by ultrasonic-assisted alkaline method[J]. Food Industry,2013,34(8):14−16. [24] 刘柏华, 殷钟意, 郑旭煦, 等. 超声波对牡丹籽粕蛋白质碱提取工艺及氨基酸组成的影响[J]. 食品与发酵工业,2015,41(9):215−219. [LIU B H, YIN Z Y, ZHENG X X, et al. Effects of ultrasonic waves on the alkali extraction process and amino acid composition of peony seed meal protein[J]. Food and Fermentation Industry,2015,41(9):215−219. [25] 毕秋芸. 裙带菜多肽的制备及其抗氧化活性的研究[J]. 中国调味品,2019,44(5):104−110. [BI Q Y. Preparation of wakame polypeptides and research on antioxidant activity[J]. China Condiments,2019,44(5):104−110. doi: 10.3969/j.issn.1000-9973.2019.05.025 [26] POWNALL T L, UDENIGWE C C, ALUKO R E. Amino acid composition and antioxidant properties of pea seed (Pisum sativum L.) enzymatic protein hydrolysate fractions[J]. Journal of Agricultural & Food Chemistry,2010,58(8):4712.
[27] 邓芝串, 张晖, 张超, 等. 籽瓜种子蛋白质的持水及持油性研究[J]. 中国粮油学报,2015,30(9):49−54. [DENG Z C, ZHANG H, ZHANG C, et al. Study on water and oil holding capacity of seed protein of melon seeds[J]. Chinese Journal of Cereals and Oils,2015,30(9):49−54. [28] PAREDES-LÓPEZ O, ORDORICA-FALOMIR C, OLIVARES-VÁZQUEZ M R. Chickpea protein isolates: Physicochemical, functional and nutritional characterization[J]. Journal of Food Science,1991,56(3):726−729. doi: 10.1111/j.1365-2621.1991.tb05367.x
[29] 邱立忠, 夏凤清, 卞希良, 等. 基于疏水改性淀粉的亲水性修饰及其乳化性研究[J]. 中国食品添加剂,2014(3):77−80. [QIU L Z, XIA F Q, BIAN X L, et al. Hydrophilic modification and emulsifying properties of hydrophobically modified starch[J]. China Food Additives,2014(3):77−80. [30] HOJILLA-EVANGELISTA, MILA P. Extraction and functional properties of non-zein proteins in corn germ from wet-milling[J]. JAOCS, Journal of the American Oil Chemists' Society,2012,89(1):167−174. doi: 10.1007/s11746-011-1881-1
[31] 王蒙蒙, 郭东红. 泡沬剂的发泡性能及其影响因素[C]//全国油田化学品发展研讨会, 2007. WANG M M, GUO D H. Foaming properties of foaming agents and their influencing factors [C]//National Seminar on the Development of Oilfield Chemicals, 2007.
[32] 李弓中, 赵英, 王俊彤, 等. 超声处理对蛋清蛋白结构性质及蛋清液起泡性的影响[J]. 食品科学,2019,40(9):68−75. [LI G Z, ZHAO Y, WANG J T, et al. Effects of ultrasonic treatment on the structural properties of egg white protein and foaming of egg white liquid[J]. Food Science,2019,40(9):68−75. -
期刊类型引用(8)
1. 王若彤,秦小勤,何小宇,夏宁. 基于响应面法的沃柑果酱工艺优化. 农产品加工. 2025(03): 49-52+57 .  百度学术
百度学术
2. 任二芳,韦志福,庞成友,罗朝丹,黄燕婷,罗文彬,李建强. 不同产地沃柑品质差异分析. 食品研究与开发. 2024(12): 150-155 .  百度学术
百度学术
3. 孙建城,王登亮,马创举,刘丽丽,陈骏,刘春荣,吴群. 不同采收期对华柑4号柑橘果实品质的影响. 中国果树. 2024(07): 67-73 .  百度学术
百度学术
4. 谢林君,成果,张劲,张瑛,王海军,何洁,庞丽婷,周咏梅. 基于电子鼻和GC-IMS解析‘阳光玫瑰’葡萄成熟过程香气特征差异. 中外葡萄与葡萄酒. 2024(04): 14-25 .  百度学术
百度学术
5. 段敏仙,张碧蓉,史文斌,闫素云,唐少平,李雪佳,周先艳. 云南沃柑果实发育成熟过程中品质变化规律分析. 云南农业科技. 2024(06): 14-19 .  百度学术
百度学术
6. 荣传胜,姜永峰,陆玉卓,张婷婷,郝义. 不同采收期对油桃果实采后贮藏品质的影响. 中国果树. 2023(09): 86-89 .  百度学术
百度学术
7. 刘征,何仁春,黄光云,黄香,黄丽霞,李绍波,王启芝,肖正中. 沃柑次果、落果发酵饲料对富凤麻鸡养分表观消化率、生长性能及肉品质的影响. 饲料研究. 2023(19): 30-34 .  百度学术
百度学术
8. 郑芳玲,甘诗雅,赵蕾,陈颖琦,赵潇奕,姜青,邱桐,张莹,郑鹏程,夏涛,戴前颖. 基于GC-MS/GC-O的不同地区红茶特征香气及分子感官分析. 食品科学. 2023(24): 262-268 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:







 下载:
下载:



