Simultaneous Determination of Seventeen Active Ingredients in Novel Tianlongquan Pithos Stored Liquor by HPLC
-
摘要: 目的:为满足企业对添加葛根、罗汉果、苦荞麦提取物的新款年份陶藏酒中活性成分含量的精准控制,建立高效液相色谱(HPLC)同时测定17种活性成分(3′−羟基葛根素、绿原酸、葛根素、表儿茶素、儿茶素、3′−甲氧基葛根素、葛根素芹菜糖苷、大豆苷、阿魏酸、芦丁、槲皮苷、异槲皮苷、山奈酚−3−O−芸香糖苷、罗汉果苷IV、罗汉果苷V、槲皮素、山奈酚)的定量方法。方法:通过梯度优化使各组分有效分离,并对定量方法进行方法学考察。结果:采用Waters Atlantis®T3色谱柱(4.6 mm×250 mm,5 μm)色谱柱,以乙腈−0.1%磷酸水溶液为流动相,在此条件下各测定成分70 min内得到较好分离,不同活性成分相对应的定量波长为203、250、280、365 nm。定量方法重复性好RSD≤4.06%,精密度高RSD(relative standard deviation)≤3.86%,加标回收率准确可靠(平均加标回收率92.46%~106.25%,RSD≤4.56%)。结论:该方操作简单、高效、准确,适用于年份陶藏酒活性成分的品控。Abstract: Objective: In order to satisfy the enterprise's precise control the dosage of active ingredients in the new Tianlongquan pithos-stored liquor dosed with radix puerariae, siraitiae fructus and tartary buckwheat extracts. To establish a method for the simultaneous determination of 17 active ingredients (3′-hydroxypuerarin, chlorogenic acid, puerarin, epicatechin, catechins, 3′-methoxypuerarin, puerarin apioside, daidzin, ferulic acid, rutin, quercetin, isoquercitrin, kaempferol-3-O-rutinoside, mogroside IV, mogroside V, quercetin, kaempferol) by high performance liquid chromatography (HPLC). Methods: Through gradient optimization was carried out to separate each component effectively, and methodological investigations was performed for quantitation method. Results: The effective separation was achieved within 70 min on a Waters Atlantis®T3 column (4.6 mm×250 mm, 5 μm) using a optimized gradient of mobile phase consisting of acetonitrile-0.1% phosphoric acid water, and with the quantitative wavelength was 203, 250, 280 and 365 nm correspondingly. This quantitative method was of with good repeatability (relative standard deviation RSD≤4.06%), high precision (RSD≤3.86%) and reliable recovery (average recoveries ranging from 92.46% to 106.25%, RSD≤4.56%). Conclusion: The method is simple, efficient and accurate, and suitable for the quality control of the active ingredients in pithos-stored liquor.
-
随着生活水平的提高,消费者更注重于饮食健康和养生,促使白酒从高度化向低度化、营养化发展[1-2]。营养型白酒添加了适量的药食同源植物提取物,酒体微黄,风味口感与白酒接近。营养型白酒与普通白酒不同,富含多种天然的活性成分,具有保健功效[3-4],因此,深受消费者的喜爱,如劲牌的毛铺苦荞酒[5]。天龙泉新款年份陶藏酒属于一款低度营养型米香白酒,它是以四年陶缸陈酿米香型白酒作为基酒,辅以添加罗汉果、葛根、苦荞麦提取物制备而成。中草药提取物具有较高的营养价值和药用价值,有保健作用[6-8],如葛根提取物所含的葛根素芹菜糖苷具有保肝功效[9],3′−羟基葛根素对神经具有保护作用[10];苦荞麦提取物含有绿原酸具有抗病毒、降血压等作用[11];罗汉果提取物具有降糖、抗哮喘等作用[12]。提取物的添加丰富了酒体的风味[13-14],天龙泉所生产的年份陶藏酒经国家级评委品评,酒体绵软醇厚,舒适顺口,上市后获得了众多消费者的一致好评。
目前相关活性成分测定的方法有分光光度法[15]、高效液相色谱法[16]、液相色谱串联质谱法[17]等。液相色谱串联质谱分析技术检测范围广、灵敏度高、分离能力强,但仪器价格昂贵,检测和运行成本高,工厂使用受限;高效液相色谱的设备和运行成本低,相较于分光光度法更灵敏准确、可控性高,在白酒企业被广泛应用于产品检测[18-19]。利用前期实验开发的同时测定天龙泉陶藏酒中12种活性成分的方法检测新款年份陶藏酒,发现样品中含多个相应较强未知峰,结合三种提取物的外检质谱报告,推测这些成分可能是阿魏酸、绿原酸、3′−甲氧基葛根素、3′−羟基葛根素、葛根素芹菜糖苷等。此次实验,通过优化色谱条件,开发同时测定天龙泉新款年份陶藏酒中17种活性成分的方法,以期为企业提供有效的品质检测方法。
1. 材料与方法
1.1 材料与仪器
样品:天龙泉新款年份陶藏33%vol(酒基55%vol陈酿4年米香型白酒,辅以添加罗汉果、苦荞麦、葛根提取物) 广西天龙泉酒业有限公司;磷酸 分析纯,天津科密欧试剂有限公司;绿原酸、阿魏酸、槲皮素、大豆苷、山奈酚、葛根素、儿茶素、山奈酚−3−O−芸香糖苷、罗汉果苷IV、罗汉果苷V、3′−甲氧基葛根素、3′−羟基葛根素、表儿茶素、葛根素芹菜糖苷 纯度均>98%,四川维克奇生物科技有限公司,乙腈、甲醇(色谱纯)、芦丁、异槲皮苷、槲皮苷(纯度>98%) 上海麦克林生化科技公司。
Alliance 3695高效液相色谱仪 美国Waters仪器公司,配备2695分离单元、2996 PDA检测器、Empower工作站;ME204E电子分析天平 梅特勒−托利多仪器(上海)有限公司;DK−98−II恒温水浴锅 天津市泰斯特仪器有限公司;Cascada I超纯水仪 美国PALL公司;Waters-Atlantis®T3色谱柱(4.6 mm×250 mm,5 μm) 美国Waters仪器公司;0.22 μm SLGP 033RB针头滤膜 美国Millipore公司;XW−80A旋涡混合器 常州万科仪器有限公司。
1.2 实验方法
1.2.1 单标定性溶液制备
分别称取17种活性成分的标准品并置于10 mL容量瓶,用热甲醇溶解后定容,得到17种活性成分的标准品单标定性溶液,浓度为100 mg/L,用于确定各活性成分的保留时间、峰形。
1.2.2 混合标准溶液制备
称取17种活性成分标准品适量,用热甲醇溶解后得到各标准品母液,再用移液枪分别适量吸取17种活性成分的单标母液置于10 mL容量瓶配制浓度为1500 mg/L的中间液,吸取1 mL中间液于10 mL容量瓶用热甲醇定容,得到浓度为150 mg/L的混合标准溶液,用于色谱条件的优化。借助单标获得的峰形、出峰时间、强度来辨识不同色谱条件下各活性成分的分离效果,进而在最优色谱条件对各成分进行定性。
1.2.3 HPLC检测条件
Waters-Atlantis®T3 色谱柱(4.6 mm×250 mm,5 μm);流动相A为乙腈,流动相B为0.1%磷酸水溶液;柱温32 ℃;进样量10 μL;流速1 mL/min;检测波长分别为203、250、280、365 nm;洗脱条件见表1。
表 1 优化过程所采用的洗脱程序Table 1. The eluent procedure used to optimize the process梯度一 梯度二 梯度三 时间
(min)流动相
A(%)流动相
B(%)时间
(min)流动相
A(%)流动相
B(%)时间
(min)流动相
A(%)流动相
B(%)10.0 5.0 95.0 5.0 5.0 95.0 5.0 10.0 90.0 20.0 10.0 90.0 10.0 10.7 89.3 10.0 10.7 89.3 30.0 10.0 90.0 40.0 10.7 89.3 32.0 10.7 89.3 40.0 12.0 88.0 45.0 14.0 86.0 33.0 7.9 92.1 50.0 12.0 88.0 58.0 20.0 80.0 36.5 7.9 92.1 55.0 18.0 82.0 68.0 78.0 62.0 45.0 20.0 80.0 60.0 20.0 80.0 70.0 60.0 40.0 53.0 25.0 75.0 68.0 38.0 62.0 72.0 0.0 100.0 60.0 40.0 60.0 71.0 45.0 55.0 75.0 0.0 100.0 65.0 60.0 40.0 73.0 60.0 40.0 70.0 0.0 100.0 75.0 0.0 100.0 75.0 0.0 100.0 80.0 0.0 100.0 1.2.4 色谱条件的优化及活性成分的定性
采用二极管阵列检测器(photo-diode array,PDA)对17种活性成分进行全波长扫描200~400 nm,得到各活性成分的光谱图,并确定其定量波长。在选定的波长测定混标,通过优化洗脱梯度,实现相邻的两种活性成分有效分离。为达到最佳的分离效果,前后共进行了30余次的梯度调整,下文仅选择三个有代表性的洗脱梯度对优化改进过程进行说明(见表1)。将目标物质完全分离、检测周期最短的洗脱梯度作为最终的色谱条件,并用于后续的定性、定量。
1.2.5 标准曲线的建立
适量称取17种标准品分别置于不同的10 mL容量瓶中,用热甲醇溶解后定容;需适量吸取不同的母液到10 mL容量瓶用甲醇定容,得到含300 mg/L儿茶素、葛根素芹菜糖苷、槲皮素、3′−羟基葛根素和400 mg/L绿原酸、葛根素、阿魏酸、异槲皮苷、槲皮苷、山奈酚−3−O−芸香糖苷、罗汉果苷V、罗汉果苷IV,200 mg/L表儿茶素、大豆苷、3′−甲氧基葛根素、芦丁、山奈酚的混合标准中间液;再依次吸取混合标准溶液中间液0.1、0.2、0.4、0.8、1.6、3.2 mL置于不同的10 mL容量瓶中用甲醇定容,得到六种不同浓度梯度的混合标准溶液。按浓度由低到高的顺序在最优色谱条件下测定,对峰面积(y)和浓度(x)进行强制过原点的线性拟合,建立标准曲线。
1.2.6 方法学考察
检出限和定量限试验:将配制好的混合标准溶液逐级稀释检测,以信噪比S/N=3、S/N=10所对应的浓度作为检出限(LOD)和定量限(LOQ)。精密度试验:取配制好的混合标准溶液于优化色谱条件下进样6次,记录峰面积,计算RSD。重复性试验:取样品6份,于优化色谱条件下测定,记录峰面积,计算RSD。加标回收率试验:吸取3份样品各0.5 mL,分别加入0.5 mL浓度梯度1、3、6的混合标准溶液,混匀得到低、中、高三个加标样品,用微孔滤膜过滤并进样,平行测定三次,记录峰面积,计算平均加标回收率及其对应的RSD,加标回收率计算公式如下[19-20]。
加标回收率(%)=(加标试样测定值−试样测定值)/加标量×100
1.2.7 样品预处理
精确吸取三份样品各1.5 mL经0.22 μm微孔滤膜过滤,并于最优色谱条件下平行测定三份样品,各进样一次,进样量为10 μL。
1.3 数据处理
使用Microsoft Excel 2017软件对数据进行处理,样品数据以平均值±标准差形式表示。
2. 结果与分析
2.1 检测条件的确定
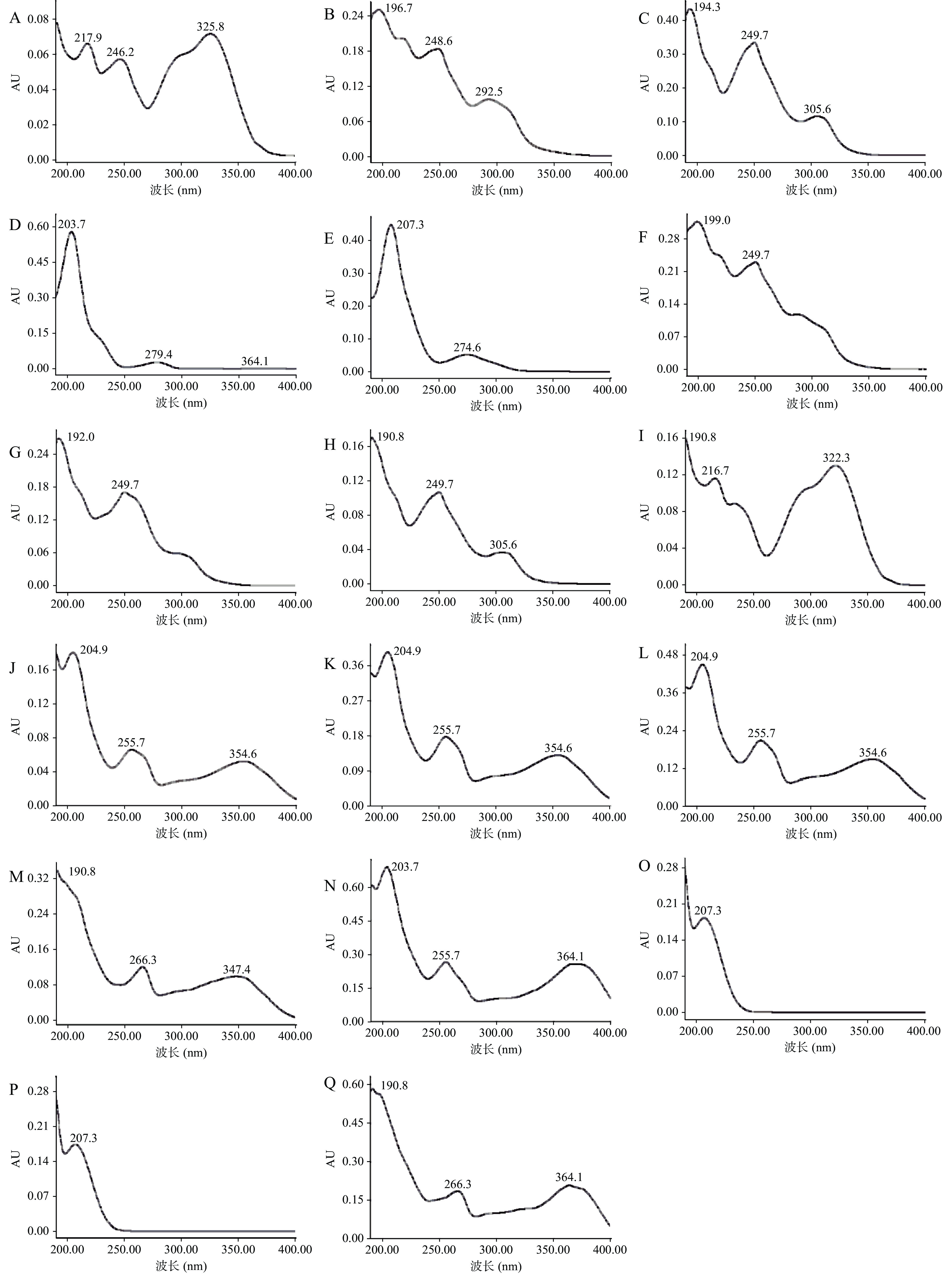
2.1.1 检测波长的选择
本试验采用PDA检测器对17种活性成分进行波长200~400 nm的扫描,结果见图1。可以发现:绿原酸、3′−羟基葛根素、葛根素、表儿茶素、儿茶素、3′−甲氧基葛根素、大豆苷、葛根素芹菜糖苷、阿魏酸、芦丁、槲皮苷、异槲皮苷、山奈酚−3−O−芸香糖苷、槲皮素、罗汉果苷V、罗汉果苷IV、山奈酚的最大吸收波长分别是325、248、249、203、207、249、249、249、322、204、204、204、266、203、207、207、364 nm。为简化定量过程,综合考虑检测效率及灵敏度[21-22],确定罗汉果苷IV、罗汉果苷V、表儿茶素、儿茶素、芦丁、槲皮苷、异槲皮苷、槲皮素定量波长为203 nm,大豆苷、葛根素芹菜糖苷、葛根素的定量波长为250 nm,山奈酚−3−O−芸香糖苷、阿魏酸、绿原酸、3′−甲氧基葛根素、3′−羟基葛根素的定量波长为280 nm,山奈酚的定量波长为365 nm。
2.1.2 流动相体系的选择
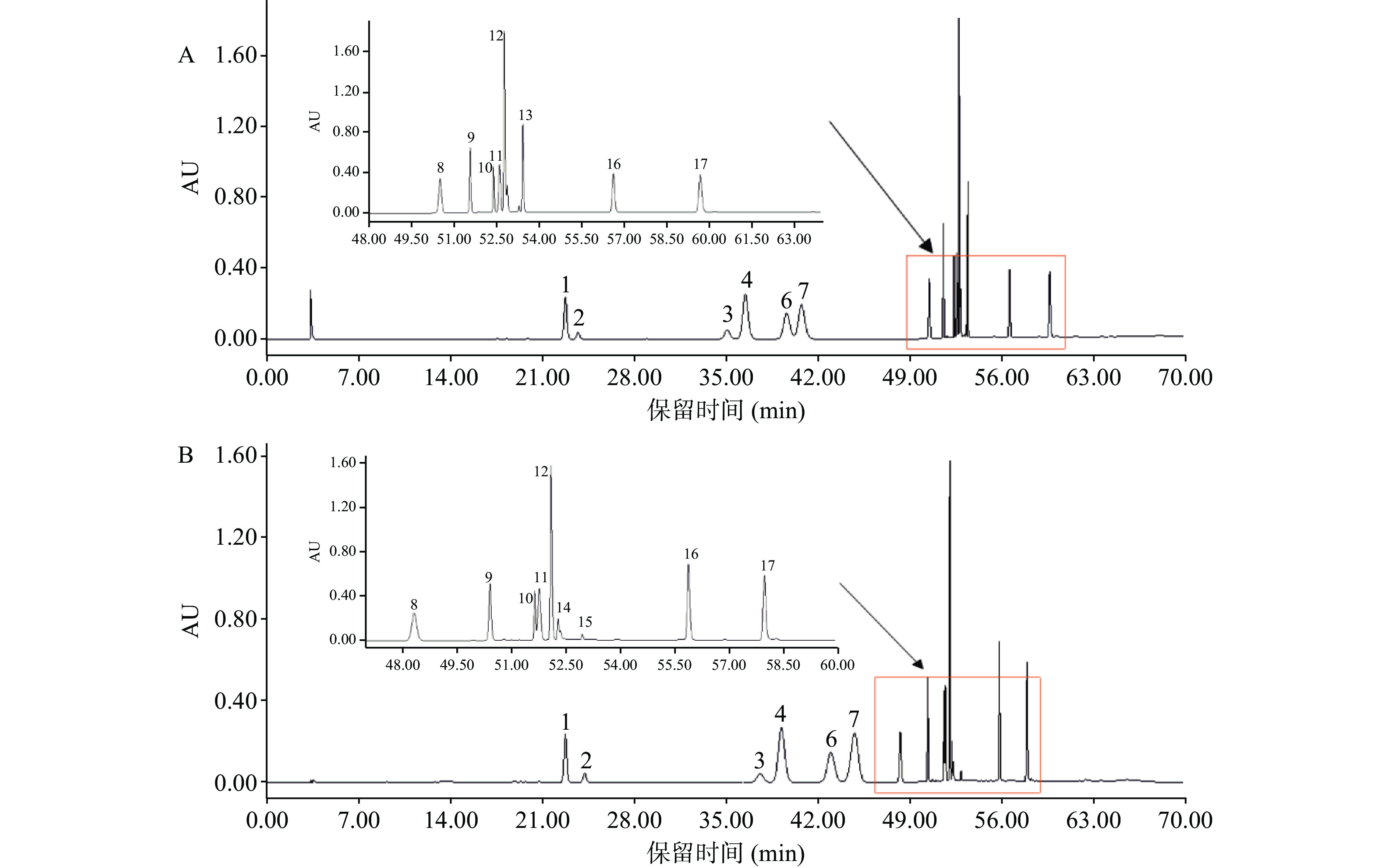
在乙腈−水流动相体系中添加酸性试剂可以抑制酚羟基、羧基类化合物发生电离,同时增大其分配系数,避免拖尾[23-25]。但实验初期选用乙腈−1%乙酸水溶液作为流动相时,罗汉果苷V、罗汉果苷IV均不出峰,见图2A,推测因乙酸的截止波长为230 nm与罗汉果苷的检测波长203 nm接近有关,改用乙腈−0.1%磷酸水溶液作流动相,发现罗汉果苷IV(峰15)、罗汉果苷V(峰14)正常出峰,见图2B。为保证罗汉果苷IV、V的峰响应,以0.1%磷酸水溶液作为流动相B,经查阅采用高效液相测定罗汉果苷的文献[26],本次试验流动相的配制与其相一致。
![]() 图 2 流动相添加乙酸、磷酸的色谱图注:A−流动相中加1%乙酸;B−流动相中加0.1%磷酸;1−3′−羟基葛根素;2−绿原酸;3−葛根素;4−表儿茶素;5−3′−甲氧基葛根素;6−儿茶素;7−葛根素芹菜糖苷;8−大豆苷;9−阿魏酸;10−异槲皮苷;11−芦丁;12−槲皮苷;13−山奈酚−3−O−芸香糖苷;14−罗汉果苷V;15−罗汉果苷IV;16−槲皮素;17−山奈酚,图3、图4同;A图中:4−表儿茶素/3′−甲氧基葛根素重合峰;B图中:12−槲皮苷/山奈酚−3−O−芸香糖苷重合峰。Figure 2. Chromatograms of acetic acid and phosphoric acid added to the mobile phase
图 2 流动相添加乙酸、磷酸的色谱图注:A−流动相中加1%乙酸;B−流动相中加0.1%磷酸;1−3′−羟基葛根素;2−绿原酸;3−葛根素;4−表儿茶素;5−3′−甲氧基葛根素;6−儿茶素;7−葛根素芹菜糖苷;8−大豆苷;9−阿魏酸;10−异槲皮苷;11−芦丁;12−槲皮苷;13−山奈酚−3−O−芸香糖苷;14−罗汉果苷V;15−罗汉果苷IV;16−槲皮素;17−山奈酚,图3、图4同;A图中:4−表儿茶素/3′−甲氧基葛根素重合峰;B图中:12−槲皮苷/山奈酚−3−O−芸香糖苷重合峰。Figure 2. Chromatograms of acetic acid and phosphoric acid added to the mobile phase2.1.3 洗脱条件的选择
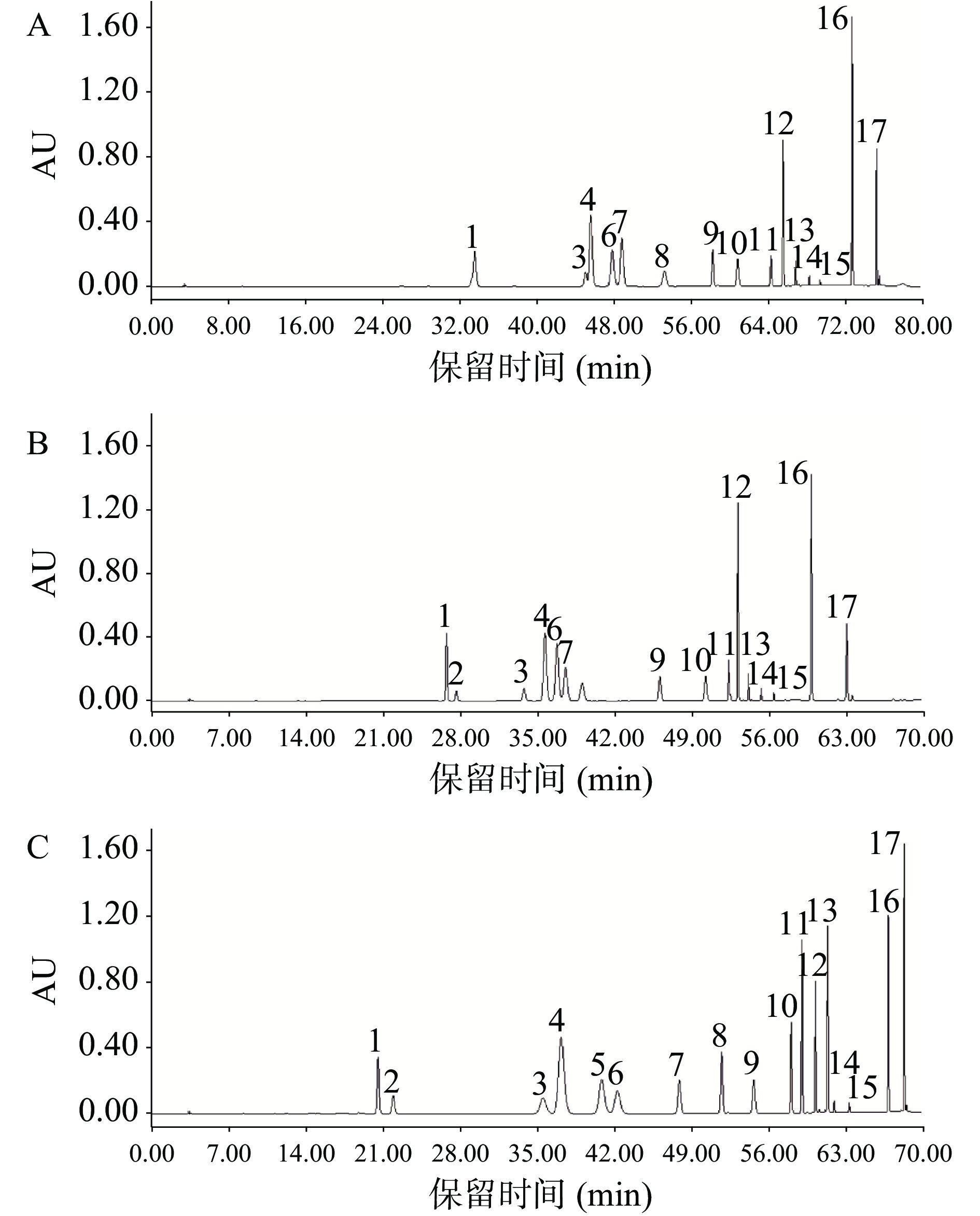
图3为3个典型洗脱梯度对应的色谱图。因17种活性成分在203 nm均有吸收,故以203 nm色谱图说明分离效果。采用梯度一洗脱,绿原酸与3′−羟基葛根素峰重合(峰1),根据单标的出峰顺序判断该洗脱梯度条件下绿原酸先出峰,葛根素(峰3)与重合峰(峰4)相连,重合峰(峰4)为表儿茶素与3′−甲氧基葛根素,见图3A。采用梯度二洗脱,各活性成分在70 min内全部出峰,相较于洗脱梯度一检测效率提高了,同时绿原酸(峰1)与3′−羟基葛根素(峰2)已分,葛根素(峰3)与重合峰(峰4)也已分离,流动相中不同比例的磷酸溶液会影响测定目标组分的保留时间[24],试验结果显示该洗脱条件下绿原酸的保留时间因流动相中磷酸比例的改变而延后,3′−羟基葛根素于绿原酸之前先出峰,但表儿茶素与3′−甲氧基葛根素(峰4)重合峰未见分离,结果见图3B。经多次调整洗脱梯度,表儿茶素与3′−甲氧基葛根素均未达到理想的分离效果,为满足分析需求,在保证各组分有效分离的前提下,采用梯度三洗脱,尝试在表儿茶素出峰前调整流动相比例,33 min流动相A从10.7%降至7.9%并保持3.5 min,结果表明,该洗脱条件能将重合峰表儿茶素与3′−甲氧基葛根素色谱峰分离且其他活性成分的色谱峰分离效果较好、峰形好,能达到分析要求,见图3C,后续采用洗脱梯度三进行定性定量。试验过程中有三组相邻且较难分离的物质组分,根据分离度计算公式(1),计算三个梯度相邻组分的分离度,结果见表2。
表 2 难分离物质组分的分离度Table 2. Separation of difficult to separate substance components难分离物质组分名称 分离度 梯度一 梯度二 梯度三 绿原酸/3′−羟基葛根素 0.28 1.51 1.57 葛根素/表儿茶素、3′−甲氧基葛根素 0.73 1.66 1.53 表儿茶素/3′−甲氧基葛根素 完全重合 完全重合 1.75 Rs=2×(tR1−tR2)/(Y1+Y2) (1) 式中:其中,Rs是两个相邻组分的分离度;
tR1 、tR2 和Y1、Y2分别为两组分的保留时间和峰宽。2.2 活性成分的定性
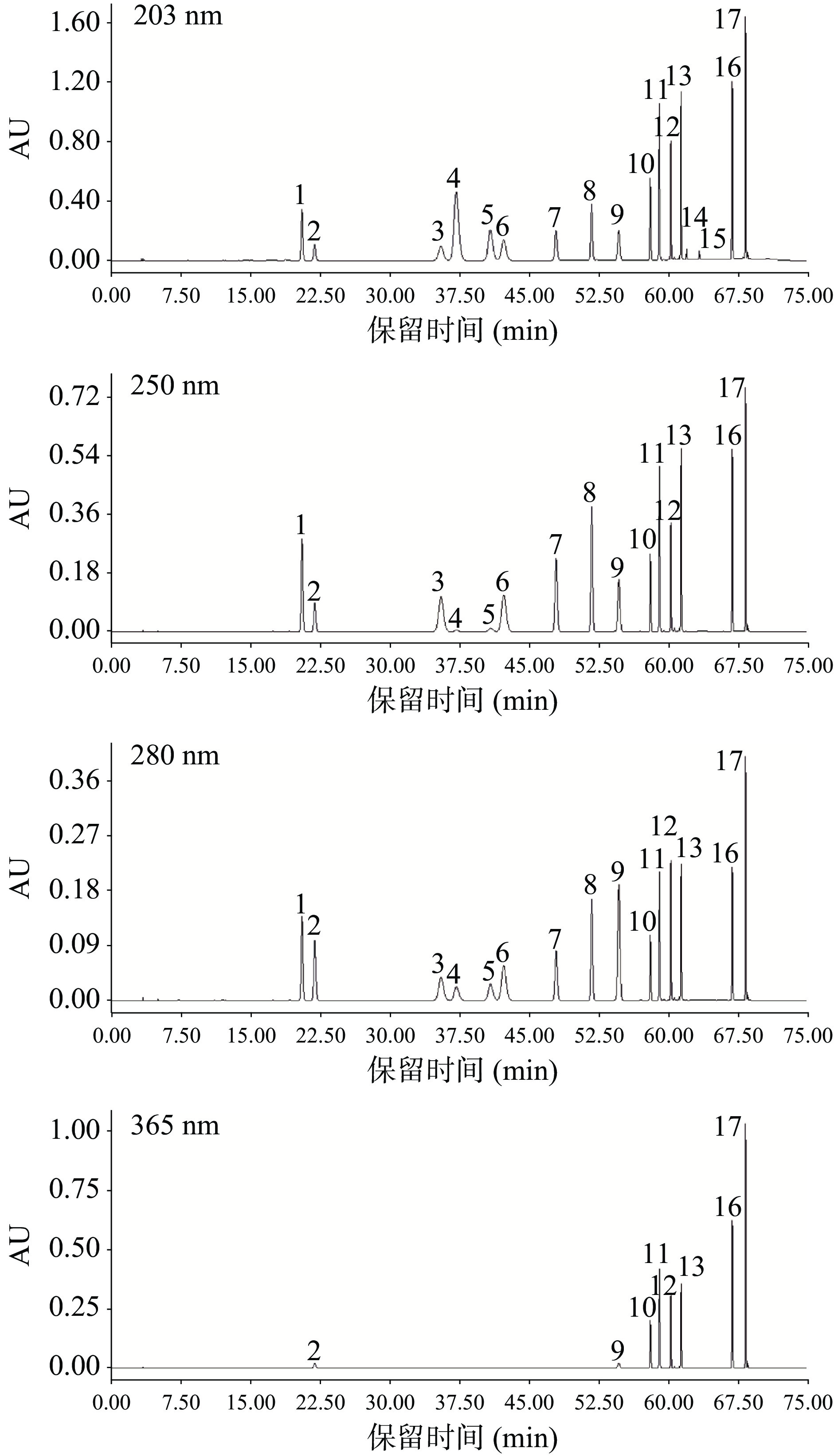
于203、250、280、365 nm测定波长下完成混合标准样品的定性,对应的色谱图见图4,保留时间见表3。由图4可知,在优化条件下,各活性成分峰形好、分离度高。
表 3 17种活性成分的保留时间、线性方程、线性范围、相关系数、检出限、定量限Table 3. The retention time, linear equation, ranges, correlation coefficients, detection limits and quantitative limits of 17 active ingredients组分名称 保留时间
(min)定量波长
(nm)线性方程 线性范围
(mg/L)相关系数
(r)检出限
(mg/L)定量限
(mg/L)3′−羟基葛根素 22.618 280 Y=2.85×104X 3~96 0.9984 0.08 0.26 绿原酸 23.626 280 Y=1.22×104X 4~128 0.9983 0.12 0.40 葛根素 34.778 250 Y=3.31×104X 4~128 0.9984 0.13 0.43 表儿茶素 36.197 203 Y=1.31×104X 2~64 0.9984 0.04 0.13 3′−甲氧基葛根素 42.463 280 Y=8.52×104X 2~64 0.9984 0.06 0.20 儿茶素 43.976 203 Y=3.92×104X 3~96 0.9984 0.06 0.20 葛根素芹菜糖苷 46.236 250 Y=3.33×104X 3~96 0.9983 0.07 0.23 大豆苷 48.421 250 Y=3.83×104X 2~64 0.9985 0.06 0.20 阿魏酸 50.847 280 Y=2.51×104X 4~128 0.9984 0.08 0.26 异槲皮苷 51.870 203 Y=3.92×104X 4~128 0.9984 0.03 0.10 芦丁 52.436 203 Y=4.76×104X 2~64 0.9978 0.04 0.13 槲皮苷 53.103 203 Y=2.23×104X 4~128 0.9986 0.05 0.16 山奈酚−3−O−芸香糖苷 54.716 280 Y=3.69×104X 4~128 0.9979 0.04 0.13 罗汉果苷V 56.557 203 Y=2.67×104X 4~128 0.9972 0.18 0.60 罗汉果苷IV 58.665 203 Y=4.15×104X 4~128 0.9952 0.15 0.50 槲皮素 63.149 203 Y=5.87×104X 3~96 0.9986 0.02 0.06 山奈酚 65.787 365 Y=5.74×104X 2~64 0.9996 0.01 0.03 2.3 标准曲线的建立及方法学考察
于优化色谱条件下测定混合标样溶液梯度1~6,以峰面积为纵坐标,浓度为横坐标,以线性过原点的方式建立标准曲线,并进行方法学考察。相关系数、线性范围、线性方程、检出限、定量限,见表3。由表3可知,17种活性成分在一定的线性范围内有较好的线性关系,相关系数r在0.9952~0.9996,检出限范围为0.01~0.18 mg/L,定量限为0.03~0.60 mg/L。
方法的重复性实验、精密度实验,结果见表4。对混合标准溶液进行6次平行测定,17种活性成分的精密度RSD在1.08%~3.86%之间。对6份样品进行测定,记录峰面积,计算得到3′−甲氧基葛根素、表儿茶素、儿茶素的含量低于检出限,其他活性成分RSD在2.03%~4.06%之间。说明该方法的精密度高、重复性好。
表 4 HPLC方法的重复性、精密度实验结果Table 4. Results of repeatability and precision obtained by HPLC样品名称 精密度RSD(%) 重复性RSD(%) 样品名称 精密度RSD(%) 重复性RSD(%) 3′−羟基葛根素 1.08 3.01 异槲皮苷 2.12 2.71 绿原酸 2.09 3.50 芦丁 1.39 2.39 葛根素 1.95 2.50 槲皮苷 2.49 3.37 表儿茶素 2.62 ND 山奈酚−3−O−芸香糖苷 1.68 2.62 3′−甲氧基葛根素 2.41 ND 罗汉果苷V 1.73 2.15 儿茶素 3.86 ND 罗汉果苷IV 1.85 3.08 葛根素芹菜糖苷 2.73 3.07 槲皮素 1.10 2.03 大豆苷 2.19 4.06 山奈酚 1.72 3.81 阿魏酸 1.33 2.57 注:ND表示含量低于检出限。 对低、中、高三种加标水平的样品进行测定,并计算加标回收率及RSD,结果见表5。由表5可知,17种活性成分的平均加标回收率为92.46%~106.25%,RSD为1.07%~4.56%,表明该方法回收率较好,结果准确可靠。
表 5 加标回收率实验结果Table 5. Results of recovery test样 品 名 称 加标样测定值(mg/mL)及回收率(%) 平均加标回收率
(%)RSD
(%)梯度1 回收率 梯度3 回收率 梯度6 回收率 3′−羟基葛根素 8.86 99.27 13.04 101.87 20.75 99.10 100.08 1.55 绿原酸 8.98 91.62 12.96 95.53 20.88 97.24 94.80 3.03 葛根素 11.00 104.25 14.92 98.45 23.09 100.33 101.01 2.92 表儿茶素 4.03 100.85 8.33 104.23 16.02 100.15 101.74 2.14 3′−甲氧基葛根素 4.15 103.92 8.41 105.15 16.10 100.66 103.24 2.24 儿茶素 4.33 108.37 8.70 108.80 16.25 101.60 106.25 3.80 葛根素芹菜糖苷 9.44 93.70 13.27 94.76 19.92 88.92 92.46 3.36 大豆苷 6.92 102.05 10.59 96.95 17.80 93.55 97.51 4.38 阿魏酸 32.59 105.97 36.25 98.70 44.07 98.23 100.96 4.30 异槲皮苷 41.50 100.27 44.97 93.51 52.73 95.28 96.35 3.63 芦丁 6.53 99.30 10.77 102.62 18.01 96.58 99.50 3.04 槲皮苷 9.29 90.42 13.06 92.28 21.02 95.88 92.86 2.99 山奈酚−3−O−芸香糖苷 10.29 98.80 14.51 102.16 22.09 98.41 99.79 2.06 罗汉果苷V 52.89 105.00 56.87 102.36 66.10 108.82 105.39 3.08 罗汉果苷IV 18.53 91.55 22.03 89.56 30.44 97.32 92.81 4.34 槲皮素 11.85 99.60 15.67 97.52 23.70 98.95 98.69 1.07 山奈酚 7.70 100.35 11.02 91.58 19.09 96.27 96.07 4.56 2.4 样品测定
于优化色谱条件下对天龙泉新款年份陶藏酒进行检测,从试验结果表6可知,新款年份陶藏酒14种活性成分检出并定量,表儿茶素、儿茶素、3′−甲氧基葛根素低于检出限,产品测定时未检出三种活性成分,可能与活性成分提取工艺或是产品的生产加工有关。经查阅了解葛根提取物中分布有多量的3′−甲氧基葛根素,苦荞麦提取物中也含有较多的表儿茶素、儿茶素[3-4],当使用不同的提取溶剂活性成分在提取物中的含量也会存在差异[27],而产品在生产过程也会因过滤等工序造成部分损失,因此新款年份陶藏酒中表儿茶素、儿茶素、3′−甲氧基葛根素含量偏低无检出。
表 6 天龙泉陶藏酒中各活性成分含量Table 6. Contents of active ingredients in Tianlongquan pithos-stored liquor样品名称 含量(mg/L) 3′−羟基葛根素 4.893±0.214 绿原酸 5.322±0.183 葛根素 7.044±0.322 表儿茶素 ND 3′−甲氧基葛根素 ND 儿茶素 ND 葛根素芹菜糖苷 5.695±0.212 大豆苷 2.839±0.112 阿魏酸 28.358±0.499 异槲皮苷 37.492±0.328 芦丁 2.560±0.121 槲皮苷 5.681±0.168 山奈酚−3−O−芸香糖苷 6.346±0.201 罗汉果苷V 48.690±0.443 罗汉果苷IV 14.869±0.075 槲皮素 7.868±0.179 山奈酚 3.694±0.084 注:ND表示含量低于检出限。 3. 结论
本文利用高效液相色谱法建立同时测定天龙泉新款年份陶藏酒中17种活性成分的定量方法,各活性成分检出限在0.01~0.18 mg/L范围内,定量限为0.03~0.60 mg/L,相关系数r>0.995,平均加标回收率在92.46%~106.25%之间,该方法精密度好、准确度高、测定效率高,有助于工厂在日常生产新款年份陶藏酒时对产品的质量进行监控,同时该方法还适用于检测陶藏同系列添加了罗汉果、葛根、苦荞麦提取物的产品,该方法为企业提供了有效的品控手段。采用方法对新款年份陶藏酒的活性成分进行测定,测得陶藏酒中含有较多的阿魏酸、异槲皮苷和罗汉果苷V,其含量均>20 mg/L,山奈酚、绿原酸、葛根素等11种活性成分的含量在2.560±0.121 ~14.869±0.075 mg/L范围内,因生产工艺等因素表儿茶素、儿茶素、3′−甲氧基葛根素含量较低,在成品中未检出。
-
图 2 流动相添加乙酸、磷酸的色谱图
注:A−流动相中加1%乙酸;B−流动相中加0.1%磷酸;1−3′−羟基葛根素;2−绿原酸;3−葛根素;4−表儿茶素;5−3′−甲氧基葛根素;6−儿茶素;7−葛根素芹菜糖苷;8−大豆苷;9−阿魏酸;10−异槲皮苷;11−芦丁;12−槲皮苷;13−山奈酚−3−O−芸香糖苷;14−罗汉果苷V;15−罗汉果苷IV;16−槲皮素;17−山奈酚,图3、图4同;A图中:4−表儿茶素/3′−甲氧基葛根素重合峰;B图中:12−槲皮苷/山奈酚−3−O−芸香糖苷重合峰。
Figure 2. Chromatograms of acetic acid and phosphoric acid added to the mobile phase
表 1 优化过程所采用的洗脱程序
Table 1 The eluent procedure used to optimize the process
梯度一 梯度二 梯度三 时间
(min)流动相
A(%)流动相
B(%)时间
(min)流动相
A(%)流动相
B(%)时间
(min)流动相
A(%)流动相
B(%)10.0 5.0 95.0 5.0 5.0 95.0 5.0 10.0 90.0 20.0 10.0 90.0 10.0 10.7 89.3 10.0 10.7 89.3 30.0 10.0 90.0 40.0 10.7 89.3 32.0 10.7 89.3 40.0 12.0 88.0 45.0 14.0 86.0 33.0 7.9 92.1 50.0 12.0 88.0 58.0 20.0 80.0 36.5 7.9 92.1 55.0 18.0 82.0 68.0 78.0 62.0 45.0 20.0 80.0 60.0 20.0 80.0 70.0 60.0 40.0 53.0 25.0 75.0 68.0 38.0 62.0 72.0 0.0 100.0 60.0 40.0 60.0 71.0 45.0 55.0 75.0 0.0 100.0 65.0 60.0 40.0 73.0 60.0 40.0 70.0 0.0 100.0 75.0 0.0 100.0 75.0 0.0 100.0 80.0 0.0 100.0 表 2 难分离物质组分的分离度
Table 2 Separation of difficult to separate substance components
难分离物质组分名称 分离度 梯度一 梯度二 梯度三 绿原酸/3′−羟基葛根素 0.28 1.51 1.57 葛根素/表儿茶素、3′−甲氧基葛根素 0.73 1.66 1.53 表儿茶素/3′−甲氧基葛根素 完全重合 完全重合 1.75 表 3 17种活性成分的保留时间、线性方程、线性范围、相关系数、检出限、定量限
Table 3 The retention time, linear equation, ranges, correlation coefficients, detection limits and quantitative limits of 17 active ingredients
组分名称 保留时间
(min)定量波长
(nm)线性方程 线性范围
(mg/L)相关系数
(r)检出限
(mg/L)定量限
(mg/L)3′−羟基葛根素 22.618 280 Y=2.85×104X 3~96 0.9984 0.08 0.26 绿原酸 23.626 280 Y=1.22×104X 4~128 0.9983 0.12 0.40 葛根素 34.778 250 Y=3.31×104X 4~128 0.9984 0.13 0.43 表儿茶素 36.197 203 Y=1.31×104X 2~64 0.9984 0.04 0.13 3′−甲氧基葛根素 42.463 280 Y=8.52×104X 2~64 0.9984 0.06 0.20 儿茶素 43.976 203 Y=3.92×104X 3~96 0.9984 0.06 0.20 葛根素芹菜糖苷 46.236 250 Y=3.33×104X 3~96 0.9983 0.07 0.23 大豆苷 48.421 250 Y=3.83×104X 2~64 0.9985 0.06 0.20 阿魏酸 50.847 280 Y=2.51×104X 4~128 0.9984 0.08 0.26 异槲皮苷 51.870 203 Y=3.92×104X 4~128 0.9984 0.03 0.10 芦丁 52.436 203 Y=4.76×104X 2~64 0.9978 0.04 0.13 槲皮苷 53.103 203 Y=2.23×104X 4~128 0.9986 0.05 0.16 山奈酚−3−O−芸香糖苷 54.716 280 Y=3.69×104X 4~128 0.9979 0.04 0.13 罗汉果苷V 56.557 203 Y=2.67×104X 4~128 0.9972 0.18 0.60 罗汉果苷IV 58.665 203 Y=4.15×104X 4~128 0.9952 0.15 0.50 槲皮素 63.149 203 Y=5.87×104X 3~96 0.9986 0.02 0.06 山奈酚 65.787 365 Y=5.74×104X 2~64 0.9996 0.01 0.03 表 4 HPLC方法的重复性、精密度实验结果
Table 4 Results of repeatability and precision obtained by HPLC
样品名称 精密度RSD(%) 重复性RSD(%) 样品名称 精密度RSD(%) 重复性RSD(%) 3′−羟基葛根素 1.08 3.01 异槲皮苷 2.12 2.71 绿原酸 2.09 3.50 芦丁 1.39 2.39 葛根素 1.95 2.50 槲皮苷 2.49 3.37 表儿茶素 2.62 ND 山奈酚−3−O−芸香糖苷 1.68 2.62 3′−甲氧基葛根素 2.41 ND 罗汉果苷V 1.73 2.15 儿茶素 3.86 ND 罗汉果苷IV 1.85 3.08 葛根素芹菜糖苷 2.73 3.07 槲皮素 1.10 2.03 大豆苷 2.19 4.06 山奈酚 1.72 3.81 阿魏酸 1.33 2.57 注:ND表示含量低于检出限。 表 5 加标回收率实验结果
Table 5 Results of recovery test
样 品 名 称 加标样测定值(mg/mL)及回收率(%) 平均加标回收率
(%)RSD
(%)梯度1 回收率 梯度3 回收率 梯度6 回收率 3′−羟基葛根素 8.86 99.27 13.04 101.87 20.75 99.10 100.08 1.55 绿原酸 8.98 91.62 12.96 95.53 20.88 97.24 94.80 3.03 葛根素 11.00 104.25 14.92 98.45 23.09 100.33 101.01 2.92 表儿茶素 4.03 100.85 8.33 104.23 16.02 100.15 101.74 2.14 3′−甲氧基葛根素 4.15 103.92 8.41 105.15 16.10 100.66 103.24 2.24 儿茶素 4.33 108.37 8.70 108.80 16.25 101.60 106.25 3.80 葛根素芹菜糖苷 9.44 93.70 13.27 94.76 19.92 88.92 92.46 3.36 大豆苷 6.92 102.05 10.59 96.95 17.80 93.55 97.51 4.38 阿魏酸 32.59 105.97 36.25 98.70 44.07 98.23 100.96 4.30 异槲皮苷 41.50 100.27 44.97 93.51 52.73 95.28 96.35 3.63 芦丁 6.53 99.30 10.77 102.62 18.01 96.58 99.50 3.04 槲皮苷 9.29 90.42 13.06 92.28 21.02 95.88 92.86 2.99 山奈酚−3−O−芸香糖苷 10.29 98.80 14.51 102.16 22.09 98.41 99.79 2.06 罗汉果苷V 52.89 105.00 56.87 102.36 66.10 108.82 105.39 3.08 罗汉果苷IV 18.53 91.55 22.03 89.56 30.44 97.32 92.81 4.34 槲皮素 11.85 99.60 15.67 97.52 23.70 98.95 98.69 1.07 山奈酚 7.70 100.35 11.02 91.58 19.09 96.27 96.07 4.56 表 6 天龙泉陶藏酒中各活性成分含量
Table 6 Contents of active ingredients in Tianlongquan pithos-stored liquor
样品名称 含量(mg/L) 3′−羟基葛根素 4.893±0.214 绿原酸 5.322±0.183 葛根素 7.044±0.322 表儿茶素 ND 3′−甲氧基葛根素 ND 儿茶素 ND 葛根素芹菜糖苷 5.695±0.212 大豆苷 2.839±0.112 阿魏酸 28.358±0.499 异槲皮苷 37.492±0.328 芦丁 2.560±0.121 槲皮苷 5.681±0.168 山奈酚−3−O−芸香糖苷 6.346±0.201 罗汉果苷V 48.690±0.443 罗汉果苷IV 14.869±0.075 槲皮素 7.868±0.179 山奈酚 3.694±0.084 注:ND表示含量低于检出限。 -
[1] ZATOŃSKA K, PSIKUS P, BASIAK-RASAŁA A, et al. Patterns of alcohol consumption in the pure poland cohort study and their relationship with health problems[J]. International Journal of Environmental Research and Public Health,2021,18(8):4185. doi: 10.3390/ijerph18084185
[2] 陆佳玲, 陈双, 徐岩. 清香型白酒降度过程中香气感知特征及风味组分挥发性变化规律[J]. 食品与发酵工业,2021,47(15):36−42. [LU J L, CHEN S, XU Y. Changes of aroma perception and flavor component volatility in the process of dilution in Chinese light-flavor Baijiu[J]. Food and Fermentation Industries,2021,47(15):36−42. doi: 10.13995/j.cnki.11-1802/ts.027157 [3] SHIMOGA G, KIM S. Makgeolli-the traditional choice of korean fermented beverage from cereal: An overview on its composition and health benefits[J]. Food Science and Technology,2022(7):42.
[4] MARTÍNEZ-FRANCÉS V, RIVERA D, OBON C, et al. Medicinal plants in traditional herbal wines and liquors in the east of Spain and the Balearic islands[J]. Frontiers in Pharmacology,2021:12.
[5] 王辉晖. 椰岛鹿龟酒、劲酒、黄金酒、毛铺苦荞酒电视广告变迁分析[J]. 现代商贸工业,2018,39(36):64−65. [WANG H H. Analysis of Chinese Jing liqueur, Yedaolugui alcohol and Huangjin liquors, Maopu tartary buckwheat TV advertisement change[J]. Modern Business Trade Industry,2018,39(36):64−65. doi: 10.19311/j.cnki.1672-3198.2018.36.032 [6] XU X, GUO Y, CHEN S, et al. The positive influence of polyphenols extracted from Pueraria Lobata root on the gut microbiota and its antioxidant capability[J]. Frontiers in Nutrition,2022:9.
[7] BHUSARI S, RODRIGUEZ C, TARKA S M, et al. Comparative in vitro metabolism of purified mogrosides derived from monk fruit extracts[J]. Regulatory Toxicology and Pharmacology,2021,120:104856. doi: 10.1016/j.yrtph.2020.104856
[8] LI J, GONG Y, LI J, et al. In vitro inhibitory effects of polyphenols from tartary buckwheat on xanthine oxidase: Identification, inhibitory activity, and action mechanism[J]. Food Chemistry,2022,379:132100. doi: 10.1016/j.foodchem.2022.132100
[9] BING X, LI F, FANG R, et al. Pharmacokinetic profiles of the five isoflavonoids from pueraria lobata roots in the CSF and plasma of rats[J]. Journal of Ethnopharmacology,2016,184:22−29. doi: 10.1016/j.jep.2016.02.027
[10] YING J S, HONG M Z, MING C, et al. New hepatoprotective isoflavone glucosides from Pueraria lobata (Willd.) Ohwi[J]. Natural Product Research,2019,33(24):3485−3492. doi: 10.1080/14786419.2018.1484461
[11] ZOU L, WU D, REN G, et al. Bioactive compounds, health benefits, and industrial applications of tartary buckwheat (Fagopyrum tataricum)[J]. Crit Rev Food Sci Nutr,2021:1−17.
[12] TONG S, JUAN W, YISA L, et al. A combined transcriptomic and proteomic approach to reveal the effect of mogroside on OVA-Induced pulmonary inflammation in mice[J]. Frontiers,2022,13:800143.
[13] 倪书干, 杨强, 童国强, 等. 添加藤茶提取物的配制酒货架期稳定性研究[J]. 酿酒科技,2020(3):57−60. [NI S G, YANG Q, TONG G Q, et al. stability of liqueur with addition of vine tea extract during shelf period[J]. Liquor-Making Science & Technology,2020(3):57−60. doi: 10.13746/j.njkj.2019271 [14] HU Y, WANG Z, LIU J, et al. Chemical stability of a Chinese herbal spirit using lc-ms-based metabolomics and accelerated tests[J]. Frontiers in Pharmacology,2022:13.
[15] DHANALAKSHMI M, THANGADURAI S. Antioxidant and anticancer activities of whole plant extracts of Lepidagathis pungens Nees: In vitro evaluation[J]. Pharmacognosy Magazine,2021,17(5):63. doi: 10.4103/pm.pm_356_20
[16] OSHIMA N, SAITO M, NIINO M, et al. Elucidation of chemical interactions between crude drugs using quantitative thin-layer chromatography analysis[J]. Molecules,2022,27(3):593. doi: 10.3390/molecules27030593
[17] SEO C, SHIN H. Simultaneous analysis for quality control of traditional herbal medicine, gungha-tang, using liquid chromatography-tandem mass spectrometry[J]. Molecules,2022,27(4):1223. doi: 10.3390/molecules27041223
[18] SEO J I, YU J S, LEE E K, et al. Molecular networking-guided strategy for the pharmacokinetic study of herbal medicines: Cudrania tricuspidata leaf extracts[J]. Biomedicine & Pharmacotherapy,2022,149:112895.
[19] 梁冬松, 王芳, 韦炎冶, 等. 高效液相色谱法同时测定发酵前后白参菌茶中六种活性成分[J]. 食品与发酵工业,2020,46(8):234−238. [LIANG D S, WAGN F, WEI Y Y, et al. Simultaneous determination of changes in six active ingredients in Schizophyllum communeh fermented tea by HPLC[J]. Food and Fermentation Industries,2020,46(8):234−238. doi: 10.13995/j.cnki.11-1802/ts.022589 [20] 费璠, 张梓莹, 胡松, 等. HPLC同时检测红茶中儿茶素和茶黄素含量[J]. 食品与发酵工业,2022,48(5):275−280. [FEI F, ZHAGN Z Y, HU S, et al. Simultaneous determination of catechins and theaflavins in black tea based on HPLC[J]. Food and Fermentation Industries,2022,48(5):275−280. doi: 10.13995/j.cnki.11-1802/ts.028906 [21] KOLEVA P, TSANOVA-SAVOVA S, PANEVA S, et al. Polyphenols content of selected medical plants and food supplements present at Bulgarian market[J]. Pharmacia,2021,68(4):819−826. doi: 10.3897/pharmacia.68.e71460
[22] KAMAL Y T, AHMAD S, MAHADEVAN N, et al. Separation and quantification of nine bioactive compounds in traditional Unani formulations by high performance liquid chromatography-photodiode array detector[J]. Acta Chromatographica,2020,33(1):3−10. doi: 10.1556/1326.2020.00696
[23] REN Q, WU C, ZHANG J. Use of on-line stop-flow heart-cutting two-dimensional high performance liquid chromatography for simultaneous determination of 12 major constituents in tartary buckwheat (Fagopyrum tataricum Gaertn)[J]. Journal of Chromatography A,2013,1304:257−262. doi: 10.1016/j.chroma.2013.07.008
[24] 杨沙, 向丽萍, 凌蕾, 等. HPLC法同时测定赤水晒醋中的6种功能性成分[J]. 食品工业科技,2021,42(3):247−252. [YANG S, XIANG L P, LING L, et al. Simultaneous determination of six functional components in Chishui sun vinegar by RP-HPLC[J]. Science and Technology of Food Industry,2021,42(3):247−252. [25] 匡凤元, 吴光斌, 张珅, 等. HPLC法同时测定采后莲雾果实木质素代谢途径中5种酚酸的含量[J]. 食品科学,2020,41(8):165−170. [KUANG F Y, WU G B, ZHANG S, et al. Simultaneous determination of 5 phenolic acids involved in the phenylpropanoid pathway of postharvest wax apple (Syzygium samarangenese [Blume] Merrill & L. M. Perry) by high performance liquid chromatography[J]. Food Science,2020,41(8):165−170. [26] 柳俊, 李汉西, 黄琪评, 等. HPLC测定特殊医学用途电解质配方食品中罗汉果甜苷Ⅴ含量[J]. 食品与药品,2021,23(3):258−261. [LIU J, LI H X, HUANG Q P, et al. Determination of mogroside V in electrolyte formula foods for special medical purpose by HPLC[J]. Food and Drug,2021,23(3):258−261. doi: 10.3969/j.issn.1672-979X.2021.03.016 [27] NOORE S, JOSHI A, KUMARI B, et al. Effects of novel extraction strategies on the recovery of phenolic compounds and associated antioxidant properties from buckwheat hull (Fagopyrum esculentum)[J]. Processes,2022,10(2):365. doi: 10.3390/pr10020365
-
期刊类型引用(8)
1. 吕广英,韩晓宇,樊军浩,王泊然. 儿童低糖保健饼干的配方研究. 江苏调味副食品. 2025(01): 23-25 .  百度学术
百度学术
2. 米合热阿依·阿不都热合曼,米叶色尔·吐逊. 烘焙技术在健康食品生产中的应用探索. 现代食品. 2024(10): 121-123 .  百度学术
百度学术
3. 左丹,赵开飞. 功能性成分在烘焙制品中的应用与研究进展. 食品工业. 2024(07): 229-234 .  百度学术
百度学术
4. 胡志高. 焙烤食品的营养成分分析及安全管控研究. 中外食品工业. 2024(10): 22-24 .  百度学术
百度学术
5. 孟庆,孙亚楠. 烘焙食品中天然抗氧化剂的应用及其对保质期的影响. 现代食品. 2024(22): 156-158 .  百度学术
百度学术
6. 刘婉,田菊平. 高糖饮食危害及西点减糖策略研究. 食品安全导刊. 2023(18): 175-178 .  百度学术
百度学术
7. 严玮一. 食品中甜味剂的前处理与检测技术现状. 食品安全导刊. 2023(19): 177-179 .  百度学术
百度学术
8. 李守宏,王雅珍,徐清. 专用酶制剂降低面包中油脂添加量的研究. 现代面粉工业. 2023(05): 26-29 .  百度学术
百度学术
其他类型引用(5)





 下载:
下载:



 下载:
下载:
