Simultaneous Determination of 8 Mycotoxins in Aquatic Products by Liquid Chromatography-Tandem Mass Spectrometry Coupled with Immunoaffinity Column Clean-up
-
摘要: 目的:建立免疫亲和柱净化-液相色谱-串联质谱法(LC-MS/MS)同时测定水产品中8种霉菌毒素残留。方法:样品经乙腈水溶液(84:16,V:V)提取,多毒素免疫亲和柱净化。色谱柱为Agilent Proshell 120 SB·C18(2.1 mm×100 mm,2.7 μm),流动相为甲醇-5 mmol/L乙酸铵(含0.1%甲酸),梯度洗脱,流速为0.4 mL/min,柱温为40 ℃。采用电喷雾离子源正负离子同时扫描,多反应监测模式(MRM)进行质谱检测。结果:8种霉菌毒素在1.0~50.0 ng/mL范围内线性关系良好(R2>0.992),方法检出限在0.05~0.50 μg/kg之间,定量限在0.17~1.65 μg/kg之间;8种霉菌毒素加标回收率在75.6%~106.3%之间,相对标准偏差(RSD)为3.5%~9.3%。结论:该方法操作便捷、灵敏度高、准确可靠,能满足水产品中多种霉菌毒素残留快速检测需求。
-
关键词:
- 霉菌毒素 /
- 水产品 /
- 液相色谱-串联质谱法 /
- 免疫亲和柱
Abstract: Objective: A liquid chromatography-tandem mass spectrometry coupled with immunoaffinity column clean-up method was established for the determination of 8 mycotoxins in aquatic products. Methods: The samples were extracted with acetonitrile water (84:16, V:V), and purified by multifunctional immunoaffinity columns. The chromatographic column was Agilent Proshell 120 SB·C18 column (2.1 mm×100 mm, 2.7 μm). Mobile phase was methanol and 5 mmol/L ammonium acetate (containing 0.1% formic acid), gradient elution. The flow rate was 0.4 mL/min, and the column temperature was 40 ℃. The electrospray was operated in both positive and negative mode at the same time, and the samples were detected by multiple reaction monitoring mode (MRM). Results: The linear relations of the eight mycotoxins were good within the concentration range of 1.0~50.0 ng/mL (R2>0.992). The limits of detection were between 0.05~0.50 μg/kg, and the limits of quantification were between 0.17~1.65 μg/kg. The average recoveries were 75.6%~106.3%, and the relative standard deviations (RSDs) were 3.5%~9.3%. Conclusion: The method is simple, sensitive and accurate for the rapid analysis of mycotoxin residues in aquatic products. -
霉菌毒素是一类由产毒真菌代谢产生的有毒代谢产物,目前已发现400余种[1],其中黄曲霉毒素B1(Aflatoxins B1,AFB1)、伏马毒素(Fumonisins,FBs)、T-2毒素(T-2 toxin,T-2)等霉菌毒素因存在普遍、污染能力强,对畜禽产品、饲料及饲料原料等安全危害大而被广泛重视[2-5]。随着植物性饲料在水产养殖中的广泛使用,霉菌毒素对水产养殖及水产品质量安全的风险随之提高。黄莹等[6]的研究显示在给花鳗鲡幼鱼饲喂含有不同浓度的AFB1饲料56 d后发现,当饲料中的AFB1≥1 mg/kg时,花鳗鲡的摄食率、特定生长率以及终末体重有显著下降;Maciej等[7]研究显示在饲喂含有玉米赤霉烯酮(Zearalenone,ZEN)的饲料后会造成虹鳟性腺发育异常、后代死亡率增加以及干扰其性别分化,此外Zeng等[8]的研究表明,当饲料中AFB1水平达到或超过59 μg/kg,饲喂60 d后草鱼的头肾和脾脏中AFB1残留量呈线性增加。目前国内外针对食品(包括食用农产品)及饲料中的霉菌毒素含量均做了严格规定[9-12],但对于水产品中霉菌毒素残留限量缺乏规定,如欧盟规定在食用玉米或其作为食品配料时,其中的AFB1不能超过5 μg/kg;美国限定成年猪玉米和花生制品饲料中四种黄曲霉毒素的总量不应超过200 μg/kg;此外,我国在GB 2761-2017《食品安全国家标准 食品中真菌毒素限量》[13]中限定了各种饲料及饲料原料中AFB1应在10~50 μg/kg以下。
目前霉菌毒素的检测技术主要有酶联免疫法(Enzyme linked immunosorbent assay,ELISA)、高效液相色谱(High performance liquid chromatography,HPLC)、液质联用技术(Liquid chromatography tandem mass spectrometry,LC-MS/MS)等[14-16],其中液质联用技术相对于ELISA法和高效液相色谱法具有灵敏度高、重现性和选择性高等特点,可以满足食品中霉菌毒素同时定性定量检测的要求,但现有的这些方法主要针对粮油、饲料及其饲料原料、畜禽产品和乳制品等,尚未见针对水产品中的霉菌毒素残留检测方法的标准,而已发表的有关水产品中霉菌毒素的检测方法中,王小博等[17]的研究建立了液相色谱-串联质谱测定水产品中的T-2和HT-2的方法,只针对两种霉菌毒素,无法实现多种霉菌毒素的检测。而李向丽等[18]的研究中建立的多功能柱净化-超高效液相色谱串联质谱法同时测定水产品中11种真菌毒素的方法,前处理过程需要对样品进行酶解,操作繁琐,耗时超过12 h。
由于水产品种类繁多、基质成分复杂、净化难度较大,因此在样品净化时常采用固相萃取柱、QuEChERS法等,而相对于多毒素免疫亲和柱而言,对个别或少量霉菌毒素具有较好的净化效果,但面临较多霉菌毒素时其净化能力有限[19-20]的问题。免疫亲和柱能够利用生物抗原、抗体间高度特异性的亲和力将多种霉菌毒素与杂质分离开[21],可有效降低基质对检测结果的影响,因此本实验拟采用多毒素免疫亲和柱净化与液质联用技术,同时测定水产品中黄曲霉毒素、伏马毒素和T-2毒素等8种霉菌毒素残留的含量,以期为不同水产品中霉菌毒素残留的检测提供便捷、精准度高的方法参考。
1. 材料与方法
1.1 材料与仪器
AFB1标准品 含量≥99%,以色列FERMENTEK公司;伏马毒素B1(Fumonisin B1,FB1,50 μg/mL)、伏马毒素B2(Fumonisin B2,FB2,50 μg/mL)、伏马毒素B3(Fumonisin B3,FB3,50.2 μg/mL)、T-2毒素(T-2 toxin,100 μg/mL)、玉米赤霉烯酮(Zearalenone,ZEN,100 μg/mL)、脱氧雪腐镰刀菌烯醇(Deoxynivalenol,DON,100 μg/mL)、赭曲霉毒素A(Ochratoxin A,OTA,10 μg/mL) 均为标准储备液,购自美国Romer公司;甲醇、乙腈 色谱纯,德国Merck公司;甲酸 色谱纯,美国Tedia公司;PBST缓冲液速溶颗粒 pH7.4,上海睿玥实验器材有限公司;MultiStarTM多毒素免疫亲和柱(0.5 mL/3 mL) 美国Romer公司;Oasis HLB固相萃取柱(500 mg/6 mL)、Oasis PRIME HLB固相萃取小柱(150 mg/6 mL) 美国Waters公司;草鱼(Ctenopharyngodon idella)、南美白对虾(Litopenaeus vannamei)、中华绒螯蟹(Eriocheir sinensis) 均购自农贸市场。
Triple Quad 5500型液相色谱-三重四极杆质谱联用仪 美国AB SCIEX公司;CB-2008高速组织捣碎机 上海测博生物科技发展中心;DMT-2500型涡旋混合器 常州金坛良友仪器有限公司Allegra X-64R型高速冷冻离心机 美国Beckman Coulter公司;BSA224型电子天平 德国Sartorius公司;Turbo Vap LV型全自动氮吹浓缩仪 瑞典Biotage公司;Milli-Q IQ700型超纯水系统 美国Millipore公司。
1.2 实验方法
1.2.1 标准溶液配制
AFB1标准储备液:称取5 mg AFB1标准品于50 mL容量瓶内,用甲醇定容至100 mg/L,−20 ℃保存。
中间标准溶液:分别精确移取8种霉菌毒素储备液于100 mL容量瓶中,用甲醇配制成1 mg/L的混合中间标准溶液,−20 ℃保存。
标准工作溶液:采用逐步稀释的方式,以50:50(V:V)的甲醇水分别配制成1、5、10、20、50 μg/L的标准工作溶液,临用现配。
1.2.2 样品前处理
参考王瑞国等[22]对饲料中5种霉菌毒素的前处理方法,并在此基础上采用多毒素免疫亲和柱作为净化方法,并考虑了基质效应的影响。
草鱼、南美白对虾、中华绒螯蟹取可食用部分匀浆,−20 ℃保存,检测时,室温解冻。准确称取样品2 g(精确到0.01 g)于50 mL聚乙烯离心管中,加入10 mL乙腈-水溶液(84:16,V:V)涡旋(2000 r/min)10 min后,离心10 min(10000 r/min),取1 mL离心后的上清液加PBST缓冲液(pH7.4)10 mL稀释后过多毒素免疫亲和柱净化(速度控制在1~3 mL/min),5 mL去离子水淋洗(中华绒螯蟹样品用PBST缓冲液进行淋洗),3 mL甲醇/乙酸(98:2,V:V)溶液洗脱。洗脱液45 ℃氮吹至近干,加入1 mL甲醇-水溶液(90:10,V:V)溶解,涡旋1 min,过0.22 μm尼龙滤膜,待测。
1.2.3 基质效应评价方法
选取不含待测物的草鱼、南美白对虾、中华绒螯蟹空白基质,按1.2.2方法操作得到空白基质液。分别用空白基质液和50:50(V:V)甲醇水配制成1、5、10、20、50 μg/L的标准工作溶液,上机检测得到标准曲线,通过标准曲线斜率比值评价基质效应的大小[23]。
1.2.4 色谱条件
色谱柱:Agilent Proshell 120 SB·C18色谱柱(2.1 mm×100 mm,2.7 μm);柱温:35 ℃;流速:0.4 mL/min;进样量:2.0 μL;流动相A:5 mmol/L乙酸铵溶液(含0.1%的甲酸),B为甲醇;梯度洗脱程序见表1。
表 1 流动相梯度洗脱程序Table 1. The program of mobile phase gradient elution时间(min) A(%) B(%) 0.00 95.0 5.0 1.00 95.0 5.0 3.00 35.0 65.0 6.00 5.0 95.0 7.50 5.0 95.0 7.60 95.0 5.0 10.00 95.0 5.0 1.2.5 质谱条件
离子源:电喷雾离子源(ESI);扫描方式:正负离子同时扫描;监测方式:多反应监测模式(MRM);喷雾电压:5500 V(ESI+),−4500 V(ESI−);离子源温度:550 ℃;气帘气压力:30 psi;喷雾气压力:55 psi;辅助雾化气压力:65 psi;射入电压:10 V,−10 V;射出电压:15 V,−10 V,质谱参数详见表2。
表 2 8种霉菌毒素的质谱参数Table 2. Mass spectrometry parameters of 8 mycotoxins毒素名称 扫描方式 母离子
(m/z)子离子
(m/z)碰撞能量
(eV)去簇电压
(V)AFB1 ESI+ 313.1 285.2* 33 100 241.1 52 100 FB1 ESI+ 722.4 352.3* 50 50 334.3 57 50 FB2 ESI+ 706.4 336.5* 49 50 318.2 55 50 FB3 ESI+ 706.4 336.5 50 50 318.4* 51 50 T-2 ESI+ 484.2 305.3* 18 40 185.2 31 40 DON ESI+ 297.0 249.1* 12 60 231.0 18 60 ZEN ESI− 317.1 131.2* −39 −50 175.0 −34 −50 OTA ESI− 402.1 358.2* −27 −100 166.9 −47 −80 注:*为定量离子。 1.3 数据处理
本试验所得数据由Analyst 1.6.3采集,由数据处理软件Multi Quant 3.0.3处理并建立曲线所得,图谱由Origin 8.5绘制,图表及其中数据由Microsoft Excel 2013处理绘制。本文提取溶剂、净化柱的选择,基质效应、加标回收率试验均采用三个样品作为平行,样品数据以平均值±标准差形式表示。
2. 结果与分析
2.1 色谱条件优化
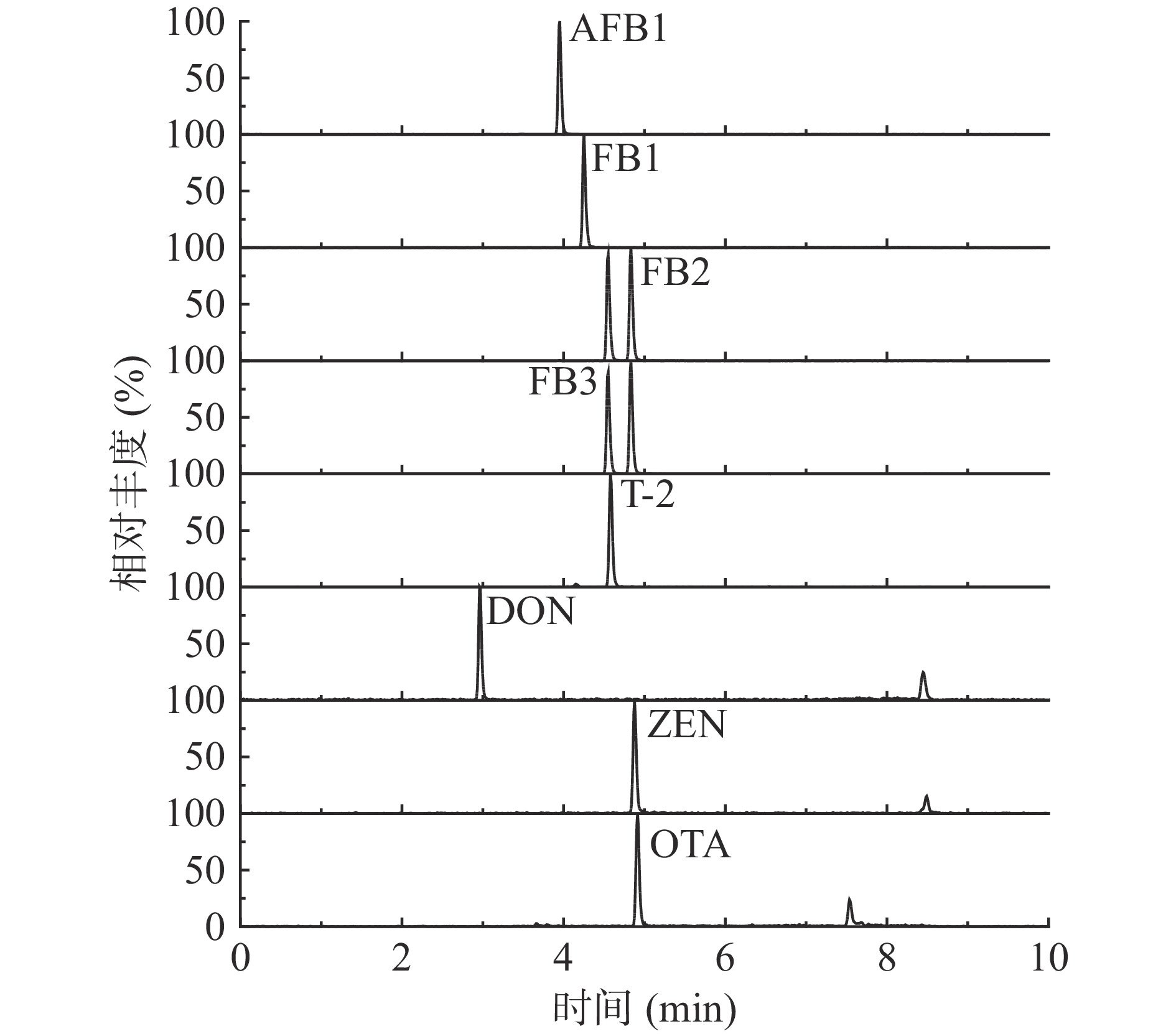
液相色谱-串联质谱法检测样品时,流动相的组成与配比会影响目标化合物的离子化效率和色谱峰峰形[24]。有研究表明,乙腈洗脱能力较强,但对目标物与干扰物的分离效果不如甲醇,故本试验选择甲醇作为流动相中的有机相[25]。本研究将甲醇与纯水、0.1%甲酸水、5 mmol/L乙酸铵、5 mmol/L乙酸铵(含0.1%甲酸)组成的不同流动相体系下的分离效果进行比较。结果显示,流动相中添加甲酸后,H+浓度增加,使得正离子扫描模式下目标物的离子化效率提高。同时添加乙酸铵后,乙酸铵水解呈弱碱性,可提高负离子的响应强度并改善峰形。因此最终选择甲醇-5 mmol/L乙酸铵(含0.1%甲酸)流动相。8种霉菌毒素提取离子色谱见图1。
2.2 质谱条件的优化
本研究将8种100 μg/L混合霉菌毒素标准溶液分别由注射泵导入质谱仪,在正、负离子模式下分别扫描,结果发现AFB1、FB1、FB2、FB3、DON正离子模式下易形成[M+H]+峰,且信号强度高,T-2易形成[M+NH4]+峰;ZEN、OTA则在负离子模式下易形成[M-H]−峰。通过调整优化碰撞能量(CE)和去簇电压(DP),使每种分子离子与其产生的离子对强度达到最佳。选择相对丰度最强,干扰小的离子作为定量离子,其余作为定性离子。
2.3 提取溶液的选择
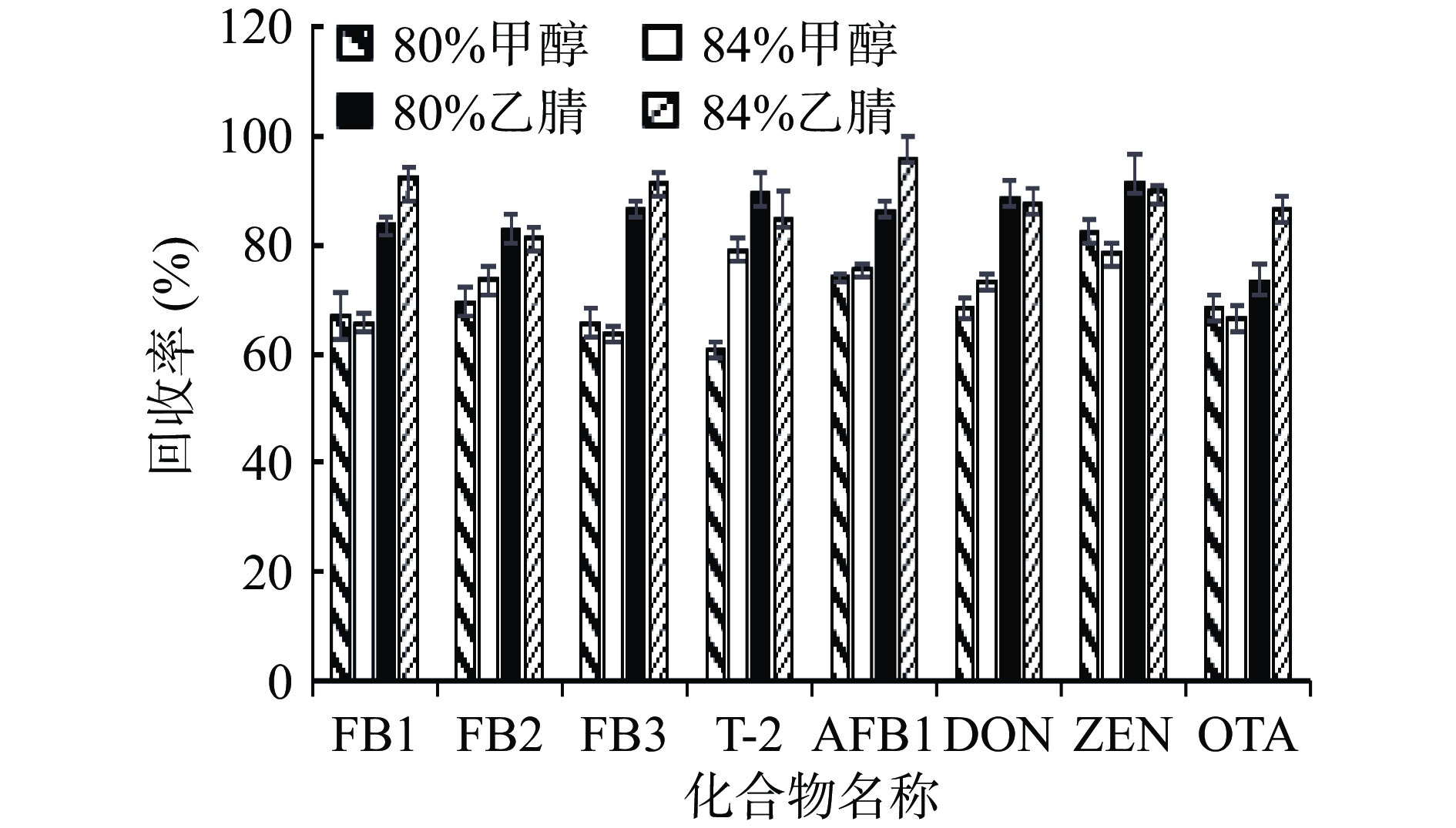
目前常用的提取溶液主要为甲醇、乙腈、乙酸乙酯等。使用甲醇、乙腈等强极性溶剂提取时,水产品中蛋白质、脂肪快速变性从而凝结在一起,影响提取效率,又因DON具有亲水性[26],在极性溶剂中加入一定比例的水后进行提取,可提高其对样品的渗透性从而提高提取效率[27]。本研究参考不同文献中的提取溶剂,选取其中具有代表性的4种进行对比:甲醇-水(80:20,V/V);甲醇-水(84:16,V/V);乙腈-水(80:20,V/V);乙腈-水(84:16,V:V)[10, 28-29]。结果如图2所示,乙腈-水溶液作为提取剂时目标物的回收率高于甲醇-水溶液,乙腈-水(84:16,V:V)较乙腈-水(80:20,V/V)作为提取剂时,FB2、T-2、DON、ZEN的回收率有所下降,但其幅度不超过4.8%,而FB1、FB3、AFB1、OTA的回收率有了明显提高,FB1的回收率由84.0%提高到92.5%,FB3由86.6%提高到91.3%,AFB1由86.3%提高到95.5%,OTA由73.3%提高到86.7%,因此最终本研究选择乙腈-水(84:16,V:V)作为提取剂。
2.4 净化柱的选择
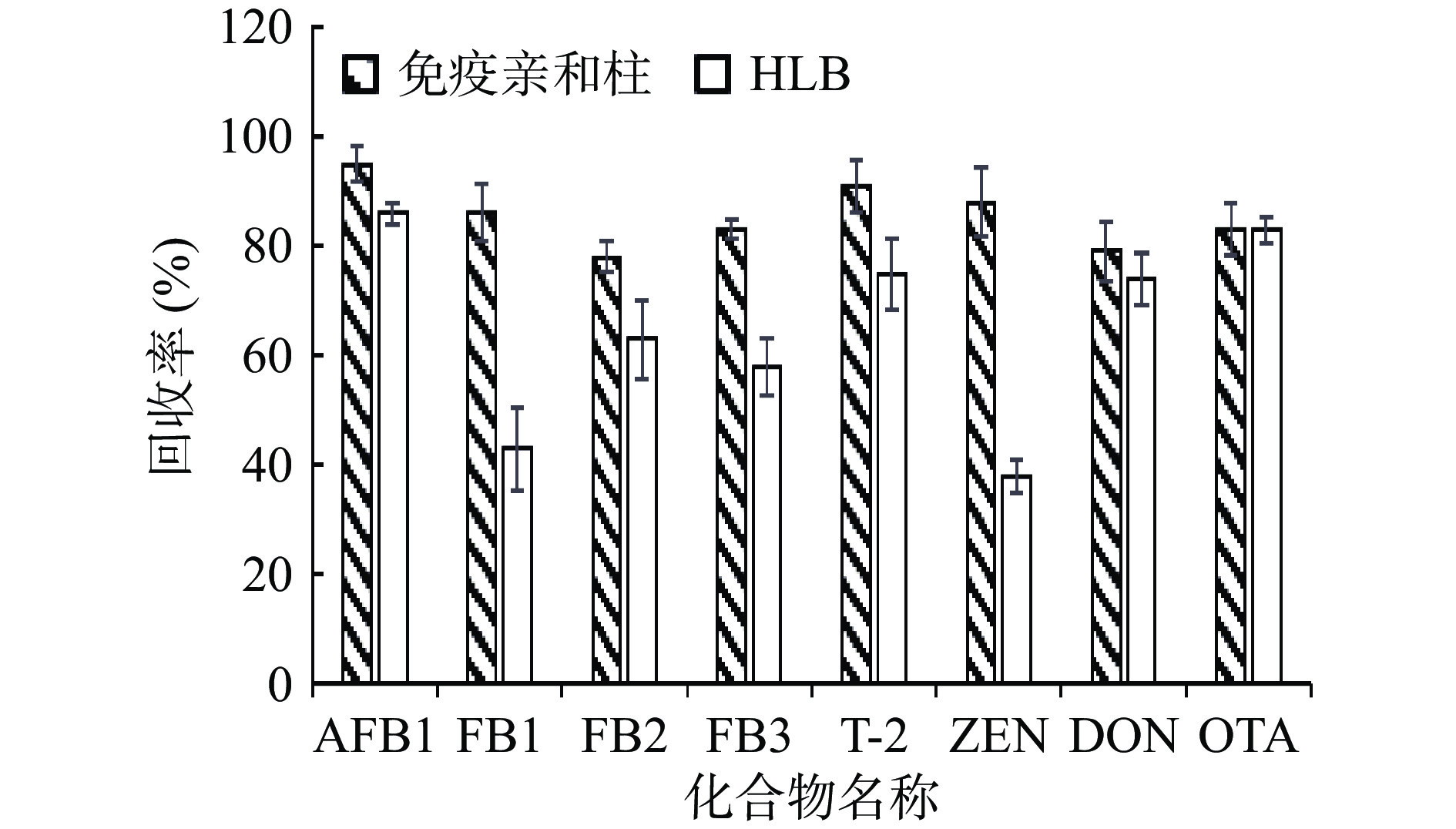
水产品种类繁多且成分复杂,富含蛋白质和脂肪等杂质[29],直接上机会严重影响目标物检测结果的准确性和重复性,且会降低仪器的使用寿命,因此通常采用净化柱对样品进行净化处理。本研究以空白草鱼样品为基质添加10 μg/kg的8种霉菌毒素,通过多毒素免疫亲和柱、Waters Oasis PRIME HLB柱和Waters Oasis HLB柱净化后的回收率,来比较三种净化柱的净化效果。在使用Oasis PRIME HLB柱时,提取溶液通过速度慢,且在浓缩后出现难溶的白色脂肪、蛋白质等凝结物,故不考虑采用Waters Oasis PRIME HLB柱。其余两种净化柱结果见图3,两种净化柱对于OTA的回收率相同,但其余霉菌毒素的回收率Oasis HLB柱均低于多毒素免疫亲和柱,尤其Oasis HLB柱对FB1、ZEN的净化能力较差,回收率低于50%。采用多毒素免疫亲和柱净化后,8种霉菌毒素的回收率在79.8%~100%之间,净化效果较好,因此本研究选择多毒素免疫亲和柱对样品进行净化。
2.5 基质效应的评价
采用质谱技术进行药物残留检测过程中,检测结果的精确度会被待测物质以外的其他物质影响,这种现象被称为基质效应(ME)[30]。本研究采用草鱼、南美白对虾、中华绒螯蟹的空白基质液和溶剂分别配制标准曲线,通过标准曲线斜率比值来对评价霉菌毒素在不同基质中的基质效应(ME)。
(1) 根据公式(1)计算,当ME的绝对值越大表明基质效应的影响越强,通常ME绝对值小于20%时,表明基质效应影响较小[31]。结果显示(如图4),在草鱼、中华绒螯蟹、南美白对虾三种代表性水产品的基质中,T-2毒素和AFB1在基质效应较大,但均不超过20%,说明在多毒素免疫亲和柱能够对基质中的干扰物质有效净化,基质效应对检测结果的影响较小,因此选用50:50(V:V)的甲醇水溶液配标法进行定量检测,外标法定量。
2.6 标准曲线和定量限
将系列标准混合溶液,按照建立的方法上机检测,并绘制出以霉菌毒素浓度为横坐标(x,μg/L),定量离子峰面积为纵坐标(y)的标准曲线,得到的各霉菌毒素的回归方程,其相关系数(R2)均大于0.992,线性关系良好(表3)。同时分别以信噪比(S/N)≥3、10为标准,计算出各毒素的检出限(Limits of detection,LOD)及定量限(Limits of quantitation,LOQ)。8种霉菌毒素的检出限在0.05~0.50 μg/kg之间,定量限在0.17~1.65 μg/kg之间,表明此检测方法的灵敏度良好,能够满足检测需求。
表 3 8种霉菌毒素的线性回归方程、相关系数、线性范围、检出限和定量限Table 3. Linear regression equations, correlation coefficients, linear ranges, LODs and LOQs of the eight mycotoxins毒素名称 线性方程 R2 线性范围(ng/mL) LOD(μg/kg) LOQ(μg/kg) AFB1 y=4.59422×105x+9.76322×104 0.99294 1.0~50.0 0.05 0.17 FB1 y=3.20835×104x+2190.51619 0.99914 1.0~50.0 0.23 0.77 FB2 y=6.90402×104x+1229.78261 0.99784 1.0~50.0 0.34 1.13 FB3 y=6.51855×104x+477.71650 0.99942 1.0~50.0 0.28 0.93 T-2 y=19970.54636x+1647.39528 0.99909 1.0~50.0 0.15 0.50 DON y=7002.87079x+992.27481 0.99844 1.0~50.0 0.50 1.65 ZEN y=15234.51511x+311.91577 0.99739 1.0~50.0 0.38 1.27 OTA y=16093.17857x+2305.16015 0.99650 1.0~50.0 0.26 0.87 2.7 准确度和精密度
选取不含待测物的草鱼、南美白对虾、中华绒螯蟹三种水产品作为空白基质,分别添加不同的3个浓度(1、5、10 μg/kg)进行加标回收率的测定,每个浓度水平平行测定六次。结果见表4,目标物的回收率在75.6%~106.3%,相对标准偏差(RSD)为3.5%~9.3%(n=6),表明该方法准确度、精密度均符合实际检测分析的要求。
表 4 水产品中8种霉菌毒素的加标回收率及相对标准偏差(n=6)Table 4. Recoveries and RSDs of the eight mycotoxins in aquatic products (n=6)化合物名称 添加水平(μg/kg) 草鱼 南美白对虾 中华绒螯蟹 回收率(%) RSD(%) 回收率(%) RSD(%) 回收率(%) RSD(%) AFB1 1 96.2 4.3 93.2 5.2 106.3 6.4 5 91.4 6.7 97.2 5.8 97.3 4.8 10 101.3 7.3 95.4 3.5 96.8 4.0 FB1 1 86.3 5.3 79.5 7.2 85.5 6.5 5 93.2 4.8 86.7 6.7 93,7 5.8 10 95.1 3.7 93.8 5.6 101.4 4.3 FB2 1 79.8 4.7 97.2 7.1 102.3 4.7 5 83.2 5.3 94.9 5.3 87.1 4.8 10 89.1 3.9 89.0 8.6 95.0 5.2 FB3 1 78.2 4.5 91.8 4.7 100.7 5.7 5 85.3 4.8 101.7 6.7 92.5 6.1 10 91.3 5.4 78.4 5.9 97.1 8.3 T-2 1 96.3 4.7 92.7 4.1 83.2 6.3 5 93.8 7.9 90.5 6.0 81.9 7.8 10 94.5 6.3 103.5 6.8 87.3 4.2 DON 1 87.2 4.6 83.0 7.4 81.5 6.8 5 94.5 5.5 83.8 6.1 75.6 4.6 10 102.5 4.9 79.2 7.8 87.0 8.5 ZEN 1 93.2 8.4 94.8 4.0 87.6 9.3 5 88.7 6.2 92.7 6.8 85.3 7.8 10 87.5 7.6 86.1 6.6 94.2 6.5 OTA 1 89.4 4.8 79.8 4.5 97.6 5.3 5 86.7 6.9 85.3 5.4 78.2 5.9 10 105.8 7.6 104.6 5.6 85.2 6.8 2.8 实际样品的检测
采用本方法对市售的20批水产品(包括草鱼、南美白对虾、中华绒螯蟹)进行检测,结果表明,其中18批样品中未检出任何霉菌毒素;2批样品中只检测出AFB1,含量分别为1.30、0.78 μg/kg,其它毒素未检出。
3. 结论
本研究采用及液相色谱-串联质谱技术建立同时测定水产品中8种霉菌毒素的测定方法。通过对提取溶剂和净化柱的对比后,选择84%的乙腈溶液提取,后经免疫亲和柱净化,其前处理步骤简单,净化效果好,有效降低了基质效应的影响,提高了检测效率。通过优化液相和质谱检测参数,使得水产品中8种霉菌毒素在1.0~50.0 ng/mL范围内线性关系良好(R2>0.992),方法检出限在0.05~0.50 μg/kg之间,定量限在0.17~1.65 μg/kg之间,8种霉菌毒素加标回收率在75.6%~106.3%之间,相对标准偏差(RSD)为3.5%~9.3%,该方法检测灵敏度高、准确可靠,能满足水产品中霉菌毒素的定性、定量检测需求,为监管部门对水产品中霉菌毒素残留监测提供了方法参考。
-
表 1 流动相梯度洗脱程序
Table 1 The program of mobile phase gradient elution
时间(min) A(%) B(%) 0.00 95.0 5.0 1.00 95.0 5.0 3.00 35.0 65.0 6.00 5.0 95.0 7.50 5.0 95.0 7.60 95.0 5.0 10.00 95.0 5.0 表 2 8种霉菌毒素的质谱参数
Table 2 Mass spectrometry parameters of 8 mycotoxins
毒素名称 扫描方式 母离子
(m/z)子离子
(m/z)碰撞能量
(eV)去簇电压
(V)AFB1 ESI+ 313.1 285.2* 33 100 241.1 52 100 FB1 ESI+ 722.4 352.3* 50 50 334.3 57 50 FB2 ESI+ 706.4 336.5* 49 50 318.2 55 50 FB3 ESI+ 706.4 336.5 50 50 318.4* 51 50 T-2 ESI+ 484.2 305.3* 18 40 185.2 31 40 DON ESI+ 297.0 249.1* 12 60 231.0 18 60 ZEN ESI− 317.1 131.2* −39 −50 175.0 −34 −50 OTA ESI− 402.1 358.2* −27 −100 166.9 −47 −80 注:*为定量离子。 表 3 8种霉菌毒素的线性回归方程、相关系数、线性范围、检出限和定量限
Table 3 Linear regression equations, correlation coefficients, linear ranges, LODs and LOQs of the eight mycotoxins
毒素名称 线性方程 R2 线性范围(ng/mL) LOD(μg/kg) LOQ(μg/kg) AFB1 y=4.59422×105x+9.76322×104 0.99294 1.0~50.0 0.05 0.17 FB1 y=3.20835×104x+2190.51619 0.99914 1.0~50.0 0.23 0.77 FB2 y=6.90402×104x+1229.78261 0.99784 1.0~50.0 0.34 1.13 FB3 y=6.51855×104x+477.71650 0.99942 1.0~50.0 0.28 0.93 T-2 y=19970.54636x+1647.39528 0.99909 1.0~50.0 0.15 0.50 DON y=7002.87079x+992.27481 0.99844 1.0~50.0 0.50 1.65 ZEN y=15234.51511x+311.91577 0.99739 1.0~50.0 0.38 1.27 OTA y=16093.17857x+2305.16015 0.99650 1.0~50.0 0.26 0.87 表 4 水产品中8种霉菌毒素的加标回收率及相对标准偏差(n=6)
Table 4 Recoveries and RSDs of the eight mycotoxins in aquatic products (n=6)
化合物名称 添加水平(μg/kg) 草鱼 南美白对虾 中华绒螯蟹 回收率(%) RSD(%) 回收率(%) RSD(%) 回收率(%) RSD(%) AFB1 1 96.2 4.3 93.2 5.2 106.3 6.4 5 91.4 6.7 97.2 5.8 97.3 4.8 10 101.3 7.3 95.4 3.5 96.8 4.0 FB1 1 86.3 5.3 79.5 7.2 85.5 6.5 5 93.2 4.8 86.7 6.7 93,7 5.8 10 95.1 3.7 93.8 5.6 101.4 4.3 FB2 1 79.8 4.7 97.2 7.1 102.3 4.7 5 83.2 5.3 94.9 5.3 87.1 4.8 10 89.1 3.9 89.0 8.6 95.0 5.2 FB3 1 78.2 4.5 91.8 4.7 100.7 5.7 5 85.3 4.8 101.7 6.7 92.5 6.1 10 91.3 5.4 78.4 5.9 97.1 8.3 T-2 1 96.3 4.7 92.7 4.1 83.2 6.3 5 93.8 7.9 90.5 6.0 81.9 7.8 10 94.5 6.3 103.5 6.8 87.3 4.2 DON 1 87.2 4.6 83.0 7.4 81.5 6.8 5 94.5 5.5 83.8 6.1 75.6 4.6 10 102.5 4.9 79.2 7.8 87.0 8.5 ZEN 1 93.2 8.4 94.8 4.0 87.6 9.3 5 88.7 6.2 92.7 6.8 85.3 7.8 10 87.5 7.6 86.1 6.6 94.2 6.5 OTA 1 89.4 4.8 79.8 4.5 97.6 5.3 5 86.7 6.9 85.3 5.4 78.2 5.9 10 105.8 7.6 104.6 5.6 85.2 6.8 -
[1] SHI H T, LI S L, BAI Y Y, et al. Mycotoxin contamination of food and feed in China: Occurrence, detection techniques, toxicological effects and advances in mitigation technologies[J]. Food Control,2018:91.
[2] 彭宏宇, 刘立鹤. 水产饲料中霉菌毒素对渔类的影响及解决策略[J]. 当代畜牧,2019(5):64−67. [PENG H Y, LIU L H. Influence of mycotoxins in aquatic feed on fish and its solution[J]. Contemporary Animal Husbandry,2019(5):64−67. [3] JAGODA K P, WIOLETTA B. Alimentary risk of mycotoxins for humans and animals[J]. Toxins,2021,13(11):822. doi: 10.3390/toxins13110822
[4] OLIVEIRA M, VASCONCELOS V. Occurrence of mycotoxins in fish feed and its effects: A review[J]. Toxins,2020,12(3):160. doi: 10.3390/toxins12030160
[5] SURENDRA P. Mycotoxins and its impact on human health[J]. Pharmaceutica Analytica Acta,2020,11(5):205.
[6] 黄莹, 韩金高, 朱晓鸣, 等. 饲喂不同浓度黄曲霉毒素B_1饲料对花鳗鲡幼鱼生长、抗氧化能力和毒素积累的影响[J]. 水生生物学报,2021,45(3):566−572. [HUANG Y, HAN J G, ZHU X M, et al. Effects of dietary aflatoxin B1 on growth, antioxidant capacity and tissue accumulation of juvenile marbled eel (Anguilla marmorata)[J]. Acta Hydrobiologica Sinica,2021,45(3):566−572. [7] MACIEJ W, STEFAN D, PIOTR H, et al. Feed-borne exposure to zearalenone impairs reproduction of rainbow trout[J]. Aquaculture,2020:528.
[8] ZENG Z Z, JIANG W D, WU P, et al. Dietary aflatoxin B1 decreases growth performance and damages the structural integrity of immune organs in juvenile grass carp (Ctenopharyngodon idella)[J]. Aquaculture,2018(500):1−17.
[9] EUROPEAN C. EC No. 1881/2006 Setting maximum levels for certain contaminants in foodstnffs[S]. EU: Official Journal of the European Union, 2006.
[10] Food and Drug Administration. 7371 Compliance program guidance manual program[S]. USA, 2004.
[11] 国家质量监督检验检疫总局. GB 13078-2017饲料卫生标准[S]. 北京: 中国标准出版社, 2017. General Administration of Quality Supervision. Inspection A. D Quarantine. GB 13078-2017 Hygienic standard for feed[S]. Beijing: China Standards Press, 2017.
[12] 国家食品药品监督管理局. GB 2761-2017食品安全国家标准 食品中真菌毒素限量[S]. 北京:中国标准出版社, 2017. China Food and Drug Administration. GB 2761-2017 National food safety standard-Limit of mycotoxins in foods[S]. Beijing: China Standards Press, 2017.
[13] 中华人民共和国农业农村部. NY/T 3803-2020饲料中37种霉菌毒素的测定 液相色谱-串联质谱法[S]. 北京:中国标准出版社, 2017. Ministry of Agriculture and Rural Affairs of the People's Republic of China. NY/T 3803-2020 Determination of 37 mycotoxins in feed by liquid chromatography tandem mass spectrometry[S]. Beijing: China Standards Press, 2017.
[14] 王玉娇, 聂继云, 闫震, 等. 超高效液相色谱-串联质谱法同时检测干果中16种真菌毒素[J]. 分析化学,2017,45(10):1556−1563. [WANG Y J, NIE J Y, YAN Z, et al. Simultaneous determination of 16 kinds of mycotoxins in common dried fruits by ultra performance liquid chromatography-tandem mass spectrometry[J]. Chinese Journal of Analytical Chemistry,2017,45(10):1556−1563. [15] 刘颖, 金永鹏, 罗荪琳, 等. 高效液相色谱同步检测饲料中黄曲霉毒素B1、玉米赤霉烯酮及呕吐毒素的方法[J]. 动物营养学报,2021,33(8):4684−4693. [LIU Y, JIN Y P, LUO S L, et al. A method for simultaneous determination of aflatoxin B1, zearalenone and deoxynivalenol in feed by high performance liquid chromatography[J]. Chinese Journal of Animal Nutrition,2021,33(8):4684−4693. [16] 周晓, 谢体三, 刘运龙. ELISA技术在食品真菌毒素检测中的应用[J]. 粮食与食品工业,2007(5):49−52. [ZHOU X, XIE T S, LIU Y L. Application of ELISA technology in the detection of mycotoxins in food[J]. Cereal & Food Industry,2007(5):49−52. doi: 10.3969/j.issn.1672-5026.2007.05.016 [17] 王小博, 施琦, 王雅玲, 等. 高效液相色谱-串联质谱法测定3种水产品中的T-2毒素与HT-2毒素[J]. 食品科学,2016,37(24):164−169. [WANG X B, SHI Q, WANG Y L, et al. Determination of T-2 and HT-2 toxins in three aquatic products by high performance liquid chromatography-tandem mass spectrometry[J]. Food Science,2016,37(24):164−169. [18] 李向丽, 谭贵良, 梁波, 等. 多功能柱净化-超高效液相色谱串联质谱法同时测定水产品中11种真菌毒素[J]. 现代食品科技,2015,31(7):342−346, 379. [LI X L, TAN G L, LIANG B, et al. Simultaneous detection of 11 mycotoxins in aquatic products using multifunctional column clean-up and ultrahigh-performance liquid chromatography-tandem mass spectrometry[J]. Modern Food Science & Technology,2015,31(7):342−346, 379. [19] 刘娜, 焦京琳, 饶正华. 利用色谱和质谱技术检测饲料原料及产品中常见霉菌毒素的研究进展[J]. 动物营养学报,2021,33(12):6612−6622. [LIU N, JIAO J L, RAO Z H. Research progress in the detection of common mycotoxins in feed raw materials and products by chromatography and mass spectrometry[J]. Journal of Animal Nutrition,2021,33(12):6612−6622. doi: 10.3969/j.issn.1006-267x.2021.12.002 [20] 何卓霖, 穆蕾, 王涛, 等. 超高效液相色谱-四极杆/静电场轨道阱高分辨质谱快速测定乳及乳制品中21种真菌毒素[J]. 食品工业科技,2022,43(6):302−310. [HE Z L, MU L, WANG T, et al. Rapid determination of 21 mycotoxins in milk and dairy products by ultra performance liquid chromatography-quadrupole/orbitrap high resolution mass spectrometry[J]. Science and Technology of Food Industry,2022,43(6):302−310. [21] 谭杰, 杜苑琪, 肖小华, 等. 食品中霉菌毒素样品前处理及分析方法研究进展[J]. 分析测试学报,2017,36(6):829−840. [TAN J, DU Y Q, XIAO X H, et al. Research progress on pretreatment and analysis methods of mycotoxin samples in food[J]. Journal of Instrumental Analysis,2017,36(6):829−840. [22] 王瑞国, 林刚, 李桐, 等. 超高效液相色谱-串联质谱法快速检测动物饲料中5种霉菌毒素[J]. 食品安全质量检测学报,2019,10(11):3286−3293. [WANG R G, LIN G, LI T, et al. Rapid determination of five mycotoxins in animal feed by ultra high performance liquid chromatography tandem mass spectrometry[J]. Journal of Food Safety and Quality Inspection,2019,10(11):3286−3293. doi: 10.3969/j.issn.2095-0381.2019.11.011 [23] 倪杨, 杨军军, 石磊, 等. 超高效液相色谱-串联质谱法同时测定水果中9种真菌毒素[J/OL]. 食品工业科技: 1−14 2022-07-18]. NI Y, YANG J J, SHI L, et al. Simultaneous determination of 9 Mycotoxins in fruits by ultra-performance liquid chromatography-tandem mass spectrometry[J/OL]. Science and Technology of Food Industry: 1−14[2022-07-18].
[24] 李凤华, 李作华, 杨丽, 等. 药食同源中药材中16种真菌毒素的测定与分析[J]. 食品工业科技,2022,43(9):268−275. [LI F H, LI Z H, YANG L, et al. Determination and analysis of 16 mycotoxins in medicinal and edible traditional Chinese medicine[J]. Science and Technology of Food Industry,2022,43(9):268−275. [25] 王瑞国, 郭丽丽, 王培龙, 等. 杂质吸附型净化结合超高效液相色谱-串联质谱法同时测定谷物和动物饲料中37种霉菌毒素[J]. 色谱,2020,38(7):817−825. [WANG R G, GUO L L, WANG P L, et al. Simultaneous determination of 37 mycotoxins in grain and animal feed by impurity adsorption purification coupled with ultra-performance liquid chromatography-tandem mass spectrometry[J]. Chinese Journal of Chromatography,2020,38(7):817−825. [26] 刘虎. 脱氧雪腐镰刀菌烯醇对罗非鱼致毒机理的研究[D]. 湛江: 广东海洋大学, 2020. LIU H. Study on toxicity mechanism of deoxynivalenol to tilapia[D]. Zhanjiang: Guangdong Ocean University, 2020.
[27] 魏云计, 冯民, 朱臻怡, 等. 高效液相色谱-串联质谱法同时测定饲料中11种霉菌毒素[J]. 色谱,2017,35(8):891−896. [WEI Y J, FENG M, ZHU Z Y, et al. Simultaneous determination of 11 mycotoxins in feed by high performance liquid chromatography tandem mass spectrometry[J]. Chinese Journal of Chromatography,2017,35(8):891−896. doi: 10.3724/SP.J.1123.2017.03042 [28] 苏秋权, 殷秋妙, 王威利, 等. 液相色谱串联质谱法同时测定饲料中6种代表性霉菌毒素[J]. 食品安全质量检测学报,2020,11(15):8. [SU Q Q, YIN M M, WANG W L, et al. Simultaneous determination of six representative mycotoxins in feed by liquid chromatography tandem mass spectrometry[J]. Food Safety and Quality Detection Technology,2020,11(15):8. [29] 邓鸣, 张科明, 朱斌. 液相色谱-串联质谱法测定水产品中β-内酰胺类抗生素的残留[J]. 食品工业科技,2013,34(16):57−59. [DENG M, ZHANG K M, ZHU B. Determination of in aquatic products by liquid chromatography tandem mass spectrometry β-residues of lactam antibiotics[J]. Science and Technology of Food Industry,2013,34(16):57−59. [30] 肖全伟, 吴文林, 刘玲利. QuEChERS-高效液相色谱-串联质谱法测定小麦中的8种真菌毒素[J]. 四川农业大学学报,2018,36(5):584−591. [XIAO Q W, WU W L, LIU L L. Determination of eight mycotoxins in wheat by QuEChERS-high performance liquid chromatography-tandem mass spectrometry[J]. Journal of Sichuan Agricultural University,2018,36(5):584−591. [31] 杨洪生, 张秋云, 谭秀慧, 等. 同位素稀释-液相色谱-串联质谱法同时测定水产品中13种镇静剂残留[J]. 食品安全质量检测学报,2021,12(15):6017−6025. [YANG H S, ZHANG Q Y, TAN X H, et al. Simultaneous determination of 13 kinds of sedative residues in aquatic products by isotope dilution-liquid chromatography-tandem mass spectrometry[J]. Food Safety and Quality Detection Technology,2021,12(15):6017−6025. -
期刊类型引用(7)
1. 刘冀黔,旦正杰,韩丽娟,桂林生,侯生珍,王志有,杨葆春. 不同月龄黑藏羊肉品质及风味评价分析. 饲料研究. 2024(13): 105-111 .  百度学术
百度学术
2. 宁舒娴,曾金秀,沙小梅,丁红秀. 不同生境来源的鳙鱼肉挥发性物质组成比较分析. 食品工业科技. 2024(18): 265-272 .  本站查看
本站查看
3. 董平,范文教,朱开宪,吴华昌,邓静. 不同复热方式对咸烧白风味的影响. 食品科技. 2023(02): 122-129 .  百度学术
百度学术
4. 陈方雪,邓祎,谌玲薇,李冬生,乔宇,吴文锦,熊光权,汪兰,李新,石柳,丁安子. 预制冷风风干武昌鱼干制过程中的品质变化及香气形成. 现代食品科技. 2023(02): 9-17 .  百度学术
百度学术
5. 张蓝月,孙万成,罗毅皓. 基于气相色谱-离子迁移谱分析不同地区羊肉的挥发性风味化合物. 食品与发酵工业. 2023(10): 265-272 .  百度学术
百度学术
6. 火玉明,柯汉杰,吴晨昕,姜红贺,梁鹏,汪晴,陈小辉. 海鲈鱼鱼松加工工艺研究. 食品安全质量检测学报. 2022(10): 3367-3374 .  百度学术
百度学术
7. 戴振庭,周惠敏,殷泽生,周瑜,陈舜胜. 添加植物油对鲣鱼鱼松滋味的影响. 甘肃农业大学学报. 2022(06): 227-234 .  百度学术
百度学术
其他类型引用(5)





 下载:
下载:


 下载:
下载:



