Research Progress of Food Protein Quality Evaluation Methods
-
摘要: 不同食物中蛋白质的种类和含量不同,其氨基酸组成及比例也不同,因而对满足人体营养需求的贡献不同。蛋白质作为食物最基本的营养成分,其质量直接影响着人体健康。在全球人口激增、资源有限的情况下,科学合理的蛋白质质量评价方法对于人类合理膳食、获取充足营养、有效开发新型蛋白质资源等是非常重要的。因此,本文综合分析了食品中蛋白质质量评价方法的发展,并对蛋白质消化率校正氨基酸评分(protein digestibility corrected amino acid score,PDCAAS)和可消化氨基酸评分(digestibility indispensable amino acid score,DIAAS)展开详细讨论,重点阐述这两种评价方法的应用状况、优势及局限性,以期为探索优质蛋白质来源、研究蛋白质互补和开发高质量蛋白食品提供理论依据。
-
关键词:
- 蛋白质质量 /
- 消化率校正氨基酸评分 /
- 可消化氨基酸评分 /
- 回肠消化率 /
- 评分模式
Abstract: The types and contents of proteins are different in different foods, and the composition and proportion of amino acids are different, as a result, their contribution to meeting the nutritional needs of the human body is different. As the most basic nutrient component of food, protein has a direct impact on human health. With the rapid increase of global population and limited resources, a scientific and reasonable protein quality evaluation method is very important for investigating reasonable diet, obtaining adequate nutrition, and effectively developing new protein resources and so on. Therefore, this paper reviews the research process of protein quality evaluation methods in food, and elaborates the protein digestibility corrected amino acid score (PDCAAS) and digestibility indispensable amino acid score (DIAAS), including the applications, advantages and limitations of these two evaluation methods. It is hoped to provide some theoretical basis for exploring high-quality protein sources and protein complementarity, and developing high-quality protein foods. -
蛋白质作为人体重要的营养素之一,对维持人体生长发育和生命健康至关重要,其主要功能包括催化反应、信号传递、调节体液平衡及免疫保护等[1]。联合国粮农组织(FAO)、世界卫生组织(WHO)和联合国大学(UNU)提出,在满足人体基本氮平衡的需求下,成年人推荐摄入高品质蛋白质为0.8 g/kg/d[2];儿童、孕妇等人群的蛋白质摄入量应达到1.5 g/kg/d左右。蛋白质摄入不足会造成水肿、肌肉及皮肤组织损伤、贫血、免疫力下降,严重的导致器官衰竭,危及生命[3]。而蛋白质摄入过多会增加肾脏的负担,加快钙流失,诱发心血管疾病等。蛋白质的摄入需同时考虑数量与质量,准确测定蛋白质的摄入量与蛋白质质量可为人体的发育与健康发展提供参考。
随着人口增加、生态破坏和资源匮乏等问题日益突出,获取优质蛋白质成为人类面临的一个重要挑战[4]。由于动物蛋白氨基酸种类齐全,含量高且吸收利用率高常被定义为高质量蛋白[5],而绝大多数植物蛋白因含有一种或多种限制性氨基酸,含量低且吸收利用率较低被定义为低质量蛋白。但是正确评价蛋白质质量需考虑多个因素,如蛋白质的氨基酸组成,人体的蛋白质需求、蛋白质的消化率、测定过程与方法、动物模型等,一个完善的蛋白质质量评价方法既要准确合理又要经济便捷。已经有调查显示混合型植物饮食将成为未来膳食主流[6],这表明植物蛋白有可能替代动物蛋白来满足人体营养需求和保持身体健康[7],食用菌、昆虫、藻类等蛋白质同样如此[8]。因此,为了清楚辨别蛋白质的优劣,指导人类健康饮食,促进新型蛋白质资源的开发和地球可持续发展,有必要对蛋白质质量评价方法进行优化,从而获得一个方便可靠、国际认可并且能够全球适用的评价方法。
本文概述了几种常见的蛋白质质量评价方法,并就蛋白质消化率校正氨基酸评分(protein digestibility corrected amino acid score,PDCAAS)和可消化氨基酸评分(digestibility indispensable amino acid score,DIAAS)两种方法进行了详细阐述,重点指出两种方法具有的优势与局限性,为蛋白质质量评价方法的优化提出改进建议,为将来开发蛋白质资源与高质量蛋白质食品提供科学依据。
1. 生物学评价方法
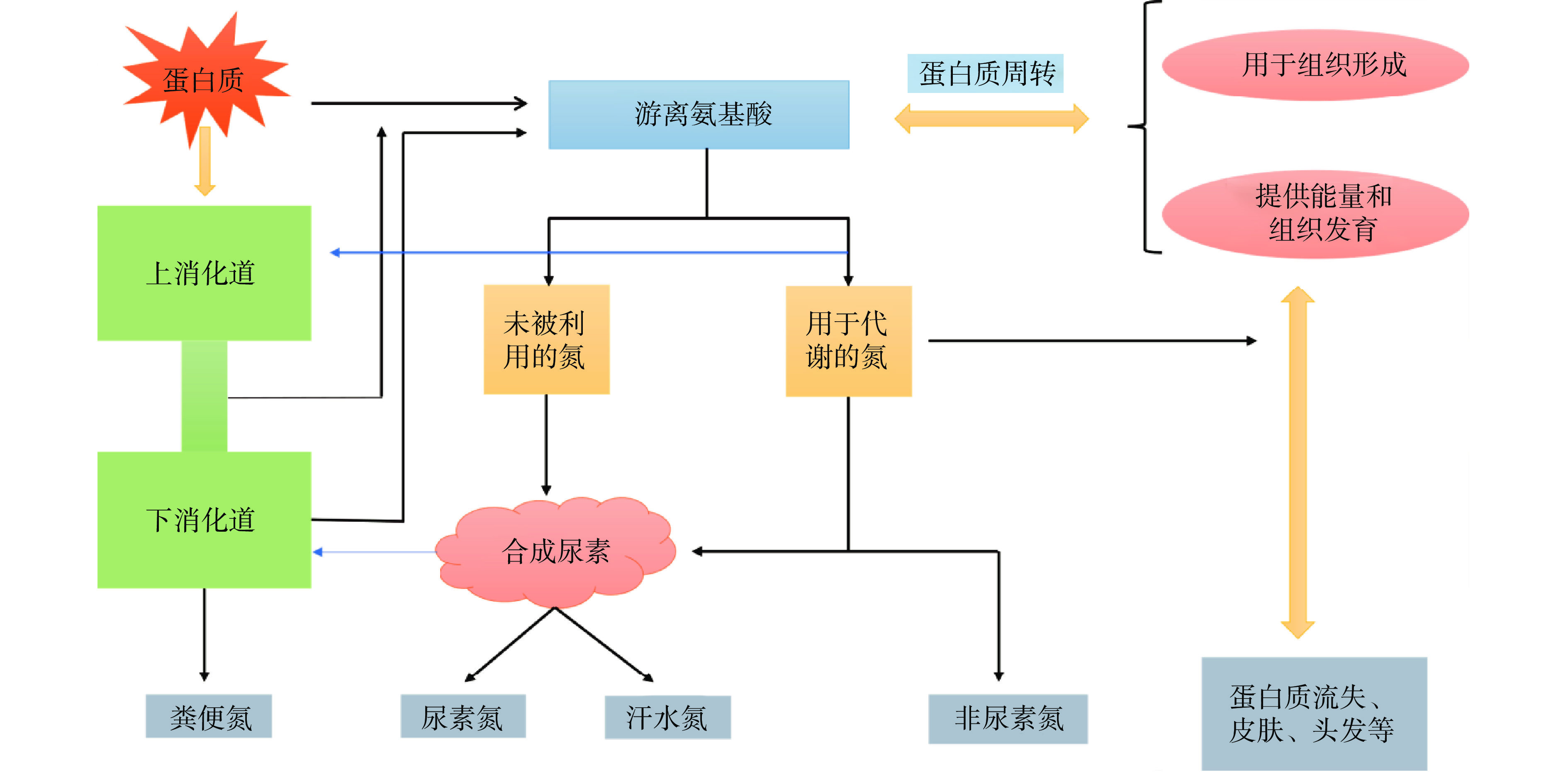
常见的生物学评价方法有氮平衡(nitrogen balance,NB)、生物学价值(biological value,BV)[9]和蛋白质效率比(protein efficiency ratio,PER)[10]。其中NB根据蛋白质在人体内的基本代谢(图1),测定氮含量的摄入与排出而得到,但存在操作困难、灵敏度低的弊端。BV通过测定保留在人体内用于维持生长的氮含量,反映机体对蛋白质的利用程度,但未考虑蛋白质在体内的消化率,导致结果不准确。PER以增加的体重评价蛋白质质量,但该方法通过大鼠测得,忽视了大鼠与人体对含硫氨基酸的需求差异,低估以含硫氨基酸为限制性氨基酸的蛋白质质量,且重复性差,精密度低。净蛋白比(net protein ratio,NPR)[11]、净蛋白质利用率(net protein utilization,NPU)[12]分别表示维持生命和机体健康的蛋白质需要量和蛋白质对正常生长发育的有效性,均存在低估蛋白质质量的问题。餐后蛋白利用率(postprandial protein utilization,PPU)[5]和餐后净蛋白利用率(net postprandial protein utilization,NPPU)[13]分别利用13C-1亮氨酸和15N标记蛋白质来测定吸收利用率,但由于低消化率的蛋白质被机体重新利用后会造成蛋白质沉积,导致PPU结果不准确,更适用于评估高消化率的蛋白质;NPPU测定过程涉及鼻肠插管技术,不适宜作为常用方法。
2. 非生物学评价方法
非生物学评价方法包括化学评分(chemical score,CS)、氨基酸评分(amino acid score,AAS)、必需氨基酸指数(essential amino acid index,EAAI)、氨基酸比值系数(ratio coefficient,RC)[15]等,这几种方法均未考虑蛋白质的消化利用率。为解决这一问题,FAO和WHO在氨基酸评分的基础上综合考虑了蛋白质消化率并提出PDCAAS,但该方法采用蛋白质的粪便消化率使测定结果不准确,因为蛋白质在人体的消化主要集中在小肠,然后在回肠被吸收,以回肠消化率来计算更可靠,于是在2013年决定使用DIAAS替代PDCAAS[16]。不过,PDCAAS目前仍是加拿大等西方国家评价蛋白质质量的方法,具有一定的研究意义和应用价值。
2.1 PDCAAS
2.1.1 PDCAAS的计算方法及评分模式
PDCAAS具体公式见表1,最初PDCAAS的计算采用学龄前儿童的氨基酸需求模式,以酪蛋白作为参考蛋白,通过大鼠模型测定真粪便消化率,其中真粪便消化率相比表观消化率可避免内源蛋白质和氨基酸损失造成的误差。
表 1 蛋白质质量评价方法Table 1. Assessment methods of protein quality方法 计算方法 优点 局限性 生物学评价
方法氮平衡(nitrogen balance,NB) NB=[蛋白质摄入量(g)6.25]−(粪氮+尿氮+皮肤氮) 反映机体吸收利用的蛋白质中氮的能力 操作困难,灵敏度低[17];高估蛋白质摄入量,低估蛋白质损失量;氮-蛋白质转换系数不同 生物学价值
(biological value,BV)BV=I−(F−F0)−(U−U0)I−(F−F0) 反映蛋白质吸收后机体的利用程度 忽略除吸收利用外的氮损失,没有考虑蛋白质消化率 蛋白质效率比(protein efficiency ratio,PER) PER=体重增长质量(g)消耗蛋白质量(g) 反映蛋白质提供能量的能力;操作简单 大鼠对含硫氨基酸的需求量比人类高,低估以含硫氨基酸为限制性氨基酸食品的蛋白质质量;PER 受环境影响大,精密度和重复性较差;没有考虑用来维持生命及机体健康的蛋白质需要量 非生物学评价方法 化学评分(chemical score,CS) CS(%)=测试蛋白中氨基酸含量(mg/g)参考蛋白中同种氨基酸含量(mg/g)×100 直接比较测试蛋白与参考蛋白的接近程度;经济方便 忽视参考蛋白与人体需求量的不同;没有考虑蛋白质的消化率 氨基酸评分(amino acid score,AAS) AAS=测试蛋白中氨基酸含量(mg/g)参考蛋白中同种氨基酸含量(mg/g) 比较测试蛋白与标准氨基酸需求谱的接近程度;经济方便 没有考虑蛋白质的消化率 蛋白质消化率校正氨基酸评分(protein digestibility corrected amino acid score,PDCAAS) PDCAAS(%)=1g测试蛋白质中限制氨基酸含量(mg)1g参考蛋白质中同种氨基酸含量(mg)×真粪便消化率(%) 科学反映蛋白质的营养价值;可行性高 采用粪便氨基酸消化率高估蛋白质质量;分数截断无法区分高质量蛋白质等 可消化氨基酸评分(digestible indispensable amino acid score,DIAAS) DIAAS(%)=1g测试蛋白质中必需氨基酸含量(mg)1g参考蛋白质中同种氨基酸含量(mg)×真回肠消化率(%) 通过分数直观区分各种食品的蛋白质质量;测定真回肠消化率 动物模型与人体回肠消化存在偏差;操作复杂,成本高等 注:NB公式中,粪氮包括未被消化的食物氮,肠道死亡微生物、消化液及肠黏膜脱落细胞氮;尿氮包括机体利用的氮和尿道黏膜脱落细胞氮;皮肤氮包括皮肤、毛发及一切分泌物的排出氮。BV公式中,I为氮的摄入量,F为食用测试蛋白的粪便氮,F0为无氮饮食的内源性粪便氮,U为食用测试蛋白的尿氮,U0为无氮饮食时的内源性尿氮。 由于不同人群对必需氨基酸的需求不同,FAO按照年龄将PDCAAS分为4种评分模式(见表2),分别为婴儿(0.5岁)、学龄前儿童(1~2岁)、年龄较大的儿童及青少年(3~18岁)、成人(>18岁)。
氨基酸 不同年龄 婴儿(0.5岁) 儿童(1~2岁) 3~18岁 >18岁 组氨酸(His) 20 18 16 15 苏氨酸(Thr) 31 27 25 23 异亮氨酸(Ile) 32 31 30 30 色氨酸(Trp) 8.5 7.4 6.6 6.0 亮氨酸(Leu) 66 63 61 59 缬氨酸(Val) 43 42 40 39 赖氨酸(Lys) 57 52 48 45 含硫氨基酸(SAA) 28 26 23 22 芳香族氨基酸(AAA) 52 46 41 38 注:含硫氨基酸(蛋氨酸+半胱氨酸);芳香族氨基酸(酪氨酸+苯丙氨酸)。 2.1.2 PDCAAS在食品中的应用
PDCAAS不仅可以评价食品中蛋白质的质量,还可以用于指导蛋白质的工业生产,获得高质量蛋白。Pehlivanoğlu等[18]通过PDCAAS评价不同生产工艺的乳清蛋白的蛋白质质量,用高效液相色谱测定氨基酸组成,体外模拟消化测定蛋白质消化率,最终发现所有样品的必需氨基酸含量和消化率都较低,PDCAAS为0.08~0.71,均低于正常乳清蛋白,表明蛋白质质量与生产工艺有很大关系,PDCAAS可作为质量评价指标促进工艺改进以获得高质量的蛋白质产品。Nosworthy等[19]采用PDCAAS测定不同加工方式对鹰嘴豆蛋白质质量的影响,发现经过处理后的鹰嘴豆的氨基酸组成和消化率发生改变,挤压膨化后的鹰嘴豆PDCAAS最高为0.84,而且体外消化与体内消化具有很好的相关性,表明加工方式会影响蛋白质质量,而且采用体外消化测定PDCAAS是可行的。Poelaert等[20]测定加热对粉虫和蟋蟀蛋白质消化率的影响并计算PDCAAS,结果显示加热处理对蛋白质消化率影响较小,而且两种蛋白质的PDCAAS为0.69~0.84,属于优质蛋白质,可作为新型蛋白质资源开发应用。同样,Wang等[21]测定不同微藻的PDCAAS,藻类的粗蛋白含量为40%~55%,PDCAAS约为0.6,通过细胞破裂技术有助于提高蛋白质的提取率和消化率,使 PDCAAS升高至0.7~0.8。因此,PDCAAS作为一种蛋白质质量评价方法对于开发蛋白质资源有重要指导意义,同时PDCAAS作为蛋白质的重要指标有助于改进蛋白质的生产工艺与方法,促进高质量蛋白的生产。
2.1.3 PDCAAS的优点
PDCAAS方法的提出相比前述方法有很大突破。PDCAAS相较于CS不再直接以标准蛋白(鸡蛋蛋白、酪蛋白)作为参考,而是重视人体真正的氨基酸需求,并分为了不同的评分模式[14]。相较于AAS考虑了蛋白质在人体的代谢情况,并通过蛋白的真粪便消化率对AAS进行了校正。另外,PDCAAS在测定过程中使用标准化的氨基酸分析方法减少了实验室之间的差异[22],规定氮-蛋白质的转换因子为6.25,不采用其他转换因子,补充了不同食品的氨基酸分析结果,建议制定可靠的国家食品氨基酸组成表以供参考等,这在很大程度上促进了蛋白质质量评价方法的发展。
2.1.4 PDCAAS的局限性
PDCAAS的局限性主要体现在3方面,分别是采用粪便氨基酸消化率校正氨基酸评分,未考虑蛋白质生物利用度的变化和将PDCAAS的最高值限定为1[23]。
第一,Tome等[24]通过同位素示踪发现,粪便氮包括食物消化产生的氮和内源性含氮化合物,后者主要为微生物蛋白且占比大,在测定植物性食物的粪便氮消化率时更明显,导致蛋白质质量被高估。第二,食品加工过程和食品中存在的抗营养因子[25]会降低蛋白质的生物利用度[19],同样高估蛋白质质量。第三,当测得某种蛋白质的PDCAAS>1时,该蛋白的最终结果是PDCAAS=1,大于1的部分会被舍掉。这是因为PDCAAS根据氨基酸消化率和生物学价值(BV)预测蛋白质质量[14],BV的最大值为100%,认为超过的蛋白质会被分解代谢并不会作用于机体。同时,PDCAAS<1表示食品中至少含有一种限制性氨基酸,PDCAAS>1表示食品中没有限制性氨基酸[24]。这消除了牛奶、大豆等高蛋白食物的营养差异,低估了高质量蛋白质的营养价值,高估了其他蛋白质的营养价值。
2.2 DIAAS
2.2.1 DIAAS的计算方法及评分模式
DIAAS通过氨基酸分数与真回肠消化率相乘得到,以最低得分作为该食物的DIAAS值,同时将分数最低的氨基酸作为限制性氨基酸。该方法基于推荐蛋白质摄入量0.66 g/kg/d,分别测定9种必需氨基酸的氨基酸分数[26],并用生长猪为动物模型测定回肠消化率[27]。
同PDCAAS,FAO也将DIAAS分为不同评分模式(见表3),分别为婴儿(0~0.5岁),幼儿(0.5~3岁),年龄较大的儿童、青少年和成人(3岁以上)。但是为方便监管,修改为两种评分模式:适用于婴儿配方奶粉的母乳模式(0.5岁以下)和适用于所有其他食品和人群的评分模式(0.5~3岁)。
氨基酸 不同年龄 婴儿(0.5岁以下) 儿童(0.5~3岁) 3岁以上儿童、
青少年及成人组氨酸(His) 21 20 16 苏氨酸(Thr) 44 31 25 异亮氨酸(Ile) 55 32 30 色氨酸(Trp) 17 8.5 6.6 亮氨酸(Leu) 96 66 61 缬氨酸(Val) 55 43 40 赖氨酸(Lys) 69 57 48 含硫氨基酸(SAA) 33 27 23 芳香族氨基酸(AAA) 94 52 41 注:含硫氨基酸(蛋氨酸+半胱氨酸);芳香族氨基酸(酪氨酸+苯丙氨酸)。 2.2.2 DIAAS在食品中的应用
DIAAS方法对于单一食品和混合食品均适用[28],常见食品的DIAAS见表4,以DIAAS为测定指标展开的蛋白质互补仍是研究的热点。
食物 组氨酸(His) 异亮氨酸(Ile) 亮氨酸(Leu) 赖氨酸(Lys) 芳香氨基酸(AAA) 含硫氨基酸(SAA) 苏氨酸(Thr) 色氨酸(Try) 缬氨酸(Val) DIAAS 限制性
氨基酸猪肉 197±13.6 153±11.1 122±9.2 157±10.7 128±10.7 148±10.4 145±10.1 144±17.1 117±9.0 117 无 鸡蛋 101±11.7 129±25.5 103±16.2 133±58.4 123±53.2 144±18.9 106±14.1 129±49.7 105±32.3 101 无 酪蛋白 147±9.4 153±4.3 141±6.6 134±4.3 117±5.0 201±8.0 130±4.3 159±13.4 148±2.7 117 无 乳清蛋白 85±10.8 166±23.2 138±22.9 131±25.2 132±21.6 101±14.0 174±22.8 180±47.0 116±14.3 85 组氨酸 大豆 119±9.4 124±8.3 102±6.1 96±9.0 91±11.5 147±8.3 105±6.0 132±21.1 95±7.3 91 芳香族氨基酸 燕麦 91±11.4 100±4.2 94±4.9 57±5.8 151±52.9 135±9.2 85±5.9 110±17.2 102±3.4 57 赖氨酸 土豆 100±7.3 156±9.2 143±11.2 122±4.6 115±6.0 210±18.2 165±12.0 128±13.7 138±5.1 100 无 玉米 110±29.7 90±14.6 162±58.2 36±14.9 126±22.2 140±42.8 86±10.2 52±35.4 90±14.4 36 赖氨酸 大米 93±7.0 89±17.4 80±12.4 47±2.3 104±11.0 119±29.6 75±4.1 114±28.6 95±18.0 47 赖氨酸 小麦 118±21.7 91±10.5 87±11.1 48±10.6 127±19.4 109±16.9 78±7.1 127±17.8 92±9.8 48 赖氨酸 注:该表格中的数据是基于0.5~3岁的评分模式所得到的。当DIAAS<100时,有限制性氨基酸;当DIAAS≥100时,无限制性氨基酸。 Bailey等[29]通过测定不同猪肉部位及不同加工条件下的DIAAS发现猪肉的DIAAS都大于100,腰部肉在0.5~3岁评分模式DIAAS最高,培根肉在3岁以上的儿童、青少年及成人的评分模式下DIAAS最高;交替腌制火腿比未腌制火腿的DIAAS高,说明不同加工条件、不同部位以及不同评分模式均会影响蛋白质质量。Herreman等[30]测定了5种动物蛋白和12种植物蛋白的DIAAS,然后通过限制性氨基酸互补的方法调整混合食物中各蛋白的比例来获得较高的DIAAS。其中马铃薯蛋白的9种必需氨基酸分数都较高,与其他食物混合测得DIAAS有明显提高且大于75,豌豆蛋白或大豆蛋白与谷物蛋白混合也可提高DIAAS。这表明DIAAS在测定过程中可明确某种食品的限制性氨基酸,准确指导不同食物进行氨基酸互补,有助于人们通过合理搭配饮食获得高质量蛋白。
混合食物的DIAAS(%)=食物质量(g)×食物占比×必需氨基酸含量(mg/g)对应评分模式下参考蛋白质中同种氨基酸含量(mg/g)×真回肠消化率(%) Han等[31]测定纯熟谷物、豆类及混合后的DIAAS,每种食物均存在限制性氨基酸,大多为赖氨酸。绿豆和小米、红小豆和薏仁混合后的DIAAS明显提高但小于100。由于在蛋白质互补的过程中不可避免地会增加碳水化合物与卡路里的含量,因此,有关蛋白质互补方面的研究还需进一步深入。
2.2.3 DIAAS的优点
在氨基酸消化率方面,氨基酸主要在回肠中被消化,采用回肠氨基酸消化率可避免回肠末端内源微生物对蛋白质消化的影响;在动物模型方面,大鼠对含硫氨基酸的需求远大于人类[32],且大鼠更能消化一些人体难以消化的蛋白质[33],导致消化率降低。生长猪的消化系统在解剖学和生理学上与人类极为相似,而且两者的回肠消化率具有一致性。Deglaire等[34]建立了以生长猪的回肠氨基酸消化率数据预测人类回肠氨基酸消化率的回归方程,该方程建立后可减少动物实验造成的误差,提高结果的准确性。2011年国际协商制定的一种静态体外消化模型——INFOGEST[35],精准模拟人体胃肠道消化,有助于人们在不伤害动物的前提下准确测定回肠氨基酸消化率。同时该模型具有重复性好、简便、经济的优点,可极大推动DIAAS方法的实施。
DIAAS的值可以超过100,能够识别高质量蛋白质,利于补充低质量蛋白质的营养价值。根据DIAAS值可将蛋白质划分为不同等级,在满足人体氨基酸需求的前提下,DIAAS≥100为优质蛋白质[36],DIAAS=75~99为高质量蛋白质,DIAAS<75为低质量蛋白质。综合来看,DIAAS是一个更为科学准确、全面直观的评价蛋白质质量的方法,具有广阔的应用前景。
不仅如此,DIAAS可有效指导人体摄入高质量蛋白质。主要分为两种途径:一种是直接摄入DIAAS>75的食物,如牛奶、鸡蛋、肉等优质蛋白质。另一种是间接摄入DIAAS>75的食物,即通过搭配两种或多种DIAAS<75的食物,使得混合后的食物具有高质量蛋白的功能,如大米和小扁豆、小米和大豆混合物等[37]。
2.2.4 DIAAS的局限性
2.2.4.1 氮-蛋白质转换因子不同
不同食品的氮-蛋白质转换因子不同,谷物蛋白的转换因子为5.3~5.8,奶制品的转换因子为5.85~6.15[38]。如果基于食物特有的转换因子计算DIAAS,如糙米的转换因子为5.95,得到的DIAAS比6.25高5%,牛奶蛋白的转换因子为6.38,得到的DIAAS比6.25低。因此,使用特定食物的转换因子会高估植物蛋白DIAAS值,低估动物蛋白DIAAS值,因此,若以广义因子6.25来计算蛋白质含量,则忽视了不同来源蛋白质的差异。
2.2.4.2 测定方法不统一
由于生长猪和人类的回肠消化极为相似,DIAAS通过回归方程以生长猪预测人类的回肠氨基酸消化率,需优化实验方法提高方程的稳定性[39]。另外,两者吸收氨基酸后发挥作用不一样,猪主要用于组织生长,而成年人主要用于维持身体代谢和能量供给。目前已通过同位素示踪法得到了部分动物蛋白和植物蛋白的消化率[40],且可直接用于人类消化率研究,但对于特定年龄和生理状态的人群并不适用。选择合适的动物模型和标准化的消化率测定方法以提供全面统一的真回肠氨基酸消化率数据库是必要的。
2.2.4.3 蛋白质需求不同
国际移民组织(IOM)推荐蛋白质摄入量为0.84 g/kg/d[41],可以满足97.5%的健康成人的需要,但是DIAAS是基于人均摄入量0.66 g/kg/d得到的,不同地区和人群对于蛋白质的需求不同。虽然DIAAS根据不同的年龄组成有不同的评分模式,但是同年龄人群身体机能也存在差异;不同地区饮食习惯不同,种植、加工食物的方式均有所区别,这就导致DIAAS不能作为唯一适用的蛋白质质量评价方法。比如对于西方国家的素食人群,选用PDCAAS更合适。
2.2.4.4 食品生物利用率改变
DIAAS在分析膳食蛋白质质量时,忽视了食物基质间的相互作用对蛋白质消化率的影响。例如,Mariotti等[38]发现猪在同时消化脂质和蛋白质时,会降低氨基酸的吸收速率,提高蛋白质消化率。碳水化合物的蛋白质节约效应[42]会降低蛋白质消化率,因为碳水化合物作为主要能量来源,会减少蛋白质的消耗。植物性食物中碳水化合物、抗营养因子含量较高也将影响DIAAS分析蛋白质消化率的准确性。
2.2.4.5 忽略食物加工的影响
在测定蛋白质消化率时大多使用生食,但人体通常摄入熟食,加工过程会使蛋白质消化率和功能特性发生改变。热处理可降低蛋白酶抑制剂的活性[43],发酵可减少植酸、单宁等抗营养因子的含量,挤压处理可使蛋白变性,暴露出更多的酶作用位点[43-44],均可提高蛋白质的消化率。相反,加工过程中发生的美拉德反应使赖氨酸利用率降低,多糖等大分子结合蛋白质,导致消化率下降[45]。Hodgkinson等[46]还发现水煮对蛋白质的破坏作用最小,水煮肉的蛋白质消化率最高,而烧烤肉最低。
2.2.4.6 不同蛋白质对人体生理功能不同
DIAAS测试了蛋白质在小肠中的消化与吸收,但没有考虑吸收后的蛋白质作用于生理反应的情况,牛奶蛋白DIAAS值很高,但与摄入相同氮含量的玉米蛋白对肌肉蛋白的刺激作用相同[47]。植物蛋白质参与机体能量构成,增加了可消化蛋白质总量,素食主义者每日摄取大量豆类、谷物、蔬菜等,可增加饱腹感、获取能量,减少胆固醇、脂肪摄入,有益于身体健康。因此DIAAS需要考虑蛋白质对于人体生理功能的影响,重视植物蛋白对人体健康的贡献。
2.2.4.7 DIAAS分级不合理
DIAAS根据最终得分对蛋白质进行分级,但分级标准并不合理。大豆蛋白、豌豆蛋白、小麦蛋白常被认为是较好的肉类替代品,在营养和结构方面可与动物肉媲美[36]。但通过测定DIAAS发现,大豆蛋白的DIAAS大于75被认为是良好的蛋白质来源,豌豆蛋白和小麦蛋白因DIAAS小于75而不被推荐作为蛋白质来源,可见以DIAAS=75作为评判蛋白质优劣的分界线是不恰当的,不利于提高植物蛋白的利用率,因此需要对DIAAS的分级标准进行重新定义。
3. 总结与展望
蛋白质是人体不可缺少的营养素且主要从食物中获取,优质的蛋白质有利于人体健康和营养平衡。蛋白质质量评价方法一直是FAO和WHO及各国相关研究人员关注的重点,目前已从氮含量、氨基酸组成、体重变化、蛋白质消化率、氨基酸利用率等方面入手确立了多种蛋白质质量评价方法,这些方法优缺点并存,需要不断更新和优化。其中PDCAAS和DIAAS两种方法考虑了影响蛋白质质量的关键因素—蛋白质的氨基酸分数及消化率,并且后者通过测定蛋白质的回肠消化率来对蛋白质进行评分,相比于其他方法更加科学准确,适用于单一食品和混合食品。
对于蛋白质质量评价方法的完善,未来研究的重点应围绕以下几个方面:a.提高回归方程的稳定性,减少动物实验,优化体外消化方法或通过微创同位素示踪法测定人体蛋白质消化率;b.建立完备的数据库供不同国家参考和使用,需考虑不同国家和地区的饮食习惯,不同人群的身体素质,食物自身基质和膳食加工过程的影响等;c.植物性饮食趋势发展迅速,对植物性食物还需要更系统和全面的研究,以提高植物蛋白的利用率;d.考虑通过必需氨基酸互补来满足人体蛋白质需求,进而提高DIAAS的准确性,最大程度减少研究过程对动物和人类的伤害,促使其成为方便、快捷、经济且适用于全世界的标准方法。
-
表 1 蛋白质质量评价方法
Table 1 Assessment methods of protein quality
方法 计算方法 优点 局限性 生物学评价
方法氮平衡(nitrogen balance,NB) NB=[蛋白质摄入量(g)6.25]−(粪氮+尿氮+皮肤氮) 反映机体吸收利用的蛋白质中氮的能力 操作困难,灵敏度低[17];高估蛋白质摄入量,低估蛋白质损失量;氮-蛋白质转换系数不同 生物学价值
(biological value,BV)BV=I−(F−F0)−(U−U0)I−(F−F0) 反映蛋白质吸收后机体的利用程度 忽略除吸收利用外的氮损失,没有考虑蛋白质消化率 蛋白质效率比(protein efficiency ratio,PER) PER=体重增长质量(g)消耗蛋白质量(g) 反映蛋白质提供能量的能力;操作简单 大鼠对含硫氨基酸的需求量比人类高,低估以含硫氨基酸为限制性氨基酸食品的蛋白质质量;PER 受环境影响大,精密度和重复性较差;没有考虑用来维持生命及机体健康的蛋白质需要量 非生物学评价方法 化学评分(chemical score,CS) CS(%)=测试蛋白中氨基酸含量(mg/g)参考蛋白中同种氨基酸含量(mg/g)×100 直接比较测试蛋白与参考蛋白的接近程度;经济方便 忽视参考蛋白与人体需求量的不同;没有考虑蛋白质的消化率 氨基酸评分(amino acid score,AAS) AAS=测试蛋白中氨基酸含量(mg/g)参考蛋白中同种氨基酸含量(mg/g) 比较测试蛋白与标准氨基酸需求谱的接近程度;经济方便 没有考虑蛋白质的消化率 蛋白质消化率校正氨基酸评分(protein digestibility corrected amino acid score,PDCAAS) PDCAAS(%)=1g测试蛋白质中限制氨基酸含量(mg)1g参考蛋白质中同种氨基酸含量(mg)×真粪便消化率(%) 科学反映蛋白质的营养价值;可行性高 采用粪便氨基酸消化率高估蛋白质质量;分数截断无法区分高质量蛋白质等 可消化氨基酸评分(digestible indispensable amino acid score,DIAAS) DIAAS(%)=1g测试蛋白质中必需氨基酸含量(mg)1g参考蛋白质中同种氨基酸含量(mg)×真回肠消化率(%) 通过分数直观区分各种食品的蛋白质质量;测定真回肠消化率 动物模型与人体回肠消化存在偏差;操作复杂,成本高等 注:NB公式中,粪氮包括未被消化的食物氮,肠道死亡微生物、消化液及肠黏膜脱落细胞氮;尿氮包括机体利用的氮和尿道黏膜脱落细胞氮;皮肤氮包括皮肤、毛发及一切分泌物的排出氮。BV公式中,I为氮的摄入量,F为食用测试蛋白的粪便氮,F0为无氮饮食的内源性粪便氮,U为食用测试蛋白的尿氮,U0为无氮饮食时的内源性尿氮。 氨基酸 不同年龄 婴儿(0.5岁) 儿童(1~2岁) 3~18岁 >18岁 组氨酸(His) 20 18 16 15 苏氨酸(Thr) 31 27 25 23 异亮氨酸(Ile) 32 31 30 30 色氨酸(Trp) 8.5 7.4 6.6 6.0 亮氨酸(Leu) 66 63 61 59 缬氨酸(Val) 43 42 40 39 赖氨酸(Lys) 57 52 48 45 含硫氨基酸(SAA) 28 26 23 22 芳香族氨基酸(AAA) 52 46 41 38 注:含硫氨基酸(蛋氨酸+半胱氨酸);芳香族氨基酸(酪氨酸+苯丙氨酸)。 氨基酸 不同年龄 婴儿(0.5岁以下) 儿童(0.5~3岁) 3岁以上儿童、
青少年及成人组氨酸(His) 21 20 16 苏氨酸(Thr) 44 31 25 异亮氨酸(Ile) 55 32 30 色氨酸(Trp) 17 8.5 6.6 亮氨酸(Leu) 96 66 61 缬氨酸(Val) 55 43 40 赖氨酸(Lys) 69 57 48 含硫氨基酸(SAA) 33 27 23 芳香族氨基酸(AAA) 94 52 41 注:含硫氨基酸(蛋氨酸+半胱氨酸);芳香族氨基酸(酪氨酸+苯丙氨酸)。 食物 组氨酸(His) 异亮氨酸(Ile) 亮氨酸(Leu) 赖氨酸(Lys) 芳香氨基酸(AAA) 含硫氨基酸(SAA) 苏氨酸(Thr) 色氨酸(Try) 缬氨酸(Val) DIAAS 限制性
氨基酸猪肉 197±13.6 153±11.1 122±9.2 157±10.7 128±10.7 148±10.4 145±10.1 144±17.1 117±9.0 117 无 鸡蛋 101±11.7 129±25.5 103±16.2 133±58.4 123±53.2 144±18.9 106±14.1 129±49.7 105±32.3 101 无 酪蛋白 147±9.4 153±4.3 141±6.6 134±4.3 117±5.0 201±8.0 130±4.3 159±13.4 148±2.7 117 无 乳清蛋白 85±10.8 166±23.2 138±22.9 131±25.2 132±21.6 101±14.0 174±22.8 180±47.0 116±14.3 85 组氨酸 大豆 119±9.4 124±8.3 102±6.1 96±9.0 91±11.5 147±8.3 105±6.0 132±21.1 95±7.3 91 芳香族氨基酸 燕麦 91±11.4 100±4.2 94±4.9 57±5.8 151±52.9 135±9.2 85±5.9 110±17.2 102±3.4 57 赖氨酸 土豆 100±7.3 156±9.2 143±11.2 122±4.6 115±6.0 210±18.2 165±12.0 128±13.7 138±5.1 100 无 玉米 110±29.7 90±14.6 162±58.2 36±14.9 126±22.2 140±42.8 86±10.2 52±35.4 90±14.4 36 赖氨酸 大米 93±7.0 89±17.4 80±12.4 47±2.3 104±11.0 119±29.6 75±4.1 114±28.6 95±18.0 47 赖氨酸 小麦 118±21.7 91±10.5 87±11.1 48±10.6 127±19.4 109±16.9 78±7.1 127±17.8 92±9.8 48 赖氨酸 注:该表格中的数据是基于0.5~3岁的评分模式所得到的。当DIAAS<100时,有限制性氨基酸;当DIAAS≥100时,无限制性氨基酸。 -
[1] CHOU C J, AFFOLTER M, KUSSMANN M. A nutrigenomics view of protein intake: Macronutrient, bioactive peptides, and protein turnover[J]. Progress in Molecular Biology and Translational Science,2012,108:51−74.
[2] ORGANIZATION W H, UNIVERSITY U N. Protein and amino acid requirements in human nutrition[M]. World Health Organization, 2007.
[3] WU G. Dietary protein intake and human health[J]. Food & Function,2016,7(3):1251−1265.
[4] ISMAIL B P, SENARATNE-LENAGALA L, STUBE A, et al. Protein demand: Review of plant and animal proteins used in alternative protein product development and production[J]. Animal Frontiers,2020,10(4):53−63. doi: 10.1093/af/vfaa040
[5] BURD N A, MCKENNA C F, SALVADOR A F, et al. Dietary protein quantity, quality, and exercise are key to healthy living: A muscle-centric perspective across the lifespan[J]. Frontiers in Nutrition,2019,6:83. doi: 10.3389/fnut.2019.00083
[6] MUNOZ L M J, TAVARES G M, CORREDIG M. Design future foods using plant protein blends for best nutritional and technological functionality[J]. Trends in Food Science & Technology,2021,113:139−150.
[7] DAY L. Proteins from land plants-potential resources for human nutrition and food security[J]. Trends in Food Science & Technology,2013,32(1):25−42.
[8] BOHRER B M. Nutrient density and nutritional value of meat products and non-meat foods high in protein[J]. Trends in Food Science & Technology,2017,65:103−112.
[9] THOMAS M R, ASHBY J, SNEED S M, et al. Minimum nitrogen requirement from glandless cottonseed protein for nitrogen balance in college women[J]. The Journal of Nutrition,1979,109(3):397−405. doi: 10.1093/jn/109.3.397
[10] OSBORNE T B, MENDEL L B, FERRY E L, et al. Amino-acids in nutrition and growth[J]. Journal of Biological Chemistry,1914,17(3):325−349. doi: 10.1016/S0021-9258(18)88398-3
[11] GILANI G S, XIAO C W, COCKELL K A. Impact of antinutritional factors in food proteins on the digestibility of protein and the bioavailability of amino acids and on protein quality[J]. British Journal of Nutrition,2012,108(S2):S315−S332. doi: 10.1017/S0007114512002371
[12] AGUILAR E G, DE JESÚS ALBARRACÍN G, UÑATES M A, et al. Evaluation of the nutritional quality of the grain protein of new amaranths varieties[J]. Plant Foods for Human Nutrition,2015,70(1):21−26. doi: 10.1007/s11130-014-0456-3
[13] TOMÉ D, BOS C C. Dietary protein and nitrogen utilization[J]. The Journal of Nutrition,2000,130(7):1868S−1873S. doi: 10.1093/jn/130.7.1868S
[14] CONSULTATION F E. Dietary protein quality evaluation in human nutrition[J]. FAO Food Nutr Pap,2011,92:1−66.
[15] 陈艳芳, 鲍大鹏, 陈洪雨, 等. 蛋白质品质评价方法及其在食用菌中的应用进展[J]. 食用菌学报,2020,27(3):92−104. [CHEN Y F, BAO D P, CHEN H Y, et al. Evaluation of protein quality and its application in edible fungi[J]. Acta Edible Fungi Sinica,2020,27(3):92−104. [16] LESER S. The 2013 FAO report on dietary protein quality evaluation in human nutrition: Recommendations and implications[J]. Nutrition Bulletin,2013,38(4):421−428. doi: 10.1111/nbu.12063
[17] PHILLIPS S M. Current concepts and unresolved questions in dietary protein requirements and supplements in adults[J]. Frontiers in Nutrition,2017,4(13):1−10.
[18] PEHLIVANOĞLU H, BARDAKÇI H F, YAMAN M. Protein quality assessment of commercial whey protein supplements commonly consumed in Turkey by in vitro protein digestibility-corrected amino acid score (PDCAAS)[J]. Food Science and Technology,2021,42:1−8.
[19] NOSWORTHY M G, MEDINA G, FRANCZYK A J, et al. Thermal processing methods differentially affect the protein quality of Chickpea (Cicer arietinum)[J]. Food Science & Nutrition,2020,8(6):2950−2958.
[20] POELAERT C, FRANCIS F, ALABI T, et al. Protein value of two insects, subjected to various heat treatments, using growing rats and the protein digestibility-corrected amino acid score[J]. Journal of Insects as Food and Feed,2018,4(2):77−87. doi: 10.3920/JIFF2017.0003
[21] WANG Y, TIBBETTS S M, BERRUE F, et al. A rat study to evaluate the protein quality of three green microalgal species and the impact of mechanical cell wall disruption[J]. Foods,2020,9(11):1531. doi: 10.3390/foods9111531
[22] GILANI G S. Background on international activities on protein quality assessment of foods[J]. British Journal of Nutrition,2012,108(S2):S168−S182. doi: 10.1017/S0007114512002383
[23] SCHAAFSMA G. Advantages and limitations of the protein digestibility-corrected amino acid score (PDCAAS) as a method for evaluating protein quality in human diets[J]. British Journal of Nutrition,2012,108(S2):S333−S336. doi: 10.1017/S0007114512002541
[24] TOME D. Criteria and markers for protein quality assessment: A review[J]. British Journal of Nutrition,2012,108(S2):S222−S229. doi: 10.1017/S0007114512002565
[25] VAGADIA B H, VANGA S K, SINGH A, et al. Comparison of conventional and microwave treatment on soymilk for inactivation of trypsin inhibitors and in vitro protein digestibility[J]. Foods,2018,7(1):6. doi: 10.3390/foods7010006
[26] PENCHARZ P B, ELANGO R, WOLFE R R. Recent developments in understanding protein needs: How much and what kind should we eat?[J]. Applied Physiology, Nutrition, and Metabolism,2016,41(5):577−580. doi: 10.1139/apnm-2015-0549
[27] WOLFE R R, RUTHERFURD S M, KIM I-Y, et al. Protein quality as determined by the digestible indispensable amino acid score: Evaluation of factors underlying the calculation[J]. Nutrition Reviews,2016,74(9):584−599. doi: 10.1093/nutrit/nuw022
[28] FANELLI N S, BAILEY H M, THOMPSON T W, et al. Digestible indispensable amino acid score (DIAAS) is greater in animal-based burgers than in plant-based burgers if determined in pigs[J]. European Journal of Nutrition,2022,61(1):461−475. doi: 10.1007/s00394-021-02658-1
[29] BAILEY H M, MATHAI J K, BERG E P, et al. Pork products have digestible indispensable amino acid scores (DIAAS) that are greater than 100 when determined in pigs, but processing does not always increase DIAAS[J]. The Journal of Nutrition,2020,150(3):475−482. doi: 10.1093/jn/nxz284
[30] HERREMAN L, NOMMENSEN P, PENNINGS B, et al. Comprehensive overview of the quality of plant-And animal-sourced proteins based on the digestible indispensable amino acid score[J]. Food Science & Nutrition,2020,8(10):5379−5391.
[31] HAN F, MOUGHAN P J, LI J, et al. Digestible indispensable amino acid scores (DIAAS) of six cooked Chinese pulses[J]. Nutrients,2020,12(12):3831. doi: 10.3390/nu12123831
[32] COUNCIL N R. Nutrient requirements of laboratory animals: 1995[M]. 4th ed. Washington, DC: National Academy Press (US), 1995.
[33] BOS C, AIRINEI G, MARIOTTI F, et al. The poor digestibility of rapeseed protein is balanced by its very high metabolic utilization in humans[J]. The Journal of Nutrition,2007,137(3):594−600. doi: 10.1093/jn/137.3.594
[34] DEGLAIRE A, BOS C, TOMÉ D, et al. Ileal digestibility of dietary protein in the growing pig and adult human[J]. British Journal of Nutrition,2009,102(12):1752−1759. doi: 10.1017/S0007114509991267
[35] BRODKORB A, EGGER L, ALMINGER M, et al. INFOGEST static in vitro simulation of gastrointestinal food digestion[J]. Nature Protocols,2019,14(4):991−1014. doi: 10.1038/s41596-018-0119-1
[36] MARINANGELI C P, HOUSE J D. Potential impact of the digestible indispensable amino acid score as a measure of protein quality on dietary regulations and health[J]. Nutrition Reviews,2017,75(8):658−67. doi: 10.1093/nutrit/nux025
[37] DAVIES R W, JAKEMAN P M. Separating the wheat from the chaff: Nutritional value of plant proteins and their potential contribution to human health[J]. Nutrients,2020,12(8):2410. doi: 10.3390/nu12082410
[38] MARIOTTI F, TOMÉ D, MIRAND P P. Converting nitrogen into protein-beyond 6.25 and Jones' factors[J]. Critical Reviews in Food Science and Nutrition,2008,48(2):177−184. doi: 10.1080/10408390701279749
[39] HODGKINSON S M, STEIN H H, DE VRIES S, et al. Determination of true ileal amino acid digestibility in the growing pig for calculation of digestible indispensable amino acid score (DIAAS)[J]. The Journal of Nutrition,2020,150(10):2621−2623. doi: 10.1093/jn/nxaa210
[40] RAFII M, ELANGO R, BALL R O, et al. Metabolic availability of the limiting amino acids lysine and tryptophan in cooked white African cornmeal assessed in healthy young men using the indicator amino acid oxidation technique[J]. The Journal of Nutrition,2018,148(6):917−924. doi: 10.1093/jn/nxy039
[41] World Health Organization. Protein quality evaluation: Report of the Joint FAO/WHO Expert Consultation, Bethesda, Md, USA 4-8 December 1989[R]. Food & Agriculture Org, 1991.
[42] IOANNIDIS, JOHN P A. The challenge of reforming nutritional epidemiologic research[J]. JAMA: The Journal of the American Medical Association,2018,320(10):969−970. doi: 10.1001/jama.2018.11025
[43] FAWALE O S, GBADAMOSI S O, IGE M M, et al. Effects of cooking and fermentation on the chemical composition, functional, and antinutritional properties of kariya (Hildergardia barteri) seeds[J]. Food Science & Nutrition,2017,5(6):1106−1115.
[44] TUŚNIO A, TACIAK M, BARSZCZ M, et al. Effect of replacing soybean meal by raw or extruded pea seeds on growth performance and selected physiological parameters of the ileum and distal colon of pigs[J]. PloS One,2017,12(1):e0169467. doi: 10.1371/journal.pone.0169467
[45] ALJAHDALI N, CARBONERO F. Impact of Maillard reaction products on nutrition and health: Current knowledge and need to understand their fate in the human digestive system[J]. Critical Reviews in Food Science and Nutrition,2019,59(3):474−487. doi: 10.1080/10408398.2017.1378865
[46] HODGKINSON S M, MONTOYA C A, SCHOLTEN P T, et al. Cooking conditions affect the true ileal digestible amino acid content and digestible indispensable amino acid score (DIAAS) of bovine meat as determined in pigs[J]. The Journal of Nutrition,2018,148(10):1564−1569. doi: 10.1093/jn/nxy153
[47] PINCKAERS P J, WEIJZEN M E, HOUBEN L H, et al. The muscle protein synthetic response following ingestion of corn protein, milk protein and their protein blend in young males[J]. Current Developments in Nutrition,2020,4(Supplement_2):651. doi: 10.1093/cdn/nzaa049_044
-
期刊类型引用(2)
1. 安容慧,陈兴开,常子安,任紫烟,张婕,连欢,贾连文,杨相政. 采后不同时间压差预冷对水蜜桃货架品质和香气成分的影响. 食品工业科技. 2024(09): 317-324 .  本站查看
本站查看
2. 隋海涛,陈东杰,王凤丽,邹泽宇,郭风军,马倩倩,隋青,张长峰,孙崇德. 桃果实采后品质变化机制及调控技术研究进展. 中国果菜. 2024(12): 1-8+19 .  百度学术
百度学术
其他类型引用(2)





 下载:
下载:

 下载:
下载:



