Effect of Cell Generations on t-BHP-induced Oxidative Stress Model of Caco-2 Cells
-
摘要: 目的:探究细胞代次对叔丁基过氧化氢(t-BHP)诱导构建人克隆结肠腺癌细胞(Caco-2)氧化应激模型的影响。方法:以不同浓度t-BHP(1、2和3 mmol/L)处理第F15代Caco-2细胞1、2、3、4、5和6 h后测定不同处理下细胞丙二醛(MDA)和8-羟基脱氧鸟苷(8-OHdG)的含量,以确定构建Caco-2细胞氧化应激模型的基础条件。再以8-OHdG为分子标志物,探究细胞代次(F14、F15、F18、F19和F20)对Caco-2细胞氧化应激模型构建的影响。结果:采用1、2和3 mmol/L t-BHP处理F15代Caco-2细胞3~6 h均可稳定构建氧化应激模型。当以2.0 mmol/L t-BHP处理不同代次Caco-2细胞5 h后,F14、F15和F18代细胞的8-OHdG浓度均显著高于对照(P<0.05),而F19和F20代细胞的8-OHdG浓度与对照无显著差异。结论:Caco-2细胞代次会影响其氧化应激模型的构建,F19代之前的Caco-2细胞采用2 mmol/L t-BHP处理细胞5 h可稳定构建氧化应激模型。Abstract: Objective: To investigate the effects of cell passage number on the establishment of an oxidative stress model in human colon adenocarcinoma cells (Caco-2) caused by tert-butyl hydroperoxide (t-BHP). Methods: First, by applying various t-BHP concentrations (1, 2 and 3 mmol/L) to the F15 generation of Caco-2 cells for 1, 2, 3, 4, 5 and 6 hours, the content of malondialdehyde (MDA) and 8-hydroxydeoxyguanosine (8-OHdG) in different treatment groups were measured to determine the basic conditions for constructing the oxidative stress model of Caco-2 cells. Then, based on the fundamental parameters, the effect of cell passage number (F14, F15, F18, F19 and F20) on the development of oxidative stress model was investigated using the content of 8-OHdG as an index. Results: When exposed to 1, 2 and 3 mmol/L of t-BHP for 3 to 6 hours, the oxidative stress model of Caco-2 cells from the F15 generation could be established steadily. The content of 8-OHdG in Caco-2 cells of the F14, F15 and F18 generations was significantly higher than that in control group (which had not been treated with t-BHP) after being exposed to 2.0 mmol/L t-BHP for 5 hours (P<0.05), whereas there was no significant difference between the F19 and F20 generations and the control group. Conclusion: The development of the oxidative stress model of Caco-2 cells will be strongly impacted by cell passage number. By subjecting Caco-2 cells prior to F19 to 2 mmol/L t-BHP for 5 hours, the oxidative stress model may be successfully constructed.
-
2019年,中国因为慢性病导致的死亡人数占总死亡人数的比例已高达88%,造成的疾病负担占总疾病负担的70%以上,已成为威胁人民健康、影响国家经济、社会发展的重大公共卫生问题[1]。有研究表明氧化应激是导致慢性疾病发生和恶化的主要因素之一[2-5]。具体表现为当机体处于氧化应激态时,机体的氧化系统和抗氧化系统失衡[6],体内产生大量的自由基并攻击脂质、蛋白质和DNA等生物大分子[7-9]。长时间处于氧化应激会造成机体的氧化损伤[10],最终诱导炎症的产生[11-12],导致各类慢性疾病的发生和恶化[13]。
抗氧化剂是能够清除自由基,以达到抑制、消除或减缓氧化反应效果的一类物质。目前已有的维生素C和维生素E是常用的抗氧化应激预防或者治疗的药物,但是长期服用维生素C或维生素E会对人体产生副作用[14],同时人工合成类抗氧化剂也存在一定的安全隐患[15]。因此,研究者们希望通过筛选天然抗氧化产物来预防和治疗各类慢性疾病,而氧化应激模型是筛选抗氧化物质[16-18]以及验证抗氧化物质对各类慢性疾病治疗效果[19-20]最常见的技术手段。由此可见,氧化应激模型的构建在抗氧化物质的筛选及其在慢性疾病治疗效果验证中发挥着至关重要的作用[21]。
目前,在氧化应激模型的构建中,各类细胞系和实验动物均有广泛应用[22],但相较于动物模型,细胞模型由于具有增殖速度快、操作简单、培养周期短、成本低、剂量反应关系易测、不涉及动物伦理等优点而被越来越多的研究人员所采用[23]。现阶段,用于构建氧化应激模型的细胞种类很多,总体依据是选择与目的器官或系统相对应的细胞株[21]。人克隆结肠腺癌细胞(Caco-2细胞)具有与人小肠相似的结构、功能和酶系统[24],因此被研究人员用来构建人小肠氧化应激模型,以筛选出可以治疗和预防小肠氧化损伤的抗氧化物质[25]。目前,应用Caco-2细胞构建氧化应激模型时,主要是采用过氧化氢(H2O2)、叔丁基过氧化氢(t-BHP)等应激源诱导细胞产生氧化损伤从而构建氧化应激模型[26-27]。相比于H2O2,t-BHP的化学性质更稳定,同时也更有利于细胞氧化应激模型的构建[26,28-29]。但目前对于细胞氧化应激模型的构建也存在较多的问题,其中较为重要的一点是,在利用Caco-2细胞构建氧化应激模型时,大部分已发表的文献只记载了构建模型时所需的细胞密度、应激源的浓度以及孵育的时间,细胞的代数被忽略,而细胞代数会影响到细胞的状态[30]。例如,随着代数的增加细胞接受刺激的敏感度不断下降[31],这将直接影响到氧化应激模型的构建,同时后人在借鉴时,也会因为这一信息的缺失而使实验受阻。同时,在本研究前期采用t-BHP诱导Caco-2细胞构建氧化应激模型时也发现细胞代次会影响氧化应激模型的构建。
基于此,本研究首先采用不同浓度的t-BHP处理Caco-2细胞不同时长,通过测定不同处理组中MDA和8-OHdG的含量以确定氧化应激模型构建条件。在此基础上,以8-OHdG为分子生物标志物,采用已确定的构建条件处理不同代次的Caco-2细胞,探究细胞代次对Caco-2细胞氧化应激模型构建的影响,以期为细胞氧化应激模型的构建提供参考。
1. 材料与方法
1.1 材料与仪器
Caco-2细胞(人结肠腺癌细胞) 购于中国科学院典型培养物保藏委员会昆明细胞库,购入的Caco-2细胞为第五代细胞;DMEM高糖培养液 购于Gibco;DMEM/F12培养液、蛋白定量检测试剂盒、PBS 购于Servicebio;胎牛血清、青链霉素混合液和胰蛋白酶-EDTA消化液 购于Solarbio;t-BHP 购于麦克林;MDA试剂盒 购于南京建成生物工程研究所;8-OHdG试剂盒 购于上海酶联生物科技有限公司。
HF90二氧化碳培养箱 上海力申科学仪器有限公司;BDS500倒置生物显微镜 重庆奥特光学仪器责任有限公司;SW-CJ-2F超净工作台 苏州安泰空气技术有限公司;BCD-190WDPT −20 ℃冰箱 海尔智能股份有限公司;MX-S旋涡震荡仪 大龙兴创实验仪器有限公司;DNM-9602G酶标分析仪 北京普朗新技术有限公司。
1.2 实验方法
1.2.1 细胞培养
参照文献[32],将第F13代、F14代、F17代、F18代和F19代Caco-2细胞接种于含有15 mL培养液的75 cm2细胞培养瓶中,置于37 ℃,5% CO2细胞培养箱中培养,培养液成分为:84% DMEM高糖培养基、15 %胎牛血清、1 %双抗。每24 h换液一次,换液量为15 mL,待细胞长满瓶底80%~90%后进行传代。传代时先将培养液弃去,然后加入5 mL PBS清洗一次后弃去,加入1 mL 0.25%胰酶后置于37 ℃培养箱中反应3~6 min,待细胞变成球状后,加入5 mL培养液终止反应,将细胞吹打下来后分装至1.5 mL无菌离心管中,1100 r/min离心5 min。离心结束后将上清液弃去,然后加入1 mL培养液将细胞吹打混匀至单个细胞后,接种至细胞瓶中后分别为F14代、F15代、F18代、F19代和F20代用于后续实验。
1.2.2 t-BHP诱导Caco-2氧化应激模型构建条件的确定
参照文献[33],将F15代Caco-2细胞浓度调至5×105个/mL后,接种于6孔板中,每孔2 mL,每组5个复孔,置于培养箱中培养48 h,每12 h换液一次。48 h后,按给药浓度进行分组(0、1、2、3 mmol/L),对照组加入不含药物和血清的DMEM/F12培养液,给药组按分组加入含药且不含血清的DMEM/F12培养液,置于培养箱中培养,每隔1 h取一次细胞培养液,一直取到第6 h结束。每次每孔取液150 μL置于1.5 mL离心管中,每次取液完毕后将样品迅速保存于−20 ℃冰箱用于丙二醛(MDA)、蛋白质和8-羟基脱氧鸟苷(8-OHdG)浓度的测定,用以确定t-BHP诱导F15代Caco-2细胞氧化应激模型构建的条件。
1.2.3 不同细胞代数对于Caco-2氧化应激模型构建的影响
以1.2.2的实验结果为基础,考虑到本实验需要选择一个稳定而可靠的构建条件,所以选择了一个稳定且适中的浓度(2 mmol/L)和处理时间(5 h)作为实验条件来探究不同细胞代数对于Caco-2氧化应激模型构建的影响。关于实验用到的细胞代次参考文献[34],将第F14代、F15代、F18代、F19代和F20代的Caco-2细胞浓度调至5×105个/mL后,接种于6孔板中,每孔2 mL,每组5个复孔,置于培养箱中培养48 h,每12 h换液一次。按照给药浓度分组(0、2 mmol/L),对照组加入2 mL不含药物和血清的DMEM/F12培养液,给药组按分组加入2 mL含药且不含血清的DMEM/F12培养液,置于培养箱中培养。培养5 h后取细胞培养液,每孔每次取100 μL置于1.5 mL离心管中,取样完毕后迅速保存于−20 ℃冰箱用于8-OHdG浓度的测定。
1.2.4 MDA浓度的测定
将待测样品从−20 ℃冰箱取出后,置于室温(20 ℃)下溶解。待样品完全溶解后采用MDA试剂盒测定样品中的MDA含量(单位为nmol/mL),并采用蛋白质试剂盒测定样品中的蛋白浓度(mg prot/mL),最终以蛋白浓度标定确认样本MDA的浓度(单位为nmol/mg prot)。
1.2.5 8-OHdG浓度的测定
将测样品从−20 ℃冰箱取出后,置于室温(20 ℃)下溶解。待样品完全溶解后按照8-HOdG试剂盒说明书对样品中8-OHdG浓度(ng/L)进行测定。
1.3 数据处理
实验结果使用Excel和GraphPad Prism 7.00软件进行单因素方差分析,所得数据以平均值±标准差表示。各组均数的两两比较均采用LSD (Least-significant difference test),其中P<0.05为显著差异有统计学意义,P<0.01为极显著差异。
2. 结果与分析
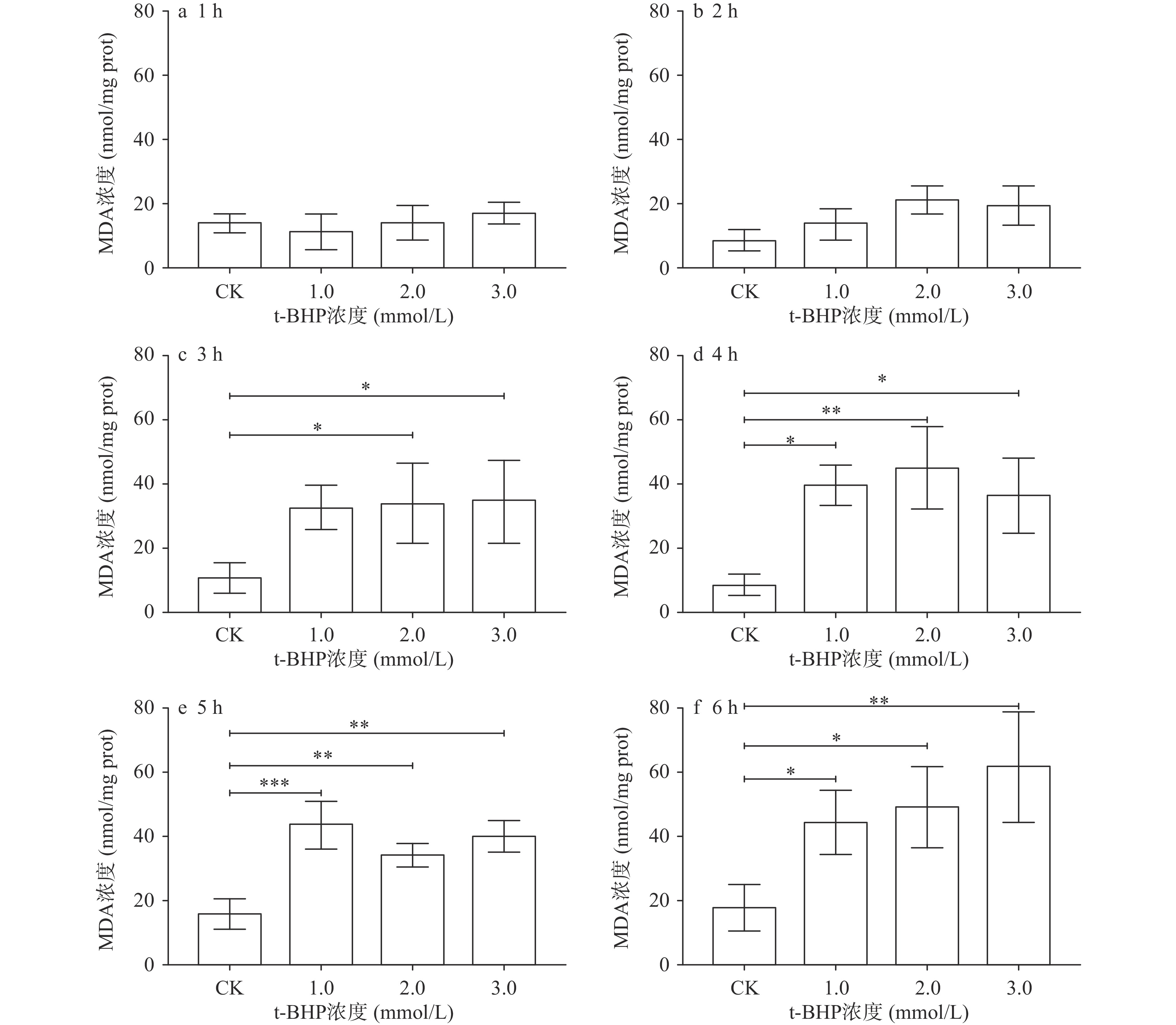
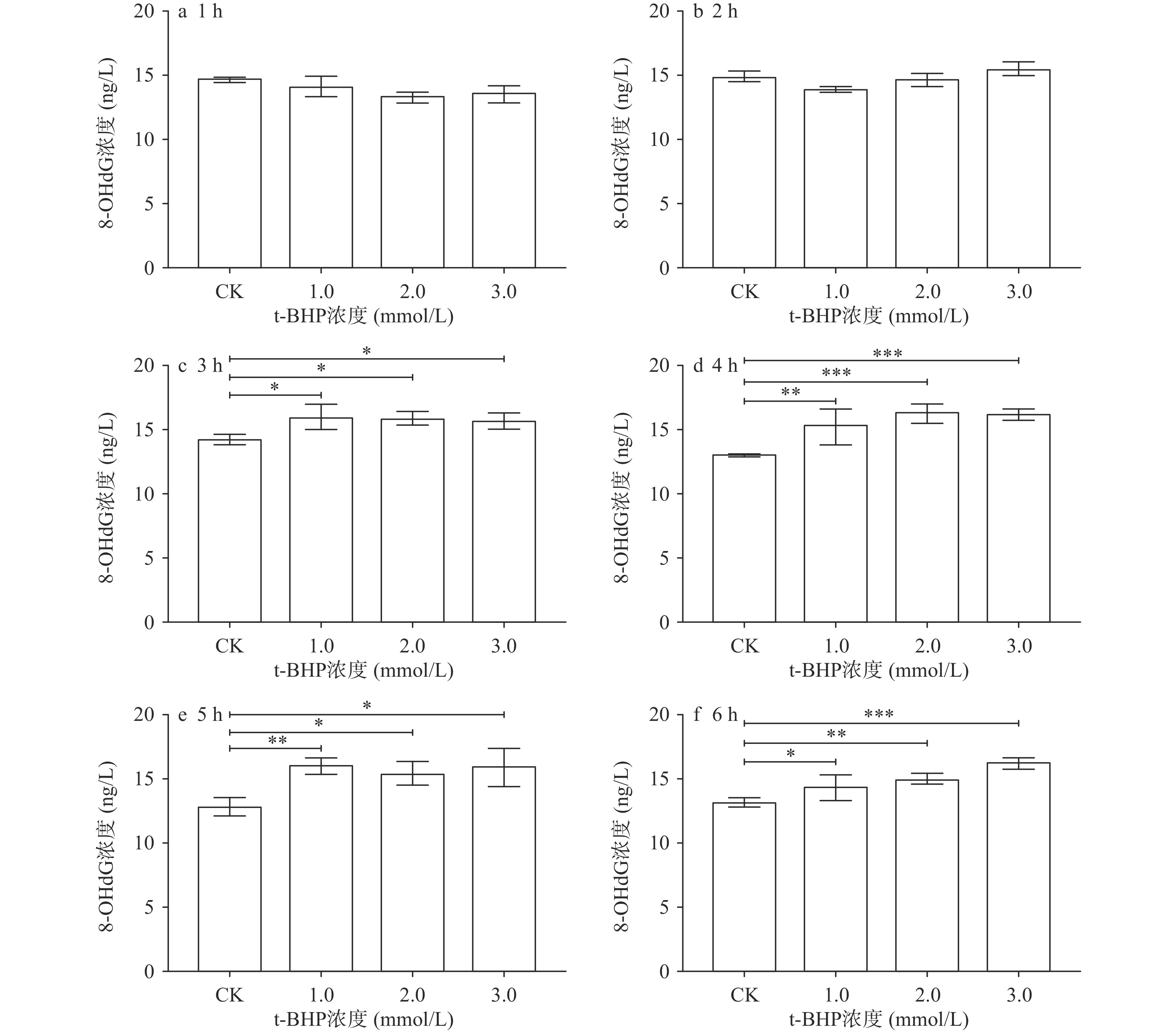
2.1 不同浓度t-BHP处理对F15代Caco-2细胞MDA和8-OHdG含量的影响
当细胞处于氧化应激态时,细胞中会产生大量的自由基并攻击脂质和DNA等生物大分子,生成MDA和8-OHdG等氧化损伤生物标志物[35],因此本实验选用MDA和8-OHdG作为细胞氧化应激模型成功构建的指示分子。采用不同浓度的t-BHP连续处理F15代Caco-2细胞6 h,培养液中MDA和8-OHdG含量的变化如图1和图2所示:分别采用1、2和3 mmol/L t-BHP处理细胞1和2 h时,处理组培养液中MDA和8-OHdG浓度与CK组相比均未出现显著变化(P>0.05)。当采用1 mmol/L t-BHP处理细胞3 h时,处理组培养液中的8-OHdG浓度为16.03±0.489 ng/L,与CK组相比开始出现显著差异(P=0.0143)。同样,当2 mmol/L t-BHP处理细胞3 h时,处理组培养液中的MDA浓度为34.04±7.784 nmol/mg prot,与CK组培相比也开始出现显著差异(P=0.0338)。3 h后,随着t-BHP的浓度的继续提高和处理时间的继续延长,处理组中细胞培养液中MDA和8-OHdG浓度均显著高于对照组(P<0.05)。
综合来看,在本实验室条件下,采用1、2和3 mmol/L t-BHP处理Caco-2细胞3~6 h均可以构建出氧化应激模型。已有研究中,有的采用150 μmol/L t-BHP作用Caco-2细胞4 h[36],或采用3 mmol/L t-BHP处理Caco-2细胞3 h[29],或采用3 mmol/L t-BHP处理Caco-2细胞2 h来构建氧化应激模型[37],可见,目前对于采用t-BHP诱导Caco-2细胞构建氧化应激的条件是不统一的。而造成这一现象的原因,一方面,可能是细胞接种量不同,例如张业尼等[38]采用1×105个细胞的接种量、200 μmol/L H2O2处理HepG-2细胞6 h构建氧化应激模型,而肖琨珉等[39]采用5×103个细胞的接种量、800 μmol/L H2O2处理HepG-2细胞6 h构建氧化应激模型。另一方面,不同生长状态的细胞和不同的评价指标等因素也会造成这一现象的出现[21]。而基于不同条件构建的氧化应激模型来评估产物的抗氧化活性,其结果必将存在差异,如此,极有可能导致抗氧化产物研究领域的混乱,从而阻碍优质产物的开发。因此,建议在后续的研究中建立起统一的氧化应激模型构建实验流程和统一的评价指标,以便于之后在筛选天然抗氧化产物时,使各产物之间具有可比性,同时也可间接加强抗氧化领域中各研究者之间的交流,以推动抗氧化领域的整体发展。
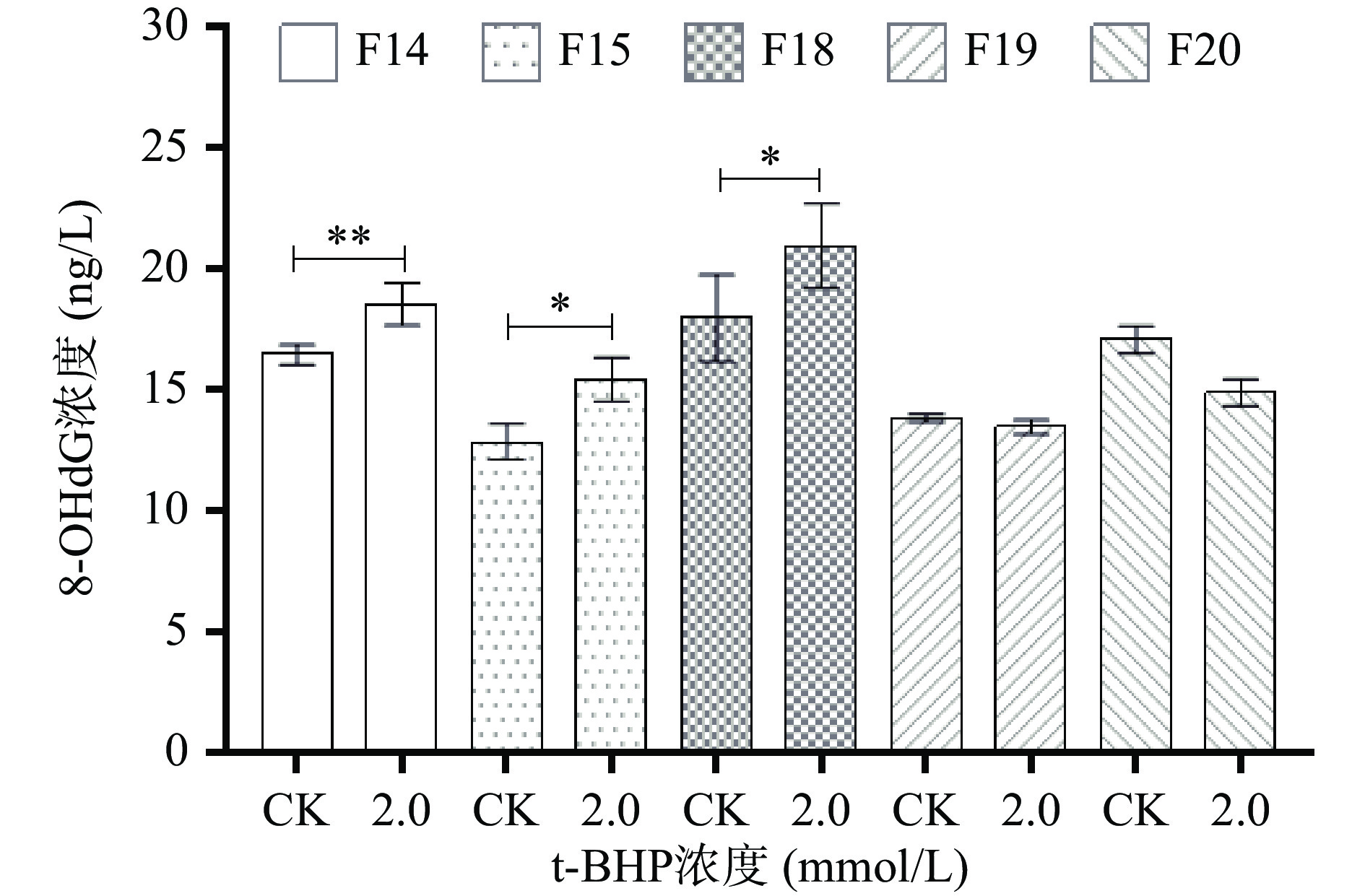
2.2 不同细胞代次对Caco-2细胞内8-OHdG含量测定的影响
细胞的生长状态会直接影响到氧化应激模型的构建。随着细胞代次不断增加,细胞的生长状态必然也会随之发生改变[30]。本研究中,不同细胞代次对Caco-2细胞内8-OHdG含量的影响如图3所示:当使用2 mmol/L t-BHP处理细胞5 h时, F14、F15和F18代细胞处理组培养液中的8-OHdG浓度显著高于CK组(P<0.05),但F19和F20代细胞处理组培养液中的8-OHdG浓度与CK组相比无显著差异(P>0.05)。究其原因,应该是随着Caco-2细胞传代次数的增加,细胞逐渐产生了适应性,因此,其对氧化剂的抗逆性可能会增强。基于此,当采用Caco-2细胞构建氧化应激模型时,需要根据细胞状态,对应调整建模条件。而纵观目前氧化应激模型构建实验报道,大多没有对细胞代次进行描述,其使用的建模条件也存在差异。基于此,建议研究者们应加大对细胞代次影响的研究,并在此基础上建立能通用的氧化应激模型构建条件,以便于不同抗氧化物质筛选结果的横向比较。基于本研究,建议在使用Caco-2细胞构建氧化应激模型时,使用F19代之前的细胞,通过2 mmol/L t-BHP处理细胞5 h进行氧化应激模型的构建。
3. 结论
在本研究条件下,分别利用1、2和3 mmol/L t-BHP处理F15代Caco-2细胞3~6 h,可成功构建氧化应激模型。同时细胞代次会影响Caco-2细胞氧化应激模型的构建。在利用t-BHP诱导Caco-2细胞构建氧化应激模型时,F19代之前的Caco-2细胞采用2 mmol/L t-BHP处理细胞5 h可稳定构建氧化应激模型。同时,由于目前的研究并没有阐释清楚细胞代次是如何影响到氧化应激模型的构建,因此后续的研究应该重点关注于细胞代次对于氧化应激模型构建影响的机理,以为构建细胞氧化应激模型提供参考。
-
-
[1] 杨胜利, 张凯奕. 我国人民健康现状、问题及对策研究[J]. 人口与健康,2021(10):46−48. [YANG S L, ZHANG K Y. Research on health status, problems and countermeasures of Chinese people[J]. Population and Health,2021(10):46−48. [2] REPINE J E, BAST A, LANKHORST I D A, et al. Oxidative stress in chronic obstructive pulmonary disease[J]. American Journal of Respiratory and Critical Care Medicine,1997,156(2):341−357. doi: 10.1164/ajrccm.156.2.9611013
[3] VASSALLE C, GAGGINI M. Type 2 diabetes and oxidative stress and inflammation: Pathophysiological mechanisms and possible therapeutic options[J]. Antioxidants,2022,11(5):953. doi: 10.3390/antiox11050953
[4] 陈渝春, 冯兰超. 癌症患者抗氧化态与氧化应激的变化[J]. 四川医学,2008(7):844−846. [CHEN Y C, FENG L C. Changes of antioxidant status and oxidative stress in cancer patients[J]. Sichuan Medical Journal,2008(7):844−846. doi: 10.3969/j.issn.1004-0501.2008.07.019 [5] BRADES R P, KREUZER J. Vascular NADPH oxidases: Molecular mechanisms of activation[J]. Cardiovasc Res,2005,65(1):16−27. doi: 10.1016/j.cardiores.2004.08.007
[6] SCHIEBER M, CHANDEL N S. ROS function in redox signaling and oxidative stress[J]. Curr Biol,2014,24(10):R453−462. doi: 10.1016/j.cub.2014.03.034
[7] 石宝明, 迟子涵. 自由基对动物的危害及消除技术研究进展[J]. 饲料工业,2021,42(9):1−6. [SHI B M, CHI Z H. Research progress on harm of free radical to animals and its elimination technology[J]. Feed Industry,2021,42(9):1−6. doi: 10.13302/j.cnki.fi.2021.09.001 [8] 骆佳铭, 李机, 赵伟. 氧化应激介导的DNA损伤在大鼠心肌H9C2细胞缺氧/复氧损伤中的作用[J]. 重庆医学,2021,50(12):1993−1997. [LUO J M, LI J, ZHAO W. Role of oxidative stress-mediated DNA damage in hypoxia/reoxygenation damage of rat myocardial H9C2 cells[J]. Chongqing Medicine,2021,50(12):1993−1997. doi: 10.3969/j.issn.1671-8348.2021.12.003 [9] 裘红权, 沈小铁, 刘璟, 等. 脂质过氧化在环境污染物生化效应研究中的应用与展望[J]. 浙江大学学报(农业与生命科学版),2021,47(5):543−556. [QIU H Q, SHENG X T, LIU J, et al. Application and prospect of lipid peroxidation in the study of biochemical effects of environmental pollutants[J]. Journal of Zhejiang University (Agriculture and Life Sciences),2021,47(5):543−556. doi: 10.3785/j.issn.1008-9209.2020.10.281 [10] PIRINCCIOGLU A G, GOKALP D, PIRINCCIOGLU M, et al. Malondialdehyde (MDA) and protein carbonyl (PCO) levels as biomarkers of oxidative stress in subjects with familial hypercholesterolemia[J]. Clinical Biochemistry,2010,43(15):1220−1224. doi: 10.1016/j.clinbiochem.2010.07.022
[11] KULINSKY V I. Biochemical aspects of inflammation[J]. Bio-chemistry,2007,72:595−607.
[12] GILL R, TSUNG A, BILLIAR T. Linking oxidative stress to inflammation: Toll-like receptors[J]. Free Radic Biol Med,2010,128:92−105.
[13] 肖文, 杨旭. 中国大健康面临的关键问题: 能量摄入过剩和氧化炎症[J]. 中国中药杂志,2022,47(4):853−861. [XIAO W, YANG X. A key issue of national health in China: Excess energy intake and oxidative inflammation[J]. China Journal of Chinese Materia Medica,2022,47(4):853−861. [14] 李冰玥, 王梅. 维生素合理应用[J]. 临床合理用药杂志,2019,12(5):180−181. [LI B Y, WANG M. Rational use of vitamins[J]. Chinese Journal of Clinical Rational Drug Use,2019,12(5):180−181. doi: 10.15887/j.cnki.13-1389/r.2019.05.121 [15] JC L. Recent european food safety authority toxicological e-valuations of major phthalates used in food contact materials[J]. Molecular Nutrition Food Res,2009,53(8):1063−1070. doi: 10.1002/mnfr.200800076
[16] 陈香君, 俸婷婷, 杨周洁, 等. 大血藤不同极性部位对H2O2损伤成骨细胞的保护作用研究[J]. 中国骨质疏松杂志,2017,23(3):291−297. [CHEN X J, FENG T T, YANG Z J, et al. Protective effect of sargentodoxa cuneata of different polar fractions on H2O2 induced damage in osteoblasts in vitro[J]. Chinese Journal of Osteoporosis,2017,23(3):291−297. doi: 10.3969/j.issn.1006-7108.2017.03.003 [17] 张艳梅, 敖长金, 萨茹丽, 等. 沙葱总黄酮对过氧化氢诱导的红细胞氧化损伤的保护作用[J]. 动物营养学报,2019,31(2):858−864. [ZHANG Y M, AO C J, SA R L, et al. Protective effects of total flavonoids from Allium mongolicum Regel on oxidative damage of erythrocytes induced by hydrogen peroxide[J]. Chinese Journal of Animal Nutrition,2019,31(2):858−864. doi: 10.3969/j.issn.1006-267x.2019.02.042 [18] 杨松, 王隶书, 刘美辰, 等. 人参多糖对氧化应激损伤肝细胞的保护作用机制研究[J]. 食品工业科技,2020,41(5):280−285, 292. [YANG S, WANG L S, LIU M C, et al. Mechanism of protective effect of ginseng polysaccharide on hepatocytes induced by oxidative stress[J]. Science and Technology of Food Industry,2020,41(5):280−285, 292. doi: 10.13386/j.issn1002-0306.2020.05.046 [19] 李莉, 马升, 张京, 等. 微生物源性抗氧化剂对葡聚糖硫酸钠诱发小鼠肝脏氧化损伤和炎症反应的影响[J]. 动物营养学报,2021,33(7):4123−4132. [LI L, MA S, ZHANG J, et al. Effects of microbe-derived antioxidants on oxidative damage and inflammatory response in liver of mice induced by dextran sulfate sodium salt[J]. Chinese Journal of Animal Nutrition,2021,33(7):4123−4132. doi: 10.3969/j.issn.1006-267x.2021.07.053 [20] 李帅. 硫辛酸对2型糖尿病患者氧化应激反应及炎症递质水平的影响[J]. 现代中西医结合杂志,2015,24(7):717−719. [LI S. Effects of lipoic acid on oxidative stress response and inflammatory transmitter levels in type 2 diabetes mellitus[J]. Modern Journal of Integrated Traditional Chinese and Western Medicine,2015,24(7):717−719. doi: 10.3969/j.issn.1008-8849.2015.07.013 [21] 何方婷, 陈嘉熠, 徐佳伊, 等. 氧化应激细胞模型建立的研究进展[J]. 食品工业科技,2019,40(7):341−345. [HE F T, CHEN J Y, XU J Y, et al. Research progress of establishing cellular oxidative stress model[J]. Science and Technology of Food Industry,2019,40(7):341−345. doi: 10.13386/j.issn1002-0306.2019.07.059 [22] 张斌, 夏作理, 赵晓民, 等. 氧化应激模型的建立及其评价[J]. 中国临床康复,2006(44):112−114. [ZHANG B, XIA Z L, ZHAO X M, et al. Establishment and evaluation of oxidative stress models[J]. Chinese Journal of Tissue Engineering Research,2006(44):112−114. [23] 张思远. 水胺硫磷和甲氰菊酯对人体SH-SY5Y细胞的单一及联合效应研究[D]. 重庆: 西南大学, 2017 ZHANG S Y. Individual and combined effect of isocarbohos and fenpropathrin to human neuroblastoma cell line SH-SY5Y[D]. Chongqing: Southwest University, 2017.
[24] 关溯, 陈孝, 黄民. Caco-2细胞模型——药物吸收研究的有效“工具”[J]. 中国药理学通报,2004(6):609−614. [GUAN S, CHEN X, HUANG M. Caco-2 cell model——an effective tool for the research of drug absorption[J]. Chinese Pharmacological Bulletin,2004(6):609−614. doi: 10.3321/j.issn:1001-1978.2004.06.003 [25] 万正瑞, 李强强, 王凯, 等. 夏枯草蜂蜜提取物对硫酸葡聚糖诱导肠上皮细胞损伤的保护作用及其机制[J]. 食品科学,2020,41(19):161−169. [WAN Z R, LI Q Q, WANG K, et al. Protective effect and mechanism of Prunella vulgaris honey extract on dextran sulfate sodium-induced injury in Caco-2 cells[J]. Food Science,2020,41(19):161−169. doi: 10.7506/spkx1002-6630-20190926-321 [26] 李亚会, 吉薇, 吉宏武, 等. 远东拟沙丁鱼抗氧化肽对Caco-2细胞氧化应激损伤的影响[J]. 广东海洋大学学报,2016,36(6):94−99. [LI Y H, JI W, JI H W, et al. Effect of antioxidant peptide from sardinops sagax on oxidative stress injury on Caco-2 cell[J]. Journal of Guangdong Ocean University,2016,36(6):94−99. doi: 10.3969/j.issn.1673-9159.2016.06.015 [27] 张景禹, 解万翠, 车红霞, 等. 超声辅助制备金乌贼墨黑色素及其对Caco-2细胞氧化损伤的保护作用[J]. 食品与机械,2020,36(5):155−159, 181. [ZHANG J Y, XIE W C, CHE H X, et al. Preparation of ink melanin from sepia esculenta by ultrasound-assisted and its protective effects on oxidative damage in Caco-2 cells[J]. Food & Machinery,2020,36(5):155−159, 181. doi: 10.13652/j.issn.1003-5788.2020.05.029 [28] ALÍA M, RAMOS S, MATEOS R, et al. Response of the antioxidant defense system to tert-butyl hydroperoxide and hydrogen peroxide in a human hepatoma cell line (HepG2)[J]. Jornal Biochem Molecular Toxicology,2005,19(2):119−128. doi: 10.1002/jbt.20061
[29] GARCIA-NEBOT M J, RECIO I, HERNANDEZ-LEDESMA B. Antioxidant activity and protective effects of peptide lunasin lunasin agsinst oxidative stress in intestinal Caco-2 cell[J]. Food and Chemical Toxicology,2014,65:155−161. doi: 10.1016/j.fct.2013.12.021
[30] 周芮, 张磊, 杨小萍, 等. 人脂肪源性血管外膜细胞的分离培养和生物学功能分析[J]. 细胞与分子免疫学杂志,2021,37(4):315−321. [ZHOU R, ZHANG L, YANG X P, et al. Isolation, culture and biological functions of human adipose-derived pericytes/perivascular cells[J]. Chinese Journal of Cellular and Molecular Immunology,2021,37(4):315−321. doi: 10.13423/j.cnki.cjcmi.009175 [31] 赵丽红, 韩玉帅, 邓旭明, 等. IGF1对不同培养代数梅花鹿鹿茸: 间充质层细胞增殖的影响[J]. 中国农学通报,2010,26(5):5−7. [ZHAO L H, HAN Y S, DENG X M, et al. Effects of insulin-like growth factor 1 on the proliferation of sika deer antler mesenchymal layer cells at different generation[J]. Chinese Agricultural Science Bulletin,2010,26(5):5−7. [32] FUENTES J, DE CAMARGO A C, ATALA E, et al. Quercetin oxidation metabolite present in onion peel protects Caco-2 cells against the oxidative stress, NF-κB activation, and loss of epithelial barrier function induced by NSAIDs[J]. Journal of Agricultural and Food Chemistry,2021,69(7):2157−2167. doi: 10.1021/acs.jafc.0c07085
[33] MARTÍNEZ M A, ARES I, MARTÍNEZ M, et al. Brown marine algae Gongolaria baccata extract protects Caco-2 cells from oxidative stress induced by tert-butyl hydroperoxide[J]. Food and Chemical Toxicology,2021,156:112460. doi: 10.1016/j.fct.2021.112460
[34] XU F, WANG L, JU X, et al. Transepithelial transport of YWDHNNPQIR and its metabolic fate with cytoprotection against oxidative stress in human intestinal Caco-2 cells[J]. Journal of Agricultural and Food Chemistry,2017,65(10):2056−2065. doi: 10.1021/acs.jafc.6b04731
[35] 武阳, 常青, 杨旭. 不同浓度甲醛致大鼠肝细胞DNA氧化损伤作用[J]. 环境科学学报,2009,29(11):2415−2419. [WU Y, CHENG Q, YANG X. Oxidative DNA damage in rat liver cells induced by formaldehyde at different concentrations[J]. Acta Scientiae Circumstantiae,2009,29(11):2415−2419. doi: 10.13671/j.hjkxxb.2009.11.030 [36] 杨文, 韩凌, 危建安, 等. 四君子汤对t-BHP诱导Caco-2细胞氧化损伤的改善及机制探讨[J]. 时珍国医国药,2015,26(11):2568−2571. [YANG W, HAN L, WEI J A, et al. Discussion on improvement and mechanism of Sijunzi Decoction for t-BHP induced oxidantive damage of Caco-2 cells[J]. Lishizhen Medicine and Materia Medica Research,2015,26(11):2568−2571. [37] YOUSR M, ALOQBI A, OMAR U, et al. Antioxidant effect of egg yolk peptides against tert-butyl hydroperoxide induced oxidative stress in Caco-2 colon cancer cells[J]. Food Sci Technol,2016,4:36−41. doi: 10.13189/fst.2016.040302
[38] 张业尼, 钱磊, 陈雪, 等. 过氧化氢诱导HepG2细胞氧化应激模型的建立[J]. 食品研究与开发,2018,39(5):160−164. [ZHANG Y N, QIAN L, CHEN X, et al. Establishment of hydrogen peroxide induced oxidative stress model in HepG2 cells[J]. Food Research and Development,2018,39(5):160−164. doi: 10.3969/j.issn.1005-6521.2018.05.029 [39] 肖琨珉, 孔晨帆, 姚树坤. 龙胆苦苷对过氧化氢诱导HepG2细胞氧化应激损伤的保护作用研究[J]. 世界中西医结合杂志,2019,14(11):1530−1534. [XIAO K M, KONG C F, YAO S K. Protective effect of gentiopicrin on oxidative stress damage in HepG2 cells induced by H2O2[J]. World Journal of Integrated Traditional and Western Medicine,2019,14(11):1530−1534. doi: 10.13935/j.cnki.sjzx.191112 -
期刊类型引用(3)
1. 郭新颖. 柱前衍生-高效液相色谱法测定鱼类中组胺. 化学分析计量. 2024(01): 12-16 .  百度学术
百度学术
2. 王建凤,冯月超,王颖,刘艳,周阳,刘佳. 鱼露中章鱼胺含量分析及衍生化产物结构推断. 分析仪器. 2024(04): 64-69 .  百度学术
百度学术
3. 卢竹阳,邵彪,王琳琳,许晶晶,张霞,李玲玉,沈蕾. 冷藏时间对大黄鱼、鲳鱼中生物胺含量变化的影响. 肉类研究. 2024(11): 41-46 .  百度学术
百度学术
其他类型引用(1)





 下载:
下载:
 下载:
下载:



