Visualization Analysis of Research Progress and Trends for the Biological Activities of Moringa oleifera Lam.
-
摘要: 基于Web of Science(简称WOS)核心合集和中文CNKI数据库收录的辣木生物活性研究相关文献,借助Citespace(5.8R3版本)可视化计量工具,对2000~2021年收录的文献进行了可视化分析和图像处理。首次回顾了二十年间辣木生物活性的研究历程和进展,并跟踪分析其年度文献分布、研究机构、国家/地区分布等情况;通过关键词和文献共被引聚类分析了国内外研究热点的时间变化趋势。通过文献调研发现,辣木在防治代谢性疾病上有着显著的优势,并就此较详尽地综述了其研究现状与进展。通过活性可视化分析,旨在使国内科研工作者较全面了解辣木生物活性研究的较新动态,关注和预测未来研究热点可能的发展趋势,为推动辣木高值化利用提供参考信息。
-
关键词:
- 辣木 /
- 生物活性 /
- Citespace(5.8R3) /
- 可视化分析
Abstract: Based on the databases of Web of Science (WOS) core collection and CNKI, we performed the visual analysis to the biological activity study of Moringa oleifera Lam. included in these databases from 2000 to 2021 by means of Citespace software (5.8 R3 vision). Anyway, it is the first time that the retrospective study on the biological activity study of M. oleifera Lam. during the past two decade were investigated through Citespace information-visualization analysis method, it is helpful for its prospective study on research hotspot prediction. In this article, we trailed and analyzed several dimensions which included their annual literature distribution, research institutions, national/regional distribution, and so on. Furthermore, the change trends of their research hotspots in the home and abroad with the time change also were analyzed through the keywords and Citespace co-citation clustering, the visual network characteristics of hot topics and evolution revealed the change trend. Eventually, through the investigation study on the reported literatures, we found that Moringa oleifera Lam. had significant advantages in preventing and treating many metabolic diseases. In this regard, we reviewed its current research progress in detail. To sum up, through bring Citespace information-visualization analysis methods to the biological activity study of M. oleifera Lam.in this paper, it was aimed to enable scientific researchers to have a more comprehensive understanding on the activity study trends of M. oleifera Lam., and attract their attention to potential research hotspots, and further promote high value utilization of M. oleifera Lam.. -
辣木(Moringa oleifera Lam.),别名鼓槌树、黄金树、不死树、萝卜树、山葵树,为十字花目辣木科辣木属多年生热带落叶深根系乔木。树龄约30年,树高可达12米,枝干脆软似伞状,根具辛辣味;叶片类羽状复叶,椭圆或卵形,质地柔软;花瓣白色或奶黄色,气味醇香;种子外观呈褐色,圆形状,有3个纸质白翼,可随采随播。辣木主根长,喜温耐旱,耐贫瘠,但忌积水,在半干旱和热带湿润地区均能速生。目前,辣木已广泛分布于亚洲、非洲和南美洲的热带、亚热带国家或地区[1]。
辣木作为药食两用植物有着悠久的使用历史。辣木在泰国传统医学中用作强心剂,根据印度和非洲的传统医学,辣木可用于精神焦虑、咽喉肿痛、坏血病、风湿性关节炎、咳嗽、痔疮、心血管疾病和糖尿病等的治疗[2];并因其全面丰富的营养成分[3],富含钾、钙、铁、锌、氨基酸、维生素以及高不饱和脂肪酸、蛋白质和甾醇等营养物质,因而被国际社会推荐用作解决贫穷地区(如西非国家)儿童营养不良的“绿色黄金”;随着辣木的推广应用,更多研究表明,它集多种功效活性于一身,譬如抗癌、抗炎、抗氧化、降脂、降糖、降压、保肝、调节免疫等[4-8]作用,但对其发挥功效活性的具体机制方面还有待进一步深入研究。
近十年来,国外对辣木功能活性的相关研究迅猛增加,但目前对辣木生物活性功能研究领域总体特征以及发展趋势的系统性报道尚少。本文借助Citespace(5.8 R3)软件对辣木活性研究相关文献进行可视化计量分析[9],对其研究发展现状、热点主题与前沿热点进行系统性梳理,并详细综述了辣木在代谢性疾病方向的研究进展,为辣木生物功能活性的研究提供参考。
1. 资料与方法
1.1 研究资料
1.1.1 文献来源
以Web of Science(WOS)核心合集和中文CNKI数据库为数据来源,检索截止时间:2021年12月31日。
1.1.2 检索方法
WOS核心合集数据库:检索词(主题="Moringa oleifera")OR(Moringa oleifera Lam.)AND检索年限:2000年1月1日~2021年12月31日;中国知网CNKI数据库:检索词(主题=“辣木”);检索年限:2000年1月1日~2021年12月31日;其余参数设定默认。
1.1.3 纳入标准
WOS核心合集数据库:(文献类型="Article")AND(语种="English");中文CNKI数据文献:期刊论文和学位论文。
生物活性相关文献要求:对文献题目、摘要的内容进行人工筛查并对信息不全(如缺失DOI、摘要、期刊名称、年卷号等信息)以及和辣木生物活性研究主题无关的文献进行排除。
1.2 研究方法
1.2.1 参数设置
a. Time Slicing功能参数区:WOS和CNKI分析时间均为2000~2021年,Time Slicing设置为1;b. Text processing功能参数区:Term Source和Term Type均采用系统默认;c. Node Types功能参数区:WOS选择Reference、Keyword、Institution、Country;CNKI则选择Keyword、Institution、Country;Links及Selection Criteria均采用系统默认;d. Pruning参数和功能区:除国家/地区和机构合作外,其余采用Pathfinder、Purning Sliced Networks。
1.2.2 数据分析
以年度文献分布、机构、国家/地区分布、被引文献等为主要调查指标,对纳入标准的文献按照调查指标进行可视化分析。利用Citespace对被引文献或关键词进行聚类分析,采用Pathfinder、Pruning Sliced Networks裁剪功能,Label Cluster with Indexing Terms(对索引词作标签聚类),并结合LLR运算法对纳入的文献关键词分别进行聚类分析,通过Modularity Q(>0.5)和Silhouette(>0.3)两个指标来判定聚类结果是否有差异显著性[10]。
2. 结果与分析
2.1 检索结果
检索时间区间:2000年1月1日~2021年12月31日,检索WOS核心合集和CNKI数据库分别得到3155篇和1308篇文献。按照“1.1.3”,对WOS核心合集和中文CNKI数据库精炼后分别得到2789篇和1155篇,最后人工逐一筛选得到有关辣木在生物活性方面的研究文献分别约504篇和189篇。
2.2 年发文量分布
本文从WOS和中文CNKI数据库中纳入的标准文献数量分布如图1所示。2000~2012年,国内外有关辣木生物活性研究性SCI论文发文量呈现逐年递增趋势,且整体上国外年均发表量高于国内。我国从2003年开始有少量学者开始关注该领域并发文,自2012年我国卫生部批准辣木叶作为食品新资源,辣木逐渐走进国人视野,2015年后,我国发文量才逐渐增加,自2017年至今发文量保持在年20篇以上,且发文量呈现快速上升态势。但我国和国外自2020年起年发文量均呈下降趋势,这可能与新冠全球大流行的背景有关。从年发文量趋势来看,辣木生物活性研究正处于较快增长阶段,很多生物活性正处于关注热点,譬如抗代谢性疾病防治方面,而且存在很多潜在研究空间,预计国内外未来发文量还将分别持续增加。
2.3 国内外机构合作分布
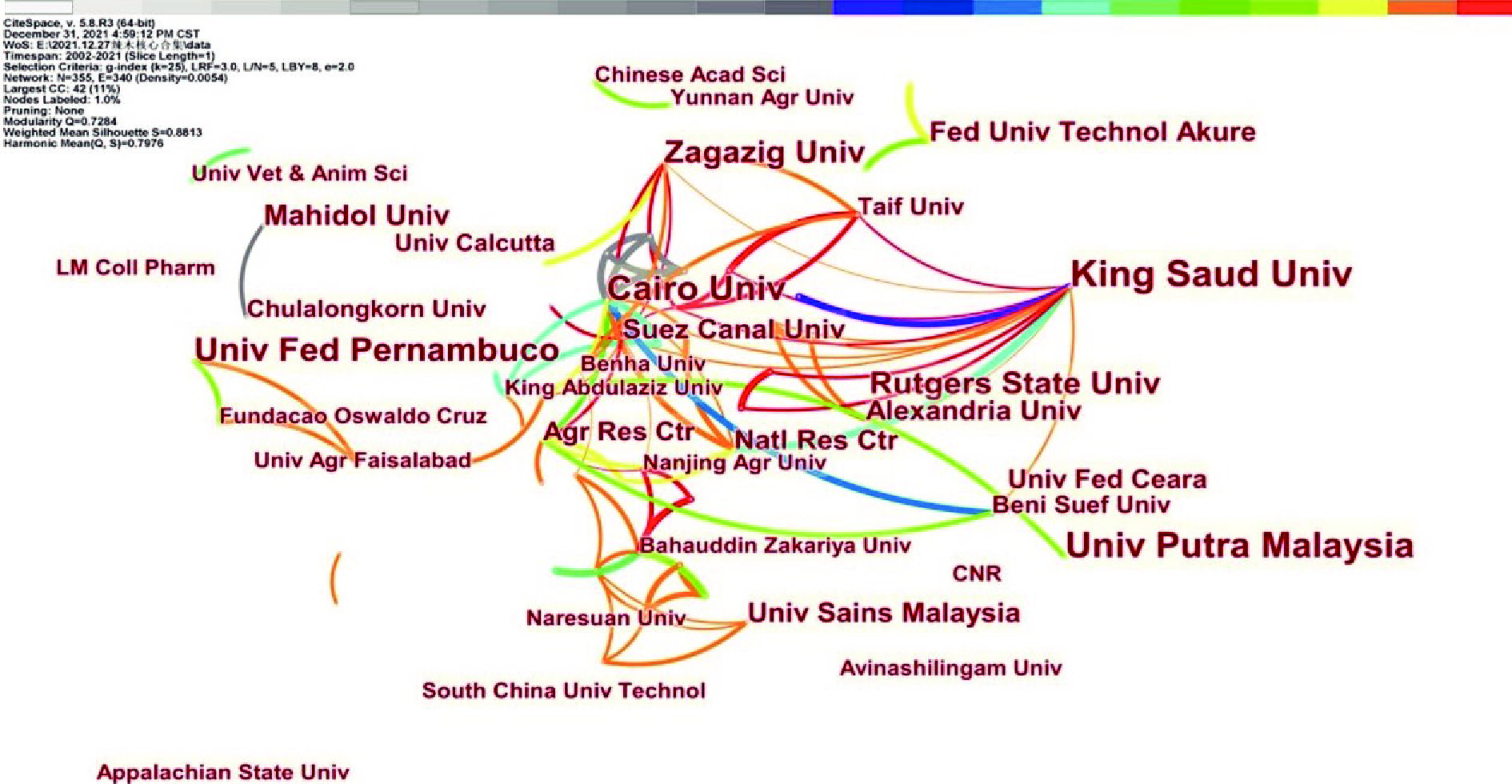
国内外对辣木生物活性研究机构和国家/地区合作关系图谱见图2和图3。
如图2和图3所示,全球报道辣木生物活性的研究机构以高校为主。对辣木活性研究的机构在世界各地均有分布,其中沙特国王大学(King Saud Univ)、开罗大学(Cairo Univ)、马来西亚博特拉大学(Univ Putra Malaysia)、伯南布哥大学(Univ Fed Pernambuco)、扎加济哥大学(Zagazig Univ)等是主要研究机构,根据图谱网络节点的稀疏、连线以及时间颜色来看,近年来,国外的研究机构整体地域跨度较大,多为国内或多国合作,其中沙特国王大学、开罗大学、扎加济哥大学以及苏伊士运河大学(Suez Canal Univ)与国内外的高校合作较为密切,预计未来国外对辣木的研究主要以上核心高校机构为主,且各国之间的合作进一步加强;相较于国外,我国对辣木进行深入研究的机构主要以云南省药物研究所、西南林业大学、深圳技术大学、遵义医科大学、云南农业大学、华南理工大学以及中国林业科学研究院等高校或研究所为主,这些机构大多数分布在云南、广东、广西、四川、南京、江西和福建等地。但从节点之间的连线、颜色、大小来看,我国不同高校或研究所之间的合作强度较弱,并未形成以某机构为核心的合作中心,建议未来我国这些机构加强合作,实现共赢。
2.4 国家/地区合作
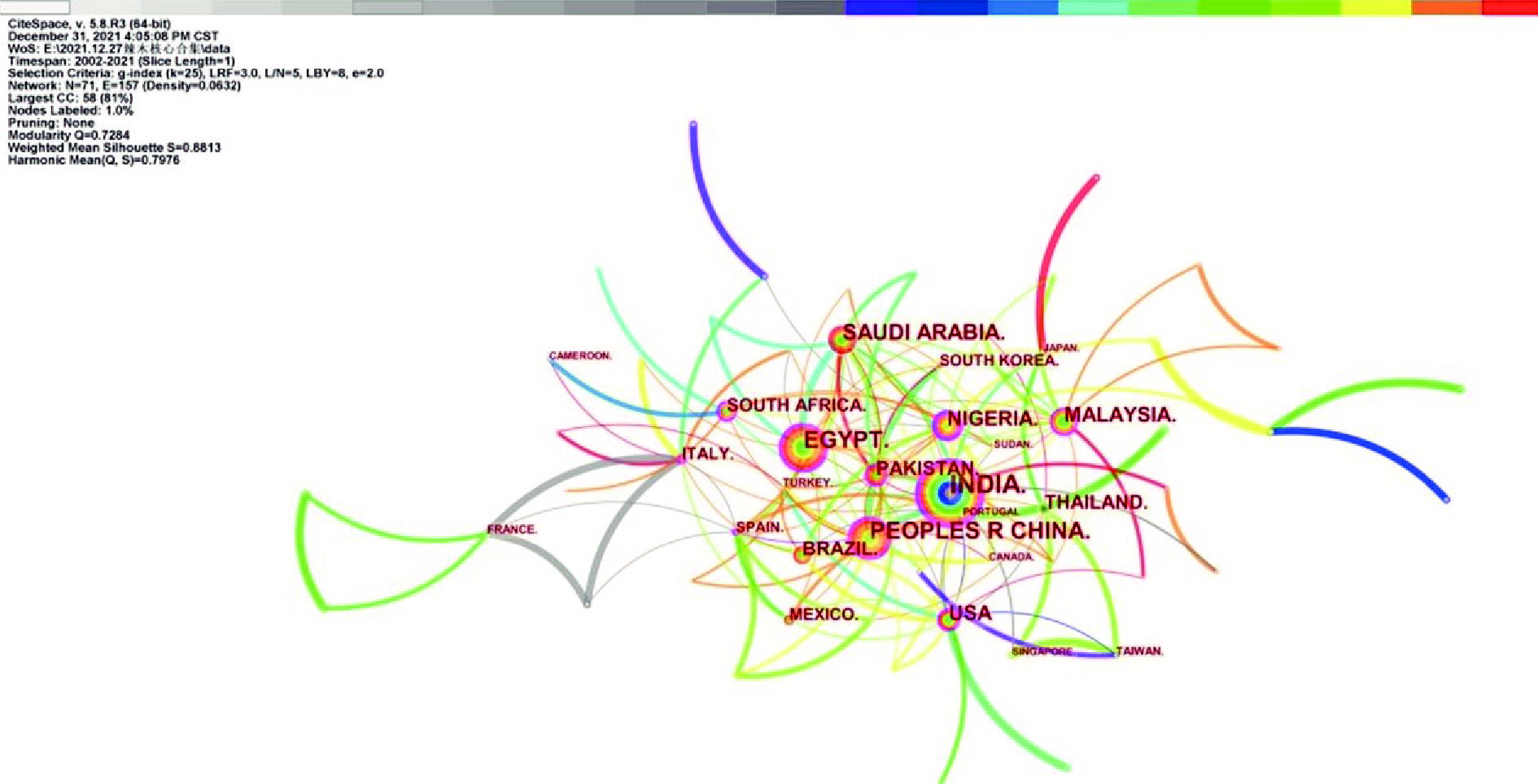
图4显示,发文作者主要集中在发展中国家和地区。其中,发文量最高的国家是印度(97篇),表明印度是辣木生物活性研究领域的主要国家;其次是埃及、中国、沙特阿拉伯和美国等。在中心性排名前十中,尼日利亚中心性值最高(0.29),表明尼日利亚在该领域的研究性论文具有重要的学术参考价值,其次为印度(0.21)、美国(0.19)、埃及(0.19)、中国(0.19)、马拉西亚(0.16)、意大利(0.14)、西班牙(0.14)、南非(0.13)和巴基斯坦(0.11)等。从发文量和中心性值来看,近二十年来,中国成为全球研究辣木较为活跃的国家,受到国内外越来越多的科研人员关注。
![]() 图 4 2000~2021年辣木生物活性研究相关国家分布图谱注:网络节点的大小代表文献涉及该国家的频次;节点间连接线的数量和粗细代表节点间的合作强度;中心性代表该节点关联强度的大小,拥有紫色外圈的节点代表具有高度中介中心性[9];颜色从灰色到红色代表时间的远近。Figure 4. The cooperation of relevant countries in the study of Moringa oleifera biological activity from 2000 to 2021
图 4 2000~2021年辣木生物活性研究相关国家分布图谱注:网络节点的大小代表文献涉及该国家的频次;节点间连接线的数量和粗细代表节点间的合作强度;中心性代表该节点关联强度的大小,拥有紫色外圈的节点代表具有高度中介中心性[9];颜色从灰色到红色代表时间的远近。Figure 4. The cooperation of relevant countries in the study of Moringa oleifera biological activity from 2000 to 20212.5 WOS文献共被引和中文CNKI关键词共现分析
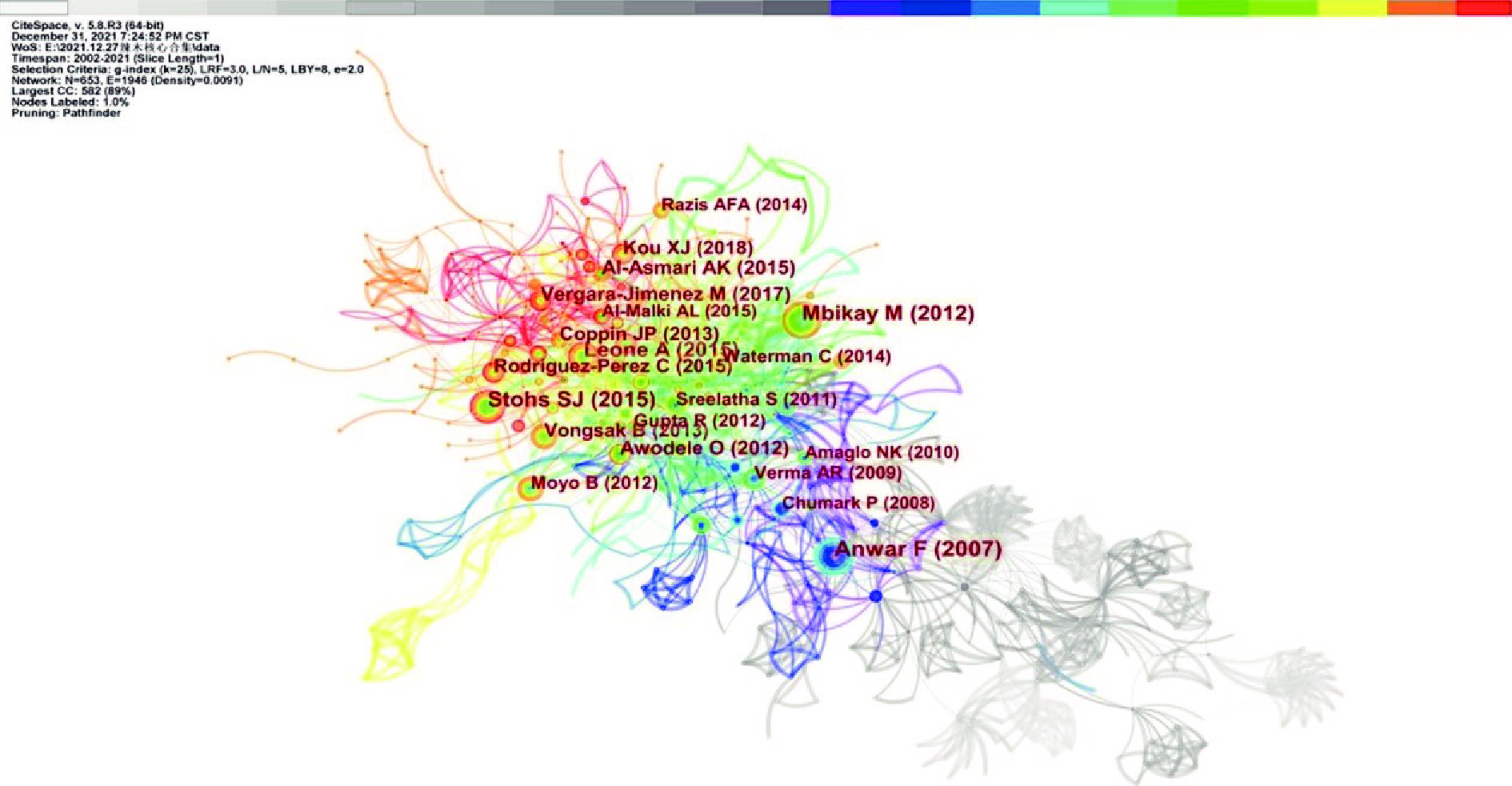
文献的被引频次在一定程度上反映了文章被认可程度和学术水平。通过软件构建共被引文献知识图谱(图5),并结合共被引频次和中心性排名前十的被引文献(表1),发现节点中心性值最高的文献是Amaglo等[11]发表在《Food Chemistry》上关于辣木不同组织化学成分和营养物质的综述文章;而共被引被频次最高的文献是Anwar等[12]发表在《Phytother Res》上有关辣木化学成分的综述。Stohs等[13]在《Phytotherapy Research》发表的辣木潜在的药理活性综述也获得高频次引用;此外,Mbikay等[14]发表在《Front Pharmacol》上关于辣木防治慢性高脂血症的综述也成为高频被引用文章。可以看出的是,以上高被引的文章大多为文献综述,综述了辣木的化学成分及其生物活性,而且多篇高被引文献均归纳提及到降血糖和降血脂等优势,在一定程度上引导人们将目光转移到辣木对代谢类疾病的防治方向,将成为未来新的研究热点。
表 1 2000~2021年辣木生物活性研究共被引文献频次和中心性值(前十)Table 1. The frequency and centrality value of co-cited documents in the study of Moringa oleifera biological activity from 2000 to 2021 (Top 10)序列 频次 被引文献及其来源 中心性 被引文献及其来源 1 52 Anwar等[12], PHYTOTHER RES 0.31 Amaglo等[11], FOOD CHEM 2 50 Stohs等[13], PHYTOTHER RES 0.29 Anwar等[15], J AGR FOOD CHEM 3 48 Mbikay等[14], FRONT PHARMACOL 0.20 Anwar等[12], PHYTOTHER RES 4 44 Leone等[16], INT J MOL SCI 0.14 Awodele等[17], J ETHNOPHARMACOL 5 31 Al-Asmari等[18], PLOS ONE 0.13 Adedapo等[19], J MED PLANTS RES 6 30 Vergara-Jimenez等[20], ANTIOXIDANTS-BASEL 0.12 Kar等[21], J ETHNOPHARMACOL 7 29 Awodele等[17], J ETHNOPHARMACOL 0.11 Mbikay等[14], FRONT PHARMACOL 8 28 Rodriguez-Perez等[22], IND CROP PROD 0.11 Verma等[23], FOOD CHEM TOXICOL 9 27 Vongsak等[24], IND CROP PROD 0.11 Iqbal等[25], J FOOD COMPOS ANAL 10 27 Kou等[26], NUTRIENTS 0.09 Ghasi等[27], J ETHNOPHARMACOL 本文还补充了中文CNKI数据库有关生物活性研究性论文189篇文献,对其关键词进行共现拟合分析(见图6)。将一些词义相近、重复的关键词进行合并处理,如血脂、调节血脂、脂质代谢、高脂血症合并为高脂血症;絮凝、吸附合并为絮凝;最后提取前十名的高频关键词,频次最高的是辣木籽72次,其次为辣木叶51次、高脂血症43次、辣木36次、多糖32次、抗氧化27次、响应面25次、絮凝18次、肝功能18次和总黄酮10次。可以看出国内对辣木籽、辣木叶、辣木多糖和糖脂代谢的研究一直保持较高热度,但与国外研究还有较大差距。
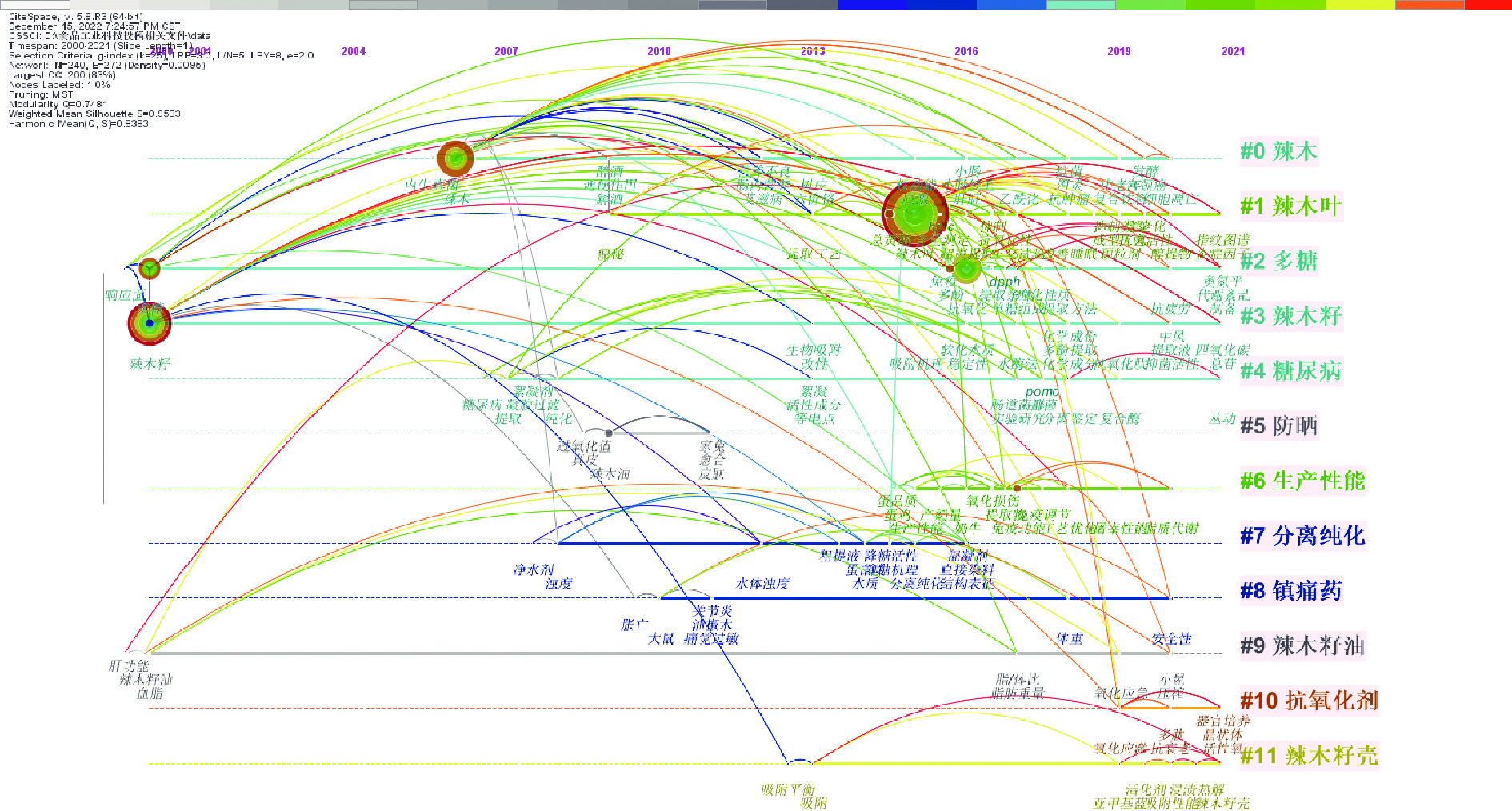
2.6 WOS共被引文献关键词和中文CNKI关键词聚类分析
在文献被引分析中,被引文献可看作施引文献的知识理论研究根据,而某研究领域中多数被引文献的聚类则可看作是该研究领域的知识基础,而对被引文献关键词的聚类还可以在一定程度上推测出研究热点的演变趋势,因此本文采用对数极大似然率(即LLR)算法对WOS数据文献的被引文献关键词进行聚类拟合分析(见图7),可从整体上把握国外学者对辣木生物活性研究领域的知识基础框架和研究热点主题的演变。
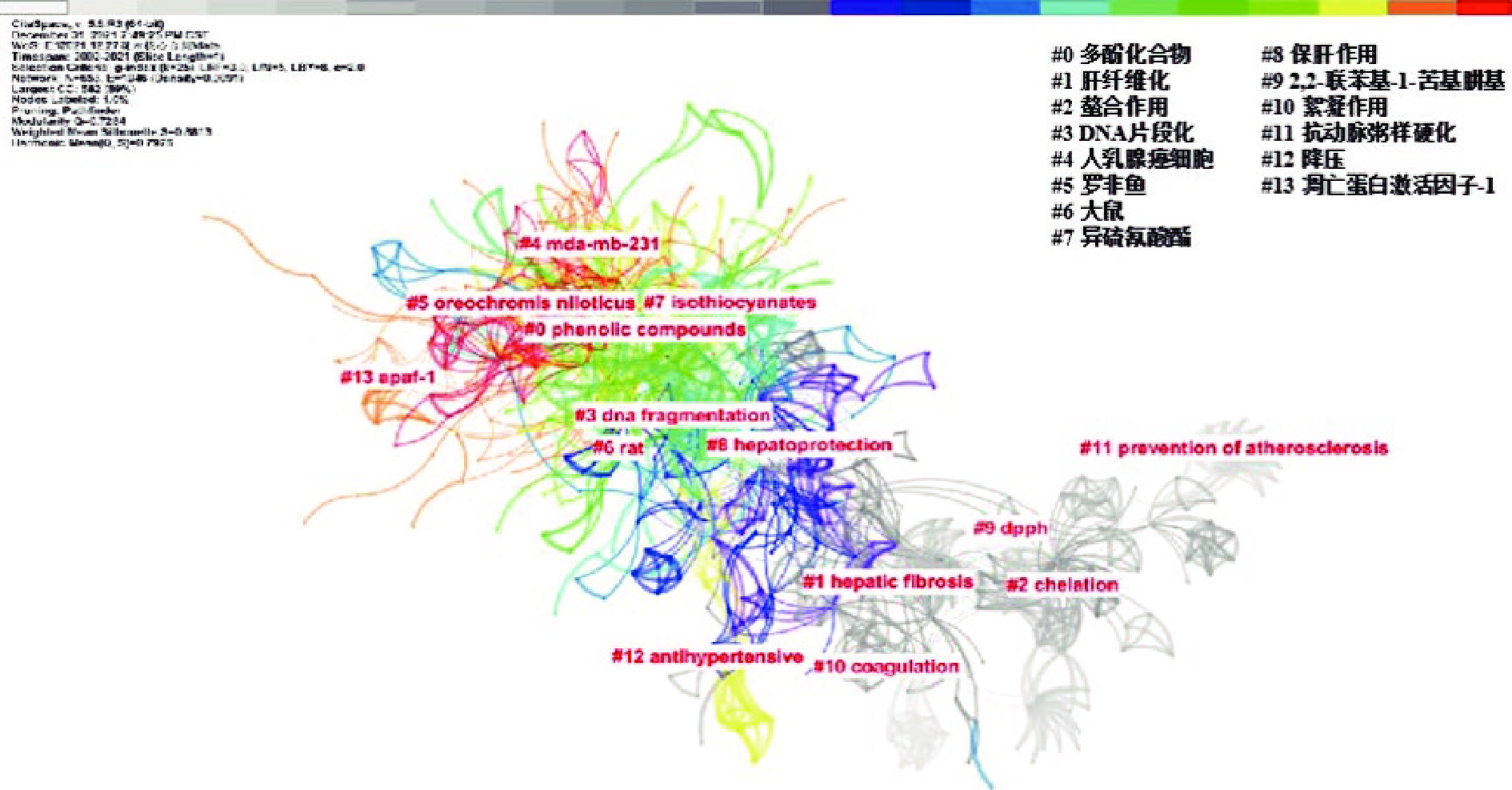
从图7可以看出,该聚类分析得到模块度Q为0.7284,平均轮廓线S为0.8813,大于软件可靠性的临界值,即可视化图谱拟合符合要求。结果显示共有14个聚类,国外文献报道围绕多酚类化合物、异硫氰酸酯、保肝、抗氧化、抗肿瘤、降压、抗动脉粥样硬化和絮凝作用、凋亡蛋白激活因子-1等研究较多。
为了进一步了解国内辣木研究热点的发展趋势,采用LLR算法对中文CNKI关键词进行聚类拟合,拟合结果见图8。关键词Q和S值均>0.7,表明聚类结果可信。图中显示共形成12个聚类标签,主要与辣木籽、辣木叶、抗氧化、提取工艺、多糖、抗炎止痛、防晒护肤以及糖尿病等方面的研究方向有关。
2.7 国内外前沿研究热点分析
在WOS共被引文献关键词聚类和CNKI关键词聚类分析的基础上,采用Timeline View方式呈现出国内外辣木生物活性研究的热点时间分布,如图9、图10所示。由图9和图10可知,近二十年辣木生物活性的研究热点发生变化,国外前十年主要集中在抗动脉粥样硬化、保肝、抗氧化、螯合和絮凝作用等,随着分子生物学的高速发展,加上人们对辣木生物功能活性认知的不断加深,发现辣木具有众多药理活性,近十年来辣木抗肝纤维化、降高血压和抗乳腺癌等方面是主要研究热点,其研究辣木生物活性成分主要是多酚化合物、异硫氰酸酯等;而我国前十年主要侧重于辣木籽和辣木籽油的活性研究如絮凝、防晒护肤作用等,近十年的研究则集中在抗氧化、降血脂、降糖、抗炎、调节免疫、神经保护以及作为饲料添加研究其对鹌鹑、肉鸡、雏鸭的生产性能研究等。
根据以上WOS共被引文献关键词和中文CNKI关键词聚类分析,大致将国外对辣木生物活性研究热点演进分为三个阶段:初期(2000~2011年)、稳步发展期(2011~2015年)、快速发展期(2015~2021年);发现大部分聚类内容有重叠,涉及糖代谢和脂代谢紊乱、高尿酸、免疫、高血压、肿瘤细胞和抗炎等。而国内的研究阶段可分为两个阶段:初期(2000~2014年)和稳定发展期(2015~2021年),在发展初期,国内大多数人对辣木的功效并不知晓,对辣木生物活性的研究很少,其研究的内容主要涉及辣木籽油的护肤防晒以及辣木籽蛋白的絮凝作用等,自2012年辣木成为我国新食品资源,国人对辣木的营养价值的认可,目前对辣木的生物活性研究方面涉及广,但大多数研究深度较浅。为了进一步了解国内外对辣木生物活性各部分热点研究的发展概况,分别汇总了各部分热点的发文量(见表2和表3),除了检索WOS核心合集数据库的文献外,还补充了WOS其它数据库文献84篇,共计588篇。其中,国外代谢性疾病研究文献195篇,占33.16%,以降血糖文献最多;在非代谢性疾病方面,抗肿瘤文献86篇,占比约14.63%;抗菌、抗炎和免疫调节依次为70篇、64篇和51篇,分别占比为11.90%、10.88%和8.67%。中文CNKI数据库检索得到189篇,国内对代谢性疾病研究文献较少,仅40篇,占21.16%,以降脂和降糖最多;而国内在非代谢性疾病方面的研究较多,其中抗氧化、抗炎55篇,占29.10%;絮凝作用、调节肠道和抑菌、抗肿瘤依次为21篇、24篇、7篇,分别占比11.11%、12.70%、3.7%。因此,后续分析重点聚焦于国内外辣木防治代谢性相关疾病研究进展。
表 2 WOS数据库有关辣木生物活性研究的发文量统计Table 2. Statistics on the number of publications of Moringa oleifera biological activity research in WOS databases序号 疾病分类 活性研究 发文量(篇) 合计(篇) 1
主
要
代
谢
性
疾
病降血脂 43
1952 减肥 24 3 降高血压 21 4 降高血糖 78 5 降尿酸 5 6 抗非酒精性脂肪肝 7 7 调节蛋白质-能量营养不良 10 8 其他代谢性疾病 7 9
非
代
谢
性
疾
病抗肿瘤 86
39310 免疫调节 51 11 抗炎 64 12 絮凝作用 20 13 抗菌 70 14 抗病毒 18 15 其他 84 合计 588 表 3 中文CNKI数据库有关辣木生物活性研究的发文量统计Table 3. Statistics on the number of publications of Moringa oleifera biological activity research in Chinese CNKI databases序号 疾病分类 活性研究 发文量(篇) 合计(篇) 1
主
要
代
谢
性
疾
病降血脂 17
402 降高血压 1 3 降高血糖 17 4 降尿酸 3 5 抗非酒精性脂肪肝 2 6 保护神经 3 7
非
代
谢
性
疾
病抗肿瘤 7
1498 免疫调节 4 9 抗炎、抗氧化 55 10 絮凝作用 21 11 调节肠道和抑菌 24 12 抗病毒 1 13 其他 35 合计 189 2.8 国内外辣木防治代谢性疾病的研究进展
2.8.1 改善脂质代谢紊乱
20多年前,Mazumder等[28]发现辣木根甲醇提取物能显著降低基础饲料饲喂小鼠的血浆胆固醇水平。Ghasi等[27]为了明确辣木是否对高脂血症模型动物具有降脂作用,发现辣木叶粗提物可以使高脂饮食诱导的高脂血症模型大鼠血清、肝脏、肾脏胆固醇的水平分别降低14.35%、6.40%、11.09%,明确了辣木具有降胆固醇的活性。随后越来越多的学者对其展开了深入研究工作,在这21年内,从WOS和中文CNKI数据库分别检索出约19篇和71篇有关辣木降血脂[29-30]、减肥[31-32]以及抗脂肪肝[33-34]的研究性文献。
由前文聚类图谱和TimeLine View结果来看,近五年来,国内学者在降血脂、减肥、抗非酒精肝等方面的研究日趋活跃[35-37],在生物分子机制的研究上,沙子珺等[38]利用网络药理学预测辣木降血脂其可能的作用机制与非酒精性脂肪肝、胰岛素抵抗、MAPK、雌激素、细胞凋亡、IF-1、AMPK及JAK-STAT信号通路等有关。Chen等[39]研究发现,辣木还能增加3T3-L1细胞胰岛素的敏感性,促进葡萄糖消耗,改善细胞内脂质积累;另外,辣木还可以改善肝组织氧化应激状态,恢复肝组织代谢的正常功能,如下调脂肪酸合成酶和脂肪酸分化相关蛋白的基因表达水平来降低机体脂质的合成,下调FXR蛋白的表达促进胆固醇的分解代谢[40]。
在2000~2015年发展阶段,国外多数文献研究报道了辣木对高脂饮食实验动物脂质代谢的影响,而近五年更多的则是对降脂减肥机制的研究,如Xie等[41]发现辣木叶石油醚提取物(MOPEE)可以显著增加高脂饮食(HFD)小鼠肝脏和附睾脂肪组织中AMPKα及其下游蛋白乙酰辅酶A羧化酶(ACC)的磷酸化程度(P<0.01)来减少下游相关脂质合成基因的表达。还有学者猜测,这可能是辣木提取物通过上调肝脏烟酰胺腺嘌呤二核苷酸依赖性酶(SirT1)的表达来引导AMPK信号通路的激活[39];在脂肪合成方面,辣木及其提取物还可以调控脂肪生成关键蛋白的转录或翻译水平来减少脂质蓄积,如羟甲基戊二酰辅酶A(HMG-CoA)[42]、脂肪酸合成酶(FAS)[43]、过氧化物酶体增殖物激活受体γ(PPARγ)、ACC[44-45]等;在另一方面,辣木还能上调脂肪甘油三酯脂肪酶(ATGL)、激素敏感性甘油三酯脂肪酶和脂肪分解酶[46],下调周脂素的表达,激活解偶联蛋白1(UCP1)、SIRT1、过氧化物酶体增殖物激活受体α(PPARα)和过氧化物酶体增殖物激活受体-γ共激活因子-1α(PGC1-α)等脂质代谢基因的表达[47],加速细胞对脂质的分解消耗,减少脂肪的生成。
近几年,国外还有报道从肠道菌群来揭示降血脂的作用研究,如辣木中的异硫氰酸酯和多糖物质能调节肠道微生物的生物多样性和丰富度来改善C57BL/6J肥胖雄性小鼠的糖脂代谢[48-49],但具体作用机理还有待挖掘。
2.8.2 调节糖代谢紊乱
在2000~2021年间,WOS和CNKI数据库分别收录了有关辣木降血糖、抗糖尿病方面的科学文献约85篇和17篇。早期国外的一些研究发现,辣木叶提取物不仅能降低正常大鼠的血糖水平,还能降低亚、轻度和重度糖尿病大鼠的高血糖水平[21,50]。近些年来,Alessandro等[51]发现将辣木叶粉添加至传统膳食(80 g米饭和160 g生骆驼肉)能降低糖尿病患者餐后血糖峰值,明确了辣木叶对人体具有降血糖作用。结合文献共被引和关键词聚类时间序列分析,预计未来在抗糖尿病方面的热点研究将会持续活跃。
国内外对辣木降血糖的机理研究主要围绕糖尿病模型动物和体外酶活力测定,如通过抑制肠道碳水化合物代谢关键酶酶活,如α-淀粉酶、α-胰腺淀粉酶[52]和α-葡萄糖苷酶[53-58]等。在体内实验中,有学者认为辣木能改善机体摄入过多的糖类物质导致胰岛β细胞的受损[59-60],促进胰岛素分泌的增加,从而提高葡萄糖的摄取和糖原合成。吉莉莉[61]研究发现辣木叶黄酮类物质促进胰岛β细胞再生,抑制丝氨酸蛋白酶4(DPP-4)活性,使得胰高血糖素(GLP-1)刺激胰岛β细胞对胰岛素分泌的增加与激活磷脂酰肌醇3-激酶/蛋白激酶B(PI3K/Akt)信号通路有关。而Hafizur等[62]却认为辣木叶提取物能促进胰β细胞的增殖和胰岛素分泌的增加是通过与PKA以静电疏水相互作用方式来介导,同时上调肌肉中葡萄糖转运蛋白4(GLUT4)和肝脏PPARα蛋白表达[63]提高细胞对葡萄糖代谢来发挥降血糖的作用。另外,Huang等[64]利用网络药理学建模方法研究了辣木籽降血糖的可能机制,认为辣木籽中的糖苷异硫氰酸酯和糖苷苄胺能调节蛋白激酶SRC和非受体型蛋白酪氨酸磷酸酶(PTPN1)的活性从改善胰岛素抵抗,最终达到降血糖的作用。
2.8.3 降血压作用
结合WOS文献共被引关键词聚类拟合图,拟合结果显示抗高血压的研究是辣木近几年的新兴的一个研究热点,WOS数据库收录的文献仅有17篇在线发表,而国内仅1篇。早期一些研究报道了辣木提取物对自发性高血压大鼠收缩压以及对家兔动脉血压具有降低作用[65-66],而近年来,已有学者观察高血压患者每日摄入120 g煮熟的辣木叶,能够使高血压患者的餐前基础血压和餐后2 h血压均显著下降,明确了辣木对人体具有降压作用[67]。2010~2021年间,相关学者对辣木降血压的研究日趋活跃,对降压机理的研究有了一定的进展。
在体外实验研究方面,辣木籽蛋白和辣木叶蛋白均能通过抑制血管紧张素转化酶(ACE)酶活,有效抑制血管紧张素II的生成,从而发挥抗高血压的作用[68-69]。在体内实验研究方面,辣木提取物对硝基左旋精氨酸甲酯(L-NAME)诱导的自发性高血压大鼠具备降压的作用,其可能的机制是通过降低游离8-异前列腺素循环水平、上调血管p22phox和p47phox基因和下调超氧化物歧化酶2(SOD2)的表达[70]来改善主动脉的氧化、亚硝化应激状态和血管内皮松弛损伤[71]。另外,辣木可通过抑制白细胞介素2(IL-2)的分泌和调节高血压大鼠的T细胞钙信号传导来发挥降血压作用[72]。
2.8.4 降尿酸作用
近二十年间有关于辣木用于降血清高尿酸和抗痛风的文献报道较少,WOS和CNKI数据库检索均显示3篇。从可视化结果来看,降高尿酸并未形成聚类标签。前期文献筛选显示,辣木对该方面的研究较浅,其未来挖掘的空间很大,是一个潜在的研究方向之一。
最近一项研究证明了食用辣木能降低人体尿酸水平[73],这可能与辣木及其提取物竞争性抑制黄嘌呤氧化酶(XO)活性有关[74]。如Tian等[75]用胰蛋白酶水解辣木叶得到酶解产物,发现酶解物中的酚类和多肽类组分可通过调节血清XO活性有效降低血清尿酸(UA)水平和肾尿酸转运蛋白含量,降低肝脏丙二醛(MDA)以及血清肌酐(CRE)的含量。梁文娟等[76]的研究得到了类似的结果,即辣木叶提取物可降低高尿酸血症小鼠CRE、血清尿酸、血尿素氮(BUN)、腺苷脱氨酶(ADA)的含量,以及降低肝脏黄嘌呤氧化酶(XOD)的活性。
2.8.5 调节蛋白质-能量营养不良
WOS数据库显示调节蛋白质-能量营养不良方面的研究文献较少,仅10篇。而国内对该方向的研究发表几乎空白。从软件拟合结果来看,未形成聚类标签。
在该方向的研究,有学者模拟传统烹饪的方法将新鲜的辣木叶于水中煮沸15 min发现可以使辣木叶和豆荚中的蛋白质消化率分别提高20.7%和7.8%,总碳水化合物略有增加[77]。还有科研人员在烘焙食品中添入辣木叶粉或辣木籽制备成面包或面团[78-79]。另外,还有人发现摄入添加辣木的酸奶能明显增加坦桑尼亚56名孕妇阴道微生物群,且口腔和胃肠道的微生物群在怀孕期间保持稳定[80]。而Boateng等[81]报道,辣木叶粉作为辅食对237名8~12个月大的婴幼儿血清血红蛋白浓度和体重没有显著影响。
2.8.6 改善其它代谢相关性疾病及其并发症
辣木还常用于膳食补充剂来解决疾病引起患者本身营养摄入不足或营养摄入不良带来的健康问题。Gambo等[82]发现辣木叶饮食补充剂能提高营养不良条件下的艾滋病毒(HIV)患者的CD4细胞数量,比未补充辣木的患者水平高10.33倍,但对HIV患者病毒载量以及体重没有显著差异。还有报道指出,辣木补充剂可改善接受抗逆转录病毒治疗(ART)HIV患者的营养摄入和营养状况,如Tshingani等[83]研究了金沙萨的60名HIV患者在抗逆转录病毒治疗期间的营养不足的问题,采用辣木叶粉作为饮食补充剂,连续干预6个月后,结果表明辣木叶干预组的体重指数(BMI)和白蛋白水平均显著高于未补充辣木的HIV患者。辣木还可用于治疗疟疾和营养不良,Pilotos等[84]持续4周对小鼠饮食限制来诱导营养不良小鼠模型,研究了辣木对营养不良状态下疟疾感染小鼠的影响,发现与食物充足的对照组小鼠相比,食物有限的小鼠(营养不良)减少了CD4(+)T细胞数量、TNF比例。而在有限组中补充辣木可略微恢复CD4(+)T细胞活化、IL-2和IL-10的产生。
3. 讨论与结论
本文借助Citespace可视化分析软件,对2000年至2021年检索的WOS核心合集和中文CNKI数据库中分别收录的504篇和189篇有关辣木生物活性研究性论文(综述性文章除外)进行可视化分析。结果显示,我国在该领域的研究起步晚于国外,但近几年的研究成果突出,论文产量和质量位居全球第三;国外机构主要分布在印度、沙特阿拉伯、美国、马拉西亚、埃及以及巴西等国家,主要有沙特国王大学、开罗大学、马来西亚博特拉大学和伯南布哥大学等主要研究机构,而国内则主要分布在云南、广东、广西、四川、南京、江西和福建等地,主要以云南省药物研究所、西南林业大学、深圳技术大学、遵义医科大学、云南农业大学、中国林业科学研究院和华南理工大学等研究机构;从机构合作网络来看,我国研究机构并未形成较大的合作团体,整体合作强度弱;在国际合作上,与他国合作较少,后续应加强合作,进一步提高我国科研论文的质量和数量;根据WOS文献共被引和中文CNKI关键词聚类分析,发现国外对辣木生物活性研究热点主要有多酚化合物、肝纤维化、螯合作用、DNA片段化、人乳腺癌细胞、罗非鱼、大鼠、异硫氰酸酯、保肝作用、2,2-联苯基-1-苦基肼基、絮凝作用、抗动脉粥样硬化、降压和凋亡蛋白激活因子-1等方面,而国内主要是辣木、辣木叶、多糖、辣木籽、糖尿病、防晒、生产性能、分离纯化、镇痛药、辣木籽油、抗氧化剂、辣木籽壳等方面。最后,在聚类基础上,采用Timeline View形式直观呈现了国内外研究热点随时间的发展脉络,得出国内外目前的研究前沿:国外致力于抗肝纤维化、降血压、抗乳腺癌、改善糖脂代谢紊乱等方面,国内则是抗氧化、降血脂、降糖等方面,其中糖脂代谢处于发展后期,后续仍会有较高的热度,而降血压、抗癌、调节免疫正处于新兴热点领域;神经保护、降尿酸很具有很大的研究潜力,预计未来相关学者对会展开更深入的研究工作;另外,Anwar等[12]、Amaglo等[11]以及Stohs等[13]等国外高被引文献对以上热门研究热点具有重要的推动和引导作用。
辣木在防治主要代谢疾病方面的国内外文献分别占比21.16%和33.16%,说明辣木在代谢性疾病防治上具有潜在优势,将是未来辣木功能食品开发的一个重要方向。通过对WOS和CNKI数据库文献调研,国内外研究辣木对代谢疾病方面的研究主要有降脂减肥、降血糖、降尿酸、调节蛋白质-能量营养不良、改善HIV患者因免疫缺陷导致的其它代谢相关性疾病及其并发症等。结合聚类时间序列分布,显示降血脂、降血糖是近十年来两大主要热门研究。其次,降血压的研究是近年来的新兴研究热点,而降尿酸的研究尚未形热点聚类标签,且国内对降尿酸的研究要比国外多,但研究较浅,预计未来对该方向的研究会越来越多。
总之,本文借助Citespace软件对国内外辣木生物活性研究领域进行了机构和国家的合作网络、文献共被引分析、关键词共现网络的拟合,分析了该领域的热点主题、研究前沿及其发展脉络。最后综述了辣木在降脂减肥、抗降糖、降血压、降尿酸、治疗蛋白质营养不良引起的代谢疾病方面的研究进展。综上,我国目前对以上研究领域还存在以下问题:a. 在一些新兴研究热点方面,如降血压、降血糖等,分子机理的研究创新较少,功效作用靶点尚不清楚;b. 实验研究多基于实验动物模型,而临床研究还十分有限,临床研究也存在研究病例数不足和观察持续时间较短等问题,缺乏前瞻性研究;c. 研究机构并未形成较大的合作团体,与他国合作强度弱。建议未来我国科研工作者应多注重学科交叉、加强国内各团队和机构之间的合作与交流,优势互补,结合现代科技、医学手段充分挖掘辣木功能活性,为辣木高值化提供基础研究和价值参考。
-
图 4 2000~2021年辣木生物活性研究相关国家分布图谱
注:网络节点的大小代表文献涉及该国家的频次;节点间连接线的数量和粗细代表节点间的合作强度;中心性代表该节点关联强度的大小,拥有紫色外圈的节点代表具有高度中介中心性[9];颜色从灰色到红色代表时间的远近。
Figure 4. The cooperation of relevant countries in the study of Moringa oleifera biological activity from 2000 to 2021
表 1 2000~2021年辣木生物活性研究共被引文献频次和中心性值(前十)
Table 1 The frequency and centrality value of co-cited documents in the study of Moringa oleifera biological activity from 2000 to 2021 (Top 10)
序列 频次 被引文献及其来源 中心性 被引文献及其来源 1 52 Anwar等[12], PHYTOTHER RES 0.31 Amaglo等[11], FOOD CHEM 2 50 Stohs等[13], PHYTOTHER RES 0.29 Anwar等[15], J AGR FOOD CHEM 3 48 Mbikay等[14], FRONT PHARMACOL 0.20 Anwar等[12], PHYTOTHER RES 4 44 Leone等[16], INT J MOL SCI 0.14 Awodele等[17], J ETHNOPHARMACOL 5 31 Al-Asmari等[18], PLOS ONE 0.13 Adedapo等[19], J MED PLANTS RES 6 30 Vergara-Jimenez等[20], ANTIOXIDANTS-BASEL 0.12 Kar等[21], J ETHNOPHARMACOL 7 29 Awodele等[17], J ETHNOPHARMACOL 0.11 Mbikay等[14], FRONT PHARMACOL 8 28 Rodriguez-Perez等[22], IND CROP PROD 0.11 Verma等[23], FOOD CHEM TOXICOL 9 27 Vongsak等[24], IND CROP PROD 0.11 Iqbal等[25], J FOOD COMPOS ANAL 10 27 Kou等[26], NUTRIENTS 0.09 Ghasi等[27], J ETHNOPHARMACOL 表 2 WOS数据库有关辣木生物活性研究的发文量统计
Table 2 Statistics on the number of publications of Moringa oleifera biological activity research in WOS databases
序号 疾病分类 活性研究 发文量(篇) 合计(篇) 1
主
要
代
谢
性
疾
病降血脂 43
1952 减肥 24 3 降高血压 21 4 降高血糖 78 5 降尿酸 5 6 抗非酒精性脂肪肝 7 7 调节蛋白质-能量营养不良 10 8 其他代谢性疾病 7 9
非
代
谢
性
疾
病抗肿瘤 86
39310 免疫调节 51 11 抗炎 64 12 絮凝作用 20 13 抗菌 70 14 抗病毒 18 15 其他 84 合计 588 表 3 中文CNKI数据库有关辣木生物活性研究的发文量统计
Table 3 Statistics on the number of publications of Moringa oleifera biological activity research in Chinese CNKI databases
序号 疾病分类 活性研究 发文量(篇) 合计(篇) 1
主
要
代
谢
性
疾
病降血脂 17
402 降高血压 1 3 降高血糖 17 4 降尿酸 3 5 抗非酒精性脂肪肝 2 6 保护神经 3 7
非
代
谢
性
疾
病抗肿瘤 7
1498 免疫调节 4 9 抗炎、抗氧化 55 10 絮凝作用 21 11 调节肠道和抑菌 24 12 抗病毒 1 13 其他 35 合计 189 -
[1] 景志贤, 李梦, 张小波, 等. 基于全球气候数据和MaxEnt模型的辣木全球气候适宜区研究[J]. 中国现代中药,2021,23(8):1352−1356. [JING Z X, LI M, ZHANG X B, et al. Study on the global climate suitable area of Moringa oleifera based on global climatedata and MaxEnt model[J]. Morden Chinese Medicine,2021,23(8):1352−1356. doi: 10.13313/j.issn.1673-4890.20200403005 [2] 高启霞, 沙子珺, 唐仕欢, 等. 辣木化学成分及其药理作用研究进展[J]. 医药导报,2020,39(3):350−359. [GAO Q X, SHA Z J, TANG S H, et al. Study on chemical constituents and pharmacological effects of Moringa oleifera: A review[J]. Herald of Medicine,2020,39(3):350−359. [3] 刘子记, 孙继华, 刘昭华, 等. 特色植物辣木的应用价值及发展前景分析[J]. 热带作物学报,2014,35(9):1871−1878. [LIU Z J, SUN J H, LIU Z H, et al. Application value and development prospect of characteristic plant Moringa oleifera[J]. Chinese Journal of Tropical Crops,2014,35(9):1871−1878. doi: 10.3969/j.issn.1000-2561.2014.09.035 [4] LIU J, MA G M, WANG Y, et al. Moringa oleifera leaf flavonoids protect bovine mammary epithelial cells from hydrogen peroxide-induced oxidative stress in vitro[J]. Reproduction in Domestic Animals,2020,55(6):711−719. doi: 10.1111/rda.13670
[5] BARBAGALLO I, VANELLA L, DISTEFANO A, et al. Moringa oleifera Lam. improves lipid metabolism during adipogenic differentiation of human stem cells[J]. European Review Formedical and Pharmacological Sciences,2016,20(24):5223−5232.
[6] MAHAJAN S G, MEHTA A. Immunosuppressive activity of ethanolic extract of seeds of Moringa oleifera Lam. in experimental immune inflammation[J]. Journal of Ethnopharmacology,2010,130(1):183−186. doi: 10.1016/j.jep.2010.04.024
[7] MA Z F, AHMAD J, ZHANG H, et al. Evaluation of phytochemical and medicinal properties of Moringa (Moringa oleifera) as a potential functional food[J]. South African Journal of Botany,2020,129:40−46. doi: 10.1016/j.sajb.2018.12.002
[8] WATERMAN C, CHENG D M, ROJAS-SILVA P, et al. Stable, water extractable isothiocyanates from Moringa oleifera leaves attenuate inflammation in vitro[J]. Phytochemistry,2014,103:114−122. doi: 10.1016/j.phytochem.2014.03.028
[9] 李杰, 陈超美. CiteSpace: 科技文本挖掘及可视化[M]. 首都经济贸易大学出版社, 2016 LI J, CHEN C M. CiteSpace: Science and technology text mining and visualization[M]. Capital University of Economics and Business Press, 2016.
[10] 陈悦, 陈超美, 刘则渊, 等. CiteSpace知识图谱的方法论功能[J]. 科学学研究,2015,33(2):242−253. [CHEN Y, CHEN C M, LIU Z Y, et al. Methodological function of citespace knowledge graph[J]. Studies in Science of Science,2015,33(2):242−253. doi: 10.3969/j.issn.1003-2053.2015.02.009 [11] AMAGLO N K, BENNETT R N, LO CURTO R B, et al. Profiling selected phytochemicalsand nutrients in different tissues of the multipurpose tree Moringa oleifera L. grown in Ghana[J]. Food Chemistry,2010,122(4):1047−1054. doi: 10.1016/j.foodchem.2010.03.073
[12] ANWAR F, LATIF S, ASHRAF M, et al. Moringa oleifera: A food plant with multiple medicinal uses[J]. Phytotherapy Research,2007,21(1):17−25. doi: 10.1002/ptr.2023
[13] STOHS S J, HARTMAN M J. Review of the safety and efficacy of Moringa oleifera[J]. Phytotherapy Reserch,2015,29(6):796−804. doi: 10.1002/ptr.5325
[14] MBIKAY M. Therapeutic potential of Moringa oleifera leaves in chronic hyperglycemia and dyslipidennia: A review[J]. Frontiers in Pharmacology,2012,3:00024.
[15] ANWAR F, BHANGER M I. Analytical characterization of Moringa oleifera seed oil grown in temperate regions of Pakistan[J]. Journal of Agricultural and Food Chemistry,2003,51(22):6558−6563. doi: 10.1021/jf0209894
[16] LEONE A, SPADA A, BATTEZZATI A, et al. Cultivation, genetic, ethnopharmacology, phytochemistry and pharmacology of Moringa oleifera leaves: An overview[J]. International Journal of Molecular Sciences,2015,16(6):12791−12835.
[17] AWODELE O, OREAGBA I A, ODOMA S, et al. Toxicological evaluation of the aqueous leaf extract of Moringa oleifera Lam. (Moringaceae)[J]. Journal of Ethnopharmacology,2012,139(2):330−336. doi: 10.1016/j.jep.2011.10.008
[18] AL-ASMARI A K, ALBALAWI S M, ATHAR M T, et al. Moringa oleifera as an anti-cancer agent against breast and colorectal cancer cell lines[J]. Plos One,2015,10(8):e01358.
[19] ADEDAPO A A, MOGBOJURI O M, EMIKPE B O. Safety evaluations of the aqueous extract of the leaves of Moringa oleifera in rats[J]. Journal of Medicinal Plants Research,2009,3(8):586−591.
[20] VERGARA-JIMENEZ M, ALMATRAFI M M, FERNANDEZ M L. Bioactive components in Moringa oleifera leaves protect against chronic disease[J]. Antioxidants, 2017, 6(4): 91.
[21] KAR A, CHOUDHARY B K, BANDYOPADHYAY N G. Comparative evaluation of hypoglycaemic activity of some Indian medicinal plants in alloxan diabetic rats[J]. Journal of Ethnopharmacology,2003,84(1):105−108. doi: 10.1016/S0378-8741(02)00144-7
[22] RODRIGUEZ-PEREZ C, QUIRANTES-PINE R, FERNANDEZ-GUTIERREZ A, et al. Optimization of extraction method to obtain a phenolic compounds-rich extract from Moringa oleifera Lam. leaves[J]. Industrial Crops and Products,2015,66:246−254. doi: 10.1016/j.indcrop.2015.01.002
[23] VERMA A R, VIJAYAKUMAR M, MATHELA C S, et al. In vitro and in vivo antioxidant properties of different fractions of Moringa oleifera leaves[J]. Food and Chemical Toxicology,2009,47(9):2196−2201. doi: 10.1016/j.fct.2009.06.005
[24] VONGSAK B, SITHISARN P, MANGMOOL S, et al. Maximizing total phenolics, total flavonoids contents and antioxidant activity of Moringa oleifera leaf extract by the appropriate extraction method[J]. Industrial Crops and Products,2013,44:566−571. doi: 10.1016/j.indcrop.2012.09.021
[25] IQBAL S, BHANGER M I. Effect of season and production location on antioxidant activity of Moringa oleifera leaves grown in Pakistan[J]. Journal of Food Composition and Analysis,2006,19(6):544−551.
[26] KOU X, LI B, OLAYANJU J B, et al. Nutraceutical or pharmacological potential of Moringa oleifera Lam.[J]. Nutrients, 2018, 10(3).
[27] GHASI S, NWOBODO E, OFILI J O. Hypocholesterolemic effects of crude extract of leaf of Moringa oleifera Lam. in high-fat diet fed wistar rats[J]. Journal of Ethnopharmacology,2000,69(1):21−25. doi: 10.1016/S0378-8741(99)00106-3
[28] MAZUMDER U K, GUPTA M, CHAKRABARTI S, et al. Evaluation of hematological and hepatorenal functions of methanolic extract of Moringa oleifera Lam. root treated mice[J]. Indian Journal of Experimental Biology,1999,37(6):612−614.
[29] MEHTA L K, BALARAMAN R, AMIN A H, et al. Effect of fruits of Moringa oleifera on the lipid profile of normal and hypercholesterolaemic rabbits[J]. Journal of Ethnopharmacology,2003,86(2-3):191−195. doi: 10.1016/S0378-8741(03)00075-8
[30] CHUMARK P, KHUNAWAT P, SANVARINDA Y, et al. The in vitro and ex vivo antioxidant properties, hypolipidaemic and antiatherosclerotic activities of water extract of Moringa oleifera Lam. leaves[J]. Journal of Ethnopharmacology,2008,116(3):439−446. doi: 10.1016/j.jep.2007.12.010
[31] LI L F, MA L, WEN Y L, et al. Crude polysaccharide extracted from Moringa oleifera leaves prevents obesity in association with modulating gut microbiota in high-fat diet-fed mice[J]. Frontiers in Nutrition,2022:9.
[32] MABROUKI L, RJEIBI I, TALEB J, et al. Cardiac ameliorative effect of Moringa oleifera leaf extract in high-fat diet-induced obesity in rat model[J]. Biomed Research International,2020:2020.
[33] MAPFUMO M, LEMBEDE B W, NKOMOZEPI P, et al. Crude Moringa oleifera Lam. seed extract attenuates non-alcoholic fatty liver disease in growing Sprague-dawley rats[J]. South Afrcan Journal of Botany,2020,129:191−197. doi: 10.1016/j.sajb.2019.05.026
[34] MUHAMMAD N, IBRAHIM K G, NDHLALA A R, et al. Moringa oleifera Lam. prevents the development of high fructose diet-induced fatty liver[J]. South Afrcan Journal of Botany,2020,129:32−39. doi: 10.1016/j.sajb.2018.12.003
[35] 孙朦, 王鸿飞, 王凯凯, 等. 辣木叶黄酮对小鼠血脂调节作用研究[J]. 核农学报,2018,32(8):1597−1602. [SUN M, WANG H F, WANG K K, et al. Study on the effect of Moringa oleifera leaf flavonoids on the regulation of blood lipids in mice[J]. Journal of Nuclear Agricultural Sciences,2018,32(8):1597−1602. doi: 10.11869/j.issn.100-8551.2018.08.1597 [36] 杨倩, 田雪梅, 张晓文, 等. 辣木提取物降脂作用的研究[J]. 食品安全质量检测学报,2017,8(3):963−967. [YANG Q, TIAN X M, ZHANG X W, et al. Study on the hypolipidemic effect of Moringa oleifera extract[J]. Journal of Food Safety and Quality Inspection,2017,8(3):963−967. doi: 10.19812/j.cnki.jfsq11-5956/ts.2017.03.044 [37] 余建兴. 辣木油提取技术及对大鼠辅助降血脂作用的研究[D]. 昆明: 昆明医学院, 2009 YU J X. Study on the extraction technique of Moringa oleifera oil and its beneficial effect on blood lipid reduction in rats[D]. Kunming: Kunming Medical College, 2009.
[38] 沙子珺, 黎彩凤, 唐仕欢, 等. 新资源药材辣木叶抗高脂血症的药效与作用机制探析[J]. 中国中药杂志,2021,46(14):3465−3477. [SHA Z J, LI C F, TANG S H, et al. Exploration of the efficacy and mechanism of action of the new resource medicinal herb Moringa oleifera against hyperlipidemia[J]. Chinese Journal of Traditional Chinese Medicine,2021,46(14):3465−3477. doi: 10.19540/j.cnki.cjcmm.20210309.401 [39] CHEN G L, XU Y B, WU J L, et al. Hypoglycemic and hypolipidemic effects of Moringa oleifera leaves and their functional chemical constituents[J]. Food Chemistry,2020:333.
[40] 王宏, 刘月, 饶露, 等. 辣木籽提取物对高脂血症小鼠血脂及肝脏的影响[J]. 中国油脂,2022,47(7):66−70. [WANG H, LIU Y, RAO L, et al. Effect of Moringa oleifera seed extract on blood lipid and liver in hyperlipidemia mice[J]. China Oils and Fats,2022,47(7):66−70. doi: 10.19902/j.cnki.zgyz.1003-7969.210412 [41] XIE J, WANG Y, JIANG W, et al. Moringa oleifera leaf petroleum ether extract inhibits lipogenesis by activating the AMPK signaling pathway[J]. Frontiers in Pharmacology,2018,9:1447. doi: 10.3389/fphar.2018.01447
[42] EZZAT S M, EL BISHBISHY M H, ABOREHAB N M, et al. Up regulation of MC4R and PPARα expression mediates the anti-obesity activity of Moringa oleifera Lam. in high fatdiet-induced obesity in rats[J]. Journal of Ethnopharmacology,2020:251.
[43] BALUSAMY S R, PERUMALSAMY H, RANJAN A, et al. A dietary vegetable, Moringa oleifera leaves (drumstick tree) induced fat cell apoptosis by inhibiting adipogenesis in 3T3-L1 adipocytes[J]. Journal of Functionanl Foods,2019,59:251−260. doi: 10.1016/j.jff.2019.05.029
[44] KIM D, CHOI M, SHIN H. Extracts of Moringa oleifera leaves from different cultivation regions show both antioxidant and antiobesity activities[J]. Journal of Food Biochemistry,2020,44(7):e13282.
[45] SWAMY G M, RAMESH G, PRASAD R D, et al. Astragalin, (3-O-glucoside of kaempferol), isolated from Moringa oleifera leaves modulates leptin, adiponectin secretion and inhibits adipogenesis in 3T3-L1 adipocytes[J]. Archives of Physiology and Biochemistry,2020,128:938−944.
[46] UKIYA M, MOTEGI K, SATO D, et al. Effect of compounds from Moringa oleifera Lam. on in vitro non-alcoholic fatty liver disease (NAFLD) model system[J]. Chemistry & Biodiversity,2021,18(7):e210024.
[47] SANGKITIKOMOL W, ROCEJANASAROJ A, TENCOMNAO T. Effect of Moringa oleifera on advanced glycation end-product formation and lipid metabolism gene expression in HepG2 cells[J]. Genetics and Molecular Research,2014,13(1):723−735. doi: 10.4238/2014.January.29.3
[48] JAJA-CHIMEDZA A, ZHANG L, WOLFF K, et al. A dietary isothiocyanate-enriched moringa (Moringa oleifera) seed extract improves glucose tolerance in a high-fat-diet mouse model and modulates the gut microbiome[J]. Journal of Functional Foods,2018,47:376−385. doi: 10.1016/j.jff.2018.05.056
[49] WANG F, BAO Y, SI J, et al. The beneficial effects of a polysaccharide from Moringa oleifera leaf on gut microecology in mice[J]. Journal of Medicinal Food,2019,22(9):907−918. doi: 10.1089/jmf.2018.4382
[50] JAISWAL D, RAI P K, KUMAR A, et al. Effect of Moringa oleifera Lam. leaves aqueous extract therapy on hyperglycemic rats[J]. Journal of Ethnopharmacology,2009,123(3):392−396. doi: 10.1016/j.jep.2009.03.036
[51] LEONE A, BERTOLI S, DI L S, et al. Effect of Moringa oleifera leaf powder on postprandial blood glucose response: In vivo study on saharawi people living in refugee camps[J]. Nutrients, 2018, 10:10.
[52] KHAN W, PARVEEN R, CHESTER K, et al. Hypoglycemic potential of aqueous extract of Moringa oleifera leaf and in vivo GC-MS metabolomics[J]. Frontiers in Pharmacology,2017:8.
[53] MAGAJI U F, SACAN O, YANARDAG R. Alpha amylase, alpha glucosidase and glycation inhibitory activity of Moringa oleifera extracts[J]. South African Journal of Botany,2020,128:225−230. doi: 10.1016/j.sajb.2019.11.024
[54] ADISAKWATTANA S, CHANATHONG B. Alpha-glucosidase inhibitory activity and lipid-lowering mechanisms of Moringa oleifera leaf extract[J]. European Review for Medical and Pharmacological Sciences,2011,15(7):803−808.
[55] BIN A S, ANSARI P, AZAM S, et al. Anti-hyperglycaemic activity of Moringa oleifera is partly mediated by carbohydrase inhibition and glucose-fibre binding[J]. Bioscience Reports,2017,37(3):BSR20170059−BSR20170059.
[56] TSHABALALA T, NDHLALA A R, NCUBE B, et al. Potential substitution of the root with the leaf in the use of Moringa oleifera for antimicrobial, antidiabetic and antioxidant properties[J]. South African Journal of Botany,2020,129:106−112. doi: 10.1016/j.sajb.2019.01.029
[57] SUBRAMANIAM S, ROSDI M H B, KUPPUSAMY U R. Customized cooking methods enhance antioxidant, antiglycemic, and insulin-like properties of momordica charantiaand Moringa oleifera[J]. Journal of Food Quality,2017,2017:1−9.
[58] 王远, 郑雯, 袁田青, 等. 辣木叶总黄酮微波辅助提取工艺优化及其抑制α-葡萄糖苷酶活性研究[J]. 核农学报,2018,32(1):84−94. [WANG Y, ZHENG W, YUAN T Q, et al. Optimization of microwave-assisted extraction process of total flavonoids from Moringa oleifera leaves and its inhibition of α-glucosidase activity[J]. Journal of Nuclear Agricultural Sciences,2018,32(1):84−94. doi: 10.11869/j.issn.100-8551.2018.01.0084 [59] OLAYAKI L A, IREKPITA J E, YAKUBU M T, et al. Methanolic extract of Moringa oleifera leaves improves glucose tolerance, glycogen synthesis and lipid metabolism in alloxan-induced diabetic rats[J]. Journal of Basic and Clinical Physiology and Pharmacology,2015,26(6):585−593.
[60] ABD E L A, EL B B E S, MAHBOUB H D, et al. Moringa oleifera leaf extract ameliorates alloxan-induced diabetes in rats by regeneration of beta cells and reductionof pyruvate carboxylase expression[J]. Biochemistry and Cell Biology,2014,92(5):413−419. doi: 10.1139/bcb-2014-0081
[61] 吉莉莉. 辣木叶黄酮提取分离纯化及其主要成分异槲皮苷降血糖活性与机理研究[D]. 成都: 四川农业大学, 2015 JI L L. Extraction, purification and hypoglycemic activity and mechanism of isoquercitrin, the main component of Moringa oleifera leaf flavonoids[D]. Chengdu: Sichuan Agricultural University, 2015.
[62] HAFIZUR R M, MARYAM K, HAMEED A, et al. Insulin releasing effect of some pure compounds from Moringa oleifera on mice islets[J]. Medicinal Chemistry Reserch,2018,27(5):1408−1418. doi: 10.1007/s00044-018-2157-1
[63] ATTAKPA E S, SANGARE M M, BEHANZIN G J, et al. Moringa oleifera Lam. stimulatesactivation of the insulin-dependent akt pathway antidiabetic effect in a diet-induced obesity (DIO) mouse model[J]. Folia Biologca,2017,63(2):42−51.
[64] HUANG Q, LIU R, LIU J, et al. Integrated network pharmacology analysis and experimental validation to reveal the mechanism of anti-insulin resistance effects of Moringa oleifera seeds[J]. Drug Design Development and Therapy,2020,14:4069−4084. doi: 10.2147/DDDT.S265198
[65] KAJIHARA R, NAKATSU S, SHIONO T, et al. Antihypertensive effect of water extracts from leaves of Moringa oleifera Lam. on spontaneously hypertensive rats[J]. Journal of the Japanese Society for Food Science and Technology-Nippon Shokuhin Kagaku Kogaku Kaishi,2008,55(4):183−185. doi: 10.3136/nskkk.55.183
[66] ABROGOUA D P, DANO D S, MANDA P, et al. Effect on blood pressure of a dietary supplement containing traditional medicinal plants of côted’ Ivoire[J]. Journal of Ethnopharmacology,2012,141(3):840−847. doi: 10.1016/j.jep.2012.03.022
[67] ACURAM L K, HERNANDEZ C L C. Anti-hypertensive effect of Moringa oleifera Lam[J]. Cogent Biology,2019,5(1):1596526. doi: 10.1080/23312025.2019.1596526
[68] ADERINOLA T A, FAGBEMI T N, ENUJIUGHA V N, et al. In vitro antihypertensive and antioxidative properties of alcalase-derived Moringa oleifera seed globulin hydrolysate and its membrane fractions[J]. Journal of Food Processing and Preservation, 2019, 43(2): e13862.
[69] 陈冰冰, 欧颖仪, 叶灏铎, 等. 富硒辣木叶蛋白ACE抑制肽的酶解工艺优化及活性研究[J]. 食品工业科技,2022,43(3):1−9. [CHEN B B, OU Y Y, YE J Z, et al. Optimization of enzymatic process and activity study of ACE inhibitory peptide of selenium-rich Moringa oleifera leaf protein[J]. Science and Technology of Food Industry,2022,43(3):1−9. doi: 10.13386/j.issn1002-0306.2021060268 [70] RANDRIAMBOAVONJY J I, RIO M, PACAUD P, et al. Moringa oleifera seeds attenuate vascular oxidative and nitrosative stresses in spontaneously hypertensive rats[J]. Oxidative Medicine and Cellular Longevity,2017,2017:4129459.
[71] AEKTHAMMARAT D, PANNANGPETCH P, TANGSUCHARIT P. Moringa oleifera leaf extract lowers high blood pressure by alleviating vascular dysfunction and decreasing oxidative stress in L-NAME hypertensive rats[J]. Phytomedicine,2019,54:9−16. doi: 10.1016/j.phymed.2018.10.023
[72] ATTAKPA E S, BERTIN G A, CHABI N W, et al. Moringa oleifera-rich diet and t cell calcium signaling in spontaneously hypertensive rats[J]. Physiology Reserch,2017,66(5):753−767.
[73] NURHAYATI N, CLARA M K, SITI M, et al. The effect of moringa capsule and moringa tea consumption on the elderly's uric acid level[J]. Indian Journal of Public Health Research & Development,2019,10(3):1061−1065.
[74] 钟英英, 周佳明, 叶美凤, 等. 辣木叶提取物对黄嘌呤氧化酶活性的抑制[J]. 食品工业,2020,41(11):55−58. [ZHONG Y Y, ZHOU J M, YE M F, et al. Inhibition of moringa leaf extract on xanthine oxidase activity[J]. Food Industry,2020,41(11):55−58. [75] TIAN Y, LIN L, ZHAO M, et al. Xanthine oxidase inhibitory activity and antihyperuricemic effect of Moringa oleifera Lam. leaf hydrolysate rich in phenolics and peptides[J]. Journal of Ethnopharmacology,2021,270:113808. doi: 10.1016/j.jep.2021.113808
[76] 梁文娟, 和劲松, 田洋, 等. 辣木叶提取物降低高尿酸血症小鼠尿酸水平及机理研究[J]. 安徽农业科学,2017,45(17):108−109, 112. [LIANG W J, HE J S, TIAN Y. et al. Study on the reduction of uric acid level and mechanism of hyperuricemic mice by Moringa oleifera leaf extract[J]. Journal of Anhui Agricultural Sciences,2017,45(17):108−109, 112. doi: 10.3969/j.issn.0517-6611.2017.17.037 [77] GIDAMIS A, PANGA J, SARWATT S, et al. Nutrient and antinutrient contents in raw and cooked young leaves and immature pods of Moringa oleifera Lam[J]. Ecology of Food and Nutrition,2003,42(6):399−411. doi: 10.1080/03670240390268857
[78] GOVENDER L, SIIWELA M. The effect of Moringa oleifera leaf powder on the physical quality, nutritional composition and consumer acceptability of white and brown breads[J]. Foods,2020,9(12):19.
[79] OGUNSINA B S, RADHA C, INDRANI D. Quality characteristics of bread and cookies enriched with debittered Moringa oleifera seed flour[J]. International Journal of Food Sciences and Nutrition,2011,62(2):185−194. doi: 10.3109/09637486.2010.526928
[80] BISANZ J E, ENOS M K, PRAYGOD G, et al. Microbiota at multiple body Sites during pregnancy in a rural tanzanian population and effects of moringa-supplemented probiotic yogurt[J]. Applied and Environmental Microbiology,2015,81(15):4965−4975. doi: 10.1128/AEM.00780-15
[81] BOATENG L, QUARPONG W, OHEMENG A, et al. Effect of complementary foods fortified with Moringa oleifera leaf powder on hemoglobin concentration and growth of infants in the Eastern Region of Ghana[J]. Food Science & Nutrition,2019,7(1):302−311.
[82] GAMBO A, MOODLEY I, BABASHANI M, et al. A double-blind, randomized controlled trial to examine the effect of Moringa oleifera leaf powder supplementation on the immune status and anthropometric parameters of adult HIV patients on antiretroviral therapy in a resource-limited setting[J]. Plos One, 2021, 16(12): e0261935.
[83] TSHINGANI K, DONNEN P, MUKUMBI H, et al. Impact of Moringa oleifera Lam. leaf powder supplementation versus nutritional counseling on the body mass index and immune response of HIV patients on antiretroviral therapy: A single-blind randomized control trial[J]. Bmc Complementary and Alternative Medicine,2017,17(1):420.
[84] PILOTOS J, IBRAHIM K A, MOWA C N, et al. Moringa oleifera treatment increases Tbet expression in CD4+ T cells and remediates immune defects of malnutrition in Plasmodium chabaudi-infected mice[J]. Malaria Journal,2020,19(1):62.
-
期刊类型引用(11)
1. 苏敏,李红丽,白亚敏,黄大亮,刘元,吴彦蕾. 基于液相色谱-串联高分辨质谱技术的食品中污染物检测技术研究进展. 食品安全质量检测学报. 2025(04): 44-52 .  百度学术
百度学术
2. 张君. 我国南方部分地区蓝莓种植过程中农药残留检测结果分析. 河北农机. 2024(03): 136-138 .  百度学术
百度学术
3. 张申平,秦宇,顾颖娟. QuEChERS-超高效液相色谱-四极杆/静电场轨道阱质谱法测定牛羊乳及其乳粉中21种兽药. 乳业科学与技术. 2024(02): 24-29 .  百度学术
百度学术
4. 李红洲,国果,李博岩,梁桂娟,李志远. 超高效液相色谱-四极杆-飞行时间-高分辨质谱法分析6种李果实中的代谢物差异性. 食品安全质量检测学报. 2024(11): 63-73 .  百度学术
百度学术
5. 刘宇航,于寒冰,杨红菊,马啸,温雅君,孙志伟,习佳林,熊慧勤,肖志勇. 高效液相色谱-四极杆-飞行时间质谱法快速筛查蔬菜中124种药物与个人护理品残留量. 食品安全质量检测学报. 2024(16): 175-184 .  百度学术
百度学术
6. 朱春雨,吴移山,郑景娇. 高效液相色谱-串联质谱法测定鸡蛋中地克珠利、妥曲珠利及其代谢物残留量. 食品安全质量检测学报. 2024(16): 211-218 .  百度学术
百度学术
7. 肖泳,曾小明,李政,袁列江,邓航,王淑霞,潘照. 超高效液相色谱-四极杆/静电场轨道阱高分辨质谱法测定鸡蛋中94种农药残留. 食品与发酵工业. 2024(21): 333-340 .  百度学术
百度学术
8. 王颖怡,吴玉田,孟春杨,周贻兵,刘利亚. HPLC-MS/MS技术同时测定鸡蛋中5种抗球虫药. 食品工业. 2023(06): 291-294 .  百度学术
百度学术
9. 李晓慧,李建洪,王洪萍,金芬. 植物源性食品中化学性危害物质的色谱-质谱检测技术研究进展. 分析测试学报. 2023(10): 1357-1369 .  百度学术
百度学术
10. 周雪莼,胡婷婷,王佳慧,白静,杨颖,侯宇,张哲,张勋. 高效液相色谱-高分辨质谱法快速筛查动物源性药食同源产品中32种抗生素兽药残留. 吉林中医药. 2023(12): 1469-1474 .  百度学术
百度学术
11. 范轶欧,迟英欣,杨路平,焦燕妮. 高分辨质谱技术在环境和食品风险物质非靶向筛查检测中应用的研究进展. 预防医学论坛. 2023(12): 955-960 .  百度学术
百度学术
其他类型引用(0)






 下载:
下载:




 下载:
下载:



