Effect of ''FD Technology'' on the Stacking Fermentation of Maotai-flavor Baijiu
-
摘要: 为探究酱香型白酒酿造堆积过程中酒醅堆各位点发酵状态及细菌群落结构的变化规律,将“FD工艺”应用于酱香型白酒第二轮次酒生产堆积发酵过程,对堆积过程中的酒醅理化因子和细菌群落变化进行探索和研究。结果表明:相较于传统酒醅堆积发酵而言,“FD工艺”处理后的酒醅酸度能够有效降低,酸度下降了1.72 mmol/10 g,同时能有效控制酒醅中水分含量,使水分含量保持在±0.8%;“FD工艺”能有效促进淀粉转化(增加转化了0.76%),同时酒醅中还原糖含量也增加(增长了0.46%);酒醅细菌群落Shannon指数、Sobs指数和Ace指数显著(P<0.05)增加;“FD工艺”处理后的酒醅微生物属分类水平的丰富度和多样性明显增加,有利于好氧菌属如芽孢杆菌属Bacillus、高温放线菌属Thermoactinomyces等微生物生长。综上,“FD工艺”能改善堆积发酵过程中酒醅发酵不均的情况,酒醅细菌群落丰富度和多样性均明显增加,有利于优势好氧及耐高温细菌群落的生长。Abstract: The purpose of this study was to explore the fermentation state and bacterial community structure of fermented grains during the stacking fermentation of Maotai-flavor Baijiu. The ''FD technology'' was applied to the stacking fermentation in second round of fermented grains production, and the changes of physicochemical factors and bacterial community in fermented grains during stacking fermentation were studied. Results showed that, compared with stacking fermentation of traditional fermented grains, the acidity of fermented grains of ''FD technology'' decreased by 1.72 mmol/10 g and the moisture content was kept to ±0.8%. The ''FD technology'' could effectively promote starch transformation (increased by 0.76%), and the reducing sugar content was increased by 0.46%. The Shannon, Sobs and Ace index of bacterial community in fermented grains increased significantly (P<0.05). On the level of microbial genus classification, the richness and diversity of microorganisms from fermented grains of ''FD technology'' significantly increased, which was conducive to the growth of aerobic bacteria such as Bacillus, and high-temperature resistant bacteria such as Thermoactinomyces. In conclusion, the ''FD technology'' could improve the uneven stations in the stacking fermentation of fermented grains, and the bacterial richness and diversity of fermented grains significantly increased, which was conducive to the growth of dominant aerobic and high-temperature resistant bacterial communities.
-
酱香型白酒的工艺总结为“端午制曲,重阳下沙,一年一个生产周期,两次投粮,九次蒸煮,八次发酵,七次取酒”[1],具有“高温制曲、高温堆积、高温发酵、高温馏酒、生产周期长、储存周期长”四高两长的工艺特点[2]。酱香型白酒具有“酱香典型,细腻醇厚,空杯留香持久”的风味特征,深受消费者喜爱[3]。堆积发酵是酱香型白酒独有的生产工艺,堆积发酵过程是一个开放式过程,主要作用是富集周围环境微生物进行发酵,产生多种酶类并在多种酶类相互作用下合成酒体前驱物质及香味物质,为后续窖内发酵工艺提供重要微生物和酶类[4]。酒醅中酱香香气成分和风味物质前体来源于堆积发酵,这一过程被描述为“二次制曲”[4-5],在高温条件下促成酯类等物质合成,产生典型的酱香香气[6]。因此,高温堆积过程对酱香型白酒的品质会带来深远的影响[6]。有报道称,没有堆积就没有酱酒,没有堆积更谈不上酱香风格,说明高温堆积是酱香型白酒的重要工序[7]。
传统酱香型白酒堆积时间4~5 d,当堆积酒醅温度达到46~52 ℃,微生物繁殖旺盛,再移至窖内进行发酵,保证发酵的正常进行。随着白酒酿造机械化进程的逐步推进,酱香型白酒机械化酿造过程中,机械设备对酒醅的物理特征的影响,加之气温较低的冬季环境下,其酒醅在堆积发酵环节易出现堆积酒醅升温不均匀和升温缓慢的问题。但是,温度直接影响酒醅微生物生长繁殖而影响各位点酒醅发酵状态,升温不均和升温缓慢则会导致酒醅发酵不彻底,影响酒质及产量。针对以上生产问题,对传统堆积模式进行改良,形成“FD工艺”,即当第一次酒醅堆积发酵温度达到43~45 ℃时,使用布氏抱斗对酒醅堆进行破堆、混匀、换位后,再进行收堆;使用布氏抱斗将堆子从顶部挖开,将顶部酒醅转移至旁边空地,并充分混匀顶部酒醅后形成底层酒醅,再将四周酒醅破堆,以同样的方式进行混匀后移至堆心层,将堆心层移至堆外层,遵循“面翻底,底翻面,中心翻四周”的原则,使各方位酒醅充分混匀后进行收堆再次堆积发酵至入池标准温度46~52 ℃时,即完成整个堆积发酵过程,可入池发酵。高通量测序技术又称第二代测序技术,它可以同时对数百万到10亿个DNA分子进行并列测序,同时满足多样本微生物的深度分析,其主要特点是高通量、快速、高精度、实时监测、数据信息量大等,可在极短时间内获得大量数据[8-9]。目前,高通量测序技术已被用于研究不同发酵食品中的微生物生态,如醋[10]和牛奶[11],以及浓香、清香型、酱香型白酒中[12]。郭敏等[12]证实了高通量测序技术可用于酱香型白酒酿造发酵过程酒醅微生物多样性的研究。基于此,本文运用高通量测序技术对酱香型白酒堆积发酵过程中酒醅进行测序,分析细菌群落结构,以明确“FD工艺”对细菌群落结构的影响。较之传统堆积发酵工艺而言,“FD工艺”对堆积酒醅进行破堆、混匀、换位,重新引入微生物生长繁殖所需氧气,改善酒醅体系的溶氧水平,促使酒醅体系的微生物再次进行生长繁殖,优化和丰富酒醅体系的微生物群落结构,提升微生物的种类和数量,可使整个酒醅堆积温度均匀升高,降低酒醅堆不同空间区位的品温差异,从而改善酒醅的各项理化指标,促使整个堆积酒醅的均匀发酵,为酱香型白酒的发酵生香奠定基础。
本研究以冬季的酱香型白酒第二轮次堆积发酵酒醅为研究对象,采用高通量测序技术分析堆积酒醅细菌群落结构,结合酒醅理化指标的动态变化,初步探究“FD工艺”对酱香型白酒堆积细菌群落结构变化,以及对酒醅在整个堆积阶段的发酵状态的影响,为“FD工艺”在酱香型白酒堆积过程的应用提供理论依据。
1. 材料与方法
1.1 材料与仪器
酱香型白酒酒醅 来源于泸州国之荣耀酒业有限公司;E.Z.N.A.® Soil DNA Kit DNA 抽提试剂盒 美国Omega公司;酚酞、硫酸铜、盐酸、酒石酸钾钠 成都市科隆化学品有限公司;氢氧化钠 重庆川东化工有限公司;次甲基兰 来自于天津市光复精细化工研究所;葡萄糖 天津市致远化学试剂有限公司;FastPfu 聚合酶 北京全式金生物技术有限公司;所用试剂 均为分析纯。
DHG-9023A电热干燥箱 上海琅歼实验设备有限公司;FA224X电子分析天平 天津市德安特传感技术有限公司;450mm干燥器;WST数显温度计 上海仪电科学仪器有限公司;ABI GeneAmp®9700型PCR仪 美国ABI公司;DYY-6C电泳仪 北京六一生物科技有限公司。
1.2 实验方法
1.2.1 酒醅取样方法
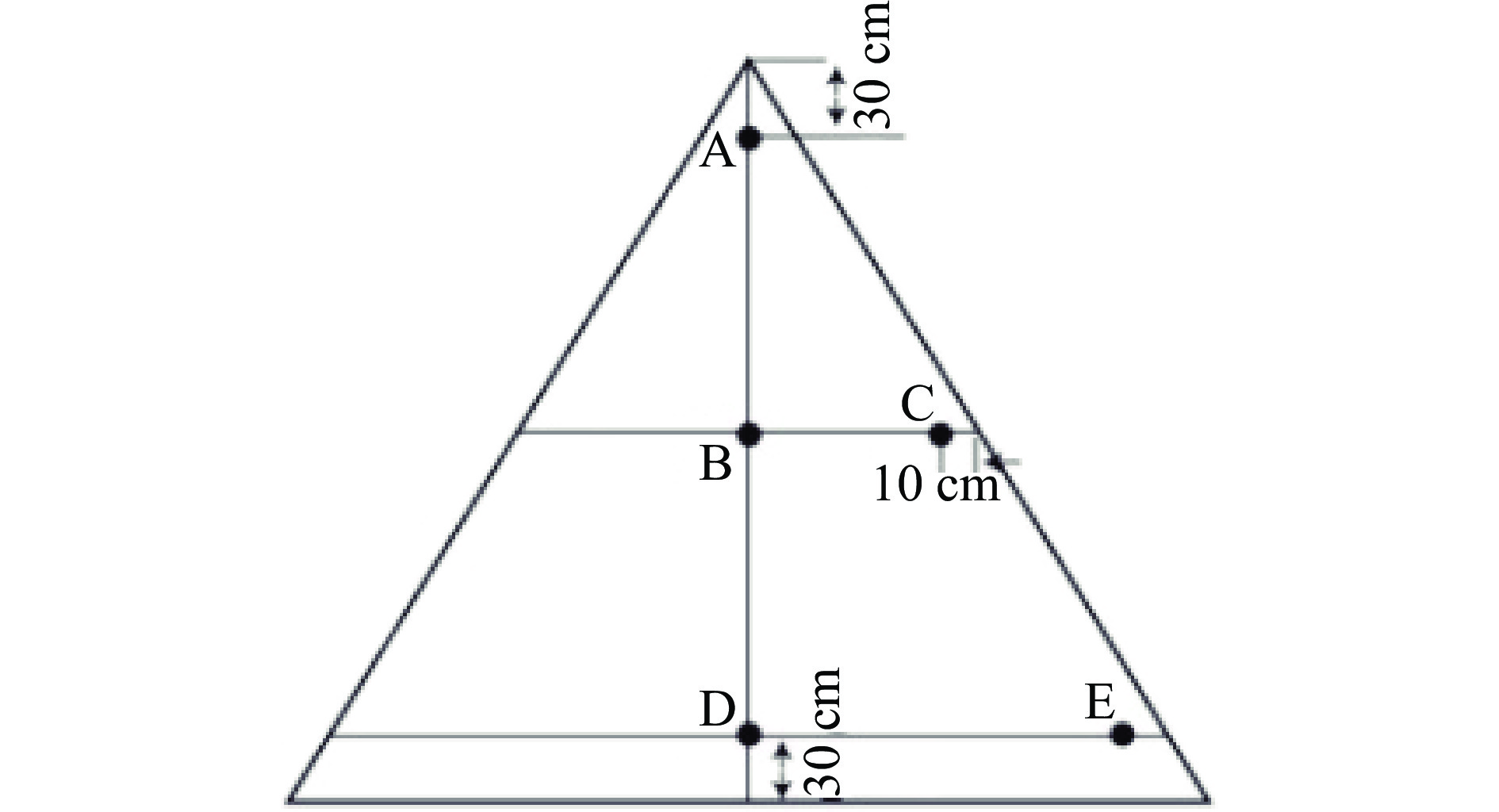
本研究以冬季的酱香型白酒第二轮次堆积发酵酒醅为研究对象,同一车间相邻两个酒醅堆采用不同堆积发酵工艺。采用“FD工艺”酒醅为实验组,取样时间以收堆完成时开始计时(起始计为0 h),取样时间间隔为24 h,其中在71 h时堆积酒醅温度达到43.4 ℃,达到“FD工艺”要求。71~72 h进行“FD工艺”操作,进行再次堆积发酵至入池温度48.6 ℃,整个堆积发酵时间共持续至96 h。取样时间编号F1、F2、F3、F4、F5。传统堆积发酵工艺即收堆完成后,经过96 h自然堆积,酒醅温度升高至48.1 ℃,酒醅表层长满白色状菌丝,醅料中富集了大量微生物,并形成一定的酱香香气成分或风味前驱物,即完成整个堆积发酵。传统堆积发酵酒醅为对照组,同理取样时间依次编号为C1、C2、C3、C4、C5。取样点如图1所示,分别取堆子上层A点,中层B、C两点,下层D、E两点,取样后各层样品混匀再将上、中、下 3个样品混合为 1个样品,取样后迅速置于-80 ℃冰箱中保藏用于开展后续实验。
1.2.2 酒醅理化指标测定
水分的测定参考GB 5009.3-2016《食品中水分含量测定》中的直接干燥法进行测定。酒醅淀粉、酸度、还原糖含量的测定参考《白酒生产技术全书》[13]。
1.2.3 温度的测定
使用数显温度计对堆子各采样点进行温度实时测定,测温记录点与采样时间保持一致,同一位点进行三次温度测定,取其平均值。
1.2.4 细菌群落分析
使用E.Z.N.A.® Soil DNA Kit DNA 抽提试剂盒提取酒醅细菌总DNA,引物采用338F (5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')[14]对细菌的16S rDNA的V3~V4区进行PCR扩增,扩增产物送送上海美吉生物医药科技有限公司进行高通量测序和后续分析。基于默认参数,使用Qiime2流程中的DADA2插件对质控拼接之后的优化序列进行降噪处理。物种注释数据库:silva138/16s_bacteria,物种注释方法:bayes分类,置信度0.7,测序数据使用上海美吉生物有限公司的云平台(https://cloud.majorbio.com)进行在线数据分析。
1.3 数据处理
采用SPSS26.0软件进行理化指标数据统计分析。使用Origin2019进行图片绘制,数据以表格及柱状图表示。
2. 结果与分析
2.1 两组堆积酒醅理化指标的变化
2.1.1 堆积阶段酒醅水分含量变化
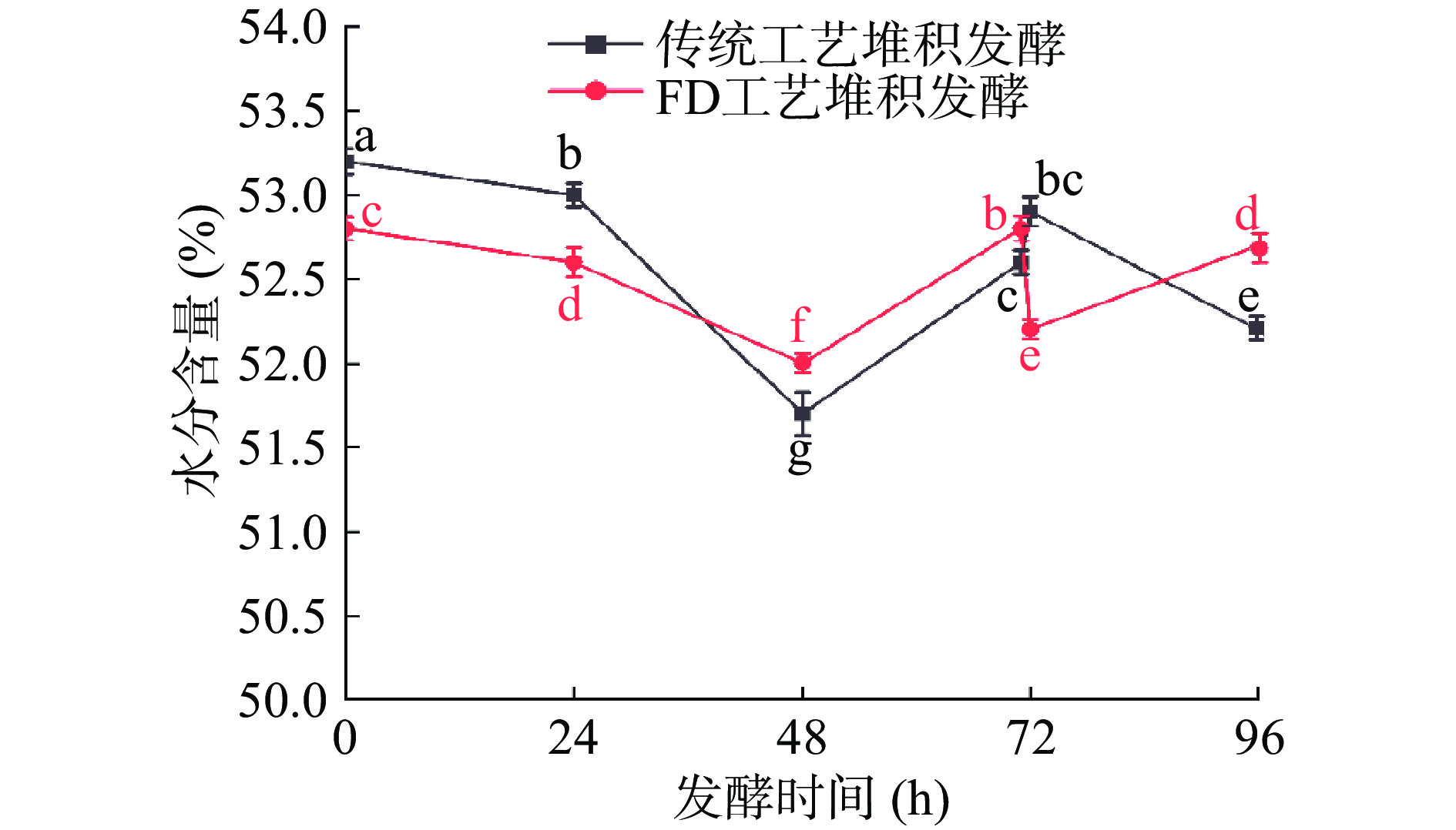
水分是酱香型白酒生产过程中控制的关键工艺参数之一[15],水分高低是判断发酵能否正常进行的依据之一。水分过高会使酒醅粘度升高,好氧型微生物生长受到抑制,厌氧型微生物加速繁殖,最终导致发酵酒醅出现酸败现象;水分过低则不利于糊化,且影响微生物正常生长,最终导致酒质受损[16-17]。堆积阶段酒醅水分含量变化如图2所示。
由图2中可知,实验组酒醅水分含量在52.0%~52.8%之间,对照组酒醅水分含量在51.7%~53.2%。两组样品在堆积发酵0~48 h,酒醅水分含量表现出下降趋势,由于堆积温度处于上升过程,水分蒸发速度增加,酒醅中的水分处于一个自然流失状态;在堆积发酵48~71 h,随着堆积时间的增加,温度升高,细菌进行大量生长繁殖代谢和淀粉的降解,产生部分水分,使得酒醅水分含量呈上升趋势。在72 h时,实验组经“FD工艺”后水分含量明显下降。在72~96 h时,受此时高温影响,传统堆积发酵酒醅水分含量呈下降趋势,而实验组酒醅经“FD工艺”后,大量引入氧气,微生物又一次富集,微生物再次进行生长繁殖代谢和淀粉降解,促使酒醅水分含量增加,且使整个堆积酒醅水分处于相对平衡状态。“FD工艺”能平衡酒醅堆各位点水分之间的差异,使得水分含量在整个堆积阶段变化幅度较小。整个发酵过程与李银强[17]和印璇等[18]研究结果基本一致,即酱香型白酒酿造过程中,发酵酒醅水分含量应保持在47%~56%,并且酒醅水分含量对酱香型白酒的生产有较大影响,应该严格控制酒醅水分含量。
2.1.2 堆积阶段酒醅酸度变化
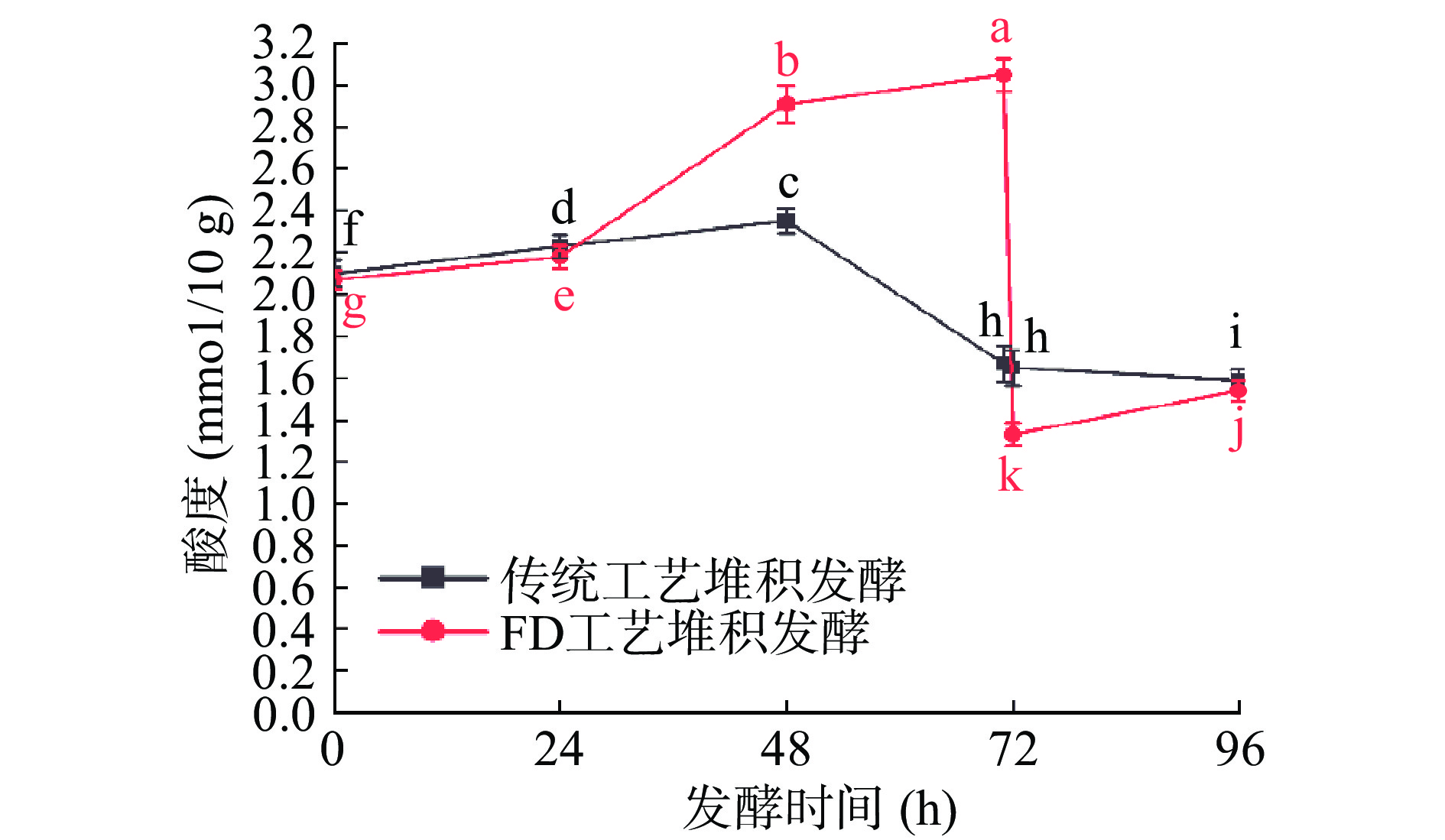
酸度是衡量堆积发酵后酒醅是否进入酒窖的主要依据之一;酸度过高或过低都会影响酒醅发酵状态,从而影响酒的产量和质量。为了保证白酒酒醅的固态发酵质量,酒醅酸度也是一个重要的影响因素,适宜的酸度能抑制杂菌的生长,为其他微生物正常生长提供良好的环境,同时能为各种酯类物质的合成提供前体[19]。印璇等[18]跟踪分析酱香型白酒酿造过程中的各项理化指标,认为酒醅酸度在1.5~2.2 mmol/10 g之间为适宜酒醅酸度。堆积阶段酒醅酸度变化如图3所示。
由图3可知,对照组酒醅在堆积过程中,酸度呈现先上升后下降趋势。在堆积发酵前期细菌大量繁殖产酸,酒醅酸度缓慢上升;在堆积发酵后期,由于堆积温度升高,产酸微生物代谢受到抑制,且有机酸合成酯类等化合物中被消耗,酒醅中酸度呈下降。实验组在0~71 h酸度呈上升趋势且上升幅度较大,在71 h时,实验组达到3.05 mmol/10 g,显著(P<0.05)高于对照组1.67 mmol/10 g。在经过“FD工艺”操作后,实验组酒醅酸度迅速下降至1.33 mmol/10 g;堆积到96 h时,实验组酒醅酸度由1.33 mmol/10 g上升为1.54 mmol/10 g,对照组为1.59 mmol/10 g;两组酒醅达到适宜入窖酸度便可进行入池发酵。在堆积24~71 h实验组酒醅酸度持续增加,由于该位点所采集的样品所处空间的某一方位酸类物质堆积过多所致,导致酒醅酸度持续增大;经“FD工艺”处理后,有效降低实验组酒醅酸度,达到适宜酸度1.59 mmol/10 g,符合酒醅入窖条件。由此可解决堆位点酸类物质在该点持续累积过多导致的酒醅酸败现象,说明“FD工艺”能够有效降低堆积酒醅酸度在某一方位持续增加,从而使得酒醅在各位点发酵状态基本一致。
2.1.3 堆积阶段酒醅淀粉含量变化
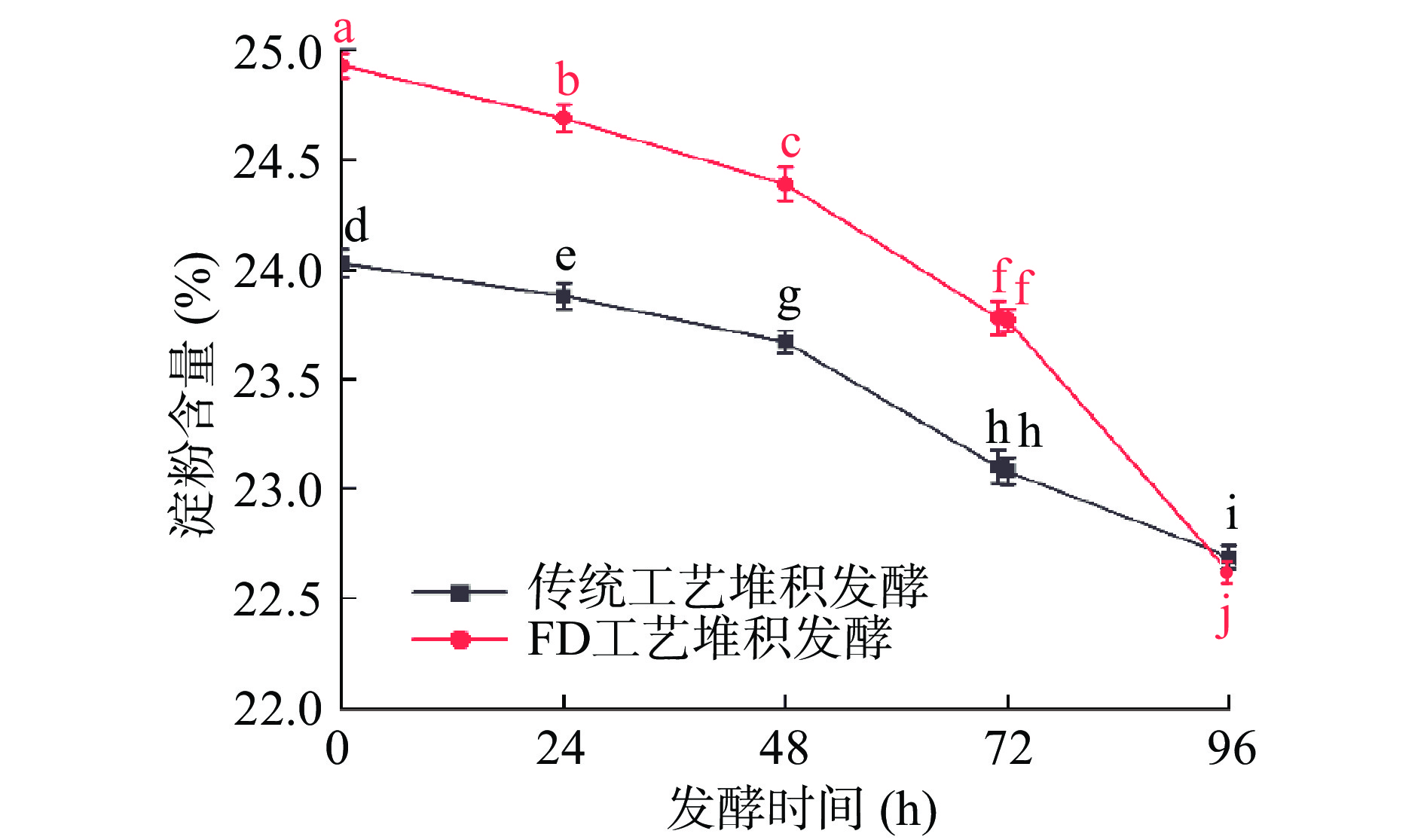
淀粉是酿造过程中细菌生长繁殖的能量来源,也是生成酒精的主要物质,淀粉含量高低与出酒率呈正比[20]。堆积阶段酒醅淀粉含量变化如图4所示。
由图4可知,在堆积发酵过程中,对照组酒醅和实验组酒醅随着堆积发酵时间的延长,酒醅中淀粉被微生物分解,淀粉含量下降。对照组酒醅淀粉含量从24.03%降至22.69%,淀粉含量下降了1.34%;实验组酒醅淀粉含量从24.93%下降至22.62%,淀粉含量下降了2.31%。在堆积71 h后,实验组酒醅堆进行“FD工艺”处理,引入大量氧气,使堆积酒醅微生物再次富集,微生物的种类数量增多,微生物代谢活动增强,淀粉含量转化(或消耗)速率加快,说明“FD工艺”有利于淀粉转化。张春林等[20]对第二轮次堆积发酵过程中,随着发酵时间的延长,酒醅中淀粉含量逐渐下降,从27.88%降至24.73%;尚柯等[21]在第三轮次堆积发酵中淀粉测定结果在26.81%~31.96%之间,变化幅度较小,说明堆积过程重点是富集微生物,酒精发酵微弱。本研究淀粉消耗结果与张春林等[20]和尚柯等[21]结果基本一致,并且说明“FD工艺”有助于淀粉的转化。
2.1.4 堆积阶段酒醅还原糖含量变化
发酵过程中还原糖含量的变化反映了糖化与发酵的协调程度[18],酒醅中的淀粉及其他多糖物质会水解成可发酵性还原糖,供微生物代谢利用,后期发酵产香。堆积阶段酒醅还原糖含量变化如图5所示。
由图5可知,两组酒醅还原糖含量均呈上升趋势,与张春林等[20]研究发现的在酱香型白酒二轮次堆积过程中还原糖含量呈明显的上升趋势,含量从0.65%上升至1.00%,具有相同的上升趋势。酒醅还原糖含量主要在积累过程中增加。对照组酒醅还原糖含量从1.45%上升至2.19%,整体上升0.74%;实验组酒醅还原糖含量从1.71%上升至2.83%,整体上升1.12%。在72~96 h,实验组经“FD工艺”处理后,还原糖含量从2.33%上升至2.83%,增加0.5%;对照组还原糖含量从2.13%上升至2.19%,增加0.06%。经过统计分析发现,实验组和对照组有显著差异(P<0.05),即经“FD工艺”处理的酒醅其还原糖量显著高于对照组( P <0.05),“FD工艺”有助于淀粉分解而形成酒醅中可发酵还原糖。本次研究所得结果实验组还原糖含量整体上升1.12%,对照组上升0.74%,远高于张春林等[20]的整体上升幅度(仅0.35%),淀粉在经“FD工艺”后氧气大量进入微生物生长繁殖加速消耗转变为还原糖,使得酒醅实验组还原糖含量明显高于对照组,满足酒醅中微生物的正常生长代谢,有助于各种微生物对还原糖的利用,进一步提升使酱香型原酒酒质[22]。
2.1.5 堆积发酵过程中温度变化
温度是评价高温堆积成效的重要指标之一,当堆积酒醅温度达到48~50 ℃时进入窖池发酵,适宜的温度有助于酒体风味的形成和质量的提高[23]。堆积发酵过程中温度变化如图6所示。
由图6可知,两组样品酒醅温度变化总体均呈上升趋势,均从收堆温度30 ℃左右逐步上升至50 ℃左右。其中,实验组在堆积71 h时温度为43.4 ℃,达到“FD工艺”温度指标要求,此时实验组进行“FD工艺”处理,处理后实验组各层温度均匀混合,温度下降。在72 h时两组样本数据达到显著(P<0.05)水平,此时由于温度较低的堆心及堆底与温度较高的堆面和堆顶酒醅混合,加之外界冷空气的引入,导致实验组酒醅温度显著(P<0.05)下降。随后在24 h内迅速上升至48.6 ℃达到入窖温度,由于在处理过程中经过机械化破堆、混匀、换位,大量氧气进入酒醅,微生物的生长和新陈代谢所释放的热量使反应堆温度升高。在堆积96 h两组样品酒醅堆积温度达到入池发酵温度,即可进行入池发酵。
2.2 细菌群落多样性分析
2.2.1 Alpha多样性指数
Alpha多样性分析是分析微生物多样性的一个重要指标,用于研究某一生境内(或样本中)的群落多样性,可通过对一系列Alpha多样性指数进行评估,获得环境群落中物种的丰富度、多样性等信息。Shannon指数和Simpson指数是反映群落多样性(community diversity)的指标,Shannon指数越大说明微生物多样性越高;Simpson指数越大,微生物多样性越低;Coverage指数反映群落覆盖度(community coverage),Coverage指数越大,则样本中序列被测出的概率越高,该指数实际反映了本次测序结果是否代表样本的真实情况;Coverage指数接近1,说明测序数据足够大,可以反映绝大多数的细菌信息。Sobs指数、Ace指数、Chao指数是衡量细菌丰富度指标,指数大小与微生物丰富度呈正相关。
酒醅细菌群落测序数据统计分析如表1。由表1可以看出酒醅样品的Ace、Sobs、Chao指数在逐步减少;在堆积过程中,由于温度不断上升,酒醅内部氧含量逐渐减少,微生物生长繁殖活动受抑制,一些不耐高温的菌经高温筛选后衰落凋亡。实验组样在堆积前4 d和对照组酒醅样品的指标变化趋势大致相同,呈现下降趋势,在堆积最后1 d,样品F5的酒醅细菌丰富度达到最大值。细菌群落多样性从Shannon指数和Simpson指数的变化可以反映出来,Shannon指数在两组样品中呈下降趋势,样品F5中Shannon指数最高,表明此时细菌多样性指数最大,种类越丰富。由表1可知,10个样本的Coverage指数均为1,说明本次测序深度基本能够覆盖酒醅中所有细菌群落。以上结果说明,酒醅经过“FD工艺”操作后,堆积酒醅重新引入大量氧气,打破堆积发酵的内部酒醅厌氧环境,并再次富集环境中的细菌类等微生物,促进细菌类等微生物大量生长和繁殖,并经过“FD工艺”处理后的酒醅再次堆积发酵,而温度急剧上升,再次进行高温,从而达到二次富集和筛选作用,最终使得有益于酿酒生产的细菌类微生物的丰富度、多样性显著提升。
表 1 Alpha多样性指数Table 1. Alpha diversity index样品号 Sobs Ace Chao Shannon Simpson Coverage C1 154 157 155 3.37 0.06 1 C2 91 94 92 2.70 0.14 1 C3 70 71 70 2.03 0.33 1 C4 67 68 67 2.38 0.27 1 C5 41 41 41 0.83 0.74 1 F1 104 105 104 2.43 0.25 1 F2 86 86 86 2.07 0.34 1 F3 47 47 47 0.93 0.71 1 F4 34 34 34 1.29 0.53 1 F5 194 195 194 2.90 0.15 1 2.2.2 细菌群落组成成分分析
2.2.2.1 优势细菌门水平变化规律
两组10个样品中检测出了23个细菌门(图7),将相对丰度高于1%细菌门定义为优势菌门。两组样本在堆积发酵过程中,共检测到相对丰度高于1%细菌门,包括变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)三大门类(图7)。
变形菌门(Proteobacteria)被发现是酱香型白酒酿造过程中的主要细菌门[24]。变形菌门在对照组中呈现上升的变化趋势,占比分别为11.61%、42.34%、67.89%、52.42%和91.95%;在实验组样品中,堆积0~72 h与对照组变化趋势相近,堆积72~96 h有明显的下降,占比分别为55.62%、71.51%、88.21%、89.21%和41.17%(图7)。实验组在堆积第72 h进行“FD工艺”处理后,F5中变形菌门(41.17%)占比明显低于对照组C5(91.95%),以上说明“FD工艺”不利于变形菌门的生长繁殖。
厚壁菌门(Firmicutes)是中国白酒发酵过程中的关键微生物结构[25]。厚壁菌门在堆积过程中是呈下降的变化趋势(图7),对照组样品中堆积前期厚壁菌门占比达到81.53%,随着堆积时间逐渐下降,占比分别为55.06%、30.08%和45.15%,堆积最后1 d下降至7.97%;实验组样品中的厚壁菌门在堆积前期与对照组同样呈下降趋势变化,占比为41.96%、27.55%、11.43%和10.64%,在实验组样品堆积第96 h时,厚壁菌门占比为57.71%。通过样品C5(7.97%)和F5(57.71%)的对比可以看出,“FD工艺”能促进堆积酒醅中的厚壁菌门生长繁殖。
放线菌在酱香型白酒中具有调控风味、抑制有害杂菌生长的作用[26]。放线菌门(Actinibacteria)在堆积过程中变化趋势总体下降,对照组C样品中的占比分别为6.64%、2.37%、1.98%、2.41%和0.08%;实验组F样品中的占比分别为2.38%、0.90%、0.35%、0.08%和0.37%(图7)。实验组样品在堆积96 h放线菌门(0.37%)占比出现增长且大于对照组(0.08%),说明“FD工艺”能促进堆积酒醅中的放线菌门生长繁殖。
2.2.2.2 优势细菌属水平变化规律
两组10个样品中检测出了205个细菌属(图8),将相对丰度高于1%细菌门定义为优势菌属。两组样本在堆积发酵过程中,共检测到相对丰度高于1%细菌属包括醋酸杆菌属(Acetobacter)、芽孢杆菌属(Bacillus)、枝芽孢菌属(Virgibacillus)、克罗本斯泰亚菌属(Kroppenstedtia)、高温放线菌属(Thermoactinomyces)、海洋芽孢杆菌属(Oceanobacillus)、火山渣芽孢杆菌属(Scopulibacillus)、糖多孢菌属(Saccharopolyspora)、驹型杆菌属(Komagataeibacter)、乳酸杆菌属(Lactobacillus)、Norank f Pseudonocardiaceae、片球菌属(Pediococcus)、葡萄球菌属(Staphylococcus)、Unclassified_c_Bacilli。
芽孢杆菌(Bacillus)是酱香白酒中酱香风味物质的主要代谢菌属[27],能分泌蛋白酶、淀粉酶等水解酶类,分解原料形成丰富的发酵前体物质,有利于风味物质的形成[28]。对照组样品中的相对丰度呈逐步下降趋势,由21.76%下降至1.49%,实验组样品在堆积0~72 h和对照组样品变化趋势相同,从10.29%下降至2.43%;经过“FD工艺”处理后,堆积第96 h芽孢杆菌相对丰度由2.43%上升至14.50%,上升幅度明显(图8)。样品F5(14.50%)较样品C5(1.49%)相对丰度高了13.01%,芽孢杆菌(Bacillus)相对丰度为14.50%,显著(P<0.05)高于张春林等[20]得出的芽孢杆菌属的相对丰度(5.90%),以上说明“FD工艺”有利于芽孢杆菌生长,为芽孢杆菌的生长创造有利的有氧条件。
枝芽孢菌属(Virgibacillus)对酱香型白酒风味品质的形成有重要贡献[29]。枝芽孢菌属(Virgibacillus)在对照组样品0~48 h细菌群落占比总体呈下降趋势,相对丰度由21.03%下降至4.85%,第72 h稍有上升,增至12.73%,96 h下降至1.69%;实验组样品0~72 h从8.77%下降至2.50%,经过“FD工艺”处理后,第96 h枝芽孢杆菌属相对丰度由2.50%上升至11.85%,上升幅度明显(图8)。样品F5(11.85%)较样品C5(1.69%)相对丰度高了10.16%,说明“FD工艺”有利于好氧枝芽孢菌属的生长。
鲜文东等[30]推测克罗本斯泰亚菌属(Kroppenstedtia)发酵功能类似于高温放线菌科多数菌属,能够参与有机物转化,利于多种酶类物质的生成。克罗本斯泰亚菌属(Kroppenstedtia)在对照组样品细菌群落占比总体呈下降趋势,0~48 h相对丰度由17.85%下降至4.01%,第48~72 h稍有上升,增至10.41%,在96 h下降至1.24%;实验组样品0~72 h从9.27%下降至2.55%,经过“FD工艺”处理后,在96 h时,Kroppenstedtia相对丰度上升至11.58%(图8)。样品F5较样品C5相对丰度高了10.34%。实验组含量明显高于较黄蕴利等[31]研究在第二轮次酱香型白酒中堆积优势细菌中Kroppenstedtia含量的6.13%,以上说明“FD工艺”有利于耐高温的克罗本斯泰亚菌微生物生长和繁殖。
高温放线菌属(Thermoactinomyces)菌种的功能性研究主要集中在产酶和产其他活性物质这两方面[32],还可生成具有酱香型味的吡嗪类物质和土霉味的二甲萘烷醇等挥发性物质[33]。在72~96 h时对照组相对丰度由4%下降至0.5%,实验组在经过“FD工艺”后由1.17%上升至8.12%(图8),实验组含量明显高于对照组和黄蕴利等[31]在第二轮次堆积过程中Thermoactinomyces含量的1.37%,说明“FD工艺”有利于高温放线菌属的生长。
3. 结论
对酱香型白酒同一生产车间相邻两个堆积发酵的酒醅分别采用“FD工艺”(实验组)和传统堆积发酵工艺(对照组),跟踪分析第二轮次堆积发酵酒醅。较之传统堆积发酵工艺而言,相关“FD工艺”处理后的酒醅的含水量更加稳定,有效保证水分的动态平衡;同时,也能明显降低酒醅堆积发酵过程中酸度积累和产酸不均匀的现象,提升了淀粉的转化率和可发酵还原糖的积累。另外,“FD工艺”的应用能够显著促进细菌类微生物的生长和繁殖,如芽孢杆菌(Bacillus)、枝芽孢菌属(Virgibacillus)的生长,以及耐高温的克罗本斯泰亚菌属(Kroppenstedtia)、高温放线菌属(Thermoactinomyces),提高其丰富度和多样性,为酱香型白酒入池发酵提供大量的菌系、物系和酶系,有助于提升酱香型白酒产量和品质。
“FD工艺”能够有效促进堆积发酵,但是,该工艺对于相对无氧环境中的窖池发酵是否有影响尚未清楚,需后续开展相关研究,以明确“FD工艺”对整个酒醅发酵阶段的影响,从而更好地解析“FD工艺”对酱香型白酒酿造过程的影响,为“FD工艺”对酱香型白酒酿造提供理论依据。
-
表 1 Alpha多样性指数
Table 1 Alpha diversity index
样品号 Sobs Ace Chao Shannon Simpson Coverage C1 154 157 155 3.37 0.06 1 C2 91 94 92 2.70 0.14 1 C3 70 71 70 2.03 0.33 1 C4 67 68 67 2.38 0.27 1 C5 41 41 41 0.83 0.74 1 F1 104 105 104 2.43 0.25 1 F2 86 86 86 2.07 0.34 1 F3 47 47 47 0.93 0.71 1 F4 34 34 34 1.29 0.53 1 F5 194 195 194 2.90 0.15 1 -
[1] 邱声强, 唐维川, 赵金松, 等. 酱香型白酒生产工艺及关键工艺原理简述[J]. 酿酒科技,2021(5):86−92. [QIU S Q, TANG W C, ZHAO J S. et al. Brief introduction of Jiangxiang Baijiu production technology and principles of key processes[J]. Liquor-Making Science & Technology,2021(5):86−92. [2] 胡小霞, 黄永光, 涂华彬, 等. 酱香型白酒1轮次酿造细菌的菌群结构[J]. 食品科学,2020,41(14):175−182. [HU X X, HUANG Y G, TU H B, et al. Bacterial diversity structure during the first round of pile and pit fermentation of Moutai-flavor Baijiu[J]. Food Science,2020,41(14):175−182. doi: 10.7506/spkx1002-6630-20190618-195 [3] 陈梦圆, 刘学彬, 汪平, 等. 产酯香功能菌对酱香型酒醅的影响[J]. 食品科学,2018,39(10):199−205. [CHEN M Y, LIU X B, WANG P, et al. Effects of an ester aroma-producing bacterial strain on Maotai-flavor fermented grains[J]. Food Science,2018,39(10):199−205. doi: 10.7506/spkx1002-6630-201810031 [4] 李欣, 王彦华, 林静怡, 等. 高通量测序技术分析酱香型白酒酒醅的微生物多样性[J]. 福建师范大学学报(自然科学版),2017,33(1):51−59. [Li X, WANG Y H, LIN J Y, et al. Analysis of microbial diversity in the fermented grains of Maotai-flavor liquor using high-throughput sequencing[J]. Journal of Fujian Normal University (Natural Science Edition),2017,33(1):51−59. doi: 10.12046/j.issn.1000-5277.2017.01.009 [5] 冯雨. 酱香型白酒的堆积发酵[J]. 酿酒科技,2013(2):80−81. [FENG Y. Study on stacked fermentation of Jiang-flavor liquor[J]. Liquor-Making Science & Technology,2013(2):80−81. doi: 10.13746/j.njkj.2013.02.035 [6] 王邦坤, 张维山. 北方大曲酱香酒云门陈酿高温堆积发酵工艺探讨[J]. 酿酒,2019,46(3):40−42. [WANG B K, ZHANG W S. Research on the high temperature stacking fermentation technology applied in the production process of north Maotai-flavor Daqu Yunmen aging liquor[J]. Liquor Making,2019,46(3):40−42. [7] 罗太江, 王军, 冯沛春. 酱香型白酒堆积发酵工艺的管理研究分析[J]. 酿酒科技,2020(7):71−74. [LUO T J, WANG J, FENG P C. Research progress in stacking fermentation of Jiangxiang Baijiu[J]. Liquor-Making Science & Technology,2020(7):71−74. doi: 10.13746/j.njkj.2020067 [8] LI R Q, ZHU H M, RUAN J, et al. De novo assembly of human genomes with massively parallel short read sequencing.[J]. Genome research,2010,20(2):265−72. doi: 10.1101/gr.097261.109
[9] YANG F, ZENG X W, NING K, et al. Saliva microbiomes distinguish caries-active from healthy human populations[J]. The ISME Journal,2012,6(1):1−10. doi: 10.1038/ismej.2011.71
[10] NIE Z, ZHENG Y, WANG M, et al. Exploring microbial succession and diversity during solid-state fermentation of Tianjin duliu mature vinegar[J]. Bioresource Technology,2013,148:325−333. doi: 10.1016/j.biortech.2013.08.152
[11] BOKULICH NA, AMIRANASHVILI L, CHITCHYAN K, et al. Microbial biogeography of the transnational fermented milk matsoni[J]. Food Microbiology,2015,50:12−19. doi: 10.1016/j.fm.2015.01.018
[12] 郭敏, 黄永光, 邱树毅, 等. 高通量测序在酱香白酒微生态多样性研究中的应用[J]. 中国酿造,2017,36(5):146−151. [GUO M, HUANG Y G, QIU S Y, et al. Application of high-throughput sequencing in microbial diversity of Moutai-flavor Baijiu[J]. China Brewing,2017,36(5):146−151. [13] 沈怡方. 白酒生产技术全书[M]. 北京: 中国轻工业出版社, 2017.12(第13次印刷) SHEN Y F. Manual for baijiu-making technology[M]. Beijing: China Light Industry Press, 2017.12 (13th printing).
[14] LIU C S, ZHAO D F, MA W J, et al. Denitrifying sulfide removal process on high-salinity wastewaters in the presence of Halomonas sp[J]. Applied Microbiology and Biotechnology,2016,100(3):1421−1426. doi: 10.1007/s00253-015-7039-6
[15] 汪地强, 陈良强, 涂昌华, 等. 酱香型白酒堆积过程腰线酒醅浅析[J]. 中国酿造,2020,39(9):97−100. [WANG D Q, CHEN L Q, TU C H, et al. Analysis on waist layer fermented grains during accumulating process of sauce-flavor Baijiu[J]. China Brewing,2020,39(9):97−100. doi: 10.11882/j.issn.0254-5071.2020.09.018 [16] 万勇, 张兆丰, 熊翔, 等. 酱香型不同轮次发酵酒醅理化因子变化规律研究[J]. 中国食品工业,2022(4):107−111. [WAN Y, ZHANG Z F, XIONG X, et al. Changes of physical and chemical factors of fermented grains in different cycles of Maotai-flavor Baijiu[J]. China Food Industry,2022(4):107−111. [17] 李银强. 酱香型白酒糟醅水分分析[J]. 酿酒科技,2011(5):72−73. [LI Y Q. Analysis of moisture content of distiller's grains and fermented grains of Maotai-flavor liquor[J]. Liquor-Making Science & Technology,2011(5):72−73. doi: 10.13746/j.njkj.2011.05.035 [18] 印璇, 冯英志, 刘建华, 等. 北大仓酱香白酒酿造机理的初步研究[J]. 酿酒,2015,42(1):63−68. [YIN X, FENG Z Y, LIU J H, et al. A preliminary study on the mechanism of Beidacang Maotai-flavor liquor making[J]. Liquor Making,2015,42(1):63−68. doi: 10.3969/j.issn.1002-8110.2015.01.015 [19] 杨萍, 胡萍, 樊敏, 等. 酱香型酒曲及窖内酒醅挥发性成分的分析[J]. 中国酿造,2018,37(11):166−171. [YANG P, HU P, FAN M, et al. Analysis of the volatile components from Jiuqu and fermented grains in the pits of the sauce-flavor Baijiu[J]. China Brewing,2018,37(11):166−171. [20] 张春林, 杨亮, 李喆, 等. 酱香型白酒二轮次堆积酒醅微生物群落与理化指标相关性研究[J]. 中国酿造,2021,40(11):31−36. [ZHANG C L, YANG L, LI Z, et al. Correlation between microbial community and physicochemical indexes in fermented grains of stacking fermentation process of the second rounds sauce-flavor Baijiu[J]. China Brewing,2021,40(11):31−36. [21] 尚柯, 韩兴林, 潘学森, 等. 酱香型白酒高温堆积过程相关理化参数变化情况的初步分析[J]. 酿酒科技,2015(10):1−4. [SHANG K, HAN X L, PAN X S, et al. The change of physiochemical indexes of Jiangxiang fermented grains in the process of high-temperature stacking[J]. Liquor-Making Science & Technology,2015(10):1−4. doi: 10.13746/j.njkj.2015293 [22] 张永燕. 不同轮次酱香型酒醅理化特性和微生物群落结构变化研究[D]. 绵阳: 西南科技大学, 2018 ZHANG Y Y. The change of physicachemical properties and microbial community structure of Maotai-flavor fermented grains in different cycles[D]. Mianyang: Southwest University of Science and Technology, 2018.
[23] 戴奕杰. 酱香型白酒酿造过程中微生物群落组成及其与酒品质的关系[D]. 长沙: 湖南农业大学, 2019 DAI Y J. The composition of microbial community and its relationship with liquor quality in the brewing process of Maotai-flavor liquor[D]. Changsha: Hunan Agricultural University of, 2019.
[24] WANG L, WANG Y Y, WANG D Q, et al. Dynamic changes in the bacterial community in Moutai liquor fermentation process characterized by deep sequencing[J]. Journal of the Institute of Brewing,2015,121(4):603−608. doi: 10.1002/jib.259
[25] 王琳. 茅台产区酱香白酒窖池发酵酒醅微生物菌群结构特征分析[D]. 贵阳: 贵州大学, 2021 WANG L. Structural characteristics of microflora in fermented grains of Maotai-flavor baijiu-making cellar in Maotai area [D]. Guiyang: Guizhou University, 2021.
[26] 尤小龙. 酱香白酒酿造过程放线菌代谢活性成分研究[D]. 贵阳: 贵州大学, 2016 YOU X L. Study on active components of an actinomycete from Maotai-flavor liquor brewing process[D]. Guiyang: Guizhou University, 2016.
[27] 曹润洁, 何宏魁, 葛向阳, 等. 芝麻香型酒醅堆积过程中微生物结构变化分析[J]. 微生物学通报,2019,46(6):1371−1380. [CAO R J, HE H K, GE X Y, et al. Change of microbial community during stacking fermentation of sesame-flavor Jiupei[J]. Microbiology China,2019,46(6):1371−1380. doi: 10.13344/j.microbiol.china.180482 [28] ZHANG W, SI G, DU H, et al. Directional design of a starter to assemble the initial microbial fermentation community of Baijiu[J]. Food Research International,2020,134:109255. doi: 10.1016/j.foodres.2020.109255
[29] 王光路, 张帆, 杨旭, 等. 贾湖原香型白酒高温堆积过程原核微生物的消长规律研究[J]. 中国酿造,2020,39(11):30−35. [WANG G L, ZHANG F, YANG X, et al. Growth and decline of prokaryotic microorganisms during high temperature stacking fermentation of the Jiahu original flavor Baijiu[J]. China Brewing,2020,39(11):30−35. doi: 10.11882/j.issn.0254-5071.2020.11.007 [30] 鲜文东, 明红, 李文均. 高温放线菌科最新研究进展小型综述[J]. 微生物学报,2015,55(1):1−11. [XIAN W D, MING H, LI W J. A small review of recent research progress in Pyroactinomycetes[J]. Acta Microbiologica Sinica,2015,55(1):1−11. doi: 10.13343/j.cnki.wsxb.20140237 [31] 黄蕴利, 黄永光, 胡建峰, 等. 酱香型白酒第二轮次酒发酵过程微生物多样性研究[J]. 中国酿造,2017,36(9):30−35. [HUANG Y L, HUANG Y G, HU J F, et al. Microbial diversity of the second rounds liquid of Moutai-flavor Baijiu during fermentation process[J]. China Brewing,2017,36(9):30−35. [32] 冯慧军, 翟磊, 程坤, 等. 高温放线菌属研究进展[J]. 食品与发酵工业,2017,43(11):257−261. [FENG H J, QUN L, CHENG K, et al. Advances in the research of Thermoactinomyces[J]. Food and Fermentation Industries,2017,43(11):257−261. [33] 蒋倩儿, 陈文浩, 孙金沅, 等. 酱香型白酒大曲微生物研究进展[J]. 中国酿造,2021,40(12):1−5. [JIANG Q E, CHEN W H, SUN J Y, et al. Research progress on microorganism of sauce-flavor Baijiu Daqu[J]. China Brewing,2021,40(12):1−5. doi: 10.11882/j.issn.0254-5071.2021.12.001 -
期刊类型引用(7)
1. 杨磊,余辉,罗南海,王业,谢军. 酱香型白酒高温堆积发酵工艺创新研究回顾与展望. 中国酿造. 2024(02): 15-21 .  百度学术
百度学术
2. 李潮云,卢君,冯海燕,李国辉,唐平,梁树英,刘慧,杨志平,谌良杰,王彬,焦琳,张帅. 酱香型白酒二轮次堆积酒醅酵母菌数量与理化指标变化分析. 中国酿造. 2024(02): 48-52 .  百度学术
百度学术
3. 陈芬. 酱香型白酒酿造环节创新研究现状及展望. 酿酒科技. 2024(09): 97-103 .  百度学术
百度学术
4. 赵湖冰,杨刚仁,李旭,张飞,罗雕,朱大超,陈勇,李中泰. 酱香型白酒堆积发酵异常的研究现状与展望. 中国酿造. 2024(10): 1-5 .  百度学术
百度学术
5. 杨明,朱维民,陈香梅,甘霖耀,韦贺丽,杨程,杨芸,张洁. 不同生产工艺对酱香型白酒酸酯变化的影响研究. 中国酿造. 2024(12): 149-154 .  百度学术
百度学术
6. 禄凌飞,沈小娟,郑蕾,沈才洪,王松涛,刘光钱,涂荣坤. 接种堆积成熟糟醅对酱香型酒堆积异常堆子的影响. 中国酿造. 2023(08): 47-51 .  百度学术
百度学术
7. 杨磊. 酱香型白酒酿造环节创新研究现状及展望. 酿酒. 2023(06): 33-38 .  百度学术
百度学术
其他类型引用(3)





 下载:
下载:




 下载:
下载:



