Determination of Shrimp Allergens in Meat Products by Ultra Performance Liquid Chromatography-Tandem Mass Spectrometry
-
摘要: 目的:建立超高效液相色谱-串联质谱(ultra performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)法检测肉制品中虾过敏原的定量方法。方法:选取基质较为复杂的肉制品(西式火腿、香肠和肉丸)作为研究对象。样品经磷酸盐缓冲液(Phosphate buffer solution,PBS)超声提取30 min,离心(10000 r/min,15 ℃,10 min)后加入乙腈去除脂肪,取样液加入内标肽段(2.5 μmol/L,40 μL)和胰蛋白酶(1 mg/mL,10 μL)在37 ℃下酶解16 h后上液质进行分析,样品经T3柱进行分离,0.1%甲酸-水溶液和乙腈梯度洗脱,多反应监测(multiple reaction monitoring,MRM)正离子模式采集数据,内标法定量。结果:采用该方法测定肉制品中虾过敏原蛋白含量,其中定量肽段在0.001~2.0 μmol/L范围内,线性关系良好,决定系数R2为1.0000,检出限为0.67 mg/kg,定量限为2.00 mg/kg;在三个加标浓度水平下,回收率为83.2%~104.5%,精密度为2.63%~7.92%。结论:该方法具有特异性强、灵敏度高和回收率好等优势,适用于肉制品中虾过敏原的筛查定量。
-
关键词:
- 超高效液相色谱-串联质谱法 /
- 肉制品 /
- 虾过敏原 /
- 特征肽段 /
- 原肌球蛋白
Abstract: Objective: To establish a method for the determination of shrimp allergens in meat products by ultra performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS). Methods: Meat products (cooked ham, sausages and meatballs) with complex matrix components were selected as the detection target. The samples were extracted by ultrasonic in phosphate buffer solution (PBS) for 30 min, and acetonitrile was added to remove fat after centrifugation (10000 r/min, 15 ℃, 10 min). Finally, trypsin (1 mg/mL, 10 μL) was added to the sample diluents which had been mixed with internal peptide (2.5 μmol/L, 40 μL), and the enzymolysis process lasted 16 h at 37 ℃ before UPLC-MS/MS analysis. The samples were separated on a T3 column, and eluted by gradient elution with 0.1% formic acid aqueous solution and acetonitrile. The data was collected by multiple reaction monitoring (MRM) in positive ion mode, and quantified by internal standard method. Results: The method was used to determine the content of shrimp allergen in meat products, and the quantitative peptide had a good linear relationship with the determination coefficients 1.0000 in the range of 0.001~2.0 μmol/L. The limits of detection was 0.67 mg/kg, and the limits of quantification was 2.00 mg/kg. The recovery was 83.2%~104.5% and the precision was 2.63%~7.92% at three spiked levels. Conclusion: The method has the advantages of strong specificity, high sensitivity and good recovery. It was suitable for the screening and quantification of shrimp allergens in meat products. -
食品过敏原是指食品中天然存在或人工添加,在进入人体之后会引起过敏反应的物质,通常由蛋白质或糖蛋白组成[1],目前已经鉴定出的食物过敏原蛋白超过了380种,而且数量还在不断增加[2]。恶心、呕吐、荨麻疹和哮喘等症状都属于过敏反应,过敏反应会降低个体生活质量,甚至危及生命[3-5]。GB7718-2011《预包装食品标签通则》[6]中鼓励食品生产企业“自愿”标识致敏物质来提示消费者潜在风险。而新修订的GB 7718(征求意见稿)中拟将八类致敏物质配料由“推荐性标示”更改为“强制性标示”。因此,基于未来监管需求,开发准确可靠的过敏原检测方法,并进行含致敏物质的食品风险评估,对保障消费者安全健康具有十分重要的意义。
食品过敏原检测的传统方法是酶联免疫吸附试验(enzyme linked immunosorbent assay, ELISA)和实时聚合酶链式反应(quantitative real-time polymerase chain reaction, qPCR)[7]。ELISA 法依赖于抗体和抗原之间特异性相互作用[8],而食品中的其他蛋白质和抗体可能会发生交叉反应[9],且热加工过程会破坏目标蛋白质的结构,从而影响测定结果准确性。qPCR法通过测定与过敏原蛋白相关的靶向DNA片段,间接得到过敏原的含量,不适用于测定具有未知基因序列的过敏原[10-11]。
近年来,超高效液相色谱-串联质谱法已经被广泛用于食品中过敏原的筛查、定量,具有高灵敏度、高特异性和高通量的优势[5,12-14],可以避免免疫测定中蛋白质的变性和交叉反应的缺点,通过目标肽段直接定量目标过敏原蛋白质[15-16]。以往利用质谱法研究过敏原主要集中在坚果、大豆和牛奶蛋白范围,如:复杂加工食品(冰激凌、酱汁和巧克力)[17-20]中的大豆和多种坚果蛋白;焙烤食品(面包、麦片、饼干和曲奇)[18,20-22]、饮料(红酒和果汁)[22-23]、水果制品(果酱)[22]和肉制品(香肠、肉馅和汉堡肉饼)[13]中的牛奶蛋白。相比之下,基于质谱法检测肉制品中虾过敏原蛋白的研究较少。
虾过敏原属于甲壳类过敏原蛋白,已被质谱鉴定出的这类蛋白主要包括:肌球蛋白轻链(myosin light chain,MLC)、肌钙结合蛋白(sarcoplasmic calcium-binding protein,SCP)、磷酸甘油醛异构酶蛋白(triosphosphate isomerase,TPI)、精氨酸激酶(arginine kinase, AK)和原肌球蛋白(tropomyosin, TM)[8,23-24],其中原肌球蛋白(TM)被认为是甲壳类的主要过敏原蛋白[24-25],临床数据证明80%的海鲜过敏患者,都是基于对TM有极强的敏感性。TM具有高度热稳定性的α-螺旋结构 [26],不易在热加工中变性,溶于水及盐溶液,易被提取,因此本研究选定原肌球蛋白作为目标过敏原蛋白。
本研究通过测定筛选出的虾过敏原蛋白(TM)的特征肽段含量,直接定量虾过敏原蛋白,并利用内标肽段补偿酶解和基质效应带来的影响,最终建立高灵敏度的肉制品中虾过敏原的筛查和定量方法,并应用于实际肉制品样品中虾过敏原含量的测定。
1. 材料与方法
1.1 材料与仪器
西式火腿、肉丸、香肠等20批不同品牌的肉制品 购于京东商城;空白样品和阳性样品 购于北京物美超市,空白样品包括猪肉、牛肉、鸡肉、羊肉、鸭肉、黑鱼、鲤鱼块,阳性样品为虾米;标准品:IR-10 IQLLEEDLER(聚异亮氨酸-谷氨酰胺-亮氨酸-亮氨酸-谷氨酸-谷氨酸-天冬氨酸-亮氨酸-谷氨酸-精氨酸肽,纯度≥96.74%)、IR-10* IQL*(13C6,15N)LEEDLER(L*代表亮氨酸-OH-13C6,15N,纯度≥95.43%)、IR-9 IVELEEER(聚异亮氨酸-缬氨酸-谷氨酸-亮氨酸-谷氨酸-谷氨酸-谷氨酸-精氨酸肽,纯度≥97.05%)、IR-9* IVEL*(13C6,15N)EEER(纯度≥95.40%) 质谱纯,上海吉尔生化有限公司;胰蛋白酶(≥15000 u/mg)、甲酸、乙腈 质谱纯,美国赛默飞世尔科技公司;PBS片剂(pH7.2~7.4,1片溶于100 mL超纯水得到0.01 mol/L磷酸盐缓冲液,0.0027 mol/L氯化钾和0.137 mol/L氯化钠) 分析纯,北京Solarbio公司;三羟甲基氨基甲烷(tris (hydroxymethyl) methyl aminomethane,THAM) 分析纯,美国 Sigma Aldrich公司;盐酸 分析纯,国药集团化学试剂有限公司;实验用水 为Milli-Q超纯水。
Q-Extractive plus Orbitrap高分辨质谱仪(配备Dionex Ultimate 3000 RSLC nano system)、Nano Trap柱(Acclaim PepMap 100 C18 5 μm,100 Å)、贺力氏Pico21离心机 美国赛默飞世尔科技有限公司;digital picoVIEW nanospray DPV550 源、C18柱(外径360 μm,内径75 μm,柱长150 mm,填料H354 3 μm) 美国New Objective中国有限公司;高效液相色谱串联三重四级杆质谱仪Waters UPLC-Vevo TQ-S、Masslynx质谱软件、ACQUITY UPLC@HSS T3色谱柱(150 mm×2.1 mm,1.8 μm) 美国沃特世科技有限公司;B-491恒温水浴锅 瑞士BUCHI公司;XP 205分析天平 瑞士梅特勒-托利多公司;SI Vortex-Genie 2涡旋振荡器 美国Scientific Industries公司;Milli-Q去离子水发生器 美国Millipore公司。
1.2 实验方法
1.2.1 样品制备
西式火腿、肉丸和香肠等市售样品,每批样品在测定前进行绞碎均匀处理;空白样品肉块剔除筋膜、搅碎成肉馅,不同种类肉馅同质量分数混合后搅拌均匀,高温蒸熟,冷却后分装;阳性样品烘干干燥后磨碎封装。所有样品均保存在实验室−20 ℃条件下。
1.2.2 样品前处理
称取试样(1.2.1中制备的阳性、空白和市售样品)5 g(精确至0.001 g) 于50 mL容量瓶中,加入30 mL PBS(10 mmol/L)溶液,充分振荡,超声30 min,离心(10000 r/min,15 ℃,10 min)后取上清5 mL,加入5 mL 乙腈,充分振荡1 min,弃去上清,沉淀用1 mL的PBS溶液复溶并使用0.45 μm滤膜过滤,准确移取500 μL上述样液,加入40 μL内标(2.5 μmol/L),10 μL胰蛋白酶液(1 mg/mL),加水定容至1 mL,涡旋混匀后置于37 ℃水浴中恒温16 h,取出加入10 μL 10%的甲酸溶液终止反应,混匀后离心(10000 r/min,4 ℃,10 min),取上清供检测用。
1.2.3 标准品的配制
精确称取适量标准品,用Tris-HCl(50 mmol/L)溶液溶解,得到标准储备液:IR-10和IR-9浓度均为20 μmol/L,IR-10*和IR-9*浓度均为10 μmol/L;分别取标准储备液适量,用Tris-HCl(50 mmol/L)溶液稀释,得到混合标准中间液:IR-10和IR-9浓度为4 μmol/L,IR-10*和IR-9*浓度为2.5 μmol/L;取IR-10和IR-9混合标准中间液适量,加入IR-10*和IR-9*混合标准中间液40 μL、胰蛋白酶液(1 mg/mL)10 μL,用水定容至1 mL混匀,配制成浓度为:0.001、0.01、0.1、0.5、2.0 μmol/L的标准工作液,内标浓度为100 nmol/L,后续酶解操作和1.2.2样品酶解步骤同时进行,取上清进样并绘制标准曲线。
1.2.4 高分辨质谱鉴定特征肽段
阳性样品(虾米)经1.2.2的处理(不加内标),取5 μL样液用于高分辨质谱鉴定TM特征肽段。高分辨质谱检测条件:通过C18毛细管柱分离,0~7 min经Trap柱脱盐富集,上样泵流速为5 μL/min。流动相A:0.1%甲酸-水溶液,B:0.1%甲酸-(20%水+80%乙腈)溶液,流速为300 nL/min。采用梯度洗脱方式:0~7 min,5% B;7~95 min,5%~70% B;95~100 min,70%~90% B;100~130 min,90%~5% B。质谱采用Full MS-ddMS2扫描模式,扫描质量范围300~3000 m/z,一级MS分辨率70000,二级分辨率35000,隔离宽度2 m/z,毛细管温度250 ℃,喷雾电压2.1 kV。
1.2.5 液相色谱联用质谱仪器检测条件
空白基质、空白基质加标及市售样品经1.2.2处理后用于UPLC-MS/MS测定。检测条件:色谱柱:ACQUITY UPLC HSS@ T3柱150 mm×2.1 mm×1.8 μm;柱温:30 ℃;进样量:5 μL;流速:0.3 mL/min。流动相A:0.1%甲酸-水溶液,流动相B:乙腈。线性梯度洗脱程序:0~0.5 min,82% A;0.5~8.0 min,82%~55% A;8.0~8.3 min,55%~18% A;8.3~8.6 min,18% A;8.6~9.0 min,18%~82% A;9.0~11.5 min,82% A。
电喷雾离子源正离子模式;毛细管电压:3200 V;脱溶剂气温度:500 ℃;离子源温度:150 ℃;脱溶剂气流速:800 L/h;锥孔气流量:150 L/h;扫描模式为多反应监测(multiple reaction monitoring,MRM)。其他质谱检测参数见表1。
表 1 质谱检测和定量过敏原的设置Table 1. Analytical settings used for detection and quantification of allergens by mass spectrometry (MS)肽段名称简写 肽段类型 序列 分子量(g/mol) 母离子(m/z) 子离子(m/z) 锥孔电压(V) 碰撞能量(eV) IR-10 定性 IQLLEEDLER 1257.42 629.6 1016.8# 2 21 242.2 2 21 IR-10* 内标 IQL*LEEDLER 1264.42 632.9 1023.7# 2 21 242.2 8 21 IR-9 定量 IVELEEER 1129.29 565.5 917.6# 4 17 213.3 4 17 IR-9* 内标 IVEL*EEER 1136.29 569.0 924.7# 38 22 213.3 38 22 注:#表示定量离子;IR-10*为IR-10的内标;IR-9*为IR-9的内标。 1.2.6 过敏原蛋白含量计算
X=δ×c×V×Mm×10−3 式中:X代表样品中过敏原蛋白含量,mg/kg;δ代表稀释倍数;V代表上机前定容体积,mL ;c代表样品中目标肽段的测定浓度,μmol/L; M代表过敏原原肌球蛋白(来源Euphausia superba(Antarctic krill),UniprotKB中登记号为A7VKE0)分子量(32663 g/mol),m代表样品称样量,g。上述计算公式推导原理:目标肽段和对应虾过敏原蛋白摩尔质量n(mol)相等,即:n肽段=n蛋白。
1.3 数据处理
方法学考察中回收率平行测定6次,样品平行测定3次,采用Microsoft Office Excel 2003进行数据处理和图形绘制,结果以平均数表示。特征肽段鉴定的数据分析软件采用Peaks 8.0,设定FDR<0.01%。在数据软件中采用Uniprot下载来源于虾米 Euphausia superba (Antarctic krill)原肌球蛋白质全序列谱库匹配搜索原始数据,TM(A7VKE0)。
2. 结果与分析
2.1 虾过敏原蛋白中特征肽段及内标的确定
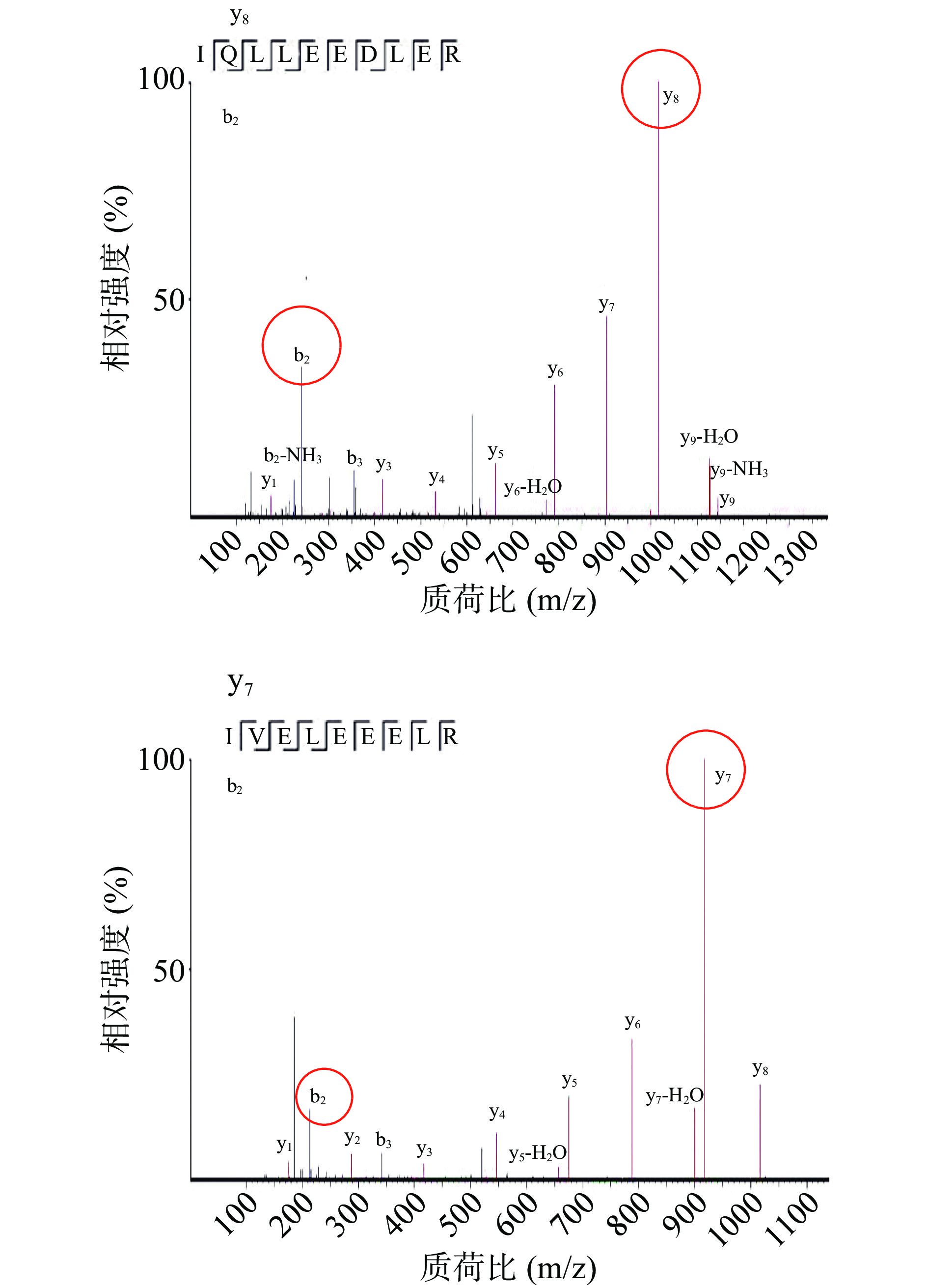
基于前期虾过敏原特征肽段筛选工作,选择和鉴定出能代表虾过敏原蛋白TM的特征肽段。根据特异性和相对强度等选择标准[27-28],并参考甲壳类制品过敏原蛋白的研究[29-30]中使用的肽段,本实验室经阳性样品确证最终选出IQLLEEDLER和IVELEEER两个特征肽段,考虑到实际的微量检测中可能产生假阳性误判的情况,把响应更高的肽段IVELEEER作为定量肽段,肽段IQLLEEDLER作为辅助分析的定性肽段,以减少误判率。对阳性样品进行分析,两个肽段的二级质谱图见图1,结合三重四级杆质谱仪的质谱条件优化,最终确定m/z 1016.8和m/z 242.2作为IQLLEEDLER的子离子,分别对应y8和b2两个碎片离子;m/z 917.6和m/z 213.3作为IVELEEER的子离子,分别对应y7和b2两个碎片离子。
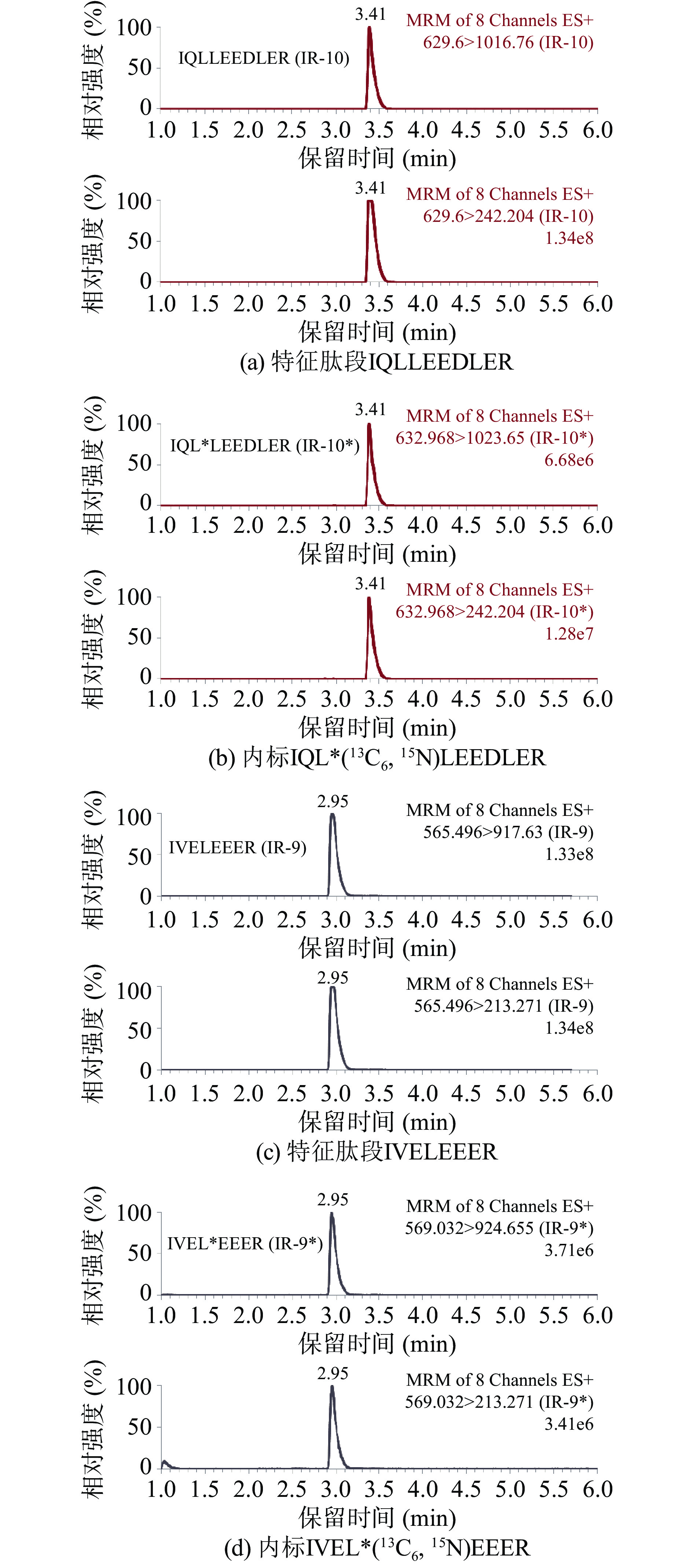
食物样品的成分复杂,常常对质谱分析定量的准确性和灵敏度产生影响[31-32]。为了提高方法的准确性,需要引入内标来减少离子抑制、基质效应带来的误差。本实验选取特征肽段对应的同位素标记肽段IQL*(13C6,15N)LEEDLER和IVEL*(13C6,15N)EEER作为内标。在样品酶解过程中,同位素标记内标肽段会释放出与虾过敏原特征肽段相似的碎片离子,在UPLC-MS/MS分析中显示出相似的色谱质谱行为,因而可以有效校正误差。图2所示为两条特异性肽段在阳性样品中的检出情况,色谱峰完全分离,可以共同监测虾过敏原的检出情况。同时,其对应的同位素内标具有相同的保留时间,且仪器响应接近,说明同位素标记内标肽段IQL*(13C6,15N)LEEDLER和IVEL*(13C6,15N)EEER与各自的虾过敏原特征肽段的色谱质谱行为相似,可以用来提高本方法定量的准确度。
2.2 特异性
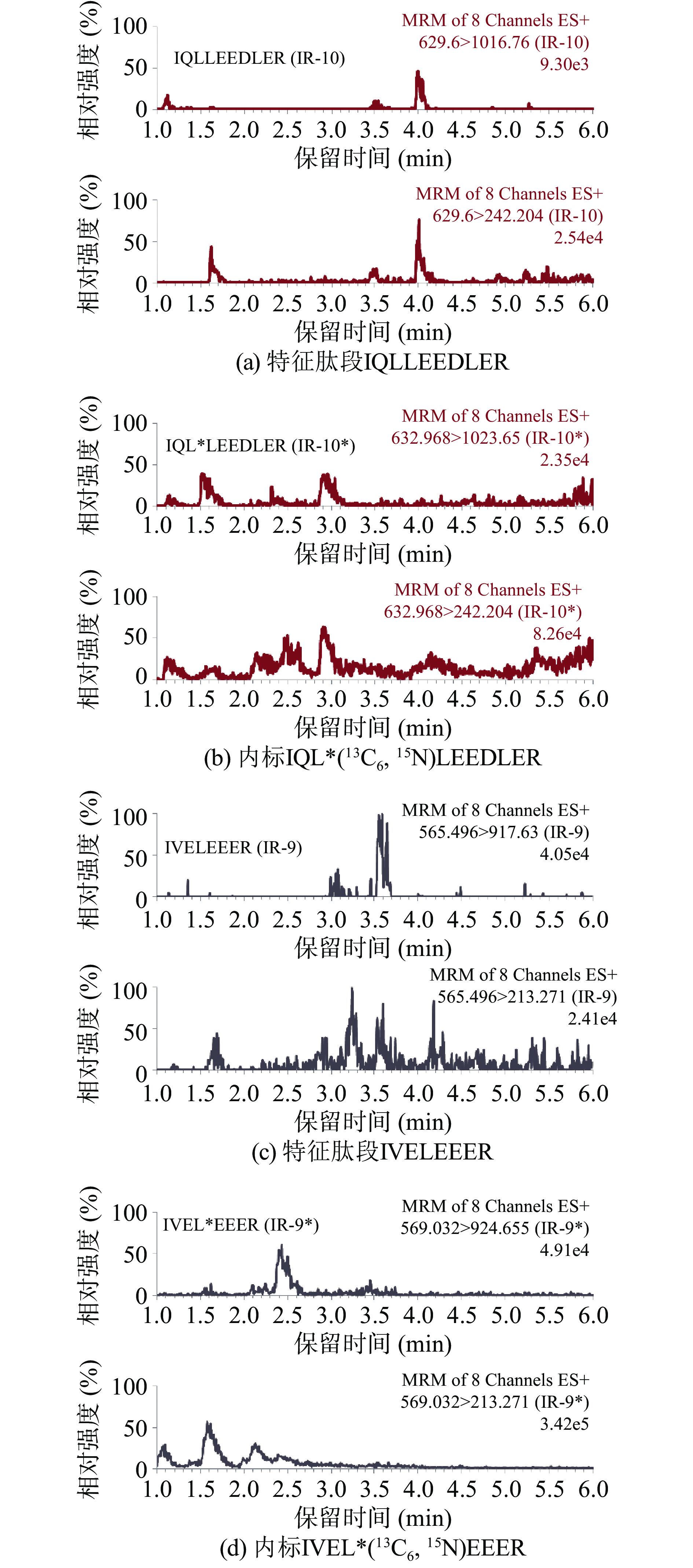
通过比较阳性样品中的特征肽段(图2)、空白基质样品(图3)和空白基质加标样品(图4)酶解后的质谱图,在1.2.5条件下的出峰情况评估特异性。空白基质加标样品与阳性样品均在同一时间出峰(IR 10及其内标在3.41 min出峰,IR 9及其内标在2.95 min出峰),同时空白基质中并未检出任何特征肽段及对应内标,这表明样品基质对本实验筛选出的肽段出峰时间没有影响,特征肽段准确性高且特异性强。
2.3 线性关系、检出限和定量限
以目标肽段与内标肽段峰面积之比为纵坐标,浓度比为横坐标制作线性曲线,肽段IR-9在0.001~2.0 μmol/L范围内,线性方程为y=1.8479x−0.0086,决定系数R2为1.0000。在空白基质提取液中添加低浓度标准溶液,当信噪比(signal to noise, S/N)等于3时,得到检出限为0.67 mg/kg,S/N等于10时,得到定量限为2.00 mg/kg。
质谱法与其他检测虾过敏原技术对比见表2。本方法的定量限比Stella等[29](3.5 mg/kg)的研究结果低,与Wang等[30](1.6 mg/kg)的定量限相近,这可能是由于质谱品牌型号和样品基质不同使得相同肽段的灵敏度有所差异。qPCR和ELISA法虽然也有较高的灵敏度,但均无法实现高通量检测多种过敏原类型;电化学免疫传感器法的样品处理过程复杂,对操作人员的要求很高,尚无法满足市场化检测需求。相比之下,本方法可弥补上述方法缺陷,且线性范围宽、灵敏度低,可以完全满足肉制品中虾过敏原的定量要求。
表 2 与其他检测虾过敏原技术对比Table 2. Comparison with other techniques for detecting shrimp allergens检测方法 样品基质 目标物 定量限
(mg/kg)对比数据来源 UPLC-MS/MS 西式火腿、
肉丸等原肌球蛋白
特征肽段2.00 本方法 LC-HRMS/MSa 鱼棒、蟹爪等 原肌球蛋白
特征肽段3.5 Stella等[29] HPLC-MSb 鸡肉肠、曲奇等 原肌球蛋白
特征肽段1.6 Wang等[30] qPCR 虾馅模型 16S rRNA 1 Fernandes等[33] ELISA 鱼糜、鳕鱼皮等 原肌球蛋白 1 Werner等[34] 电化学免疫
传感器细胞 原肌球蛋白
Pen a 10.15 μg/mL Jiang等[35] 注:a液相色谱-高分辨率串联质谱(liquid chromatography high-resolution tandem mass spectrometry,LC-HRMS/MS);b高效液相色谱-质谱( high performance liquid chromatography mass spectrometry,HPLC-MS)。 2.4 加标回收率和精密度
以空白基质作为本底,分别加入三个浓度水平的特征肽段标准溶液,测定加标回收率,每个浓度水平测定6次。如表3所示的结果可得,IR-9回收率为83.2%~104.5%,低浓度(2.00和5.25 mg/kg)加标水平的回收率比高浓度(20.00 mg/kg)的低,但仍在方法回收率偏差范围之内(浓度水平1~10 mg/kg,偏差范围75%~120%[36]);精密度较高,范围为2.63%~7.92%。结果表明该方法的回收率和精密度良好,均符合CNAS-TRL-011:2020中的要求。
表 3 加标回收率和精密度(n=6)Table 3. Recoveries and relative standard deviations (n=6)添加浓度(mg/kg) 测定浓度(mg/kg) 回收率(%) 精密度(%) 2.00 1.67 83.2 6.44 5.25 4.54 86.5 7.92 20.00 20.90 104.5 2.63 注:mg/kg指过敏原蛋白质量/称样量。 2.5 样品测定结果
为验证建立方法的适用性,随机选取20批市售的、有致敏可能的肉制品作为测试样品进行分析,包括西式火腿、香肠和肉丸三类。所选的样品中,有12批样品的外包装上标识了可能含有过敏原的提示,剩余8批没有过敏原提示。所有样品按照前述方法进行处理后测定,肽段IR-9用于定量计算,同时检出IR-9和IR-10的样品统计为阳性样品。
过敏原标识情况和样品测定结果汇总在表4,结果显示,在标识可能有过敏原风险的12批样品中,4批样品(编号1~3和18)虾过敏原含量在2.3~448.1 mg/kg之间,8批样品(编号4、5、7、9、12、13、15和16)未检出虾过敏原;在没有标识过敏原风险的8批样品中,1批样品(编号6)检出了定量和定性肽段,但计算值低于定量限;其余7批样品未检出虾过敏原。1和18号样品分别是虾肠和虾丸,过敏原蛋白含量分别为46.7和448.1 mg/kg;样品2、3号有少量检出,因与1号样品是同一生产厂家,怀疑是使用相同生产线清洗不彻底导致;6号样品可能也是生产中产生了交叉接触所致。另外,6号样品的检出结果虽然未达到定量限,但其未标识过敏原提示,可能会对部分极其敏感的过敏体质消费者造成危害。这也说明开发复杂食品基质中过敏原检测方法的重要性,可以保护过敏体质消费者免受潜在健康风险,同时便于规范食品生产企业整个供应链的过敏原管理。
表 4 样品测定结果(n=3)Table 4. Determination of allergens in samples (n=3)类别 样品编号 测定含量(mg/kg) 标签 香肠 1 46.7±4.2 √ 2 2.3±0.1 √ 3 2.7±0.2 √ 4 ND √ 西式火腿 5 ND √ 6 NQ — 7 ND √ 8 ND — 9 ND √ 10 ND — 11 ND — 12 ND √ 13 ND √ 14 ND — 15 ND √ 16 ND √ 17 ND — 肉丸 18 448.1±31.4 √ 19 ND — 20 ND — 注:—表示未标出;ND表示小于方法检出限;NQ表示小于方法定量限;编号1~4为香肠,5~17为西式火腿,18~20为肉丸。 此外,目前我国对于过敏原为推荐性标识要求,可能存在部分生产企业对过敏原标识不规范的情况,这可能也是上述测定结果和标识有出入的原因。总之,实际样品的检测结果说明,本方法适用于肉制品中虾过敏原的精准定量,且可靠性高。
3. 结论
本方法采用超高效液相色谱-串联质谱法测定肉制品中的虾过敏原TM,选取特征肽段IVELEEER作为定量肽段, IQLLEEDLER作为辅助分析的定性肽段,在降低假阳性率的同时提高方法的准确性;所采用的内标法可大幅度减少多种混合肉制品样品基质的干扰,提高了方法定量分析虾过敏原的灵敏度。在市售20种肉制品中进行验证,发挥了高灵敏度的特点,微量检测结果呈现了较强的可靠性。综上,本方法可用于评估有致敏风险的肉制品,满足监管部门风险监测和企业自检自控的品控的需求,维护和保障消费者的安全健康。
-
表 1 质谱检测和定量过敏原的设置
Table 1 Analytical settings used for detection and quantification of allergens by mass spectrometry (MS)
肽段名称简写 肽段类型 序列 分子量(g/mol) 母离子(m/z) 子离子(m/z) 锥孔电压(V) 碰撞能量(eV) IR-10 定性 IQLLEEDLER 1257.42 629.6 1016.8# 2 21 242.2 2 21 IR-10* 内标 IQL*LEEDLER 1264.42 632.9 1023.7# 2 21 242.2 8 21 IR-9 定量 IVELEEER 1129.29 565.5 917.6# 4 17 213.3 4 17 IR-9* 内标 IVEL*EEER 1136.29 569.0 924.7# 38 22 213.3 38 22 注:#表示定量离子;IR-10*为IR-10的内标;IR-9*为IR-9的内标。 表 2 与其他检测虾过敏原技术对比
Table 2 Comparison with other techniques for detecting shrimp allergens
检测方法 样品基质 目标物 定量限
(mg/kg)对比数据来源 UPLC-MS/MS 西式火腿、
肉丸等原肌球蛋白
特征肽段2.00 本方法 LC-HRMS/MSa 鱼棒、蟹爪等 原肌球蛋白
特征肽段3.5 Stella等[29] HPLC-MSb 鸡肉肠、曲奇等 原肌球蛋白
特征肽段1.6 Wang等[30] qPCR 虾馅模型 16S rRNA 1 Fernandes等[33] ELISA 鱼糜、鳕鱼皮等 原肌球蛋白 1 Werner等[34] 电化学免疫
传感器细胞 原肌球蛋白
Pen a 10.15 μg/mL Jiang等[35] 注:a液相色谱-高分辨率串联质谱(liquid chromatography high-resolution tandem mass spectrometry,LC-HRMS/MS);b高效液相色谱-质谱( high performance liquid chromatography mass spectrometry,HPLC-MS)。 表 3 加标回收率和精密度(n=6)
Table 3 Recoveries and relative standard deviations (n=6)
添加浓度(mg/kg) 测定浓度(mg/kg) 回收率(%) 精密度(%) 2.00 1.67 83.2 6.44 5.25 4.54 86.5 7.92 20.00 20.90 104.5 2.63 注:mg/kg指过敏原蛋白质量/称样量。 表 4 样品测定结果(n=3)
Table 4 Determination of allergens in samples (n=3)
类别 样品编号 测定含量(mg/kg) 标签 香肠 1 46.7±4.2 √ 2 2.3±0.1 √ 3 2.7±0.2 √ 4 ND √ 西式火腿 5 ND √ 6 NQ — 7 ND √ 8 ND — 9 ND √ 10 ND — 11 ND — 12 ND √ 13 ND √ 14 ND — 15 ND √ 16 ND √ 17 ND — 肉丸 18 448.1±31.4 √ 19 ND — 20 ND — 注:—表示未标出;ND表示小于方法检出限;NQ表示小于方法定量限;编号1~4为香肠,5~17为西式火腿,18~20为肉丸。 -
[1] KABASSER S, HAFNER C, CHINTHRAJAH S, et al. Identification of Pru du 6 as a potential marker allergen for almond allergy[J]. Allergy,2021,76(5):1463−1472. doi: 10.1111/all.14613
[2] XU J Y, YE Y L, JI J, et al. Advances on the rapid and multiplex detection methods of food allergens[J]. Critical Reviews in Food Science and Nutrition,2022,62(25):6887−6907.
[3] DAVIS C M, GUPTA R S, AKTAS O N, et al. Clinical management of seafood allergy[J]. The Journal of Allergy and Clinical Immunology: In Practice,2020,8(1):37−44. doi: 10.1016/j.jaip.2019.10.019
[4] MONERET-VAUTRIN D A, MORISSET M, FLABBEE J, et al. Epidemiology of life-threatening and lethal anaphylaxis: A review[J]. Allergy,2005,60(4):443−451. doi: 10.1111/j.1398-9995.2005.00785.x
[5] MATRICARDI P M, KLEINE-TEBBE J, HOFFMANN H J, et al. EAACI molecular allergology user's guide[J]. Pediatric Allergy and Immunology,2016,27(S23):1−250.
[6] 中华人民共和国卫生部. GB 7718-2011食品安全国家标准 预包装食品标签通则[S]. 北京: 中国标准出版社, 2011. Ministry of Health of the People's Republic of China. GB 7718-2011 National food safety standard. General rules for labeling of prepackaged foods[S]. Beijing: China Standard Press, 2011.
[7] SENA-TORRALBA A, PALLÁS-TAMARIT Y, MORAIS S, et al. Recent advances and challenges in food-borne allergen detection[J]. TrAC Trends in Analytical Chemistry,2020,132:116050. doi: 10.1016/j.trac.2020.116050
[8] HOLZHAUSER T, JOHNSON P, HINDLEY J P, et al. Are current analytical methods suitable to verify VITAL® 2.0/3.0 allergen reference doses for EU allergens in foods ?[J]. Food and Chemical Toxicology,2020,145(10):111709.
[9] KOEBERL M, CLARKE D, LOPATA A L. Next generation of food allergen quantification using mass spectrometric systems[J]. Journal of Proteome Research,2014,13(8):3499−3509. doi: 10.1021/pr500247r
[10] HOLZHAUSER T. Protein or no protein? Opportunities for DNA-based detection of allergenic foods[J]. Journal of Agricultural and Food Chemistry,2018,66(38):9889−9894. doi: 10.1021/acs.jafc.8b03657
[11] LI J, WANG H, CHENG J H. DNA, protein and aptamer-based methods for seafood allergens detection: Principles, comparisons and updated applications[J]. Critical Reviews in Food Science and Nutrition,2023,63(2):178−191.
[12] COSTA J, FERNANDES T J R, VILLA C, et al. Advances in food allergen analysis: Innovative analytical tools for safety assessment. In food safety: Innovative analytical tools for safety assessment(Chapter 9)[M]. Massachusetts: Scrivener Publishing LLC, 2017: 306-360.
[13] BIANCO M, CALVANO C D, VENTURA G, et al. Determination of hidden milk allergens in meat-based foodstuffs by liquid chromatography coupled to electrospray ionization and high-resolution tandem mass spectrometry[J]. Food Control,2021,131(1):108443.
[14] LÓPEZ-PEDROUSO M, LORENZO J M, GAGAOUA M, et al. Current trends in proteomic advances for food allergen analysis[J]. Biology,2020,9(9):247. doi: 10.3390/biology9090247
[15] PERNER S P, HEUPEL L, ZIMMERMANN L, et al. Investigation of reduced ELISA recovery of almond and hazelnut traces from roasted nut samples by SDS-PAGE and mass spectrometry[J]. Journal of AOAC International,2019,102(5):1271−1279. doi: 10.5740/jaoacint.19-0055
[16] MONACI L, DE ANGELIS E, MONTEMURRO N, et al. Comprehensive overview and recent advances in proteomics MS based methods for food allergens analysis[J]. TrAC Trends in Analytical Chemistry,2018,106:21−36. doi: 10.1016/j.trac.2018.06.016
[17] PlANQUE M, ARNOULD T, DIEU M, et al. Liquid chromatography coupled to tandem mass spectrometry for detecting ten allergens in complex and incurred foodstuffs[J]. Journal of Chromatography A,2017,1530:138−151. doi: 10.1016/j.chroma.2017.11.039
[18] PLANQUE M, ARNOULD T, DIEU M, et al. Advances in ultra-high performance liquid chromatography coupled to tandem mass spectrometry for sensitive detection of several food allergens in complex and processed foodstuffs[J]. Journal of Chromatography A,2016,1464:115−123. doi: 10.1016/j.chroma.2016.08.033
[19] HUSCHEK G, BÖNICK J, LÖWENSTEIN Y, et al. Quantification of allergenic plant traces in baked products by targeted proteomics using isotope marked peptides[J]. LWT-Food Science & Technology,2016,74:286−293.
[20] GOMAA A, BOYE J. Simultaneous detection of multi-allergens in an incurred food matrix using ELISA, multiplex flow cytometry and liquid chromatography mass spectrometry (LC-MS)[J]. Food Chemistry,2015,175:585−592. doi: 10.1016/j.foodchem.2014.12.017
[21] JI J, ZHU P, PI F, et al. Development of a liquid chromatography-tandem mass spectrometry method for simultaneous detection of the main milk allergens[J]. Food Control,2017,74:79−88. doi: 10.1016/j.foodcont.2016.11.030
[22] 詹丽娜, 陈沁, 古淑青, 等. 超高效液相色谱-四级杆/静电场轨道阱高分辨质谱检测食品中的牛奶过敏原酪蛋白[J]. 色谱,2017,35(4):405−412. [ZHAN L N, CHEN Q, GU S Q, et al. Determination of milk allergen caseins in foods by ultra performance liquid chromatography-quadrupole/electrostatic field orbitrap high resolution mass spectrometry[J]. Chinese Journal of Chromatography,2017,35(4):405−412. doi: 10.3724/SP.J.1123.2016.10034 [23] MATTAROZZI M, MILIOLI M, BIGNARDI C, et al. Investigation of different sample pre-treatment routes for liquid chromatography-tandem mass spectrometry detection of caseins and ovalbumin in fortified red wine[J]. Food Control,2014,38:82−87. doi: 10.1016/j.foodcont.2013.10.015
[24] THIMO R, TAKI A C, OHNSTON E B, et al. Seafood allergy: A comprehensive review of fish and shellfish allergens[J]. Molecular Immunology,2018,100:28−57. doi: 10.1016/j.molimm.2018.04.008
[25] KHORA S S. Seafood-associated shellfish allergy: A comprehensive review[J]. Immunological Investigations,2016,45(6):504−530. doi: 10.1080/08820139.2016.1180301
[26] ZHAO J, LI Y, XU L, et al. Insights into IgG/IgE binding ability, in vitro digestibility and structural changes of shrimp (Litopenaeus vannamei) soluble extracts with thermal processing[J]. Food Chemistry,2022:132177.
[27] KAMIIE J, OHTSUKI S, IWASE R, et al. Quantitative atlas of membrane transporter proteins: Development and application of a highly sensitive simultaneous LC/MS/MS method combined with novel in-silico peptide selection criteria[J]. Pharmaceutical Research,2008,25(6):1469−1483. doi: 10.1007/s11095-008-9532-4
[28] JOHNSON P, BAUMGARTNER S, ALDICK T, et al. Current perspectives and recommendations for the development of mass spectrometry methods for the determination of allergens in foods[J]. Journal of AOAC International,2011,94(4):1026−1033. doi: 10.1093/jaoac/94.4.1026
[29] STELLA R, SETTE G, MORESSA A, et al. LC-HRMS/MS for the simultaneous determination of four allergens in fish and swine food products[J]. Food Chemistry,2020,331:127276. doi: 10.1016/j.foodchem.2020.127276
[30] WANG J H, GE M, SUN L, et al. Quantification of crustacean tropomyosin in foods using high-performance liquid chromatography-tandem mass spectrometry method[J]. Journal of the Science of Food and Agriculture,2021,101(12):5278−5285. doi: 10.1002/jsfa.11177
[31] BRUN V, MASSELON C, GARIN J, et al. Isotope dilution strategies for absolute quantitative proteomics[J]. Journal of Proteomics,2009,72(5):740−749. doi: 10.1016/j.jprot.2009.03.007
[32] BANTSCHEFF M, SCHIRLE M, SWEETMAN G, et al. Quantitative mass spectrometry in proteomics: A critical review[J]. Analytical and Bioanalytical Chemistry,2007,389(4):1017−1031. doi: 10.1007/s00216-007-1486-6
[33] FERNANDES T J R, COSTA J, OLIVEIRA M B P P, et al. A new real-time PCR quantitative approach for the detection of shrimp crustaceans as potential allergens[J]. Journal of Food Composition and Analysis,2018,72:7−14. doi: 10.1016/j.jfca.2018.05.012
[34] WERNER M T, FÆSTE C K, EGAAS E. Quantitative sandwich ELISA for the determination of tropomyosin from crustaceans in foods[J]. Journal of Agricultural & Food Chemistry,2007,55(20):8025−8032.
[35] JIANG D, JI J, AN L, et al. Mast cell-based electrochemical biosensor for quantification of the major shrimp allergen Pen a 1 (tropomyosin)[J]. Biosensors & Bioelectronics,2013,50:150−156.
[36] 中国合格评定国家认可委员会. CNAS-TRL-011: 2020 轻工产品化学分析方法确认和验证指南[S]. 北京: 中国计量出版社, 2020. China National Accreditation Service for Conformity Assessment. CNAS-TRL-011: 2020 Guidelines for the validation and validation of chemical analysis methods for light industrial products[S]. Beijing: China Metrology Press, 2020.
-
期刊类型引用(4)
1. 梁瑞强,刘彤彤,罗娇依,曹进,孙姗姗. UPLC-MS法测定肉制品中虾过敏原含量的不确定度评定. 生物加工过程. 2024(01): 89-98 .  百度学术
百度学术
2. 宁亚维,周泓鑫,杨正,马俊美,刘茁,张岩,李强. UPLC-MS/MS法检测3种食品中松仁过敏原. 食品科学. 2024(01): 247-253 .  百度学术
百度学术
3. 陈梦琪,彭淼曦,刘婧文,黄成栋,吴祖庆,凌莉,袁慕云,陈文锐,胡松青. 靶向蛋白质组学技术在食品安全检测的应用. 食品科学. 2024(23): 23297-23310 .  百度学术
百度学术
4. 黄浩伦,徐道坤,孙小杰,胡文彦,刘真,王玉梅,孙嘉笛,孙秀兰. 超高效液相色谱-串联质谱法检测婴幼儿低致敏配方乳粉中过敏原蛋白. 现代食品. 2023(09): 130-136+140 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:


 下载:
下载:



