Optimization of Ultrasound-Assisted Enzymatic Method Extraction of Antioxidant from Malus hupehensis Leaves by Response Surface Methodology
-
摘要: 为研究湖北海棠叶中抗氧化物最佳提取工艺,以羟基自由基清除率为参考指标,采用响应面优化超声波辅助酶法对湖北海棠叶抗氧化物提取条件进行研究。结果表明:超声波辅助酶法最佳工艺为超声功率100 W,液料比17:1 mL∙g−1,超声时间32 min,加纤维素酶量2.6%,酶解时间49 min。此条件下羟基自由基清除率为89.9%±0.06%,提取物中黄酮含量14.01%,多酚含量8.93%,多糖含量7.65%,相比煎煮法、回流法、酶法和超声波法,提取物活性物质含量提高了10%以上,DPPH清除率和羟基自由基清除均提高20%以上。利用超声波辅助酶法提取湖北海棠叶抗氧化物效果较好。Abstract: In order to study the optimal extraction process of antioxidants from Malus hupehensis leaves, hydroxyl radical scavenging rate was taken as a reference index, and the extraction conditions of antioxidants from Malus hupehensis leaves was studied by response surface optimization ultrasonic-assisted enzymatic method. The results showed that the best process of ultrasonic-assisted enzyme method was 100 W ultrasonic power, liquid to material ratio 17:1 mL∙g−1, ultrasonic time 32 min, cellulase addition 2.6%, enzymatic digestion time 49 min. The hydroxyl radical scavenging rate was 89.9%±0.06% under this condition, the flavonoid content in the extract was 14.01%, the polyphenol content was 8.93%, and the polysaccharide content was 7.65%, compared with the decoction method, reflux method, enzymatic method and ultrasonic method, the active substance content was increased by more than 10%, the DPPH scavenging rate and hydroxyl radical scavenging rate were increased by more than 20%. It's better to extraction of antioxidants from Malus hupehensis leaves by ultrasonic aided enzymatic method.
-
湖北海棠[Malus hupehensis (Pamp.) Rehd.]为蔷薇科苹果属落叶乔木药食同源植物,生长于海拔50~2900 m的山坡或山谷丛林中,因原产地在湖北而得名。研究表明武陵山区湖北海棠富含黄酮、多酚类等多种物质[1],能有效清除羟基自由基,具有抗氧化[2],降血糖、降血脂代谢、抗菌消炎、调节脂质等多种药理作用[3],其药用价值现已被载入《湖北省中药材质量标准》,2014年卫生部第20号公告批准“湖北海棠(茶海棠)叶”为新食品原料[4]。作为湖北特色植物资源,湖北海棠叶用来冲泡清凉茶解暑降温历史悠久,且药用价值已被证实,产品加工利用及应用前景非常广阔。
国内外对抗氧化物提取研究较多,主要采用煎煮[5]、溶剂回流法[6]、酶法[7]和超声波法[8]等提取黄酮、多酚和多糖等活性成分,通过Fenton反应产生的羟基自由基(·OH)的清除作用考察体外抗氧化活性效果。王耀峰等[9]通过采用乙醇浸提法得到湖北海棠叶总黄酮,含量达4.57%;乔孟等[10]利用响应面法优化超声波提取总黄酮,含量达12.76%。相比于传统水提和溶剂提取法,超声波在液体中可以产生机械效应、空化作用及其热效应等,破坏细胞壁,进而暴露更多的酶促位点[11],是目前从植物中提取活性成分的重要方法;与酶法结合进行提取,兼具了两者的优点,不但缩短了提取时间且大大提高了活性成分。目前超声波辅助酶法在桑叶总黄酮[12]、葡萄皮渣多酚[13]和黄精多糖[14]等提取方面已有报道。动物实验[15]表明黄酮等类化合物越多其抗氧化活性越好,且采用超声波辅助酶法提取湖北海棠叶抗氧化物及成分研究未见报道。
本试验以羟基自由基清除率为指标,采用响应面法优化湖北海棠叶抗氧化物提取工艺,分析对比不同提取工艺下黄酮、多酚和多糖活性成分含量及抗氧化性,为更好的开发利用湖北海棠叶的药用食用价值提供参考。
1. 材料与方法
1.1 材料与仪器
湖北海棠叶(蔷薇科苹果属) 产于湖北武陵山区;没食子酸 质量分数大于98%,批号27975,上海一基实业有限公司;葡萄糖、苯酚、浓硫酸等 均为分析纯,天津市凯通化学试剂有限公司。
KQ-100E超声波清洗机 昆山市超声仪器有限公司;HH-2恒温水浴锅 金坛市宏华仪器厂;GL-21M高速冷冻离心机 湘麓离心机仪器有限公司;722E可见分光光度计 上海光谱仪器有限公司。
1.2 实验方法
1.2.1 湖北海棠叶的预处理
将湖北海棠叶置于60 ℃烘箱中,烘至恒重之后粉碎(过100目筛),密封于干燥容器中备用。
1.2.2 超声波辅助酶法提取海棠叶抗氧化物
准确称取样品1.00 g,置于50 mL三角瓶中,加入一定体积分数为70%乙醇溶液,在功率为100 W的超声波清洗器中提取数分钟,适量加入纤维素酶酶解一段时间,在4200 r/min离心20 min,取上清液备用。
1.2.3 超声波-酶法提取工艺的单因素实验
1.2.3.1 液料比对提取物羟基自由基清除率的影响
取1.00 g湖北海棠叶样品,研究以70%乙醇为溶剂,超声温度30 ℃,超声功率100 W,超声时间30 min,加纤维素酶量2.5%,酶解时间50 min,液料比10:1、20:1、30:1、40:1、50:1 mL·g−1条件下,液料比对提取物羟基自由基清除率的影响。
1.2.3.2 超声时间对提取物羟基自由基清除率的影响
取1.00 g湖北海棠叶样品,研究以70%乙醇为溶剂,超声温度30 ℃,超声功率100 W,液料比20:1 mL·g−1,加纤维素酶量2.5%,酶解时间50 min,超声时间10、20、30、40、50 min条件下,超声时间对提取物羟基自由基清除率的影响。
1.2.3.3 加酶量对提取物羟基自由基清除率的影响
取1.00 g湖北海棠叶样品,研究以70%乙醇为溶剂,超声温度30 ℃,超声功率100 W,液料比20:1 mL·g−1,超声时间30 min,酶解时间50 min,加纤维素酶量1.0%、1.5%、2.0%、2.5%、3.0%条件下,加酶量对提取物羟基自由基清除率的影响。
1.2.3.4 酶解时间对提取物羟基自由基清除率的影响
取1.00 g湖北海棠叶样品,研究以70%乙醇为溶剂,超声温度30 ℃,超声功率100 W,液料比20:1 mL·g−1,超声时间30 min,加纤维素酶量2.5%,酶解时间10、30、50、70、90 min条件下,酶解时间对提取物羟基自由基清除率的影响。
1.2.4 响应面试验设计
在单因素基础上,以羟基自由基清除率为响应值,用响应面分析法分析各因素的交互作用,以确定最佳工艺参数。因素水平设计见表1。
表 1 响应面设计因素水平表设计Table 1. Response surface design factor level table design水平 因素 A液料比(mL·g−1) B超声时间(min) C加纤维素酶量(%) D酶解时间(min) −1 10:1 20 2.0 30 0 20:1 30 2.5 50 +1 30:1 40 3.0 70 1.2.5 抗氧化活性及活性成分含量的测定
1.2.5.1 羟基自由基清除率的测定
采用水杨酸法[16],准确吸取提取液1.00 mL,注入比色管中,依次加入硫酸亚铁,乙醇-水杨酸,最后加适量过氧化氢摇匀,水浴,在510 nm处测吸光度,计算羟基自由基清除率。
式中:A0为空白对照的吸光度;A1为加入样品的吸光度;A2为不加显色剂H2O2的吸光度。
1.2.5.2 DPPH清除率的测定
利用DPPH自由基与抗氧化剂反应褪色[17]原理,吸取提取液1.00 mL,注入比色管中,加入适量DPPH溶液,在517 nm处测吸光度,室温避光保存一段时间后在测一次吸光度,计算DPPH清除率。
式中:A0为DPPH液+空白溶液混合液的吸光度;A1为样品+DPPH混合液的吸光度;A2为样品+空白溶液混合液的吸光度。
1.2.5.3 黄酮含量的测定
采用亚硝酸钠-硝酸铝-氢氧化钠比色法[18],准确吸取提取液1.00 mL,在碱性环境下,亚硝酸钠-硝酸铝为显色剂,在510 nm波长处测定吸光度,计算样品中黄酮的含量。
1.2.5.4 多酚含量的测定
采用酒石酸亚铁法[19],准确吸取提取液1.00 mL,注入比色管中,加蒸馏水和酒石酸亚铁溶液,充分混匀后,再加入磷酸盐缓冲液,在540 nm波长处,测定吸光度,计算样品中多酚的含量。
1.2.5.5 多糖含量的测定
采用蒽酮-硫酸法[20],准确吸取提取液1.00 mL,置于具塞试管中,加入苯酚和硫酸,显色,在490 nm处测定吸光度,计算样品中多糖的含量。
1.2.6 不同提取工艺提取液的制备
1.2.6.1 煎煮法
准确称取称样品1.00 g,采用煎煮法[5]提取,在加入20 mL蒸馏水置于50 mL圆底烧瓶中,在60 ℃热水浴中浸提90 min,然后过滤得滤液,再4000 r/min离心15 min,取上清液备用。
1.2.6.2 回流法
准确称取样品1.00 g,采用回流法[6]提取,置于50 mL圆底烧瓶中,加70%乙醇溶液20 mL,在提取温度为70 ℃下,提取100 min,再4000 r/min离心15 min,取上清液备用。
1.2.6.3 酶法
准确称取样品1.00 g,采用酶法[7]提取,置于50 mL三角瓶中,加蒸馏水20 mL,在50 ℃,pH为5.0条件下加1.5%纤维素酶,酶解50 min,再4000 r/min离心15 min,取上清备用。
1.2.6.4 超声波法
准确称取样品1.00 g,采用超声波法[8]提取,置于50 mL三角瓶中,加入20 mL体积分数为70%的乙醇溶液,在功率为100 W的超声波清洗器中提取30 min,再4200 r/min离心20 min,取上清液备用。
1.2.6.5 超声波辅助酶法
准确称取样品1.00 g,采用超声波辅助酶法[21]提取,置于50 mL三角瓶中,加入17 mL体积分数为70%乙醇溶液,功率为100 W的超声波清洗器中提取32 min,加纤维素酶量2.6%,酶解时间49 min,温度50 ℃,在4200 r/min离心20 min,取上清液备用。
1.3 数据处理
单因素实验结果重复三次,结果取平均值和标准偏差,响应面采用Design Expert程序设计软件进行处理[22]。
2. 结果与分析
2.1 标准曲线的制备
采用亚硝酸钠-硝酸铝-氢氧化钠比色法测得黄酮标准曲线,标准曲线线性回归方程为y=0.0172x+0.0025(R2=0.9996);采用酒石酸亚铁法测得多酚标准曲线,标准曲线线性回归方程为y=0.0208x−0.0036(R2=0.9993);采用蒽酮-硫酸法测得多糖标准曲线,标准曲线线性回归方程为y=0.0419x−0.0134(R2=0.9992)。以上标准曲线R2<0.999,符合要求。
2.2 超声波辅助酶法提取抗氧化物质单因素实验结果
2.2.1 液料比对提取物羟基自由基清除率的影响
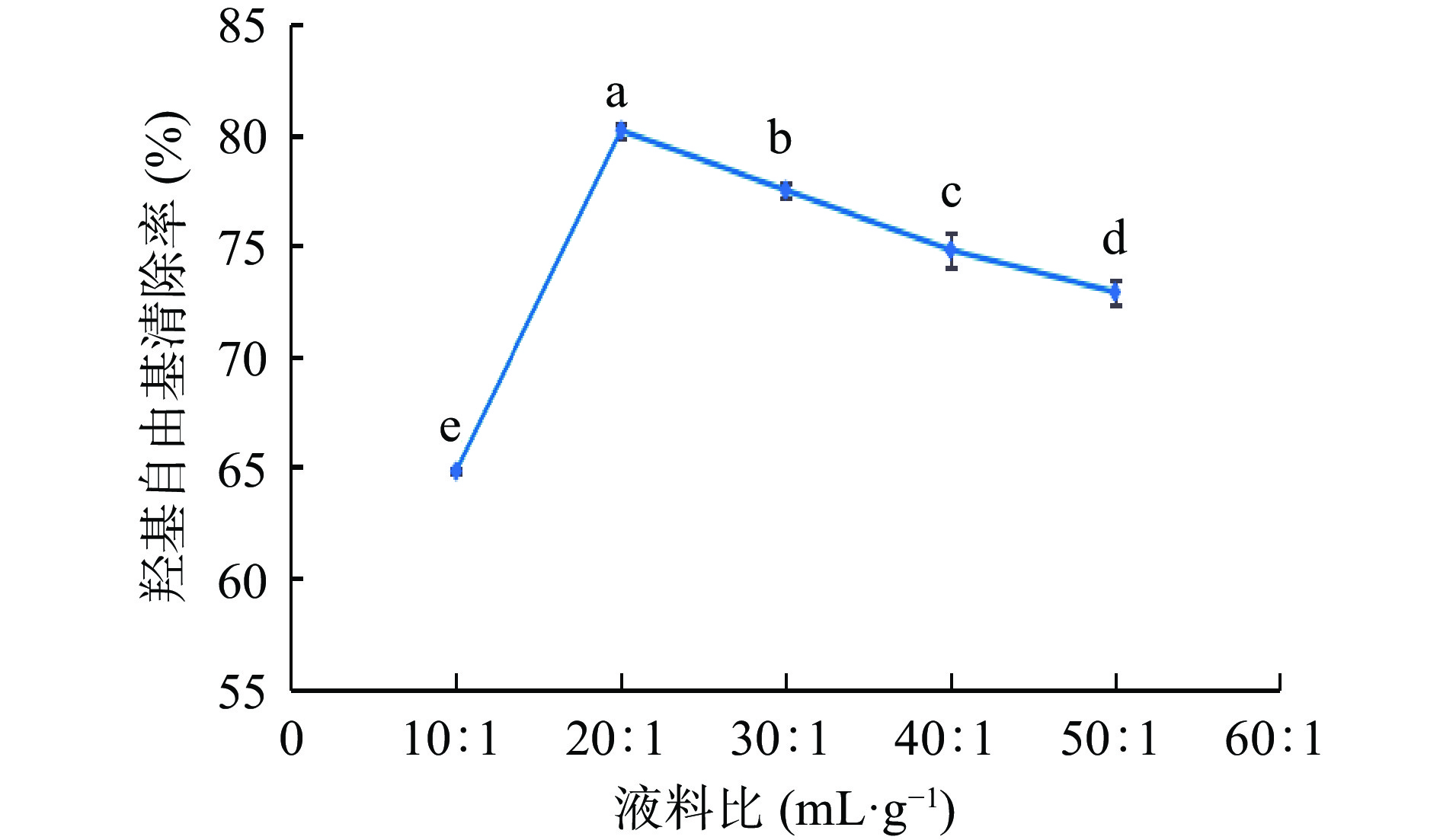
由图1可知,在超声时间、加纤维素酶量和酶解时间保持不变,仅改变液料比时,羟基自由基清除率在60%~85%之间,当液料比为10:1~20:1 mL·g−1时,湖北海棠叶中抗氧化物的羟基自由基清除率逐渐增强,在液料比为20:1 mL·g−1时达到最大,液料比对羟基自由基清除率影响显著(P<0.05),且高于其他水平。继续增加液料比,羟基自由基清除率逐渐降低。因为随着液料比继续升高湖北海棠叶中抗氧化物即使有少量溶出,但被溶剂大量稀释[23],羟基自由基清除率呈现缓慢下降。因此选择最佳的液料比为20:1 mL·g−1左右。
2.2.2 超声时间对提取物羟基自由基清除率的影响
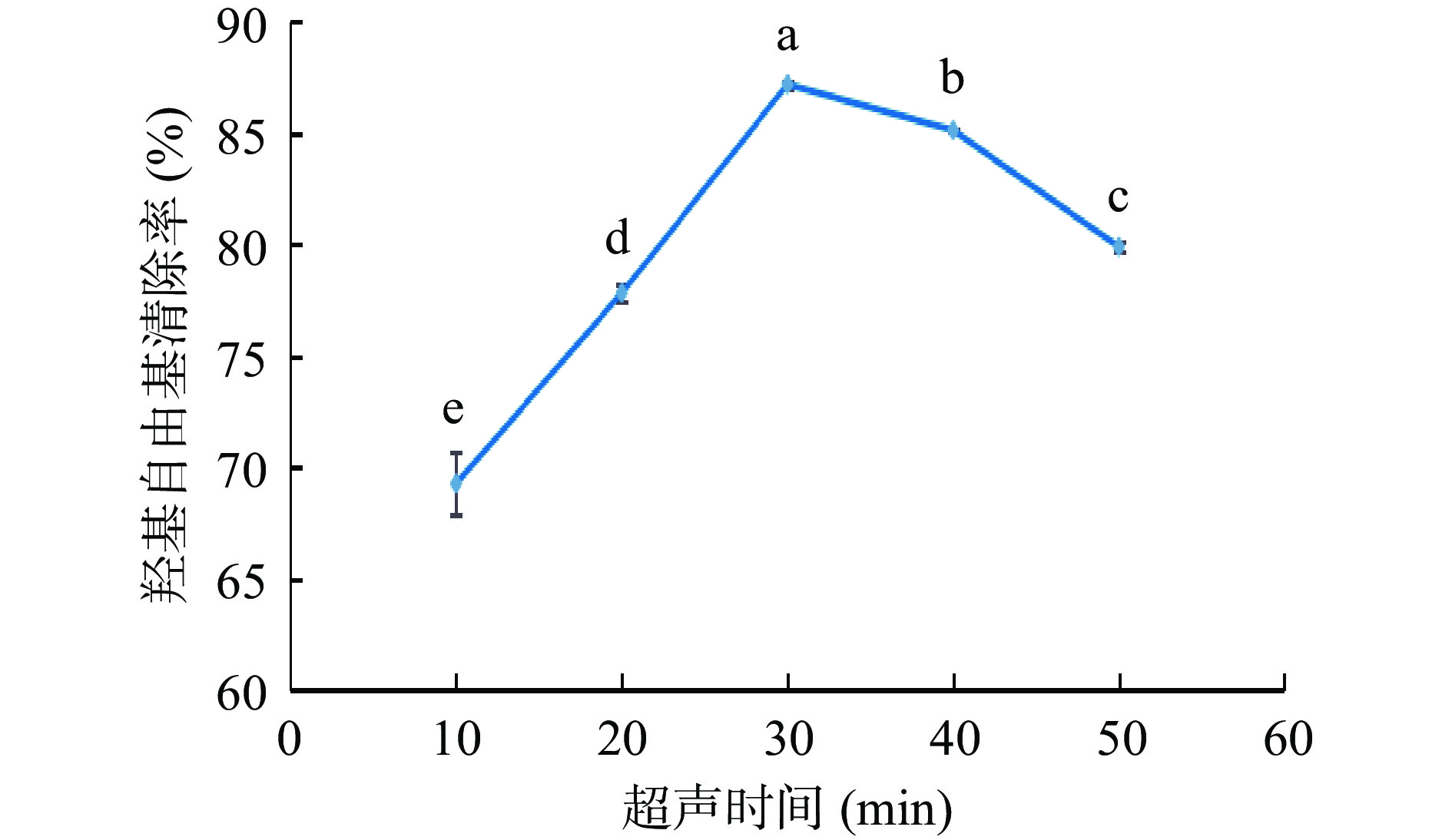
由图2可知,在液料比、加纤维素酶量和酶解时间保持不变,仅改变超声时间时,羟基自由基清除率在65%~90%之间,当超声时间为10~30 min时,羟基自由基清除率逐渐增加,在30 min之后呈下降趋势,在30min后达到最大,超声时间对羟基自由基清除率影响显著(P<0.05),且高于其他水平。由于超声波具有强力的机械切割作用,长时间的作用使得抗氧化物结构键能被破坏,从而使清除率降低[24]。因此最佳超声时间为30 min左右。
2.2.3 加酶量对提取物羟基自由基清除率的影响
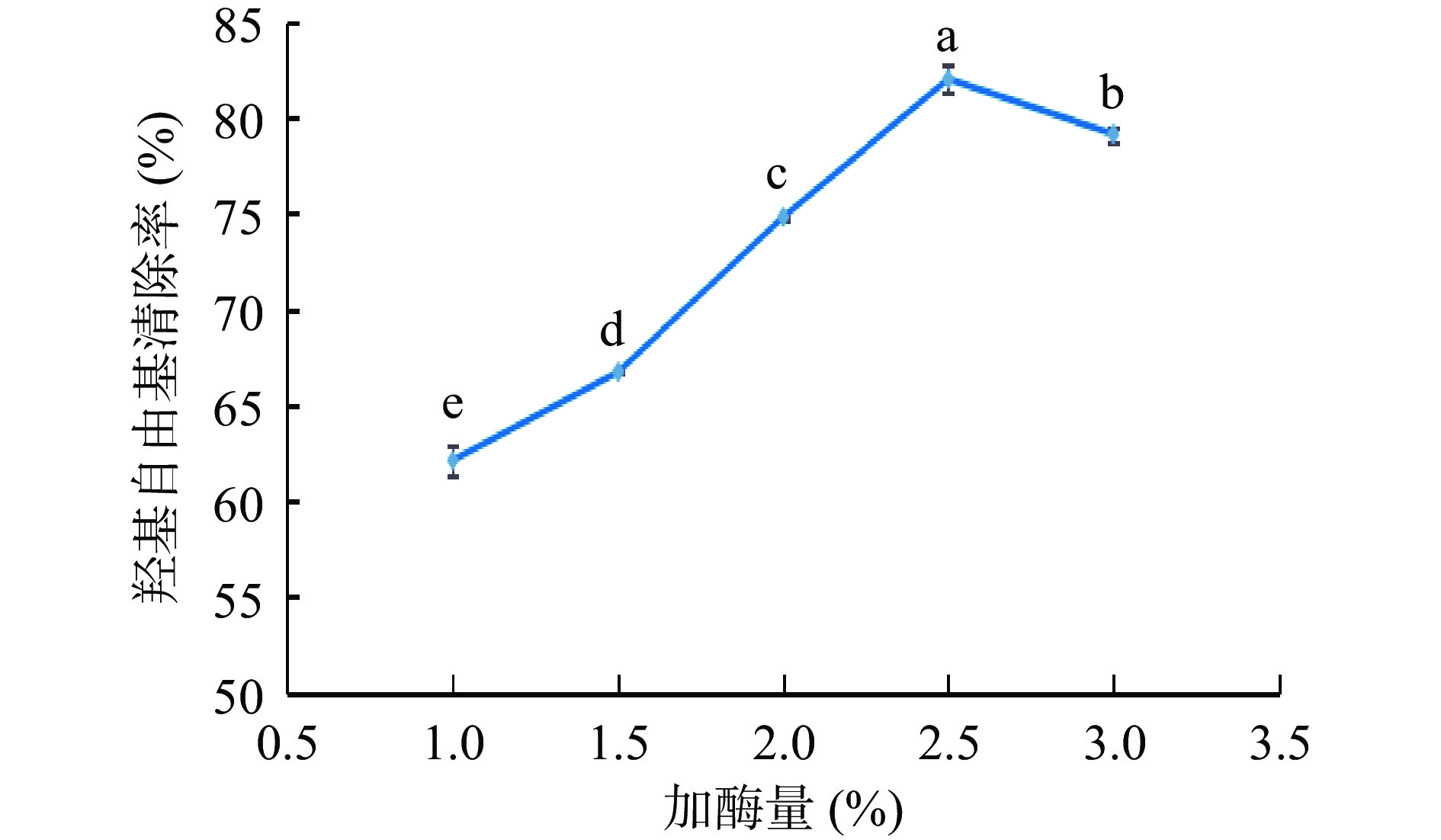
由图3可知,在液料比、超声时间和酶解时间保持不变,仅改变纤维素酶添加量时,羟基自由基清除率在60%~85%之间,当纤维素酶的用量为1.0%~2.5%时,抗氧化物羟基自由基的清除能力逐渐增强,在2.5%时达到最高,加酶量对羟基自由基清除率影响显著(P<0.05),且高于其他水平。加酶量超过2.5%时,羟基自由基清除率不再增强。因为随着酶量的增加,细胞壁与纤维素酶接触增多,抗氧化物溶出加快,羟基自由基清除率增加。当加酶量超过2.5%后,底物与酶全部结合位点达到饱和状态,继续添加酶清除率不会提高反而造成浪费[16]。因此选择最佳加酶量为2.5%左右。
2.2.4 酶解时间对提取物羟基自由基清除率的影响
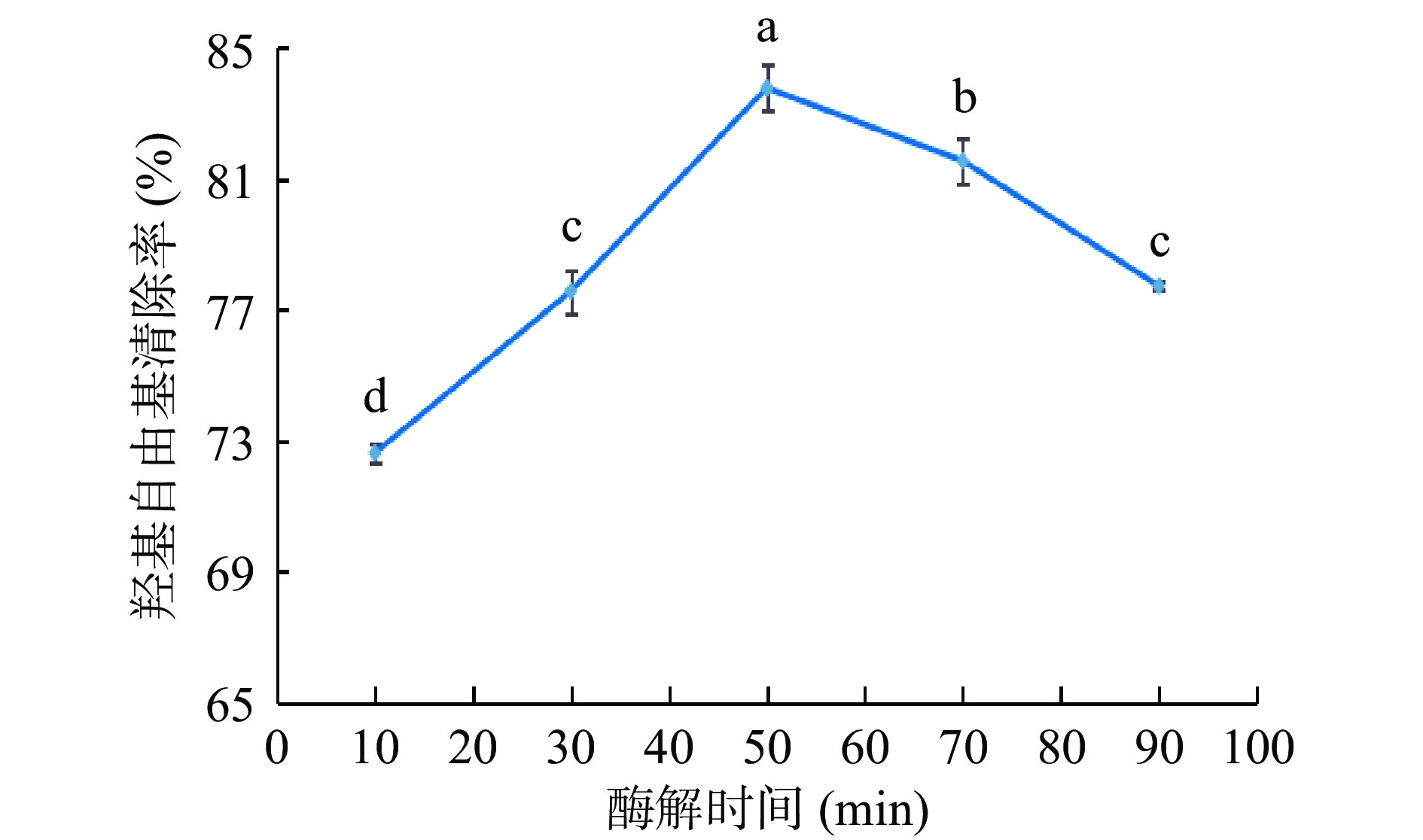
由图4可知,在液料比、超声时间和纤维素酶添加量保持不变,仅改变酶解时间时,羟基自由基清除率在70%~85%之间,在酶解时间为10~50 min时,湖北海棠叶中抗氧化物羟基自由基的清除率逐渐增强,在酶解50 min后,羟基自由基清除率呈下降趋势,在50 min达到最大值,酶解时间对羟基自由基清除率影响显著(P<0.05),且高于其他水平。因为酶解时间较短时,纤维素酶不能充分水解纤维素,从而使抗氧化性物质溶出较少。当酶解时间延长到50 min,纤维素酶与湖北海棠叶充分接触,抗氧化物溶出最多,羟基自由基清除率达到最大,随着酶解时间的延长,一部分抗氧化性物质可能被过度水解,生成不具有抗氧化活性的片段[25],导致自由基清除率降低。即最佳酶解时间为50 min左右。
2.3 响应面优化结果分析
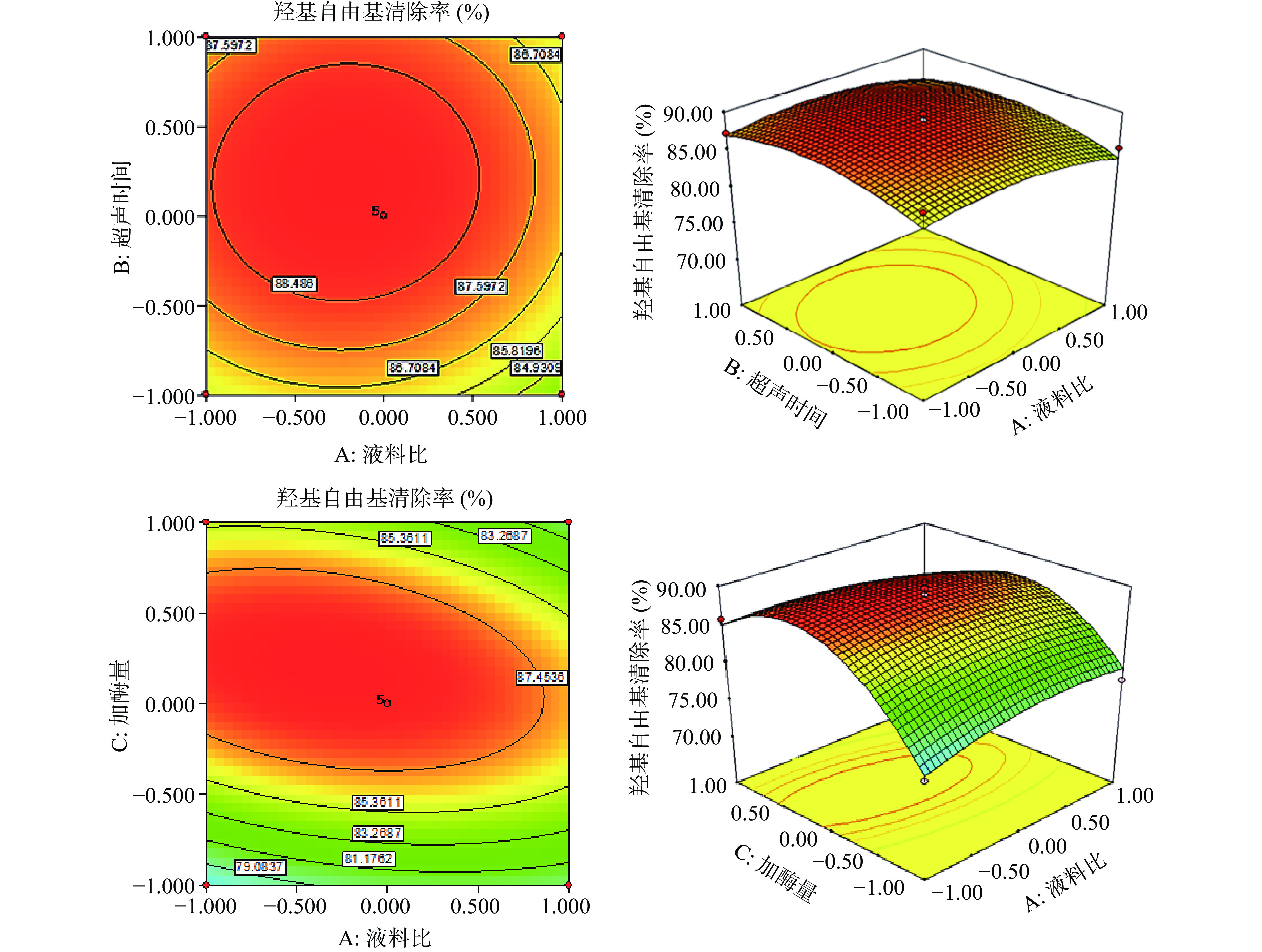
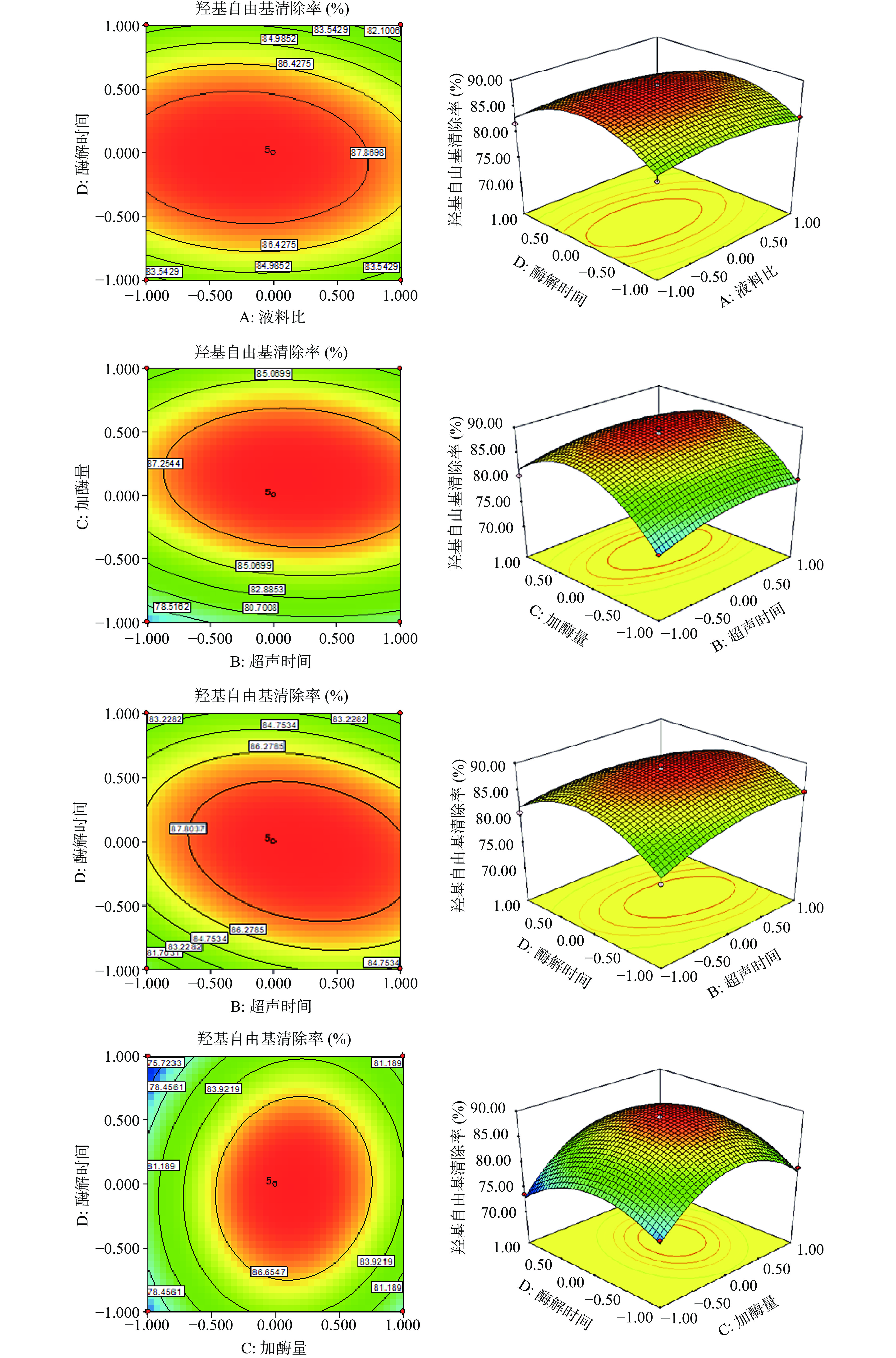
采用Design Expert软件中的Box-Behnken程序进行分析,共设计29个实验点。结果见表2。根据表2中的数据得到回归方程为:Y=89.23−0.70A+0.78B+2.13C−0.51D+0.1AB−1.92AC−0.45AD−0.65BC−1.42BD+0.96CD−1.58A2−2.03B2−7.31C2−5.33D,对模型进行方差分析,结果见表3。
表 2 响应面实验结果Table 2. Data of response surface experiment实验号 A液料比 B超声时间 C加酶量 D酶解时间 羟基自由基
清除率(%)1 0 −1 0 −1 79.09 2 0 0 −1 −1 76.55 3 0 1 1 0 81.27 4 1 −1 0 0 85.32 5 0 −1 −1 0 76.55 6 0 0 0 0 88.85 7 0 1 0 −1 84.79 8 1 0 0 −1 83.09 9 −1 0 −1 0 76.35 10 −1 1 0 0 87.21 11 0 −1 0 1 80.93 12 1 0 0 1 81.07 13 1 0 −1 0 77.89 14 0 0 0 0 89.78 15 0 0 −1 1 73.69 16 −1 −1 0 0 87.59 17 −1 0 0 −1 82.01 18 0 0 0 0 87.98 19 −1 0 0 1 81.78 20 −1 0 1 0 85.79 21 0 0 1 1 80.03 22 0 0 1 −1 79.06 23 0 0 0 0 89.84 24 0 −1 1 0 80.59 25 1 0 1 0 79.65 26 0 1 0 1 80.96 27 0 0 0 0 89.69 28 0 1 −1 0 79.84 29 1 1 0 0 85.34 表 3 回归模型及方差分析Table 3. Analysis of variance of regression equation来源 平方和 自由度 均方 F值 P值 显著 模型 552.33 14 39.45 24.9 <0.0001 ** A-液料比 5.84 1 5.84 3.69 0.0755 B-超声时间 7.27 1 7.27 4.59 0.0502 C-加酶量 54.27 1 54.27 34.27 <0.0001 ** D-酶解时间 3.13 1 3.13 1.98 0.1815 AB 0.04 1 0.04 0.025 0.8760 AC 14.75 1 14.75 9.31 0.0086 ** AD 0.80 1 0.80 0.51 0.4487 BC 1.70 1 1.70 1.08 0.3173 BD 8.04 1 8.04 5.07 0.0408 CD 3.67 1 3.67 2.32 0.1504 A2 16.18 1 16.18 10.22 0.0065 ** B2 26.75 1 26.75 16.89 0.0011 ** C2 346.44 1 346.44 218.73 <0.0001 ** D2 184.58 1 184.58 116.54 <0.0001 ** 残差项 22.17 14 1.58 − − 失拟项 19.58 10 1.96 3.02 0.1491 注:**表示差异极显著(P<0.01);*表示差异显著(P<0.05)。 由表3可以看出,模型极显著(P<0.01),失拟项(P=0.1491>0.05)不显著,说明模型是合理的,模型决定系数R2为0.9614,说明该模型能较好的反映湖北海棠叶抗氧化物羟基自由基的清除率与液料比、超声时间、加酶量和酶解时间的关系。其中加酶量(C)、液料比的二次项(A2)、超声时间的二次项(B2)、加酶量的二次项(C2)、酶解时间的二次项(D2)、液料比与加酶量的交互项(AC)对应的响应值影响极显著(P<0.01);超声时间和酶解时间的交互项(BD)对应响应值影响显著(P<0.05)。各影响因素对响应值的影响性排序为加酶量(C)>超声时间(B)>液料比(A)>酶解时间(D)。
图5分别显示了6组以羟基自由基清除率为响应值的趋势图。等高线图可直观反映出各因素交互作用对羟基自由基清除率的影响,等高线越接近于椭圆,该因素对羟基自由基清除率影响越大,其中AC交互坡度最大,等高线趋于椭圆,BD次之,CD、BC、AD、AB均较圆,与回归方差分析结果相符合,即交互作用AC>BD>CD>BC>AD>AB。
2.4 最佳工艺条件
利用Design Expert软件对工艺条件进行优化,通过软件分析得到湖北海棠叶抗氧化物羟基自由基清除率最佳提取条件为液料比16.82:1 mL·g−1,超声时间31.71 min,加酶量为2.59%,酶解时间为49.18 min,预测羟基自由基清除率为89.60%。
2.5 响应面验证分析
考虑到试验的可操作性,利用最佳工艺条件做三次平行实验,液料比为17:1 mL·g−1,超声时间为32 min,加酶量为2.6%,酶解时间为49 min。为了证实预测值的准确性,在最优条件下进行验证实验,得到湖北海棠叶抗氧化物羟基自由基清除能力实际测量值为89.9%±0.06%,与预测值89.6%非常接近。试验结果与戢得蓉等[26]的雪莲果叶超声波辅助酶法提取总黄酮率6.317%质量浓度为0.6 mg·mL−1时,DPPH自由基清除率71.09%较接近;与柴军红等[27]的五叶地锦果实多糖、花色苷浓度在0.80 mg·mL−1时羟基自由基的清除率75.87%±1.61%、68.60%±1.52%结果略高。
2.6 不同提取工艺下活性成分含量及抗氧化性比较
不同提取工艺下活性成分及抗氧化性见表4。从表4中提取的黄酮和多酚含量看出超声波法和超声波辅助酶法与传统提取法相比,抗氧化物活性成分含量提高了10%以上,而超声波法和超声波辅助酶法相差不大;从提取多糖含量来看超声波法和酶法提取的含量分别比传统煎煮法、回流法提高了5%左右,超声波辅助酶法又比单一的超声波法和酶法提取的多糖含量提高了5%左右,因为超声波的机械切割作用能够破坏细胞壁,而适当添加纤维素酶也能帮助抗氧化性活性成分溶出,使其含量增高,但是酶量过多时会破坏糖苷键,不利于多糖的提取[28]。
表 4 活性成分及抗氧化性分析结果Table 4. Antioxidant content and clearance rate提取工艺 活性成分及抗氧化性 黄酮含量(%) 多酚含量(%) 多糖含量(%) DPPH
清除率(%)羟基自由基
清除率(%)煎煮法 6.83±0.58 1.27±0.12 1.23±0.02 30.24 37.83 回流法 8.43±0.35 4.71±0.24 2.63±0.03 56.63 67.50 酶法 5.43±0.12 3.44±0.24 6.27±0.03 37.27 41.44 超声波法 17.01±0.87 15.38±1.2 6.05±0.15 63.00 78.81 超声波辅助酶法 18.81±0.12 16.9±0.11 11.51±0.02 70.16 86.97 VC − − − 75.20 90.27 从DPPH自由基清除率和羟基自由基清除率的比较得出超声波法比煎煮法、回流法和酶法提高了30%左右,而超声波辅助酶法又比超声波法提高了7%左右,能够说明超声波辅助酶法在活性物质提取上效果显著。
综上所述,传统的煎煮法、回流法和酶法提取的抗氧化物含量较低,超声波法和超声波辅助酶法能一定程度上提高提取率,通过抗氧化物的清除率与标准VC对比也能得到超声波辅助酶法提取的抗氧化物清除率最高,可见超声波辅助酶法提取效果比传统方法更优,在未来湖北海棠叶的抗氧化物提取上前景广阔。
3. 结论
本试验在单因素实验设计的基础上,运用Box-Behnken响应面优化超声波辅助酶法提取湖北海棠叶抗氧化物的工艺,对湖北海棠叶中抗氧化物的羟基自由基清除率的二次回归模型进行设计分析,结果表明:模型拟合程度高,实验误差小。超声波辅助酶法提取湖北海棠叶抗氧化物羟基自由基清除率的最佳提取工艺条件为:液料比为17:1 mL·g−1,超声时间为32 min,加酶量为2.6%,酶解时间为49 min。在此工艺条件下,提取物活性物质的含量比煎煮法、回流法和酶法提高了12%左右,DPPH自由基清除率和羟基自由基的清除率与煎煮法,回流法和酶法提高了30%左右,与超声波法相比提高了7%左右,说明此工艺是合适的,且此方法设备简单,成本低,耗时少,为一些天然的植物原料的抗氧化提取物提供技术参考,为进一步开发和利用湖北海棠叶资源提供依据。
-
表 1 响应面设计因素水平表设计
Table 1 Response surface design factor level table design
水平 因素 A液料比(mL·g−1) B超声时间(min) C加纤维素酶量(%) D酶解时间(min) −1 10:1 20 2.0 30 0 20:1 30 2.5 50 +1 30:1 40 3.0 70 表 2 响应面实验结果
Table 2 Data of response surface experiment
实验号 A液料比 B超声时间 C加酶量 D酶解时间 羟基自由基
清除率(%)1 0 −1 0 −1 79.09 2 0 0 −1 −1 76.55 3 0 1 1 0 81.27 4 1 −1 0 0 85.32 5 0 −1 −1 0 76.55 6 0 0 0 0 88.85 7 0 1 0 −1 84.79 8 1 0 0 −1 83.09 9 −1 0 −1 0 76.35 10 −1 1 0 0 87.21 11 0 −1 0 1 80.93 12 1 0 0 1 81.07 13 1 0 −1 0 77.89 14 0 0 0 0 89.78 15 0 0 −1 1 73.69 16 −1 −1 0 0 87.59 17 −1 0 0 −1 82.01 18 0 0 0 0 87.98 19 −1 0 0 1 81.78 20 −1 0 1 0 85.79 21 0 0 1 1 80.03 22 0 0 1 −1 79.06 23 0 0 0 0 89.84 24 0 −1 1 0 80.59 25 1 0 1 0 79.65 26 0 1 0 1 80.96 27 0 0 0 0 89.69 28 0 1 −1 0 79.84 29 1 1 0 0 85.34 表 3 回归模型及方差分析
Table 3 Analysis of variance of regression equation
来源 平方和 自由度 均方 F值 P值 显著 模型 552.33 14 39.45 24.9 <0.0001 ** A-液料比 5.84 1 5.84 3.69 0.0755 B-超声时间 7.27 1 7.27 4.59 0.0502 C-加酶量 54.27 1 54.27 34.27 <0.0001 ** D-酶解时间 3.13 1 3.13 1.98 0.1815 AB 0.04 1 0.04 0.025 0.8760 AC 14.75 1 14.75 9.31 0.0086 ** AD 0.80 1 0.80 0.51 0.4487 BC 1.70 1 1.70 1.08 0.3173 BD 8.04 1 8.04 5.07 0.0408 CD 3.67 1 3.67 2.32 0.1504 A2 16.18 1 16.18 10.22 0.0065 ** B2 26.75 1 26.75 16.89 0.0011 ** C2 346.44 1 346.44 218.73 <0.0001 ** D2 184.58 1 184.58 116.54 <0.0001 ** 残差项 22.17 14 1.58 − − 失拟项 19.58 10 1.96 3.02 0.1491 注:**表示差异极显著(P<0.01);*表示差异显著(P<0.05)。 表 4 活性成分及抗氧化性分析结果
Table 4 Antioxidant content and clearance rate
提取工艺 活性成分及抗氧化性 黄酮含量(%) 多酚含量(%) 多糖含量(%) DPPH
清除率(%)羟基自由基
清除率(%)煎煮法 6.83±0.58 1.27±0.12 1.23±0.02 30.24 37.83 回流法 8.43±0.35 4.71±0.24 2.63±0.03 56.63 67.50 酶法 5.43±0.12 3.44±0.24 6.27±0.03 37.27 41.44 超声波法 17.01±0.87 15.38±1.2 6.05±0.15 63.00 78.81 超声波辅助酶法 18.81±0.12 16.9±0.11 11.51±0.02 70.16 86.97 VC − − − 75.20 90.27 -
[1] 肖咪, 刘利敏, 李鹏程, 等. 冠突散囊菌发酵湖北海棠茶过程中主要成分及活性研究[J]. 食品科技,2022,47(1):79−86. [XIAO Mi, LIU Limin, LI Pengcheng, et al. Dynamic analysis of the main active components and activity in fermentation process of Malus hupehensis by Eurotium cristatum[J]. Food Science and Technology,2022,47(1):79−86. doi: 10.3969/j.issn.1005-9989.2022.1.spkj202201012 [2] 李鹏程. 双水相体系提取湖北海棠多糖及其生理活性初探[D]. 长春: 吉林农业大学, 2021 LI Pengcheng. Extraction of polysaccharides from Malus hupehensis by aqueous two-phase system and its physiological activity[D]. Changchun: Jilin Agricultural University, 2021.
[3] 周桦, 樊强强, 刘基, 等. 湖北海棠叶总黄酮改善衰老大鼠认知功能障碍的研究[J]. 现代药物与临床,2022,37(5):917−923. [ZHOU Hua, FAN Qiangqiang, LIU Ji, et al. Improvement of cognitive impairment in aging rats by total flavonoids of Malus hupehensis leaves[J]. Drugs & Clinic,2022,37(5):917−923. [4] 湖北省药品监督管理局编. 湖北省中药材质量标准[S]. 北京: 中国科技医药出版社, 2019: 244−245 Edited by Hubei Provincial Drug Administration. Quality standard of Chinese medicinal materials in Hubei Province[S]. Beijing: China Science & Technology Medical Press, 2019: 244−245.
[5] 马文兵, 曹端林, 王建龙. 北柴胡茎叶总黄酮提取工艺研究[J]. 中药材,2010,33(2):288−290. [MA Winbing, CAO Duanlin, WANG Jianlong. Study on extraction technology of total flavonoids from stem and leaf of Bupleurum chinense[J]. Journal of Chinese Medicinal Materials,2010,33(2):288−290. [6] 王幸, 师延琼, 覃鸿恩, 等. 多指标综合评价法优选湖北海棠叶中总黄酮提取工艺[J]. 中国实验方剂学杂志,2012,18(13):46−49. [WANG Xing, SHI Yanqiong, QIN Hongen, et al. Optimization of extraction technology for total flavonoids from Malus hupehensis Leaves by multi-index comprehensive evaluation method[J]. Chinese Journal of Experimental Traditional Medical Formulae,2012,18(13):46−49. doi: 10.3969/j.issn.1005-9903.2012.13.014 [7] 唐功, 王柯然, 朱欣, 等. 不同酶辅助提取毛竹叶中黄酮的工艺研究[J]. 甘肃科技,2021,37(20):65−66, 39. [TANG Gong, WANG Kerran, ZHU Xin, et al. Extraction of flavonoids from Phyllostachys heterocycla leaves by different enzymes[J]. Gansu Science and Technology,2021,37(20):65−66, 39. [8] 陈苏丹, 汪亚祺, 李秀珍, 等. 超声辅助提取款冬总黄酮工艺及抗氧化活性研究[J]. 河南科技大学学报(自然科学版),2020,41(4):82−87,9. [CHEN Sudan, WANG Yaqi, LI Xiuzhen, et al. of Ultrasonic-assisted extraction technology and antioxidant activity of total flavonoids from Tussilago farfara L[J]. Journal of Henan University of Science and Technology (Natural Science),2020,41(4):82−87,9. [9] 王耀峰, 宫智勇, 方敏. 湖北海棠叶黄酮类物质提取工艺的研究[J]. 武汉工业学院学报,2008(2):12−15. [WANG Yaofeng, GONG Zhiyong, FANG Min. Study on extraction tecnology of flovnoid in Malus hupehensis leaves[J]. Journal of Wuhan Polytechnic University,2008(2):12−15. [10] 乔孟, 屈晓清, 丁之恩. 响应面法优化超声波辅助提取湖北海棠叶中总黄酮工艺[J]. 食品科学,2013,34(2):143−147. [QIAO Meng, QU Xiaoqing, DING Zhien. Optimization of ultrasonic-assisted extraction process for total flavonoids from Malus hupehensis leaves by response surface methodology[J]. Food Science,2013,34(2):143−147. [11] 陈雁雁, 赵雅兰, 张淑香, 等. Box-Behnken响应面法优化柴胡多糖的超声提取工艺[J]. 化学工程师,2022,36(2):71−75, 81. [CHEN Yanyan, ZHAO Yalan, ZHANG Shuxiang, et al. Optimize the ultrasonic extraction process of Bupleurum polysaccharides by Box-Behnken response surface method[J]. Chemical Engineer,2022,36(2):71−75, 81. [12] 张丽霞, 魏照辉, 赵婉晴. 响应面优化超声波辅助酶法提取桑叶总黄酮的工艺[J]. 江苏农业科学,2019,47(13):217−221. [ZHANG Lixia, WEI Zhaohui, ZHAO Wanqing. Optimization of ultrasonic-assisted enzymatic extraction process for total flavonoids from mulberry leaf by response surface analysis[J]. Jiangsu Agricultural Sciences,2019,47(13):217−221. [13] 陈瑞喜, 王璐璐, 陈德蓉, 等. 超声波辅助酶法提取葡萄皮渣多酚工艺优化[J]. 食品工业科技,2019,40(9):198−201. [CHEN Ruixi, WANG Lulu, CHEN Derong, et al. Optimization for ultrasonic-assisted enzymatic extraction of polyphenols from grape pomace[J]. Science and Technology of Food Industry,2019,40(9):198−201. [14] 刘日斌, 张宇鹏, 马崇坚, 等. 超声波辅助酶法优化黄精多糖提取工艺的研究[J]. 食品研究与开发,2021,42(7):141−146. [LIU Ribin, ZHANG Yupeng, MA Chongjian, et al. Ultrasonic-assisted enzymatic optimization of extraction process of polysaccharides from Polygonatum sibiricum[J]. Food Research and Development,2021,42(7):141−146. [15] 公丕军, 杨明仁, 贺可娜, 等. 湖北海棠叶治疗2型糖尿病疗效观察[J]. 实用糖尿病杂志,2011,7(4):34−35. [GONG Pijun, YANG Mingren, HE Kena, et al. Observation on the curative effect of Hubei Begonia leaves on type 2 diabetes[J]. Journal of Practical Diabetology,2011,7(4):34−35. [16] 李明依, 迟雪文, 季青霞, 等. 超声波辅助酶法提取柚子皮果胶的工艺研究[J]. 包装与食品机械,2022,40(2):1−7. [LI Mingyi, CHI Xuewen, JI Qingxia, et al. Study on extraction of pectin from shaddock peel by ultrasonic assisted enzymatic method[J]. Packaging and Food Machinery,2022,40(2):1−7. [17] FRIEDMAN M. Overview of antibacterial, antitoxin, antiviral, and antifungal activities of tea flavonoids and teas[J]. Molecular Nutritionand Food Research,2007,51(1):116−134. doi: 10.1002/mnfr.200600173
[18] 吕亭亭, 杨志华, 谢奇, 等. 泡桐花总黄酮含量测定方法研究[J]. 化学与生物工程,2020,37(10):64−68. [LÜ Tingting, YANG Zhihua, XIE Qi, et al. Content determination of total flavonoids from Paulownia flos[J]. Chemistry & Bioengineering,2020,37(10):64−68. [19] 陈磊. 不同种类茶叶中茶多酚含量的测定和分析[J]. 食品安全导刊,2021(25):71,73. [CHEN Lei. Determination and analysis of tea polyphenols in different kinds of tea[J]. China Food Safety Magazine,2021(25):71,73. [20] 郑丽萍, 朱重阳, 张小梅. 山药多糖含量测定方法优化的研究[J]. 中州大学学报,2021,38(5):116−119. [DEN Liping, ZHU Chongyang, ZHANG Xiaomei. Study on optimization of content determination method for yam polysaccharides[J]. Journal of Zhongzhou University,2021,38(5):116−119. [21] 吴娜怡郁, 郭晓青, 陈晓靓, 等. 超声波辅助优化黔产野生地瓜叶总黄酮提取及清除羟基自由基研究[J]. 广东化工,2022,49(7):39−41. [WU Nayiyu, GUO Xiaoqing, CHEN Xiailiang, et al. Ultrasonic assisted optimization of wild melon leaves in guizhou extraction of total flavonoids[J]. Guangdong Chemical Industry,2022,49(7):39−41. doi: 10.3969/j.issn.1007-1865.2022.07.014 [22] WEl Lingyun, WANG Jianhua, ZHENG Xiaodong, et al. Studies on the extracting technical conditions of inulin from Jerusalem artichoke tubers[J]. Journal of Food Engineering,2007,79(3):1087−1093. doi: 10.1016/j.jfoodeng.2006.03.028
[23] BARRY D OSAWA TNAMKIMA. Epimerization of lactose to free lactulose in heated modes milk solutions[J]. Dairy Res,1985(12):409−417.
[24] 温馨, 田甜, 沈悦, 等. 超声波辅助提取变叶海棠中总黄酮工艺优化及抗氧化活性研究[J]. 天然产物研究与开发,2016,28(3):452−456,461. [WEN Xin, TIAN Tian, SHEN Yue, et al. Optimization of ultrasonic-assisted extraction and antioxidant activity of flavonoids from Malus toringoides[J]. Natural Product Research and Development,2016,28(3):452−456,461. [25] 杜云建, 赵玉巧, 李念念. 酶解法制备草鱼鱼鳞多肽及其清除羟自由基的研究[J]. 食品科学,2010,31(7):168−172. [DU Yunjian, ZHAO Yuqiao, LI Niannian. Enzymatic preparation and hydroxyl free radical scavenging activity of polypeptides from grass carp scales[J]. Food Science,2010,31(7):168−172. [26] 戢得蓉, 刘松奇, 熊坤艳, 等. 雪莲果叶总黄酮超声波辅助酶法提取工艺优化及抗氧化活性研究[J]. 食品与机械,2021,37(2):179−185. [JI Dwrong, LIU Songqi, XIONG Kunyan, et al. Ultrasonic enzymatic extraction of total flavonoids from Saussurea involucrataleaves and its antioxidant capacity analysis[J]. Food & Machinery,2021,37(2):179−185. [27] 柴军红, 何婷婷, 赵楠, 等. 五叶地锦果实多糖、花色苷抗氧化、抗肿瘤活性研究[J]. 湖北农业科学,2019,58(15):97−101,138. [CHAI Junhong, HE Tingting, ZHAO Nan, et al. Study on antioxidant and antitumor activity of polysaccharideand anthocyanin from Parthenocissus quinquefolia fruit[J]. Hubei Agricultural Sciences,2019,58(15):97−101,138. doi: 10.14088/j.cnki.issn0439-8114.2019.15.023 [28] 史瑞琴, 李大伟, 梁静静, 等. 响应面法优化小球藻多糖提取工艺研究[J]. 食品研究与开发,2018,39(3):18−23. [SHI Ruiqin, LI Dawei, LIANG Jingjing, et al. Optimization of extraction technology of polysaccharides from chlorella by response surface methodology[J]. Food Research and Development,2018,39(3):18−23. -
期刊类型引用(8)
1. 许天月,张俊杰,魏家乐,成永之,段蕊. 叶酸形式、稳定性及天然化叶酸的研究进展. 食品安全质量检测学报. 2024(02): 266-274 .  百度学术
百度学术
2. 毕晨,游清徽. 雷公藤红素-氨基葡萄糖酰胺偶联物的合成及其减毒调脂作用. 中草药. 2024(04): 1158-1166 .  百度学术
百度学术
3. 林伟明,廖红兴,孙剑光,梁传兴,黄略,李惠民,李灏. 氨基葡萄糖联合膝关节腔注射富血小板血浆治疗膝骨关节炎的临床效果. 中国医药. 2024(03): 420-425 .  百度学术
百度学术
4. 但晓梦,刘晓锋,郭江红,姜红. 氨基葡萄糖类药物的来源、结构及其鉴别技术研究. 中国药师. 2024(04): 551-556 .  百度学术
百度学术
5. 吕昊坤,杨腾辉,吴启赐,潘裕添,薛钰. 利用斑马鱼肝癌模型探究氨基葡萄糖盐酸盐对肝癌的影响. 食品工业科技. 2024(20): 332-340 .  本站查看
本站查看
6. 王锴,林剑浩. 氨基葡萄糖治疗骨关节炎的药理作用及其临床应用研究进展. 中华医学杂志. 2024(43): 4005-4010 .  百度学术
百度学术
7. 张倩如,吴启赐,薛钰,林志超,黄家福,吕昊坤,彭伟,潘裕添,林进妹. 杏鲍菇废弃菌渣中D-氨基葡萄糖盐酸盐的制备工艺及生物学活性分析. 食品工业科技. 2023(17): 263-271 .  本站查看
本站查看
8. 殷光玲,贤欢,肖义然,黄远英. 氨糖软骨素钙片安全性毒理学试验研究. 现代食品. 2023(19): 160-164+172 .  百度学术
百度学术
其他类型引用(5)





 下载:
下载:


 下载:
下载:



