Isolation, Identification and Enzyme Producing Capacity Analysis of Dominant Strain in Traditional Fermented Meitauza
-
摘要: 为实现豆渣的高值化利用,解决豆渣资源浪费以及霉豆渣规模化生产受限的问题。本研究以湖北咸宁传统发酵霉豆渣为材料进行微生物分离鉴定,共得到5种细菌和3种霉菌,分别命名为J1~J8。根据形态学观察、生理生化特征分析、16S rRNA及ITS测序结果,最终确定J1~J5分别为水生拉恩氏菌属B13菌株(Rahnella aquatilis strain B13)、戊糖片球菌属S1菌株(Pediococcus pentosaceus strain S1)、成团泛菌属NSD菌株(Pantoea agglomerans strain NSD)、肠膜明串珠菌属2020GS202菌株(Leuconostoc mesenteroides strain 2020GS202)和枯草芽孢杆菌属A10菌株(Bacillus subtilis strain A10),J6~J8分别为层出镰刀菌CanR-8菌株(Fusarium proliferatum strain CanR-8)、黑曲霉DZ-4-3-1菌株(Aspergillus niger strain DZ-4-3-1)和总状毛霉M-22菌株(Mucor racemosus f. racemosus strain M-22)。8株菌产酶能力测定结果表明,枯草芽孢杆菌(J5)产蛋白酶和纤维素酶的能力最强,分别达到153.247和66.552 U/mL,其他菌株的产酶能力相对较低。枯草芽孢杆菌、总状毛霉和黑曲霉可能是传统霉豆渣营养与特殊风味形成的主要发酵菌种。Abstract: This study attempted to solve the waste of soybean dregs resources problem and the limited scale production of moldy Meitauza to achieve the high-value utilization of soybean dregs. The traditional fermented Meitauza of Hubei Xianning were used as the material for microbial isolation and identification. A total of 5 bacteria and 3 fungi were obtained, named J1~J8, respectively. The morphological observation, physiological and biochemical analysis, 16S rRNA and ITS sequencing analysis revealed that J1~J5 were Rahnella aquatilis strain B13, Pediococcus pentosaceus strain S1, Pantoea agglomerans strain NSD, Leuconostoc mesenteroides strain 2020GS202 and Bacillus subtilis strain A10, respectively, while J6~J8 were respectively Fusarium proliferatum strain CanR-8, Aspergillus niger strain DZ-4-3-1, and Mucor racemosus f. racemosus strain M-22. In addition, the enzyme-producing ability determination of 8 strains showed that Bacillus subtilis (J5) had strong ability to produce protease and cellulase, reaching 153.247 and 66.552 U/mL, respectively, compared to others strains. The study also found that Bacillus subtilis, Mucor racemosa, and Aspergillus niger might be the main fermentative strains for nutrition and flavor of the traditional Meitauza.
-
大豆食品在我国已有几千年的生产历史,是我国人民膳食结构的重要组成部分,我国是世界上大豆的主要消费国,每年产生的鲜湿豆渣高达2000万吨以上[1]。目前,企业对豆渣的处理方式一般是作为动物饲料、植物肥料低价出售,或直接丢弃,豆渣利用率很低,不仅浪费大量可利用资源,而且容易造成环境污染。已有研究表明,鲜湿豆渣中仍然含有丰富的营养物质,如膳食纤维、蛋白质、脂肪、碳水化合物、维生素、矿物质以及大豆异黄酮、大豆皂苷、植酸等功能性成分,具有极高的资源化利用价值[2]。
霉豆渣作为一种以豆渣为生产原料的大豆发酵食品,是我国湘鄂一带具有民族特色的传统食品,不仅在弘扬我国传统文化,保障人民生活品质等方面发挥着独特的作用[3],而且为豆渣地有效利用提供了途径。经过微生物的发酵作用,豆渣中的蛋白质、纤维素、脂肪、异黄酮等物质被分解成小分子物质[4],并且能够去除豆渣的豆腥味,从而形成了味道鲜美、营养丰富的风味霉豆渣产品[5]。发酵后的豆渣不仅能够增加豆渣的可食性和营养价值,而且具有抗氧化、溶血栓、降血压和降低胆固醇等多种功能性作用[6]。然而,传统霉豆渣是利用自然环境中的微生物发酵而成,发酵条件不受控制,因而产品的感官品质、功能营养成分等都不稳定,而且容易受到病原菌污染,制约了豆渣资源的高值化转化利用及规模化生产。
近年来,国内研究人员对发酵霉豆渣中微生物多样性进行了探索,如尚雪娇等[7]和刘梦琦等[5]采用高通量测序技术分别对湖北荆州地区霉豆渣的细菌多样性和真菌多样性进行了分析。但上述研究还停留在微生物鉴定及营养功能价值层面,没有深入挖掘霉豆渣中的优良微生物菌种以及微生物与豆渣中营养物质分解之间的关系,而且目前没有关于湖北咸宁霉豆渣发酵菌种的相关报道。因此,本研究以湖北咸宁霉豆渣为研究对象,从中筛选鉴定其主要发酵微生物,对其进行形态学观察、生理生化特征指标测定并进行分子生物学鉴定,测定其产蛋白酶和纤维素酶的能力,以期为鲜湿豆渣的高附加值资源化利用提供参考。
1. 材料与方法
1.1 材料与仪器
霉豆渣 购于湖北省咸宁市旺业农产品有限公司(湖北省咸宁市崇阳县白霓镇严垅村楚味园)。
土豆液体培养基(PDB):土豆200 g,葡萄糖20 g,蒸馏水1000 mL,121 ℃灭菌30 min;马铃薯葡萄糖琼脂培养基(PDA):马铃薯葡萄糖琼脂46 g,蒸馏水1000 mL,121 ℃灭菌30 min;胰蛋白大豆琼脂(TSA)培养基:胰蛋白大豆琼脂38 g,酵母浸粉6 g,蒸馏水1000 mL,121 ℃灭菌30 min;胰蛋白大豆肉汤(TSB)液体培养基:胰蛋白大豆肉汤30 g,蒸馏水1000 mL,121 ℃灭菌30 min;生理生化鉴定培养基:参照《常见细菌系统鉴定手册》[8]中的培养基配制;豆渣培养基:将新鲜豆渣平摊在托盘中,厚度约为2 cm,于烘箱60 ℃除去部分水分,经过处理的豆渣,用手捏紧手指间可见少量余水流出但不下滴即可。称取50 g豆渣装入250 mL的锥形瓶中(体积比1/5),121 ℃蒸汽灭菌15 min。
马铃薯葡萄糖琼脂培养基(PDA)、胰蛋白大豆琼脂培养基(TSA)、胰蛋白大豆肉汤(TSB)、酵母浸粉 北京路桥技术股份有限公司;孟加拉红培养基 国药集团化学试剂有限公司;氯化钠、过氧化氢、磷酸氢二钾、葡萄糖、琼脂、乙醇、甲基红、氢氧化钠、牛肉浸膏、五水合硫酸铜、柠檬酸钠、无水碳酸钠、对氨基苯磺酸、磷酸氢二钠、磷酸二氢钾、氢氧化钠、石蕊、磷酸二氢钠、3,5-二硝基水杨酸、酒石酸钾钠 国药集团化学试剂有限公司;盐酸二甲基对苯撑二胺、1-萘胺、二苯胺、L-苯丙氨酸、对二甲基氨基苯甲醛 上海麦克林生化科技有限公司;蛋白胨、溴百里酚蓝、乳糖 上海源叶生物科技有限公司;硝酸钾、明胶 天津市科密欧化学试剂公司;醋酸、浓盐酸、无水亚硫酸钠 南京化学试剂有限公司;三氯乙酸、羧甲基纤维素、L-色氨酸、酵母膏、肌酸 上海阿拉丁生化科技股份有限公司;酪蛋白、L-酪氨酸、胰蛋白胨、革兰氏染色试剂盒 北京索莱宝科技有限公司;乙酸、苯酚 南京宁试化学试剂有限公司。
YP202N电子天平 上海菁海仪器有限公司;SQ510C高压蒸汽灭菌锅 日本雅马拓公司;HX-4均质器 上海沪析仪器有限公司;Thermo Fisher Pico-21高速冷冻离心机 赛默飞世尔科技公司;移液枪 大龙兴创实验仪器有限公司;SPX-70B恒温培养箱 天津泰斯特仪器有限公司;XS-3000-200光学显微镜 北京京宁国大科技发展有限责任公司;UV-1100紫外分光光度计 上海美谱达仪器有限公司;FE28 pH计 梅特勒-托利多仪器(上海)有限公司。
1.2 实验方法
1.2.1 微生物分离及纯化
参考GB 4789.2-2016食品微生物学检验 菌落总数测定方法[9]。称取10 g样品置无菌均质袋中, 加入90 mL无菌生理盐水,用拍击式均质器拍打2 min,制成1:10的样品匀液,按照10倍稀释法稀释至10−6。每个稀释度样品匀液吸取100 µL,涂布于胰蛋白胨大豆琼脂培养基(TSA),分别置于37±1 ℃下培养24 h和28±1 ℃下培养2~4 d,待菌落长出。在涂布平板中挑取典型细菌单菌落,采用划线法接种到TSA固体培养基上;挑取霉菌的典型菌落采用点种法接种到PDA固体培养基上。纯化2~3次,直到得到纯种单菌落。
1.2.2 形态特征鉴定
将纯化的菌种分别接种到相应的平板中进行培养,其中细菌采用划线法接种,霉菌采用三点植法接种,观察菌落形态。然后利用革兰氏染色法对细菌菌体进行染色,制作镜片,在显微镜下观察菌体形态;挑取适量的霉菌菌丝于载玻片上,观察菌丝形态。
1.2.3 生理生化指标鉴定
参照《常见细菌系统鉴定手册》[8],对5种细菌菌株进行了革兰氏反应、过氧化氢酶、氧化酶、葡萄糖氧化发酵、甲基红、V-P、吲哚、3-酮基乳糖、苯丙氨基酸脱氨酶、淀粉水解、牛奶分解、卵磷脂酶、硝酸盐还原、明胶液化、耐渗透压(2%、5%、7%、10%)指标的测定。其中耐渗透压测定:将预先活化好的菌株接种于氯化钠浓度分别为2%、5%、7%、10%的TSB液体培养基中,37 ℃静置培养,每隔24 h测一次OD600 nm值[10]。
1.2.4 细菌16S rRNA及霉菌ITS鉴定
将分离得到的单一菌株送样至北京擎科生物科技有限公司进行分子鉴定,具体方法如下。细菌使用擎科2×Tsing KE Master Mixmin(CodeNo.:TSE003)体系进行PCR扩增。用16S rRNA基因通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)PCR扩增菌株的16S rRNA基因。PCR扩增体系:10×buffer 5 μL,10×TransTaq-T 0.5 μL,引物27F 1 μL,引物1492R 1 μL,DNA模板1 μL,dNTPs 4 μL。PCR扩增程序:预变性10 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,29个循环;72 ℃再延伸10 min,4 ℃保存。扩增产物进行回收,测序。霉菌使用真菌通用引物ITS1 TCCGTAGGTGAACCTGCGG)、ITS4(TCCTCCGCTTATTGATATGC)扩增菌株的5.8S-ITS区域;PCR扩增产物以DL5000为分子质量标准,1%琼脂糖、150 V、100 mA电泳20 min检测;回收扩增产物,测序。将得到的序列与NCBI数据库序列进行BLAST同源性比对,并用MEGA6.0软件中Neighbor-Joining法构建系统发育树。
1.2.5 蛋白酶、纤维素酶活性测定
将微生物接种于新鲜豆渣培养基中,细菌于37 ℃培养2 d,霉菌于28 ℃培养6 d。准确称取4 g发酵后的豆渣,按照1:5(g/mL)比例加入0.9% NaCl溶液。45 ℃水浴1.5 h,过滤去掉滤渣,将滤液8000 r/min离心5 min,上清液即为粗酶液。参照GB/T 23527-2009蛋白酶制剂[11],采用福林法测定蛋白酶活力。蛋白酶酶活定义:1 g豆渣在45 ℃、pH7.5条件下,1 min水解酪蛋白产生1 μg酪氨酸,即为1个酶活力单位,以U/mL表示。参照QB 2583-2003纤维素酶制剂[12],采用羧甲基纤维素酶活力(CMCA-DNS)方法测定纤维素酶活力。纤维素酶酶活定义:1 g豆渣在50 ℃、pH6.0的条件下,每小时水解羧甲基纤维素钠底物,产生出相当于1 mg葡萄糖的还原糖量为1个酶活力单位,以U/mL表示。
1.3 数据处理
实验重复3次,结果表示为“平均值±标准偏差”。利用Excel、SPSS软件对数据进行分析处理,使用MEGA6.0软件构建系统发育树。
2. 结果与分析
2.1 微生物的分离纯化结果
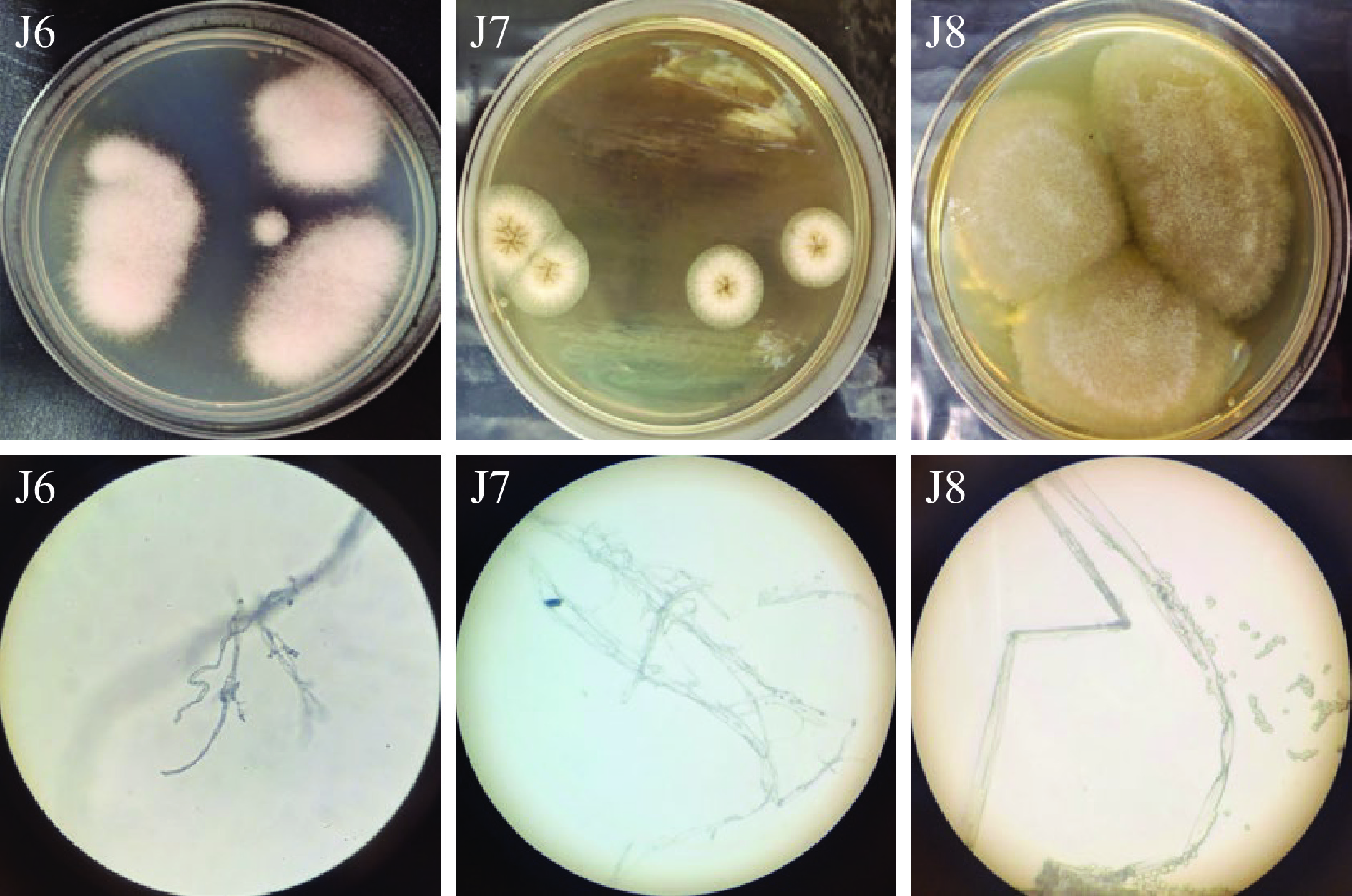
通过对霉豆渣样品进行梯度稀释、涂布分离,共分离纯化得到8株菌,将其编号为J1、J2、J3、J4、J5、J6、J7、J8,其中J1~J5是细菌,J6~J8是霉菌。将分离纯化的5株细菌在TSA培养基上培养2 d,3株霉菌在PDA培养基上培养6 d,其菌落形态及镜检结果见图1、图2和表1。5株细菌中,J1、J3为革兰氏阴性杆菌,J2和J4为革兰氏阳性球菌,J5为革兰氏阳性杆菌(图1)。3株霉菌中,根据形态可初步判定J7为黑曲霉,J8为毛霉。
表 1 菌落形态特征Table 1. Colony morphological characteristics菌株 菌落颜色 形态特征 J1 乳白色 表面光滑、边缘规则整齐、圆形、有凸起、不透明 J2 白色 表面光滑、边缘规则整齐、圆形、扁平、不透明 J3 黄色 表面光滑、边缘规则整齐、圆形、有凸起、不透明 J4 白色 表面光滑、边缘规则整齐、圆形、有凸起、不透明 J5 淡黄色 表面褶皱、边缘不规则、花朵状、有凸起、边缘透明 J6 白色 表面绒毛絮状、菌丝长、边缘较规则、圆形、不透明 J7 白色,产
黑色孢子表面绒毛絮状、菌丝短、边缘较规则、圆形、
产黑色孢子、不透明J8 灰白色 表面绒毛絮状、菌丝长、边缘不规则、不透明 2.2 生理生化指标鉴定分析
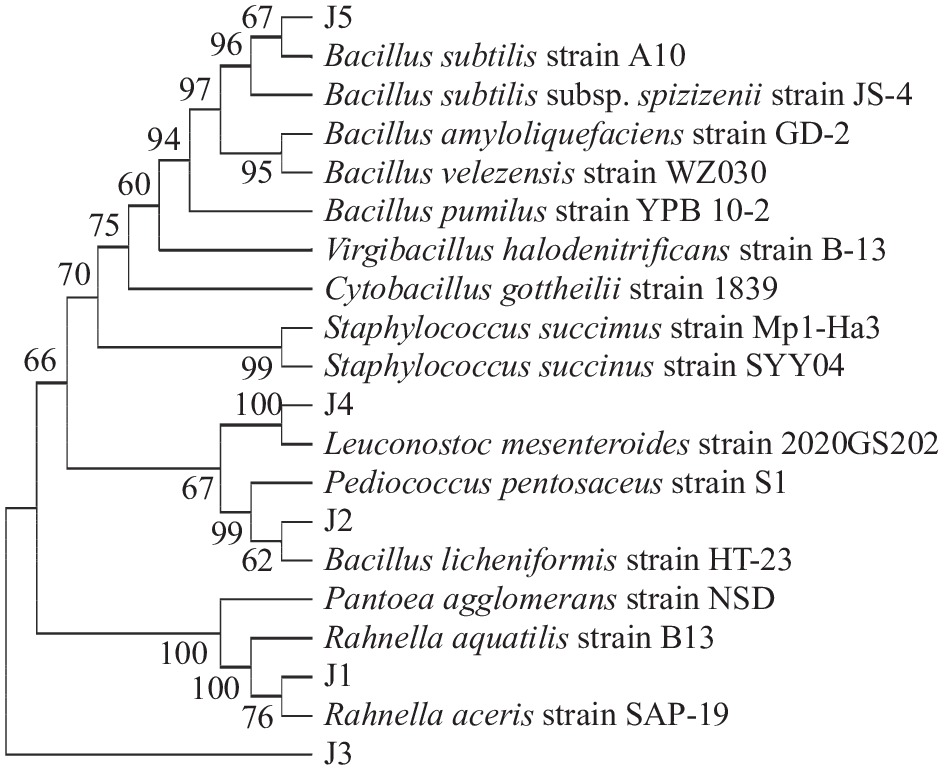
5株细菌生理生化鉴定指标结果见表2。根据菌落形态及生理生化指标鉴定结果,参照《常见细菌系统鉴定手册》,初步推断J1~J5分别为拉恩氏菌属、片球菌属、泛菌属、明串球菌属和芽孢杆菌属。
表 2 菌株生理生化指标鉴定Table 2. Identification of physiological and biochemical indexes序号 鉴定指标 J1 J2 J3 J4 J5 1 革兰氏染色 - + - + + 2 过氧化氢酶 + - + - + 3 氧化酶 - - - - + 4 葡萄糖氧化发酵 产酸,
产气产酸,
发酵型产酸,
发酵型产酸,
发酵型产酸,
发酵型5 甲基红 + + + + - 6 V-P测定 + + - - + 7 吲哚 - - - - - 8 3-酮基乳糖测定 + - - - - 9 苯丙氨基酸脱氨酶 + - + - - 10 淀粉水解 - - - - + 11 牛奶分解 胨化 胨化 还原 无 酸凝 12 卵磷脂酶 - - - - + 13 硝酸盐还原 + + + + + 14 明胶液化 - + + + + 15 耐渗透压 2% ++ +++ + ++ + 5% ++ +++ + +++ + 7% +++ ++ +++ +++ ++ 10% + ++ ++ ++ +++ 16 微生物分类 拉恩氏
菌属片球菌属 泛菌属 明串球
菌属芽孢杆
菌属注:+菌株阳性反应,-菌株阴性反应。 表2还显示,5株细菌在含有2%、5%、7%、10%氯化钠的液体培养基中都可以生长,但生长情况存在差异。菌株J1和J3在7%氯化钠培养基中生长状况最好,菌株J4在5%和7%氯化钠培养基中生长状况均良好,但3种菌株在10%氯化钠培养基中生长受到明显的抑制;菌株J2在5%及以下氯化钠培养基中生长较好,但在7%及以上氯化钠培养基中生长受到抑制;菌株J5随着培养基中氯化钠浓度的增加,生长状况逐渐变好,且在10%氯化钠培养基中生长状况最好。以上结果表明,不同的菌株对氯化钠的耐受性和需求有很大差异,这为后期霉豆渣的工业化纯种发酵生产提供了有益参考。
2.3 细菌16S rRNA鉴定分析
将5株细菌16S rRNA序列测定结果提交NCBI数据库进行Blast同源性比对,并利用Neighbor-Joining法构建系统发育树,结果见图3和表3。由系统发育树可知,菌株J1与Rahnella aquatilis strain B13的亲缘关系最为接近;菌株J2和Pediococcus pentosaceus strain S1的16S rRNA序列同源性达99.86%;菌株J3与Pantoea agglomerans strain NSD的序列同源性最高,亲缘关系最接近;菌株J4和Leuconostoc mesenteroides strain 2020GS202的16S rRNA序列同源性达99.79%;菌株J5隶属于Bacillus与Bacillus subtilis strain A10的16S rRNA序列同源性达99.72%。以上5株菌与数据库中菌株序列比对结果表明其同源性均达到99%以上,覆盖率均达到99%以上,而且E值都为0.0,表明比对结果可靠性强。结合形态学观察和生理生化特征分析结果,确定菌株J1~J5分别为水生拉恩氏菌属B13菌株(Rahnella aquatilis strain B13)、戊糖片球菌属S1菌株(Pediococcus pentosaceus strain S1)、成团泛菌属NSD菌株(Pantoea agglomerans strain NSD)、肠膜明串珠菌属2020GS202菌株(Leuconostoc mesen-teroides strain 2020GS202)和枯草芽孢杆菌属A10菌株(Bacillus subtilis strain A10)。
表 3 8株菌的序列同源性比对结果Table 3. Homologous alignment analysis of eight typical isolates菌株编号 BLAST结果 序列大小(bp) 覆盖百分率(%) 同源性(%) 菌株登录号 J1 水生拉恩氏菌B13菌株(Rahnella aquatilis strain B13) 1473 99 99.79 MW555197.1 J2 戊糖片球菌属S1菌株(Pediococcus pentosaceus strain S1) 1569 99 99.86 JX134608.1 J3 成团泛菌属NSD菌株(Pantoea agglomerans strain NSD) 1473 99 99.86 KT075169.1 J4 肠膜明串珠菌属2020GS202菌株(Leuconostoc mesenteroides strain 2020GS202) 1402 99 99.79 OM442915.1 J5 枯草芽孢杆菌属A10菌株(Bacillus subtilis strain A10) 1472 100 99.72 MW276095.1 J6 层出镰刀菌CanR-8菌株(Fusarium proliferatum strain CanR-8) 558 100 99.82 JF817300.1 J7 黑曲霉DZ-4-3-1菌株(Aspergillus niger strain DZ-4-3-1) 596 96 99.83 KT192262.1 J8 总状毛霉M-22菌株(Mucor racemosus f. racemosus strain M-22) 582 93 99.68 HQ285603.1 注:以上菌株E值均为0.0。 2.4 霉菌ITS鉴定分析
将3株霉菌ITS测序后的序列结果登录NCBI数据库进行同源性比对,结果见图4和表3。由图4可知,菌株J6隶属于Fusarium与Fusarium proliferatum strain CanR-8基因序列同源性达到99.82%; J7与Aspergillus niger strain DZ-4-3-1亲缘关系最为接近;J8隶属于Mucor与Mucor racemosus f. racemosus strain M-22的基因序列同源性达到99.68%。以上3株霉菌与数据库中菌株序列比对结果表明其同源性均达到99%以上,覆盖率均达到93%以上,而且E值都为0.0,表明比对结果可靠性强。综合形态学观察及分子生物学分析结果,确定菌株J6~J8分别为层出镰刀菌CanR-8菌株(Fusarium proliferatum strain CanR-8)、黑曲霉DZ-4-3-1菌株(Aspergillus niger strain DZ-4-3-1)和总状毛霉M-22菌株(Mucor racemosus f. racemosus strain M-22)。
2.5 蛋白酶、纤维素酶活性分析
由表4可知,在5种细菌中,枯草芽孢杆菌属A10菌株产蛋白酶和纤维素酶能力均最高,分别为153.247±3.88和66.552±3.06 U/mL,显著高于其他4种细菌(P<0.05);成团泛菌属NSD菌株产蛋白酶能力较高(25.412±2.36 U/mL),但产纤维素酶能力较弱(5.352±1.08 U/mL);而肠膜明串珠菌属2020GS202菌株产蛋白酶能力较弱,仅为4.404±1.03 U/mL,但产纤维素酶能力较高,为14.083±1.70 U/mL;水生拉恩氏菌属B13菌株和戊糖片球菌属S1菌株产蛋白酶和纤维素酶能力均较弱。
表 4 8 株菌的蛋白酶和纤维素酶活性Table 4. Protease and cellulase activities of 8 typical isolates菌种 蛋白酶活力(U/mL) 纤维素酶活力(U/mL) J1水生拉恩氏菌属B13菌株 12.752±1.89B 4.600±0.76A J2戊糖片球菌属S1菌株 1.010±0.22A 6.144±0.94A J3成团泛菌属NSD菌株 25.412±2.36C 5.352±1.08A J4肠膜明串珠菌属2020GS202菌株 4.404±1.03A 14.083±1.70B J5枯草芽孢杆菌属A10菌株 153.247±3.88E 66.552±3.06D J6层出镰刀菌CanR-8菌株 325.068±2.87F 19.479±2.21B J7黑曲霉DZ-4-3-1菌株 17.064±2.95C 63.272±5.02D J8总状毛霉M-22菌株 45.500±3.46D 24.790±2.57C 注:同列大写字母不同表示存在显著差异(P<0.05)。 在3种霉菌中,层出镰刀菌CanR-8菌株蛋白酶活力最强,为325.068±2.87 U/mL,总状毛霉M-22菌株次之,为45.500±3.46 U/mL,黑曲霉DZ-4-3-1菌株最弱,为17.064±2.95 U/mL,三者之间差异显著(P<0.05)。3种霉菌菌株产纤维素酶能力大小顺序为黑曲霉DZ-4-3-1菌株>总状毛霉M-22菌株>层出镰刀菌CanR-8 菌株,分别为63.272±5.02、24.790±2.57和19.479±2.21 U/mL(表4),三者之间存在显著性差异(P<0.05)。
3. 讨论
霉豆渣是我国独具特色的传统发酵食品,含有游离氨基酸、水溶性矿物质、水溶性固形物、维生素等,具有抗氧化、降血压、抑制糖尿病和降低胆固醇等多种功能[13]。霉豆渣的品质、功能特性与微生物息息相关,霉豆渣风味、色泽和功能因子的形成离不开微生物发酵作用及其代谢产生的多种酶系。传统发酵霉豆渣多采用自然发酵、开放式或半开放式生产方式,发酵过程中可能有多种细菌和霉菌协同发挥作用。毛欣欣等[14]从湖南邵阳霉豆渣中进行分离纯化得到33株菌,其中包括13株乳酸菌、7株芽孢杆菌、9株葡萄球菌和4株真菌。徐书泽等[15]从广西梧州霉豆渣中分离得到一株粗糙脉孢菌。张燕鹏等[16]发现江西瑞金霉豆渣中真菌主要为串珠霉属、根霉属和酵母菌属,细菌属为微球菌属、葡萄球菌属、片球菌属和异常球菌属。本研究对湖北地区霉豆渣样品中的微生物进行了分离鉴定,得到了5种细菌和3种霉菌,推测这8种菌可能与霉豆渣营养品质、特殊风味和功能成分的形成有关。
豆渣中含有丰富的蛋白质和粗纤维,微生物代谢产生的蛋白酶能催化蛋白质水解生成多肽及小分子氨基酸等,进而产生各种香气成分[17-18],而纤维素酶可降解豆渣中的粗纤维,纤维素的降解会改善豆渣的硬度、弹性以及咀嚼度等质构指标[19],两种酶活力的高低可能对霉豆渣风味的形成及发酵成熟周期有重要影响。本研究筛选的5种细菌和3种真菌均有一定的产蛋白酶和纤维素酶能力,其中枯草芽孢杆菌属A10菌株的蛋白酶酶活力高达153.247 U/mL,总状毛霉M-22菌株和黑曲霉DZ-4-3-1菌株的蛋白酶活力分别为45.500、17.064 U/mL。黑曲霉DZ-4-3-1菌株纤维素酶活力为63.272 U/mL,与刘松等[20]经优化培养条件后的黑曲霉纤维素酶活力相当,远远高于殷休等[21]黑曲霉发酵香菇次品的纤维素酶活力。总状毛霉M-22菌株的纤维素酶活力为24.790 U/mL,远高于陈怡等[22]从浏阳豆豉发酵中分离筛选的毛霉纤维素酶活力和何维等[23]从太和毛霉豆豉中分离筛选的毛霉纤维素酶活力。以上结果表明,枯草芽孢杆菌属A10菌株、总状毛霉M-22菌株和黑曲霉DZ-4-3-1菌株可能是霉豆渣的主要发酵菌种。成团泛菌属NSD菌株产蛋白酶能力和肠膜明串珠菌属2020GS202菌株产纤维素酶能力较高,这两种细菌可能对霉豆渣风味形成中起辅助作用。此外,本实验分离出的层出镰刀菌CanR-8菌株蛋白酶活力高达325.068 U/mL,但是该菌被认为是导致农作物发生枯萎病的优势病原菌,被侵染的农作物会产生大量伏马毒素[24-25]。伏马毒素归类为2B组致癌物质,并证实伏马毒素与人的食道癌和新生儿神经管缺陷有关[26]。
综合上述分析,霉豆渣的营养品质、特殊风味以及各种功能性物质的产生,不是单一微生物的贡献,而是多种细菌和霉菌在发酵过程中相互协同作用的结果,枯草芽孢杆菌属A10菌株、总状毛霉M-22菌株和黑曲霉DZ-4-3-1菌株可能是霉豆渣风味形成的主要优势发酵菌种,成团泛菌属NSD菌株和肠膜明串珠菌属2020GS202菌株具有协同作用。
4. 结论
本研究从霉豆渣中分离得到5种细菌和3种霉菌,经多次平板分离、纯化和筛选,对其进行生理生化特征鉴定,同时,提取其基因进行16S rRNA鉴定和ITS鉴定分析,最终鉴定J1~J5为水生拉恩氏菌属B13菌株、戊糖片球菌属S1菌株、成团泛菌属NSD菌株、肠膜明串珠菌属2020GS202菌株和枯草芽孢杆菌属A10菌株,J6~J8鉴定为层出镰刀菌CanR-8菌株、黑曲霉DZ-4-3-1菌株和总状毛霉M-22菌株。霉豆渣产品中鉴定出有害的层出镰刀菌CanR-8菌株,这可能与传统自然发酵生产有关,因此有必要对传统工艺进行改进提升。同时,对各菌株的酶活力进行了测定,枯草芽孢杆菌属A10菌株的蛋白酶活力和纤维素酶活力均较高,分别达到153.247和66.552 U/mL;黑曲霉DZ-4-3-1菌株的纤维素酶活力较高,达到63.272 U/mL;总状毛霉M-22菌株的蛋白酶活力较高,为45.500 U/mL。由此推断,枯草芽孢杆菌属A10菌株、总状毛霉M-22菌株及黑曲霉DZ-4-3-1菌株可能与霉豆渣独特风味的形成密切相关,具体发酵特性还有待进一步研究。
本研究对霉豆渣中的微生物进行具体的分析和研究,有助于实现霉豆渣工业化生产,形成统一的生产安全标准体系,从而为豆渣的高值化利用开辟新的道路,解决资源浪费、环境污染问题。
-
表 1 菌落形态特征
Table 1 Colony morphological characteristics
菌株 菌落颜色 形态特征 J1 乳白色 表面光滑、边缘规则整齐、圆形、有凸起、不透明 J2 白色 表面光滑、边缘规则整齐、圆形、扁平、不透明 J3 黄色 表面光滑、边缘规则整齐、圆形、有凸起、不透明 J4 白色 表面光滑、边缘规则整齐、圆形、有凸起、不透明 J5 淡黄色 表面褶皱、边缘不规则、花朵状、有凸起、边缘透明 J6 白色 表面绒毛絮状、菌丝长、边缘较规则、圆形、不透明 J7 白色,产
黑色孢子表面绒毛絮状、菌丝短、边缘较规则、圆形、
产黑色孢子、不透明J8 灰白色 表面绒毛絮状、菌丝长、边缘不规则、不透明 表 2 菌株生理生化指标鉴定
Table 2 Identification of physiological and biochemical indexes
序号 鉴定指标 J1 J2 J3 J4 J5 1 革兰氏染色 - + - + + 2 过氧化氢酶 + - + - + 3 氧化酶 - - - - + 4 葡萄糖氧化发酵 产酸,
产气产酸,
发酵型产酸,
发酵型产酸,
发酵型产酸,
发酵型5 甲基红 + + + + - 6 V-P测定 + + - - + 7 吲哚 - - - - - 8 3-酮基乳糖测定 + - - - - 9 苯丙氨基酸脱氨酶 + - + - - 10 淀粉水解 - - - - + 11 牛奶分解 胨化 胨化 还原 无 酸凝 12 卵磷脂酶 - - - - + 13 硝酸盐还原 + + + + + 14 明胶液化 - + + + + 15 耐渗透压 2% ++ +++ + ++ + 5% ++ +++ + +++ + 7% +++ ++ +++ +++ ++ 10% + ++ ++ ++ +++ 16 微生物分类 拉恩氏
菌属片球菌属 泛菌属 明串球
菌属芽孢杆
菌属注:+菌株阳性反应,-菌株阴性反应。 表 3 8株菌的序列同源性比对结果
Table 3 Homologous alignment analysis of eight typical isolates
菌株编号 BLAST结果 序列大小(bp) 覆盖百分率(%) 同源性(%) 菌株登录号 J1 水生拉恩氏菌B13菌株(Rahnella aquatilis strain B13) 1473 99 99.79 MW555197.1 J2 戊糖片球菌属S1菌株(Pediococcus pentosaceus strain S1) 1569 99 99.86 JX134608.1 J3 成团泛菌属NSD菌株(Pantoea agglomerans strain NSD) 1473 99 99.86 KT075169.1 J4 肠膜明串珠菌属2020GS202菌株(Leuconostoc mesenteroides strain 2020GS202) 1402 99 99.79 OM442915.1 J5 枯草芽孢杆菌属A10菌株(Bacillus subtilis strain A10) 1472 100 99.72 MW276095.1 J6 层出镰刀菌CanR-8菌株(Fusarium proliferatum strain CanR-8) 558 100 99.82 JF817300.1 J7 黑曲霉DZ-4-3-1菌株(Aspergillus niger strain DZ-4-3-1) 596 96 99.83 KT192262.1 J8 总状毛霉M-22菌株(Mucor racemosus f. racemosus strain M-22) 582 93 99.68 HQ285603.1 注:以上菌株E值均为0.0。 表 4 8 株菌的蛋白酶和纤维素酶活性
Table 4 Protease and cellulase activities of 8 typical isolates
菌种 蛋白酶活力(U/mL) 纤维素酶活力(U/mL) J1水生拉恩氏菌属B13菌株 12.752±1.89B 4.600±0.76A J2戊糖片球菌属S1菌株 1.010±0.22A 6.144±0.94A J3成团泛菌属NSD菌株 25.412±2.36C 5.352±1.08A J4肠膜明串珠菌属2020GS202菌株 4.404±1.03A 14.083±1.70B J5枯草芽孢杆菌属A10菌株 153.247±3.88E 66.552±3.06D J6层出镰刀菌CanR-8菌株 325.068±2.87F 19.479±2.21B J7黑曲霉DZ-4-3-1菌株 17.064±2.95C 63.272±5.02D J8总状毛霉M-22菌株 45.500±3.46D 24.790±2.57C 注:同列大写字母不同表示存在显著差异(P<0.05)。 -
[1] GE G, GUO W, ZHENG J, et al. Effect of interaction between tea polyphenols with soymilk protein on inactivation of soybean trypsin inhibitor[J]. Food Hydrocolloids,2021:111.
[2] DU Y, ZHANG Q, ZHAO X, et al. Effect of reverse micelle on physicochemical properties of soybean 7S globulins[J]. Journal of Food Engineering,2020,282:11026−11026.
[3] 刘原媛. 大豆发酵食品对机体的保健作用[J]. 食品与发酵科技,2020,56(4):65−68. [LIU Y Y. The health function of fermented soybean food to the body[J]. Food and Fermentation Science & Technology,2020,56(4):65−68. [4] 吴永祥, 吴丽萍, 朴银美, 等. 药(食)真菌发酵豆渣的主要功能物质及生物活性变化[J]. 食品与发酵工业,2020,46(15):100−106. [WU Y X, WU L P, PIAO Y M, et al. Changes in main functional substances and biological activities of okara fermented with medicinal and edible fungi[J]. Food and Fermentation Industries,2020,46(15):100−106. doi: 10.13995/j.cnki.11-1802/ts.024045 [5] 刘梦琦, 朱媛媛, 倪慧, 等. 荆州地区霉豆渣真菌多样性研究[J]. 食品与发酵工业,2021,47(6):241−246. [LIU M Q, ZHU Y Y, NI H, et al. Fungal diversity in meitauza collected from Jingzhou[J]. Food and Fermentation Industries,2021,47(6):241−246. doi: 10.13995/j.cnki.11-1802/ts.025381 [6] 刘彦敏, 沈璐, 王康, 等. 传统大豆发酵食品中纳豆芽孢杆菌的分离及纳豆发酵[J]. 食品科学,2020,41(2):208−214. [LIU Y M, SHEN L, WANG K, et al. lsolation of Bacillus subtilis natto from Chinese traditional fermented soybean foods and their use in fermentation of Natto[J]. Food Science,2020,41(2):208−214. doi: 10.7506/spkx1002-6630-20181116-186 [7] 尚雪娇, 方三胜, 朱媛媛, 等. 霉豆渣细菌多样性解析及基因功能预测[J]. 食品与发酵工业,2021,47(3):36−42. [SHANG X J, FANG S S, ZHU Y Y, et al. Bacterial diversity and prediction of gene function in Meitauza[J]. Food and Fermentation Industries,2021,47(3):36−42. doi: 10.13995/j.cnki.11-1802/ts.025193 [8] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 364–398. DONG X Z, CAI M Y. Manual for systematic identification of common bacteria[M]. Beijing: Science Press, 2001: 364–398.
[9] GB 4789.2-2016 食品安全国家标准 食品微生物学检验 菌落总数测定[S]. 北京: 中国标准出版社, 2016. GB 4789.2-2016 National Food Safety Standards Food Microbiological analysi-determination of total bacterial count[S]. Beijing: China Standards Press, 2016.
[10] 贺燕, 谭纯良, 李娜, 等. 腐败鸡蛋干中微生物的分离鉴定[J]. 食品科技,2019,44(12):366−372. [HE Y, TAN C L, LI N, et al. Purification and identification of microbes in egg curd[J]. Food Science and Technology,2019,44(12):366−372. doi: 10.13684/j.cnki.spkj.2019.12.062 [11] GB/T 23527-2009 蛋白酶制剂[S]. 北京: 中国标准出版社, 2009. GB/T 23527-2009 Protease preparations[S]. Beijing: China Standards Press, 2009.
[12] QB 2583-2003 纤维素酶制剂[S]. 北京: 中国标准出版社, 2003. QB 2583-2003 Cellulases[S]. Beijing: China Standards Press, 2003.
[13] 王慧. 豆渣发酵成分分析及其产品开发的研究[D]. 长沙: 湖南农业大学, 2014. WANG H. Study on fermentation component analysis and product development of soybean residue[D]. Changsha: Hunan Agricultural University, 2014.
[14] 毛欣欣, 雷茜, 陈伟哲, 等. 传统发酵霉豆渣中微生物的分离及其作为豆渣发酵剂的应用[J]. 现代食品科技,2022,38(6):74−83. [MAO X X, LEI X, CHEN W Z, et al. Isolation of microorganisms from traditional fermented meitauza and its use as starter for fermented okara[J]. Modern Food Science and Technology,2022,38(6):74−83. doi: 10.13982/j.mfst.1673-9078.2022.6.0745 [15] 徐书泽, 黄丽, 滕建文, 等. 传统发酵霉豆渣产酶优势菌的分离鉴定及性质研究[J]. 食品与发酵工业,2014,40(3):102−106. [XU S Z, HUANG L, TENG J W, et al. lsolation and identification of dominant microorganism in traditional fermentative Meidouzha and characterization of dominant strain[J]. Food and Fermentation Industries,2014,40(3):102−106. [16] 张燕鹏, 杨瑞金, 王贺, 等. 传统豆渣菌的菌相分析及蛋白酶和纤维素酶主要产生菌株的鉴定[J]. 食品工业科技,2012,33(1):171−174. [ZHANG Y P, YANG R J, WANG H, et al. Analysis of the microflora and identification of the protease and cellulase producing strains from the traditional fermentative Douzhajun[J]. Science and Technology of Food Industry,2012,33(1):171−174. doi: 10.13386/j.issn1002-0306.2012.01.044 [17] GUO J, HE Z, WU S, et al. Effects of concentration of flavor compounds on interaction between soy protein isolate and flavor compounds[J]. Food Hydrocolloids,2020:100.
[18] TROISE A D, WILTAFSKY M, FOGLIANO V, et al. The quantification of free Amadori compounds and amino acids allows to model the bound Maillard reaction products formation in soybean products[J]. Food Chemistry,2018,247:29−38. doi: 10.1016/j.foodchem.2017.12.019
[19] 索化夷, 赵欣, 骞宇, 等. 永川豆豉发酵过程中质构色泽形成规律[J]. 食品与发酵工业,2016,42(7):80−85. [SUO H Y, ZHAO X, QIAN Y, et al. Texture and color formation of Yongchuan Douchi during fermentation process[J]. Food ang Fermentation Idustries,2016,42(7):80−85. doi: 10.13995/j.cnki.11-1802/ts.201607014 [20] 刘松, 李祝, 周礼红, 等. 响应面法优化黑曲霉产纤维素酶的发酵条件[J]. 食品科学,2013,34(17):225−229. [LIU S, LI Z, ZHOU L H, et al. Optimization of fermentation conditions for cellulase production by aspergillus niger using response surface methodology[J]. Food Science,2013,34(17):225−229. doi: 10.7506/spkx1002-6630-201317048 [21] 殷休, 袁博, 刘应保, 等. 黑曲霉液体发酵香菇残次品产纤维素酶的培养基优化[J]. 中国酿造,2019,38(12):97−101. [YI X, YUAN B, LIU Y B, et al. Optimization of medium for cellulase production from defective Lentinus edodes with liquid-state fermentation by Aspergillus niger[J]. China Brewing,2019,38(12):97−101. doi: 10.11882/j.issn.0254-5071.2019.12.019 [22] 陈怡, 刘洋, 蒋立文, 等. 浏阳豆豉发酵中高产酶活菌株的分离鉴定及酶活性分析[J]. 中国酿造,2020,39(8):37−41. [CHEN Y, LIU Y, JIANG L W, et al. lsolation and identification of strains with high enzyme activity during Liuyang Douchi fermentation and enzyme activity analysis[J]. China Brewing,2020,39(8):37−41. doi: 10.11882/j.issn.0254-5071.2020.08.008 [23] 何维, 安天星, 余玲, 等. 四川太和毛霉豆豉中优势发酵菌株的分离鉴定与酶活分析[J]. 安徽农业科学,2021,49(14):157−161. [HE W, AN T X, YU L, et al. lsolation, purification enzyme activity analysis of domianant fermentation strains from Sichuan Taihe Mucor Douchi[J]. Journal of Anhui Agricultural Sciences,2021,49(14):157−161. doi: 10.3969/j.issn.0517-6611.2021.14.042 [24] 李寅生, 王璐, 何雅婷, 等. 产毒条件下层出镰刀菌总RNA提取方法的比较研究[J]. 食品安全质量检测学报,2020,11(12):3970−3975. [LI Y S, WANG L, HE Y T, et al. Comparative study on the extraction methods of total RNA from Fusarium proliferatum under toxicity conditions[J]. Journal of Food Safety & Quality,2020,11(12):3970−3975. doi: 10.19812/j.cnki.jfsq11-5956/ts.2020.12.043 [25] MONDANI L, CHIUSA G, PIETRI A, et al. Monitoring the incidence of dry rot caused by Fusarium proliferatum in garlic at harvest and during storage[J]. Postharvest Biology and Technology,2021:173.
[26] BRAUN M S, WINK M. Exposure, occurrence, and chemistry of fumonisins and their cryptic derivatives[J]. Comprehensive Reviews in Food Science and Food Safety,2018,17(3):769−791. doi: 10.1111/1541-4337.12334
-
期刊类型引用(5)
1. 王共明,黄会,丁玉竹,薛敬林,舒志强,井月欣,矫春娜,张健. 海参粉超临界CO_2萃取脱脂工艺优化及对挥发性风味物质的影响. 食品工业科技. 2025(03): 241-248 .  本站查看
本站查看
2. 李正阳,刘畅,费靖淳,周浩,韩万鑫,潘一萍,祁艳霞,赵前程. 刺参自溶肽美拉德反应产物表征及抗氧化活性研究. 食品安全质量检测学报. 2025(04): 224-233 .  百度学术
百度学术
3. 赵影,田柬昕,钟碧銮,李萌,苏可珍. 海参深加工脱腥技术研究进展. 食品工业. 2024(03): 229-235 .  百度学术
百度学术
4. 王志龙,王禹,段静瑶,苏岩峰,喻佩. 海参制品腥味化合物形成与脱腥技术研究进展. 中国调味品. 2024(06): 206-212 .  百度学术
百度学术
5. 马慧,顾雪敏,李芳,梅洁,王梓棚,孔令明. 菌酶协同处理在食品加工中的研究进展及应用. 中国调味品. 2024(07): 208-213 .  百度学术
百度学术
其他类型引用(1)






 下载:
下载:

 下载:
下载:



