Simultaneous Determination of Five Phenolic Acids and Isoquercitrin in Sweet Potato (Ipomoea batatas (L.) Lam) Leaves by HPLC
-
摘要: 咖啡酸、绿原酸、3,4-二咖啡酰奎宁酸、3,5-二咖啡酰奎宁酸、4,5-二咖啡酰奎宁酸和异槲皮苷是甘薯叶中的主要活性成分,本研究建立高效液相色谱(high performance liquid chromatography, HPLC)同时测定这6种成分的方法。通过对检测波长、色谱柱、洗脱溶剂、洗脱流速等参数优化得到的最佳分析条件为:ZORBAX SB-C18(4.6 mm×250 mm,5 μm)为分析柱,以0.1%甲酸水溶液(A)和乙腈(B)为流动相,采用梯度洗脱:0~12 min,10%~25% B;12~18 min,25% B,流速0.8 mL/min,检测波长326 nm,柱温30 ℃。咖啡酸、绿原酸、3,4-二咖啡酰奎宁酸、3,5-二咖啡酰奎宁酸、4,5-二咖啡酰奎宁酸和异槲皮苷的线性范围分别为0.25~25.0、0.5~50.0、5.0~100.0、10.0~200.0、5.0~100.0和0.5~50.0 μg/mL。该方法分析时间短(18 min),线性度(R2≥0.998)、稳定性(RSD≤1.97%)、精密度(RSD≤1.56%)和加标回收率(95.14%~103.22%)好。对江西10个不同产地甘薯叶目标成分分析发现,宜春丰城的甘薯叶具有最高的总酚含量。Abstract: In this study, a reversed-phase high performance liquid-chromatography coupled to ultraviolet detection (RP-HPLC/UV) method for simultaneous determination of six major bioactive constituents (caffeic acid, chlorogenic acid, 3,4-dicaffeoyl quinic acid, 3,5-dicaffeoyl quinic acid, 4,5-dicaffeoyl quinic acid and isoquercetin) in sweet potato leaves was developed and validated after optimization of various chromatographic conditions and other experimental parameters. The chromatographic separation was achieved on an Agilent ZORBAX SB-C18 reserved-phase column (4.6 mm×250 mm, 5 μm) using a gradient elution program with a mobile phase consisting of 0.1% formic acid aqueous solution (solvent A) and acetonitrile (solvent B) (0~12 min, 10%~25% B; 12~18 min, 25% B), at a flow rate of 0.8 mL/min, an operating temperature of 30 ℃, and a wavelength of 326 nm. The calibration curves were linear in the range of 0.25~25.0, 0.5~50.0, 5.0~100.0, 10.0~200.0, 5.0~100.0, 0.5~50.0 μg/mL for caffeic acid, chlorogenic acid, 3,4-dicaffeoyl quinic acid, 3,5-dicaffeoyl quinic acid, 4,5-dicaffeoyl quinic acid and isoquercetin, respectively. The present method was fast (18 min), and demonstrated acceptable values for linearity (R2≥0.998), stability (RSD≤1.97%), recovery (95.14%~103.22%) and precision (RSD≤1.56%). Additionally, the new method was successfully applied to determine components in sweet potato leaves from ten different regions of Jiangxi Province, and the results indicated that the sample harvested in Fengcheng city of Yichun contained higher total phenol content than those collected in other regions.
-
Keywords:
- HPLC /
- caffeoylquinic acids /
- isoquercitrin /
- simultaneous determination /
- sweet potato leaves
-
甘薯(Ipomoea batatas (L.) Lam),学名番薯,种植广泛,是世界主要的粮食作物之一[1]。甘薯叶为甘薯加工的副产物,现代科学研究表明甘薯叶提取物具有抑菌[1]、抗氧化[2]、抗癌[3]、降血糖[4]、降血脂[5]等多种生物活性。在许多国家和地区,甘薯叶被当作一种绿叶蔬菜食用[6]。酚酸和黄酮类化合物是甘薯叶中主要的活性成分,甘薯叶中的主要酚酸为咖啡酸衍生物及咖啡酰奎宁酸衍生物,黄酮类化合物为槲皮素及其衍生物[7-8]。酚酸和黄酮类化合物具有多种生物活性。绿原酸和二咖啡酰奎宁酸具有抗菌、抗病毒活性和保肝作用[9-10],咖啡酸具有止血的功效[11],异槲皮苷具有抗氧化、抗炎及抗癌作用[12]。这些化合物的活性与其含量密切相关[13],因此建立合适的定量方法对研究甘薯叶生物活性及甘薯叶高值化利用具有重要意义。
目前,甘薯叶酚酸和黄酮类化合物的定量方法主要有紫外分光光度法(如福林酚法、氯化铝显色法)[7, 14]和HPLC法。其中紫外分光光度法简单方便,但其根据试剂化学反应的原理测定,只能粗略的测定总量,无法区分单体化合物,容易受到干扰[15-16]。HPLC具有选择性好、灵敏度和准确度高等特点,可通过标准物质实现具体化合物的定量分析,目前已应用于茶叶[17]、石榴[18]、蓝莓[19]等多种植物酚酸和黄酮类化合物的测定。虽已有HPLC法分离测定甘薯叶中酚酸和黄酮类化合物的报道,但有待于进一步改善,如ZHANG等[8]采用HPLC分离甘薯叶中酚类物质的时间较长(约40 min);钟伟[20]采用HPLC测定甘薯叶中酚酸含量时未对甘薯叶中含量较高的二咖啡酰奎宁酸类化合物定量。
咖啡酸、绿原酸、3,4-二咖啡酰奎宁酸、3,5-二咖啡酰奎宁酸、4,5-二咖啡酰奎宁酸和异槲皮苷为甘薯叶中的主要活性成分[7](结构如图1所示)。本研究优化建立HPLC同时测定甘薯叶中这6种化合物含量的方法,通过对检测波长、色谱柱、洗脱溶剂、洗脱流速等参数优化得到的最佳分析条件,并进行方法学评价,最后对江西10个不同产地甘薯叶进行分析测定,为甘薯叶资源的进一步开发利用提供理论指导和技术支撑。
1. 材料与方法
1.1 材料与仪器
甘薯叶 于2020年9月采摘于江西省10个不同产地(吉安市新干县、吉安市吉安县、新余市渝水区、宜春市丰城市、宜春市袁州区、上饶市横峰县、鹰潭市贵溪市、南昌市南昌县、景德镇市浮梁县和九江市永修县)的郊区农场,经南昌大学食品学院石燕教授鉴定均为红心甘薯叶(red-flesh Ipomea batatas (L.) Lam. leaves);甲酸(色谱纯)、咖啡酸、绿原酸、3,4-二咖啡酰奎宁酸、3,5-二咖啡酰奎宁酸、4,5-二咖啡酰奎宁酸、异槲皮苷(纯度均>97%) 阿拉丁试剂(上海)有限公司;乙腈、甲醇、丙酮 色谱纯,德国Merck公司;实验用水 超纯水(电阻率18.2 MΩ)。
Hitachi D-2000高效液相色谱仪(配L-2400紫外-可见光检测器) 日本日立高新技术公司;ML104电子天平 梅特勒-托利多有限公司;TGL-10C高速台式离心机 上海安亭科学仪器厂;DFY-500C试样粉碎机 温岭市林大机械有限公司;HY-4A数显多用调速振荡器 常州朗越仪器制造有限公司;Leader-A1超纯水仪 上海领德仪器有限公司。
1.2 实验方法
1.2.1 样品的制备
取新鲜甘薯叶,去除杂质,用水清洗干净后置于电热鼓风干燥箱中50 ℃干燥72 h,然后用粉碎机粉碎过60目筛,置于自封袋中,−20 ℃冰箱保存备用。准确称取甘薯叶粉末5.0 g于具塞锥形瓶中,加入70%丙酮溶液100 mL,于室温在振荡器上100 r/min提取12 h,所得提取液4000 r/min离心10 min,残渣再在相同条件下提取2 h。合并2次所得上清液,用70%丙酮定容至500 mL,所得溶液用0.45 μm微孔滤膜过滤后即得待测样品。
1.2.2 标准溶液配制
分别准确称取25 mg 6种化合物标准物质于25 mL容量瓶中,加入70%丙酮溶解,定容至刻度,制得浓度为1 mg/mL的各化合物标准储备液。再分别精密吸取咖啡酸0.25 mL、绿原酸0.50 mL、3,4-二咖啡酰奎宁酸1.00 mL、3,5-二咖啡酰奎宁酸2.00 mL、4,5-二咖啡酰奎宁酸1.00 mL和异槲皮苷0.50 mL于同一10 mL容量瓶中,用70%丙酮定容至刻度,作为混合标准储备液(咖啡酸25.0 μg/mL,绿原酸、异槲皮苷50.0 μg/mL,3,4-二咖啡酰奎宁酸、4,5-二咖啡酰奎宁酸100.0 μg/mL,3,5-二咖啡酰奎宁酸200.0 μg/mL),根据需要对混合标准储备液稀释得到系列浓度的标准使用液。
1.2.3 方法学验证
1.2.4 色谱条件
色谱柱:ZORBAX SB-C18(4.6 mm×250 mm,5 μm);流动相:0.1%甲酸水溶液(A)和乙腈(B);洗脱梯度:0~12 min,10%~25% B;12~18 min,25% B;流速:0.8 mL/min,进样量:10 μL;柱温:30 ℃;检测波长为326 nm。
将测得的各组分保留时间与标准谱图对比,对各化合物进行定性分析,采用峰面积按外标法定量分析其质量浓度。
参照ICH指导原则[21],从线性、精密度、稳定性、重现性和加标回收率等方面验证方法的可行性。
1.2.5 样品含量测定
分别准确称取5.0 g不同产地的甘薯叶粉末,按1.2.1方法制备样品,并根据优化后的条件测定,准确记录图谱中目标成分的峰面积,并根据标准曲线计算含量,结果以干物质(dried material, DM)质量计。
1.3 数据处理
每个样品重复测量3次,结果表示为“
¯X±SD ”,采用SPSS 19.0和Excel 2010对数据分析处理,使用ANOVA法进行显著性检验,P<0.05为统计学上有显著性差异,应用Origin 9.0软件绘图。2. 结果与分析
2.1 色谱条件优化
采用Hatachi D-2000 HPLC对5种酚酸和异槲皮苷的洗脱条件进行优化。以前期研究采用的方法作为分离的初始条件[15],即水(含0.1%的甲酸)为流动相A;甲醇为流动相B;洗脱梯度:0~15 min,10%~35% B,15~35 min,35%~80% B,36~40 min,100% B;流速:1.0 mL/min;检测波长320 nm;进样量:10 μL,柱温30 ℃,在此基础上对检测波长、色谱柱、洗脱溶剂A和B、洗脱梯度和洗脱流速等参数进行优化。
2.1.1 检测波长的选择
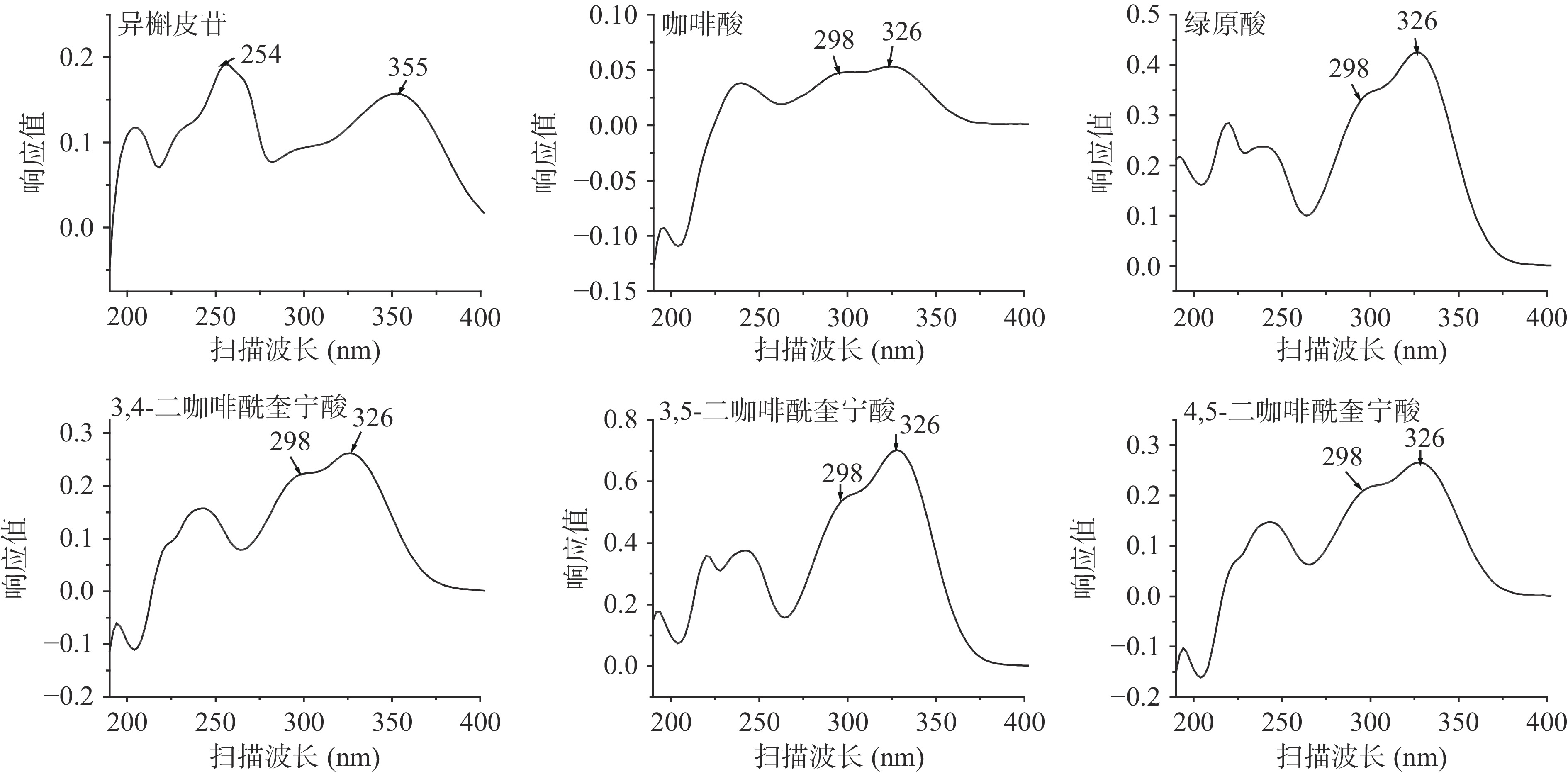
在190~400 nm波长范围内对甘薯叶中5种酚酸和异槲皮苷的紫外光谱进行扫描。如图2,咖啡酸、绿原酸、3,4-二咖啡酰奎宁酸、3,5-二咖啡酰奎宁酸和4,5-二咖啡酰奎宁酸的最大吸收波长均为326 nm,异槲皮苷在254和355 nm处均有最大吸收峰。由于L-2400紫外-可见光检测器为单波长检测器,同一时间只能检测一个波长,且已有大量文献将槲皮素及其衍生物的HPLC波长设在326 nm附近[22-24],综合考虑工作量和试剂使用量等因素,后续试验中酚酸和异槲皮苷的检测波长设为326 nm。
2.1.2 色谱柱的选择
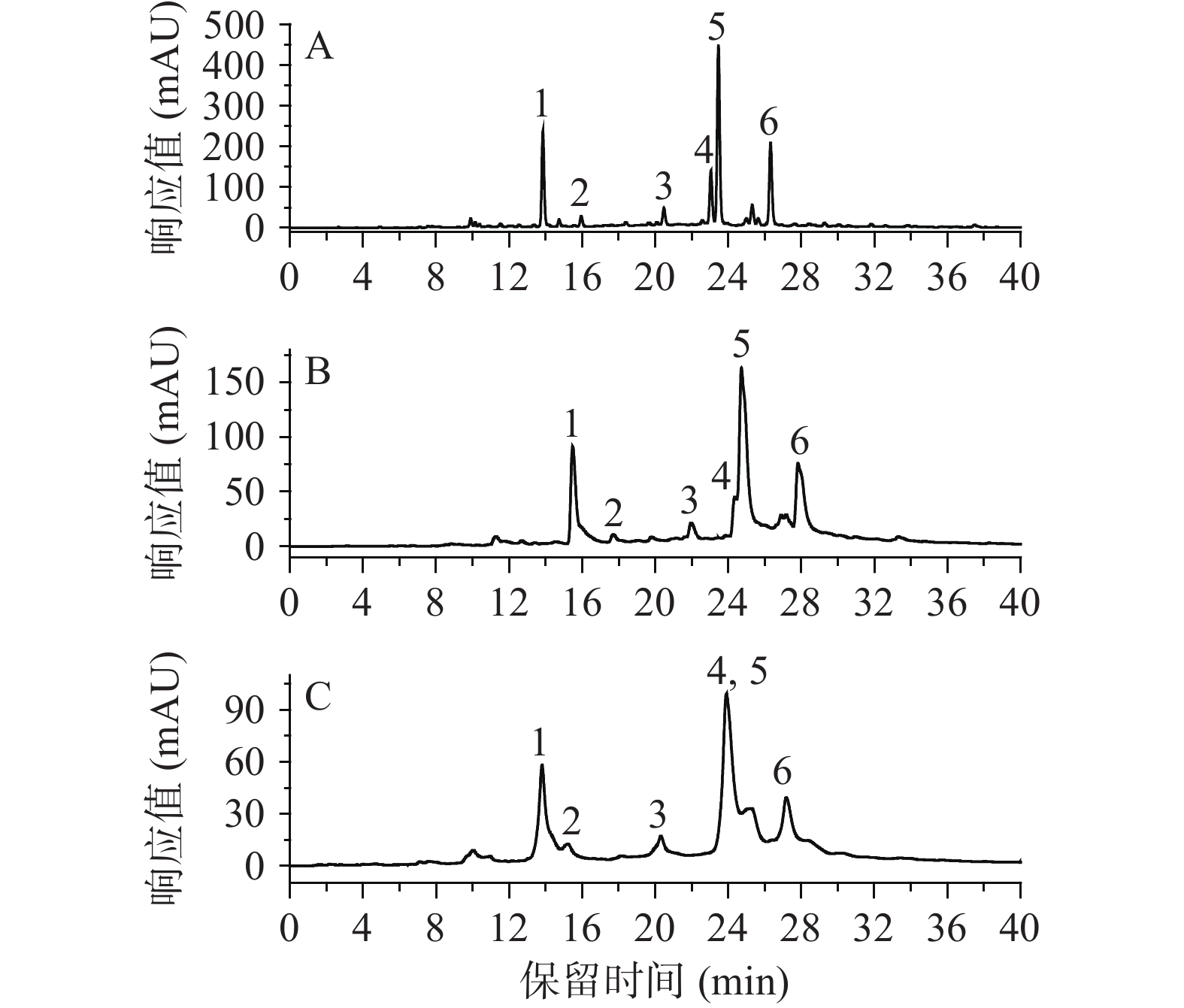
酚酸和黄酮类化合物通常采用反相色谱柱进行分离。本文比较了Phenomenex Luna 5u 100A C18长柱(4.6 mm×250 mm,5 µm)、Phenomenex LaChrom C18短柱(4.6 mm×150 mm,5 µm)及Agilent ZORBAX SB-C18柱(4.6 mm×250 mm, 5 µm)3款色谱柱对甘薯叶中5种酚酸和异槲皮苷分离效果的差异。如图3,所选的色谱柱中Agilent ZORBAX SB-C18柱分离效果最好,6种化合物在26 min内均得到完全分离,且峰形对称,因此选择此色谱柱进行后续分析。
2.1.3 流动相的选择
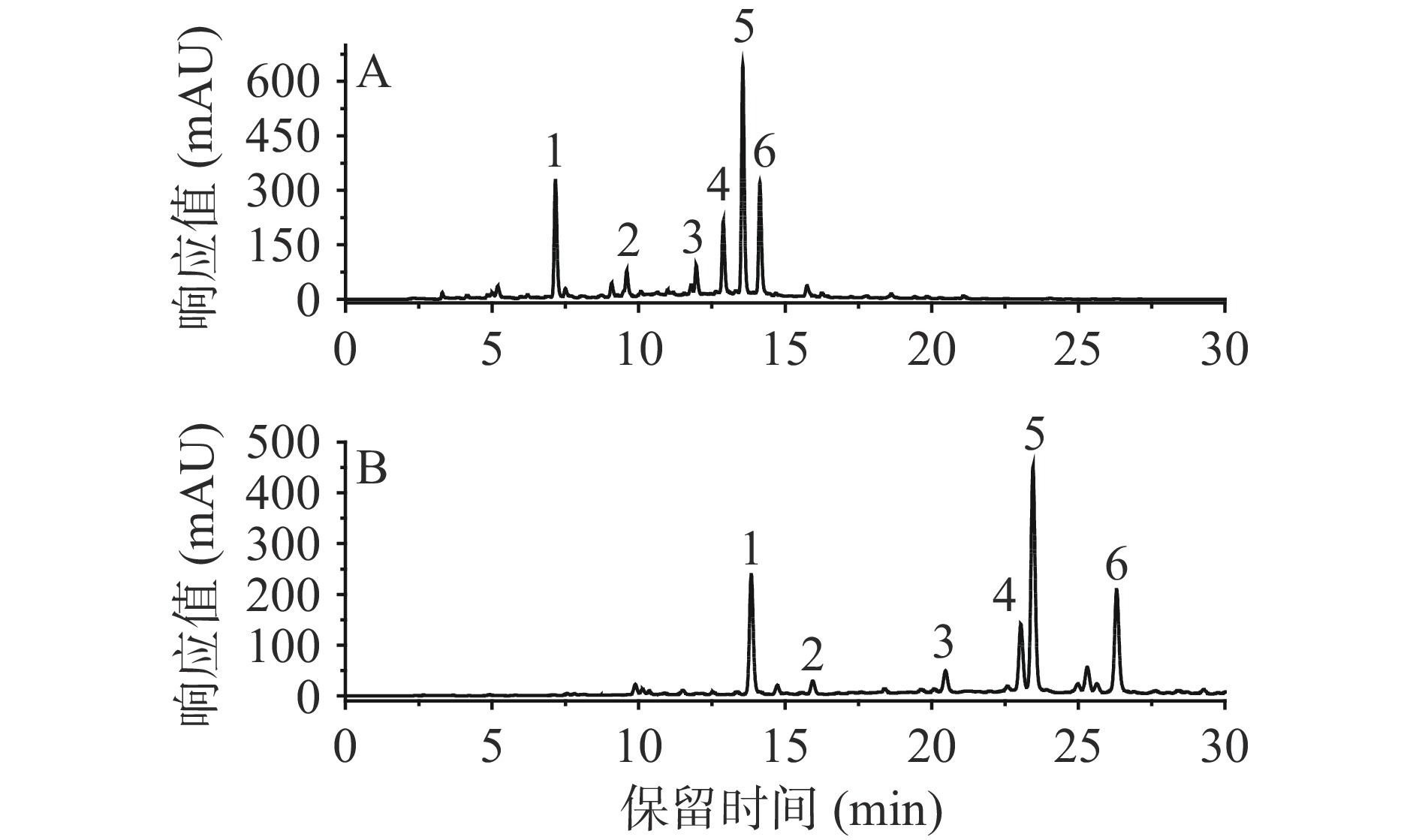
酚酸和黄酮类化合物分离的流动相体系主要为乙腈/水及甲醇/水[25],本文测试了这两类溶剂系统对甘薯叶中5种酚酸和异槲皮苷的分离效果差异。如图4,当采用甲醇/0.1%甲酸水作为流动相时,分离时间长(约26.5 min),且3,4-二咖啡酰奎宁酸与3,5-二咖啡酰奎宁酸无法完全分离,但采用乙腈/0.1%甲酸水为流动相时,6种化合物均可完全分离,时间较以甲醇/0.1%甲酸水为流动相时显著缩短,这可能是由乙腈的高偶极矩使产生更强的分析物-流动相分散相互作用(供体-受体相互作用)引起的[26]。使用乙腈为流动相时比甲醇分析时间更短、峰形更尖锐也被HUANG等[27]报道,因此初步选择乙腈/0.1%甲酸水作为流动相,经过调试得到最佳洗脱程序为:0.1%甲酸水溶液(A)和乙腈(B),洗脱梯度:0~12 min,10%~25% B;12~18 min,25% B。
2.1.4 流速的选择
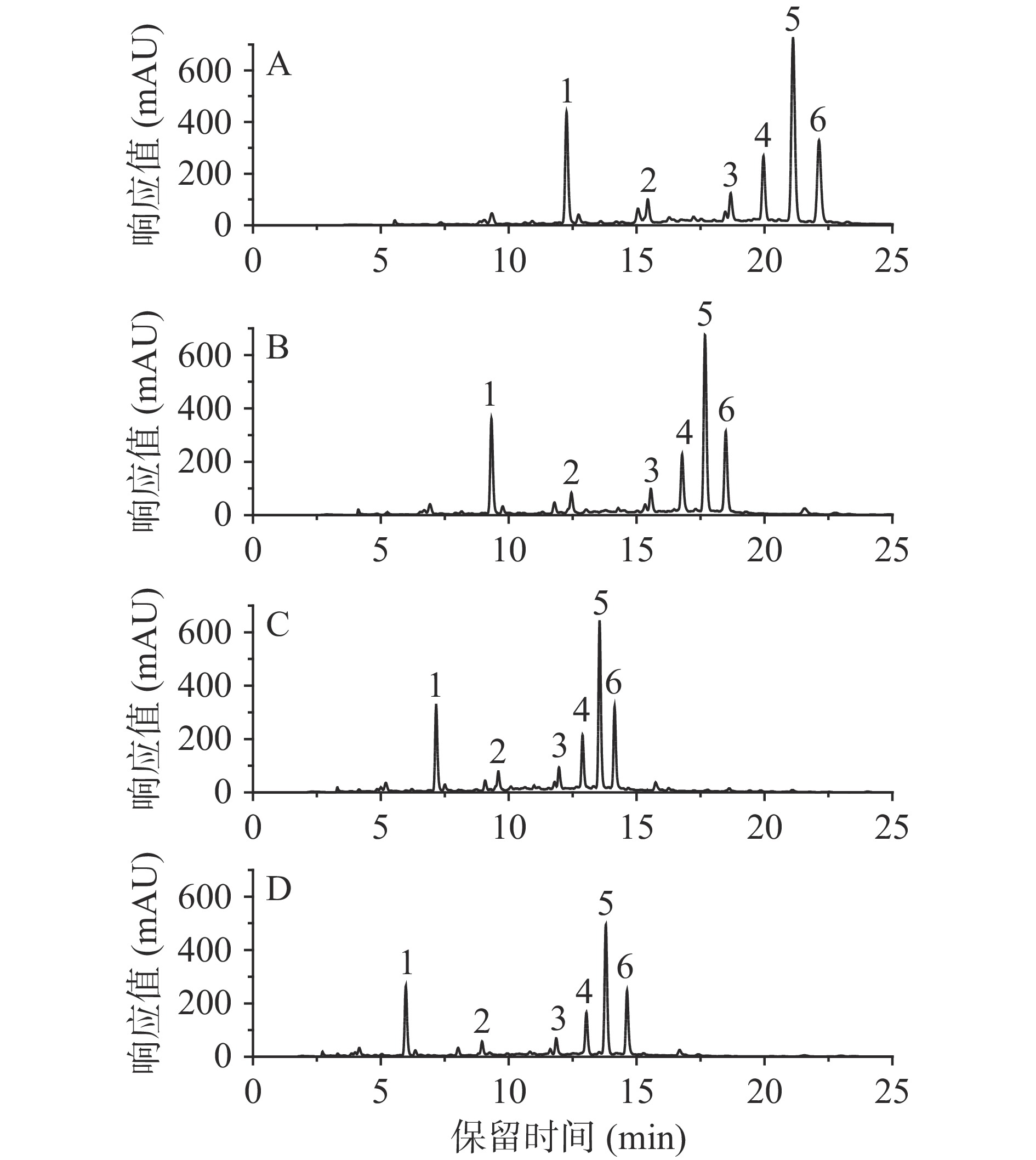
本文比较了不同流动相流速(0.6、0.8、1.0、l.2 mL/min)对6种化合物分离的影响,如图5,流速的增加缩短了化合物的分离时间,但分析物质之间的分离度降低,这与段云飞等[28]应用HPLC法同时测定采后莲雾果实中7种有机酸含量的结果相似,综合考虑分析时间及分离度,设置流速为0.8 mL/min。
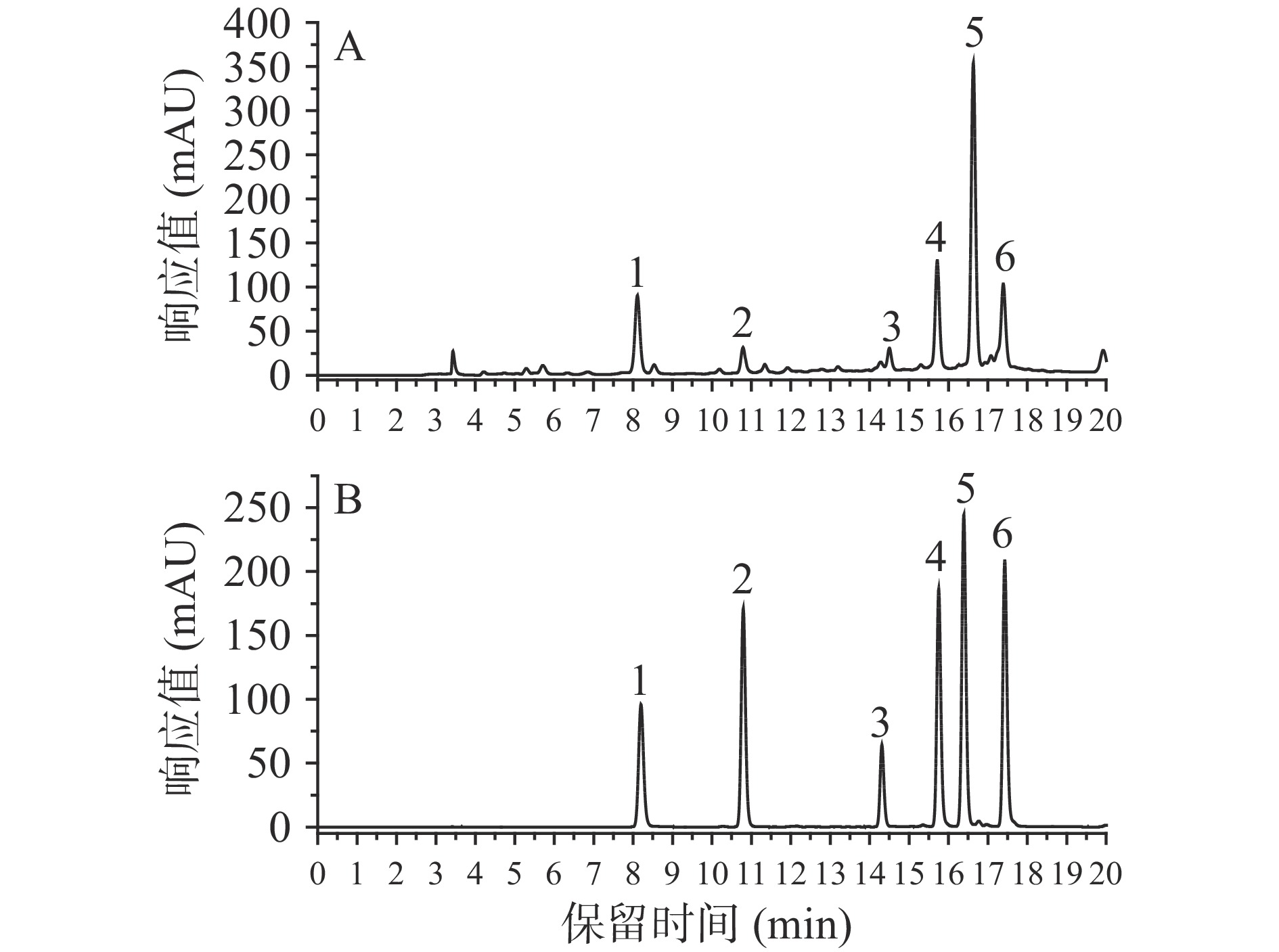
综上,得到优化后的分析条件为:色谱柱:ZORBAX SB-C18(4.6 mm×250 mm,5 μm);流动相:0.1%甲酸水溶液(A)和乙腈(B);洗脱梯度:0~12 min,10%~25% B;12~18 min,25% B;流速:0.8 mL/min;进样量:10 μL,柱温:30 ℃,检测波长为326 nm。在此条件下所得样品和混标溶液的色谱图见图6。可以看出,本文建立方法能在18 min内对甘薯叶中6种目标成分完成分离,与ZHANG等[8]及朱亚珠[29]分离甘薯叶中酚酸的HPLC条件相比,时间缩短了约1倍。
2.2 方法学验证
2.2.1 线性关系、检出限和定量限
将不同浓度的混合标准品溶液进样,采用优化好的色谱条件分析,以浓度(μg/mL)为横坐标,峰面积为纵坐标绘制标准曲线,并将标准溶液稀释至信噪比(signal to noise, S/N)为3和10,计算各化合物的检出限及定量限,所得相关信息见表1。可以看出,咖啡酸、绿原酸、3,4-二咖啡酰奎宁酸、3,5-二咖啡酰奎宁酸、4,5-二咖啡酰奎宁酸和异槲皮苷分别在0.25~25.0、0.5~50.0、5.0~100.0、10.0~200.0、5.0~100.0和0.5~50.0 μg/mL浓度范围具有良好的线性关系,决定系数(R2)均≥0.998。6种化合物检出限变化范围为0.9~18.4 μg/g DM,定量限变化范围为3.0~61.2 μg/g DM,能够满足定量分析的要求。
表 1 5种酚酸和异槲皮苷的线性范围、标准曲线、决定系数、检出限及定量限(n=7)Table 1. Linear range, standard curve, determination coefficient, detection limit and quantification limit of five phenolic acids and isoquercitrin (n=7)化合物 线性范围(μg/mL) 标准曲线 决定系数(R2) 检出限(μg/g DM) 定量限(μg/g DM) 咖啡酸 0.25~25.0 Y=67793X−18215 0.9997 0.9 3.0 绿原酸 0.5~50.0 Y=37913X−21415 0.9996 4.3 14.2 3,4-二咖啡酰奎宁酸 5.0~100.0 Y=40131X−105662 0.9980 11.6 38.6 3,5-二咖啡酰奎宁酸 10.0~200.0 Y=25927−110983 0.9985 18.4 61.2 4,5-二咖啡酰奎宁酸 5.0~100.0 Y=44641X−81094 0.9980 12.8 42.6 异槲皮苷 0.5~50.0 Y=18595X−14879 0.9991 12.6 41.9 2.2.2 精密度
取1.2.2中混合标准溶液,在优化好的色谱条件下连续进样6次,分别记录6种化合物的峰面积。得到咖啡酸、绿原酸、3,4-二咖啡酰奎宁酸、3,5-二咖啡酰奎宁酸、4,5-二咖啡酰奎宁酸以及异槲皮苷峰面积的RSD分别为1.08%、1.49%、1.19%、1.40%、1.55%和1.56%,均<2.0%,表明仪器精密度良好。
2.2.3 稳定性
取同一混合标准溶液,分别在0、2、4、6、8、12、24 h后进样测定,记录6种化合物的峰面积。得到咖啡酸、绿原酸、3,4-二咖啡酰奎宁酸、3,5-二咖啡酰奎宁酸、4,5-二咖啡酰奎宁酸以及异槲皮苷峰面积的RSD分别为0.75%、0.38%、1.49%、1.83%、1.97%和0.66%,均<2.0%,表明测试样品溶液在24 h内稳定性良好。
2.2.4 重现性
取6份产地为南昌的甘薯叶粉末,按照1.2.1中的方法制备样品溶液,得到咖啡酸、绿原酸、3,4-二咖啡酰奎宁酸、3,5-二咖啡酰奎宁酸、4,5-二咖啡酰奎宁酸以及异槲皮苷峰面积的RSD分别为0.55%、0.37%、1.71%、1.81%、1.94%和0.41%,均<2.0%,表明该方法具有较好的重现性。
2.2.5 加标回收率
采用加标回收实验评价方法的准确性。取12份产地为南昌的甘薯叶粉末,其中3份用于测定样品中6种化合物的本底值,剩余9份进行三个标准添加水平的回收率试验,按照1.2.1中方法处理样品,采用优化的色谱条件测定并计算回收率。如表2所示,5种酚酸和异槲皮苷的平均加标回收率变化范围为95.14%~103.22%,RSD变化范围1.0%~3.0%,平均加标回收率结果较好,表明该方法具有较好的准确性。
表 2 5种酚酸和异槲皮苷的加标回收率结果Table 2. The recovery results of five phenolic acids and isoquercitrin determined化合物 样品中含量
(μg/g DM)加入量
(μg/g DM)测得总量平均值
(μg/g DM)平均回收
率(%)RSD
(%)咖啡酸 529 420 939 97.62 1.8 525 1058 100.76 1.1 630 1128.4 95.14 1.0 绿原酸 2416 1900 4310.3 99.70 1.6 2400 4784 98.67 1.8 2900 5247 97.62 1.4 3,4-二咖啡
酰奎宁酸3332 2650 6017 101.32 2.6 3350 6790 103.22 3.0 4000 7426.4 102.36 2.4 3,5-二咖啡
酰奎宁酸12312 9850 21933.5 97.68 2.0 12300 24272.5 97.24 2.9 14800 27058.7 99.64 1.7 4,5-二咖啡
酰奎宁酸3857 3100 6895.7 98.02 3.0 3850 7580.5 96.71 2.9 4650 8407.5 95.91 1.6 异槲皮苷 1340 1050 2361 97.24 1.6 1340 2628.3 96.14 2.3 1600 2874.5 95.91 1.1 2.3 实际样品的测定
将建立的方法用于测定江西省内10个不同产地(吉安市新干县、吉安市吉安县、新余市渝水区、宜春市丰城市、宜春市袁州区、上饶市横峰县、鹰潭市贵溪市、南昌市南昌县、景德镇市浮梁县、九江市永修县)甘薯叶中5种酚酸和异槲皮苷的含量。如表3,咖啡酸、绿原酸、3,4-二咖啡酰奎宁酸、3,5-二咖啡酰奎宁酸、4,5-二咖啡酰奎宁酸和异槲皮苷的含量变化范围分别为0.12~0.53、0.68~2.99、0.23~3.33、3.27~18.25、0.85~4.49和0.32~1.34 mg/g DM。在所有甘薯叶中均检出6种目标成分,其中3,5-二咖啡酰奎宁酸均为6个化合物中含量最高的物质(占总酚的比例34.1%~67.5%),这与MAKORI等[30]的结果一致。不同产地甘薯叶中6种目标成分总量的变化范围为9.45~30.24 mg/g DM,其中产地为宜春丰城市的甘薯叶具有最高的6种目标成分总量(30.24 mg/g DM),与SUÁREZ等[31]报道的30.87~47.28 mg/g DM结果接近,但显著低于MAKORI等[30]研究的Yuzi 7号品种的结果(72.61 mg/g DM)。此外,不同产地甘薯叶中5种酚酸和异槲皮苷的含量差异较大,其中产地为南昌南昌县和宜春丰城市的甘薯叶样品中的酚酸和异槲皮苷较高,前者含有最高的异槲皮苷含量,后者的绿原酸、3,5二咖啡酰奎宁酸、4,5-二咖啡酰奎宁酸含量最高,但两者的咖啡酸及3,4-二咖啡酰奎宁酸含量不存在显著性差异(P>0.05),这可能是由甘薯叶的栽培环境(降水量、气温、光照、土壤肥力等)及栽培方式等差异多因素引起的[32-33],以上表明在后续甘薯叶生物活性研究和高值化利用实验中,可优先考虑江西南昌南昌县和宜春丰城市的甘薯叶资源。
表 3 不同产地甘薯叶中5种酚酸和异槲皮苷的含量Table 3. Contents of five phenolic acids and isoquercitrin of sweet potato leaves from different areas样品产地 样品含量(mg/g DM) 咖啡酸 绿原酸 3,4-二咖啡酰奎宁酸 3,5-二咖啡酰奎宁酸 4,5-二咖啡酰奎宁酸 异槲皮苷 总计含量 产地1 0.29±
0.02cd0.68±
0.09a1.55±
0.19b8.25±
0.32d2.73±
0.39c0.63±
0.04c14.13 产地2 0.22±
0.01b1.10±
0.12bc1.52±
0.18b8.34±
0.30d2.73±
0.26c0.67±
0.03c14.58 产地3 0.24±
0.02bc1.65±
0.14de0.61±
0.05a8.16±
0.32d0.99±
0.05a0.44±
0.02b12.09 产地4 0.51±
0.04f2.99±
0.18g3.04±
0.33d18.25±
0.20f4.49±
0.28e0.96±
0.04e30.24 产地5 0.19±
0.02b0.86±
0.10ab2.26±
0.23c3.27±
0.19a1.97±
0.10b1.03±
0.05e9.59 产地6 0.31±
0.02d1.89±
0.17e0.35±
0.02a5.40±
0.20b1.85±
0.10b0.32±
0.01a10.15 产地7 0.12±
0.01a2.73±
0.14g0.23±
0.01a4.75±
0.20b1.22±
0.08a0.40±
0.01ab9.45 产地8 0.53±
0.03f2.42±
0.12f3.33±
0.25d12.31±
0.43e3.86±
0.43d1.34±
0.07f23.79 产地9 0.44±
0.02e1.86±
0.16e2.31±
0.22c4.91±
0.20b0.85±
0.04a0.82±
0.03d11.19 产地10 0.41±
0.02e1.36±
0.12cd2.02±
0.18c7.47±
0.30c1.29±
0.09a0.62±
0.02c13.17 注:产地1:吉安新干县;产地2:吉安吉安县;产地3:新余渝水区;产地4:宜春丰城市;产地5:宜春袁州区;产地6:上饶横峰县;产地7:鹰潭贵溪市;产地8:南昌南昌县;产地9:景德镇浮梁县;产地10:九江永修县。同列不同小写字母表示样品间差异显著(P<0.05)。 3. 结论
建立了HPLC同时检测甘薯叶中咖啡酸、绿原酸、3,4-二咖啡酰奎宁酸、3,5-二咖啡酰奎宁酸、4,5-二咖啡酰奎宁酸和异槲皮苷的方法,通过对HPLC条件的选择和优化,得到的最优分析条件为:ZORBAX SB-C18(250 mm×4.6 mm, 5 μm)为分析柱;以0.1%甲酸/水溶液(A)和乙腈(B)为流动相;检测波长为326 nm;梯度洗脱(0~12 min, 10%~25%B;12~18 min, 25%B);柱温为30 ℃。该条件下甘薯叶中5种酚酸和异槲皮苷在18 min内能够完全分离,线性关系、灵敏度、精密度、稳定性和重复性好,且平均加标回收率在95.14%~103.22%之间。对江西10个不同产地的甘薯叶分析发现同一品种不同产地目标成分含量差异很大,南昌市南昌县和宜春市丰城市的甘薯叶具有较高的酚酸和异槲皮苷含量。研究结果可为甘薯叶中酚酸和黄酮类化合物的定性定量分析提供技术参考,同时为甘薯叶资源的高效开发与利用提供一定的指导。
-
表 1 5种酚酸和异槲皮苷的线性范围、标准曲线、决定系数、检出限及定量限(n=7)
Table 1 Linear range, standard curve, determination coefficient, detection limit and quantification limit of five phenolic acids and isoquercitrin (n=7)
化合物 线性范围(μg/mL) 标准曲线 决定系数(R2) 检出限(μg/g DM) 定量限(μg/g DM) 咖啡酸 0.25~25.0 Y=67793X−18215 0.9997 0.9 3.0 绿原酸 0.5~50.0 Y=37913X−21415 0.9996 4.3 14.2 3,4-二咖啡酰奎宁酸 5.0~100.0 Y=40131X−105662 0.9980 11.6 38.6 3,5-二咖啡酰奎宁酸 10.0~200.0 Y=25927−110983 0.9985 18.4 61.2 4,5-二咖啡酰奎宁酸 5.0~100.0 Y=44641X−81094 0.9980 12.8 42.6 异槲皮苷 0.5~50.0 Y=18595X−14879 0.9991 12.6 41.9 表 2 5种酚酸和异槲皮苷的加标回收率结果
Table 2 The recovery results of five phenolic acids and isoquercitrin determined
化合物 样品中含量
(μg/g DM)加入量
(μg/g DM)测得总量平均值
(μg/g DM)平均回收
率(%)RSD
(%)咖啡酸 529 420 939 97.62 1.8 525 1058 100.76 1.1 630 1128.4 95.14 1.0 绿原酸 2416 1900 4310.3 99.70 1.6 2400 4784 98.67 1.8 2900 5247 97.62 1.4 3,4-二咖啡
酰奎宁酸3332 2650 6017 101.32 2.6 3350 6790 103.22 3.0 4000 7426.4 102.36 2.4 3,5-二咖啡
酰奎宁酸12312 9850 21933.5 97.68 2.0 12300 24272.5 97.24 2.9 14800 27058.7 99.64 1.7 4,5-二咖啡
酰奎宁酸3857 3100 6895.7 98.02 3.0 3850 7580.5 96.71 2.9 4650 8407.5 95.91 1.6 异槲皮苷 1340 1050 2361 97.24 1.6 1340 2628.3 96.14 2.3 1600 2874.5 95.91 1.1 表 3 不同产地甘薯叶中5种酚酸和异槲皮苷的含量
Table 3 Contents of five phenolic acids and isoquercitrin of sweet potato leaves from different areas
样品产地 样品含量(mg/g DM) 咖啡酸 绿原酸 3,4-二咖啡酰奎宁酸 3,5-二咖啡酰奎宁酸 4,5-二咖啡酰奎宁酸 异槲皮苷 总计含量 产地1 0.29±
0.02cd0.68±
0.09a1.55±
0.19b8.25±
0.32d2.73±
0.39c0.63±
0.04c14.13 产地2 0.22±
0.01b1.10±
0.12bc1.52±
0.18b8.34±
0.30d2.73±
0.26c0.67±
0.03c14.58 产地3 0.24±
0.02bc1.65±
0.14de0.61±
0.05a8.16±
0.32d0.99±
0.05a0.44±
0.02b12.09 产地4 0.51±
0.04f2.99±
0.18g3.04±
0.33d18.25±
0.20f4.49±
0.28e0.96±
0.04e30.24 产地5 0.19±
0.02b0.86±
0.10ab2.26±
0.23c3.27±
0.19a1.97±
0.10b1.03±
0.05e9.59 产地6 0.31±
0.02d1.89±
0.17e0.35±
0.02a5.40±
0.20b1.85±
0.10b0.32±
0.01a10.15 产地7 0.12±
0.01a2.73±
0.14g0.23±
0.01a4.75±
0.20b1.22±
0.08a0.40±
0.01ab9.45 产地8 0.53±
0.03f2.42±
0.12f3.33±
0.25d12.31±
0.43e3.86±
0.43d1.34±
0.07f23.79 产地9 0.44±
0.02e1.86±
0.16e2.31±
0.22c4.91±
0.20b0.85±
0.04a0.82±
0.03d11.19 产地10 0.41±
0.02e1.36±
0.12cd2.02±
0.18c7.47±
0.30c1.29±
0.09a0.62±
0.02c13.17 注:产地1:吉安新干县;产地2:吉安吉安县;产地3:新余渝水区;产地4:宜春丰城市;产地5:宜春袁州区;产地6:上饶横峰县;产地7:鹰潭贵溪市;产地8:南昌南昌县;产地9:景德镇浮梁县;产地10:九江永修县。同列不同小写字母表示样品间差异显著(P<0.05)。 -
[1] NGUYEN H C, CHEN C C, LIN K H, et al. Bioactive compounds, antioxidants, and health benefits of sweet potato leaves[J]. Molecules,2021,26(7):1820. doi: 10.3390/molecules26071820
[2] JANG Y, KOH E. Antioxidant content and activity in leaves and petioles of six sweet potato (Ipomoea batatas L.) and antioxidant properties of blanched leaves[J]. Food Science and Biotechnology,2019,28(2):337−345. doi: 10.1007/s10068-018-0481-3
[3] TAIRA J, UEHARA M, TSUCHIDA E, et al. Inhibition of the β-catenin/Tcf signaling by caffeoylquinic acids in sweet potato leaf through down regulation of the Tcf-4 transcription[J]. Journal of Agricultural and Food Chemistry,2014,62(1):167−172. doi: 10.1021/jf404411r
[4] LUO D, MU T H, SUN H N. Profiling of phenolic acids and flavonoids in sweet potato (Ipomoea batatas L.) leaves and evaluation of their anti-oxidant and hypoglycemic activities[J]. Food Bioscience,2021,39:100801. doi: 10.1016/j.fbio.2020.100801
[5] NTCHAPDA F, TCHATCHOUANG F C, MIAFFO D, et al. Hypolipidemic and anti-atherosclerogenic effects of aqueous extract of Ipomoea batatas leaves in diet-induced hypercholesterolemic rats[J]. Journal of Integrative Medicine,2021,19(3):243−250. doi: 10.1016/j.joim.2021.02.002
[6] ISHIDA H, SUZUNO H, SUGIYAMA N, et al. Nutritive evaluation on chemical components of leaves, stalks and stems of sweet potatoes (Ipomoea batatas poir)[J]. Food Chemistry,2000,68(3):359−367. doi: 10.1016/S0308-8146(99)00206-X
[7] CHEN Y, FU Z F, TU Z C, et al. Influence of in vitro gastrointestinal digestion on the bioavailability and antioxidant activity of polyphenols from Ipomoea batatas leaves[J]. International Journal of Food Science & Technology,2017,52(5):1131−1137.
[8] ZHANG C C, LIU D Q, WU L H, et al. Chemical characterization and antioxidant properties of ethanolic extract and its fractions from sweet potato (Ipomoea batatas L.) leaves[J]. Foods,2019,9(1):15. doi: 10.3390/foods9010015
[9] NAVEED M, HEJAZI V, ABBAS M, et al. Chlorogenic acid (CGA): A pharmacological review and call for further research[J]. Biomedicine & Pharmacotherapy,2018,97:67−74.
[10] CHEN S, LIU J, DONG G Q, et al. Flavonoids and caffeoylquinic acids in Chrysanthemum morifolium Ramat flowers: A potentially rich source of bioactive compounds[J]. Food Chemistry,2021,344:128733. doi: 10.1016/j.foodchem.2020.128733
[11] LIAN W W, DU G H. Caffeic acid[M]//Natural small molecule drugs from plants. Springer, Singapore, 2018: 19−23.
[12] LI C, TAN F, YANG J J, et al. Antioxidant effects of Apocynum venetum tea extracts on D-galactose-induced aging model in mice[J]. Antioxidants,2019,8(9):381. doi: 10.3390/antiox8090381
[13] STASZOWSKA-KARKUT M, MATERSKA M. Phenolic composition, mineral content, and beneficial bioactivities of leaf extracts from black currant (Ribes nigrum L.), raspberry (Rubus idaeus), and aronia (Aronia melanocarpa)[J]. Nutrients,2020,12(2):463. doi: 10.3390/nu12020463
[14] EL-HAWARY S S, MOHAMMED R, EL-DIN M E, et al. Comparative phytochemical analysis of five Egyptian strawberry cultivars (Fragaria×ananassa Duch.) and antidiabetic potential of festival and red merlin cultivars[J]. RSC Advances,2021,11(27):16755−16767. doi: 10.1039/D0RA10748D
[15] FU Z F, TU Z C, ZHANG L, et al. Antioxidant activities and polyphenols of sweet potato (Ipomoea batatas L.) leaves extracted with solvents of various polarities[J]. Food Bioscience,2016,15:11−18. doi: 10.1016/j.fbio.2016.04.004
[16] WAY M L, JONES J E, NICHOLS D S, et al. A comparison of laboratory analysis methods for total phenolic content of cider[J]. Beverages,2020,6(3):55. doi: 10.3390/beverages6030055
[17] BAE I K, HAM H M, JEONG M H, et al. Simultaneous determination of 15 phenolic compounds and caffeine in teas and mate using RP-HPLC/UV detection: Method development and optimization of extraction process[J]. Food Chemistry,2015,172:469−475. doi: 10.1016/j.foodchem.2014.09.050
[18] RUSSO M, FANALI C, TRIPODO G, et al. Analysis of phenolic compounds in different parts of pomegranate (Punica granatum) fruit by HPLC-PDA-ESI/MS and evaluation of their antioxidant activity: Application to different Italian varieties[J]. Analytical and Bioanalytical Chemistry,2018,410(15):3507−3520. doi: 10.1007/s00216-018-0854-8
[19] MUSTAFA A M, ANGELONI S, ABOUELENEIN D, et al. A new HPLC-MS/MS method for the simultaneous determination of 36 polyphenols in blueberry, strawberry and their commercial products and determination of antioxidant activity[J]. Food Chemistry,2022,367:130743. doi: 10.1016/j.foodchem.2021.130743
[20] 钟伟. 红薯叶中多酚类物质的抗氧化及抗肿瘤细胞增殖作用研究[D]. 广州: 华南理工大学, 2015 ZHONG W. Research evaluation of antioxidant and antitumour activities of Ipomoea batatas leaves[D]. Guangzhou: South China University of Technology, 2015
[21] Q2 (R1) Validation of analytical procedures: Text and methodology[S].2005.
[22] 覃日宏, 陈汝旭, 盘涌, 等. HPLC法同时测定五指毛桃中6个黄酮类成分的含量[J]. 药物分析杂志,2020,40(12):2244−2249. [QIN R H, CHEN R X, PAN Y, et al. Simultaneous determination of six flavonoids in Ficushirta Vahl. by HPLC[J]. Chinese Journal of Pharmaceutical Analysis,2020,40(12):2244−2249. doi: 10.16155/j.0254-1793.2020.12.19 [23] TSOLMON B, FANG Y, YANG T, et al. Structural identification and UPLC-ESI-QTOF-MS-MS analysis of flavonoids in the aquatic plant Landoltia punctata and their in vitro and in vivo antioxidant activities[J]. Food Chemistry,2021,343:128392. doi: 10.1016/j.foodchem.2020.128392
[24] LIU J, MU T H, SUN H N, et al. Optimization of ultrasonic-microwave synergistic extraction of flavonoids from sweet potato leaves by response surface methodology[J]. Journal of Food Processing and Preservation,2019,43(5):e13928. doi: 10.1111/jfpp.13928
[25] 马帅, 王纪华, 高媛, 等. 超高效液相色谱-串联质谱法同时测定5个产地花椰菜和西兰花中的23种酚酸类化合物[J]. 食品科学,2018,39(4):176−187. [MA S, WANG J H, GAO Y, et al. Simultaneous determination of twenty-three phenolic acids in Cauliflower (Brassica oleracea L. var. botrytis L.) and Broccoli (B. oleracea L. var. italica) from five producing places by ultra performance liquid chromatography-tandem mass spectrometry[J]. Food Science,2018,39(4):176−187. doi: 10.7506/spkx1002-6630-201804027 [26] ZHANG A, WAN L, WU C Y, et al. Simultaneous determination of 14 phenolic compounds in grape canes by HPLC-DAD-UV using wavelength switching detection[J]. Molecules,2013,18(11):14241−14257. doi: 10.3390/molecules181114241
[27] HUANG R T, LU Y F, INBARAJ B S, et al. Determination of phenolic acids and flavonoids in Rhinacanthus nasutus (L.) kurz by high-performance-liquid-chromatography with photodiode-array detection and tandem mass spectrometry[J]. Journal of Functional Foods,2015,12:498−508. doi: 10.1016/j.jff.2014.12.002
[28] 段云飞, 吴光斌, 叶洪, 等. HPLC法同时测定采后莲雾果实7种有机酸的含量[J]. 食品科学,2021,42(4):175−180. [DUAN Y F, WU G B, YE H, et al. Simultaneous determination of seven organic acids in wax apple (Syzygium samarangenese [Blume] Merrill & L. M. Perry) fruit during postharvest storage by high performance liquid chromatography[J]. Food Science,2021,42(4):175−180. doi: 10.7506/spkx1002-6630-20191025-287 [29] 朱亚珠. 甘薯叶中咖啡酰奎尼酸类物质的分离纯化和高效液相色谱法分析[J]. 食品工业科技,2015,36(10):73−77. [ZHU Y Z. Purification of caffeoylquinic acids from sweet potato leaves and their analysis by high performance liquid chromatography[J]. Science and Technology of Food Industry,2015,36(10):73−77. doi: 10.13386/j.issn1002-0306.2015.10.006 [30] MAKORI S I, MU T H, SUN H N. Total polyphenol content, antioxidant activity, and individual phenolic composition of different edible parts of 4 sweet potato cultivars[J]. Natural Product Communications, 2020, 15(7): 1934578X20936931.
[31] SUÁREZ S, MU T H, SUN H N, et al. Antioxidant activity, nutritional, and phenolic composition of sweet potato leaves as affected by harvesting period[J]. International Journal of Food Properties,2020,23(1):178−188. doi: 10.1080/10942912.2020.1716796
[32] XIANG G, YANG H Y, YANG L, et al. Multivariate statistical analysis of tobacco of different origin, grade and variety according to polyphenols and organic acids[J]. Microchemical Journal,2010,95(2):198−206. doi: 10.1016/j.microc.2009.12.001
[33] ZHANG D Y, WAN Y, HAO J Y, et al. Evaluation of the alkaloid, polyphenols, and antioxidant contents of various mulberry cultivars from different planting areas in eastern China[J]. Industrial Crops and Products,2018,122:298−307. doi: 10.1016/j.indcrop.2018.05.065
-
期刊类型引用(1)
1. 黄秋颜,李斌,林晓蓉,鲁森,陈忠正,张媛媛. 基于高分辨质谱和网络药理学的可可茶多酚降血糖活性研究. 食品与机械. 2023(09): 4-11 .  百度学术
百度学术
其他类型引用(1)






 下载:
下载:

 下载:
下载:



