Determination of Chlorantraniliprole, Flubendiamide and 2-Methyl-4-chlorophenoxyacetic Acid Residues in Milk by Ultra Performance Liquid Chromatography-tandem Mass Spectrometry
-
摘要: 目的:建立了一种牛乳中氯虫苯甲酰胺、氟苯虫酰胺和2甲4氯的超高效液相色谱-串联质谱(UPLC-MS/MS)检测方法。方法:样品经乙腈提取,氯化钠盐析,正己烷除脂,两步低温冷冻离心净化;采用Acquity UPLC BEH C18柱(50 mm×2.1 mm(i.d.),1.7 μm)色谱柱分离,以乙腈和0.1%甲酸水溶液为流动相进行梯度洗脱;采用电喷雾电离源,正负离子切换模式扫描,多反应监测模式,以基质标准曲线外标法进行定量。结果:三种农药在10~150 ng/mL范围内线性关系良好(R2>0.999)。分别在5.0、10.0和50.0 μg/kg添加水平进行添加回收实验,三种农药的平均回收率在73.3%~117.3%之间,相对标准偏差在1.0%~5.9%之间(n=6);方法的检出限(S/N≥3)和定量限(S/N≥10)分别为1.0、5.0 μg/kg。结论:本方法简便、准确、灵敏,适用于牛乳中氯虫苯甲酰胺、氟苯虫酰胺和2甲4氯的同时测定。
-
关键词:
- 超高效液相色谱-串联质谱 /
- 双酰胺类农药 /
- 2甲4氯 /
- 牛乳 /
- 残留
Abstract: Objective: A method was developed for the determination of chlorantraniliprole, flubendiamide and 2-methyl-4-chlorophenoxyacetic acid in milk by ultra performance liquid chromatography-tandemmass spectrometry (UPLC-MS/MS). Methods: The samples were extracted by acetonitrile, salted out by sodium chloride, degreased by n-hexane and purified by two-step cryogenic centrifugation. The analytes were separated by Waters Acquity UPLC BEH C18 chromatographic column. The mobile phase was eluted with a gradient of acetonitrile and 0.1% formic acid aqueous solution. The detection was carried out with electrospray ion source, positive and negative ion switching, scanning mode and the quantification was accomplished by external standard method of matrix standard curve. Results: The three pesticides showed a good linear relationship (R2>0.999) in the range of 10~150 ng/mL. With the addition of 5.0, 10.0 and 50.0 μg/kg in the standard recovery experiment, the recoveries were 73.3%~117.3% and the relative standard deviations were 1.0%~5.9% (n=6). The detection limits (S/N≥3) and the limit of quantification of the method (S/N≥10) were 1.0 and 5.0 μg/kg, respectively. Conclusion: This method is simple, accurate and sensitive, which is suitable for simultaneous determination of chlorfenoxamide, fluorofenoxamide and 2-methyl-4-chlorophenoxyacetic acid residues in milk. -
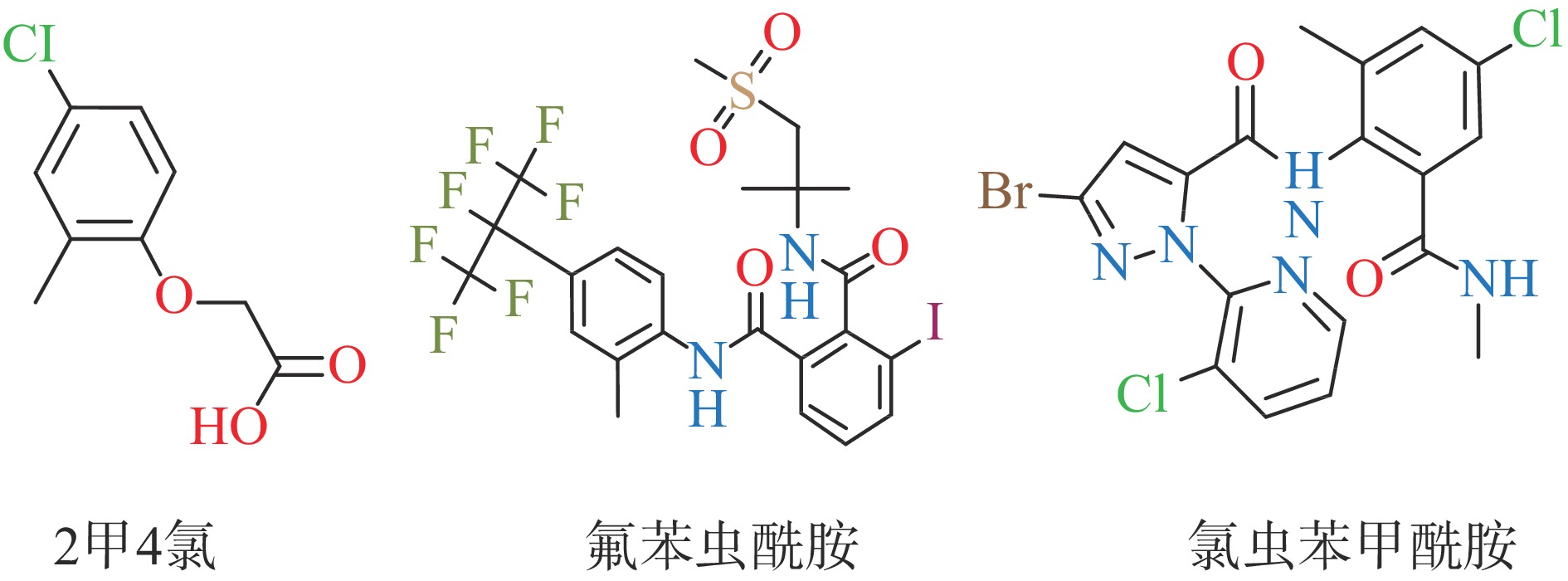
农药主要包括除草剂、杀虫剂和杀菌剂三大种类,其中杀虫剂和除草剂应用最广。目前除草剂、杀虫剂在农作物生产过程发挥着重要作用,保证农作物的产量和质量的同时,也带来农药残留问题。由于除草剂和杀虫剂的广泛、长期和违规使用,对人类健康的影响和对环境的危害已成人们日益关注的话题[1-2]。氯虫苯甲酰胺和氟苯虫酰胺属于新型双酰胺类杀虫剂,以毒性低、杀虫效果好、对环境友好的优势受到用户认可,使用量逐年增加[3]。人长期接触双酰胺类农药时,会伤害人的眼睛[4-5]和呼吸系统[6-7]。2甲4氯属于苯氧羧酸类除草剂,作为一种高效的除草剂,在防除杂草有效性上具有优良效果,被广泛、持续地应用于防除不同作物中杂草,但是存在生物毒性强、易迁移累积等缺点[8]。当人大量接触或摄入2甲4氯会造成人体的肾、肝损伤,迟发性神经衰弱,甚至会引起胎儿泌尿生殖系统畸形,直接威胁人体健康[9-10]。我国GB 2763-2021《食品安全国家标准 食品中农药最大残留限量》规定了生乳中氯虫苯甲酰胺、氟苯虫酰胺、2甲4氯的临时限量分别为0.05、0.1和0.04 mg/kg[11],说明三种农药在生乳中存在较高风险。因此,随着牛乳需求量日益增加,且牛乳中可能存在杀虫剂和除草剂残留共存的风险,开展牛乳中氯虫苯甲酰胺、氟苯虫酰胺、2甲4氯的残留的检测技术研究,规范用药,保障食品安全,迫在眉睫。三种农药的结构式如图1所示。
目前报道的氯虫苯甲酰胺和氟苯虫酰胺的检测方法主要有超高效液相色谱-串联质谱法[12-19]、液相色谱法[20-21]和气相色谱-串联质谱法[22];2甲4氯的检测方法主要有液相色谱法[8, 23-25]、气相色谱-串联质谱法[26]、超高效液相色谱-串联质谱法[27-32],这些方法的净化方式主要集中在固相萃取法[8, 13, 21, 30-31]和QuEChERS法[3, 17, 20-22]。固相萃取法存在操作复杂、检测成本高、重复性差等缺点;QuEChERS法是农药残留检测主流的净化技术,净化填料种类较多,如N-丙基乙二胺(PSA)、十八烷基硅烷键合硅胶(C18)和石墨化碳黑(GCB)等,通常需要优化填料的组合与用量才能满足牛乳等复杂基质的检测需求,筛选过程时间长,甚至无法得到满意的填料组合。双酰胺类杀虫剂和苯氧羧酸类除草剂的检测方法有很多相似之处,但是尚未见到同时检测的相关报道。本研究通过对前处理与仪器条件优化,基于两步低温高速离心净化技术,结合超高效液相色谱质谱联用仪,以期建立一种适用于同时检测牛乳中2种双酰胺类农药和2甲4氯的方法。
1. 材料与方法
1.1 材料与仪器
牛乳 市售;三种化合物标准品(氯虫苯甲酰胺、2甲4氯、氟苯虫酰胺) 购自坛墨质检科技股份有限公司;乙二胺-N-丙基硅烷(PSA,40~60 µm)、十八烷基硅烷键合硅胶(C18,40~60 µm)、石墨化炭黑(GCB,40~120 µm) 美国Aglent公司;HLB固相萃取小柱(6 cc,200 mg) 美国Waters公司;聚四氟乙烯微孔滤膜(0.22 µm) 上海安谱实验科技股份有限公司;乙腈、甲酸 色谱纯,上海安谱实验科技股份有限公司;NaCl 分析纯,上海国药集团化学试剂有限公司。
ACQUITY UPLC TQS超高效液相色谱-质谱联用仪,配有电喷雾离子源(ESI) 美国Waters公司;ST16R高速冷冻离心机 美国Thermo Fisher公司;S25旋涡振荡器 德国IKA公司;ME2002E分析天平 梅特勒公司;Millipore Q纯水机 美国Millipore公司。
1.2 实验方法
1.2.1 样品的前处理
称取5 g均质牛乳(精确至0.1 mg)于30 mL离心管中,加入10 mL乙腈,以1500 r/min 涡旋提取5 min,加入氯化钠2.0 g后迅速摇散,再次涡旋振荡5 min,以15000 r/min,在0 ℃下离心10 min。准确移取5 mL上层清液于塑料离心管中,40 ℃下氮气吹至近干,加入1 mL乙腈涡旋复溶,转移至1.5 mL离心管中,加入0.5 mL正己烷,涡旋混匀后,0 ℃下以23000 r/min离心5 min。取上清液通过0.22 μm微孔滤膜后,收集于塑料进样小瓶中,供超高效液相色谱-串联质谱检测。
1.2.2 标准品溶液配制
混合标准储备溶液(1 μg/mL):分别准确吸取氯虫苯甲酰胺、2甲4氯和氟苯虫酰胺标准品(质量浓度为100 μg/mL)各0.1 mL至10 mL容量瓶中,乙腈定容至刻度线,于−18 ℃避光保存。
混合标准中间溶液(100 ng/mL):准确吸取混合标准储备溶液1.0 mL至10 mL容量瓶中,乙腈定容至刻度线,于4 ℃冷藏保存。
吸取适量混合标准中间溶液,临用稀释配制合适浓度的系列标准工作溶液。
1.2.3 色谱条件
1.2.3.1 液相条件
色谱柱:Acquity UPLC BEH C18柱(50 mm×2.1 mm(i.d.),1.7 μm);柱温40 ℃;进样量1 μL;流速0.3 mL/min;流动相A为0.1%甲酸水溶液,B为乙腈;梯度洗脱程序见表1。
表 1 梯度洗脱程序Table 1. Gradient elution procedure时间
(min)流速
(mL/min)体积分数(%) A 0.1%甲酸水溶液 B 乙腈 0.00 0.30 80 20 2.00 0.30 50 50 4.00 0.30 5 95 4.01 0.30 0 100 5.00 0.30 0 100 6.00 0.30 80 20 1.2.3.2 MS/MS条件
采用电喷雾离子源(ESI),多反应监测(MRM)模式下进行正、负离子交换扫描模式进行数据采集;为了保证仪器有最佳的响应,参数设置如下:离子源温度:150 ℃,毛细管电压:3.0 kV,脱溶剂气流量:1000 L/Hr,碰撞室气流:0.15 mL/min,脱溶剂温度:500 ℃。
1.2.4 定性定量方法
1.2.4.1 定性方法
按照上述条件测定试样和标准工作溶液,如果试样中的色谱峰保留时间与标准工作溶液一致(变化范围在±2.5%之内),样品中目标化合物的两个子离子的相对丰度与浓度相当标准溶液的相对丰度一致(相对丰度偏差不超过表2的规定),则可判断样品中存在目标化合物。
表 2 定性离子相对丰度的最大允许偏差Table 2. Maximum allowable deviation of relative abundance of qualitative ions for analytes相对离子丰度 >50% >20%至50% >10%至20% ≤10% 允许的相对偏差 ±20% ±25% ±30% ±50% 1.2.4.2 定量方法
样品中氯虫苯甲酰胺、氟苯虫酰胺、2甲4氯的结果按式(1)计算:
(1) 式中:X:试样中被测物残留量,μg/kg;C:试样上机溶液中被测物残留量,ng/mL;V:样液最终定容体积,mL;n:稀释倍数;m:试样质量,g;计算结果需扣除空白值。
1.3 数据处理
UPLC-MS/MS数据采集使用Waters TQS MassLynx软件,处理数据和绘图采用Excel软件。所有实验均重复两次,结果以平均值±RSD表示。
2. 结果与分析
2.1 质谱条件的选择
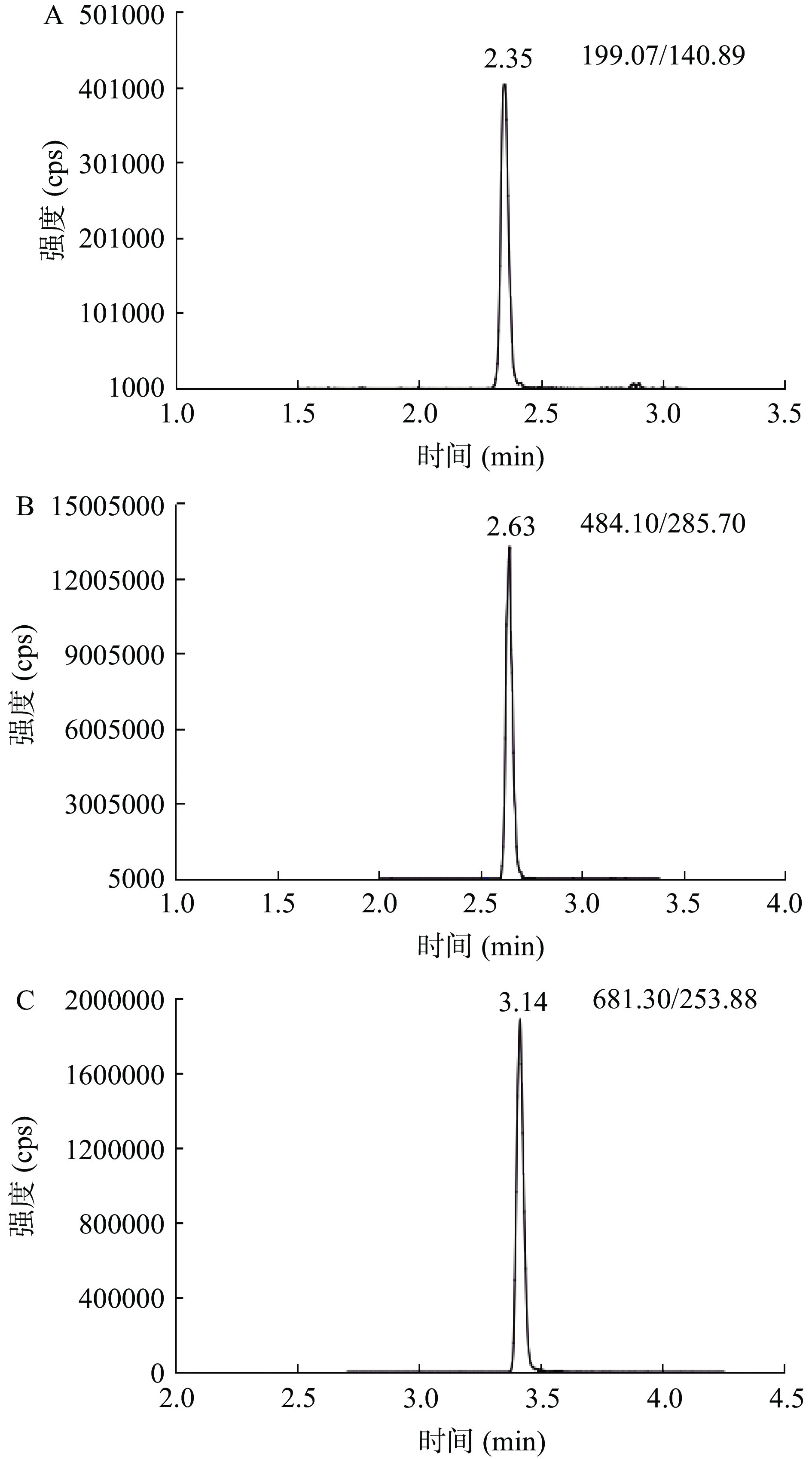
首先,优化毛细管电压、锥孔电压、碰撞电压等仪器基础参数,得到目标化合物的定量离子对和定性离子对。为了提高方法的灵敏度,分别在正、负离子模式下考察氯虫苯甲酰胺、2甲4氯、氟苯虫酰胺的灵敏度。结果表明,在负离子模式下氟苯虫酰胺、2甲4氯具有较高的响应,而氯虫苯甲酰胺响应较低。由于在不同离子模式下三种农药的响应变化较大,所以本研究选择正负离子交替扫描模式。在不同模式下毛细管电压、锥孔电压、源温、脱溶剂温度、脱溶剂气流量、碰撞室气流量等质谱参数均保持一致,保证仪器稳定性,减少因模式切换的时间延误影响实际的化合物扫描时间。图2代表三种化合物的提取离子流色谱图。采用一针进样完成三种农药检测,三种化合物的质谱参数如表3。
表 3 化合物的质谱参数Table 3. Mass parameters for detection for analytes化合物 保留时间(min) 锥孔电压(V) 离子对1 离子对2 子离子
(m/z)碰撞电压(V) 子离子
(m/z)碰撞电压(V) 2甲4氯 2.35 33 199.07/140.89* 18 201.08/142.88 18 氯虫苯甲酰胺 2.63 30 484.10/285.70* 14 484.10/453.00 20 氟苯虫酰胺 3.14 35 681.30/253.88* 30 681.30/273.91 16 注:“*”表示定量离子对。 2.2 前处理条件的优化
2.2.1 提取溶剂的选择
氯虫苯甲酰胺、氟苯虫酰胺、2甲4氯均属于中等极性的化合物,在乙腈中具有很好的溶解性。乙腈可以沉淀乳蛋白,同时对脂肪、糖分等非极性成分提取效率极低,去除效果更好[33],选择乙腈作为提取试剂。为了进一步提高目标物的提取效率,在乙腈中加入相分离引发剂氯化钠。盐的加入产生强烈的水化作用,盐束缚了更多的水分子,使溶于乙腈中的水分含量降低,导致水相与有机相分离,从而使溶解在水相中的物质在相分离过程中而被转移到乙腈相中。所以最终选择先乙腈提取目标物,再利用盐析作用进一步萃取目标物。
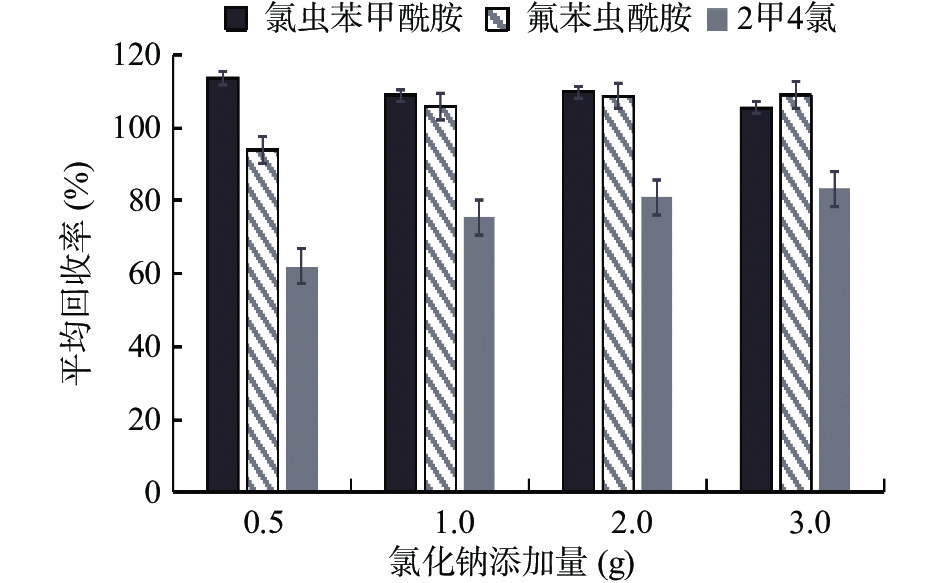
按照1.2.1条件考察氯化钠的不同添加量对氯虫苯甲酰胺、氟苯虫酰胺、2甲4氯回收率的影响。当不添加氯化钠添时,乙腈与水分层不明显,不利于上清液有机相的移取进行氮吹浓缩。加入氯化钠后,两相分离逐渐明显,2甲4氯的回收率偏低,结果如图3所示。考虑到2甲4氯钠盐水溶性强,通过优化氯化钠的使用量来提高回收率。随着氯化钠的添加量增加,氯虫苯甲酰胺的回收率呈下降趋势,而氟苯虫酰胺、2甲4氯的回收率呈上升趋势。当氯化钠的使用量达到2.0 g时,氯虫苯甲酰胺回收率为109.8%,氟苯虫酰胺的回收率为108.7%,2甲4氯的回收率为81.0%;当继续增大氯化钠的添加量时,三种农药的回收率均没有明显的变化。因此本研究最终选择氯化钠适宜的添加量为2.0 g。
2.2.2 低温离心的温度与速度控制
由于牛乳中脂肪、蛋白等成分较多,LC-MS/MS检测时受基质效应影响较大,需进一步净化减小其他成分对目标化合物的影响。
本研究考察了在15000 r/min条件下0、4、25 ℃三个温度的离心效果。结果表明,25 ℃时因脂肪、蛋白等杂质不能完全溶出,分离效果不好;此外,0和4 ℃时样液和杂质的分离效果较好,但是4 ℃离心后的试样经二次离心后脂肪层仍较厚,不利于上机样液的移取,所以选择0 ℃作为本方法的离心温度。研究结果同时表明离心速度分别为10000和15000 r/min时,虽然提取效率没有明显的变化,但是10000 r/min离心后的试样经二次离心后脂肪层较厚,同样不利于上机样液的移取,因此试样提取时选择离心转速为15000 r/min。
为了达到最佳的净化效果,减少基质对结果的影响,考察了在0 ℃下15000、20000、23000 r/min三个速度下去除脂肪的净化效果。研究结果表明,15000、20000 r/min离心后,提取出的脂肪层不紧实,在移取下层试样时脂肪层易被破坏,还需二次处理;当离心速度为23000 r/min时,脂肪层不易被破坏,有利于移取下层试样。所以正己烷除脂肪时选择离心速度为23000 r/min。
2.2.3 净化方式的选取
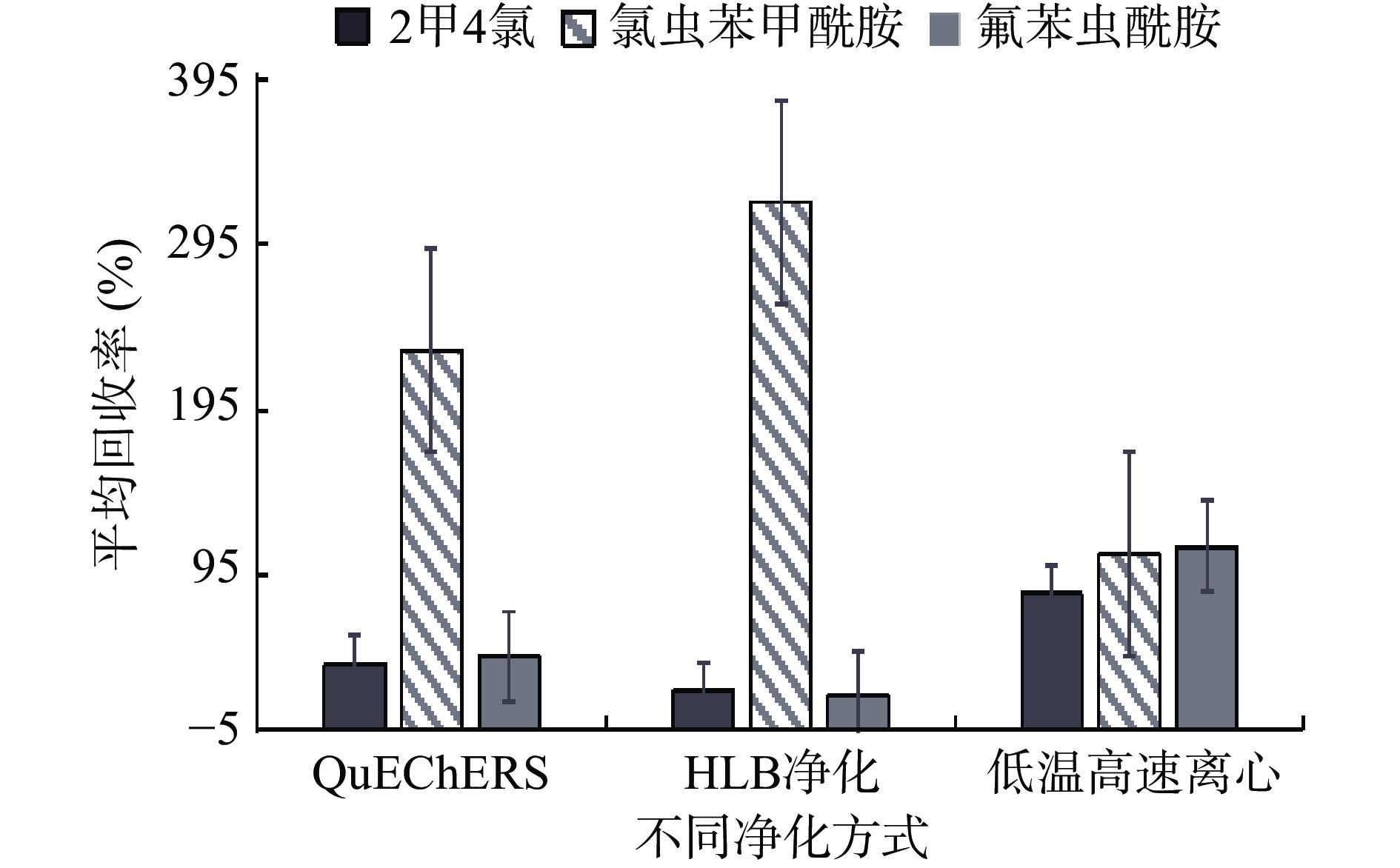
本研究考察了QuEChERS法、固相萃取法(HLB柱)、低温高速离心三种净化方式对目标化合物的回收率影响。实验证明,通过QuEChERS进行回收率实验时,氯虫苯甲酰胺平均回收率231.3%,氟苯虫酰胺平均回收率为45%,2甲4氯平均回收率为39.9%,三种化合物的回收率不符合定量要求;通过固相萃取法(HLB柱)净化时,氯虫苯甲酰胺平均回收率为320.8%,2甲4氯平均回收率为24.4%,氟苯虫酰胺平均回收率为21.3%,3种化合物的回收率同样不符合定量要求,这与填料对大部分中等极性农药有基质增强或者抑制效应有关;通过高速低温离心净化后,氯虫苯甲酰胺平均回收率为107%,氟苯虫酰胺平均回收率为117%,2甲4氯平均回收率为83%,如图4所示,符合定量检测的要求,实现低成本高效率的检测目标。
2.2.4 氮吹管材质的选择
本研究考察了玻璃氮吹管、塑料离心管对氯虫苯甲酰胺、氟苯虫酰胺和2甲4氯回收率的影响(表4)。结果显示,无论使用玻璃氮吹管还是塑料离心管进行样液浓缩,在一定时间内(40 min)氯虫苯甲酰胺、氟苯虫酰胺的回收率没有明显变化,而使用玻璃氮吹管进行浓缩时2甲4氯的回收率最大达到60.1%,使用塑料离心管时2甲4氯的回收率可达到91.2%,因此本研究最终选择塑料离心管进行样液浓缩满足3种农药同时检测的需求。
表 4 不同氮吹管对化合物回收率的影响Table 4. Effects of different nitrogen blowing pipes on the recoveries for analytes耗材
属性氯虫苯甲酰胺 氟苯虫酰胺 2甲4氯 平均回收率
(%)RSD
(%)平均回收率
(%)RSD
(%)平均回收率
(%)RSD
(%)玻璃 109.9 1.3 105.7 3.2 60.1 2.5 塑料 102.6 1.8 103.7 2.4 91.2 3.9 2.3 基质效应评价
由于牛乳中含有大量磷脂、蛋白质、脂肪等成分,基质较复杂,存在基质效应。基质效应增强或抑制均会影响检测结果,有必要结合基质效应进行准确定量分析,保证检测结果的准确性。本研究使用标准曲线斜率比较法进行基质效应评价,标准曲线法优于单点或者多个点单独比较基质效应评价,更具有统计意义和代表性。基质标准曲线A:选择阴性空白样品,通过与其他样品完全相同的前处理方法得到净化液,配制浓度分别为10、20、50、100、150 ng/mL的混合标准曲线。溶剂标准曲线B:吸取适量混合标准中间溶液,临用前乙腈稀释配制浓度与基质标准曲线A相同的标准曲线,分别以质量浓度为横坐标(x),各农药对应的峰面积为纵坐标(y),得到各自的标准曲线。评价公式如下:
式中:a代表基质标准曲线的斜率;b代表溶剂标准曲线的斜率。若a/b>120%,则表示存在基质增强效应;若a/b<80%,则表示存在基质抑制效应;当a/b介于80%~120%时,基质干扰程度较低,结果可接受;当a/b<80%或a/b>120%,基质效应较大,结果不可接受,需要结合基质效应进行结果评价[34]。结果表明,2甲4氯基质效应为93%,氯虫苯甲酰胺基质效应为85%,二者可视为无基质效应;氟苯虫酰胺基质效应为132%,表现为基质增强。为消除基质效应,提高氟苯虫酰胺检测结果的准确性,配制基质标准曲线对检测结果进行校准。
2.4 方法评价
2.4.1 方法的线性范围、检出限与定量限
按照1.2.2所述方法处理后得到阴性样液稀释混合标准中间液,得到浓度依次为10、20、50、100、150 ng/mL系列基质混合标准品工作液。结果表明,在10~150 ng/mL范围内,三种农药的浓度与峰面积之间具有良好的线性关系,决定系数(R2)均大于0.999(见表5)。
表 5 化合物的线性方程、决定系数(R2)、检出限、定量限Table 5. Linear equations, determination coefficients (R2), LOD, LOQ for analytes化合物 线性范围
(ng/mL)线性方程 决定系数
(R2)检出限
(μg/kg)定量限
(μg/kg)2甲4氯 10~150 y=864.11x-359.82 0.9999 1.0 5.0 氯虫苯甲酰胺 10~150 y=8423.7x+9998.8 0.9998 氟苯虫酰胺 10~150 y=4229.9x+3235.2 0.9997 GB/T 27417-2017规定以不低于3倍信噪比峰高相应质量浓度为检出限、不小于10倍信噪比峰高相应质量浓度为定量限,同时采用添加法进行实际样品的检测,根据精密度和准确度(以RSD计)≤15%的要求确定合适的检出限和定量限。结果表明,2甲4氯、氯虫苯甲酰胺和氟苯虫酰胺的检出限均为1.0 μg/kg,定量限均为5.0 μg/kg。
2.4.2 准确度和精密度
本方法通过考察氯虫苯甲酰胺、氟苯虫酰胺和2甲4氯的回收率和相对标准偏差来评价方法的准确度和精密度。分别进行5.0、10.0、50.0 μg/kg加标回收率实验,每个梯度进行6平行检测,计算每个梯度的RSD。表6结果表明,三种农药的回收率为73.3%~117.3%,RSD为1.0%~5.9%,满足GB/T 27404-2008中关于回收率和精密度的要求,说明该方法具有较高的准确度和良好的重复性。
表 6 3种化合物的平均回收率和精密度Table 6. Average recoveries and precisions for three analytes化合物 添加量
(μg/kg)平均回收率
(%)RSD
(%)2甲4氯 5.0 73.3 2.3 10.0 79.0 1.2 50.0 73.8 1.0 氯虫苯甲酰胺 5.0 111.6 5.9 10.0 117.3 1.2 50.0 101.0 4.6 氟苯虫酰胺 5.0 112.7 5.4 10.0 110.4 4.4 50.0 106.4 4.2 2.5 实际样品测定
采用本方法对来自市售的15份牛乳和不同牧场的38份原奶进行检测,三种农药均未检出,说明牧场对牛乳中农药控制严格。
3. 结论
本实验通过优化氯化钠的添加量、低温高速离心的温度和速度等前处理条件,采用超高效液相色谱串联质谱法正负离子交替的模式对牛乳中2甲4氯、氯虫苯甲酰胺和氟苯虫酰胺的残留进行了快速、准确的定性与定量分析。采用加标回收试验结合基质标准曲线验证方法的准确性。实验结果表明,3种农药在10~150 ng/mL范围内线性关系良好,在5.0、10.0、50.0 μg/kg三个水平的回收率为73.3%~117.3%,RSD为1.0%~5.9%。采用所建立的方法对53份牛乳进行检测,均未检出氯虫苯甲酰胺、氟苯虫酰胺和2甲4氯的残留。该方法操作简单、结果准确、灵敏度高,有利于方法的实际应用推广,为牛乳中农药残留的标准研究和实际检测提供方法参考与补充,为牛乳中农药的使用与监管提供合理的依据,进一步保障牛乳质量安全。
-
表 1 梯度洗脱程序
Table 1 Gradient elution procedure
时间
(min)流速
(mL/min)体积分数(%) A 0.1%甲酸水溶液 B 乙腈 0.00 0.30 80 20 2.00 0.30 50 50 4.00 0.30 5 95 4.01 0.30 0 100 5.00 0.30 0 100 6.00 0.30 80 20 表 2 定性离子相对丰度的最大允许偏差
Table 2 Maximum allowable deviation of relative abundance of qualitative ions for analytes
相对离子丰度 >50% >20%至50% >10%至20% ≤10% 允许的相对偏差 ±20% ±25% ±30% ±50% 表 3 化合物的质谱参数
Table 3 Mass parameters for detection for analytes
化合物 保留时间(min) 锥孔电压(V) 离子对1 离子对2 子离子
(m/z)碰撞电压(V) 子离子
(m/z)碰撞电压(V) 2甲4氯 2.35 33 199.07/140.89* 18 201.08/142.88 18 氯虫苯甲酰胺 2.63 30 484.10/285.70* 14 484.10/453.00 20 氟苯虫酰胺 3.14 35 681.30/253.88* 30 681.30/273.91 16 注:“*”表示定量离子对。 表 4 不同氮吹管对化合物回收率的影响
Table 4 Effects of different nitrogen blowing pipes on the recoveries for analytes
耗材
属性氯虫苯甲酰胺 氟苯虫酰胺 2甲4氯 平均回收率
(%)RSD
(%)平均回收率
(%)RSD
(%)平均回收率
(%)RSD
(%)玻璃 109.9 1.3 105.7 3.2 60.1 2.5 塑料 102.6 1.8 103.7 2.4 91.2 3.9 表 5 化合物的线性方程、决定系数(R2)、检出限、定量限
Table 5 Linear equations, determination coefficients (R2), LOD, LOQ for analytes
化合物 线性范围
(ng/mL)线性方程 决定系数
(R2)检出限
(μg/kg)定量限
(μg/kg)2甲4氯 10~150 y=864.11x-359.82 0.9999 1.0 5.0 氯虫苯甲酰胺 10~150 y=8423.7x+9998.8 0.9998 氟苯虫酰胺 10~150 y=4229.9x+3235.2 0.9997 表 6 3种化合物的平均回收率和精密度
Table 6 Average recoveries and precisions for three analytes
化合物 添加量
(μg/kg)平均回收率
(%)RSD
(%)2甲4氯 5.0 73.3 2.3 10.0 79.0 1.2 50.0 73.8 1.0 氯虫苯甲酰胺 5.0 111.6 5.9 10.0 117.3 1.2 50.0 101.0 4.6 氟苯虫酰胺 5.0 112.7 5.4 10.0 110.4 4.4 50.0 106.4 4.2 -
[1] 储晓刚, 雍炜, 凌云, 等. 高效液相色谱-飞行时间质谱法筛查大豆中残留的多种除草剂和杀虫剂[J]. 色谱,2007,25(6):907−916. [CHU Xiaogang, YONG Wei, LING Yun, et al. High performance liquid chromatography time of flight mass spectrometry for screening of herbicides and pesticides residues in soybeans[J]. Chromatography,2007,25(6):907−916. doi: 10.3321/j.issn:1000-8713.2007.06.025 [2] 高霞, 陈辉, 谭敏, 等. QuEChERS-气相色谱质谱法测定苹果中45种农药残留[J]. 食品工业科技,2020,41(16):243−251. [GAO Xia, CHEN Hui, TAN Min, et al. Determination of 45 pesticide residues in apples by QuEChERS-gas chromatography-mass spectrometry[J]. Science and Technology of Food Industry,2020,41(16):243−251. doi: 10.13386/j.issn1002-0306.2020.16.039 [3] 张天旭, 李国, 曹小彦. QuEChERS结合液相色谱-串联质谱联用法同时测定植物源性食品中多种双酰胺类农药残留[J]. 现代食品,2021,27(3):154−157,161. [ZHANG Tianxu, LI Guo, CAO Xiaoyan, et al. Simultaneous determination of multiple bisamide pesticide residues in plant-derived foods by QuEChERS combined with LC-MS/MS[J]. Modern Food,2021,27(3):154−157,161. [4] MALHAT F M. Determination of chlorantraniliprole residues in grape by high-performance liquid chromatography[J]. Food Analytical Methods,2012,5(6):1492−1496. doi: 10.1007/s12161-012-9400-z
[5] JACOBSON A L, KENNEDY G G. The effect of three rates of cyantraniliprole on the transmission of tomato spotted wilt virus by frankliniella occidentalis and frankliniella fusca (thysanoptera: Thripidae) to Capsicum annuum[J]. Crop Prot,2011,30(4):512−515. doi: 10.1016/j.cropro.2010.12.004
[6] DONG F, LIU X, XU J, et al. Determination of cyantraniliprole and its major metabolite residues in vegetable and soil using ultra performance liquid chromatography/tandem mass spectrometry[J]. Biomedical Chromatography,2012,26(3):377−383.
[7] LU Z, ZHANG Z, FANG N, et al. Simultaneous determination of five diamide insecticides in food matrices using carbon nanotube multiplug filtration cleanup and ultrahigh-performance liquid chromatography-tandem mass spectrometry[J]. Journal of Agricultural and Food Chemistry,2019,67(39):1097−1098.
[8] 陈淼, 彭丽成, 李勤奋, 等. 超声辅助提取-固相萃取净化-高效液相色谱法测定沉积物中的2甲4氯残留[J]. 农药,2020,59(5):357−361. [CHEN Miao, PENG Licheng, LI Qinfen, et al. Determination of 4-chloro-2-methylphenoxyacetic acid in sediment by HPLC with ultrasound-assisted xtraction E and solid phase extraction[J]. Agrochemicals,2020,59(5):357−361. [9] ES SANDOH M, WOLGEMUTH D, JRON C U, et al. Phenoxy herbicide removal from aqueous solutions using fast pyrolysis switchgrass biochar[J]. Chemosphere,2017,174:49−57. doi: 10.1016/j.chemosphere.2017.01.105
[10] BERNARDINI G, SPINELLI O, VISMARA C, et al. Evaluation of the developmental toxicity of the pesticide MCPA and its contaminants phenoland chlorocresol[J]. Environmental Toxicology and Chemistry,2010,15(5):754−760.
[11] 中华人民共和国国家卫生健康委员会, 中华人民共和国农业农村部, 国家市场监督管理总局. 食品安全国家标准 食品中农药最大残留限量: GB 2763-2021[S]. 2021: 117−213 The State Health Commission of the People's Republic of China, The Ministry of Agriculture and Rural Affairs of the People's Republic of China, The State Administration of Market Supervision and Administration. National Food Safety Standard-Maximum residue limits for pesticides in food: GB 2763-2021[S]. 2021: 117−213.
[12] 中华人民共和国国家卫生健康委员会, 中华人民共和国农业农村部, 国家市场监督管理总局. 食品安全国家标准 食品中氟苯虫酰胺残留量的测定 液相色谱-质谱/质谱法: GB 23200.76-2016[S]. 2016 The State Health Commission of the People's Republic of China, The Ministry of Agriculture and Rural Affairs of the People's Republic of China, The State Administration of Market Supervision and Administration. National Food Safety Standards-Determination of flubendiamide residue in foods-Liquid chromatography-mass spectrometry: GB 23200.76-2016[S]. 2016
[13] 韩帅兵, 张耀中, 于淼, 等. 超高效液相色谱-串联质谱法测定水中双酰胺类杀虫剂的残留量[J]. 农药科学与管理,2021,42(2):38−43. [HAN Shuaibing, ZHANG Yaozhong, YU Miao, et al. Determination of diamide insecticides residues in water by high performance liquid chromatography-tandem mass spectrometry[J]. Pesticide Science and Administration,2021,42(2):38−43. doi: 10.3969/j.issn.1002-5480.2021.02.007 [14] 黄美玲, 林毅楠, 周杨, 等. 液相色谱串联质谱法测定油料作物中3种双酰胺类杀虫剂残留量[J]. 食品安全质量检测学报,2020,11(15):5099−5106. [HUANG Meiling, LIN Yinan, ZHOU Yang, et al. Determination of 3 kinds of diamide insecticides in oil crops by liquid chromatography-tandem mass spectrometry[J]. Journal of Food Safety & Quality,2020,11(15):5099−5106. [15] 孙程鹏, 许炳雯, 高娜, 等. Sin-QuEChERS结合超高效液相色谱串联质谱法同时检测果蔬中5种双酰胺类杀虫剂[J]. 食品安全质量检测学报,2020,11(6):1784−1791. [SUN Chengpeng, XU Bingwen, GAO Na, et al. Simultaneous determination of 5 kinds of diamide insecticides in fruits and vegetables by Sin-QuEChERS with ultra performance liquid chromatography tandem mass spectrometry[J]. Journal of Food Safety & Quality,2020,11(6):1784−1791. doi: 10.19812/j.cnki.jfsq11-5956/ts.2020.06.015 [16] 曹雪, 李厚标, 李少军, 等. 超高效液相色谱-串联质谱/质谱法测定蔬菜和水果中氯虫苯甲酰胺、虫酰肼残留量[J]. 现代食品,2018,11(21):117−121. [CAO Xue, LI Houbiao, LI Shaojun, et al. Determination of chlorantraniliprole and tebufenozide in fruits and vegetables by UPLC-MS/MS[J]. Modern Food Science and Technology,2018,11(21):117−121. [17] 张云, 程立军, 侯杰, 等. UPLC-MS/MS测定葡萄酒中3种双酰胺类杀虫剂[J]. 中国酿造,2016,35(9):172−175. [ZHANG Yun, CHENG Lijun, HOU Jie, et al. Determination of three kinds of diamides insecticides in wine by UPLC-MS/MS[J]. China Brewing,2016,35(9):172−175. doi: 10.11882/j.issn.0254-5071.2016.09.039 [18] SINGH B, KAR A, MANDAL K, et al. Development and validation of QuEChERS method for estimation of chlorantraniliprole residue in vegetables[J]. Food Science,2012,77(12):208−215. doi: 10.1111/j.1750-3841.2012.02801.x
[19] 马琳, 陈建波, 赵莉, 等. 固相萃取-超高效液相色谱-串联质谱法同时测定果蔬中6种酰胺类农药残留量[J]. 色谱,2015(10):1019−1025. [MA Lin, CHEN Jianbo, ZHAO Li, et al. Determination of six amide pesticide residues in vegetables and fruits by solid phase extraction-ultra high performance liquid chromatography-tandem mass spectrometry[J]. Chinese Journal of Chromatography,2015(10):1019−1025. [20] 吴丹亚, 潘洁. 固相萃取-高效液相色谱法同时测定蔬菜中氯虫苯甲酰胺等5种农药残留量[J]. 浙江农业科学,2021,62(1):129−132. [WU Danya, PAN Jie. Simultaneous determination of five pesticide residues including chlorantraniliprole in vegetables by solid phase extraction and high-performance liquid chromatography[J]. Journal of Zhejiang Agricultural Sciences,2021,62(1):129−132. [21] 宋文芳. 高效液相色谱法同时测定辣椒中氯虫苯甲酰胺和溴氰虫酰胺的残留[J]. 现代食品,2020(7):172−174. [SONG Wenfang. Determination for residues of chlorantraniliprole and cyantraniliprole in pepper by HPLC method[J]. Modern Food Science and Technology,2020(7):172−174. [22] 杨松, 王瑶, 禾丽菲, 等. QuEChERS-气相色谱-串联质谱法分析鲜茶叶中6种杀虫剂的残留及消解动态[J]. 分析试验室,2019,38(12):1459−1464. [YANG Song, WANG Yao, HE Lifei, et al. Residue and dissipation dynamics of six insecticides in fresh tea by QuEChERS-gas chromatography tandem mass spectrometry[J]. Chinese Journal of Analysis Laboratory,2019,38(12):1459−1464. [23] 聂春林, 梁贵平, 欧晓明, 等. 柱前衍生HPLC法测定2甲4氯异辛酯及代谢物在玉米中的残留[J]. 农药,2022,61(3):203−207. [NIE Chunlin, LIANG Guiping, OU Xiaoming, et al. Determination of MCPA-isooctyl and its metabolite residues in corn with pre-column derivatization by HPLC[J]. Agrochemicals,2022,61(3):203−207. doi: 10.3969/j.issn.1006-0413.2022.3.ny202203012 [24] 许宏彩, 高翀, 庞怀林. 40.5%2甲·草甘膦异丙胺盐可溶液剂分析方法研究[J]. 世界农药,2021,43(7):30−37. [XU Hongcai, GAO Chong, PANG Huailin. Analytical methods of active ingredients of MCPA·glyphosate isopropylamine 40.5%[J]. World Pesticide,2021,43(7):30−37. [25] 陈亚玲, 江阳, 李永新, 等. 高效液相色谱法同时测定瓜果中6种植物生长调节剂[J]. 现代预防医学,2016,43(5):891−895. [CHEN Yaling, JAING Yang, LI Yongxin, et al. Simultaneous determination of six plant growth regulators in melon and fruit by high-performance liquid chromatography[J]. Modern Preventive Medicine,2016,43(5):891−895. [26] 张嘉坤, 武宪, 周旭东, 等. 二甲四氯异辛酯及其代谢物二甲四氯在玉米中的残留量及风险评估[J]. 食品安全质量检测学报,2020,11(20):7544−7554. [ZHANG Jiakun, WU Xian, ZHOU Xudong, et al. Residue and risk assessment of 2-methyl-4-chlorophenoxyacetic acid-isooctyl and its metabolite 2-methyl-4-chlorophenoxyacetic acid in corn[J]. Journal of Food Safety & Quality,2020,11(20):7544−7554. doi: 10.19812/j.cnki.jfsq11-5956/ts.2020.20.062 [27] 王博, 侯志广, 刘良月, 等. 烟嘧磺隆、莠去津、2甲4氯异辛酯及其代谢物在玉米和土壤中的残留分析[J]. 现代农药,2018,17(6):40−44. [WANG Bo, HOU Zhiguang, LIU Liangyue, et al. Residual analysis of nicosulfuron, atrazine, MCPA-isooctyl and its metabolite in corn and soil[J]. Modern Agrochemicals,2018,17(6):40−44. doi: 10.3969/j.issn.1671-5284.2018.06.012 [28] 黄锋, 张文锋, 符少怀, 等. 基于直接进样-超高效液相色谱串联质谱法的水中2甲4氯残留测定[J]. 安全与环境学报,2021,21(1):435−441. [HUANG Feng, ZHANG Wenfeng, FU Shaohuai, et al. Determining 4-chloro-2-methylphe-noxyacetic acid residue in waters via direct injection-UPLC-MS/MS[J]. Journal of Safety and Environment,2021,21(1):435−441. doi: 10.13637/j.issn.1009-6094.2019.1490 [29] 赵慧宇, 薄瑞, 薛佳莹, 等. 超高效液相色谱-串联质谱法测定小麦中2甲4氯残留[J]. 农药学学报,2010,12(1):105−108. [ZHAO Huiyu, BO Rui, XUE Jiaying, et al. Determination of MCPA residue in wheat using high performance liquid chromatography tandem mass spectrometry[J]. Chinese Journal of Pesticide Science,2010,12(1):105−108. doi: 10.3969/j.issn.1008-7303.2010.01.18 [30] 吴晓峰, 欧晓明, 金晨钟, 等. 固相萃取-高效液相色谱-串联质谱法检测稻田中硝磺草酮和2甲4氯钠残留[J]. 农药学学报,2017,19(1):53−60. [WU Xiaofeng, OU Xiaoming, JIN Chenzhong, et al. Determination of mesotrione and MCPA-Na residues in oryzasativa ecosystems by solid-phase extraction and high performance liquid chromatography-tandem mass spectrometry[J]. Chinese Journal of Pesticide Science,2017,19(1):53−60. doi: 10.16801/j.issn.1008-7303.2017.0008 [31] 于彦彬, 张嵘, 李莉, 等. 固相萃取液相色谱-串联质谱法测定土壤中9种苯氧羧酸类除草剂残留量[J]. 分析化学,2014,42(9):1354−1358. [YU Yanbin, ZHANG Rong, LI Li, et al. Determination of 9 phenoxy acid herbicides in soil by solid phase extraction and LC/MS/MS[J]. Chinese Journal of Analytical Chemistry,2014,42(9):1354−1358. doi: 10.11895/j.issn.0253-3820.140128 [32] BYUNGSUK C, SUNCHEUN K, SANGWHAN I, et al. Simultaneous determination of bentazone and its metabolites in postmortem whole blood using liquid chromatography-tandem mass spectrometry[J]. Forensic Science International,2017,278:304−312. doi: 10.1016/j.forsciint.2017.07.024
[33] 朱晓玲, 刘杰, 余婷婷, 等. 高效液相色谱-四极杆-飞行时间质谱法快速筛查胡椒粉中多种农药残留[J]. 食品科学,2021,42(4):287−296. [ZHU Xiaoling, LIU Jie, YU Tingting, et al. Rapid Screening of pesticide residues in pepper powder by high performance liquid chromatography coupled with quadrupole-time of flight mass spectrometry[J]. Food Science,2021,42(4):287−296. doi: 10.7506/spkx1002-6630-20191008-045 [34] 刘进玺, 秦珊珊, 冯书惠, 等. 超高效液相色谱-串联质谱法测定食用菌中农药多残留的基质效应[J]. 食品科学,2016,37(18):171−177. [LIU Jinxi, QIN Shanshan, FENG Shuhui, et al. Matrix effects in the analysis of pesticides residues in edible Fungi by HPLC-MS/MS[J]. Food Science,2016,37(18):171−177. doi: 10.7506/spkx1002-6630-201618028 -
期刊类型引用(7)
1. 黄积武,郭思妤,王慧敏,周博文,王昊阳,郭寅龙,刘文. 上海白玉兰花香和鲜花精油挥发性成分的GC-MS分析研究. 化学试剂. 2025(01): 80-85 .  百度学术
百度学术
2. 叶小真,张龙华,陈红梅,林曦碧,李渊顺,杨晓文,陈全助. 樟树枝枯病病原菌生物学特性及杀菌剂室内筛选. 福建林业科技. 2024(01): 23-32 .  百度学术
百度学术
3. 刘庆璇,庄连玉,马文局,孙光辉,刘亚辉,李冠喜. 樟树叶片精油对微生物生长的抑制作用. 曲阜师范大学学报(自然科学版). 2023(02): 88-92 .  百度学术
百度学术
4. 赵纯静,陈卫国,白丽,武有聪. 美洲大蠊提取物CⅡ-3对白假丝酵母菌生物膜形成的作用. 大理大学学报. 2023(04): 28-33 .  百度学术
百度学术
5. 孙琦,李明珠,安珂瑶,熊馨炜,范爽妍,乐涛. 基于科研项目驱动的食品类专业大学生创新能力培养——以纳米金的绿色制备与性能研究为例. 农产品加工. 2023(21): 150-152 .  百度学术
百度学术
6. 智亚楠,赵筱岑,汪伟,鲁泽培,王春生,陈利军. 番茄挥发物组分分析及其对番茄灰霉病菌的熏蒸抑菌作用. 化学研究与应用. 2022(09): 2029-2035 .  百度学术
百度学术
7. 石瑀,张雨佳,任怡琳,陆春雷,王娟娟,江露露,李华祥,高亚军. 牛樟树提取物对食源性致病菌的抑制效果. 食品科技. 2021(04): 168-172+179 .  百度学术
百度学术
其他类型引用(1)





 下载:
下载:


 下载:
下载:



