Effect of Processing Technology on Quality and Functional Activity of Taxilli Herba Tea
-
摘要: 目的:探讨不同加工工艺对桑寄生茶品质及功能活性的影响。方法:采用自然发酵、杀青、冠突曲霉发酵等3种加工技术进行工序组合,制备8种不同的桑寄生茶样品,进而测定8种桑寄生茶的主要化学成分、抗氧化活性及对α-淀粉酶的影响,并对8种桑寄生茶进行感官审评。结果:经杀青处理的桑寄生茶能提升水浸出物、游离氨基酸、茶多酚、总黄酮、可溶性糖等5种化学成分的含量(P<0.05)及抗氧化活性;经自然发酵处理的桑寄生茶清香气加强;冠突曲霉发酵处理桑寄生茶能显著提升α-淀粉酶的酶活力(P<0.05)。其中,杀青处理能最大程度提升桑寄生茶的主要化学成分含量、抗氧活活性;杀青结合冠突曲霉发酵处理桑寄生茶具有一定的抗氧化活性及风味特点,且能双向调节α-淀粉酶的活性。结论:杀青、杀青结合冠突曲霉发酵等加工技术在品质、功能活性上各有明显优势,可作为关键加工技术用于制作品质优异的桑寄生茶。Abstract: Objective: To explore the effect of different processing technology on the quality and functional activity of Taxilli Herba tea. Methods: A total of eight different samples of Taxilli Herba tea were prepared by different procedures combined with 3 processing technologies including natural fermentation, fixation, and Aspergillus cristatus fermentation. After processing, determinations were done on the main chemical components, antioxidant activity, influence on α-amylase activity, and organoleptic evaluation. Results: The content of 5 chemical compounds, including water extract, free amino acid, tea polyphenol, total flavonoid, and soluble sugar in Taxilli Herba tea, were increased (P < 0.05) after fixation while the antioxidant activity was improved too. The delightful odour of Taxilli Herba tea processed by natural fermentation was enhanced. The α-amylase activity of Taxilli Herba tea fermented by A. cristatus was significantly improved (P<0.05) . The data showed that, if only taken fixation process, the content of the main chemical components and anti-oxidant activity were improved in the maximum extent. What’s more, if taken fixation process combined with A. cristatus fermentation, the α-amylase activity was bidirectionally regulated, the antioxidant activity was detected to a certain extent, and flavor characteristics were tasted. Conclusion: Different processing technologies (fixation, and fixation combined with A. cristatus fermentation) on this project showed different and clear advantages on quality and functional activity of Taxilli Herba tea, and it could be key processing technologies used to produce excellent quality of Taxilli Herba tea.
-
Keywords:
- Taxilli Herba tea /
- processing technology /
- quality /
- functional activity /
- organoleptic evaluation
-
茶一般指山茶科(Thcaceae)山茶属(Camellia)植物的叶和叶芽,是世界上最广泛饮用的饮料之一[1],依据不同的工艺、品质[2-3]及功能特点[4-5],分为绿茶、红茶、白茶、黄茶、黑茶和青茶。然而,其他许多非山茶科山茶属来源的植物,在参考茶的加工工艺基础上,也被广泛用作茶饮,且具有一定的保健作用[6]。张巧花[7]借鉴红茶、茯茶加工工艺制备的葛叶茶达到优等茶水平,张永瑞等[8]借鉴绿茶、白茶、红茶加工工艺制备的刺槐花茶促进了刺槐花资源的开发利用。这为别样茶的工艺优化提供了一定思路。
桑寄生茶是桑寄生(Taxillus chinensis (DC.) Danser)的叶和叶芽通过茶艺处理而成的一种别样茶(non-Camellia teas),于1992年被列入中华传统食品保健茶类。桑寄生茶历史悠久,文字记载可追溯至清代《生草药性备要》[9],“消热,滋补,追风,养血散热。作茶饮,舒筋活络。”传统桑寄生茶多采用阴干、晒干等工艺加工,存在产品形态单一,茶叶特征不鲜明,有青臭味等缺点。对此,参考不同茶类的加工工艺,特别是红茶、绿茶、黑茶的关键加工技术——自然发酵、杀青、冠突曲霉发酵[10],可能有助于提升桑寄生茶的品质及功能特点。目前桑寄生茶无此方面的比较研究。
本研究以桑寄生叶和叶芽为原料,在传统桑寄生茶加工工艺基础上,借鉴红茶、绿茶、茯茶的加工工艺,选取自然发酵、杀青、冠突曲霉发酵等三种关键加工技术,优化桑寄生茶加工工艺,对不同加工工艺桑寄生茶的主要化学成分及功能活性进行比较分析,旨在获得一种提高桑寄生茶品质或功能特点的加工工艺。
1. 材料与方法
1.1 材料和仪器
桑寄生茶的原料为桑寄生叶和叶芽 采摘于广西梧州岑溪市桑寄生人工种植基地,寄主植物为桑树,采摘时间2020年10月。桑寄生茶原料经广西中医药大学李永华研究员鉴定为桑寄生科植物桑寄生(Taxillus chinensis (DC.) Danser)的叶和叶芽;冠突曲霉(菌株编号:CICC2016.97) 中国工业微生物菌种保藏管理中心;牛血清白蛋白、α-淀粉酶(3700 U/g)、α-淀粉酶试剂盒、DPPH自由基清除能力检测试剂盒 北京索莱宝科技有限公司;总抗氧化活性(T-AOC)测试盒FRAP法、总抗氧化活性(T-AOC)测试盒ABTS法 南京建成生物工程研究所;芦丁、没食子酸、L-谷氨酸 成都麦德生科技有限公司;原花青素 信阳市中检计量生物有限公司;D-无水葡萄糖 中国食品药品检定研究院。除α-淀粉酶为生物试剂(BR)外,其他试剂均为分析纯(AR)。
CGD600自控温鼓式炒药机 南京海善制药设备有限公司;UV-1780紫外可见分光光度计 岛津仪器(苏州)有限公司;En Vision 2105高通量酶标仪筛选系 珀金埃尔默股份有限公司;ZQZY-78BN振荡培养箱 上海知楚仪器有限公司。
1.2 实验方法
1.2.1 不同工序组合加工桑寄生茶
1.2.1.1 不同桑寄生茶的加工工艺流程
样品A:原料→阴干;样品B:原料→杀青→阴干;样品C:原料→自然发酵→阴干;样品D:原料→自然发酵→杀青→阴干;样品E:原料→冠突曲霉发酵;样品F:原料→杀青→冠突曲霉发酵;样品G:原料→自然发酵→冠突曲霉发酵;样品H:原料→自然发酵→杀青→冠突曲霉发酵。
1.2.1.2 各工序操作要点
原料预处理:采摘桑寄生鲜品,去除茎枝,取叶和叶芽于阴凉、通风处摊晾至含水量60%,揉捻至微有汁液渗出。
自然发酵:将原料置于不锈钢桶中,常温闷堆至叶片基本呈黄褐色,散发明显酵香气。
杀青:锅温180 ℃时投料,炒至原料微有刺手感时出锅。
冠突曲霉发酵:将原料置于发酵桶中,添加纯水至原料含水量为35%,搅拌均匀,于45 ℃发酵箱中渥堆3 h,冷却至常温,按15:1物料比接种冠突曲霉菌液(菌液浓度为1×106 CFU/mL),搅拌均匀,28 ℃、75%湿度发酵7 d,然后每天升高2~3 ℃至45 ℃,45 ℃干燥样品至含水量低于8.5%。
阴干:于阴凉、通风处摊晾样品至含水量低于8.5%。
1.2.2 主要化学成分的测定
1.2.2.1 含水量测定
参照GB 5009.3-2016进行含水量测定[11]。样品含水量的测定用于水浸出物、可溶性蛋白等7个主要化学成分干物质含量的换算,不作单独分析。
1.2.2.2 水浸出物测定
参照GB/T 8305-2013进行水浸出物测定[12]。
1.2.2.3 可溶性蛋白含量测定
参考张馨宇[13]的考马斯亮蓝法测定可溶性蛋白含量。精密称取牛血清白蛋白标准品,以吸光度(y)和牛血清白蛋白标准品溶液浓度(x,mg/mL)制作标准曲线,得出线性回归方程:y=6.85918x−0.100190,R2=0.99909。
1.2.2.4 原花青素含量测定
参考DB12/T 885-2019测定原花青素含量[14]。精密称取原花青素标准品,以吸光度(y)和原花青素标准品溶液浓度(x,μg/mL)制作标准曲线。得出线性回归方程:y=0.00482968+0.0285607,R2=0.99901。
1.2.2.5 游离氨基酸含量测定
参考GB 5009.124-2016测定游离氨基酸含量[15]。精密称取L-谷氨酸标准品,以吸光度(y)和L-谷氨酸标准品溶液浓度(x,mg/mL)制作标准曲线。得出线性回归方程:y=3.56803x−0.288655,R2=0.99900。
1.2.2.6 茶多酚含量测定
参考GB/T 8313-2018测定茶多酚含量[16]。精密称取没食子酸标准品,以吸光度(y)和没食子酸标准品溶液浓度(x,μg/mL)制作标准曲线。得出线性回归方程:y=0.0102464x+0.0126241,R2=0.99987。
1.2.2.7 总黄酮含量测定
参考黄蜚颖[17]的AlCl3比色法测定总黄酮含量。精密称取芦丁标准品,以吸光度(y)和芦丁标准品溶液浓度(x,mg/mL)制作标准曲线。得出线性回归方程:y=1.30459x+0.0183035,R2=0.99967。
1.2.2.8 可溶性糖含量测定
参考李远华[18]的蒽酮-硫酸比色法测定可溶性糖含量。精密称取D-无水葡萄糖标准品,以吸光度(y)和D-无水葡萄糖标准品溶液浓度(x,mg/mL)制作标准曲线。得出线性回归方程:y=6.01420x+0.0125817,R2=0.99904。
1.2.3 感官审评
参考GB/T 23776-2018《茶叶感官审评方法》[19],选择3名具有评茶员资质的人员进行评测。审评方法修改为:取样品10.00 g,洗茶2次后注满沸水,加盖,计时。一泡5 min,二泡8 min。分别对两泡的汤色、香气、滋味进行因子审评及评分,(一泡、二泡)总分=汤色×0.3+香气×0.35+滋味×0.35,样品总分为两泡评分的平均值。评分大致等级划分说明如表1所示。
表 1 感官审评评分标准Table 1. Scoring criteria of organoleptic evaluation指标 评价标准 评分(分) 汤色 根据发酵程度划分红浓、橙红、橙黄、
黄绿等档次,明亮,澄清90<x≤100 根据发酵程度划分红浓、橙红、橙黄、
黄绿等档次,尚明亮,略有浑浊80<x≤90 根据发酵程度划分红浓、橙红、橙黄、
黄绿等档次,欠亮,浑浊70<x≤80 香气 (香型描述,如花香、蜜香、药香),
香气纯正,无杂气味,香高爽,香气持久90<x≤100 (香型描述,如花香、蜜香、药香),
香气较高尚纯正,无杂气味,80<x≤90 (香型描述,如花香、蜜香、药香),香气尚纯 70<x≤80 滋味 醇厚,回味甘爽 90<x≤100 尚醇厚 80<x≤90 尚醇,略有苦涩等杂味 70<x≤80 1.2.4 桑寄生茶功能性测试
1.2.4.1 样品处理
取3.00 g样品,加入100 mL沸水,浸提45 min,每10 min振摇一次,抽滤,浓缩至100 mg/mL,备用。
1.2.4.2 抗氧化活性测试
参照DPPH、FRAP、ABTS测定试剂盒进行检测。
1.2.4.3 对α-淀粉酶活性影响
参考α-淀粉酶活性检测试剂盒,测定样品对α-淀粉酶活性影响。根据预实验结果α-淀粉酶浓度为0.024 mg/mL。
1.3 数据处理
所有试验重复3次,使用SPSS 25对样品的7个主要化学成分含量结果进行多因素方差分析,化学成分与功能性测定结果通过主成分分析方法进行关联性分析,相关性结果进行单尾检验显著性,P<0.05为具有显著性差异。使用GraphPad Prism 9和Origin 2021作图。
2. 结果与分析
2.1 化学成分分析
2.1.1 化学成分含量测定
8种样品的化学成分百分含量如表2所示。其中茶多酚、总黄酮、可溶性糖含量>1.0%,为样品化学成分的主要组分。除可溶性蛋白、原花青素外,其他组分经杀青处理含量均有升高,而经自然发酵、冠突曲霉发酵处理均表现为下降。冠突曲霉发酵处理对化学成分的含量影响大于发酵处理。原花青素、游离氨基酸、茶多酚等成分的含量经冠突曲霉发酵处理降低约50%。
表 2 8种样品的化学成分含量(干基,%)Table 2. Chemical composition content of eight kinds of samples (dry base, %)样品 水浸出物 可溶性蛋白 原花青素 游离氨基酸 茶多酚 总黄酮 可溶性糖 A 25.18±0.15c 0.53±0.02a 0.75±0.01a 0.85±0.01b 8.88±0.36c 2.52±0.52b 3.02±0.03b B 27.73±0.14a 0.50±0.00b 0.58±0.00b 0.94±0.01a 9.70±0.46a 2.71±0.56a 3.50±0.04a C 23.55±0.11d 0.48±0.00c 0.43±0.01c 0.76±0.00d 7.96±0.56d 2.22±0.39c 2.66±0.03e D 25.61±0.21b 0.48±0.00c 0.41±0.03d 0.84±0.01c 9.42±0.68b 2.49±0.36b 2.94±0.02c E 20.90±0.10f 0.36±0.00f 0.14±0.03f 0.42±0.00f 3.74±0.58g 1.97±0.24d 2.15±0.03g F 24.90±0.04c 0.45±0.00d 0.22±0.02e 0.53±0.00e 4.52±0.04e 2.19±0.18c 2.70±0.04d G 19.15±0.20g 0.32±0.00g 0.08±0.01h 0.38±0.00g 3.25±0.07h 1.73±0.21f 2.00±0.03h H 21.88±0.11e 0.39±0.01e 0.13±0.01g 0.42±0.00f 4.25±0.12f 1.83±0.42e 2.34±0.03f 注:同列字母不同表示差异显著(P<0.05),表4~表7同。 2.1.2 化学成分聚类分析
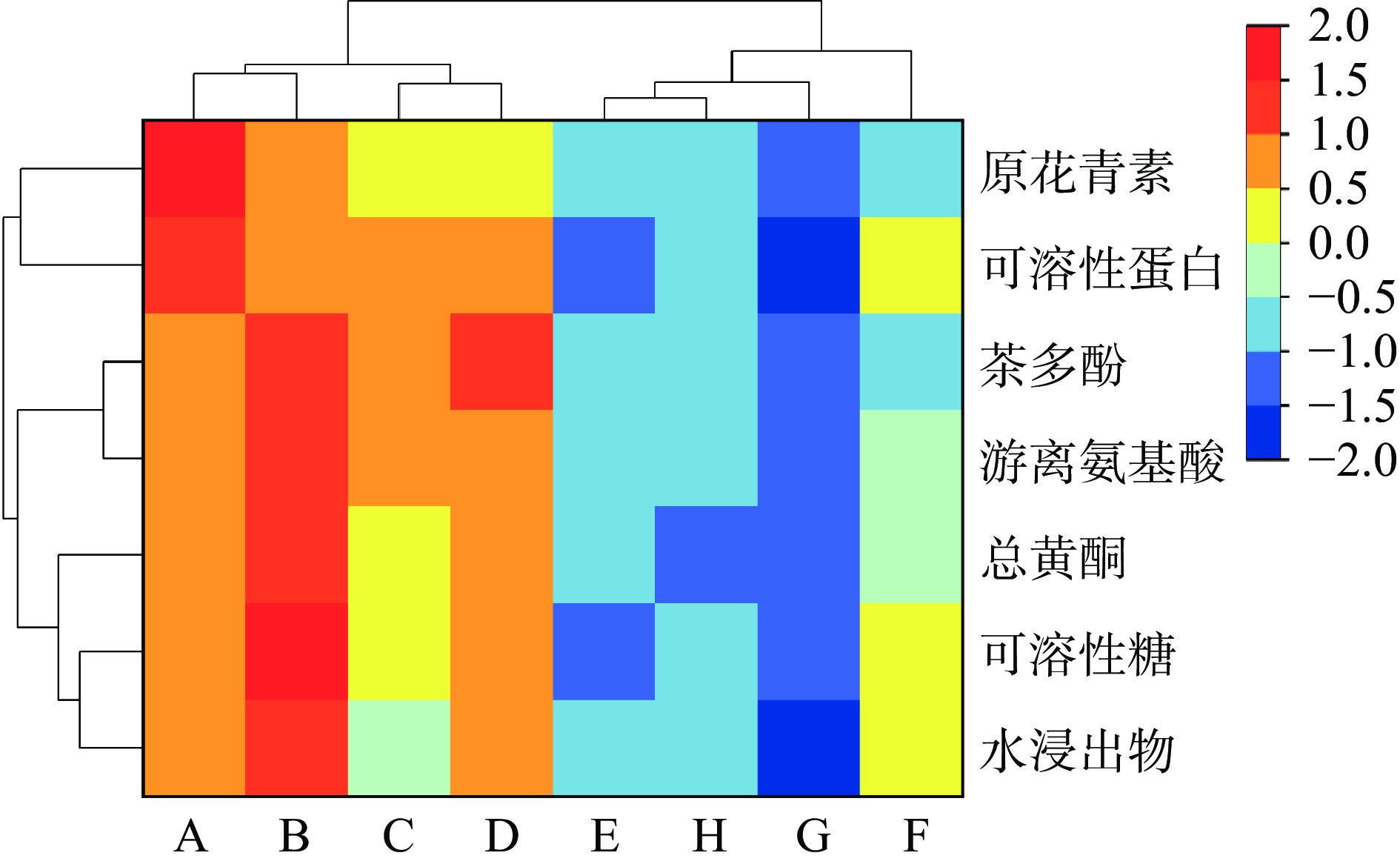
对8种样品进行聚类热图分析,从化学成分上进行聚类分析,原花青素、可溶性蛋白的变化趋势在整体趋势上为一类,其他成分趋于一类;从加工技术方面进行聚类分析,冠突曲霉发酵处理前与处理后的样品各分为一类,其中,样品B在冠突曲霉发酵前样品中各类化学成分含量较高,样品F在冠突曲霉发酵后样品中各类化学成分含量较高,样品B、F可分别作为两类样品的代表,结果如图1所示。
2.1.3 多因素方差分析
对样品加工技术进行多因素方差分析的主体间效应检验,结果如表3所示。自然发酵与杀青、自然发酵与冠突曲霉发酵两组因素的交互作用对总黄酮含量的影响没有显著差异(P>0.05),但杀青与冠突曲霉发酵的交互作用对总黄酮含量有显著影响(P<0.05)。除总黄酮外,其他六个考察指标受自然发酵、杀青、冠突曲霉发酵三因素的二阶交互作用影响均表现为极显著差异(P<0.01)。自然发酵、杀青、冠突曲霉发酵的三阶交互效应对可溶性糖含量无显著影响(P>0.05),对其他考察指标表现为极显著差异(P<0.01)。结果表明,适当的加工技术组合可弥补单一加工技术的缺点。
表 3 主体间效应检验Table 3. Inter subject effect test源 因变量 III 类平
方和自由度 F值 显著性 自然发酵 水浸出物 27.219 1 1337.354 P<0.01 可溶性蛋白 0.009 1 6883.516 P<0.01 原花青素 0.157 1 70131.094 P<0.01 游离氨基酸 0.040 1 70676.859 P<0.01 茶多酚 1.448 1 788.066 P<0.01 总黄酮 0.480 1 325.743 P<0.01 可溶性糖 0.765 1 71570.144 P<0.01 杀青 水浸出物 48.335 1 2374.853 P<0.01 可溶性蛋白 0.006 1 4410.784 P<0.01 原花青素 0.001 1 579.138 P<0.01 游离氨基酸 0.037 1 65006.069 P<0.01 茶多酚 6.213 1 3381.868 P<0.01 总黄酮 0.227 1 154.337 P<0.01 可溶性糖 1.012 1 94704.247 P<0.01 冠突曲
霉发酵水浸出物 87.153 1 4282.078 P<0.01 可溶性蛋白 0.082 1 61515.840 P<0.01 原花青素 0.952 1 426128.386 P<0.01 游离氨基酸 1.016 1 1786183.053 P<0.01 茶多酚 153.059 1 83315.476 P<0.01 总黄酮 1.838 1 1248.053 P<0.01 可溶性糖 3.223 1 301573.024 P<0.01 自然发
酵×杀青水浸出物 1.146 1 56.318 P<0.01 可溶性蛋白 0.000 1 28.820 P<0.01 原花青素 0.006 1 2488.127 P<0.01 游离氨基酸 0.002 1 4307.651 P<0.01 茶多酚 0.275 1 149.944 P<0.01 总黄酮 0.001 1 0.783 - 可溶性糖 0.068 1 6323.129 P<0.01 自然发酵×
冠突曲霉发酵水浸出物 0.387 1 19.023 P<0.01 可溶性蛋白 0.000 1 369.264 P<0.01 原花青素 0.045 1 20083.856 P<0.01 游离氨基酸 0.000 1 638.403 P<0.01 茶多酚 0.078 1 42.565 P<0.01 总黄酮 0.003 1 2.004 - 可溶性糖 0.066 1 6193.973 P<0.01 杀青×冠突
曲霉发酵水浸出物 1.698 1 83.408 P<0.01 可溶性蛋白 0.015 1 11038.234 P<0.01 原花青素 0.038 1 16954.748 P<0.01 游离氨基酸 0.000 1 511.193 P<0.01 茶多酚 0.095 1 51.771 P<0.01 总黄酮 0.007 1 4.715 P<0.05 可溶性糖 0.006 1 601.096 P<0.01 自然发酵×
杀青×冠突
曲霉发酵水浸出物 0.235 1 11.538 P<0.01 可溶性蛋白 0.001 1 563.706 P<0.01 原花青素 0.011 1 4978.039 P<0.01 游离氨基酸 0.002 1 3209.791 P<0.01 茶多酚 0.063 1 34.076 P<0.01 总黄酮 0.013 1 8.685 P<0.01 可溶性糖 0.000 1 0.776 - 注:-表示差异不显著(P>0.05)。 2.2 感官审评结果
对8种样品汤色进行分析,8种样品二泡的汤色均比一泡有所加深,其中冠突曲霉发酵处理对于汤色影响较大,经冠突曲霉发酵处理,汤色由黄色或黄绿色转变为橙黄色;自然发酵处理同样能加深汤色,但程度较轻;杀青处理后样品汤色偏淡,且带淡绿色;杀青结合冠突曲霉发酵处理样品的颜色较仅冠突曲霉发酵处理的样品颜色加深,更偏于橙黄色。
对8种样品香气进行分析,未经冠突曲霉发酵处理的样品以清香、奶香为主;经冠突曲霉发酵处理的样品则多表现为药香;经杀青处理的样品被赋予栗香;经自然发酵处理清香气较强烈。
对8种样品滋味进行分析,8种样品整体尚醇厚。经冠突曲霉发酵处理回甘现象较明显;经杀青后涩味较明显;经自然发酵处理涩味有所减轻。8种样品感官审评结果见表4。
表 4 8种样品的感官审评结果Table 4. Organoleptic evaluation of eight kinds of samples样品 泡数 审评因子 一二泡分别评分总分(汤色×0.3+香气×0.35+滋味×0.35) 样品总分(一泡总分×0.5+二泡总分×0.5) 汤色 香气 滋味 评语 评分(分) 评语 评分(分) 评语 评分(分) A 第一泡 明亮,澄清,鹅黄 91.67±1.53 花香,奶香,
香气纯正93.00±3.00 醇厚,回味甘爽 89.67±3.51 91.43±2.03 90.90±1.57a 第二泡 透亮,黄带绿 92.00±1.73 奶香气显著,带桑叶香,香气持久 90.67±1.15 醇厚,回甜 88.67±4.16 90.37±1.10 B 第一泡 尚明亮,黄绿 82.33±6.35 清香,略带酸气 80.33±5.51 尚醇厚,微酸,涩 74.33±4.04 78.83±4.13 78.01±3.68d 第二泡 尚明亮,黄带绿 82.67±8.74 淡香,略带酸气 75.33±4.04 尚醇厚,微涩,微酸 74.33±5.13 77.18±3.84 C 第一泡 明亮,黄 87.33±6.43 清香,略带奶香 81.67±6.66 尚醇,微甜,微涩 79.33±5.77 82.55±4.63 83.08±3.20c 第二泡 明亮,黄 89.33±3.06 清香,微带奶香气 83.67±3.21 尚醇厚,微酸,微甘 78.67±7.09 83.62±1.81 D 第一泡 透亮,澄清,黄 92.33±2.08 栗香,清香 86.00±3.61 尚醇厚,微酸回甘 81.00±8.54 86.15±3.63 86.61±2.93bc 第二泡 明亮,橙黄 92.67±2.52 蜜香,栗香 87.67±2.52 微涩,带甜 81.67±9.07 87.07±2.77 E 第一泡 尚明亮,橙黄 87.00±2.65 淡药香,清香 82.33±4.04 尚醇,微苦,回甘, 82.67±4.93 83.85±1.96 83.97±1.82bc 第二泡 明亮,橙黄 87.00±2.65 淡药香气 82.33±4.04 尚醇,甘甜,
回甘持久83.33±4.62 84.08±2.09 F 第一泡 明亮,澄清,橙黄 89.67±3.51 桑叶茶香,带花香 87.33±2.31 尚醇厚 82.33±4.04 86.28±1.15 85.97±1.35bc 第二泡 明亮,橙黄 88.33±4.73 花香,微带枣香气 84.00±1.73 尚醇厚,微涩 85.00±3.00 85.65±1.70 G 第一泡 尚明亮,橙黄带绿 88.33±2.08 甘和茶药香 89.33±3.51 尚醇厚,回甘 84.00±4.58 87.17±2.05 87.28±2.25ab 第二泡 尚明亮,橙黄带绿 88.33±3.21 药香明显,纯正 86.67±3.51 尚醇厚,甘甜 87.33±2.31 87.40±2.90 H 第一泡 尚明亮,橙黄带绿 84.00±3.46 清香 79.33±3.06 尚醇厚,微涩,略苦 72.00±3.46 78.17±0.91 79.30±2.33d 第二泡 尚明亮,橙黄 87.67±7.51 淡枣香 79.33±5.77 尚醇厚,微涩,微凉 75.33±5.03 80.43±2.99 样品A为最高分90.90分,其他样品均以A为基础进行工艺调整,分值均有所降低,即传统工艺中以阴干、晒干为主的做法可能是考虑其滋味、香气等风味特点。对比样品B与F的加工工艺与得分可知,冠突曲霉发酵处理可弥补杀青处理后样品涩味明显的缺点,使之风味明显好转。
2.3 功能性评价
2.3.1 DPPH自由基清除能力测定
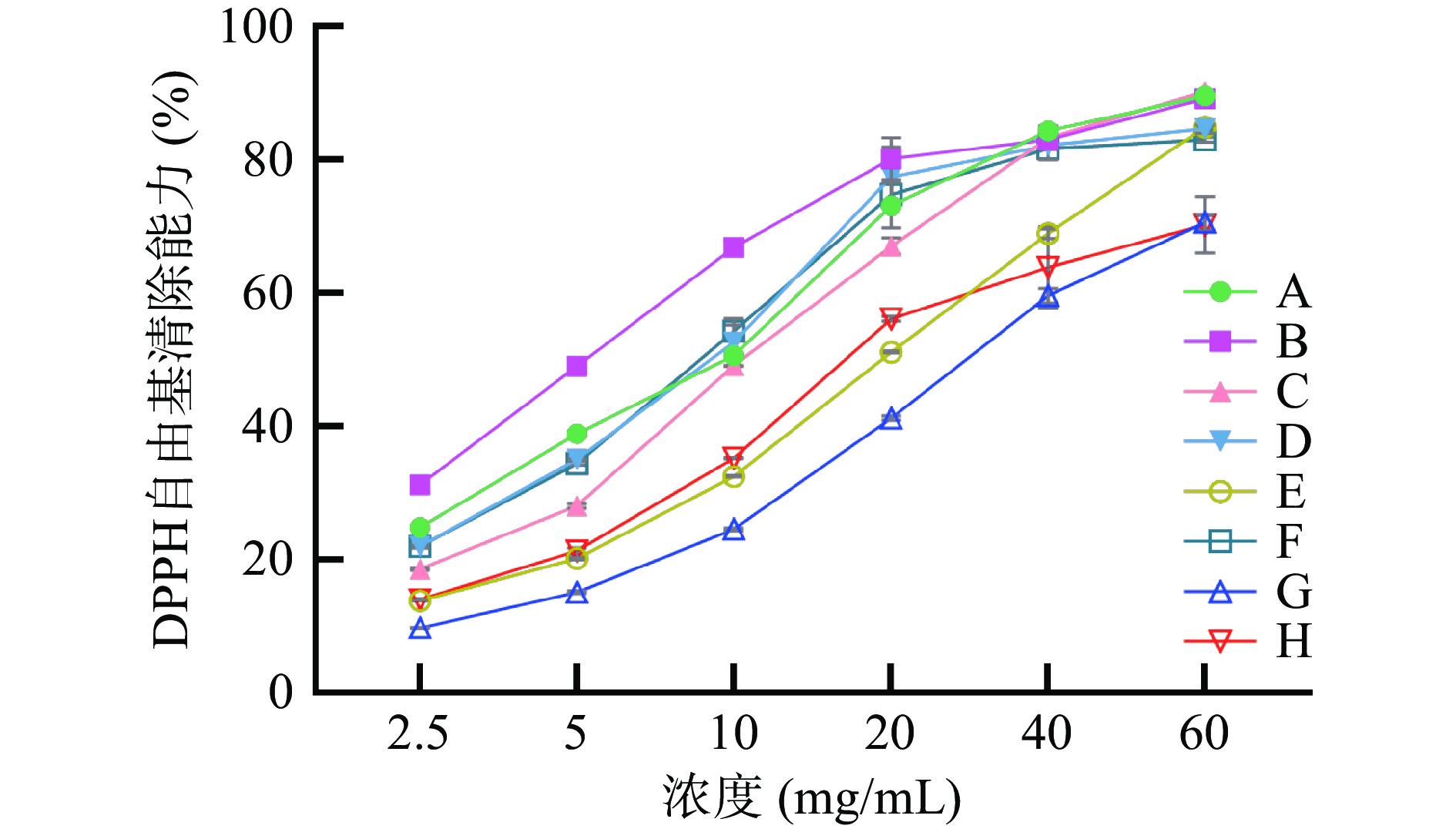
由图2可知,在2.5~60 mg/mL范围内,各样品对DPPH自由基的清除能力呈剂量依赖性。结合DPPH自由基清除能力拟合曲线求得的IC50可知,样品B的DPPH自由基清除能力最强,其IC50为5.29 mg/mL;在冠突曲霉发酵后的样品中,样品F的DPPH自由基清除能力较强,其IC50为8.75 mg/mL。8种样品DPPH自由基清除能力的IC50见表5。结合样品加工工艺可知,杀青可提升样品DPPH自由基清除能力,而自然发酵与冠突曲霉发酵均降低其DPPH自由基清除能力,冠突曲霉发酵对DPPH自由基清除能力的影响大于自然发酵。
表 5 8种样品的DPPH自由基清除能力的IC50Table 5. IC50 of DPPH radical scavenging capacity of eight kinds of samples样品 IC50(mg/mL) A 8.03±0.30e B 5.29±0.32f C 10.23±0.17d D 8.58±0.70de E 17.31±0.20c F 8.75±0.23de G 27.26±0.87a H 19.98±2.71b 2.3.2 ABTS自由基清除能力测定
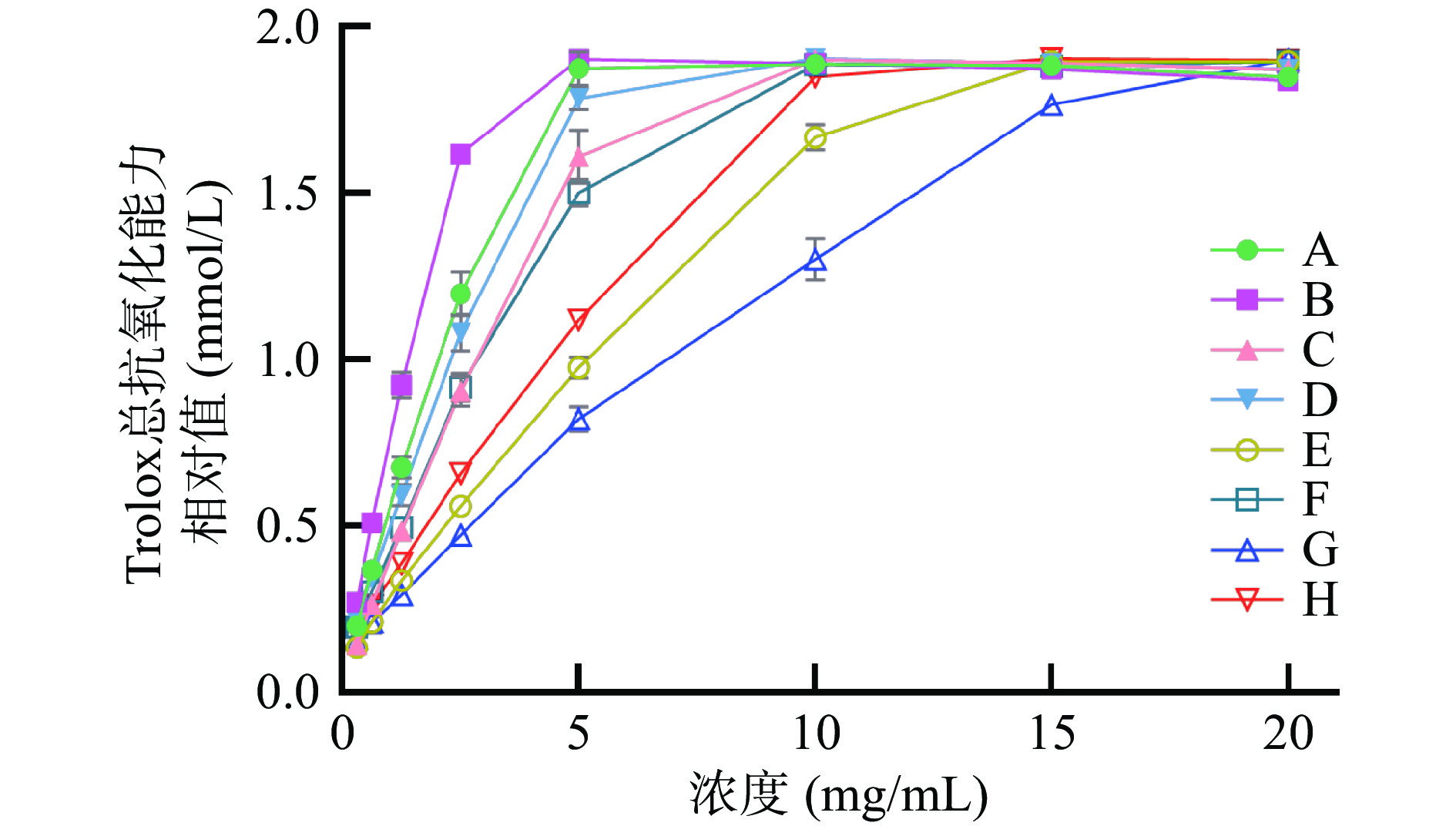
选取0.3125~20 mg/mL浓度范围,考查不同加工工艺桑寄生茶的ABTS自由基清除能力。以Trolox作标准品,且以Trolox标准浓度(y,mmol/L)和Trolox标准溶液的吸光度(x)作标准曲线。标准曲线为y=−1.1268x+2.1052,R2=0.9946。各样品的ABTS自由基清除能力与样品浓度呈正向依赖性,整体趋势与DPPH自由基清除能力相近。样品B的ABTS自由基清除能力最强,样品G的ABTS自由基清除能力最弱。8种样品的ABTS自由基清除能力在0.3125~2.5 mg/mL范围内呈线性相关,如图3所示。样品浓度均为2.5 mg/mL时其抗氧化活性换算的Trolox浓度结果如表6所示,样品B抗氧化活性相当于1.62 mmol/L Trolox,为8种样品中抗氧化活性最强样品;样品F为0.92 mmol/L,为冠突曲霉发酵后的4种样品中抗氧化活性较强样品。结合样品加工工艺可知,杀青可增强样品ABTS自由基清除能力,而自然发酵与冠突曲霉发酵均会降低其清除能力。
表 6 8种样品浓度为2.5 mg/mL时的ABTS自由基清除能力及相关线性方程Table 6. ABTS radical scavenging ability and correlation linear equation of eight kinds of samples at the concentration of 2.5 mg/mL样品 浓度2.5 mg/mL时
Trolox相对值(mmol/L)相关线性方程 R2 A 1.20±0.07b y=0.453x+0.0792 0.9972 B 1.62±0.01a y=0.6086x+0.1166 0.9963 C 0.90±0.05d y=0.3459x+0.043 0.9994 D 1.08±0.06c y=0.3944x+0.0961 0.9999 E 0.56±0.01f y=0.1916x+0.0858 0.9970 F 0.92±0.04d y=0.328x+0.0928 0.9997 G 0.47±0.01g y=0.1414x+0.1185 0.9994 H 0.66±0.01e y=0.2156x+0.1189 0.9993 注:相关线性方程中的y为Trolox标准浓度,mmol/L;x为样品浓度,mg/mL。 2.3.3 铁离子还原能力(FRAP)测定
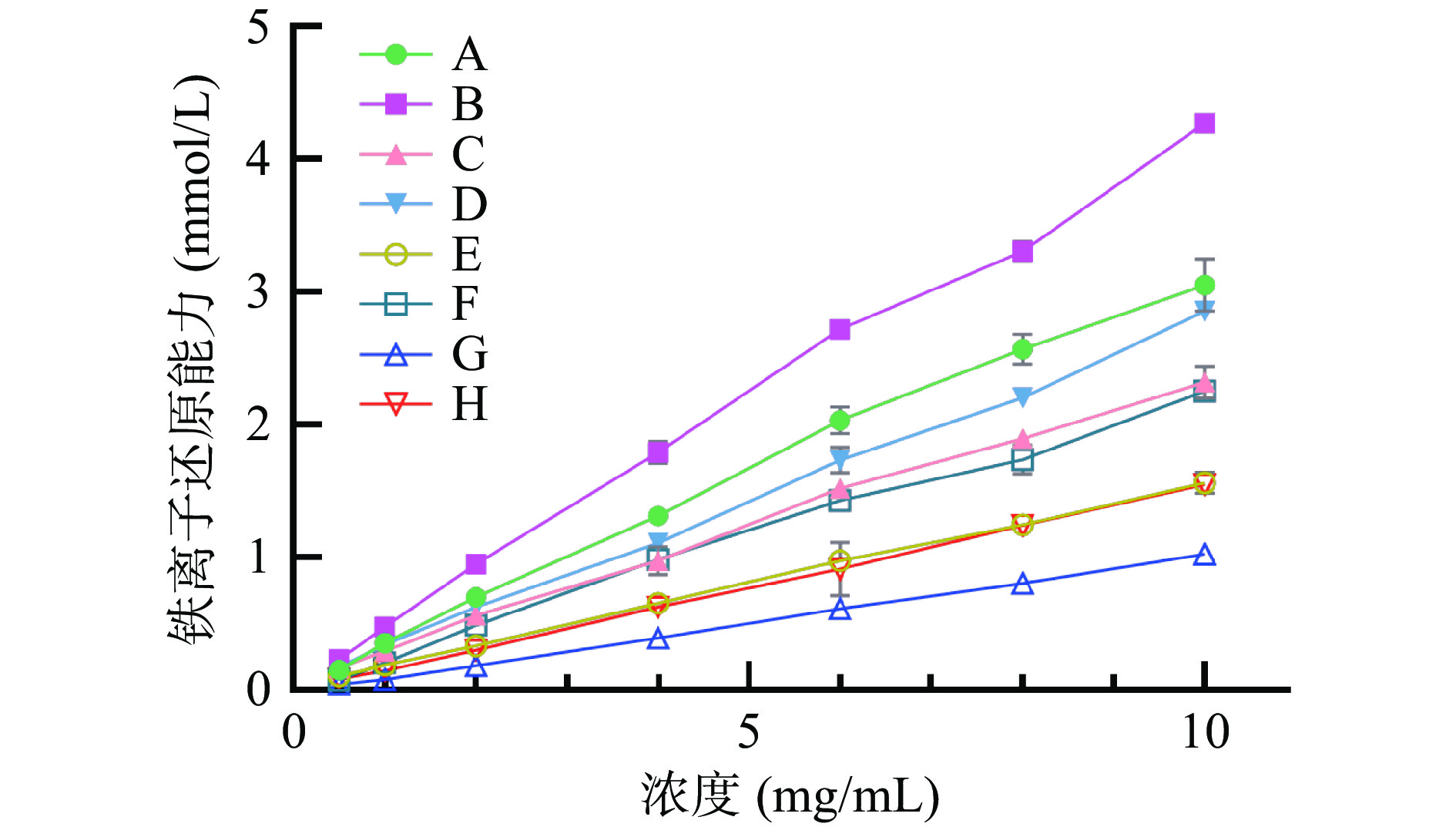
以FeSO4-7H2O作标准品,FeSO4-7H2O标准品浓度(y, mmol/L)和FeSO4-7H2O标准品吸光度(x)制作标准曲线,标准曲线为y=3.5646x+0.0114,R2=0.999。实验选取0.5~10 mg/mL浓度范围对比不同加工工艺处理样品的抗氧化活性,结果如图4所示。样品测定结果与DPPH、ABTS法抗氧化活性趋势大致相同,均表现为杀青增强抗氧化活性,而自然发酵与冠突曲霉发酵降低抗氧化活性,其结果线性趋势良好,如表7所示。选取浓度为6.0 mg/mL时各样品抗氧化活性进行比较可知,样品B的FeSO4-7H2O含量换算至为2.72 mmol/L,是8种样品中抗氧化活性最强的样品;样品F为1.43 mmol/L,是冠突曲霉发酵后的4种样品中抗氧化活性最强的样品。
表 7 8种样品浓度为6.0 mg/mL时的铁离子还原能力及相关线性方程Table 7. Iron ion reduction capacity and correlation linear equation of eight kinds of samples at the concentration of 6.0 mg/mL样品 浓度6.0 mg/mL时FeSO4-7H2O
含量相对值(mmol/L)相关线性方程 R2 A 2.03±0.10b y=0.3093x+0.0596 0.9961 B 2.72±0.01a y=0.4193x+0.0754 0.9973 C 1.52±0.03d y=0.2277x+0.077 0.9978 D 1.73±0.09c y=0.2771x+0.0426 0.9986 E 0.97±0.01e y=0.1535x+0.03 0.9996 F 1.43±0.07d y=0.2251x+0.0088 0.9952 G 0.61±0.04f y=0.1043x−0.0231 0.9997 H 0.91±0.20e y=0.1553x−0.0067 0.9998 注:相关线性方程中的y为Fe2+相对浓度,mmol/L;x为样品浓度,mg/mL。 2.3.4 样品对α-淀粉酶活性的影响
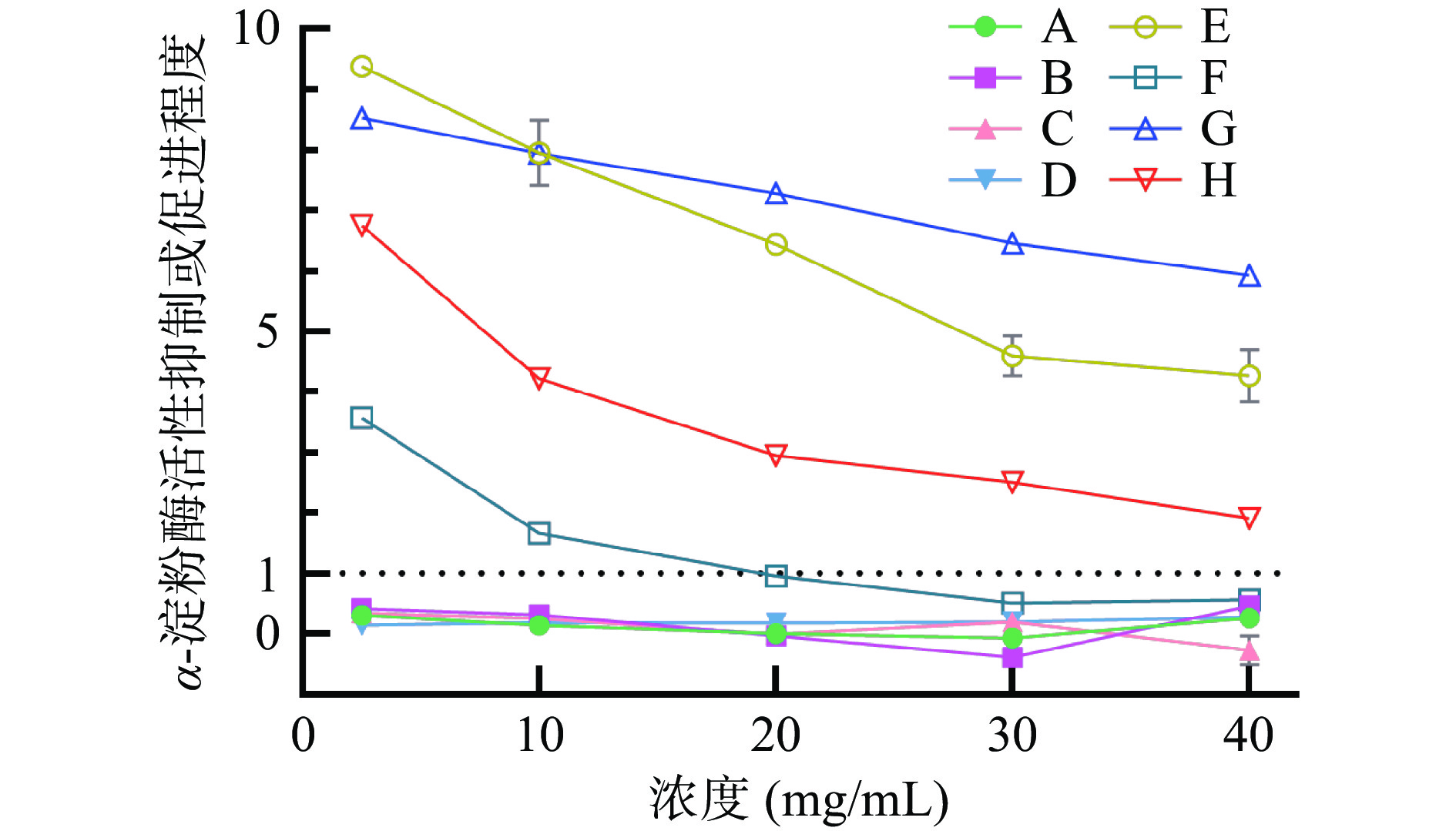
8种样品对α-淀粉酶活力影响如图5所示,纵坐标以α-淀粉酶自身酶活力作对照,大于1表示促进α-淀粉酶活力,小于1表示抑制α-淀粉酶活力。冠突曲霉发酵样品E、G、H在2.5~40 mg/mL浓度范围内对α-淀粉酶活力均有提升,而样品F在浓度接近20 mg/mL时对α-淀粉酶活力起抑制作用,随浓度增加,抑制作用增强,样品F对α-淀粉酶的活性具有双向调节作用。未经冠突曲霉发酵样品A、B、C、D对α-淀粉酶活力均表现为抑制作用,其变化趋势规律性不明显。
2.4 化学成分与功效关联性分析
对7个化学成分及4种功能性测试结果进行关联性分析,结果如表8所示。DPPH、ABTS、FRAP均与水浸出物、总黄酮极显著相关(∣相关系数∣>0.9),此外,DPPH与可溶性蛋白有极显著的负相关关系(相关系数<−0.9),ABTS、FRAP与游离氨基酸、可溶性糖有极显著的正相关关系(相关系数>0.9)。α-淀粉酶活性与可溶性蛋白有极显著的负相关关系(相关系数<−0.9)。
表 8 化学成分与功能活性的相关性分析Table 8. Correlation analysis between chemical composition and functional activity水浸出物 可溶性蛋白 原花青素 游离氨基酸 茶多酚 总黄酮 可溶性糖 DPPH ABTS FRAP α-淀粉酶活性 水浸出物 1.00 0.90** 0.78** 0.88** 0.84** 0.94** 0.98** −0.94** 0.95** 0.94** −0.90** 可溶性蛋白 1.00 0.91** 0.91** 0.89** 0.90** 0.89** −0.92** 0.85** 0.86** −0.96** 原花青素 1.00 0.92** 0.90** 0.88** 0.85** −0.78** 0.84** 0.87** −0.77** 游离氨基酸 1.00 0.99** 0.95** 0.92** −0.84** 0.91** 0.92** −0.84** 茶多酚 1.00 0.92** 0.89** −0.81** 0.87** 0.88** −0.83** 总黄酮 1.00 0.96** −0.91** 0.95** 0.96** −0.82** 可溶性糖 1.00 −0.89** 0.99** 0.98** −0.86** DPPH 1.00 −0.85** −0.86** 0.89** ABTS 1.00 0.98** −0.80** FRAP 1.00 −0.79** α-淀粉酶活性 1.00 注:单尾显著性:*P<0.05,**P<0.01。 3. 讨论
试验结果表明,不同加工工艺的桑寄生茶在化学成分、感官审评及功能活性上有显著差异,且具有明显的交互作用。其中,自然发酵处理能增强桑寄生茶清香气;杀青处理能提高水浸出物、游离氨基酸、茶多酚、总黄酮、可溶性糖等化学成分含量,并提升DPPH自由基、ABTS自由基清除能力及铁离子还原能力;冠突曲霉发酵处理能大幅度加深汤色,赋予桑寄生茶药香气味,使桑寄生茶回甘更为明显,并提升α-淀粉酶活性。但自然发酵及冠突曲霉发酵等加工技术均会降低桑寄生茶的7个化学成分含量。
自然发酵处理的作用机理是揉捻后样品细胞结构被破坏,内含物溢出,并在水解酶作用下发生反应,同时产生热量形成湿热条件,适当湿热条件下糖苷酶、糖苷转移酶等活性增强,促进糖、蛋白质和黄酮类化合物水解,同时促进茶多酚和原花青素等成分发生非酶促降解[20-21]。因此,自然发酵后样品的可溶性糖、可溶性蛋白、总黄酮、茶多酚、原花青素含量明显下降。游离氨基酸的降低主要有两方面原因,其一是游离氨基酸与儿茶素代谢产物邻醌结合;其二是自身转化为苯乙醇、苯乙醛等挥发性物质[22-23]。
杀青处理会提高茶多酚、总黄酮、游离性氨基酸、可溶性糖、水浸出物的含量,但可溶性蛋白和原花青素的含量有所下降。样品经杀青处理,多酚氧化酶、糖苷酶被钝化,细胞膜功能被破坏,促使茶多酚、氨基酸、黄酮等成分的浸出率升高[13]。不溶性大分子糖类如纤维素、果胶等也在高温下转化为可溶性物质。胡晶[24]研究发现,蛋白质与茶多酚等多酚类物质结合形成了非水溶性转化产物,使可溶性蛋白含量下降,同时某些易氧化物质如原花青素结构在高温下被破坏[25],导致原花青素含量下降。
样品经冠突曲霉发酵处理,7种化学成分的含量均有明显下降,其中,原花青素、茶多酚、游离氨基酸下降40%~80%。冠突曲霉发酵过程中可产生多种胞外酶如多酚氧化酶、淀粉酶、蛋白酶等,并通过降解、糖基化、去糖基化、甲基化和氧化聚合等一系列反应,从而使多酚、多糖、蛋白质等成分被分解[26],结果与赵宏朋、冉莉莎等[27-28]研究一致。
桑寄生茶对α-淀粉酶的活性调节可能与糖蛋白——凝集素[29]的含量有关,凝集素为寡糖与缬氨酸结合的酸性糖蛋白,可抑制α-淀粉酶的活性[30]。冠突曲霉可通过胞外酶将凝集素降解为氮源、碳源,从而拮抗其对α-淀粉酶的抑制作用。
4. 结论
通过自然发酵、杀青和冠突曲霉发酵等三种加工技术制备的桑寄生茶与红茶、绿茶、黑茶等类型茶叶的变化趋势一致,桑寄生茶具备作为别样茶的基本特性。样品B、F的7个主要化学成分含量及DPPH自由基清除能力、ABTS自由基清除能力、铁离子还原能力均较高;此外,样品F在2.5~40 mg/mL浓度范围对α-淀粉酶活性具有双向调节作用,且具有药香气,回甘明显。即样品B、F涉及的加工技术——杀青、杀青结合冠突曲霉发酵,可作为关键加工技术用于制作品质优异的桑寄生茶。
-
表 1 感官审评评分标准
Table 1 Scoring criteria of organoleptic evaluation
指标 评价标准 评分(分) 汤色 根据发酵程度划分红浓、橙红、橙黄、
黄绿等档次,明亮,澄清90<x≤100 根据发酵程度划分红浓、橙红、橙黄、
黄绿等档次,尚明亮,略有浑浊80<x≤90 根据发酵程度划分红浓、橙红、橙黄、
黄绿等档次,欠亮,浑浊70<x≤80 香气 (香型描述,如花香、蜜香、药香),
香气纯正,无杂气味,香高爽,香气持久90<x≤100 (香型描述,如花香、蜜香、药香),
香气较高尚纯正,无杂气味,80<x≤90 (香型描述,如花香、蜜香、药香),香气尚纯 70<x≤80 滋味 醇厚,回味甘爽 90<x≤100 尚醇厚 80<x≤90 尚醇,略有苦涩等杂味 70<x≤80 表 2 8种样品的化学成分含量(干基,%)
Table 2 Chemical composition content of eight kinds of samples (dry base, %)
样品 水浸出物 可溶性蛋白 原花青素 游离氨基酸 茶多酚 总黄酮 可溶性糖 A 25.18±0.15c 0.53±0.02a 0.75±0.01a 0.85±0.01b 8.88±0.36c 2.52±0.52b 3.02±0.03b B 27.73±0.14a 0.50±0.00b 0.58±0.00b 0.94±0.01a 9.70±0.46a 2.71±0.56a 3.50±0.04a C 23.55±0.11d 0.48±0.00c 0.43±0.01c 0.76±0.00d 7.96±0.56d 2.22±0.39c 2.66±0.03e D 25.61±0.21b 0.48±0.00c 0.41±0.03d 0.84±0.01c 9.42±0.68b 2.49±0.36b 2.94±0.02c E 20.90±0.10f 0.36±0.00f 0.14±0.03f 0.42±0.00f 3.74±0.58g 1.97±0.24d 2.15±0.03g F 24.90±0.04c 0.45±0.00d 0.22±0.02e 0.53±0.00e 4.52±0.04e 2.19±0.18c 2.70±0.04d G 19.15±0.20g 0.32±0.00g 0.08±0.01h 0.38±0.00g 3.25±0.07h 1.73±0.21f 2.00±0.03h H 21.88±0.11e 0.39±0.01e 0.13±0.01g 0.42±0.00f 4.25±0.12f 1.83±0.42e 2.34±0.03f 注:同列字母不同表示差异显著(P<0.05),表4~表7同。 表 3 主体间效应检验
Table 3 Inter subject effect test
源 因变量 III 类平
方和自由度 F值 显著性 自然发酵 水浸出物 27.219 1 1337.354 P<0.01 可溶性蛋白 0.009 1 6883.516 P<0.01 原花青素 0.157 1 70131.094 P<0.01 游离氨基酸 0.040 1 70676.859 P<0.01 茶多酚 1.448 1 788.066 P<0.01 总黄酮 0.480 1 325.743 P<0.01 可溶性糖 0.765 1 71570.144 P<0.01 杀青 水浸出物 48.335 1 2374.853 P<0.01 可溶性蛋白 0.006 1 4410.784 P<0.01 原花青素 0.001 1 579.138 P<0.01 游离氨基酸 0.037 1 65006.069 P<0.01 茶多酚 6.213 1 3381.868 P<0.01 总黄酮 0.227 1 154.337 P<0.01 可溶性糖 1.012 1 94704.247 P<0.01 冠突曲
霉发酵水浸出物 87.153 1 4282.078 P<0.01 可溶性蛋白 0.082 1 61515.840 P<0.01 原花青素 0.952 1 426128.386 P<0.01 游离氨基酸 1.016 1 1786183.053 P<0.01 茶多酚 153.059 1 83315.476 P<0.01 总黄酮 1.838 1 1248.053 P<0.01 可溶性糖 3.223 1 301573.024 P<0.01 自然发
酵×杀青水浸出物 1.146 1 56.318 P<0.01 可溶性蛋白 0.000 1 28.820 P<0.01 原花青素 0.006 1 2488.127 P<0.01 游离氨基酸 0.002 1 4307.651 P<0.01 茶多酚 0.275 1 149.944 P<0.01 总黄酮 0.001 1 0.783 - 可溶性糖 0.068 1 6323.129 P<0.01 自然发酵×
冠突曲霉发酵水浸出物 0.387 1 19.023 P<0.01 可溶性蛋白 0.000 1 369.264 P<0.01 原花青素 0.045 1 20083.856 P<0.01 游离氨基酸 0.000 1 638.403 P<0.01 茶多酚 0.078 1 42.565 P<0.01 总黄酮 0.003 1 2.004 - 可溶性糖 0.066 1 6193.973 P<0.01 杀青×冠突
曲霉发酵水浸出物 1.698 1 83.408 P<0.01 可溶性蛋白 0.015 1 11038.234 P<0.01 原花青素 0.038 1 16954.748 P<0.01 游离氨基酸 0.000 1 511.193 P<0.01 茶多酚 0.095 1 51.771 P<0.01 总黄酮 0.007 1 4.715 P<0.05 可溶性糖 0.006 1 601.096 P<0.01 自然发酵×
杀青×冠突
曲霉发酵水浸出物 0.235 1 11.538 P<0.01 可溶性蛋白 0.001 1 563.706 P<0.01 原花青素 0.011 1 4978.039 P<0.01 游离氨基酸 0.002 1 3209.791 P<0.01 茶多酚 0.063 1 34.076 P<0.01 总黄酮 0.013 1 8.685 P<0.01 可溶性糖 0.000 1 0.776 - 注:-表示差异不显著(P>0.05)。 表 4 8种样品的感官审评结果
Table 4 Organoleptic evaluation of eight kinds of samples
样品 泡数 审评因子 一二泡分别评分总分(汤色×0.3+香气×0.35+滋味×0.35) 样品总分(一泡总分×0.5+二泡总分×0.5) 汤色 香气 滋味 评语 评分(分) 评语 评分(分) 评语 评分(分) A 第一泡 明亮,澄清,鹅黄 91.67±1.53 花香,奶香,
香气纯正93.00±3.00 醇厚,回味甘爽 89.67±3.51 91.43±2.03 90.90±1.57a 第二泡 透亮,黄带绿 92.00±1.73 奶香气显著,带桑叶香,香气持久 90.67±1.15 醇厚,回甜 88.67±4.16 90.37±1.10 B 第一泡 尚明亮,黄绿 82.33±6.35 清香,略带酸气 80.33±5.51 尚醇厚,微酸,涩 74.33±4.04 78.83±4.13 78.01±3.68d 第二泡 尚明亮,黄带绿 82.67±8.74 淡香,略带酸气 75.33±4.04 尚醇厚,微涩,微酸 74.33±5.13 77.18±3.84 C 第一泡 明亮,黄 87.33±6.43 清香,略带奶香 81.67±6.66 尚醇,微甜,微涩 79.33±5.77 82.55±4.63 83.08±3.20c 第二泡 明亮,黄 89.33±3.06 清香,微带奶香气 83.67±3.21 尚醇厚,微酸,微甘 78.67±7.09 83.62±1.81 D 第一泡 透亮,澄清,黄 92.33±2.08 栗香,清香 86.00±3.61 尚醇厚,微酸回甘 81.00±8.54 86.15±3.63 86.61±2.93bc 第二泡 明亮,橙黄 92.67±2.52 蜜香,栗香 87.67±2.52 微涩,带甜 81.67±9.07 87.07±2.77 E 第一泡 尚明亮,橙黄 87.00±2.65 淡药香,清香 82.33±4.04 尚醇,微苦,回甘, 82.67±4.93 83.85±1.96 83.97±1.82bc 第二泡 明亮,橙黄 87.00±2.65 淡药香气 82.33±4.04 尚醇,甘甜,
回甘持久83.33±4.62 84.08±2.09 F 第一泡 明亮,澄清,橙黄 89.67±3.51 桑叶茶香,带花香 87.33±2.31 尚醇厚 82.33±4.04 86.28±1.15 85.97±1.35bc 第二泡 明亮,橙黄 88.33±4.73 花香,微带枣香气 84.00±1.73 尚醇厚,微涩 85.00±3.00 85.65±1.70 G 第一泡 尚明亮,橙黄带绿 88.33±2.08 甘和茶药香 89.33±3.51 尚醇厚,回甘 84.00±4.58 87.17±2.05 87.28±2.25ab 第二泡 尚明亮,橙黄带绿 88.33±3.21 药香明显,纯正 86.67±3.51 尚醇厚,甘甜 87.33±2.31 87.40±2.90 H 第一泡 尚明亮,橙黄带绿 84.00±3.46 清香 79.33±3.06 尚醇厚,微涩,略苦 72.00±3.46 78.17±0.91 79.30±2.33d 第二泡 尚明亮,橙黄 87.67±7.51 淡枣香 79.33±5.77 尚醇厚,微涩,微凉 75.33±5.03 80.43±2.99 表 5 8种样品的DPPH自由基清除能力的IC50
Table 5 IC50 of DPPH radical scavenging capacity of eight kinds of samples
样品 IC50(mg/mL) A 8.03±0.30e B 5.29±0.32f C 10.23±0.17d D 8.58±0.70de E 17.31±0.20c F 8.75±0.23de G 27.26±0.87a H 19.98±2.71b 表 6 8种样品浓度为2.5 mg/mL时的ABTS自由基清除能力及相关线性方程
Table 6 ABTS radical scavenging ability and correlation linear equation of eight kinds of samples at the concentration of 2.5 mg/mL
样品 浓度2.5 mg/mL时
Trolox相对值(mmol/L)相关线性方程 R2 A 1.20±0.07b y=0.453x+0.0792 0.9972 B 1.62±0.01a y=0.6086x+0.1166 0.9963 C 0.90±0.05d y=0.3459x+0.043 0.9994 D 1.08±0.06c y=0.3944x+0.0961 0.9999 E 0.56±0.01f y=0.1916x+0.0858 0.9970 F 0.92±0.04d y=0.328x+0.0928 0.9997 G 0.47±0.01g y=0.1414x+0.1185 0.9994 H 0.66±0.01e y=0.2156x+0.1189 0.9993 注:相关线性方程中的y为Trolox标准浓度,mmol/L;x为样品浓度,mg/mL。 表 7 8种样品浓度为6.0 mg/mL时的铁离子还原能力及相关线性方程
Table 7 Iron ion reduction capacity and correlation linear equation of eight kinds of samples at the concentration of 6.0 mg/mL
样品 浓度6.0 mg/mL时FeSO4-7H2O
含量相对值(mmol/L)相关线性方程 R2 A 2.03±0.10b y=0.3093x+0.0596 0.9961 B 2.72±0.01a y=0.4193x+0.0754 0.9973 C 1.52±0.03d y=0.2277x+0.077 0.9978 D 1.73±0.09c y=0.2771x+0.0426 0.9986 E 0.97±0.01e y=0.1535x+0.03 0.9996 F 1.43±0.07d y=0.2251x+0.0088 0.9952 G 0.61±0.04f y=0.1043x−0.0231 0.9997 H 0.91±0.20e y=0.1553x−0.0067 0.9998 注:相关线性方程中的y为Fe2+相对浓度,mmol/L;x为样品浓度,mg/mL。 表 8 化学成分与功能活性的相关性分析
Table 8 Correlation analysis between chemical composition and functional activity
水浸出物 可溶性蛋白 原花青素 游离氨基酸 茶多酚 总黄酮 可溶性糖 DPPH ABTS FRAP α-淀粉酶活性 水浸出物 1.00 0.90** 0.78** 0.88** 0.84** 0.94** 0.98** −0.94** 0.95** 0.94** −0.90** 可溶性蛋白 1.00 0.91** 0.91** 0.89** 0.90** 0.89** −0.92** 0.85** 0.86** −0.96** 原花青素 1.00 0.92** 0.90** 0.88** 0.85** −0.78** 0.84** 0.87** −0.77** 游离氨基酸 1.00 0.99** 0.95** 0.92** −0.84** 0.91** 0.92** −0.84** 茶多酚 1.00 0.92** 0.89** −0.81** 0.87** 0.88** −0.83** 总黄酮 1.00 0.96** −0.91** 0.95** 0.96** −0.82** 可溶性糖 1.00 −0.89** 0.99** 0.98** −0.86** DPPH 1.00 −0.85** −0.86** 0.89** ABTS 1.00 0.98** −0.80** FRAP 1.00 −0.79** α-淀粉酶活性 1.00 注:单尾显著性:*P<0.05,**P<0.01。 -
[1] NANRI H, YOSHIDA T, WATANABE Y, et al. The association between habitual green tea consumption and comprehensive frailty as assessed by Kihon checklist indexes among an older Japanese population[J]. Nutrients,2021,13(11):4149. doi: 10.3390/nu13114149
[2] ZENG L, WATANABE N, YANG Z. Understanding the biosyntheses and stress response mechanisms of aroma compounds in tea (Camellia sinensis) to safely and effectively improve tea aroma[J]. Crit Rev Food Sci Nutr,2019,59(14):2321−2334. doi: 10.1080/10408398.2018.1506907
[3] DAI W, XIE D, LU M, et al. Characterization of white tea metabolome: Comparison against green and black tea by a nontargeted metabolomics approach[J]. Food Res Int,2017,96:40−45. doi: 10.1016/j.foodres.2017.03.028
[4] ANNUNZIATA G, MAISTO M, SCHISANO C, et al. Colon bioaccessibility and antioxidant activity of white, green and black tea polyphenols extract after in vitro simulated gastrointestinal digestion[J]. Nutrients,2018,10(11):1711. doi: 10.3390/nu10111711
[5] YUAN D, LIN L, PENG Y, et al. Effects of black tea and black brick tea with fungal growth on lowering uric acid levels in hyperuricemic mice[J]. J Food Biochem,2022,46(7):e14140.
[6] LONG P, CUI Z, WANG Y, et al. Commercialized non-Camellia tea: traditional function and molecular identification[J]. Acta Pharm Sin B,2014,4(3):227−37. doi: 10.1016/j.apsb.2014.02.006
[7] 张巧花, 赵思远, 韩雪, 等. 葛叶代用茶制备工艺及品质分析[J]. 食品工业,2022,43(7):77−81. [ZHANG Q H, ZHAO S Y, HAN X, et al. Preparation technology and quality analysis of Pueraria lobata leaf herbal tea[J]. The Food Industry,2022,43(7):77−81. [8] 张永瑞, 鲁静, 郭桂义, 等. 刺槐花代用茶加工工艺研究与品质分析[J]. 食品科技,2020,45(3):121−126. [ZHANG Y R, LU J, GUO G Y, et al. Technology research and quality analysis on substitute tea of Robinia pseudoacacia L. flowers[J]. Food Science,2020,45(3):121−126. doi: 10.13684/j.cnki.spkj.2020.03.024 [9] 何克谏. 生草药性备要[M]. 广州: 广东科技出版社, 2009: 57. HE K J. Preparation of raw herbal medicine[M]. Guangzhou: Guangdong Science and Technology Press, 2009: 57.
[10] 纪鹏彬, 李新生, 燕飞, 等. 茶叶适制性研究进展[J]. 食品研究与开发,2021,42(13):219−224. [JI P B, LI X S, YAN F, et al. Research progress on tea suitability[J]. Food Research and Development,2021,42(13):219−224. doi: 10.12161/j.issn.1005-6521.2021.13.032 [11] 国家食品药品监督管理总局, 国家卫生和计划生育委员会. GB 5009.3-2016食品安全国家标准 食品中水分的测定[S]. 北京: 中国标准出版社, 2016: 1−2. State Food and Drug Administration, National Health and Family Planning Commission. GB 5009.3-2016 National food safety standard Determination of moisture in food[S]. Beijing: China Standard Press, 2016: 1−2.
[12] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 8305-2013茶 水浸出物测定[S]. 北京: 中国标准出版社, 2014: 1−2. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. GB/T 8305-2013 Tea—Determination of water extracts content[S]. Beijing: Standards Press of China, 2014: 1−2.
[13] 张馨宇. 杜仲叶功能茶加工工艺研究[D]. 杨凌: 西北农林科技大学, 2016: 14. ZHANG X Y. A study on the processing technology of Eucommia ulmoides functional tea[D]. Yangling: Northwest A & F University, 2016: 14.
[14] 天津市市场监督管理委员会. DB12/T 885-2019植物提取物中原花青素的测定紫外/可见分光光度法[S]. 2019: 1−3. Tianjin Administration for Market Regulation. DB12/T 885-2019 Determination of polysaccharide in Lily Bulbus-UV/VIS spectrophotometry[S]. 2019: 1−3.
[15] 国家食品药品监督管理总局, 国家卫生和计划生育委员会. GB 5009.124-2016 食品安全国家标准 食品中氨基酸的测定[S]. 北京: 中国标准出版社, 2016: 1−6. State Food and Drug Administration, National Health and Family Planning Commission. GB 5009.124-2016 National food safety standard determination of amino acids in foods[S]. Beijing: China Standard Press, 2016: 1−6.
[16] 国家市场监督管理总局, 国家标准化管理委员会. GB/T 8313-2018 茶叶中茶多酚和儿茶素类含量的检测方法[S]. 北京: 中国标准出版社, 2018: 4−5. State Administration of Market Supervision and Administration, Standardization Administration of the People's Republic of China. GB/T 8313-2018 Determination of total polyphenols and catechins content in tea[S]. Beijing: Standards Press of China, 2018: 4−5.
[17] 黄蜚颖. 基于寄主影响的中药桑寄生药性研究[D]. 南宁: 广西中医药大学, 2018: 9−21. HUANG F Y. Study on the difference of cold and hot property of Taxillus chinensis based on host plants[D]. Nanning: Guangxi University of Chinese Medicine, 2018: 9−21.
[18] 李远华. 普通高等教育“十三五”规划教材 茶学综合实验[M]. 北京: 中国轻工业出版社, 2018: 198−199. LI Y H. Textbooks for the 13th five year plan of general higher education comprehensive experiment of tea science[M]. Beijing: China Light Industry Press, 2018: 198−199.
[19] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 23776-2018 茶叶感官审评方法[S]. 北京: 中国标准出版社, 2018: 1−20. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. GB/T 23776-2018 Methodology for sensory evaluation of tea[S]. Beijing: Standards Press of China, 2018: 1−20.
[20] 薛金金, 尹鹏, 张建勇, 等. 工夫红茶品质化学成分及加工工艺研究进展[J]. 食品研究与开发,2020,41(18):219−224. [XUE J J, YIN P, ZHANG J Y, et al. Research progress on quality-related chemical components and processing technology of Congou black tea doi: 10.12161/j.issn.1005-6521.2020.18.036 J]. Food Research and Development,2020,41(18):219−224. doi: 10.12161/j.issn.1005-6521.2020.18.036
[21] 陶琳琳, 张娅楠, 闫振, 等. 红茶加工过程中发酵技术研究进展[J]. 广东茶业,2020,1(1):2−6. [TAO L L, ZHANG Y N, YAN Z, et al. Research progress of fermentation technology in black tea processing[J]. Guangdong Tea Industry,2020,1(1):2−6. doi: 10.3969/j.issn.1672-7398.2020.01.001 [22] CHEN Y, ZENG L, LIAO Y, et al. Enzymatic reaction-related protein degradation and proteinaceous amino acid metabolism during the black tea (Camellia sinensis) manufacturing process[J]. Foods,2020,9(1):66. doi: 10.3390/foods9010066
[23] 赵和涛. 红茶发酵时主要化学变化及不同发酵方法对工夫红茶品质的影响[J]. 蚕桑茶叶通讯,1989(2):10−13. [ZHAO H T. Main chemical changes of black tea during fermentation and effects of different fermentation methods on quality of Congou black tea[J]. Journal of Sericulture Tea Communication,1989(2):10−13. [24] 胡晶. 炒制对大麦芽蛋白—多酚复合物抗氧化活性、抗增殖活性的影响[D]. 广州: 暨南大学, 2020: 44−45. HU J. Effect of frying on antioxidant activity and antiproliferation activity of protein-phenolic complex from barley malt[D]. Guangzhou: Jinan University, 2020: 44−45.
[25] 钱玉玲, 王维维, 荣国强, 等. 超声波辅助提取蔓越莓中原花青素及其抗氧化性研究[J]. 凯里学院学报,2021,39(6):35−41. [QIAN Y L, WANG W W, RONG G Q, et al. Ultrasonic assisted extraction and antioxidant activity of proanthocyanidins from cranberry doi: 10.3969/j.issn.1673-9329.2021.06.007 J]. Journal of Kaili University,2021,39(6):35−41. doi: 10.3969/j.issn.1673-9329.2021.06.007
[26] 方洪枫. 冠突曲霉和黑曲霉产胞外水解酶及酯型儿茶素水解研究[D]. 福州: 福建师范大学, 2017, 9−46. FANG H F. Detection of extracellular hydrolase from Aspergillus cristatus and Aspergillus niger and hydrolysis of catechin gallates[D]. Fuzhou: Fujian Normal University, 2017, 9−46.
[27] 赵宏朋, 黄斯晨, 施丽娟, 等. 茯砖茶优势菌株分离鉴定及发酵低级绿茶分析[J]. 食品科学,2022,43(6):89−95. [ZHAO H P, HUANG S C, SHI L J, et al. Isolation and identiflcation of predominant fungi in Fuzhuan tea and their application for fermentation of low-grade green tea[J]. Food Science,2022,43(6):89−95. doi: 10.7506/spkx1002-6630-20210415-211 [28] 冉莉莎, 刘宝贵, 陈崇俊, 等. “金花”菌分离鉴定及其对茯茶化学成分的影响[J]. 辐射研究与辐射工艺学报,2021,39(5):96−103. [RAN L S, LIU B G, CHEN C J, et al. Isolation and identification of “golden flower” fungus and determination of its effects on chemical the composition of Fu tea[J]. Journal of Radiation Research and Radiation Processing,2021,39(5):96−103. doi: 10.11889/j.1000-3436.2021.rrj.39.050701 [29] 陈希宏, 曾仲奎, 刘荣华. 桑寄生凝集素的纯化及部分性质研究[J]. 生物化学杂志,1992(2):150−156. [CHEN X H, ZENG Z K, LIU R H. Purification and characterization of lectin from Loranthus parasiticus (L.) Merr[J]. Biochemical Journal,1992(2):150−156. [30] 李梦洋, 常远, 冯国军, 等. α-淀粉酶抑制剂构效关系及应用研究进展[J/OL]. 食品工业科技:1−17[2022-05-04]. DOI: 10.13386/j.issn1002-0306.2021080293. LI M Y, CHANG Y, FENG G J, et al. Research progress on structure-activity relationship and application of α-amylase inhibitors[J/OL]. Science and Technology of Food Industry:1−17[2022-05-04]. DOI: 10.13386/j.issn1002-0306.2021080293.
-
期刊类型引用(8)
1. 吕广英,韩晓宇,樊军浩,王泊然. 儿童低糖保健饼干的配方研究. 江苏调味副食品. 2025(01): 23-25 .  百度学术
百度学术
2. 米合热阿依·阿不都热合曼,米叶色尔·吐逊. 烘焙技术在健康食品生产中的应用探索. 现代食品. 2024(10): 121-123 .  百度学术
百度学术
3. 左丹,赵开飞. 功能性成分在烘焙制品中的应用与研究进展. 食品工业. 2024(07): 229-234 .  百度学术
百度学术
4. 胡志高. 焙烤食品的营养成分分析及安全管控研究. 中外食品工业. 2024(10): 22-24 .  百度学术
百度学术
5. 孟庆,孙亚楠. 烘焙食品中天然抗氧化剂的应用及其对保质期的影响. 现代食品. 2024(22): 156-158 .  百度学术
百度学术
6. 刘婉,田菊平. 高糖饮食危害及西点减糖策略研究. 食品安全导刊. 2023(18): 175-178 .  百度学术
百度学术
7. 严玮一. 食品中甜味剂的前处理与检测技术现状. 食品安全导刊. 2023(19): 177-179 .  百度学术
百度学术
8. 李守宏,王雅珍,徐清. 专用酶制剂降低面包中油脂添加量的研究. 现代面粉工业. 2023(05): 26-29 .  百度学术
百度学术
其他类型引用(5)





 下载:
下载:
 下载:
下载:
