Optimization of Aqueous Extraction Preparation Technology of Cistanche deserticola by Response Surface Methodology and Its Activity Research
-
摘要: 为了研究肉苁蓉水提物制备工艺及其营养价值和活性功能研究,本实验采用水提取法,考察不同提取条件对肉苁蓉浸膏得率的影响,并进一步采用响应面法优化工艺,再测定提取物营养成分及功效成分含量,讨论其抗氧化功能及对秀丽隐杆线虫寿命和生殖力的影响。结果显示,当料液比为1:12 g/mL,煎煮时间为140 min,煎煮次数为4次,肉苁蓉水提物(Aqueous extract of Cistanche, AEC)浸膏得率为65.83%±0.87%。此外,检测AEC的营养成分和活性成分,发现其含有大量的营养成分,例如蛋白质(5.22±0.44 g/100 g)、脂肪(0.150±0.06 g/100 g)、氨基酸(0.640±0.05 g/100 g)等,以及松果菊苷(557±4.24 mg/100 g)、毛蕊花糖苷(169±7.07 mg/100 g)、总糖(22.1±0.64 g/100 g)、总黄酮(4.13±0.08 g/100 g)等多种功效成分。AEC还具有良好的DPPH·清除能力、抑制·OH能力、总抗氧化能力和还原能力,且均呈浓度依赖性。最后,AEC还可以延长秀丽隐杆线虫的寿命,其中8 mg/mL AEC效果最好,平均寿命可达10.95±2.40 d。由此可见,水提取后的AEC具有良好的抗氧化能力,富含多种营养成分和功效成分,这提示肉苁蓉具备开发食品抗氧化剂或功能食品的潜力,为日后肉苁蓉的临床应用研究提供一定的理论依据。Abstract: To study the nutritional value and antioxidant activities of Cistanche deserticola Y. C. Ma extract. The water extraction method was used in this experiment to research the effects of different extraction conditions on the dry extract rate of Cistanche deserticola Y. C. Ma. Then the response surface analysis method was further used to optimize the process. Moreover, the nutritional components and functional components of the extract were determined, and the antioxidant function and effects on the life span and fecundity of C. elegans were discussed. The results showed that when the material liquid ratio was 1:12 g/mL, the decocting time was 140 min, and the decocting times were 4 times, the dry extract yield of the aqueous extract of Cistanche (AEC) was 65.83%±0.87%. In addition, the nutritional composition and functional components of AEC was detected and found to contain a large amount of nutritional components such as protein (5.22±0.44 g/100 g), fat (0.150±0.06 g/100 g), amino acids (0.640±0.05 g/100 g), etc, and echinacoside (557±4.24 mg/100 g), acteoside (169±7.07 mg/100 g), total sugar (22.1±0.64 g/100 g), total flavonoids (4.13±0.08 g/100 g) and others. Furthermore, the AEC also showed good DPPH scavenging activity, hydroxyl radical scavenging activity, total antioxidant activity, and reducing activity, all of which were concentration dependent. Finally, AEC could prolong the life span of Caenorhabditis elegans. Among them, 8 mg/mL AEC had the best effect, and its average life span reached 10.95±2.40 d. Therefore, AEC has good antioxidant capacity, and rich in various nutrients and functional components, which indicates that Cistanche deserticola Y. C. Ma has the potential to develop functional food antioxidants and provides a theoretical basis for the clinical application of Cistanche deserticola Y. C. Ma in the future.
-
肉苁蓉(Cistanche deserticola Ma),是一种寄生在沙漠树木梭梭根部的寄生植物,因其功效和适度的滋补性而被广泛接受,素有“沙漠人参”的美誉,具有极高的药用价值,含有多糖、苯乙醇苷类物质、环烯醚萜类及其苷类以及木质素类及其苷类等多种活性成分,是中国传统的名贵中药材[1]。肉苁蓉种类多样,国内主要分为荒漠肉苁蓉、盐生肉苁蓉、管花肉苁蓉及沙苁蓉四大类[2]。传统医学认为肉苁蓉具有补肾阳、益精血、润肠通便的作用[1-3],现代药理研究证明肉苁蓉及其有效成分具有抗疲劳、抗衰老、抗肿瘤、抗菌、抗炎、保肝、抗骨质疏松和促进骨形成及增强机体免疫力[3-7];肉苁蓉可以调节中枢神经系统和内分泌功能、改善性功能、提高记忆能力、抗动脉粥样硬化及预防老年痴呆[8-10]等,此外,还具有降压作用及呼吸麻醉作用等药理作用[2-3,5]。因而肉苁蓉备受人们关注,成为医药领域研究的热点之一。
荒漠肉苁蓉(Cistanche deserticola Y. C. Ma
)是一种分布于沙漠地区的滋补草药,常用作中药,自2020年1月,国家卫生健康委员会、国家市场监督总局正式公布肉苁蓉按照传统既是食品又是中药材的物质(简称食药同源物质)进行生产经营试点工作后,肉苁蓉作为食药同源物质得到了广泛关注及深入的研究[11]。因此,对于肉苁蓉的提取开发便显得尤为重要,提取方法的多样性会导致肉苁蓉活性成分含量的不同,例如,以乙醇提取肉苁蓉时松果菊苷和毛蕊花糖苷得率较高,而以水为溶剂时得率稍低[12]。王英姿等[13]发现超声提取法、絮凝水提法、醇提法三种提取方法会使得松果菊苷、总糖、β-谷甾醇含量会有所改变。此外,肖道安[14]研究证明采用吐温60协同超声提取肉苁蓉多糖效果较好。同时,切片厚度、烘干温度、烘干时间及抑制酶的方式等因素都会导致肉苁蓉有效成分含量的改变[15]。然而,肉苁蓉作为食药同源类物质,急需进一步推广应用开发,结合现代人的饮食生活习惯,开拓肉苁蓉食品市场。考虑到水提法作为传统的提取方法之一,具有节约成本、操作简便、周期短、条件控制方便及引入杂质少等优点,是大多数人们普遍满足的提取方法之一,因此本研究选择此法进行肉苁蓉的提取。 本试验利用荒漠肉苁蓉为原料,考察水提取法多种因素对AEC的影响,通过响应面分析优化提取工艺,初步确定提取物的主要功效成分含量,检测AEC的抗氧化活性,并将AEC应用于模式生物秀丽隐杆线虫,探讨其对线虫寿命和生殖力的影响,以期为肉苁蓉开发为抗氧化产品或功能食品提供一定的理论依据,为日后进一步研究肉苁蓉奠定基础。
1. 材料及方法
1.1 材料与仪器
荒漠肉苁蓉(拉丁学名:Cistanche deserticola Y. C. Ma) 采集于内蒙古鄂尔多斯,由内蒙古三口科技有限公司提供;DPPH试剂盒、总抗氧化能力试剂盒、羟基自由基试剂盒、超氧阴离子试剂盒 南京建成科技有限公司;氯化铁(III) 默克Sigma生命科学;铁氰化钾(K3Fe(CN)6)、三氯乙酸 北京化工厂;氯化钠 国药集团化学试剂有限公司;Tris-HCl、Tris-base Genview。
DFD-700煎煮锅、W201B水浴锅 北京中兴伟业有限公司;INFINITE M NANO多功能酶标仪 TECAN公司;UV-1600紫外分光光度计 上海美普达仪器有限公司。
1.2 实验方法
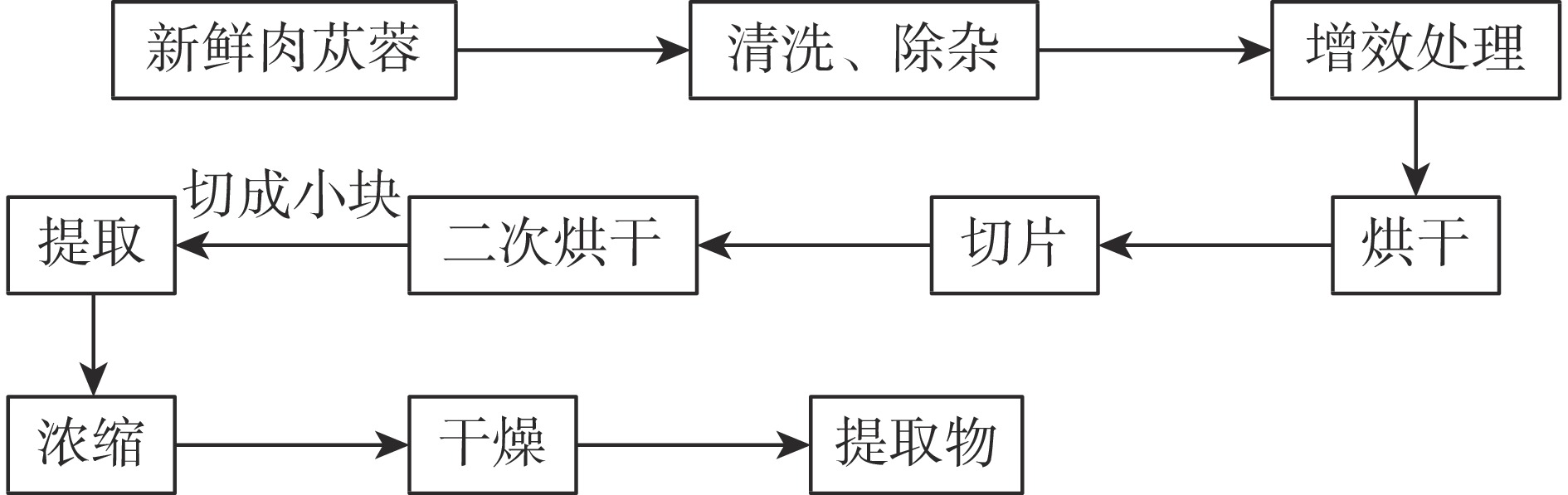
1.2.1 AEC实验工艺流程
工艺流程如图1所示。
1.2.1.1 操作要点
取原料新鲜肉苁蓉净制,除去杂质;放入蒸锅中进行增效处理,再放入鼓风干燥箱中进行烘干(烘干温度60~70 ℃,烘干至水分含量30%~40%);取出肉苁蓉,切厚片,将切片平铺到托盘上放入鼓风干燥箱进行二次烘干(烘干温度60~70 ℃,烘干至水分含量10%以下);将烘干好的肉苁蓉片切成小块备用;称量,加入纯化水进行提取;将提取液进行减压浓缩(真空度−0.08 MPa以上,温度60~70 ℃),浓缩至浸膏状;将浸膏转入真空干燥箱中,进行干燥(真空度−0.08 MPa以上,温度60~80 ℃);至水分含量5%以下。
1.2.2 单因素实验设计
准确称取切片原料100 g,以浸泡30 min、水浴温度100 ℃、料液比1:10 g/mL、煎煮时间1 h、煎煮次数2次为基础固定值,研究不同料液比(1:8、1:10、1:12、1:14、1:16 g/mL)、不同煎煮时间(0.5、1.0、1.5、2.0、2.5 h)和不同煎煮次数(1、2、3、4、5次)对肉苁蓉干浸膏得率的影响。
1.2.3 响应面优化试验
1.2.3.1 响应面试验Box-Behnken设计
本试验根据单因素实验设计,得出较优因素范围,并通过响应面试验分析进一步优化,得到各因素最佳参数[16],如表1所示。
表 1 响应面试验因素水平编码表Table 1. Coding table of response surface test factor level序号 因素 −1 0 1 A 料液比(g/mL) 1:10 1:12 1:14 B 煎煮时间(h) 1.5 2.0 2.5 C 煎煮次数(times) 3 4 5 1.2.3.2 评价指标
以浸膏得率为考察指标,按公式(1)计算浸膏得率。
浸膏得率(%)=m1v1×V0M0×100 (1) 式中:m1为样品溶液测得固形物质量(g);v1为样品溶液称取体积(mL);V0为提取液总体积(mL);M0为实验中原料总质量(g)。
1.2.4 AEC成分指标含量测定
1.2.4.1 基本营养成分含量检测
蛋白质、氨基酸、脂肪、灰分、钠等含量测定参照《食品安全国家标准》(GB/T 5009-2016)中“食品中蛋白质的测定”、“食品中氨基酸的测定”、“食品中脂肪的测定”、“食品中灰分的测定”、“食品中钾、钠的测定”。碳水化合物、能量参照《食品安全国家标准》(GB 28050-2011)问答(修订版))进行计算。
1.2.4.2 活性成分含量检测
松果菊苷、毛蕊花糖苷根据《中华人民共和国药典》规定方法检测。总糖参照《食品安全国家标准》(GB/T 10782-2006)。总黄酮参照食品理化2020版(第二法)。根据杨国宁等[17]的方法检测京尼平苷酸、8-表番木鳖酸、肉苁蓉苷A、管花苷A、异类叶升麻苷、2-乙酰基洋丁香氛苷、管花苷B。粗多糖的测定“粗多糖的苯酚-硫酸分光光度测定法”进行检测[18]。尿囊素含量检测根据陈天朝等[19]的方法进行检测。
1.2.5 AEC体外抗氧化性的测定
1.2.5.1 总抗氧化能力测定
使用蒸馏水将AEC和VC配制成终浓度为0.1、0.2、0.4、0.6、0.8、1.0 mg/mL,参照试剂盒说明书进行操作,按照公式(2)进行计算:
总抗氧化能力(U/mL)=OD2−OD10.01/30×V0V1 (2) 式中:OD1为对照值;OD2为测定值;V0为反应液总量(mL);V1为取样量(mL)。
1.2.5.2 DPPH自由基的清除能力测定
使用蒸馏水将AEC和VC配制成终浓度为0.1、0.2、0.4、0.6、0.8、1.0 mg/mL,参照试剂盒说明书进行操作,按照公式(3)进行计算:
清除率(%)=(1−OD2−OD1OD0)×100 (3) 式中:OD0为空白值;OD1为对照值;OD2为测定值。
1.2.5.3 羟自由基清除能力的测定
使用蒸馏水将AEC和VC配制成终浓度为0.1、0.2、0.4、0.6、0.8、1.0 mg/mL,参照试剂盒说明书进行操作,按公式(4)计算待测样本清除羟自由基的能力:
清除羟自由基能力(U/mL)=OD1−OD2OD−OD0×8.824×1V1 (4) 式中:OD0为空白值;OD1为对照值;OD2为测定值;OD为标准值;V1为取样量(mL),标准品浓度为8.824 mmol/L。
1.2.5.4 还原力测定
制备以下溶液:1% K3Fe(CN)6、0.1% FeCl3 (新鲜)、10%三氯乙酸(Trichloroacetic acid,TCA)和磷酸盐缓冲液(pH6.6)。
使用蒸馏水溶解配制AEC和VC终浓度为0.1、0.2、0.4、0.6、0.8、1.0 mg/mL,参照文献[20]方法检测,在700 nm处测量吸光度(A)。较高的吸光度值表明较高的三价铁还原能力,按公式(5)计算液体还原能力:
还原力=A1−A0 (5) 式中:A0为蒸馏水所测吸光度值;A1为待测样本所测吸光度值。
1.2.6 AEC对秀丽隐杆线虫寿命和生殖能力的影响
1.2.6.1 线虫培养
在6 cm培养皿的线虫生长培养基(Nematome Growth Medium,NGM)上均匀分布涂抹大肠杆菌OP50(E. coli OP50)200 μL,20 ℃培养秀丽隐杆线虫,根据线虫生长状况定期转移至新的NGM培养基中。于65 ℃水浴灭菌,并将AEC溶于大肠杆菌OP50中至终浓度为0、4、8、16 mg/mL,冷藏备用。
1.2.6.2 寿命试验
根据Chen等[21]的方法并稍作修改,将同期化至L4期的野生型N2线虫,随机挑取30条至0、4、8、16 mg/mL AEC加药组与空白对照组,每组3个平行,记为第0 d,20 ℃下培养,每天同一时间将线虫转移至新的同浓度培养皿内,并记录线虫的生存情况。以铂金丝碰触线虫10 s内不动判定为死亡,并依据线虫生存条数绘制生存曲线。
1.2.6.3 生殖力测定
将同期化的L4期野生型N2线虫,随机挑取10条至加药组与空白对照组,每组3个培养皿,此时记为第0 d,每隔24 h将线虫转移至新的同浓度培养皿中,记录当天虫卵数目(产卵量),培养到第8 d,将线虫每天所产虫卵数目相加,即为总产卵量。卵较小不易辨别,可以将板上的卵孵化至L4期放于65 ℃烘箱中烘30 min,使板上线虫死亡后在显微镜下统计幼虫数量,未孵化出幼虫的卵不计入内。
1.3 数据处理
采用SPSS 25.0统计软件进行数据ANONA单因素显著性分析,以
¯X±SD 表示;Graphpad prism 8.0.2 进行绘图;P<0.05表示组间存在显著性差异,P<0.01表示存在极显著性差异。2. 结果与分析
2.1 单因素实验结果
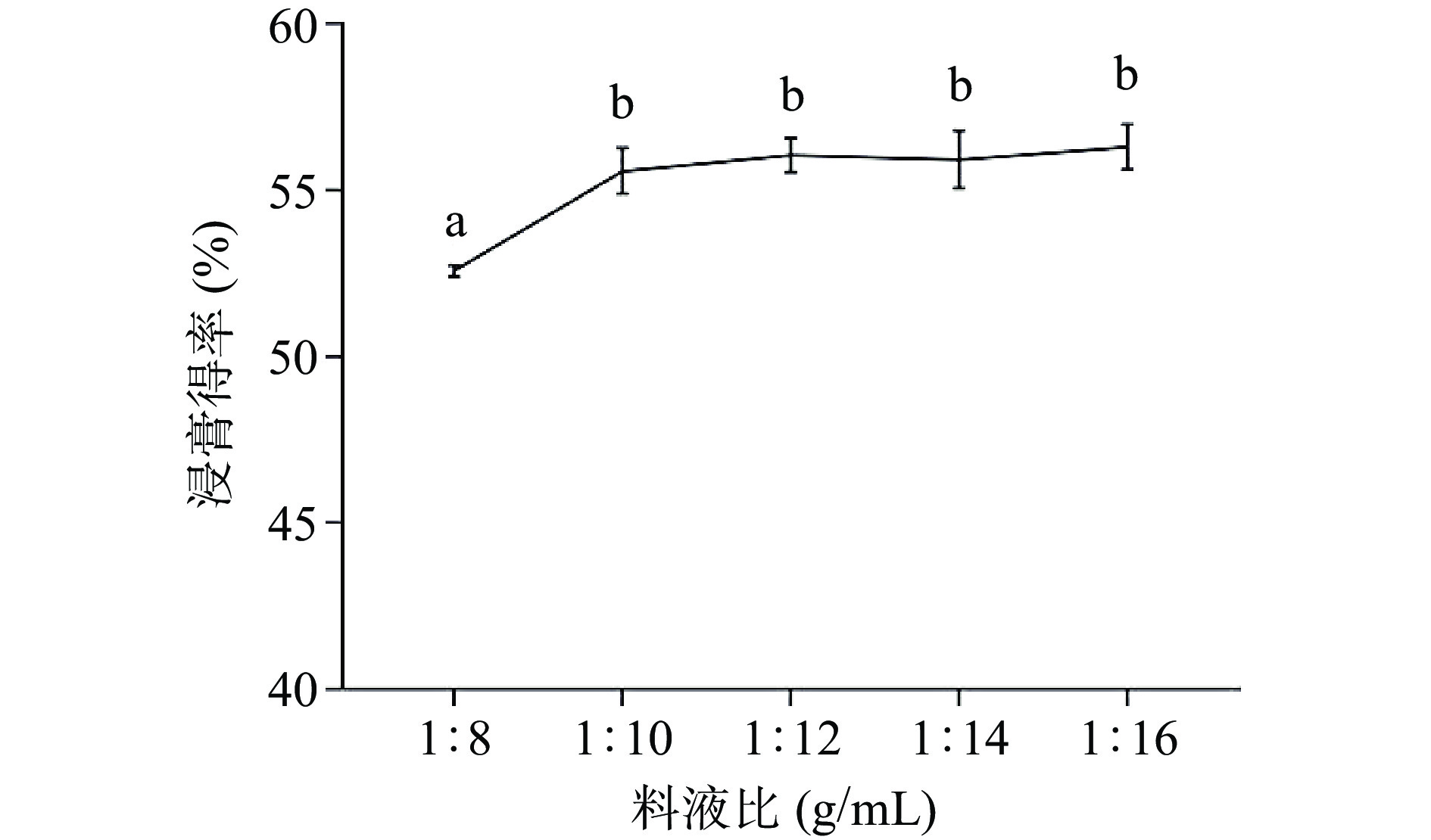
2.1.1 料液比对AEC浸膏得率的影响
在不改变水提物加工流程及常量的前提下,料液比对AEC浸膏得率的影响如图2所示。
由图2观察发现,固定其他因素,只改变料液比,比较得出,1:8 g/mL时浸膏得率最低,为52.58%±0.17%,与其他处理组存在显著差异(P<0.05);1:10、1:12、1:14、1:16分别为55.58%±0.69%、56.05%±0.51%、55.92%±0.87%、56.3%±0.68%,变化范围在0%~0.72%之间,且不存在显著性差异(P>0.05),因此本着节约成本的原则,试验采用1:10、1:12、1:14 g/mL进行响应拟合探究最佳取值。
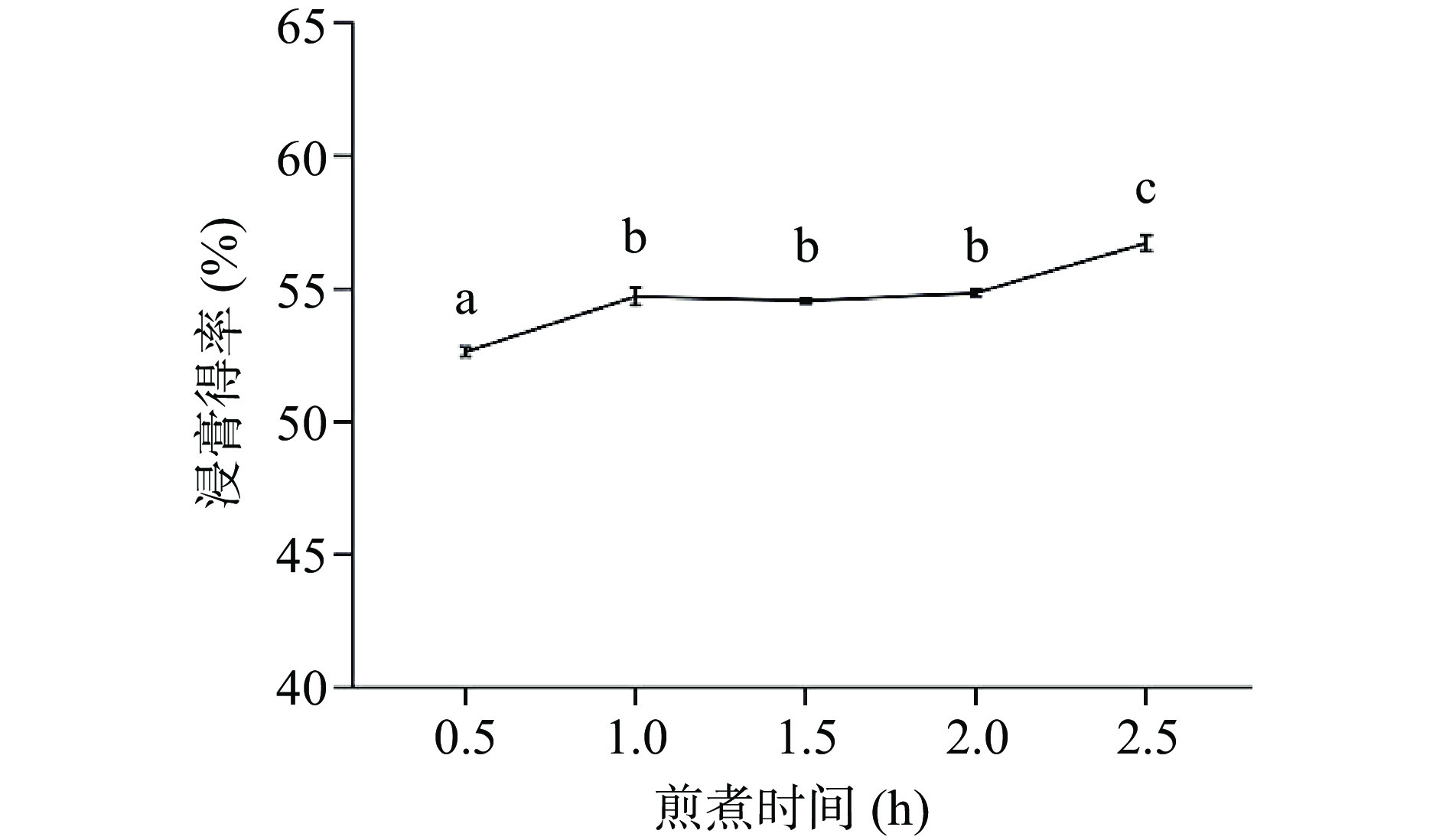
2.1.2 煎煮时间对AEC浸膏得率的影响
在不改变水提物加工流程及固定因素的前提下,煎煮时间对于浸膏得率的影响如图3所示。
由图3观察得出,煎煮时间越长,浸膏得率越高,0.5、1.0、1.5、2.0、2.5 h的浸膏得率分别为52.64%±0.18%、54.73%±0.33%、54.56%±0.09%、54.85%±0.13%、56.73%±0.30%,在1.0~2.0 h之间,浸膏得率变化幅度不大,2.5 h浸膏得率再次升高的原因可能是由于煎煮时间过长,不溶性物质过滤至溶液中使得固形物质量上升,同时液体过量挥发,造成得率升高,而煎煮时间的升高又会造成水提物中一些化合物挥发或转化,使其含量降低[12,15],因此选择1.5、2.0、2.5 h三个水平进行响应拟合探究最佳取值。
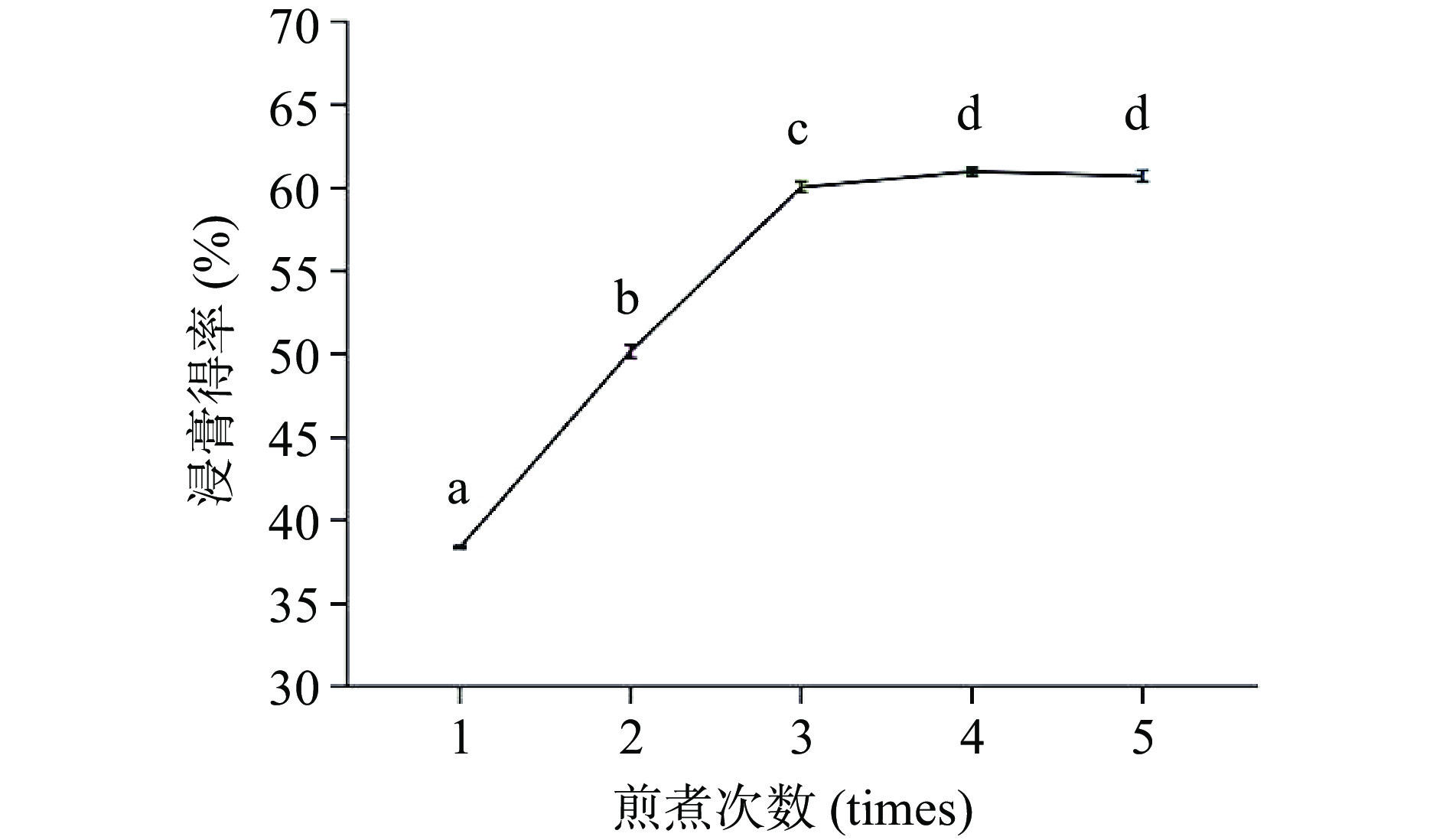
2.1.3 煎煮次数对AEC浸膏得率的影响
在不改变水提物加工流程及固定因素的前提下,检测煎煮次数对于浸膏得率的影响,如图4所示。
由图4中观察发现,煎煮次数为1~3次时,浸膏得率呈线性增长关系,分别为38.39%±0.065%、50.17%±0.398%、60.07%±0.31%,增长速率快速,且两者之间均存在显著性差异(P<0.05);当煎煮次数为4次和5次时,其得率分别为60.98±0.22%、60.72±0.33%,增长速度平缓,由图4可知,当煎煮次数为4次时,浸膏得率最高。因此,选择煎煮次数为3、4、5三个水平进行响应拟合探究最佳取值。
2.2 响应面试验设计
本试验采用Box-Behnken设计,进行分析探讨,研究料液比、煎煮时间和煎煮次数及两两因素之间的交互作用对于浸膏得率的影响,通过单因素实验设计得出各因素对于因变量较优的范围,再利用响应面试验设计得出最佳因素水平,最终得到浸膏得率试验设计的最优参数水平。响应面试验设计如表2所示。
表 2 响应面试验设计与结果Table 2. Response surface test design and results试验号 A料液比 B煎煮时间 C煎煮次数 浸膏得率(%) 1 −1 0 1 63.10 2 0 0 0 60.09 3 0 −1 1 64.96 4 1 −1 0 58.66 5 0 0 0 61.30 6 0 0 0 58.90 7 0 1 −1 52.02 8 0 −1 −1 39.66 9 1 0 1 65.10 10 −1 −1 0 56.51 11 0 1 1 65.30 12 1 1 0 62.70 13 1 0 −1 41.31 14 −1 0 −1 39.54 15 0 0 0 59.70 16 0 0 0 58.90 17 −1 1 0 61.50 使用响应面软件Design Expert 10.0.7对表2中的数据进行分析确定,可得到因变量(浸膏得率)对于自变量(A、B、C)的二次多项方程:
浸膏得率=61.698+1.64A+1.96625B+10.74125C+1.2625AB+0.0575AC−3.005BC−3.289A2−0.0665B2−6.1465C2
2.2.1 各因素方差分析
对该结果进行方差分析,见表3。
表 3 二次多项方程的方差分析Table 3. Analysis of variance of quadratic multinomial equation来源 平方和 自由度 均值 F值 P值 显著性 模型 1194.57 9 132.73 60.80 <0.0001 ** A 6.34 1 6.34 2.90 0.1322 B 59.02 1 59.02 27.04 0.0013 ** C 923.00 1 923.00 422.8 <0.0001 ** AB 0.23 1 0.23 0.10 0.7572 AC 0.013 1 0.013 0.006058 0.9401 BC 36.12 1 36.12 16.55 0.0048 ** A2 10.50 1 10.50 4.81 0.0644 B2 11.37 1 11.37 5.21 0.0564 C2 148.39 1 148.39 67.97 <0.0001 ** 残差 15.28 7 2.18 失拟项 11.32 3 3.77 3.81 0.1145 ns 总和 1209.86 16 R2:0.9874 C.V.%:2.59 R2Adj:0.9711 R2Pred:0.8452 注:*代表存在显著性差异(P<0.05);**代表存在极显著性差异(P<0.01);ns(not significant)代表差异不显著。 通过表3中观察发现,该试验设计模型极显著(P<0.0001),失拟项不显著(P>0.05),表明该回归模型的拟合度较好,模型选择合适,可较为准确地反映各因素与响应值之间的关系,其中B、C、BC、C2具有极显著性差异(P<0.01)。A、B、C三个因素对浸膏得率有不同的影响,影响最大的为C(煎煮次数),其次是B(煎煮时间),A(料液比)因素对浸膏得率的影响最小。回归方程相关系数R2=0.9874,R2越接近1,模型的线性相关程度就会越高[22],表明回归方程的拟合性较好,可更好地说明A、B、C因素对因变量的拟合程度。变异系数(C.V.%)为2.59<10,变异系数越小,变异程度就越低,表明模型的重复性较好,可靠性较高。 R2Adj=0.9711, R2Pred=0.8452,两者均接近1,说明该模型较具代表性,浸膏得率的预测值与实际值之间拟合相关性较高。综上可知,以浸膏得率为响应值所建立的肉苁蓉水提取工艺优化模型是合理的,可利用该模型预测分析不同变量水平对AEC浸膏得率的影响[23-24]。
2.2.2 响应面优化曲面分析
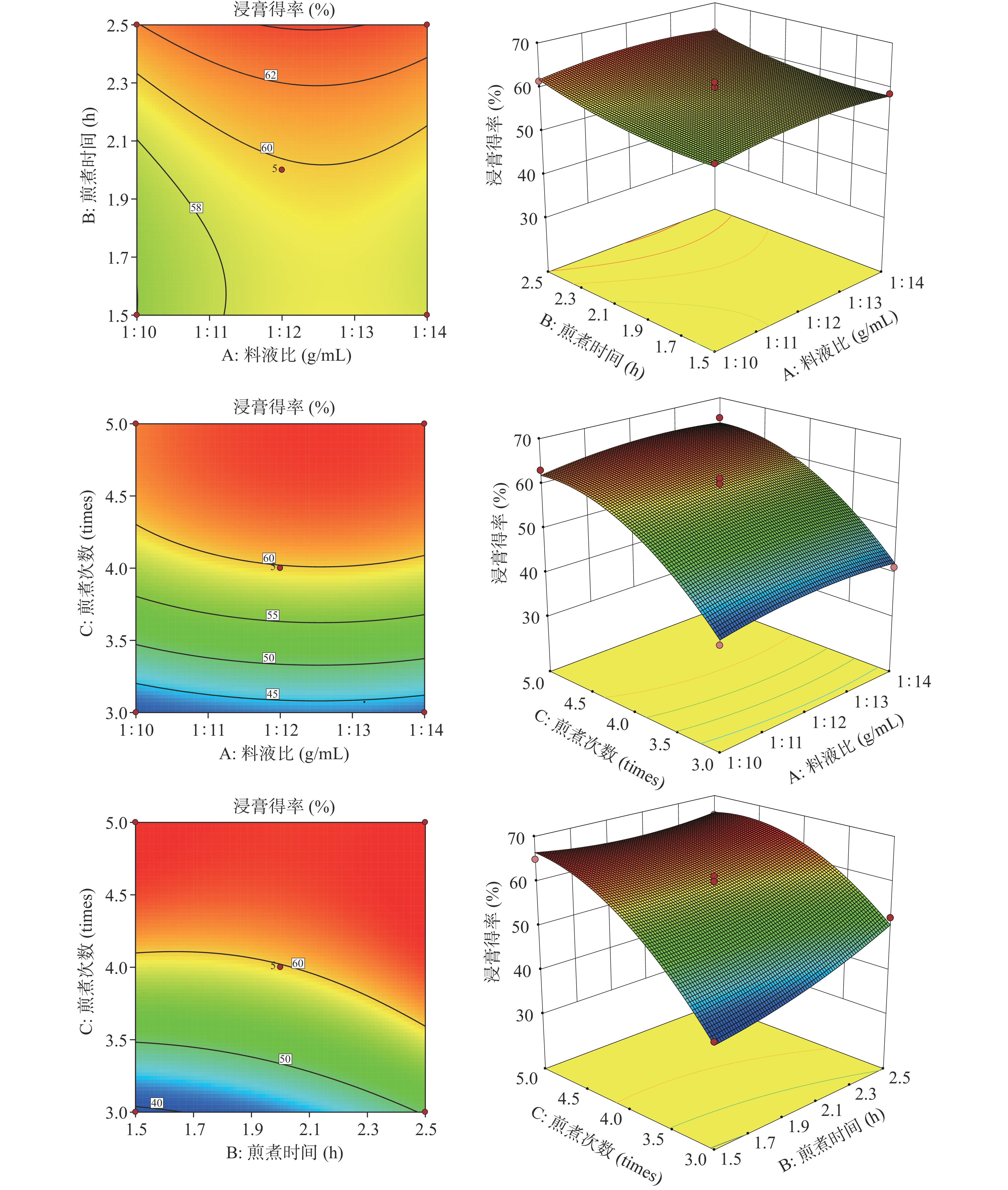
通过响应面软件,计算得出三个自变量(料液比、煎煮时间、煎煮次数)与因变量(浸膏得率)之间的关系,并绘制等高线图和响应面图(等高线图可反映任意两因素之间的相互作用是否显著,显著为椭圆,反之是圆形),直观地反映各因素之间的交互作用及对因变量的影响[25-26]。
将建立的回归模型中任一因素固定在0水平,得到另外两个因素之间交互作用结果,二次多项回归方程的等高线图和响应面中见图5,由图5可知,在一定范围内,煎煮次数对浸膏得率的影响最大,其次是煎煮时间,最后是料液比。当料液比为1:12 g/mL时,煎煮时间在1.9~2.1 h范围内,浸膏得率达到最大值,而从等高线图中发现两因素交互作用不显著;当料液比在1:12~1:14 g/mL范围,煎煮次数达5次时,浸膏得率取得最大值,同时料液比与煎煮次数等高线图呈圆形,说明两因素交互作用不显著;当煎煮时间在1.9~2.1 h内,煎煮次数为4~5次时,浸膏得率最高,结合表3可知,两因素之间存在显著性交互作用。
2.2.3 验证试验
通过响应面设计得出各因素最优参数为:A(料液比)为1:12.4 g/mL,B(煎煮时间)为2.39 h,C(煎煮次数)为4.46次,在此条件下,浸膏预测得率为65.9253%。为了方便操作,简化估值料液比参数为1:12 g/mL,煎煮时间140 min,煎煮次数4次,进行3次验证试验,测定浸膏得率为65.83%±0.87%,与预测值相差不多,这就表明该试验可以采用响应面法优化肉苁蓉水提法,以此提高AEC的浸膏得率。
2.3 AEC成分指标含量测定
2.3.1 营养成分检测
本次试验测定了AEC基本营养成分,由表4可知,肉苁蓉富含丰富的营养成分,包括蛋白质5.22±0.44 g/100 g、碳水化合物33.6±1.63 g/100 g、钠225±3.54 mg/100 g,少量的氨基酸0.64±0.05 g/100 g和脂肪0.15±0.06 g/100 g,可提供大量能量,具有很高的营养价值。
表 4 AEC主要营养成分检测结果Table 4. Detection of main nutrients in AEC指标 含量(g/100 g) 蛋白质 5.22±0.44 氨基酸 0.64±0.05 脂肪 0.15±0.06 灰分 2.70±0.00 钠(mg/100 g) 225±3.54 碳水化合物 33.60±1.63 能量(kJ/100 g) 665.50±18.17 2.3.2 活性成分检测
本次实验测定了AEC主要成分的含量,由表5可知,AEC含有丰富的活性成分,主要包括松果菊苷、毛蕊花糖苷、肉苁蓉苷A、管花苷A等多种苯乙醇苷类物质,以及总黄酮、粗多糖、总糖等活性成分,而不同的活性成分具有不同的功效,例如,肉苁蓉多糖具有抗氧化的作用,苯乙醇苷类物质具有缓解阿尔兹海默症的功效,以及抗癌作用[27]等。由此可知,丰富的功效成分使得肉苁蓉具有极高的药用价值和经济价值。目前我国已开发出抗疲劳、抗氧化、辅助改善记忆力和调节免疫力等功能声称的肉苁蓉保健产品,产品的开发与产业需求形成良好的正向循环,提高了肉苁蓉的应用价值[28]。
表 5 AEC主要活性成分检测Table 5. Detection of main active components in AEC指标 含量(mg/100 g) 松果菊苷 557±4.24 毛蕊花糖苷 169±7.07 粗多糖(g/100 g) 1.86±0.03 京尼平苷酸 13.40±0.64 8-表番木鳖酸 131±3.54 肉苁蓉苷A 126±0.00 管花苷A 20.40±0.21 异类叶升麻苷 194±0.71 2-乙酰基洋丁香氛苷 234±11.31 管花苷B 487±9.90 总糖(g/100 g) 22.10±0.64 总黄酮(g/100 g) 4.13±0.08 尿囊素 293±4.95 2.4 AEC体外抗氧化性的测定
2.4.1 不同浓度AEC总抗氧化能力测定
总抗氧化能力是待测样本中所有抗氧化剂的抗氧化总和,可以直观地反映待测样本整体抗氧化能力。通过图6,发现AEC浓度与总抗氧化能力呈正向增长,与VC对照组增长趋势一致。不同浓度AEC的总抗氧化能力分别为0.23±0.04、0.42±0.03、1.87±0.58、3.18±0.92、7.50±1.40、8.51±0.80 U/mL,其中,在0.6~0.8 mg/mL范围内呈现快速增长状态,其中,AEC的IC50值为0.6823 mg/mL。
2.4.2 不同浓度AEC清除DPPH自由基的能力
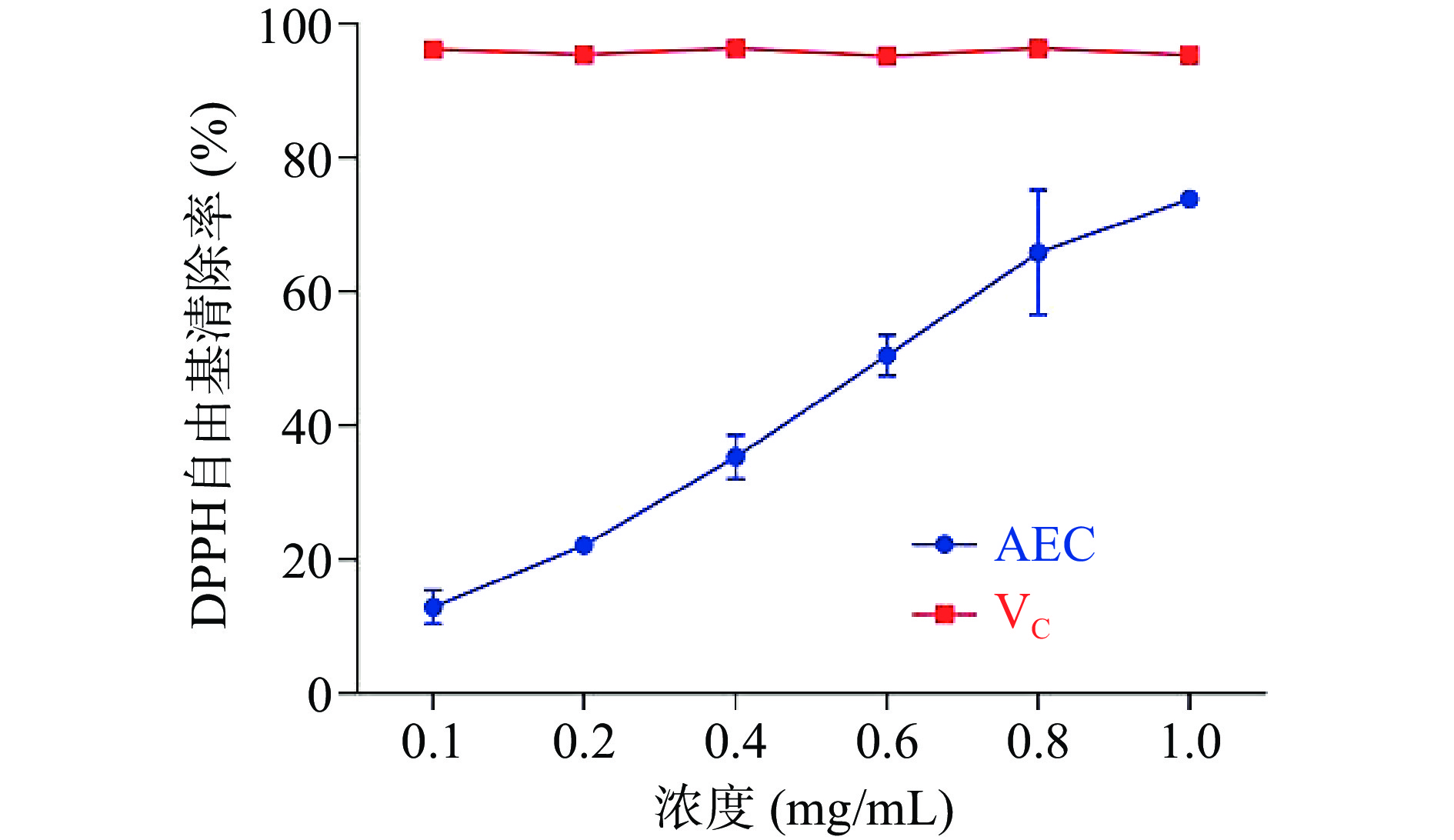
该试验测定了不同浓度AEC清除DPPH自由基的能力,以VC做对照,由图7可知,0.1、0.2、0.4、0.6、0.8、1.0 mg/mL AEC的DPPH自由基清除能力分别为12.9%±2.56%、22.13%±1.16%、35.38%±3.3%、50.51%±3.04%、65.87%±9.32%、73.87%±0.84%,随AEC浓度的升高呈线性增长关系,且DPPH自由基清除能力IC50值为0.5371 mg/mL,说明AEC具有良好的DPPH自由基清除效果。
2.4.3 不同浓度AEC清除羟自由基能力测定
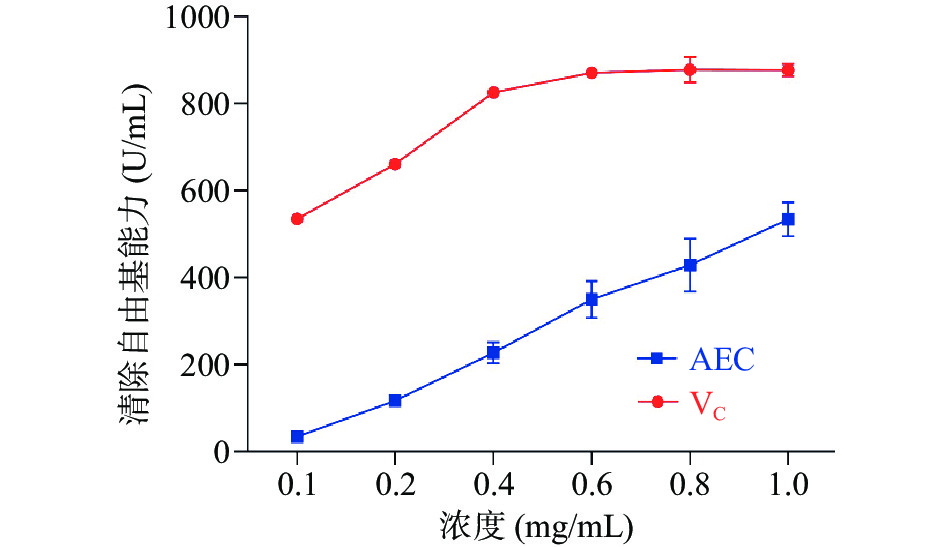
羟基自由基是一种重要的活性氧,容易得到电子,具有极强的氧化能力。所以清除羟基自由基成为物质体外抗氧化能力中的重点之一,由图8观察得到,AEC和VC都具有清除羟基自由基的能力,当VC高于0.4 mg/mL后,清除能力趋于稳定;而随着AEC浓度的逐渐升高,清除能力呈线性增长,分别为34.06±5.26、116.70±9.28、226.66±24.37、349.76±42.44、 428.28±61.35、534.01±39.37 U/mL。
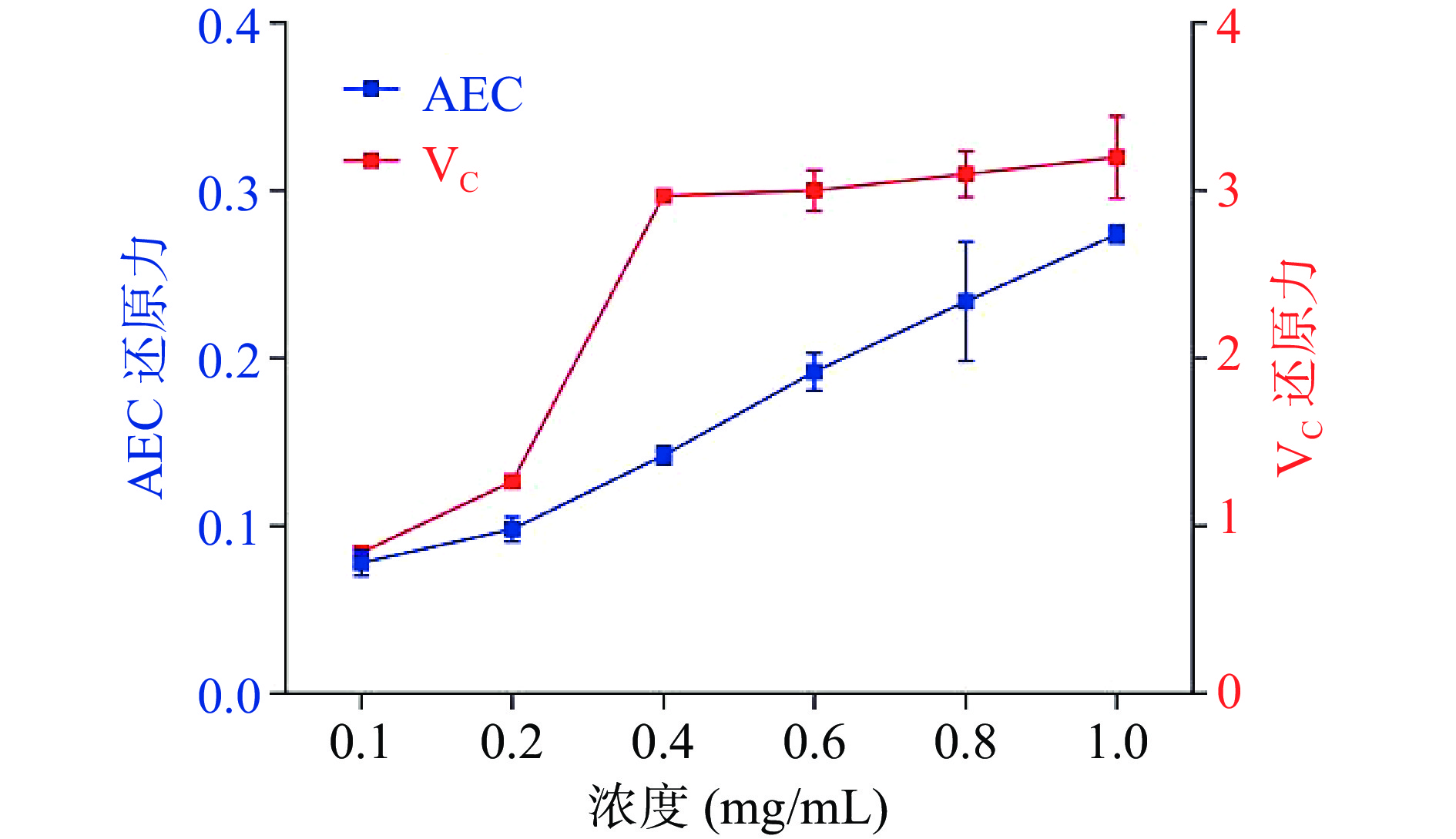
2.4.4 不同浓度AEC还原力测定
还原能力指在化学反应中原子、分子或离子失去电子的能力。物质还原能力越强,抗氧化性就越强。由图9可知,吸光度值越大,样本的还原能力就越强,AEC与VC的还原力均具有浓度依赖性,0.1、0.2、0.4、0.6、0.8和1.0 mg/mL的AEC还原力分别为0.078±0.0078、0.098±0.0075、0.142±0.0057、0.192±0.0112、0.234±0.0357、0.274±0.0052;还原能力检测显示AEC的EC50值为1.295 mg/mL。
综上,AEC具有一定的总抗氧化能力和还原力,但远低于VC;AEC对DPPH自由基和羟基自由基具有良好的清除能力,清除能力略低于VC,这可能是因为肉苁蓉中的苯乙醇苷类化合物中的酚羟基,可提供H+发生氧化还原反应,从而达到清除自由基的目的[29-32]。
2.5 AEC对线虫寿命和生殖能力的影响
2.5.1 AEC对线虫寿命的影响
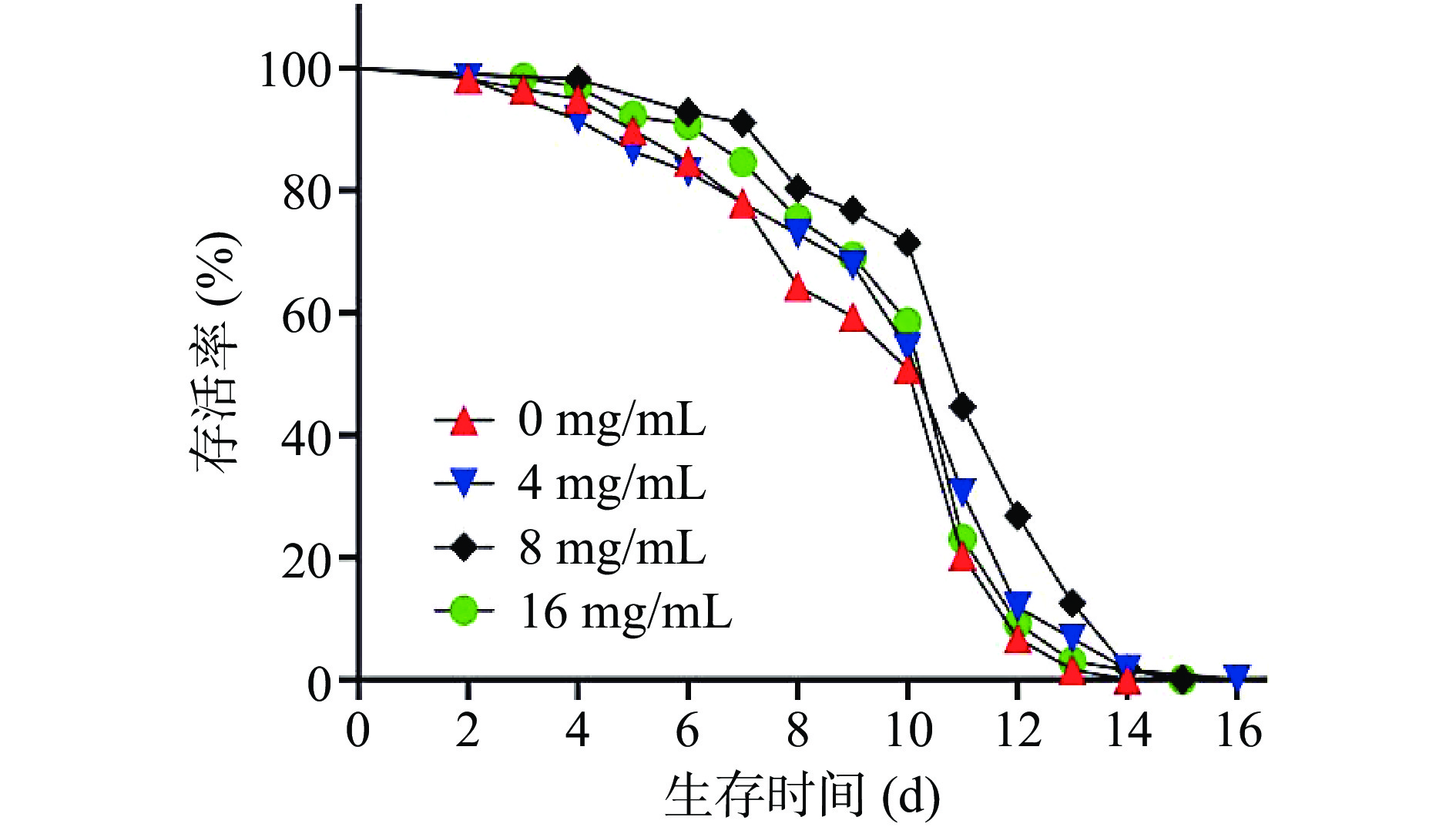
秀丽隐杆线虫寿命长短是衰老过程研究中的一个主要的评价指标。因此,也是抗衰老药物研究中必不可少的一个环节。经Kaplan-Meier生存分析得出(图10和表6),对照组(AEC为0 mg/mL)线虫的平均寿命为9.46 d,AEC为4、8、16 mg/mL时,线虫平均寿命分别为9.88、10.95、10.05 d,通过测定线虫寿命试验发现不同浓度的AEC均可延长线虫的寿命。另外,与对照组相比,当AEC浓度为8 mg/mL时,秀丽隐杆线虫平均寿命具有极显著性差异(P<0.01)。
表 6 不同浓度AEC对线虫平均寿命的影响Table 6. Effects of different concentrations of AEC on C. elegans average lifespan组别 平均寿命(d) 对照组 9.46±2.69 4 mg/mL 9.88±2.97 8 mg/mL 10.95±2.40** 16 mg/mL 10.05±2.45 注:**表示与对照组存在极显著性差异(P<0.01)。 2.5.2 AEC对线虫生殖力的影响
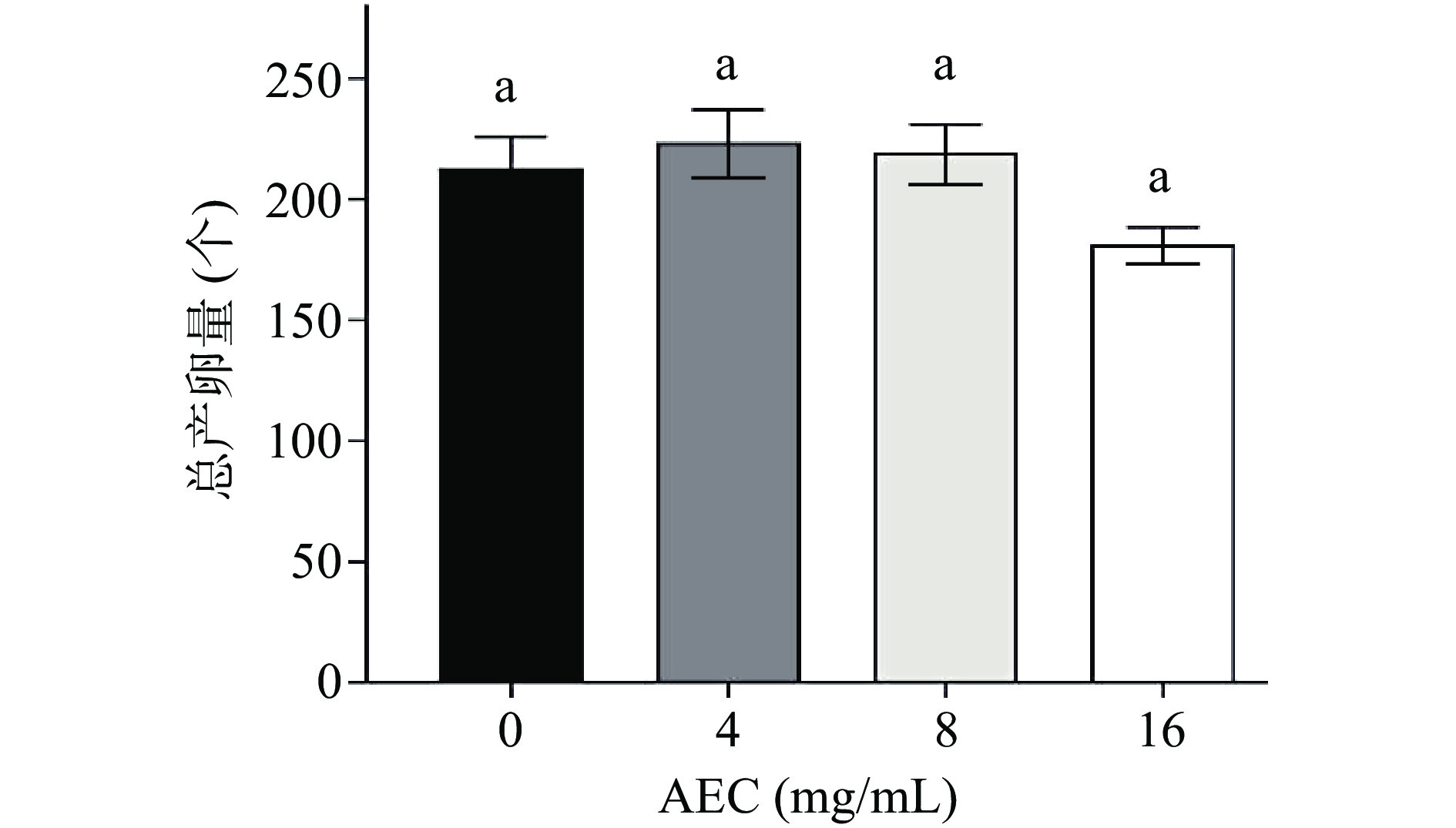
线虫的生殖能力(产卵量)等指标也常作为药物抗氧化、抗衰老效果评价的参照。本次试验采用0、4、8、16 mg/mL AEC喂养线虫,饲养期间总产卵量分别为212.85±13.06、223.61±13.30、219.24±11.81、181.17±7.37个,结果显示4、8 mg/mL较对照组略有提高,但是16 mg/mL的AEC反而降低了产卵量(图11),推测可能是药物浓度过高,使OP50吸光度过高,大肠杆菌浓度过低,线虫食用不良,从而影响线虫的生长状态[21]。然而,在实践过程中,经常通过多个指标对药物的效果进行综合评价[33]。所以后续还需通过多种指标检测进一步研究AEC延缓线虫衰老效应和作用机制,以期为肉苁蓉的深度开发提供理论依据。
3. 结论
本研究以肉苁蓉为原料,开发制备肉苁蓉提取物,采用响应面法优化提取工艺,并对提取物进行抗氧化活性研究,同时应用于简单模式生物线虫。结果显示,通过单因素和响应面试验发现,料液比为1:12 g/mL,煎煮时间140 min,煎煮次数4次,由此制得的肉苁蓉干浸膏得率可达65.83%±0.87%。提取物具有一定的清除DPPH自由基和羟基自由基的能力,和抗氧化活性,且呈浓度梯度性,同时发现提取物可以延长线虫寿命,研究发现当AEC为8 mg/mL时,线虫平均寿命较对照组延长15.75%。由此推测,肉苁蓉可以调节机体抗氧化功能的平衡,拮抗自由基损伤起到抗氧化的作用,从而起到延缓衰老的目的,而抗氧化功能作为保健品企业的主要研发方向之一,提示肉苁蓉可以作为原料开发研制抗氧化、延缓衰老产品,进一步发挥其药用价值和经济价值,为“健康中国”行动添砖加瓦,贡献一份力量。
-
表 1 响应面试验因素水平编码表
Table 1 Coding table of response surface test factor level
序号 因素 −1 0 1 A 料液比(g/mL) 1:10 1:12 1:14 B 煎煮时间(h) 1.5 2.0 2.5 C 煎煮次数(times) 3 4 5 表 2 响应面试验设计与结果
Table 2 Response surface test design and results
试验号 A料液比 B煎煮时间 C煎煮次数 浸膏得率(%) 1 −1 0 1 63.10 2 0 0 0 60.09 3 0 −1 1 64.96 4 1 −1 0 58.66 5 0 0 0 61.30 6 0 0 0 58.90 7 0 1 −1 52.02 8 0 −1 −1 39.66 9 1 0 1 65.10 10 −1 −1 0 56.51 11 0 1 1 65.30 12 1 1 0 62.70 13 1 0 −1 41.31 14 −1 0 −1 39.54 15 0 0 0 59.70 16 0 0 0 58.90 17 −1 1 0 61.50 表 3 二次多项方程的方差分析
Table 3 Analysis of variance of quadratic multinomial equation
来源 平方和 自由度 均值 F值 P值 显著性 模型 1194.57 9 132.73 60.80 <0.0001 ** A 6.34 1 6.34 2.90 0.1322 B 59.02 1 59.02 27.04 0.0013 ** C 923.00 1 923.00 422.8 <0.0001 ** AB 0.23 1 0.23 0.10 0.7572 AC 0.013 1 0.013 0.006058 0.9401 BC 36.12 1 36.12 16.55 0.0048 ** A2 10.50 1 10.50 4.81 0.0644 B2 11.37 1 11.37 5.21 0.0564 C2 148.39 1 148.39 67.97 <0.0001 ** 残差 15.28 7 2.18 失拟项 11.32 3 3.77 3.81 0.1145 ns 总和 1209.86 16 R2:0.9874 C.V.%:2.59 R2Adj:0.9711 R2Pred:0.8452 注:*代表存在显著性差异(P<0.05);**代表存在极显著性差异(P<0.01);ns(not significant)代表差异不显著。 表 4 AEC主要营养成分检测结果
Table 4 Detection of main nutrients in AEC
指标 含量(g/100 g) 蛋白质 5.22±0.44 氨基酸 0.64±0.05 脂肪 0.15±0.06 灰分 2.70±0.00 钠(mg/100 g) 225±3.54 碳水化合物 33.60±1.63 能量(kJ/100 g) 665.50±18.17 表 5 AEC主要活性成分检测
Table 5 Detection of main active components in AEC
指标 含量(mg/100 g) 松果菊苷 557±4.24 毛蕊花糖苷 169±7.07 粗多糖(g/100 g) 1.86±0.03 京尼平苷酸 13.40±0.64 8-表番木鳖酸 131±3.54 肉苁蓉苷A 126±0.00 管花苷A 20.40±0.21 异类叶升麻苷 194±0.71 2-乙酰基洋丁香氛苷 234±11.31 管花苷B 487±9.90 总糖(g/100 g) 22.10±0.64 总黄酮(g/100 g) 4.13±0.08 尿囊素 293±4.95 表 6 不同浓度AEC对线虫平均寿命的影响
Table 6 Effects of different concentrations of AEC on C. elegans average lifespan
组别 平均寿命(d) 对照组 9.46±2.69 4 mg/mL 9.88±2.97 8 mg/mL 10.95±2.40** 16 mg/mL 10.05±2.45 注:**表示与对照组存在极显著性差异(P<0.01)。 -
[1] 毕萃萃, 刘银路, 魏芬芬, 等. 肉苁蓉的主要化学成分及生物活性研究进展[J]. 药物评价研究,2019,42(9):1896−1900. [BI C C, LIU Y L, WEI F F, et al. Research progress on main chemical constituents and biological activities of Cistanche deserticola[J]. Drug Evaluation Res,2019,42(9):1896−1900. [2] 刘雄, 李成明, 高建德, 等. 肉苁蓉的研究进展[J]. 中国中医药科技, 2013, 20(5): 1575−1577. LIU X, LI C M, GAO J D, et al. Research progress of Cistanche herba[J]. Chinese Journal of Traditional Medical Science and Technology, 2013, 20(5): 1575−1577.
[3] 方鉴. 肉苁蓉的药理研究进展[J]. 光明中医,2017,32(14):2140−2142. [FANG J. Pharmacological research progress of Cistanches herba[J]. Guangming J Chin Med,2017,32(14):2140−2142. doi: 10.3969/j.issn.1003-8914.2017.14.071 [4] SHEN C Y, JIANG J G, YANG L, et al. Anti-ageing active ingredients from herbs and nutraceuticals used in traditional Chinese medicine: Pharmacological mechanisms and implications for drug discovery[J]. British Journal of Pharmacology,2017,174(11):1395−1425. doi: 10.1111/bph.13631
[5] 陈诗雅, 覃威, 杨莎莎, 等. 肉苁蓉的临床应用及其疗效机制研究进展[J]. 海峡药学,2017,29(5):1−4. [CHEN S Y, QIN W, YANG S S, et al. Research progress of clinical application and therapeutic mechanism of Cistanche herba[J]. Strait Pharm J,2017,29(5):1−4. doi: 10.3969/j.issn.1006-3765.2017.05.001 [6] 高宇宏, 柯尊记. 肉苁蓉治疗阿尔茨海默病药理作用研究进展[J]. 上海中医药杂志,2018,52(1):109−112. [GAO Y H, KE Z J. Research progress onpharmacological effects of Roucongrong (Cistanches herba) in the treatment of Alzheimer’s disease[J]. Shanghai Journal of Traditional Chinese Medicine,2018,52(1):109−112. doi: 10.16305/j.1007-1334.2018.01.031 [7] LIN Z J, WEN J N, ZHU T J, et al. Chrysogenamide A from an endophytic fungus associated with Cistanche deserticola and its neuroprotective effect on SH-SY5Y Cells[J]. Journal of Antibiotics,2008,61(2):81−85. doi: 10.1038/ja.2008.114
[8] 邢海燕, 赵璐璐, 王胜男, 等. 肉苁蓉多糖对衰老过程中学习记忆影响的体内外作用[J]. 中国药理学与毒理学杂志,2019,33(6):453. [XING H Y, ZHAO L L, WANG S N, et al. Effects of Cistanche deserticola polysaccharide on learning and memory during agingin vitro andin vivo[J]. Chin J Pharm Toxicol,2019,33(6):453. [9] 张青, 李亚珍, 孙志惠, 等. 肉苁蓉中活性物质体外抗氧化活性研究进展[J]. 农产品加工,2018(21):60−62. [ZHANG Q, LI Y Z, SUN Y H, et al. Research progress of antioxidant function evaluation in vitro of bioactive substances in Cistanche[J]. Farm Prod Process,2018(21):60−62. doi: 10.16693/j.cnki.1671-9646(X).2018.11.016 [10] CAI R L, YANG M H, SHI Y, et al. Antifatigue activity of phenylethanoid-rich extract from Cistanche deserticola[J]. Phytotherapy Research,2010,24(2):313−315. doi: 10.1002/ptr.2927
[11] 冯朵, 何悦, 蒋勇军, 等. 肉苁蓉抗衰老功能的研究进展[J]. 食品安全质量检测学报,2021,12(22):4429−4437. [FENG D, HE Y, JIANG Y J, et al. Research progress on anti-aging function of Cistanches[J]. Journal of Food Safety & Quality,2021,12(22):4429−4437. doi: 10.19812/j.cnki.jfsq11-5956/ts.2021.11.018 [12] 庞金虎. 采后处理及提取方法对肉苁蓉主要有效成分的影响[D]. 呼和浩特: 内蒙古农业大学, 2013. PANG J H. The effect of postharvest treatment and extraction on main effective components of Cistanche deserticola Y. C. Ma[D]. Hohhot: Inner Mongolia Agricultural University, 2013.
[13] 王英姿, 张超, 贺葵邦. 肉苁蓉提取工艺的优选方法研究[J]. 中医学报,2012,27(2):191−193. [WANG Y Z, ZHANG C, HE K B. Methods research optimization of the extraction technology of Cistanche deserticola[J]. Acta Chinese Medicine,2012,27(2):191−193. doi: 10.16368/j.issn.1674-8999.2012.02.044 [14] 肖道安. 肉苁蓉多糖的提取工艺优化[J]. 世界科学技术-中医药现代化,2014,16(4):926−929. [XIAO D A. Optimization on extraction technology of desertliving Cistanche polysaccharides[J]. Modernization of Traditional Chinese Medicine and Materia Medica-World Science and Technology,2014,16(4):926−929. [15] 李彪. 肉苁蓉有效成分含量的研究[D]. 呼和浩特: 内蒙古农业大学, 2012. LI B. The study on effective component content in Cistanche[D]. Hohhot: Inner Mongolia Agricultural University, 2012.
[16] 张钎, 沈雪梅, 刘琨毅, 等. 基于响应面法优化水提紫娟茶花青素工艺[J]. 甘肃农业大学学报,2021,56(1):175−181. [ZHANG Q, SHEN X M, LIU K Y, et al. Response surface method based optimization of anthocyanins extraction process from Zijuan tea[J]. Journal of Gansu Agricultural University,2021,56(1):175−181. doi: 10.13432/j.cnki.jgsau.2021.01.023 [17] 杨国宁, 毕天琛, 仝桂平, 等. HPLC法同时测定肉苁蓉饮片中8种成分的含量[J]. 中国药师,2020,23(7):1442−1445. [YANG G N, BI T C, TONG G P, et al. Simultaneous determination of 8 components in Cistanches herba decoction pieces by HPLC[J]. China Pharmacist,2020,23(7):1442−1445. doi: 10.3969/j.issn.1008-049X.2020.07.048 [18] 白鸿. 保健食品功效成分的检测方法[M]. 北京: 中国中医药出版社, 2011. BAI H. Method for detecting functional components of health food[M]. Beijing: China Press of Traditional Chinese Medicine, 2011.
[19] 陈天朝, 李沁, 姚超, 等. 山药不同炮制品丸剂物性参数及成分含量间相关性研究[J]. 中医研究,2020,33(7):57−60. [CHEN T C, LI Q, YAO C, et al. Correlative study of physical properties and compositions of different processed Chinese yam pliis[J]. Traditional Chinese Medicinal Research,2020,33(7):57−60. doi: 10.3969/j.issn.1001-6910.2020.07.21 [20] OMAGE S O, ORHUE N E J, OMAGE K. Evaluation of the phytochemical content, in vitro antioxidant capacity, biochemical and histological effects of Dennettia tripetala fruits in healthy rats[J]. Food Science & Nutrition,2019,7(1):65−75.
[21] CHEN W, LIN H R, WEI C M, et al. Echinacoside, a phenylethanoid glycoside from Cistanche deserticola, extends lifespan of Caenorhabditis elegans and protects from A beta-induced toxicity[J]. Biogerontology,2018,19(1):47−65. doi: 10.1007/s10522-017-9738-0
[22] 刘磊, 关枫, 张晓燕, 等. Box-Behnken响应面法优化五味子花色苷提取工艺研究[J]. 辽宁中医药大学学报,2019,21(1):66−69. [LIU L, GUAN F, ZHANG X Y, et al. Optimization of extraction technique of anthocyanins from Schisandra chinensis Baill. by Box-behnken design[J]. Journal of Liaoning University of Traditional Chinese Medicine,2019,21(1):66−69. doi: 10.13194/j.issn.1673-842x.2019.01.017 [23] 李林, 范文翔, 王利, 等. 基于Box-Behnken响应面法优化半夏蒸制工艺[J]. 中药材, 2018, 41(10): 2329−2334. LI L, FAN W X, WANG L, et al. Optimization of steaming process for Pinellia ternata by Box-Behnken response surface methodology[J]. Journal of Chinese Medicinal Materials 2018, 41(10): 2329−2334.
[24] 程海涛, 申献双. 响应面法优化机械砂磨辅助提取婆枣中原花青素工艺[J]. 食品工业科技,2019,40(11):218−222, 228. [CHENG H T, SHEN X S. Optimization of mechanical grinding assisted extraction of proanthocyanidins from Shenzhou Jujube by response surface methodology[J]. Science and Technology of Food Industry,2019,40(11):218−222, 228. doi: 10.13386/j.issn1002-0306.2019.11.036 [25] MASON R L, GUNST R F, HESS J L. Statistical design and analysis of experiments: With applications to engineering and science[J]. Technometrics,2003,33(1):105−106.
[26] 郭莹, 周颖, 毕海丹, 等. 响应面优化超声波-微波协同提取凤眼莲黄酮工艺及其不同部位黄酮抗氧化活性分析[J]. 食品工业科技,2019,40(1):168−174,180. [GUO Y, ZHOU Y, BI H D, et al. Optimization of ultrasonic-microwave synergistic extraction of flavonoids from Eichhorniacrassipes by response surface methodology and analysis of antioxidant activity of flavonoids from Its different parts[J]. Science and Technology of Food Industry,2019,40(1):168−174,180. doi: 10.13386/j.issn1002-0306.2019.01.031 [27] YE Y, SONG Y, ZHUANG J, et al. Anticancer effects of Echinacoside in hepatocellular carcinoma mouse model and HepG2 cells[J]. J Cell Physiol,2019,234(2):1880−1888. doi: 10.1002/jcp.27063
[28] 冯朵, 段昊, 吕燕妮, 等. 肉苁蓉在我国保健食品中的应用[J]. 食品科技,2021,46(12):76−81. [FENG D, DUAN H, LÜ Y N, et al. Application of Cistanche deserticola Ma in functional food in China[J]. Food Science and Technology,2021,46(12):76−81. doi: 10.3969/j.issn.1005-9989.2021.12.spkj202112013 [29] 何梦梦, 游林, 包晓玮, 等. 肉苁蓉水提物体外抗氧化及对小鼠肠道菌群紊乱的作用[J]. 食品研究与开发,2020,41(23):44−50. [HE M M, YOU L, BAO X W, et al. Antioxidation of Cistanche deserticola water extract in vitro and its effect on intestinalflora disorder in mice[J]. Food Research and Development,2020,41(23):44−50. doi: 10.12161/j.issn.1005-6521.2020.23.008 [30] 肖星辉, 张向前, 李桂芳, 等. 双水相萃取荒漠肉苁蓉总黄酮及其抗氧化活性[J]. 食品研究与开发,2017,38(16):5−9. [XIAO X H, ZHANG X Q, LI G F, et al. Aqueous two-phase extraction of total flavonoids from Cistanche deserticola Y. C. Ma and the antioxidant activity of the extracts[J]. Food Research and Development,2017,38(16):5−9. doi: 10.3969/j.issn.1005-6521.2017.16.002 [31] 王国卫, 赵芳. 新疆肉苁蓉多糖清除活性氧自由基[J]. 光谱实验室,2011,28(3):1545−1548. [WANG G W, ZHAO F. Elimination active oxygen radicals of Cistanche deserticola (Y. C. Ma) polysaccharid in Xinjiang[J]. Chinese Journal of Spectroscopy Laboratory,2011,28(3):1545−1548. doi: 10.3969/j.issn.1004-8138.2011.03.138 [32] 刘伯言. 肉苁蓉苯乙醇苷的提取、纯化和抗氧化活性研究[D]. 北京: 北京林业大学, 2014. LIU B Y. Extraction, purification and antioxidant activities of phenylethanoid glycosides from Cistanche deserticola[D]. Beijing: Beijing Forestry University, 2014.
[33] 史秋佳, 杨剑萍, 陈缵光. 秀丽隐杆线虫作为抗感染药物筛选模型的研究进展[J]. 中国药理学通报,2013,29(10):1333−1337. [SHI Q J, YANG J P, CHEN Z G. Recent progress of Caenorhabditis elegans: As host model and tool for antimicrobial drug screening[J]. Chinese Pharmacological Bulletin,2013,29(10):1333−1337. doi: 10.3969/j.issn.1001-1978.2013.10.001 -
期刊类型引用(4)
1. 李红英,王静,李娜,姜琳琳,杨洋,胡宏远,张晓煜. 贺兰山东麓葡萄园不同方位摘叶对赤霞珠果实品质的影响. 中国农业气象. 2024(01): 23-32 .  百度学术
百度学术
2. 贾永华,马军,许泽华,李百云,侯克峰,李晓龙. 果园生草条件下介导果树适施外源钙剂引起的果实内源激素和品质变化特征. 北方园艺. 2024(07): 1-9 .  百度学术
百度学术
3. 李媛媛,王鲁泉,张栋. 我国葡萄酒产业竞争力提升路径探析. 中外葡萄与葡萄酒. 2022(03): 78-83 .  百度学术
百度学术
4. 任小彤,彭婧,韩晓,王军,何非. 贺兰山东麓产区不同地块酿酒葡萄果实类黄酮物质分析. 中外葡萄与葡萄酒. 2022(06): 32-41 .  百度学术
百度学术
其他类型引用(3)





 下载:
下载:






 下载:
下载:



