Research Progress on the Mechanism of Chilling Injury and Alleviating Measures in Peach Fruit
-
摘要: 桃果实因其呼吸跃变的特点,采后在室温下会出现呼吸高峰与乙烯释放高峰,极易腐烂,不耐贮藏。冷藏是延长桃果实贮藏期的最有效方法之一,但由于桃果实的冷敏性,长期的不适低温易使桃产生冷害,引起果肉革质化、组织絮败、褐变、固有风味损失等品质劣变问题,成为桃产业健康发展的重要影响因素。本文综述了目前桃果实采后冷害发生的机理的研究进展,总结了冷害对桃果实细胞膜、细胞壁代谢、抗氧化系统及精氨酸代谢的影响,并针对相关机制归纳了桃果实采后冷害控制技术,旨在为桃果实采后保鲜研究和应用提供理论与技术依据。Abstract: Peach fruit is easy perishable with its high respiration and ethylene emission peak after postharvest at room temperature for its climacteric character. Cold storage is one of the most effective way to extend the storage shelf life, however, peach fruit is chilling sensitive and highly vulnerable to chilling injury (CI) during long-term inappropriate low temperature storage. The peach fruit show deterioration of quality of flesh leathery with texture elevated, occurrence of tissue woolliness, internal browning and loss of the inherent flavor which being the main risk of the sound development of peach industry. This article reviews the research progress of the mechanism on peach fruit chilling injury and summarizes the influence on change of cell membrane, cell wall metabolic, antioxidant system and arginine metabolism. In addition, the postharvest technologies to control chilling injury are also detailed, which would provide the foundation for the theoretical study and develop of applied techniques for storage and fresh-keeping after postharvest in peach.
-
Keywords:
- peach /
- chilling injury /
- resistant mechanism /
- controlled techniques
-
桃(Amygdalus persica L.)属于蔷薇科(Rosaceae)桃属(Amygdalus L.)落叶果树。我国是桃的原产国,也是世界上最大的桃生产国,数据显示,2019年我国桃总产量为1599.3 万吨,种植面积达89万平方千米[1]。桃属于典型的呼吸跃变型果实,研究表明,水蜜桃采后常温放置3 d就会出现呼吸高峰与乙烯释放高峰,果实迅速后熟软化,不耐贮藏[2]。目前,低温贮藏是桃果实最常用的贮藏保鲜方法,可以有效延长桃果实的保鲜期,然而,桃属于冷敏性果实,低温下易发生冷害。冷害是指一些对低温敏感的果蔬在非冻结温度下出现的一系列代谢异常,导致组织细胞结构破坏甚至细胞死亡的现象,对于桃,冷害的症状表现为细胞壁革质化、果肉组织絮败、褐变、果实不能正常后熟等问题[3]。此外,由于桃采后冷链物流运输环节薄弱,包括预冷环节缺失,预冷包装不当以及预冷设备缺乏等因素,冷链运输中的果实品质难以得到保持,因此,桃的采后冷害研究成为国内外学者研究的热点。
近年来,有关桃果实低温冷害的发生以及品质劣变机制研究主要集中于糖酸代谢、果实能量代谢、细胞膜脂变化以及挥发性物质的变化。膜系统的损伤是导致桃果实冷害的重要原因之一,膜脂组分的变化以及脂肪酸的不饱和度与桃的冷害密切相关[4],低温胁迫下活性氧自由基(reactive oxygen species,ROS)的积累也与冷害有关,而酶和非酶抗氧化系统在清除ROS和保护膜完整性方面发挥着重要作用[5],较高的蔗糖含量、充足的能量供应以及耐冷性氨基酸的积累也可提高桃果实的耐寒性[6-7]。此外,桃冷害的发生会使香气相关的挥发性物质含量降低,使果实失去固有芳香[8]。针对上述问题,国内外学者对缓解桃果实冷害的技术进行大量研究,一些采后处理如物理方法(低温预贮[9]、冰温贮藏[10]、热处理[11]、气调处理[12]、间歇升温[13]、紫外辐照[14])、化学方法(1-甲基环丙烯[15]、一氧化氮[16]、褪黑激素[17]、H2S[18]、CaCl2[19]、水杨酸[20]和茉莉酸盐[21])以及新型生长调节剂等均可缓解桃果实的冷害。
由于桃冷害发生的影响因素众多,以上冷害控制技术很多只聚焦了改善冷害发生的某些指标,缺乏较为全面的总结与探讨。笔者总结了桃果实冷害发生过程中细胞膜、抗氧化系统、细胞壁代谢以及精氨酸代谢的变化,并针对相关机制的研究归纳了桃果实采后御冷技术,以期为减缓桃果实采后冷害发生的技术创新提供理论依据。
1. 桃果实采后的冷害现象及评价
低温可降低果蔬代谢速率,抑制内源乙烯的释放,延缓采后成熟,从而维持采后的品质,延长保鲜期。尽管应用广泛,但低温保鲜技术有其局限性。通常,一些原产自热带和亚热带的果蔬对低温敏感,易发生冷害[22]。一般来说,贮藏温度越低,果实冷害越严重,但桃是典型的中间温度冷敏性果实,在2~8 ℃条件下容易发生冷害,0~2 ℃条件下冷害症状反而减轻,8 ℃以上的温度虽不易发生冷害,但果实会迅速软化,降低商品性能[23]。此外,前人对冷害相关评价指标开展了比较系统研究(表1),冷害会影响果实外观、质地、风味,并引起一系列生理生化变化。
表 1 桃冷害评价的关键指标及变化趋势Table 1. Key indexes and changing trend of chilling injury evaluation in peach fruit指标名称 冷害下的变化 果实外观 果皮凹陷;
颜色暗淡无光泽果肉质地 果肉质地发绵,汁液减少;
果实硬度上升;
果肉褐变或出血果实风味 醇醛、酯类、内酯类、酮和烯萜类物质含量降低;
糖酸比失调,甚至产生苦味呼吸作用和乙烯释放 呼吸强度异常增加;
乙烯合成受到抑制褐变指数 果肉褐变,褐变指数增加; 丙二醛含量及电导率 细胞膜受损,膜通透性增加,
电导率上升,丙二醛积累不同品种的桃对低温的敏感性不同,如‘保佳俊’白肉桃相比于‘中华寿桃’,‘大久保’,具有更强的抗褐变性[24]。‘锦花’对低温不敏感,0 ℃贮藏35 d后,在4 d的货架期内仍未发生褐变,而‘玉露’在4 d货架期后褐变指数高达0.68[25]。祝美云等[26]的研究表明,不同品种的桃对低温的敏感性有较大差异,在其研究的15个品种中,‘大东’、‘绿化9号’、‘高峰’、‘碧霞’对低温敏感,果实褐变严重,而‘油桃75号’、‘金童7号’对低温的敏感性较低,贮藏期间未发生褐变。不同品种的桃冷害的表现也不同,在4 ℃下贮藏的硬质桃果实(‘中油桃18号’、‘中桃9号’和‘白如玉’)冷害主要表现为果肉褐变,而溶质型桃(‘中油桃13号’、‘春美’和‘中油桃4号’)的冷害症状以果肉木质化和絮败为主[27]。此外,早熟品种不易发生絮败,中晚熟品种易发生絮败,且成熟度越低,果实对低温越敏感[28]。
2. 桃果实冷害发生的机理研究
2.1 冷害对桃果实细胞膜的影响
冷害主要通过改变细胞膜的组成和结构来影响细胞膜透性。冷害发生后,细胞膜从紧密有序的液晶状态到松散无序的凝胶状态,这种转化导致细胞膜中的脂肪酸链从有序变为无序,细胞膜的通透性增加,细胞内容物外渗,与膜结合的酶系统受到破坏,酶活性下降,蛋白质变性或者解离,最终造成代谢紊乱,影响桃果实采后贮藏期[29]。
2.1.1 冷害与桃果实膜脂代谢
脂质含量和不饱和度是影响细胞膜完整性和流动性的主要因素,膜脂的不饱和度越高,细胞膜的流动性越强,桃果实的耐寒性越强[30]。磷脂酶D(phospholipase D,PLD)和脂氧合酶(lipoxygenase,LOX)与膜脂代谢密切相关,桃发生冷害时,PLD和LOX活性升高,导致不饱和脂肪酸降解,细胞膜完整性降低[31]。Song等[32]的研究表明,4 ℃贮藏初期的桃冷害的发生与膜脂代谢相关基因表达上调有关,随着冷害程度的增加,二酰甘油(DAG)、甘油(TAG)、及几种磷脂酰胆碱(PC)组分含量和脂肪酸去饱和酶(FAD)基因表达量增加,为桃果实的低温胁迫提供了保护机制。Hu等[33]的研究表明,2,4-表油菜素内酯通过有效抑制PLD、LOX和脂肪酶活性和基因表达的增加缓解桃果实冷害,并发现PpCBF5可能是膜脂代谢的重要调节因子。Wang等[34]认为,甘氨酸甜菜碱(glycine betaine,GB)处理减缓桃果实的冷害与降低PLD和LOX活性及转录水平有关。此外,乙烯缓解桃果实低温胁迫与细胞膜成分磷脂和甘油脂质变化有关,并发现ESE3和ABR1两种乙烯反应因子(ERF)的表达分别与细胞壁代谢和脂质代谢相关基因的表达高度相关[35]。
2.1.2 冷害对桃果实能量代谢的影响
能量状态与果实采后的成熟、衰老以及抗逆性有关。完整的膜使得电子传动链系统,氧化磷酸化以及其他一些代谢活动,如三羧酸循环和糖酵解正常进行,这些过程是植物体维持基本生理代谢的物质基础与能量基础。在低温胁迫下,线粒体细胞膜会由液晶态转变为凝胶态,致使内膜上维持能量代谢平衡的相关酶活性发生改变,如细胞色素c氧化酶(cytochrome c oxidase,CCO)、琥珀酸脱氢酶(succinate dehydrogenase,SDH)、H+-ATPase和Ca2+-ATPase等[36]。有研究发现,茉莉酸甲酯(methyl jasmonate,MeJA)处理后的桃果实中H+-ATPase、Ca2+-ATPase、SDH和CCO果实显著高于对照,并保持了较高的ATP和ADP含量,从而减少了超氧阴离子(O2−)和过氧化氢(H2O2)的积累,有效维持了膜结构的完整性[37]。陈京京等[9]的研究中,低温预贮(low temperature conditioning,LTC)处理可使桃保持较高的ATP、ADP含量,并减少了MDA的产生与积累,显著减轻了桃果实褐变的发生。
2.2 冷害对桃果实抗氧化系统的影响
通常,在植物的正常生长和代谢过程中,如酶促反应、电子传递及小分子自身氧化过程等会产生ROS,主要包括H2O2、O2−和羟自由基(-OH)等[5]。它们性质活泼,氧化能力强,对许多生物功能分子有破坏作用。在正常生长发育过程中,细胞的抗氧化系统可以消除过量的ROS,维持体内平衡。然而,当植物遭受长期的低温胁迫时,ROS产生就会明显增加,而清除量下降,导致活性氧自由基积累,造成膜脂过氧化,对体内的核酸、蛋白质和脂肪酸造成损伤[38]。
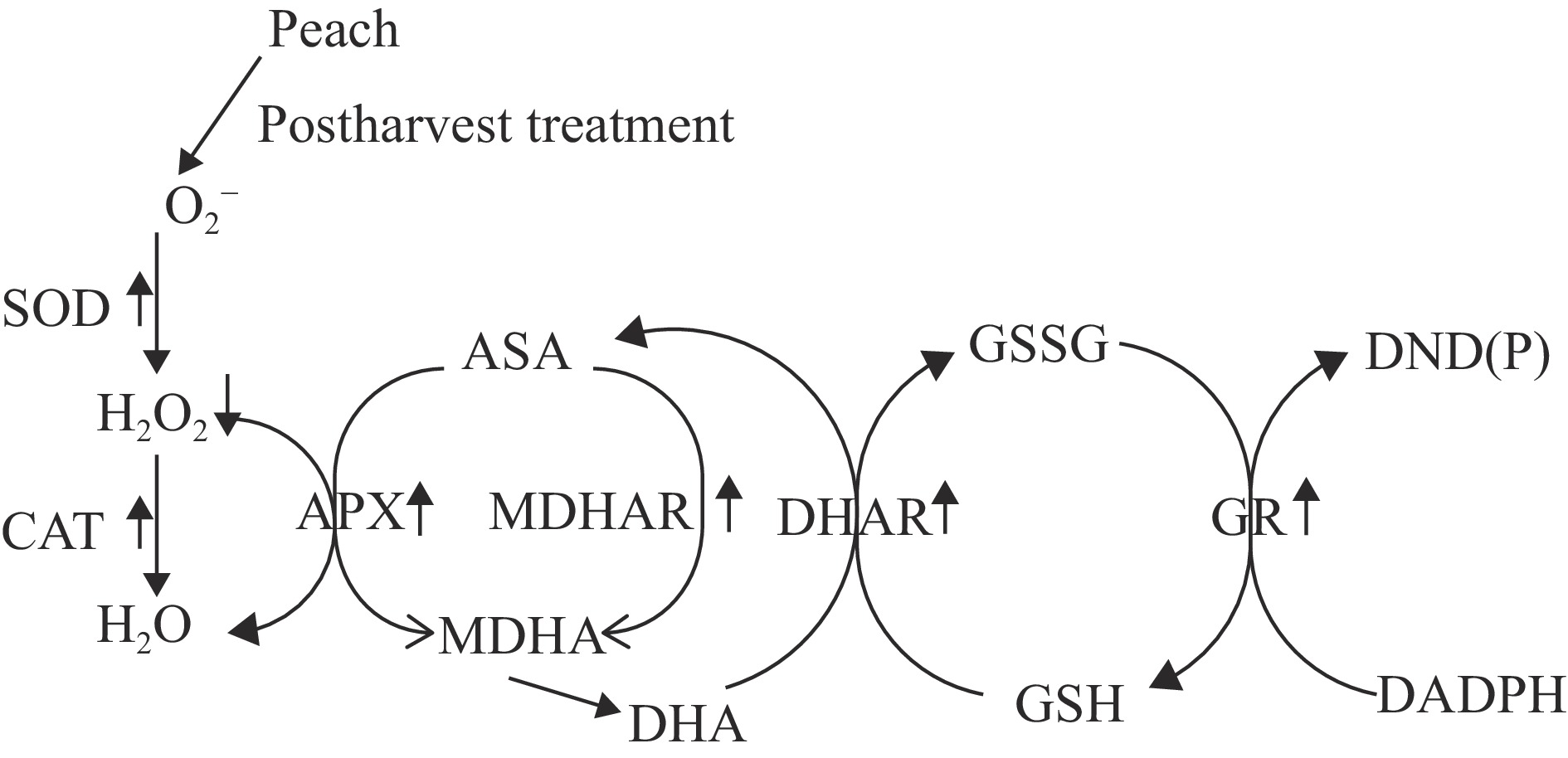
桃果实的抗氧化系统主要包括酶促抗氧化系统和非酶促抗氧化系统。酶促抗氧化系统主要由超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、过氧化物酶(peroxidase,POD)以及抗坏血酸过氧化物酶(ascorbate peroxidase,APX)等抗氧化酶类组成。此外,抗坏血酸-谷胱甘肽(ascorbic acid-glutathione,ASA-GSH)循环在清除H2O2方面发挥着重要作用,其循环如图1所示,而非酶抗氧化系统主要由酚类、黄酮类等抗氧化物质组成[5]。研究表明,10 μL/L NO可提高脱氢抗坏血酸还原酶(dehydroascorbate reductase,DHAR)、APX、谷胱甘肽-S-转移酶和谷胱甘肽还原酶(glutathione reductase,GR)的活性,通过调控ASA-GSH循环系统来缓解冷害[39]。同样,在最新的报道中,GB通过提高APX、单脱氢抗坏血酸还原酶(mondehydroascorbate reductase,MDHAR)、DHAR、GR活力以及PpAPX、PpGR、PpMDHAR和PpDHAR基因的表达水平显著减缓了湖景蜜露水蜜桃冷害的发生[40]。另外,褪黑素处理通过提高葡萄糖-6磷酸脱氢酶、莽草酸脱氢酶和苯丙氨酸解氨酶活性,诱导总酚积累进而减缓冷害的发生[17]。在Wang等[41]的研究中,热水处理提高了桃果实中原儿茶酸、儿茶素、绿原酸、新绿原酸、槲皮素、橙皮素和柚皮素含量。腐胺处理减少桃果实冷害的发生也被证明与减少果实中酚类物质的降低有关[42]。
2.3 冷害对桃果实细胞壁代谢的影响
一般认为,桃果实质地的软化与细胞壁组分含量以及果胶酶活性变化有关。在正常成熟的桃果实中,果胶甲酯酶(pectin methylesterase,PME)和多聚半乳糖醛酸酶(polygalacturonase,PG)共同作用,保证桃果实的正常软化,但当果实发生冷害后,PME和PG活性失衡导致果实细胞壁代谢紊乱,进而出现果实硬度上升,出汁率下降等絮败症状[43]。Zhao等[30]的研究表明,NO处理抑制了纤维素酶、PG和β-半乳糖苷酶(β-galactosidase,β-Gal)的活性,通过抑制细胞壁水解,并抑制木葡聚糖内转糖基酶的基因表达,进而减缓了桃果实粉化症状的发生。类似的,Wang等[44]的研究中,H2S通过抑制细胞壁降解相关的酶活性,从而增加了细胞壁组分中水不溶性果胶(EDTA可溶性果胶和Na2CO3可溶性果胶),纤维素和半纤维素的含量,减轻了桃果实的冷害。纳米氧化锌包装也可抑制桃果实低温冷藏下PME活性,增强了PG和β-Gal活性,有效保持了细胞壁结构的完整性[45]。此外,γ-氨基丁酸(gamma-aminobutyric acid,GABA)处理通过诱导PpPG基因表达并显著抑制桃果实PpPME基因表达,保证了原果胶的正常水解和果实正常的软化[46]。
2.4 冷害对桃果实精氨酸代谢的影响
精氨酸作为细胞中的重要氨基酸之一,可作为基质参与脯氨酸、多胺(polyamine,PAs)、NO以及GABA等重要信号分子的合成,这些信号分子通常在维持细胞稳态,调节植物抗性和ROS清除方面发挥着重要作用[47]。研究表明,GABA和脯氨酸含量与桃果实抗冷性呈正相关,外源GB通过提高了谷氨酸脱羧酶、1-吡啶-5-羧酸合成酶和鸟氨酸δ-氨基转移酶的活性,促进了桃内源GB、GABA和脯氨酸含量的积累,从而减少了MDA的产生,减缓了冷害[48]。与GB类似,热水处理减缓桃果实的冷害与其促进了氨基酸代谢有关,经45 ℃热水处理后的桃果实中因其较高的精氨酸、脯氨酸、GABA以及PAs含量进而减轻了冷藏过程中的膜损伤,同时热水处理上调了PpP5CS、PpOAT、PpGAD和PpGABA-T的基因表达,这与相关酶活性也一致[41]。此外,2,4-表油菜素内酯减少桃果实的冷害与增加了脯氨酸的积累有关[49],在冷藏枇杷[50]和西葫芦[51]中也得到相似结论。
3. 冷害减缓措施
御冷技术即通过技术手段提高桃果抵御冷害的能力,延缓冷害的发生。近年来,研究人员探究了许多减缓桃果实冷害的御冷技术,取得了重要进展(表2)。桃冷害发生伴随诸多代谢紊乱症状,如何系统评价冷害的发生对于其控制技术的研究具有重要意义。
表 2 冷害的减缓措施及其御冷机制Table 2. Alleviating measures of chilling injury and its resistant mechanism处理方法 条件参数 御冷效果 御冷机制 参考文献 低温预贮 4、8和12 ℃条件贮藏2、4、6、8和10 d,然后转入0 ℃冷藏 4和8 ℃出现严重的木质化和果肉褐变,12 ℃
减缓了冷害症状调节线粒体呼吸代谢;
维持果实较高的能量水平
[53−54]冰温贮藏 10±0.1 ℃预冷24 h,置于
−1.4±0.1 ℃贮藏桃果保持较高的蔗糖含量以及己糖激酶和果糖激酶活性,并保持高水平的三磷酸腺苷和能量 诱导可溶性碳水化合物和能量的代谢
[56−57]热处理 45 ℃水中连续浸泡10 min 丙二醛含量降低,氨基酸、酚类化合物及其衍生物含量增加,并显著增强了氨基酸代谢相关酶的活性 调节酚类物质和氨基酸的代谢,维持较高的酚类物质和氨基酸含量
[11,41]间歇升温 5 ℃贮藏14 d后转移至25 ℃
保持24 h调节PME和PG的活力;
减少酯类物质损失调节细胞壁代谢;
调节风味物质合成[13,58] 气调贮藏 5% O2+10% CO2 延缓果肉组织膜透性和褐变度的上升趋势 保持果实细胞膜完整性
[59−61]紫外辐照 3.0 kJ/m2 提高SOD、CAT和APX活性,提高酚类物质含量 增强抗氧化系统
调控酚类物质含量[63−64] 1-甲基环丙烯 1 μL/L 1-MCP 5 ℃处理24 h然后再贮藏在5 ℃ 增加了蔗糖合成酶的活性和表达,果实保持硬度,抑制细胞膜透性, 维持膜结构稳定 增强抗氧化系统;
调节酚类物质代谢;
调节活性氧和能量代谢[69−70] NO处理 1 μL/L NO处理 促进货架期内呼吸速率和乙烯产量的恢复,
防止挥发性有机物的损失维持冷藏桃果实线粒体内的不饱和脂肪酸的含量和LOX的活性
[72−73]水杨酸及其衍生物 1 μmol/L浸泡5 min 增加蔗糖含量,增强抗氧化相关酶活性 调节抗氧化系统;
影响热休克蛋白
[75]茉莉酸 30 μmol/L浸泡30 s 抑制了离子渗漏的增加和丙二醛、超氧自由基和过氧化氢的积累,抑制可溶性固形物的降低 维持细胞膜完整性;
调节蔗糖代谢;
调节能量代谢
[77−78]褪黑素 0.1 mmol/L浸泡10 min 增强抗氧化酶活性,降低了脂肪氧合酶活性 调节脂肪酸含量;
增强抗氧化系统
[81−82]3.1 物理方法
3.1.1 低温预贮
LTC指的是在冷藏前的一段时间内,以略高于采后产品冷害发生的临界温度下进行预贮藏,以增强其抗冷能力的方法[52]。蔡琰等[53]将桃果实置于4、8、12 ℃下分别预贮藏2、4、6、8和10 d,然后转入0 ℃冷藏28 d,结果表明,不同温度和时间组合的LTC处理的桃果实均出现了果实木质化和果肉褐变的冷害症状,其中采用12 ℃、6 d预贮的桃果实褐变指数仅为8.86%。对于‘霞晖5号’水蜜桃,8 ℃预贮的果实在贮藏期间褐变严重,而‘大久宝桃’在8 ℃下进行9 d的冷锻炼可预防果实冷害的发生[54],说明不同品种的桃对温度的敏感性不同。此外,较高的预贮温度或较长的预贮时间虽能抑制冷害的发生,但会导致果实软化程度增加,从而降低商品性能。例如,8 ℃预冷15 d的‘大久宝桃’虽然没有出现冷害症状,但果实软化迅速,商品性能较差[55]。王贵禧等[54]的研究也得到相似的结论。因此,预贮温度和处理时间是影响贮藏效果的关键因素。根据目前报道,最佳预贮温度为9~12 ℃,预贮时间为6~10 d,而2~8 ℃温度范围内,较易发生冷害。
3.1.2 冰温贮藏
冰温(near-freezing temperature,NFT)指0 ℃以下、冰点以上的温度区域,当果蔬贮藏温度控制在冰温范围内时,其组织细胞处于活体非冷冻状态,此状态下,果蔬的代谢速率较低,维持生命活动所需的能量也较小,可达到延缓采后衰老、延长贮藏期的目的[56]。Zhao等[10]研究了NFT对油桃冷害的影响,结果发现,油桃果实在0和5 ℃贮藏3周后,出现明显的冷害现象,而NFT处理的桃果实在整个贮藏期间并未发生冷害,并发现NFT是通过诱导可溶性碳水化合物和能量的代谢,有效提高油桃果实的抗寒性。此外,NFT贮藏还可提高油桃采后品质、抗氧化能力和自由基清除能力[7]。虽然冰温贮藏是一项非常有前景的技术,但温度的精确控制是该技术成功应用于果蔬采后保鲜的关键挑战,因为比冰温稍低的温度会对细胞组织造成冻害,温度稍高会导致贮藏寿命缩短。此外,不同品种的桃冰点存在明显差异,对于不同品种的桃冰温的适用性仍需不断研究。
3.1.3 热处理
热处理主要是指桃采后在冷藏前用热空气或热水处理一段时间。适宜的加热温度和处理时间取决于桃的品种、成熟度、大小和生长季节条件。目前,热处理的温度一般为35~60 ℃。Wang等[41]将桃置于45 ℃热水中浸泡10 min后果实的褐变指数显著降低,电导率和MDA含量分别比对照降低了20.93%和29.58%。另外,桃果实经37 ℃的热空气处理3 d后,冷害症状明显减轻,贮藏35 d后,褐变指数仅为0.18,而对照果实褐变指数高达0.74[21]。在Jin等[11]的研究中,虽然在38 ℃下用热空气处理12 h后的桃相比于对照和热处理联合茉莉酸甲酯具有较低的褐变指数,但却在一定程度上加剧了果肉的粉化。此外,研究表明,热处理缓解冷害可能与热休克蛋白(HSPs)的积累有关[57]。
3.1.4 间歇升温
间歇升温(intermittent warming,IW)指采用一次或多次短期升温处理冷藏期间的桃果实,以达到中断冷害发生的目的。研究表明,IW可调节细胞壁代谢相关的酶(PME和PG),防止柏山蜜桃糠化现象的发生[58]。在Xi等[13]的研究中,间歇升温(每周在20 ℃放置1 d后转移至5 ℃贮藏)处理提高了醇酰基转移酶的活性及PpAAT1基因表达量,减少了黄桃酯类物质的损失,同时减轻了褐变的发生。此外,间歇升温也常用作联合处理,其联合1-MCP[15]及NO[59]也可显著减轻桃果实冷害症状的发生。
3.1.5 气调贮藏
气调贮藏主要影响采后果实周围的O2和CO2等气体微环境,从而增强果实的耐寒性,其主要贮藏方式有自发气调(MA)和人工调节(CA),目前桃果实保鲜研究中,适宜的O2浓度为3%~5%,CO2浓度为5%~10%。Liu等[60]研究中,5% O2+10% CO2处理提高了桃果实低温贮藏条件下的蔗糖含量和脂肪酸不饱和程度,同时提高了PpLOX1、PpHPL1、PpAAT1的基因表达水平,减缓冷害的同时有效保持了果实香气。赵迎丽等[12]的研究结果表明,采用5% O2+10% CO2的气调处理可显著降低‘大久保桃’冷害症状,减少了果肉膜透性和褐变度的上升。何双等[61]的研究也得出相似的结论,3% O2+9% CO2的气调贮藏能显著减缓黄桃果实的冷害。O2浓度过低时,桃果实会进行无氧呼吸,产生异味,当CO2浓度过高时,会对其产生CO2伤害。对于油桃,在0 ℃下,含有10% CO2和10% O2的气调包装6周,可以防止冷害症状的发生[9]。
3.1.6 紫外辐照
紫外光指的是电磁波谱中x射线(200 nm)和可见光(400 nm)之间的波段。它通常分为长波长UV-A(320~400 nm)、中波长UV-B(280~320 nm)和短波长UV-C(200~280 nm)[62],目前果蔬采后贮藏中的应用主要是UV-B和UV-C。通常认为,UV-B和UV-C通过提高抗氧化系统来增强果实的耐寒性。最新研究表明,UV-B和UV-C处理能刺激桃果实中SOD、CAT和APX等抗氧化酶的活性,从而提高桃果实采后品质[14]。Yang等[63]的研究也得出相似的结论,UV-C处理(3.0 kJ/m2)果实的SOD、CAT和APX活性明显高于对照果实,导致O2−和H2O2水平明显降低,从而减缓桃果实的冷害。此外,UV-B和UV-C都作为非生物胁迫作用于植物,影响酚类物质的变化。UV-B处理桃果实36 h后,花青素、黄酮和二氢黄酮醇含量分别增加了2.06、1.92和1.68倍,但UV-B处理24 h后,大部分酚类物质积累量下降[64]。Santin等[65]后续的研究也再次证实了这一点。这种波动趋势归因于植物对UV-B胁迫的防御反应,在辐照开始时,果实中存在的酚类物质被降解以抵消UV-B辐射的影响。他的另一份研究还表明UV-B虽然不能穿透果皮,但仍然可引起果实萜类化合物、苯丙素、植物抗毒素和脂肪酸等物质发生变化[66]。
3.2 化学方法
3.2.1 1-甲基环丙烯(1-MCP)
1-甲基环丙烯(1-MCP)是乙烯受体的竞争性抑制剂,可抑制乙烯的生理作用,并影响乙烯生物合成途径中ACC氧化酶和ACC合成酶活力[67]。研究表明,1-MCP处理可增强桃中APX、SOD、CAT酶活性,通过增强抗氧化系统来缓解桃的冷害[68]。当1-MCP的浓度为1 μL/L时,能较好延缓桃果实冷害的发生。Yu等[69]采用1 μL/L的1-MCP处理两种桃果实,使其褐变指数分别降低了51.43%和46.95%,并证明1-MCP处理降低了蔗糖降解相关酶的活性和表达。在一份最新的研究中,在储存0、5、10、15和20 d后五次施用高剂量1-MCP(1 μL/L)处理的油桃在第五周模拟货架期结束后,褐变指数仅为24.43%,MDA和H2O2含量显著降低,有效减缓了油桃冷害的发生[70],这为1-MCP的应用提供了新模式。
3.2.2 NO和H2S处理
NO可以作为信号分子激活细胞抗氧化防御系统来缓解冷胁迫,参与植物的成熟、衰老以及生物和非生物胁迫响应等生理过程,近年来在保持果实采后贮藏品质方面研究广泛,主要包括延缓衰老、预防冷害以及控制病虫害[71]。目前在缓解桃冷害的应用上主要有SNP(外源NO供体)浸泡和外源NO熏蒸两种方法。在Song等[72]的研究中,15 μmol/L的SNP浸泡桃果实后,H2O2含量和O2−产生速率明显降低,增强了桃果实抗氧化能力和耐冷性。此外,NO可维持线粒体膜电位和膜流动性,有效地保持桃线粒体结构和功能,减轻桃线粒体在冷藏过程中的氧化损伤[73]。NO处理对桃冷害后挥发性有机物损失也有明显的减缓作用,Cai等[74]采用10 μL/L NO对桃进行4 ℃冷藏前熏蒸,结果表明,NO处理促进了冷藏后C6醛、C6醇、直链酯和内酯等主要挥发性有机化合物的释放,保持了桃的香气成分。
硫化氢(H2S)作为一种新的气体信号分子,在果蔬的采后贮藏保鲜中应用前景广阔。研究表明,低浓度的H2S(15 μmol/L)可通过调节桃果实的活性氧代谢,保持果实品质,而高浓度的H2S(45 µmol/L)则会对果实造成损伤[18]。此外,NO和H2S之间存在相互作用,NO可以调节桃果实内源性H2S的代谢,H2S和NO的组合处理可调控ACC合成酶和氧化酶活性,抑制桃果实中乙烯的生物合成并调控细胞壁代谢,从而保持果实品质[16]。
3.2.3 水杨酸和茉莉酸
水杨酸(Salicylic acid,SA)和茉莉酸植物防御系统和发育过程中的重要激素,在植物生长发育、果实成熟和对环境胁迫的反应中起着重要作用。Zhao等[75]的研究表明,用1 μmol/L SA处理的桃果实在冷藏后第28 d才出现褐变,并表明与增加了特定脱水反应元件结合蛋白(DREB)基因的表达有关。在Wang等[20]的研究中,1 mmol/L SA处理可通过影响ASA-GSH减缓桃果实的冷害,并发现水杨酸处理的果实和对照果实在冷藏前后均有HSP73的表达,推测水杨酸缓解桃冷藏冷害的作用可能与其诱导抗氧化系统和HSPs的能力有关。
MeJA通过亚油酸氧化途径产生,作为植物细胞反应的信号,在调节植物生理中起到重要作用[76]。Meng等[77]证明0.1 mmol/L MeJA处理降低了酚类化合物含量,提高了POD活性,导致冷害指数下降,并能减少细胞壁的降解和维持细胞壁钙含量,通过维持细胞膜的完整性来降低冷害。Zhao等[78]在桃采后4 ℃贮藏前短暂(30 s)浸泡天然植物激素茉莉酸,结果表明,茉莉酸处理后的果实褐变指数明显降低,这可能和茉莉酸增加乙烯产量和防止可溶性糖含量下降相关。
3.2.4 氯化钙处理
Ca2+参与植物信号转导,可作为一种信号分子对植物的生物和非生物信号作出反应,近年来,在缓解果蔬采后冷害方面逐步得到应用。在Xie等[19]的研究中,1% CaCl2可增加桃果实中钙调素PpCaM的基因表达和PpCaM的蛋白质含量,此外,PpCaM可诱导PpCa2+-ATPase,PpGAD的表达,提高相应酶活性,促进GABA的合成,通过调控能量代谢和GABA代谢缓解桃果实冷害的发生。CaCl2也被用于缓解香蕉[79]、李果[80]等果蔬冷害。
3.2.5 褪黑素
褪黑素(melatonin,MT)是自然界中普遍存在的一种吲哚胺激素,参与许多生理过程,如植物的分化、生长、成熟和衰老,以及对各种形式的环境胁迫有保护作用。目前研究表明,0.1 mmol/L MT能有效缓解低温贮藏下桃果实的冷害。Gao等[81]采用0.1 mmol/L MT处理桃果实,结果发现,MT处理有效降低了LOX活性、O2−和H2O2水平以及MDA含量,有效减缓了冷害的发生。之后,进一步研究发现,0.1 mmol/L MT通过调节膜脂肪酸含量和酚类物质代谢来减轻桃果实的冷害[17]。然而,这些结果都基于低温冷藏下的桃果实,作者并未进一步揭示MT对桃果实由低温转到常温后的冷害缓解效果。大部分研究表明,桃果实的冷害常表现在常温货架期内,并不是低温贮藏过程中[23],因此,后期研究MT对常温货架期中的桃果实的冷害抑制效果具有一定意义。
3.2.6 新型生长调节剂
其他一些化学物质,如GABA、GB和脱落酸(Abscisic acid,ABA),已显示出缓解采后水果冷害的潜力。GABA是一种非蛋白氨基酸,被认为是一种内源性信号分子,在调节胁迫反应、植物生长和发育中起着重要作用。Shang等[82]采用1、5、10 mmol/L GABA处理桃果实,结果表明,5 mmol/L为最有效浓度,在此浓度下,外源GABA处理通过诱导内源GABA和脯氨酸积累来提高抗冷性。GB是甘氨酸的N-三甲基衍生物和季铵化合物,是保护植物组织免受环境胁迫和增强非生物胁迫耐受性的重要渗透调节剂。Wang等[83]的研究表明,GB降低了桃果实冷害,保持了较高的总酚和黄酮含量,并能显著提高苯丙素代谢相关酶的活性,保持果实较高的蔗糖含量。另外,ABA也是一种重要的信号分子,在植物对许多胁迫的抗性中起着关键作用,有研究证明,外源脱落酸的施用可以通过提高部分由一氧化氮介导的酶和非酶系统的效率来提高对低温诱导的氧化应激的抗性[84]。
4. 结论与展望
长期以来,桃果实的冷害是采后保鲜贮藏的一个重要难题,国内外学者对果蔬采后冷害的发生机理和控制技术进行大量研究。笔者探讨分析了桃果采后冷害发生的机制,将桃果实低温下冷害的发生归因于以下几点:a.细胞膜组成和结构变化;b.果实能量亏缺;c.自由基活性氧的过量积累;d.细胞壁代谢异常;e.精氨酸代谢异常。建议后续不同采后技术缓解桃采后冷害的机制探究可从维持膜结构和充足的能量供应、调节糖代谢、增强抗氧化系统以及促进精氨酸代谢等进行深入研究。完整的膜结构使得生命活动正常进行,保证充足的能量供应,较高的糖含量(蔗糖)不仅有利于果实风味,且有助于稳定细胞膜,对果实具有保护作用,抗氧化系统能有效维持果实活性氧平衡使细胞免受自由基伤害,而精氨酸代谢产生的小分子物质在植物的抗寒性中发挥着重要作用。
迄今为止,桃采后冷害控制技术及其御冷机制已被广泛研究,但各项技术都有其优势与不足,具体表现为:a.冰温贮藏御冷效果好,能显著减缓褐变,但贮运过程中精确的温度控制以及对不同品种桃的适用性仍需进一步研究解决;b.紫外辐照是一种新型的冷害控制技术,具有绿色无残留的特点,但其抵御非生物胁迫的机制较为复杂,且辐照食品存在大众接受度低的问题,应用困难;c.一些天然植物小分子信号物质如茉莉酸、水杨酸、褪黑素、γ-氨基丁酸和甘氨酸甜菜碱等作为参与胁迫反应的信号分子,在减缓冷害方面已经表现出巨大潜力,是目前研究的热点,但机制尚不清楚,且大多数采用浸泡作为处理方式,难以应用到实际的生产应用中。
为减缓桃果实在低温贮藏过程中冷害的发生,建议未来研究可从以下方面开展:a.根据不同品种,不同成熟度桃对冷害的敏感性,建立适当的冷害评价体系,以期为不同地区不同品种桃贮运温度提供理论依据;b.加速发展冷链物流运输技术,保证采摘、运输、贮存到销售间的紧密连接,并完善预冷环节;c.发展经济、节约、高效、无污染的御冷技术的同时,加强耐冷品种的选育,并建立温度波动较小的冷库以及冰温库;d.转录组学、代谢组学和蛋白组学作为新一代的高通量测序技术,是进一步阐明桃果实冷害发生的潜在分子机制的重要工具,后续研究可通过转录组和代谢组结合,转录组和蛋白组共同分析等技术,找到桃果实冷害发生的关键代谢通路,找出关键调控基因,解释果实响应寒冷胁迫的分子机制。
-
表 1 桃冷害评价的关键指标及变化趋势
Table 1 Key indexes and changing trend of chilling injury evaluation in peach fruit
指标名称 冷害下的变化 果实外观 果皮凹陷;
颜色暗淡无光泽果肉质地 果肉质地发绵,汁液减少;
果实硬度上升;
果肉褐变或出血果实风味 醇醛、酯类、内酯类、酮和烯萜类物质含量降低;
糖酸比失调,甚至产生苦味呼吸作用和乙烯释放 呼吸强度异常增加;
乙烯合成受到抑制褐变指数 果肉褐变,褐变指数增加; 丙二醛含量及电导率 细胞膜受损,膜通透性增加,
电导率上升,丙二醛积累表 2 冷害的减缓措施及其御冷机制
Table 2 Alleviating measures of chilling injury and its resistant mechanism
处理方法 条件参数 御冷效果 御冷机制 参考文献 低温预贮 4、8和12 ℃条件贮藏2、4、6、8和10 d,然后转入0 ℃冷藏 4和8 ℃出现严重的木质化和果肉褐变,12 ℃
减缓了冷害症状调节线粒体呼吸代谢;
维持果实较高的能量水平
[53−54]冰温贮藏 10±0.1 ℃预冷24 h,置于
−1.4±0.1 ℃贮藏桃果保持较高的蔗糖含量以及己糖激酶和果糖激酶活性,并保持高水平的三磷酸腺苷和能量 诱导可溶性碳水化合物和能量的代谢
[56−57]热处理 45 ℃水中连续浸泡10 min 丙二醛含量降低,氨基酸、酚类化合物及其衍生物含量增加,并显著增强了氨基酸代谢相关酶的活性 调节酚类物质和氨基酸的代谢,维持较高的酚类物质和氨基酸含量
[11,41]间歇升温 5 ℃贮藏14 d后转移至25 ℃
保持24 h调节PME和PG的活力;
减少酯类物质损失调节细胞壁代谢;
调节风味物质合成[13,58] 气调贮藏 5% O2+10% CO2 延缓果肉组织膜透性和褐变度的上升趋势 保持果实细胞膜完整性
[59−61]紫外辐照 3.0 kJ/m2 提高SOD、CAT和APX活性,提高酚类物质含量 增强抗氧化系统
调控酚类物质含量[63−64] 1-甲基环丙烯 1 μL/L 1-MCP 5 ℃处理24 h然后再贮藏在5 ℃ 增加了蔗糖合成酶的活性和表达,果实保持硬度,抑制细胞膜透性, 维持膜结构稳定 增强抗氧化系统;
调节酚类物质代谢;
调节活性氧和能量代谢[69−70] NO处理 1 μL/L NO处理 促进货架期内呼吸速率和乙烯产量的恢复,
防止挥发性有机物的损失维持冷藏桃果实线粒体内的不饱和脂肪酸的含量和LOX的活性
[72−73]水杨酸及其衍生物 1 μmol/L浸泡5 min 增加蔗糖含量,增强抗氧化相关酶活性 调节抗氧化系统;
影响热休克蛋白
[75]茉莉酸 30 μmol/L浸泡30 s 抑制了离子渗漏的增加和丙二醛、超氧自由基和过氧化氢的积累,抑制可溶性固形物的降低 维持细胞膜完整性;
调节蔗糖代谢;
调节能量代谢
[77−78]褪黑素 0.1 mmol/L浸泡10 min 增强抗氧化酶活性,降低了脂肪氧合酶活性 调节脂肪酸含量;
增强抗氧化系统
[81−82] -
[1] 王力荣. 我国桃产业现状与发展建议[J]. 中国果树,2021(10):5. [WANG L R. Situation and development suggestions of peach industry in China[J]. China Fruits,2021(10):5. doi: 10.16626/j.cnki.issn1000-8047.2021.10.001 [2] GANG C, LI J, CHEN Y, et al. Synergistic effect of chemical treatments on storage quality and chilling injury of honey peaches[J]. Journal of Food Processing and Preservation,2015,39(6):1108−1117. doi: 10.1111/jfpp.12325
[3] 刘晨霞, 乔勇进, 王晓, 等. 桃果采后生理与贮藏保鲜技术研究进展[J]. 江苏农业科学,2018,46(17):6. [LIU C X, QIAO Y J, WANG X, et al. Research progress on postharvest physiology and storage and preservation technology of peach[J]. Jiangsu Agricultural Sciences,2018,46(17):6. doi: 10.15889/j.issn.1002-1302.2018.17.004 [4] KONG X, WEI B, GAO Z, et al. Changes in membrane lipid composition and function accompanying chilling injury in bell peppers[J]. Plant Cell Physiol,2018,59(1):167−178. doi: 10.1093/pcp/pcx171
[5] 胡均如, 张敏. 热处理提高采后果蔬低温贮藏期间活性氧清除能力的机制[J]. 食品与发酵工业,2021,47(12):8. [HU J R, ZHANG M. Mechanism of heat treatment to improve the active oxygen scavenging ability of postharvest vegetables during low temperature storage[J]. Food and Fermentation Industries,2021,47(12):8. doi: 10.13995/j.cnki.11-1802/ts.026053 [6] WANG X, WEI Y, CHEN Y, et al. NMR revealed that trehalose enhances sucrose accumulation and alleviates chilling injury in peach fruit[J]. Scientia Horticulturae,2022,303:111190. doi: 10.1016/j.scienta.2022.111190
[7] ZHAO H, JIAO W, CUI K, et al. Near-freezing temperature storage enhances chilling tolerance in nectarine fruit through its regulation of soluble sugars and energy metabolism[J]. Food Chem,2019,289:426−435. doi: 10.1016/j.foodchem.2019.03.088
[8] ZHANG B, XI W P, WEI W W, et al. Changes in aroma-related volatiles and gene expression during low temperature storage and subsequent shelf-life of peach fruit[J]. Postharvest Biology and Technology,2011,60(1):7−16. doi: 10.1016/j.postharvbio.2010.09.012
[9] 陈京京, 金鹏, 李会会, 等. 低温贮藏对桃果实冷害和能量水平的影响[J]. 农业工程学报,2012,28(4):7. [CHEN J J, JIN P, LI H H, et al. Effects of low temperature storage on chilling injury and energy level of peach fruit[J]. Journal of Agricultural Engineering,2012,28(4):7. doi: 10.3969/j.issn.1002-6819.2012.04.046 [10] ZHAO H, SHU C, FAN X, et al. Near-freezing temperature storage prolongs storage period and improves quality and antioxidant capacity of nectarines[J]. Scientia Horticulturae,2018,228:196−203. doi: 10.1016/j.scienta.2017.10.032
[11] JIN P, ZHENG Y, TANG S, et al. A combination of hot air and methyl jasmonate vapor treatment alleviates chilling injury of peach fruit[J]. Postharvest Biology and Technology,2009,52(1):24−29. doi: 10.1016/j.postharvbio.2008.09.011
[12] 赵迎丽, 王春生, 王亮, 等. 不同气调贮藏方式对大久保桃冷藏后品质的影响[J]. 华北农学报,2010,25(5):234−238. [ZHAO Y L, WANG C S, WANG L, et al. Effects of various controlled atmosphere treaments to the quality of "Okubao" peach fruit during cold storage and shelf-life[J]. Acta Agriculturae Boreali-Sinica,2010,25(5):234−238. [13] XI W P, ZHANG B, SHEN J Y, et al. Intermittent warming alleviated the loss of peach fruit aroma-related esters by regulation of AAT during cold storage[J]. Postharvest Biology & Technology,2012,74:42−48.
[14] ZHANG W, JIANG W. UV treatment improved the quality of postharvest fruits and vegetables by inducing resistance[J]. Trends in Food Science & Technology,2019,92:71−80.
[15] LIU H, JIANG W, CAO J, et al. A combination of 1-methylcyclopropene treatment and intermittent warming alleviates chilling injury and affects phenolics and antioxidant activity of peach fruit during storage[J]. Scientia Horticulturae,2018,229:175−181. doi: 10.1016/j.scienta.2017.11.010
[16] ZHU L Q, DU H A, WANG W, et al. Synergistic effect of nitric oxide with hydrogen sulfide on inhibition of ripening and softening of peach fruits during storage[J]. Scientia Horticulturae,2019,256:108591. doi: 10.1016/j.scienta.2019.108591
[17] GAO H, LU Z M, YANG Y, et al. Melatonin treatment reduces chilling injury in peach fruit through its regulation of membrane fatty acid contents and phenolic metabolism[J]. Food Chem,2018,245:659−666. doi: 10.1016/j.foodchem.2017.10.008
[18] 汪伟, 沈勇根, 石晶莹, 等. 外源硫化氢对桃果实保鲜效果及活性氧代谢的影响[J]. 果树学报,2014,31(2):6. [WANG W, SHEN Y G, SHI J Y, et al. Effects of exogenous hydrogen sulfide on preservation effect and active oxygen metabolism of peach fruit[J]. Journal of Fruit Science,2014,31(2):6. doi: 10.13925/j.cnki.gsxb.2014.02.026 [19] XIE B, LING C, HU S, et al. CaM enhances chilling tolerance of peach fruit by regulating energy and GABA metabolism[J]. Postharvest Biology and Technology,2021,181(1):111691.
[20] WANG L, CHEN S, KONG W, et al. Salicylic acid pretreatment alleviates chilling injury and affects the antioxidant system and heat shock proteins of peaches during cold storage[J]. Postharvest Biology and Technology,2006,41(3):244−251. doi: 10.1016/j.postharvbio.2006.04.010
[21] YU L, LIU H, SHAO X, et al. Effects of hot air and methyl jasmonate treatment on the metabolism of soluble sugars in peach fruit during cold storage[J]. Postharvest Biology and Technology,2016,113:8−16. doi: 10.1016/j.postharvbio.2015.10.013
[22] 殷健东. 1-MCP和乙烯对水蜜桃采后冷害发生的生理调控机制研究[D]. 扬州: 扬州大学, 2018 YIN J D. Physiological regulation mechanism of 1-MCP and ethylene on postharvest chilling injury of peach[D]. Yangzhou: Yangzhou University, 2018.
[23] 金微微, 陈功楷, 姚丽娟, 等. 桃果实采后冷害生理及分子水平研究进展[J]. 广东农业科学,2012,39(18):4. [JIN W W, CHEN G K, YAO L J, et al. Research progress on physiology and molecular level of postharvest chilling injury of peach[J]. Guangdong Agricultural Sciences,2012,39(18):4. doi: 10.3969/j.issn.1004-874X.2012.18.040 [24] 张佳俊, 陈海江, 曹洪波, 等. 桃优系‘保佳俊’采后褐变特征与相关机理研究[J]. 果树学报,2014,31(5):946−952. [ZHANG J J, CHEN J H, CAO H B, et al. Characteristics and related mechanism of browning of a newly found peach 'Baojiajun' during postharvest storage[J]. Journal of Fruit Science,2014,31(5):946−952. doi: 10.13925/j.cnki.gsxb.20140128 [25] 吴春霞. 桃果实采后物流机械伤与冷害控制以及不同品种冷害敏感性研究[D]. 杭州: 浙江大学, 2020 WU C X. Studies on postharvest mechanical wound and chilling injury control and chilling injury sensitivity in peach fruit[J]. Hangzhou: Zhejiang University, 2020.
[26] 祝美云, 党建磊, 梁丽松, 等. 低温条件下不同品种桃果实的耐藏性差异研究[J]. 食品科学,2012,33(8):289−295. [ZHU M Y, DANG J L, LIANG L S, et al. Storability difference of peach varieties during low-temperature storage[J]. Food Science,2012,33(8):289−295. [27] 邓丽, 曾文芳, 刘慧, 等. 低温贮藏过程中溶质和硬质桃冷害发生的生理差异[J]. 西北植物学报,2020,40(4):635−641. [DENG L, ZENG W F, LIU H, et al. Physiological differences of chilling injury between stony hard and melting peaches during cold storage[J]. Acta Botanica Boreali-Occidentalia Sinica,2020,40(4):635−641. [28] 邵兴锋, 屠康, 曹燕, 等. 桃果实絮败机理及减缓措施[J]. 果树学报,2005,22(2):149−153. [SHAO X X, TU K, CAO Y, et al. Woolly breakdown mechanism of peach and nectarine and the control methods[J]. Journal of Fruit Science,2005,22(2):149−153. [29] AGHDAM M S, JANNATIZA A, LUO Z, et al. Ensuring sufficient intracellular ATP supplying and friendly extracellular ATP signaling attenuates stresses, delays senescence and maintains quality in horticultural crops during postharvest life[J]. Trends in Food Science & Technology,2018,76:67−81.
[30] ZHAO Y, TANG J, SONG C, et al. Nitric oxide alleviates chilling injury by regulating the metabolism of lipid and cell wall in cold-storage peach fruit[J]. Plant Physiol Biochem,2021,169:63−69. doi: 10.1016/j.plaphy.2021.10.039
[31] WANG J W, ZHOU X, ZHOU Q, et al. Proteomic analysis of peel browning of 'Nanguo' pears after low-temperature storage[J]. J Sci Food Agric,2017,97(8):2460−2467. doi: 10.1002/jsfa.8060
[32] SONG C, WANG K, XIAO X, et al. Membrane lipid metabolism influences chilling injury during cold storage of peach fruit[J]. Food Research International,2022,157:111249. doi: 10.1016/j.foodres.2022.111249
[33] HU S Q, MA Y Q, XIE B, et al. 24-Epibrassinolide improves chilling tolerance by regulating PpCBF5-mediated membrane lipid metabolism in peach fruit[J]. Postharvest Biology and Technology,2022,186:111844. doi: 10.1016/j.postharvbio.2022.111844
[34] WANG L, BOKHARY S, XIE B, et al. Biochemical and molecular effects of glycine betaine treatment on membrane fatty acid metabolism in cold stored peaches[J]. Postharvest Biology and Technology,2019,154(C):58−69.
[35] ZHU Y, WANG K, WU C, et al. Effect of ethylene on cell wall and lipid metabolism during alleviation of postharvest chilling injury in peach[J]. Cells,2019,8:12.
[36] AZEVEDO I G, OLIVEIRA J G, SILVA M, et al. P-type H+-ATPases activity, membrane integrity, and apoplastic pH during papaya fruit ripening[J]. Postharvest Biology & Technology,2008,48(2):242−247.
[37] JIN P, ZHU H, WANG J, et al. Effect of methyl jasmonate on energy metabolism in peach fruit during chilling stress[J]. Journal of the Science of Food & Agriculture,2013,93(8):1827−1832.
[38] 王艳颖, 胡文忠, 刘程惠, 等. 低温贮藏引起果蔬冷害的研究进展[J]. 食品科技,2010(1):5. [WANG Y Y, HU W Z, LIU C H, et al. Progress of research on chilling injury of fruit and vegetable during low temperature storage[J]. Food Science and Technology,2010(1):5. doi: 10.13684/j.cnki.spkj.2010.01.026 [39] MA Y, HUANG D, CHEN C, et al. Regulation of ascorbate-glutathione cycle in peaches via nitric oxide treatment during cold storage[J]. Scientia Horticulturae,2019,247:400−406. doi: 10.1016/j.scienta.2018.12.039
[40] 王懿, 侯媛媛, 马钰晴, 等. 甘氨酸甜菜碱处理对桃果实冷害及抗坏血酸-谷胱甘肽循环代谢的影响[J]. 食品科学,2021,42(13):8. [WANG Y, HOU Y Y, MA Y Q, et al. Effects of glycine betaine treatment on chilling injury and ascorbic acid glutathione cycle metabolism of peach fruit[J]. Food Science,2021,42(13):8. doi: 10.7506/spkx1002-6630-20200818-242 [41] WANG L, WANG Y, HOU, et al. Physiological and metabolomic analyses of hot water treatment on amino acids and phenolic metabolisms in peach cold tolerance[J]. Postharvest Biology and Technology,2021,179:111593. doi: 10.1016/j.postharvbio.2021.111593
[42] HK A, AT B, MG C. Evaluation of biochemical changes and quality in peach fruit: Effect of putrescine treatments and storage[J]. Journal of Food Composition and Analysis,2021,102:104048. doi: 10.1016/j.jfca.2021.104048
[43] CARVAJAL F, PALMA F, JAMILENA M, et al. Cell wall metabolism and chilling injury during postharvest cold storage in zucchini fruit[J]. Postharvest Biology and Technology,2015,108:68−77. doi: 10.1016/j.postharvbio.2015.05.013
[44] WANG L, CHEN S, SHAO J, et al. Hydrogen sulfide alleviates chilling injury in peach fruit by maintaining cell structure integrity via regulating endogenous H2S, antioxidant and cell wall metabolisms[J]. Food Chem,2022,391:133283. doi: 10.1016/j.foodchem.2022.133283
[45] LI D, LI L, LUO Z, et al. Effect of nano-ZnO-packaging on chilling tolerance and pectin metabolism of peaches during cold storage[J]. Scientia Horticulturae,2017,225:128−133. doi: 10.1016/j.scienta.2017.07.003
[46] 廖云霞, 冉自强, 王丹, 等. γ-氨基丁酸处理对桃果实冷藏期间细胞壁代谢及冷害的影响[J]. 食品科技,2017,42(11):50−56. [LIAO Y X, RAN Z Q, WANG D, et al. Effect of γ-amino butyric acid treatments on cell wall metabolism and chilling injury in peaches during the refrigerated storage[J]. Food Science and Technology,2017,42(11):50−56. [47] YAO W, XU T, FAROOQ S U, et al. Glycine betaine treatment alleviates chilling injury in zucchini fruit (Cucurbita pepo L.) by modulating antioxidant enzymes and membrane fatty acid metabolism[J]. Postharvest Biology & Technology,2018,144:20−28.
[48] SHAN T, JIN P, ZHANG Y, et al. Exogenous glycine betaine treatment enhances chilling tolerance of peach fruit during cold storage[J]. Postharvest Biology and Technology,2016,114:104−110. doi: 10.1016/j.postharvbio.2015.12.005
[49] GAO H, ZHANG Z, LV X, et al. Effect of 24-epibrassinolide on chilling injury of peach fruit in relation to phenolic and proline metabolisms[J]. Postharvest Biology and Technology,2016,111:390−397. doi: 10.1016/j.postharvbio.2015.07.031
[50] VENKATALAXMI A, PADMAVATHI B S, AMARANATH T. A general solution of unsteady stokes equations[J]. Fluid Dynamics Research,2004,35(3):229−236. doi: 10.1016/j.fluiddyn.2004.06.001
[51] BOKHARY S U F, WANG L, ZHENG Y, et al. Pre-storage hot water treatment enhances chilling tolerance of zucchini (Cucurbita pepo L.) squash by regulating arginine metabolism[J]. Postharvest Biology and Technology,2020,166:111229. doi: 10.1016/j.postharvbio.2020.111229
[52] CHAUDHARY P R, JAYAPRAKASHA G K, PORAT R, et al. Low temperature conditioning reduces chilling injury while maintaining quality and certain bioactive compounds of 'Star Ruby' grapefruit[J]. Food Chemistry,2014,153(15):243−249.
[53] 蔡琰, 余美丽, 邢宏杰, 等. 低温预处理对冷藏水蜜桃冷害和品质的影响[J]. 农业工程学报,2010(6):5. [CAI Y, YU M L, XING H J, et al. Effects of low temperature conditioning on chilling injury and quality of cold-stored juicy peach fruit[J]. Journal of Agricultural Engineering,2010(6):5. [54] 王贵禧, 王友升, 梁丽松. 不同贮藏温度模式下大久保桃果实冷害及其品质劣变研究[J]. 林业科学研究,2005,18(2):114−119. [GUI X, WANG Y S, LIANG L S. Study on chilling injury and quality deterioration of Okubo peach under different storage temperature modes[J]. Forest Research,2005,18(2):114−119. doi: 10.3321/j.issn:1001-1498.2005.02.002 [55] 及华, 关军锋, 李丽梅, 等. 贮藏模式对大久宝桃果实冷害和品质的影响[J]. 河北农业科学,2008,12(4):3. [JI H, GUAN J F, LI L M, et al. Effect of different storage temperature on chilling injury and quality of the 'Okubao' peach fruit[J]. Journal of Hebei Agricultural Sciences,2008,12(4):3. doi: 10.3969/j.issn.1088-1631.2008.04.007 [56] LIU D K, XU C C, GUO C X, et al. Sub-zero temperature preservation of fruits and vegetables: A review[J]. Journal of Food Engineering,2019,275:109881.
[57] ELAZAR, FALLIK. Prestorage hot water treatments (immersion, rinsing and brushing)[J]. Postharvest Biology & Technology,2004,32(2):125−134.
[58] 王淑琴, 皮钰珍, 颜廷才, 等. 间歇升温防止冷藏桃果实糠化的研究[J]. 食品工业科技,2009(4):3. [WANG S Q, PI Y Z, YAN T C, et al. Study on intermittent heating to prevent chafing of refrigerated peach fruit[J]. Science and Technology of Food Industry,2009(4):3. doi: 10.13386/j.issn1002-0306.2009.04.072 [59] ZHU L Q, JIE Z, ZHU S H. Effect of a combination of nitric oxide treatment and intermittent warming on chilling injury of 'Feicheng' peach fruit during storage[J]. Food Chemistry,2010,121(1):165−170. doi: 10.1016/j.foodchem.2009.12.025
[60] LIU H R, HE H, LIU C X, et al. Changes of sensory quality, flavor-related metabolites and gene expression in peach fruit treated by controlled atmosphere (CA) under cold storage[J]. International Journal of Molecular Sciences,2022,23(13):7141. doi: 10.3390/ijms23137141
[61] 何双, 李高阳, 蒋成, 等. 气调贮藏对黄桃风味和软化及褐变相关酶的影响[J]. 现代农业科技,2019(7):202−205. [HE S, LI G Y, JIANG C, et al. Effect of controlled atmosphere storage on flavor, softening, browning related enzymes of yellow peach[J]. Modern Agricultural Science and Technology,2019(7):202−205. [62] URBAN L, CHARLES F, MIRANDA M D, et al. Understanding the physiological effects of UV-C light and exploiting its agronomic potential before and after harvest[J]. Plant Physiology and Biochemistry,2016,105:1−11. doi: 10.1016/j.plaphy.2016.04.004
[63] YANG Z, CAO S, SU X, et al. Respiratory activity and mitochondrial membrane associated with fruit senescence in postharvest peaches in response to UV-C treatment[J]. Food Chem, 2014, 161: 16−21.
[64] SANTIN M, LUCINI L, CASTAGNA A, et al. Post-harvest UV-B radiation modulates metabolite profile in peach fruit[J]. Postharvest Biology and Technology,2018,139:127−134. doi: 10.1016/j.postharvbio.2018.02.001
[65] SANTIN M, LUCINI L, CASTAGNA A, et al. Comparative "phenol-omics" and gene expression analyses in peach (Prunus persica) skin in response to different postharvest UV-B treatments[J]. Plant Physiol Biochem,2019,135:511−519. doi: 10.1016/j.plaphy.2018.11.009
[66] SANTIN M, RANIERI A, HAUSER M T, et al. The outer influences the inner: Postharvest UV-B irradiation modulates peach flesh metabolome although shielded by the skin[J]. Food Chemistry,2020,338:127782.
[67] 任艳芳, 何俊瑜, 刘国琴, 等. 1-甲基环丙烯对艳红桃采后果实软化和活性氧代谢的影响[J]. 西南农业学报,2013,26(6):5. [REN Y F, HE J Y, LIU G Q, et al. Effects of 1-MCP treatment on fruit softening and active oxygen metabolism of 'Yanhong' peach[J]. Southwest China Journal of Agricultural Sciences,2013,26(6):5. doi: 10.16213/j.cnki.scjas.2013.06.079 [68] CHEN H, X AN, YU M, et al. Effect of combined heat and 1-MCP treatment on the quality and antioxidant level of peach fruit during storage[J]. Postharvest Biology and Technology,2018,145:193−202. doi: 10.1016/j.postharvbio.2018.07.013
[69] YU L, SHAO X, WEI Y, et al. Sucrose degradation is regulated by 1-methycyclopropene treatment and is related to chilling tolerance in two peach cultivars[J]. Postharvest Biology and Technology,2017,124:25−34. doi: 10.1016/j.postharvbio.2016.09.002
[70] ZHANG W, ZHAO H, JIANG H, et al. Multiple 1-MCP treatment more effectively alleviated postharvest nectarine chilling injury than conventional one-time 1-MCP treatment by regulating ROS and energy metabolism[J]. Food Chem,2020,330:127256. doi: 10.1016/j.foodchem.2020.127256
[71] ZHANG W L, CAO J K, FAN X G, et al. Applications of nitric oxide and melatonin in improving postharvest fruit quality and the separate and crosstalk biochemical mechanisms[J]. Trends in Food Science & Technology,2020,99:531−541.
[72] SONG C, ZHAO Y, LI A, et al. Postharvest nitric oxide treatment induced the alternative oxidase pathway to enhance antioxidant capacity and chilling tolerance in peach fruit[J]. Plant Physiol Biochem,2021,167:113−122. doi: 10.1016/j.plaphy.2021.07.036
[73] WANG C, HUANG D, TIAN W, et al. Nitric oxide alleviates mitochondrial oxidative damage and maintains mitochondrial functions in peach fruit during cold storage[J]. Scientia Horticulturae,2021,287:110249. doi: 10.1016/j.scienta.2021.110249
[74] CAI H, HAN S, YU M, et al. Exogenous nitric oxide fumigation promoted the emission of volatile organic compounds in peach fruit during shelf life after long-term cold storage[J]. Food Res Int,2020,133:109135. doi: 10.1016/j.foodres.2020.109135
[75] ZHAO Y, SONG C, BRUMMELL D A, et al. Salicylic acid treatment mitigates chilling injury in peach fruit by regulation of sucrose metabolism and soluble sugar content[J]. Food Chem,2021,358:129867. doi: 10.1016/j.foodchem.2021.129867
[76] WANG S Y, SHI X C, LIU F Q, et al. Effects of exogenous methyl jasmonate on quality and preservation of postharvest fruits: A review[J]. Food Chem,2021,353:129482. doi: 10.1016/j.foodchem.2021.129482
[77] MENG X H, HAN J, WANG Q, et al. Changes in physiology and quality of peach fruits treated by methyl jasmonate under low temperature stress[J]. Food Chemistry,2009,114(3):1028−1035. doi: 10.1016/j.foodchem.2008.09.109
[78] ZHAO Y, SONG C, BRUMMELL D A, et al. Jasmonic acid treatment alleviates chilling injury in peach fruit by promoting sugar and ethylene metabolism[J]. Food Chem,2021,338:128005. doi: 10.1016/j.foodchem.2020.128005
[79] 杨文慧, 黄玉咪, 徐超, 等. 氯化钙和草酸处理减轻香蕉果实贮藏冷害[J]. 中国南方果树,2020,49(5):78−86. [YANG W H, HUANG Y M, XU C, et al. Calcium chloride and oxalic acid treatment reduced chilling injury of banana fruit during storage[J]. South China Fruits,2020,49(5):78−86. [80] 王艳颖, 胡文忠, 田密霞, 等. 氯化钙处理对李果实抑制冷害作用的影响[J]. 食品科学,2011,32(8):5. [WANG Y Y, HU W Z, TIAN M X, et al. Inhibitory effect of calcium chloride treatment on chilling injury in plum fruits[J]. Food Science,2011,32(8):5. [81] GAO H, ZHANG Z K, CHAI H K, et al. Melatonin treatment delays postharvest senescence and regulates reactive oxygen species metabolism in peach fruit[J]. Postharvest Biology & Technology,2016,118:103−110.
[82] SHANG H, CAO S, YANG Z, et al. Effect of exogenous γ-aminobutyric acid treatment on proline accumulation and chilling injury in peach fruit after long-term cold storage[J]. Journal of Agricultural & Food Chemistry,2011,59(4):1264−1268.
[83] WANG L, SHAN T, XIE B, et al. Glycine betaine reduces chilling injury in peach fruit by enhancing phenolic and sugar metabolisms[J]. Food Chemistry,2019,272:530−538. doi: 10.1016/j.foodchem.2018.08.085
[84] ZHANG Q, ZHANG L, GENG B, et al. Interactive effects of abscisic acid and nitric oxide on chilling resistance and active oxygen metabolism in peach fruit during cold storage[J]. Journal of the Science of Food and Agriculture,2019,99:7. doi: 10.1002/jsfa.9469





 下载:
下载:
 下载:
下载:



