Isolation, Identification of Leuconostoc mesenteroides HDE1 and Anti-oxidation and Milk Coagulability of Its Extracellular Polysaccharide
-
摘要: 为了拓展产乳酸菌胞外多糖的来源,获得来源明确、产量稳定、具有优良生物学特性的乳酸菌胞外多糖。本研究从自制橘子发酵液中利用产黏菌落法分离筛选得到一株高产胞外多糖的乳酸菌,综合形态学观察及16S rDNA序列分析结果、API 50 CHL试验,对其进行鉴定,利用抗氧化及牛奶凝结试验研究了该乳酸菌胞外多糖的抗氧化及牛奶凝结等特性。结果表明,本研究获得了一株肠膜明串珠菌(Leuconostoc mesenteroides),该菌株16S rDNA序列片段长度为1444 bp,GenBank登录号为OM302141。菌株HDE1胞外多糖的总糖、蛋白质、糖醛酸含量分别为41.73%±1.74%、0.29%±0.03%和7.69%±0.42%。该胞外多糖在浓度为3 mg/mL时展现出良好的抗氧化活性,当胞外多糖浓度为5 mg/mL时DPPH自由基清除能力达到50.00%±0.05%,ABTS+自由基清除能力达到40.00%±0.02%,H2O2-自由基清除能力超过了50%,羟基自由基清除能力达到49.96%±0.03%,胞外多糖的总还原力为38.82%±0.09%。牛奶凝结研究结果表明,HDE1在36 h能够使添加3%(w/v)蔗糖的脱脂牛奶完全凝结。这些结果表明菌株HDE1胞外多糖具有良好的抗氧化和牛奶凝结特性,在食品、医药及益生领域展现出良好应用潜力。Abstract: In order to expand the source of exopolysaccharides (EPS) from lactic acid bacteria, obtain EPS from lactic acid bacteria with clear source, stable yield and excellent biological characteristics. In this study, a strain of lactic acid bacteria with high EPS production was isolated and screened from self-made orange fermentation liquid by slime producing colony method. Morphological observation, 16S rDNA sequence analysis results and API 50 CHL test were combined to identify the strain. Antioxidant and milk coagulation characteristics of the lactic acid bacteria EPS were studied by antioxidant and milk coagulation test. Results showed that: A 16S rDNA fragment of Leuconostoc mesenteroides with 1444 bp was obtained, and its GenBank number was OM302141. The contents of total sugar, protein and uronic acid in strain HDE1 EPS were 41.73%±1.74%, 0.29%±0.03% and 7.69%±0.42%, respectively. The EPS showed good antioxidant activity when the concentration was 3 mg/mL. When the concentration of EPS was 5 mg/mL, the scavenging ability of DPPH, ABTS+ and H2O2- free radical reached 50.00%±0.05%, 40.00%±0.02% and more than 50%. The hydroxyl scavenging ability was 49.96%±0.03%, and the total reducing power of EPS was 38.82%±0.09%. Milk curdling results showed that HDE1 could make skim milk with 3% (w/v) sucrose coagulate completely at 36 h. These results indicated that strain HDE1 EPS had good antioxidant and milk condensation properties, showing good application potential in food, medicine and probiotics.
-
乳酸菌(lactic acid bacteria,LAB)胞外多糖(exopolysaccharides,EPS)是部分乳酸菌在生长代谢过程中分泌到细胞外的天然高分子聚合物,具有分子质量大、黏度大、结构复杂多样等特点[1]。乳酸菌胞外多糖具有抗炎、抗氧化、抗肿瘤、免疫调节和降血糖等功能,具有开发成益生元的潜力[2],还可以作为增稠剂、稳定剂等改善或增强乳制品的口感和流变特性[3],广泛用于食品、医药、化工等领域[4]。一般来说,产胞外多糖的乳酸菌主要从泡菜、果蔬酱、水果发酵液中分离筛选[5-7]。但是由于菌种来源、培养条件和分离纯化方法等不同,使得胞外多糖的分子质量、单糖组成、结构产生较大差异,进而影响胞外多糖的功能特性[8]。
目前报道的产胞外多糖的乳酸菌主要包括:链球菌属(Streptococcus)、乳杆菌属(Lactobacillus)、双歧杆菌属(Bifidobacterium)和明串珠菌属(Leuconostoc)等[9]。其中Leuconostoc胞外多糖是由一种单糖组成的同型多糖,具有抗氧化、免疫调节等功能,是目前乳酸菌胞外多糖的主要来源。产胞外多糖成员有肠膜明串珠菌(Leuconostoc mesenteroides)和假肠膜明串珠菌(Leuconostoc pseudomesenteroides)等[10]。深入挖掘高产胞外多糖Leuconostoc资源,获得不同化学组分、优良特性的胞外多糖,对于揭示构效关系和拓展应用范畴具有重要的意义。此外,乳酸菌胞外多糖的产量较低,限制了其大规模生产及应用[11],因此新的乳酸菌胞外多糖的研究与开发将成为生命科学领域的重要发展方向。
目前已分离的乳酸菌胞外多糖产量尚不能满足发酵工业的需求。本研究从自制发酵水果中分离筛选到一株产胞外多糖的Ln. mesenteroides HDE1,分离纯化胞外多糖后测定化学组成,并考察了胞外多糖的牛奶凝结能力和体外抗氧化活性。研究结果不仅丰富Leuconostoc胞外多糖来源,为HDE1胞外多糖构效关系研究奠定了基础,也有助于推动该多糖在食品、医药等领域的应用。
1. 材料与方法
1.1 材料与仪器
橘子 哈达水果批发市场;API 50 CHL试验条(产品编号:50300) 法国梅里埃有限公司;细菌基因组DNA提取试剂盒(产品编号:DP302-02) 北京天根生化科技有限公司;DNA Marker DL 2000、DNA Marker DL 15000 大连宝生物工程有限公司;MRS培养基(g/L):葡萄糖20 g,牛肉膏10 g,蛋白胨10 g,硫酸镁0.2 g,硫酸锰0.05 g,酵母浸粉5 g,柠檬酸铵2 g,磷酸氢二钾2 g,无水乙酸钠5 g,无水亚硫酸钠0.1 g,吐温80 1 mL,加蒸馏水定容至1 L,调至pH5.5,121 ℃灭菌15 min;MRS-S培养基(g/L):蛋白胨10 g,牛肉膏10 g,酵母浸粉5 g,蔗糖50 g,磷酸氢二钾2 g,亚硫酸钠0.1 g,乙酸钠5 g,硫酸镁0.2 g,硫酸锰0.05 g,柠檬酸铵2 g,吐温80 1 mL,加蒸馏水定容至1 L,调至pH5.5,108 ℃灭菌20 min;其他试剂 均为国产分析纯。
UVmini-1240型紫外可见分光光度计 岛津国际贸易上海有限公司;VersaMax型酶标仪 美国美谷分子仪器有限公司;BX43型正置荧光显微镜 奥林巴斯中国有限公司;SM+3140B型体视镜 北京泰克仪器有限公司;X-15R型高速冷冻离心机 美国Beckman Coulter有限公司;HH-B11-420-S型恒温培养振荡器 上海跃进医疗器械厂。
1.2 实验方法
1.2.1 原料预处理
取新鲜个体均匀的橘子洗净切块,去核处理后放入含100 mL无菌水的发酵罐中,密封自然发酵72 h。
1.2.2 产胞外多糖菌株的分离与纯化
取200 μL准备好的发酵液稀释涂布于MRS平板上,置于37 ℃培养箱培养48 h,待平板上长出菌落,挑取单菌落接种于MRS液体培养基中,过夜静置培养后获得菌悬液,将菌悬液于MRS-S固体平板上进行三区划线,37 ℃静置培养24 h后,观察平板上菌落特征。
1.2.3 菌株的生长及产胞外多糖的进程
以2%(v/v)的接种量将活化到对数期的种子液接种到100 mL/250 mL MRS-S培养基中,30 ℃恒温培养72 h,每间隔6 h,采用平板菌落计数法测定发酵液中的活菌数(CFU/mL)及胞外多糖产糖量(g/L)。
1.2.4 基于16S rDNA序列的鉴定
菌株HDE1基因组DNA的提取:取5 mL活化好的种子液经12000 r/min离心1 min,尽量吸净上清,留沉淀。然后用基因组提取试剂盒提取菌株HDE1的基因组DNA。PCR扩增:采用16S rDNA通用引物,上游引物27F 5' AGAGTTTGATCMTGGCTCAG 3'和下游引物1492R 5' GGTTACCTTGTTACGACTT 3',对提取的基因组DNA进行PCR扩增,扩增体系及扩增程序见表1及表2。
表 1 16S rDNA PCR扩增体系Table 1. 16S rDNA PCR amplification systemPCR反应体系组分 体积(μL) 2×Taq PCR Master Mix 5 基因组DNA 2 上游引物10 µmol/L 1 下游引物10 µmol/L 1 dd H2O 1 表 2 16S rDNA PCR扩增程序Table 2. 16S rDNA PCR amplification procedure步骤 温度(℃) 时间 循环数 预变性 95 5 min 1 变性 95 30 s 1 退火 55 30 s 30 延伸 72 90 s 1 16S rDNA测序及分析:将PCR产物交由上海生工生物公司进行测序,测序结果上传至NCBI数据库,经BLAST与GenBank数据库中已有核苷酸序列进行同源序列比对,根据同源性确定菌株的种属水平。系统发育树构建:下载与获得的16S rDNA核苷酸序列同源性高的模式菌株核苷酸序列,构建系统发育树。
1.2.5 API鉴定
使用API试剂盒分析菌株生理生化特性,37 ℃恒温静置培养,分别于24和48 h观察并记录结果。
1.2.6 胞外多糖的纯化
按照Du等[12]的方法纯化胞外多糖。以2%(v/v)的接种量将活化好的产胞外多糖菌株种子液接入到MRS-S产糖培养基中,30 ℃、120 r/min培养36 h,得到的发酵液4 ℃、12000 r/min离心30 min,加入80%(w/v)的TCA,使上清液的TCA终浓度达4%(w/v)。4 ℃静置过夜后,4 ℃、12000 r/min离心30 min除去发酵液中的蛋白,获得上清液。向上清液中加入三倍体积95%预冷乙醇,4 ℃静置过夜沉淀为胞外多糖,4 ℃、12000 r/min离心20 min,将沉淀溶于去离子水并转入透析袋(截留分子量为8000~12000 Da),4 ℃透析2 d,每8 h更换一次水。透析后将胞外多糖样品冷冻干燥。
1.2.7 胞外多糖产糖量的测定
胞外多糖产糖量根据苯酚-硫酸法[13]进行测定,并以葡萄糖作为标准品绘制标准曲线。将烘干至恒重的葡萄糖配制成200 μg/mL的母液,并依次稀释成浓度为0、20、40、60、80、100、120、140、160、180及200 μg/mL的葡萄糖溶液。取1 mL葡萄糖溶液与1 mL 6%(w/v)的苯酚溶液混合,随后加入5 mL浓硫酸,冷却至室温后,测定OD490 nm。以葡萄糖浓度(μg/mL)和OD490 nm分别为横纵坐标绘制标准曲线,得到标准曲线方程y=22.246x+0.002(R²=0.9995)。将胞外多糖溶液适当稀释后,同法测定OD490 nm,并通过标准曲线计算菌株胞外多糖产糖量。
1.2.8 胞外多糖纯度检测
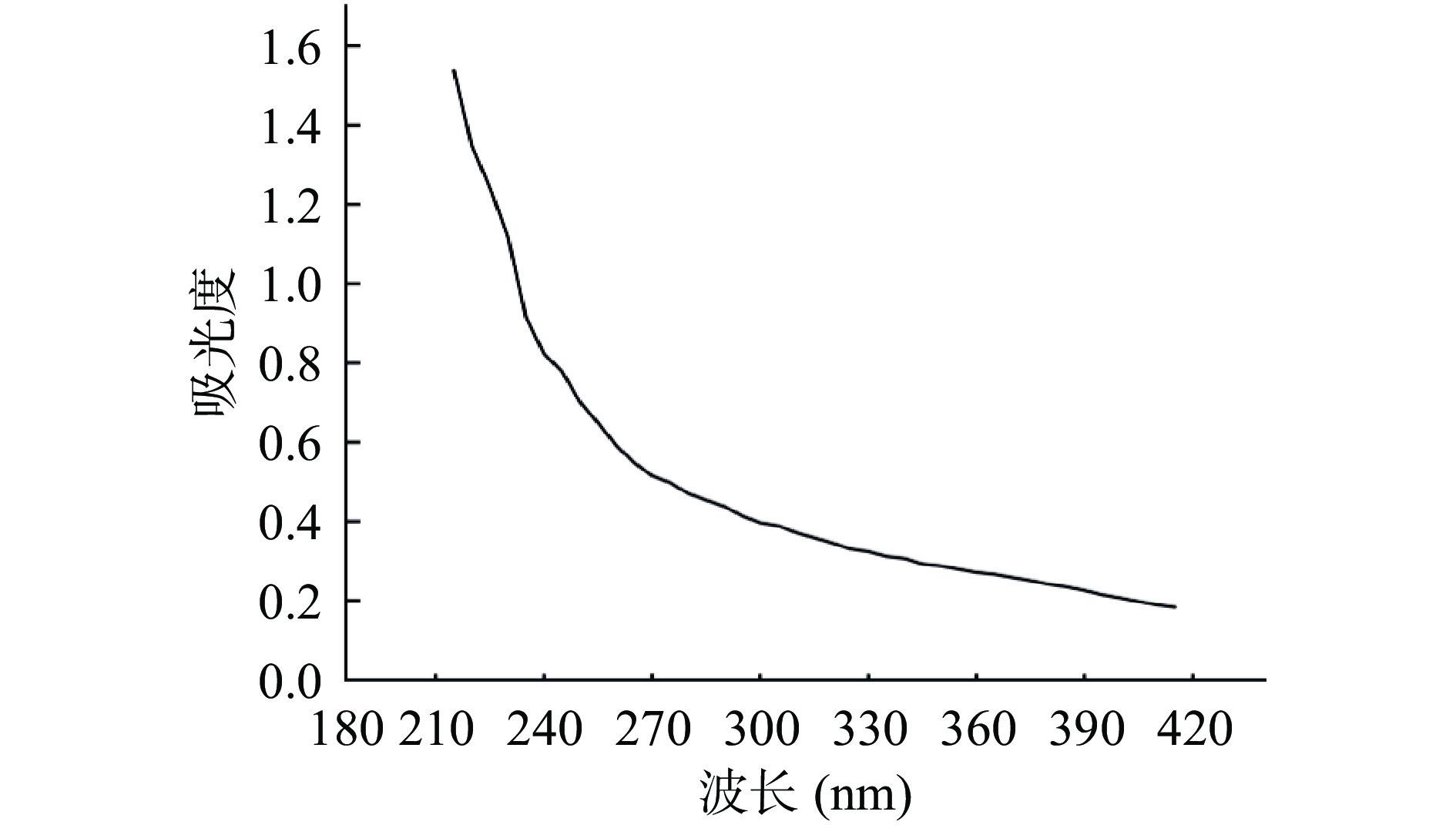
将冻干的胞外多糖溶于去离子水中,配制成浓度为1 mg/mL的胞外多糖溶液,紫外分光光度计检测纯度,扫描波长范围为190~350 nm,观察在波长260和280 nm处有无特征峰,检测胞外多糖是否有核酸和蛋白的污染。
1.2.9 胞外多糖化学组成测定
本研究采用BCA法蛋白质定量试剂盒对胞外多糖中蛋白的定量测定。采用苯酚-硫酸法测定胞外多糖的总糖含量,具体操作见1.2.7。采用硫酸-咔唑法[14]测定胞外多糖的糖醛酸含量。将烘干至恒重的葡萄糖醛酸配制成40 μg/mL的母液,并依次稀释成浓度为0、5、10、15、20、25、30、35、40 μg/mL的葡萄糖醛酸溶液。取5 mL 0.025 mol/L硫酸-四硼酸钠溶液置于冰上冷却10 min,随后缓慢加入1 mL葡萄糖醛酸溶液,冰上混匀后,将试管于沸水浴中加热10 min,冷却至室温。再向其中加入0.2 mL 0.125%咔唑溶液,混匀后继续沸水浴加热15 min,冷却至室温后,测定其OD530 nm。以葡萄糖醛酸浓度(μg/mL)和OD530 nm分别为横纵坐标绘制标准曲线,得到标准曲线方程y=0.0137x+0.0403(R²=0.9903)。同法测定胞外多糖中糖醛酸含量。
1.2.10 抗氧化活性检测
1.2.10.1 DPPH自由基清除能力
参照Shen等[15]的方法,将2 mL(浓度范围0~5 mg/mL)的胞外多糖样品与2 mL 0.2 mmol/L DPPH乙醇溶液混匀,暗反应30 min后,测定OD517 nm,以VC为阳性对照。DPPH自由基清除能力计算公式如下:
清除率(%)=[1−(A1−A2)/A0]×100 式中:A0:水与DPPH反应的吸光度;A1:样品与DPPH反应的吸光度;A2:水与样品反应的吸光度,以排除样品自身对试验的干扰。
1.2.10.2 ABTS+自由基清除能力
参照Peter等[16]的方法稍作修改,将2 mL(浓度范围0~5 mg/mL)的胞外多糖样品与4 mL 7 mmol/L的ABTS工作液混匀,室温反应6 min,以VC为阳性对照测定混合液OD734 nm。ABTS+自由基清除能力计算公式:
清除率(%)=[1−(A1−A2)/A0]×100 式中:A0:水与ABTS反应的吸光度;A1:样品与ABTS反应的吸光度;A2:水与样品反应的吸光度,以排除样品自身对试验的干扰。
1.2.10.3 H2O2-自由基清除能力
参照Ruch等[17]的方法并稍作调整,将0.6 mL 40 mmol/L的H2O2溶液与2.4 mL 0.1 mol/L pH7.4的磷酸盐缓冲液混匀,并向其中加入2 mL(浓度范围0~5 mg/mL)的胞外多糖样品,反应体系混匀后于室温反应10 min,以VC为阳性对照,测定混合液OD230 nm。H2O2-自由基清除能力计算公式:
清除率(%)=[1−(A1−A2)/A0]×100 式中:A0:磷酸盐缓冲液与H2O2反应的吸光度;A1:样品与H2O2反应的吸光度;A2:磷酸盐缓冲液与样品反应的吸光度,以排除样品自身对试验的干扰。
1.2.10.4 羟基自由基清除能力
根据Liu等[18]的报道,将2 mL(浓度范围0~5 mg/mL)的胞外多糖样品与1 mL 9 mmol/L的FeSO4溶液、1 mL 9 mmol/L的水杨酸-乙醇溶液振荡混匀,随即加入1 mL 9 mmol/L的H2O2溶液以启动反应发生,混匀后于37 ℃反应40 min,以VC为阳性对照,测定混合液OD510 nm。羟基自由基清除能力计算公式:
清除率(%)=[1−(A1−A2)/A0]×100 式中:A0:水与OH反应的吸光度;A1:样品与OH反应的吸光度;A2:水与样品反应的吸光度,以排除样品自身对试验的干扰。
1.2.10.5 总还原力
采用Chen等[19]的研究稍作调整,将2 mL(浓度范围0~5 mg/mL)的胞外多糖样品与2.5 mL 0.2 mol/L pH6.6的磷酸盐缓冲液及2.5 mL 1%(w/v)的铁氰化钾溶液振荡混匀,50 ℃反应20 min,冷却至室温后,向反应体系中加入2.5 mL 10%(w/v)的TCA溶液,4000 r/min离心30 min,取2.5 mL上清与0.5 mL 0.1%(w/v)的FeCl3溶液及2.5 mL去离子水振荡混匀,反应10 min,以VC为阳性对照,测定混合液OD700 nm。
1.2.11 牛奶凝结试验
向灭菌后的10%(w/v)脱脂牛奶中分别加入3%、6%、9%及12%(w/v)的蔗糖。将Ln. mesenteroides HDE1发酵液按1%的接种量接入到含不同蔗糖浓度的脱脂牛奶中,摇匀后于30 ℃静止放置12、24及36 h,以不含蔗糖的脱脂牛奶为对照,观察脱脂牛奶的凝结情况。
1.3 数据处理
所有处理设置三个平行,数据以均值±标准差表示。本研究使用Excel 2019(Microsoft, U.S.A.)软件绘图,使用JMP 10.0(LISHISAS)进行统计分析及多重比较。P<0.05为差异显著,P<0.01为差异极显著。
2. 结果与分析
2.1 菌株HDE1菌落形态特征
水果发酵液经稀释涂布、三区划线后,获得一株产胞外多糖菌株HDE1。在MRS琼脂培养基上(图1A),菌落呈现圆形、灰白色、凸起、边缘整齐。在MRS-S琼脂培养基上(图1B),菌落为半透明、凸起、表面粘稠、有光泽,并且比MRS琼脂培养基上的菌落要大。李彬等[20]和Kanamarlapudi等[21]同样在MRS-S培养基上筛选得到了产胞外多糖的乳酸菌。以上结果均证明,蔗糖不仅可以作为乳酸菌生长的碳源,还可以作为菌株产胞外多糖的诱导剂。
2.2 菌株HDE1产胞外多糖进程
菌株在MRS-S培养基中的生长及产胞外多糖进程如图2所示,在发酵初期,胞外多糖产量随着菌株的生长不断增加,在发酵42 h时,菌株的活菌数达到13.4±0.10 lg CFU/mL,此时胞外多糖产量达到最大。随后,随着发酵时间的延长,胞外多糖的产量呈现下降的趋势。本研究中菌株HDE1与韩瑨等[22]研究的Ln. mesenteroides Leuco 4相比产胞外多糖速度更快、产量更高。HDE1在42 h即可达到13.02±0.61 g/L而Leuco 4在80 h才能达到11 g/L。
2.3 菌株HDE1 16S rDNA序列分析
菌株HDE1 16S rDNA部分序列长度为1444 bp,GenBank登录号为OM302141,该序列与Ln. mesenteroides LAB-29(GenBank登录号MT 953985.1)的16S rDNA基因序列相似度最高,同源性达98%(图3)。
2.4 菌株HDE1糖发酵特征
菌株API 50 CHL鉴定结果如表3所示,菌株可以利用L-阿拉伯糖、D-葡萄糖、D-木糖、D-半乳糖、D-葡萄糖、D-果糖及D-甘露醇等,而不能利用甘露醇、D-阿拉伯糖、L-木糖及L-鼠李糖等,发酵特征与Ln. mesenteroides最为相似,相似度达99.9%。结合形态学观察及16S rDNA分析,鉴定该菌株HDE1为Ln. mesenteroides。
表 3 菌株HDE1的API 50 CHL鉴定结果Table 3. Identification results based on API 50 CHL test of strain HDE1编号 碳水化合物 结果 编号 碳水化合物 结果 0 对照 − 25 七叶灵 + 1 甘露醇 − 26 水杨苷 + 2 赤藻糖醇 − 27 D-纤维二糖 + 3 D-阿拉伯糖 − 28 D-麦芽糖 + 4 L-阿拉伯糖 + 29 D-乳糖 − 5 D-核糖 + 30 D-密二糖 + 6 D-木糖 + 31 D-蔗糖 + 7 L-木糖 − 32 D-海藻糖 + 8 D-侧金盏花醇 − 33 菊粉 − 9 甲基-β-D-吡喃木糖苷 − 34 D-松三糖 − 10 D-半乳糖 + 35 D-棉子糖 + 11 D-葡萄糖 + 36 淀粉 − 12 D-果糖 + 37 糖原 − 13 D-甘露醇 + 38 木糖醇 − 14 L-山梨糖 − 39 D-龙胆二糖 + 15 L-鼠李糖 − 40 D-土伦糖 + 16 卫芽醇 − 41 D-来苏糖 − 17 肌醇 − 42 D-塔格糖 − 18 甘露醇 − 43 D-岩藻糖 − 19 山梨醇 − 44 L-岩藻糖 − 20 α-甲基-D-吡喃甘露糖苷 − 45 D-阿拉伯醇 − 21 α-甲基-D-吡喃葡萄糖苷 + 46 L-阿拉伯醇 − 22 N-乙酰葡-萄糖胺 + 47 葡萄糖酸钾 − 23 苦杏仁苷 + 48 2-酮基葡萄糖酸钾 − 24 熊果苷 + 49 5-酮基葡萄糖酸钾 − 注:“+”代表阳性反应;“−”代表阴性反应。 2.5 菌株HDE1胞外多糖纯度检测
发酵液经TCA去蛋白、乙醇沉淀、透析及冷冻干燥后,获得Ln. mesenteroides HDE1胞外多糖粗品,呈白色棉花状固体。HDE1胞外多糖溶液全波长扫描结果如图4所示,在260和280 nm附近没有吸收峰,说明胞外多糖中没有核酸和蛋白的污染[23]。
2.6 菌株HDE1胞外多糖化学组成
HDE1胞外多糖的总糖含量为41.73%±1.74%,蛋白含量为0.29%±0.03%,糖醛酸含量为7.69%±0.42%,表明HDE1胞外多糖中含有少量的蛋白质修饰,胡风庆等[24]也曾报告过相关情况。叶广彬等[25]之前报道的Ln. pseudomesenteroides GX-3胞外多糖总糖含量最高才可达到38.42%±2.15%,研究结果展示HDE1的总糖含量远远高于GX-3。证明不同种属来源的胞外多糖在化学组分上有差异。
2.7 菌株HDE1胞外多糖抗氧化活性
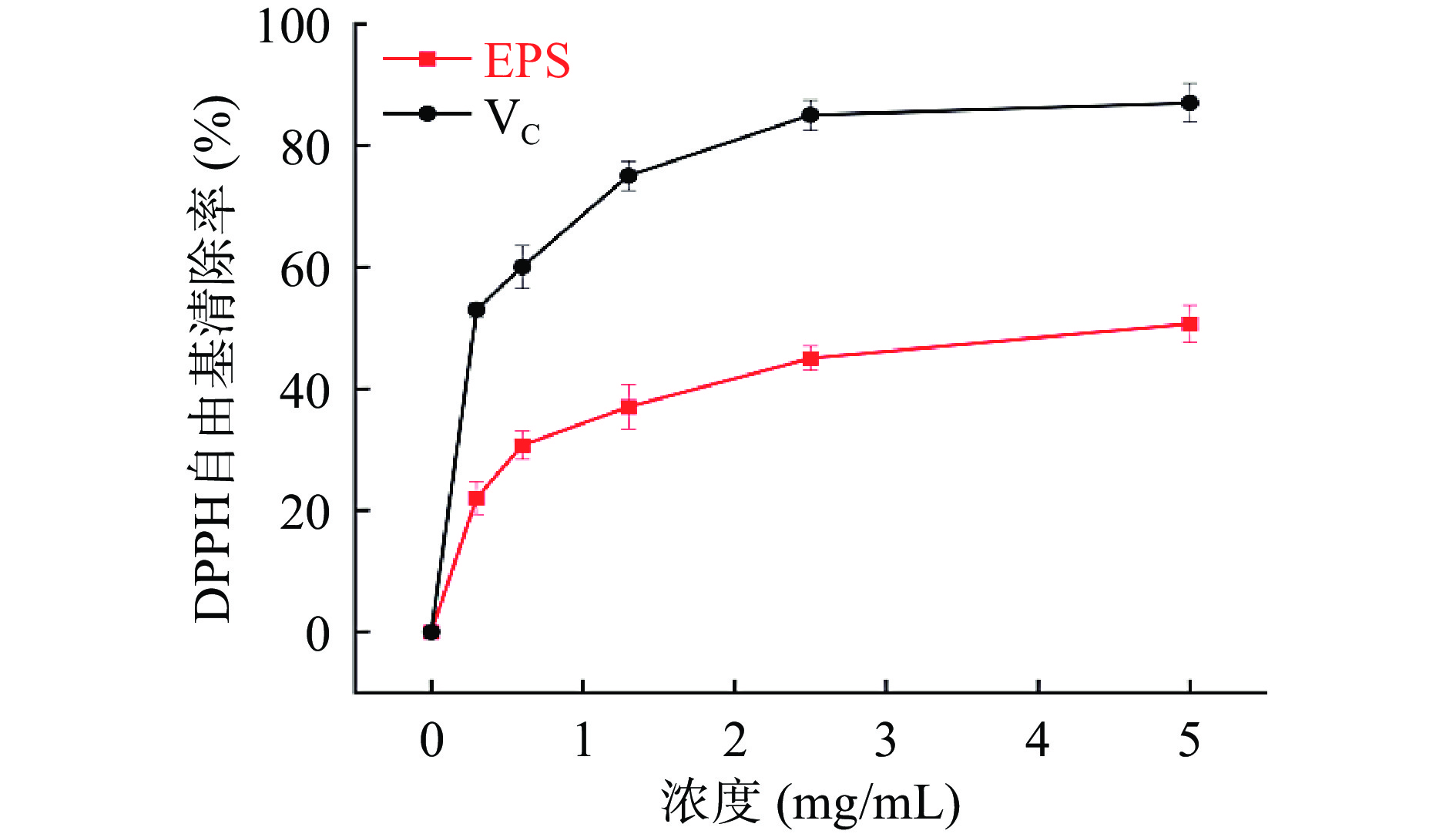
2.7.1 DPPH自由基清除能力
如图5所示,随着HDE1胞外多糖质量浓度的升高,DPPH自由基清除能力不断升高。当胞外多糖浓度为1.3 mg/mL时,DPPH自由基清除率达到37%±0.05%,胞外多糖质量浓度为5 mg/mL时,DPPH自由基清除能力达到50.00%±0.05%。董乐等[26]研究发现,当胞外多糖质量浓度为10 mg/mL时,胞外多糖对DPPH自由基清除率为19.32%。不同来源的胞外多糖可能因为单糖组成、羟基和羧基的含量以及供氢能力不同,使得DPPH自由基清除能力上存在差异[27]。
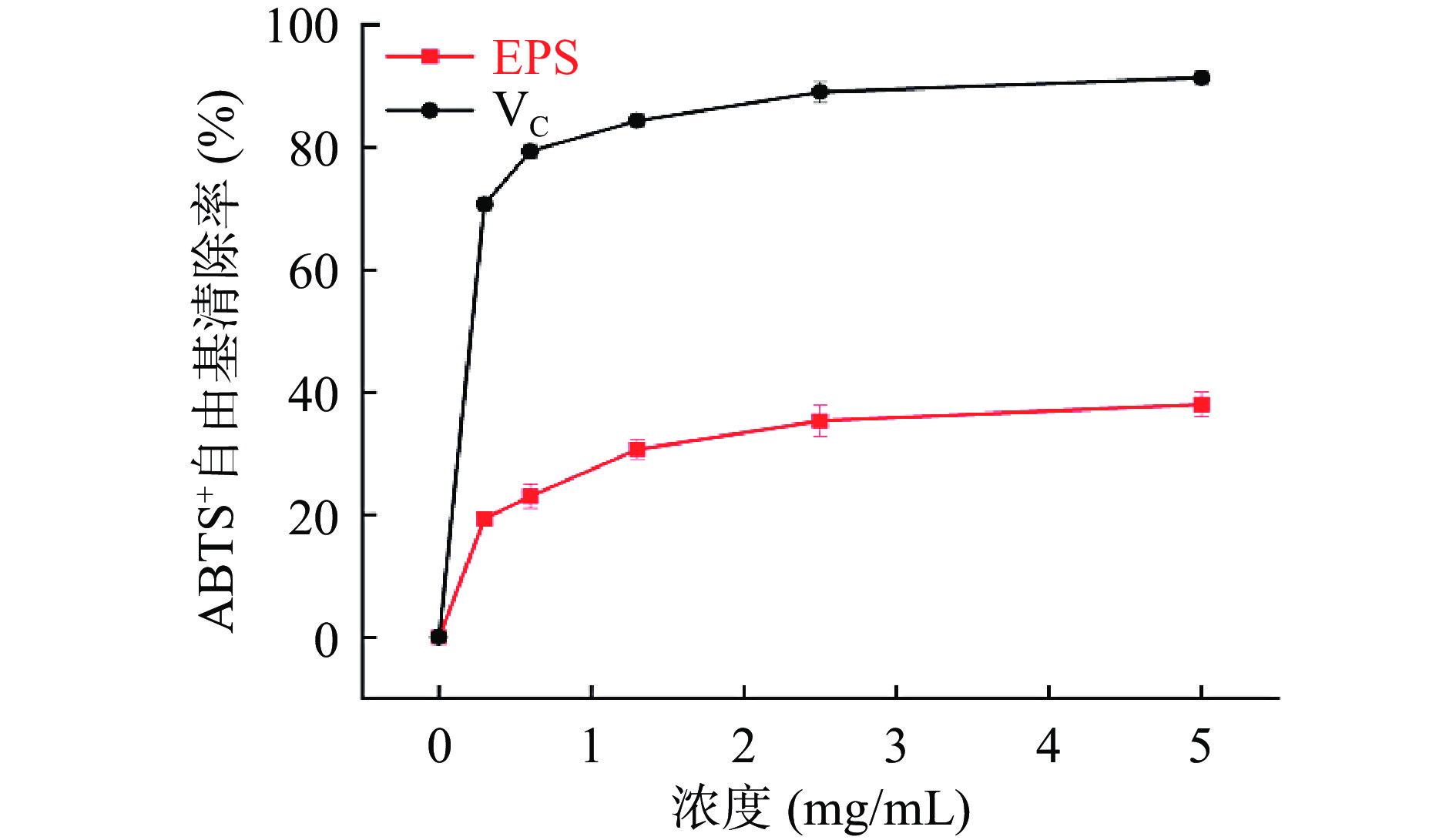
2.7.2 ABTS+自由基清除能力
ABTS+自由基清除率结果如图6所示,当胞外多糖质量浓度为1 mg/mL时,对ABTS的清除能力超过了20%。随着胞外多糖质量浓度继续升高,ABTS+自由基清除能力也随之增强,胞外多糖质量浓度为5 mg/mL时,ABTS+自由基清除能力达到40.00%±0.02%。
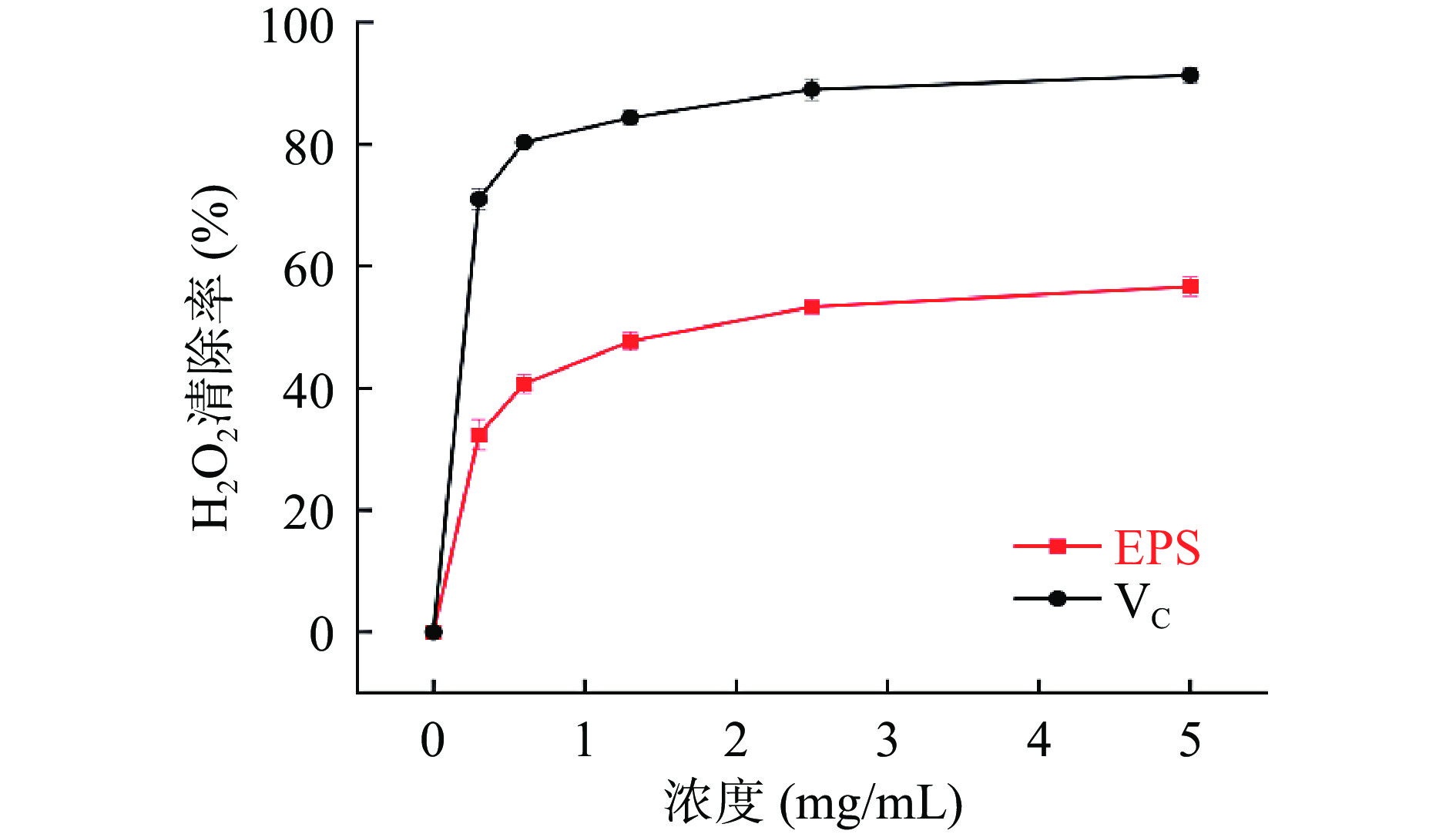
2.7.3 H2O2-自由基清除能力
对于食物或细胞的功能性来说,清除羟基来防御被氧化是至关重要的[28]。HDE1胞外多糖和VC对H2O2自由基清除活性如图7所示。胞外多糖和VC的清除能力均呈现浓度依赖性,但HDE1胞外多糖的清除能力始终低于VC,当胞外多糖浓度为5 mg/mL时H2O2-自由基清除能力超过了50%,明显高于紫芝(Ganoderma sinense)GSP2胞外多糖[29],优化后的GSP2含量为10 mg/mL时,H2O2-自由基清除率仅达到了48.12%。研究结果表明HDE1胞外多糖具有良好的H2O2-自由基清除活性。-
2.7.4 羟基自由基清除能力
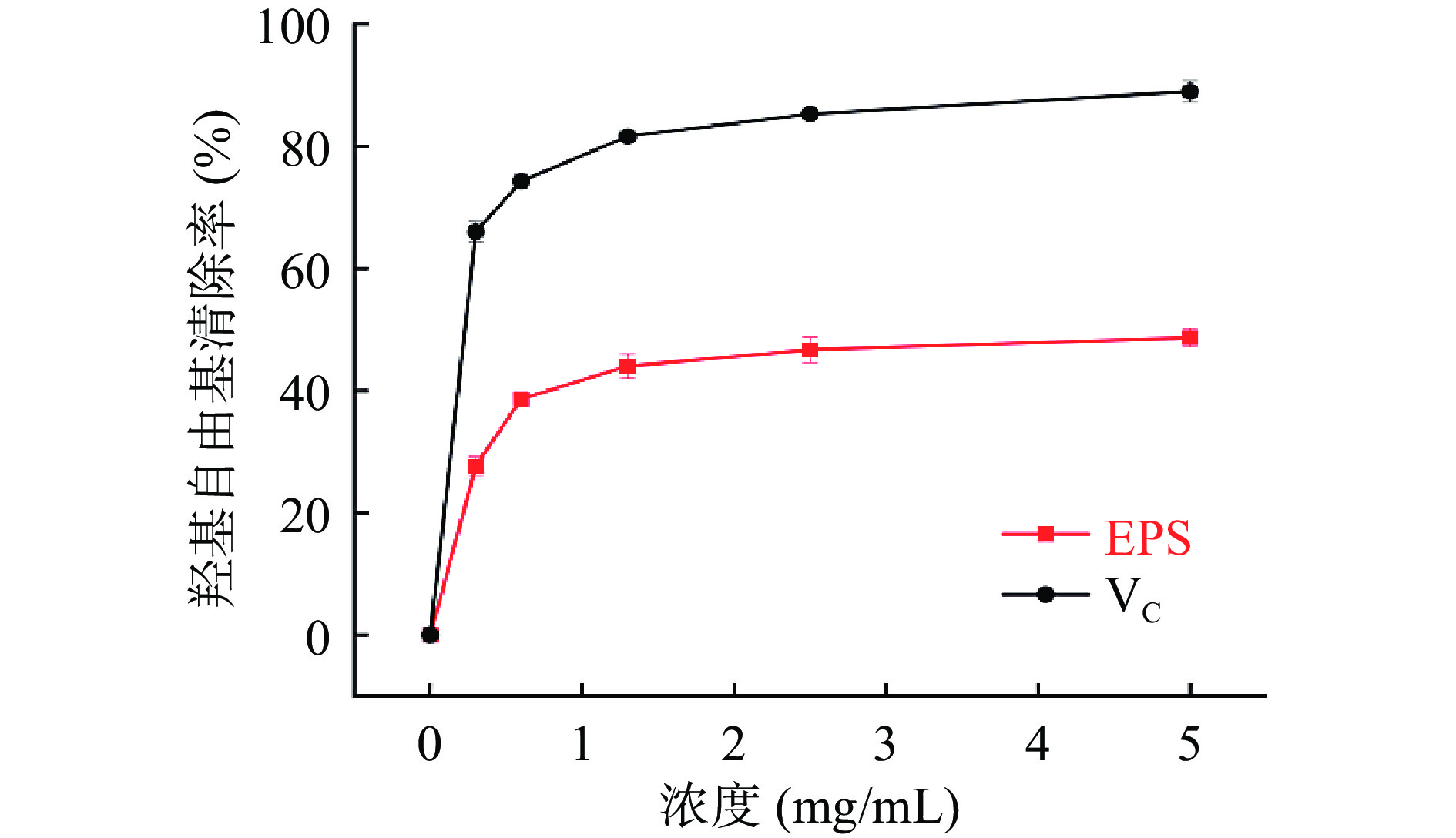
从图8可以看出,HDE1胞外多糖和VC均表现出羟基自由基的清除活性,且羟基自由基清除能力呈浓度依赖性。Ye等[30]与崔静等[31]试验研究结果均可证明,胞外多糖浓度越高,羟基自由基清除效果越强。在浓度为5 mg/mL时,HDE1胞外多糖对羟基自由基清除能力达到49.96%±0.03%,表明HDE1胞外多糖有良好的羟基自由基清除能力。
2.7.5 总还原力
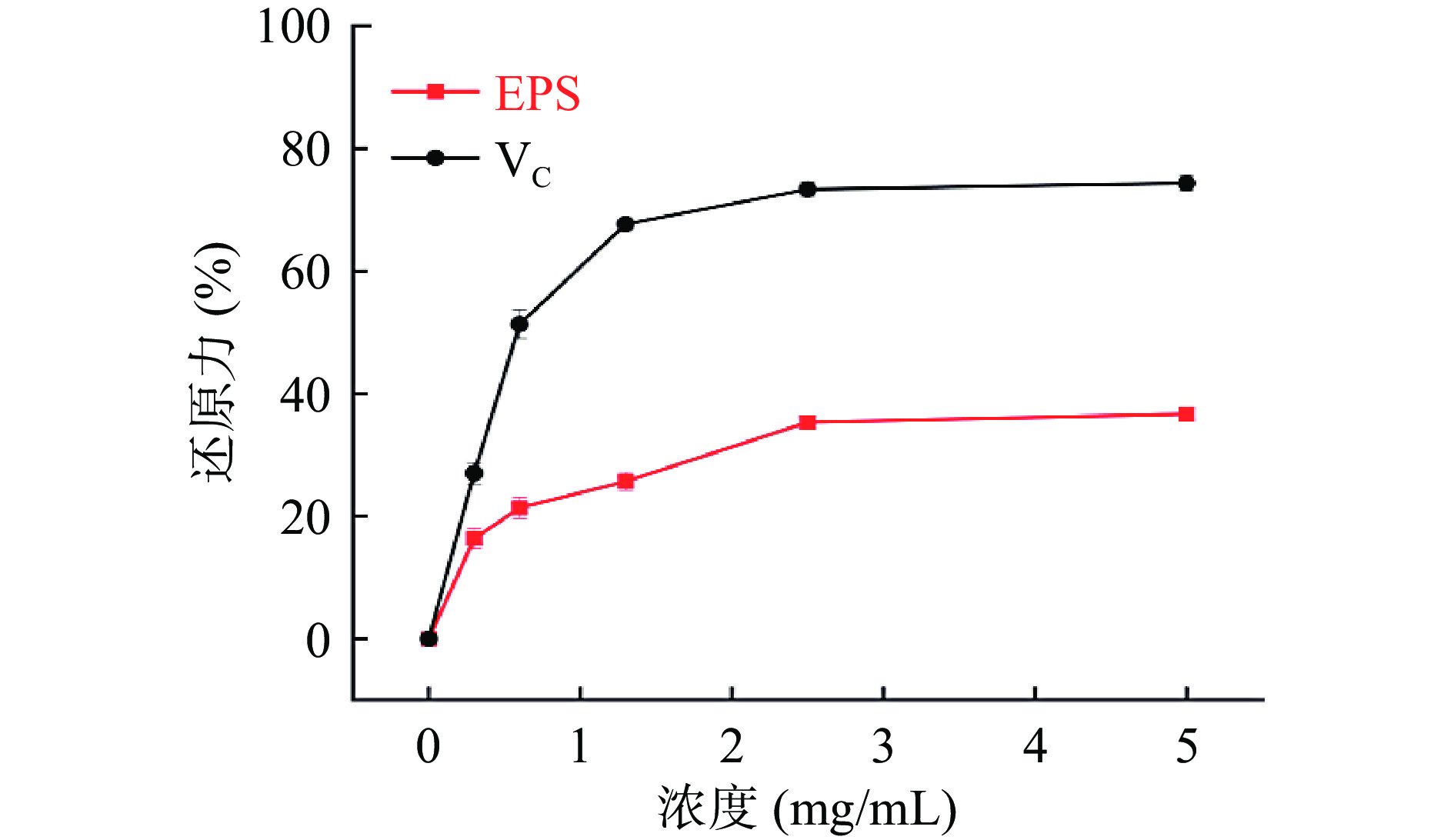
总还原力是通过测定样品在700 nm处Fe3+/铁氰化物配合物还原成亚铁的吸光度来估算样品还原能力。具有还原力的化学物质可以提供氢原子来阻断过氧化物的形成,进而破坏自由基反应链,展现抗氧化能力[28]。如图9所示,随着质量浓度的升高,胞外多糖和VC的总还原力呈现先急速上升后稳定的趋势,但胞外多糖的总还原力始终低于VC。在浓度为5 mg/mL时,胞外多糖的总还原力为38.82%±0.09%,高于Ln. pseudomesenteroides GX-3胞外多糖[22]和戊糖片球菌(Pediococcus pentosaceus)SR2-2胞外多糖[32]。
2.8 牛奶凝结
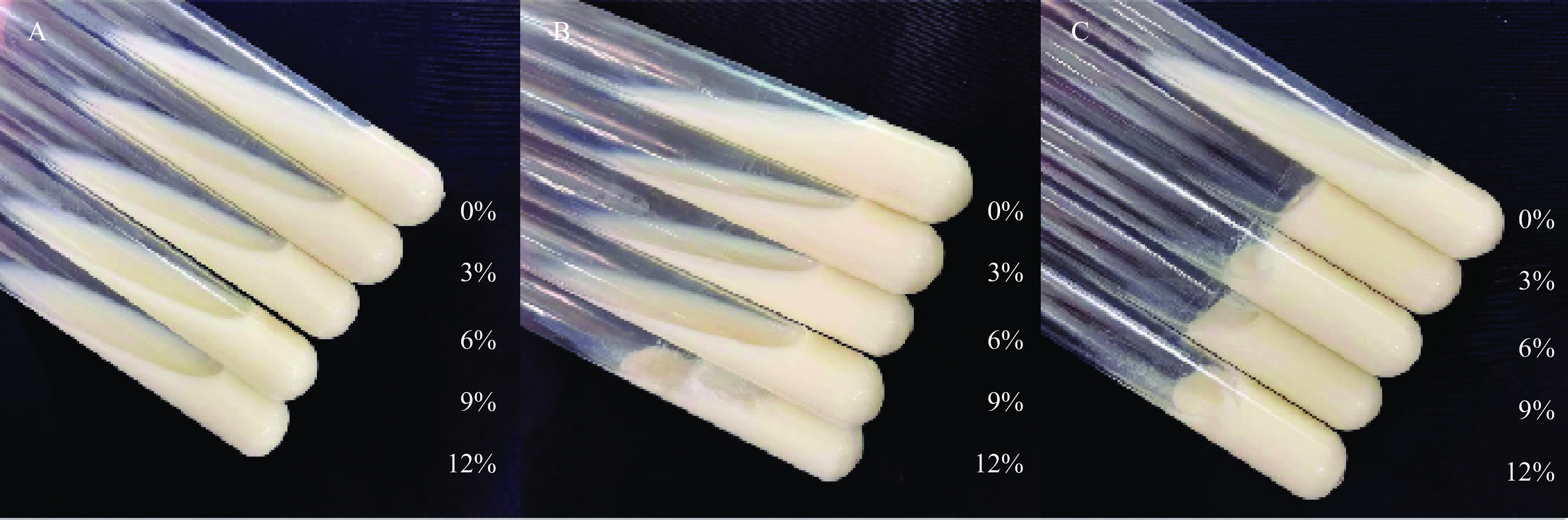
Ln. mesenteroides HDE1对脱脂牛奶的凝结效果如图10所示。与无蔗糖的脱脂牛奶相比,蔗糖的存在使得脱脂牛奶均呈现出一定程度的凝固效果,并且随着蔗糖浓度和培养时间的增加,凝结效果越强。当蔗糖的浓度为12%,并且培养至36 h时,凝结效果最强,这证明蔗糖诱导菌株产胞外多糖,且胞外多糖的产量随蔗糖浓度和时间的升高而增加。与Zhao等[33]曾报道过的融合魏斯氏菌(Weissella. confusa)XG-3相比,蔗糖浓度同为3%时HDE1使牛奶凝结的时间远远低于W. confuse XG-3,36 h HDE1即可使脱脂牛奶完全凝结,而W. confuse XG-3则需要48 h。研究结果表明HDE1利用蔗糖作为底物产胞外多糖的能力高于W. confuse XG-3。上述结果证明Ln. mesenteroides HDE1在发酵乳制品方面具有很好的应用潜力。
3. 结论
本研究从自制水果发酵液中分离得到一株产胞外多糖的乳酸菌HDE1,其胞外多糖的总糖、蛋白质、糖醛酸含量分别为41.73%±1.74%、0.29%±0.03%和7.69%±0.42%。经形态特征、16S rDNA及API 50 CHL试验,鉴定为Ln. mesenteroides。HDE1胞外多糖具有较高的抗氧化活性,在0~5 mg/mL范围内随着胞外多糖浓度的增加,抗氧化活性增强。牛奶凝结研究结果表明,HDE1在36 h能够使添加3%(w/v)蔗糖的脱脂牛奶完全凝结,展示出作为天然食品添加剂或抗氧化剂应用和开发前景。此外,虽然胞外多糖在抗氧化方面发挥着重要作用,但具体的机制尚不明确,应进一步研究抗氧化作用机制,还应利用临床医学领域的相关知识和设备进一步研究验证其抗氧化作用。
-
表 1 16S rDNA PCR扩增体系
Table 1 16S rDNA PCR amplification system
PCR反应体系组分 体积(μL) 2×Taq PCR Master Mix 5 基因组DNA 2 上游引物10 µmol/L 1 下游引物10 µmol/L 1 dd H2O 1 表 2 16S rDNA PCR扩增程序
Table 2 16S rDNA PCR amplification procedure
步骤 温度(℃) 时间 循环数 预变性 95 5 min 1 变性 95 30 s 1 退火 55 30 s 30 延伸 72 90 s 1 表 3 菌株HDE1的API 50 CHL鉴定结果
Table 3 Identification results based on API 50 CHL test of strain HDE1
编号 碳水化合物 结果 编号 碳水化合物 结果 0 对照 − 25 七叶灵 + 1 甘露醇 − 26 水杨苷 + 2 赤藻糖醇 − 27 D-纤维二糖 + 3 D-阿拉伯糖 − 28 D-麦芽糖 + 4 L-阿拉伯糖 + 29 D-乳糖 − 5 D-核糖 + 30 D-密二糖 + 6 D-木糖 + 31 D-蔗糖 + 7 L-木糖 − 32 D-海藻糖 + 8 D-侧金盏花醇 − 33 菊粉 − 9 甲基-β-D-吡喃木糖苷 − 34 D-松三糖 − 10 D-半乳糖 + 35 D-棉子糖 + 11 D-葡萄糖 + 36 淀粉 − 12 D-果糖 + 37 糖原 − 13 D-甘露醇 + 38 木糖醇 − 14 L-山梨糖 − 39 D-龙胆二糖 + 15 L-鼠李糖 − 40 D-土伦糖 + 16 卫芽醇 − 41 D-来苏糖 − 17 肌醇 − 42 D-塔格糖 − 18 甘露醇 − 43 D-岩藻糖 − 19 山梨醇 − 44 L-岩藻糖 − 20 α-甲基-D-吡喃甘露糖苷 − 45 D-阿拉伯醇 − 21 α-甲基-D-吡喃葡萄糖苷 + 46 L-阿拉伯醇 − 22 N-乙酰葡-萄糖胺 + 47 葡萄糖酸钾 − 23 苦杏仁苷 + 48 2-酮基葡萄糖酸钾 − 24 熊果苷 + 49 5-酮基葡萄糖酸钾 − 注:“+”代表阳性反应;“−”代表阴性反应。 -
[1] WANG Y, WU J, LV M, et al. Metabolism characteristics of lactic acid bacteria and the expanding applications in food industry[J]. Frontiers in Bioengineering and Biotechnology,2021,12(9):1−19.
[2] KORCZ E, VARGA L. Exopolysaccharides from lactic acid bacteria: Techno-functional application in the food industry[J]. Trends in Food Science & Technology,2021,110(2):375−384.
[3] TAN K, CHAMUNDESWARI V N, LOO S C J. Prospects of kefiran as a food-derived biopolymer for agri-food and biomedical applications[J]. RSC Advances,2020,42(10):25339−25351.
[4] KAVITAKE D, DEVI P B, SHETTY P H. Overview of exopolysaccharides produced by Weissella genus-a review[J]. International Journal of Biological Macromolecules,2020,164(12):2964−2973.
[5] 李静, 王瑶, 邓毛程. 泡菜中优良乳酸菌筛选及特性的研究[J]. 食品工业科技,2016,37(6):229−232. [LI Jing, WANG Yao, DENG Maocheng. Screening and characterization of an excellent Lactobacillus isolated from pickle[J]. Science and Technology of Food Industry,2016,37(6):229−232. doi: 10.13386/j.issn1002-0306.2016.06.039 [6] 刘珊娜, 王聪, 魏金艳, 等. 酸菜汁中乳酸菌的筛选和产酸性能的优化[J]. 食品工业科技,2018,39(3):112−116. [LIU Shanna, WANG Cong, WEI Jinyan, et al. Screening and acid production optimization of lactic acid bacteria from sauerkraut juice[J]. Science and Technology of Food Industry,2018,39(3):112−116. doi: 10.13386/j.issn1002-0306.2018.03.023 [7] 杨郁, 罗伊丝, 刘小涛, 等. 腌制雪菜中适用发酵乳生产的耐酸性乳酸菌的筛选[J]. 食品与发酵科技,2016,52(3):5−10. [YANG Yu, LUO Yisi, LIU Xiaotao, et al. Screening of acid resisting Lactobacillus filling for fermented milk production from pickled potherb mustard[J]. Food and Fermentation Technology,2016,52(3):5−10. [8] 姜静, 杜仁鹏, 郭尚旭, 等. 融合魏斯氏菌胞外多糖的分离纯化及其生化特性[J]. 食品科学,2020,41(1):9−15. [JIANG Jing, DU Renpeng, GUO Shangxu, et al. Separation, purification and biochemical properties of exopolysaccharides from Weissella confusa[J]. Food Science,2020,41(1):9−15. doi: 10.7506/spkx1002-6630-20190623-270 [9] GUERIN M, SILVA C R D, GARCIA C, et al. Lactic acid bacterial production of exopolysaccharides from fruit and vegetables and associated benefits[J]. Fermentation Basel,2020,115(6):2−21.
[10] 崔亮, 岳媛媛, 乌日娜. 明串珠菌应用研究进展[J]. 乳业科学与技术,2018,28(5):28−34. [CUI Liang, YUE Yuanyuan, WU Rina. Recent progress in the application of Leuconostoc[J]. Journal of Dairy Science and Technology,2018,28(5):28−34. doi: 10.15922/j.cnki.jdst.2018.05.007 [11] 张钊瑞, 张晨, 李大鹏. 微生物多糖的结构与应用研究进展[J]. 食品研究与开发,2021,42(1):181−192. [ZHANG Zhaorui, ZHANG Chen, LI Dapeng. Advances in structure and spplication of microbial polysaccharides[J]. Food Research and Development,2021,42(1):181−192. doi: 10.12161/j.issn.1005-6521.2021.01.031 [12] DU R P, XING H W, YANG Y P, et al. Optimization, purification and structural characterization of a dextran produced by L. mesenteroides isolated from Chinese sauerkraut[J]. Carbohydrate Polymers,2017,174(5):409−416.
[13] ZENG C, YE G, LI G, et al. RID serve as a more appropriate measure than phenol sulfuric acid method for natural water-soluble polysaccharides quantification[J]. Carbohydrate Polymers,2022,278(2):1−12.
[14] BITTER T, MUIR H M. A modified uronic acid carbazole reaction[J]. Analytical Biochemistry,1962,12(4):330−334.
[15] SHEN S, CHEN D, LI X, et al. Optimization of extraction process and antioxidant activity of polysaccharides from leaves of Paris polyphylla[J]. Carbohydrate Polymers,2014,104(5):80−86.
[16] PETER C, WOOTTON B, AISLING M, et al. Stability of the total antioxidant capacity and total polyphenol content of 23 commercially available vegetable juices before and after in vitro digestion measured by FRAP, DPPH, ABTS and Folin-Ciocalteu methods[J]. Food Research International,2011,44(1):217−224. doi: 10.1016/j.foodres.2010.10.033
[17] RUCH R J, CHENG S J, KLAUNIG J E. Prevention of cytotoxicity and inhibition of intercellular communication by antioxidant catechins isolated from Chinese green tea[J]. Carcinogenesis,1989,10(6):1003−1008. doi: 10.1093/carcin/10.6.1003
[18] LIU Y, DU Y Q, WANG J H, et al. Structural analysis and antioxidant activities of polysaccharide isolated from Jinqian mushroom[J]. International Journal of Biological Macromolecules,2014,64(4):63−68.
[19] CHEN Y X, LIU X Y, XIAO Z, et al. Antioxidant activities of polysaccharides obtained from Chlorella pyrenoidosa via different ethanol concentrations[J]. International Journal of Biological Macromolecules,2016,91(5):505−509.
[20] 李彬, 陈向楠, 张建法, 等. 产胞外多糖菌株的筛选及胞外多糖结构分析[J]. 生物技术通报,2016,32(5):165−171. [LI Bin, CHEN Xiangnan, ZHANG Jianfa, et al. Screening of exopolysaccharide-producing strains and structural analysis of the exopolysaccharides[J]. Biotechnology Bulletin,2016,32(5):165−171. doi: 10.13560/j.cnki.biotech.bull.1985.2016.05.022 [21] KANAMARLAPUDI S L R K, MUDDADA S. Characterization of exopolysaccharide produced by Streptococcus thermophilus CC30[J]. BioMed Research International,2017,2017(11):1−11.
[22] 韩瑨, 吴正钧, 季红, 等. 肠膜明串株菌Leuco 4的筛选、鉴定及产糖条件的优化[J]. 食品研究与开发,2014,35(19):106−111. [HAN Jin, WU Zhengyun, JI Hong, et al. Screening, identification and polysaccharide biosynthesis condition optimization of Leuconostoc mesenteroides Leuco 4[J]. Food Research and Development,2014,35(19):106−111. doi: 10.3969/j.issn.1005-6521.2014.19.030 [23] 王利, 温建康. 嗜酸氧化亚铁硫杆菌胞外聚合物浸矿作用研究[J]. 金属矿山,2011,421(7):86−97. [WANG Li, WEN Jiankang. Research on the leaching effect of extracellular polymers of Acidithiobacillus ferrooxidans[J]. Metal Mine,2011,421(7):86−97. [24] 胡风庆, 万姝含, 刘诗宇, 等. 鼠李糖乳杆菌胞外多糖提取与硒纳米粒制备[J]. 辽宁大学学报,2019,46(3):193−201. [HU Fengqing, WAN Shuhan, LIU Shiyu, et al. Extraction of Lactobacillus rhamnosus exopolysaccharide and preparation of selenium nanoparticles[J]. Journal of Liaoning University,2019,46(3):193−201. [25] 叶广彬, 陈源红, 王长丽, 等. 假肠膜明串珠菌胞外多糖的分离纯化及其抗氧化特性研究[J]. 食品研究与开发,2019,40(3):31−37. [YE Guangbin, CHEN Yuanhong, WANG Chanli, et al. Separation, purification and antioxidant activity of exopolysaccharide from Leuconostoc pseudomesenteroides[J]. Food Research and Development,2019,40(3):31−37. doi: 10.3969/j.issn.1005-6521.2019.03.006 [26] 董乐, 何静艳, 郑婷婷, 等. 抗氧化紫球藻胞外多糖酶解物制备工艺优化[J]. 食品与机械,2018,34(5):177−182. [DONG Le, HE Jingyan, ZHENG Tingting, et al. Optimization on the enzymatic preparation of extracellular polysaccharide from Porphyridium creuntum with antioxidant activities in vitro[J]. Food & Machinery,2018,34(5):177−182. doi: 10.13652/j.issn.1003-5788.2018.05.037 [27] 蔡淼, 陈超, 曹永强. 甲基营养型芽孢杆菌产胞外多糖发酵条件及生物活性研究[J]. 食品科学技术学报,2020,38(2):48−58. [CAI Miao, CHEN Chao, CAO Yongqiang. Research on fermentation conditions and bioactivity of exopolysaccharide produced by Bacillus methylotrophicus[J]. Journal of Food Science and Technology,2020,38(2):48−58. doi: 10.3969/j.issn.2095-6002.2020.02.007 [28] HUANG S Q, DING S D, FAN L P. Antioxidant activities of five polysaccharides from Inonotus obliquus[J]. International Journal of Biological Macromolecules,2012,50(5):1183−1187. doi: 10.1016/j.ijbiomac.2012.03.019
[29] 戚跃明, 陈涛. 紫芝胞外多糖分离纯化及抗氧化性的研究[J]. 食品工业科技,2013,34(4):105−113. [QI Yueming, CHEN Tao. Purification and antioxidant activity in vitro of exopolysaccharides from fermentation liquid of Ganoderma sinense[J]. Science and Technology of Food Industry,2013,34(4):105−113. doi: 10.13386/j.issn1002-0306.2013.04.004 [30] YE G, CHEN Y, WANG C, et al. Purification and characterization of exopolysaccharide produced by Weissella cibaria YB-1 from pickle Chinese cabbage[J]. International Journal of Biological Macromolecules,2018,120(12):1315−1321.
[31] 崔静, 李成, 孙晓萌, 等. 海参肠道酵母菌产胞外多糖的抗氧化性[J]. 大连工业大学学报,2016,35(2):84−87. [CUI Jing, LI Cheng, SUN Xiaomeng, et al. The antioxidant effects of extracellular polysaccharide of yeasts from sea cucumber intestine[J]. Journal of Dalian Polytechnic University,2016,35(2):84−87. doi: 10.19670/j.cnki.dlgydxxb.2016.02.002 [32] 张玉龙, 胡萍幸, 王金龙, 等. 产胞外多糖乳酸菌的筛选及抗氧化特性研究[J]. 中国酿造,2015,34(10):37−42. [ZHANG Yulong, HU Pingxing, WANG Jinlong, et al. Solation of exopolysaccharides-producing lactic acid bacteria and its antioxidant properties[J]. China Brewing,2015,34(10):37−42. doi: 10.11882/j.issn.0254-5071.2015.10.009 [33] ZHAO D, LIU L, JIANG J, et al. The response surface optimization of exopolysaccharide produced by Weissella confusa XG-3 and its rheological property[J]. Preparative Biochemistry & Biotechnology,2020,50(10):1014−1022.
-
期刊类型引用(9)
1. 尉洁,张玲芳,胡顺安,秦孟春,马琳,李丹,段翠翠. 长白山区发酵酱菜中高产胞外多糖乳酸菌的筛选及多糖抗氧化性分析. 食品工业科技. 2024(02): 110-117 .  本站查看
本站查看
2. 石贺,于连升,齐心彤,钱志刚,阚连宝,杜仁鹏. 乳酸菌葡聚糖蔗糖酶的研究进展. 食品工业科技. 2024(04): 354-361 .  本站查看
本站查看
3. 马博文,张博源,黄亮,周佳,赵帅,黄峰,屈建航. 副球菌TH21-44胞外多糖的结构表征及其抗氧化活性探究. 中国食品添加剂. 2024(06): 1-7 .  百度学术
百度学术
4. 张菡,陈海军,龙晓宇,赵抒娜,魏学军,魏国坤,申光辉. 1株甜菜糖蜜源高产胞外多糖明串珠菌的分离鉴定、发酵工艺优化及抗氧化活性研究. 轻工学报. 2024(03): 9-20 .  百度学术
百度学术
5. 李宁,赵圣国,郑楠,张养东. 热处理对生乳中益生微生物的影响研究进展. 现代食品科技. 2024(08): 367-373 .  百度学术
百度学术
6. 蒋同,李龙岩,张菊梅,谢新强,吴清平. 功能益生菌对代谢综合征的治疗作用及其机制研究进展. 食品科学. 2023(11): 233-243 .  百度学术
百度学术
7. 李春雨,屈建航,周佳. 微生物胞外多糖结构与活性研究进展. 食品研究与开发. 2023(18): 198-204 .  百度学术
百度学术
8. 李春雨,屈建航,周佳,赵帅,罗宇. Rufibacter hautae NBS58-1胞外多糖的抗氧化活性及其在草莓保鲜中的应用. 河南工业大学学报(自然科学版). 2023(05): 93-99 .  百度学术
百度学术
9. 左凯悦,孙晓灵,王风懿,吴宝美,刘维仲,王斌斌. 高产胞外多糖乳酸菌菌株的筛选及鉴定. 食品科技. 2023(10): 1-9 .  百度学术
百度学术
其他类型引用(3)





 下载:
下载:







 下载:
下载:



