Antimicrobial Activity and Identification of Antimicrobial Substances of Antagonistic Bacteria against Black Spot of Sweet Potato
-
摘要: 甘薯采后由病原菌引起的腐烂损失严重,其中由长喙壳菌(Ceratocystis fimbriata)侵染所导致的黑斑病是甘薯采后主要病害之一。本研究对前期筛选到的对长喙壳菌有较强拮抗作用的菌株解淀粉芽孢杆菌(Bacillus amyloliquefaciens)JK和克雷伯氏杆菌(Klebsiella pneumoniae)GK进行抑菌性能分析,同时采用气相色谱-离子迁移谱(GC-IMS)和气相色谱-质谱联用(GC-MS)技术对两株拮抗菌的体外挥发性抑菌成分进行了分析。结果表明:用两株拮抗菌JK和GK的菌液熏蒸甘薯果实,延缓了黑斑病发病时间,显著(P<0.05)抑制了病斑的扩展。两株菌所产的挥发性气体成分主要有酮类、烷类、醇类、酯类、醛类等,其中异辛醇(1-Hexanol, 2-ethyl-)、己醛(Hexanal)、2-壬酮(2-Nonanone)和2,2,4-三甲基-1,3-戊二醇二异丁酸酯(2,2,4-Trimethyl-1,3-pentanediol diisobutyrate)对甘薯长喙壳菌具有较强的抑制作用。选择两种安全气体成分己醛和2-壬酮按照1:1比例混合,在200 µL/L时可以完全抑制长喙壳菌的生长。该研究为拮抗微生物在果蔬采后的应用提供了参考和依据。Abstract: The losses of harvested sweet potato is large due to postharvest disease, among which black spot, caused by Ceratocystis fimbriata is one of the most important. In this study, the antimicrobial activities of Bacillus amyloliquefaciens (JK) and Klebsiella pneumoniae (GK) screened in the previous research with strong antagonistic effect on C. fimbriata were analyzed. The volatile antifungal components of the two antagonistic bacteria were analyzed by gas chromatography-ion mobility spectrometry (GC-IMS) and gas chromatography-mass spectrometry (GC-MS). It was found that fumigation sweet potato with fermentation of the two antagonistic bacteria delayed the onset time of black spot and effectively controlled the development of the disease spot. The volatile components were ketones, alkanes, alcohols, esters, aldehydes and so on. In all of them, 1-hexanol, 2-ethyl-, hexanal, 2-nonanone and 2,2,4-trimethyl-1,3-pentanediol diisobutyrate had strong inhibitory effects on C. fimbriata by plate test. After the two safety gas components hexanal and 2-nonone were mixed in the ratio of 1:1, the growth of C. fimbriata could be completely inhibited when the concentration of the mixtures reached 200 µL/L. This study would provide a reference for the application of antagonistic microorganisms in postharvest fruits and vegetables.
-
甘薯中含有丰富的营养物质,包括多种必需氨基酸、维生素、膳食纤维等营养和功能成分[1-3]。但是,甘薯在采后贮藏过程中容易受病原微生物侵染造成腐烂损失,其中,由长喙壳菌(Ceratocystis fimbriata)侵染引起的甘薯黑斑病是主要的病害之一,长喙壳菌有很强的寄生能力,主要通过伤口侵染甘薯[4],造成严重的经济损失[5-6]。另外,由于甘薯喜温,低温贮藏会使甘薯发生冷害[7-8],需要在12 ℃以上进行甘薯贮藏,但是此温度下长喙壳菌仍然可以生长繁殖,因此,目前产业上多依赖化学杀菌剂如多菌灵等抑制黑斑病发生。但是,化学杀菌剂的长期使用会导致病原菌产生抗药性,容易造成环境污染和农药残留等诸多问题[9-10]。生物防治凭借无毒无害、无污染且无抗药性等优点,被认为是有望降低化学杀菌剂使用量或替代化学杀菌剂的有效方法[11-12]。
拮抗微生物的挥发性代谢产物对于果蔬采后病害控制有重要作用。绿叶假单胞菌(Pseudomonas adaceae)释放的挥发性物质中含有的3-甲基-1-丁醇、苯乙醇和2-甲基-1-丁醇能有效抑制甘薯黑斑病的菌丝生长和孢子萌发[13]。萎缩芽孢杆菌(Bacillus atrophaeus)HAB-5产生的烷烃、醇、酸等挥发性物质,对炭疽菌有较高的抑制活性[14]。枯草芽孢杆菌(B. subtilis)CF-3的挥发性代谢产物不仅能抑制褐腐菌的生长,而且还激活了桃果实的抗病相关酶,诱导果实提高抗病性[15]。因此,利用拮抗微生物产生的挥发性代谢产物来抑制采后病害,成为采后病害生物防治领域的热点。
本研究对前期从甘薯表面和甘薯种植的土壤中分离到两株对甘薯黑斑病有较强抑制作用的菌株解淀粉芽孢杆菌JK和克雷伯氏杆菌GK进行抑菌性能分析[16]。通过熏蒸方法探究挥发性代谢产物对甘薯的抑菌效果,通过气相色谱-离子迁移谱(Gas chromatograph-ion mobility spectrometry,GC-IMS)和气相色谱-质谱联用(Gas chromatography-mass spectrometry,GC-MS)技术对分离得到的两株拮抗菌的挥发性代谢产物组分进行分析鉴定,同时在平板上筛选出对黑斑病抑制作用较强的成分,旨在为甘薯黑斑病的防治提供新的拮抗菌株资源,为开发新型、安全的防腐保鲜剂提供理论依据。
1. 材料与方法
1.1 材料与仪器
解淀粉芽孢杆菌(Bacillus amyloliquefaciens)JK、克雷伯氏杆菌(Klebsiella pneumoniae)GK、长喙壳菌(Ceratocystis fimbriata) 均由山东农业大学食品科学与工程学院果蔬采后贮藏保鲜实验室分离、鉴定和保存;马铃薯葡萄糖琼脂培养基(PDA)、牛肉膏蛋白胨固体培养基(NA)、牛肉膏蛋白胨液体培养基(NB),制备方法参照Liu等[17];己醛(Hexanal)、2-己酮(2-Hexanone)、乙酸丙酯(Propyl acetate)、2-壬酮(2-Nonanone)、异辛醇(1-Hexanol, 2-ethyl-)、甲基壬基甲酮(2-Undecanone)、2,2,4-三甲基-1,3-戊二醇二异丁酸酯(2,2,4-Trimethyl-1,3-pentanediol diisobutyrate)浓度分别为97%、99.5%、99%、99%、99%、99%、98.5% 购于北京优尼康生物科技有限公司和上海麦克林生化科技有限公司;甘薯品种为苏薯8号 采购于山东省泰安市岱岳区,挑选成熟度一致、大小均匀、果色良好、没有病虫害且无机械伤的新薯进行下一步实验。
SJ-CJ-1D超净工作台 苏州苏洁净化设备有限公司;ZQTY-70F恒温振荡培养箱 上海知楚仪器有限公司;AL204电子天平 上海梅特勒-托利多仪器有限公司;EPED-E2-20TF实验室级超纯水器 南京易普易达科技发展有限公司;YXQ-LS-50S立式压力蒸汽灭菌器 上海博迅实业有限公司;8200气相色谱-离子迁移谱(GC-IMS) 德国GAS公司;7010 气相色谱-质谱联用仪(GC-MS) Agilent Technologies Inc。
1.2 实验方法
1.2.1 拮抗菌菌液熏蒸对甘薯黑斑病病斑扩展抑制率的测定
将在NA平板上生长良好的两株拮抗菌JK、GK分别接种到1000 mL NB培养基中,在28 ℃ 180 r/min下培养48 h后,分别将1000 mL菌液倒入容积为20 L的密封罐的隔板下层,对照为相同体积的无菌水,隔板上层放置10个甘薯,用凡士林密封罐盖,熏蒸1 h。在熏蒸后的甘薯果实上用打孔器打直径为1 cm,高度为1 cm的圆孔,每个甘薯的同一面每间隔7~8 cm打一个孔,每个甘薯打三个圆孔,去除圆孔中的甘薯表皮,分别立即接种5×105个孢子囊/mL的长喙壳菌孢子囊悬浮液20 µL[18],对照组接种同上。每个处理重复三次,每次重复处理10个甘薯,实验重复两次。于28±1 ℃ RH 90%条件下保湿贮藏,每5 d测量一次病斑,计算病斑扩展抑制率。
抑制率(%)=(对照病斑直径−处理病斑直径)/对照病斑直径×100
1.2.2 拮抗菌挥发性抑菌物质的测定
1.2.2.1 拮抗菌挥发性代谢产物GC-IMS测定
样品预处理:将JK和GK分别接种于100 mL NB液体培养基中,28 ℃ 180 r/min培养48 h后,分别吸取10 mL于20 mL顶空进样瓶中,对照为相同体积的NB培养基,每个处理重复两次,分别记作JK1、JK2,GK1、GK2,CK1、CK2。
GC-IMS条件:色谱柱型号FS-SE-54-CB-1(15 m×0.53 mm,1 μm),IMS温度45 ℃,色谱柱温度40 ℃,分析时间20 min,载气/漂移器N2,离子化模式为正离子模式,以β射线(氚,3H)进行放射处理。
自动顶空进样条件:进样体积为300 μL,孵育时间 10 min,孵育温度40 ℃,进样针温度45 ℃,孵化转速500 r/min。载气流速参照邵悦春等[19]设定,初始气相载气流速为2 mL/min,保持2 min后,在10 min内线性增至100 mL/min,在20 min内线性增至150 mL/min。漂移气流速为150 mL/min。
每组实验均重复两次,采用GC-IMS仪器配套的LAV(Laboratory Analytical Viewer)分析软件对拮抗菌的挥发性气味进行采集和分析,利用LAV中的Reporter插件对比样品之间的谱图差异,Gallery Plot插件构建指纹图谱,直观对比样品之间的谱图差异,采用Dynamic PCA插件对样品进行动态主成分分析。同时根据特征性物质保留时间和迁移时间计算每种挥发性物质的保留指数,通过GC-IMS Library Search中的NIST和IMS数据库对挥发性代谢成分进行定性分析。
1.2.2.2 拮抗菌挥发性代谢产物GC-MS测定
采用顶空固相微萃取-气相色谱-质谱法(HS-SPME-GC-MS)分离鉴定挥发性活性物质的组分,并对平板抑菌活性进行跟踪。将JK和GK分别接种于100 mL NB液体培养基中,28 ℃ 180 r/min培养48 h。将萃取头在250 ℃进样口老化30 min。50 ℃条件下预热10 min后,分别用65 µm PDMS/DVB和75 μm PDMS萃取纤维头对JK和GK挥发性物质进行顶空吸附,吸附时间30 min[20]。气相色谱色谱柱为Rtx-5MS 毛细管色谱柱(30.0 m×0.32 mm×0.25 µm),载气为He,采用程序升温的起始温度为60 ℃,维持 2 min,以5 ℃/min 的速率升温至180 ℃,再以2 ℃/min的速率升温至250 ℃,维持3 min,运行时间 64 min。质谱条件为:电子轰击离子源及四级杆质量检测器,离子源温度为230 ℃,接口温度为250 ℃,热解析1 min,质量扫描范围45~500 m/z [21-22] 。
每组实验均重复两次,色谱分离后,质谱扫描每个色谱峰得到质谱图,所得质谱信息经计算机用标准NIST08质谱图数据库确定香气物质组分种类。用色谱峰面积归一化法进一步确定各物质组分含量。
1.2.3 挥发性单物质的抑菌作用分析
为验证两株拮抗菌产生的主要挥发性物质对甘薯黑斑病病原菌的抑菌作用,通过分析两株拮抗菌共同产生的挥发性代谢产物的测定结果(GC-IMS、GC-MS)以及结合各成分安全性分析和在食品中应用现状,选择研究己醛(Hexanal)[23]、2-己酮(2-Hexanone)[24]、乙酸丙酯(Propyl acetate)[25]、2-壬酮(2-Nonanone)[26],同时在GC-MS测定结果中选择相对含量较高的物质,并根据各成分安全性、实际应用和购买情况,选择研究异辛醇(1-Hexanol, 2-ethyl-)[27]、甲基壬基甲酮(2-Undecanone)[28]、2,2,4-三甲基-1,3-戊二醇二异丁酸酯(2,2,4-Trimethyl-1,3-pentanediol diisobutyrate)[29],因此购买以上7种挥发性物质纯品分析其对病原菌的抑制情况,平板对扣法对挥发性物质进行抑菌效果的检测。在NA平板培养基中央放置直径为5 mm的无菌滤纸片,分别滴加20 μL的七种物质(对照不滴加试剂),迅速与放置有直径8 mm甘薯长喙壳菌菌饼的PDA平板培养基对扣,封口膜密封。每个处理重复三次。28 ℃下培养96 h,每天观察并测量病原菌的菌落直径,并计算抑菌率[30-31]。
抑菌率(%)=(对照菌落直径−处理菌落直径)/对照菌落直径×100
1.2.4 挥发性混合物质的抑菌作用分析
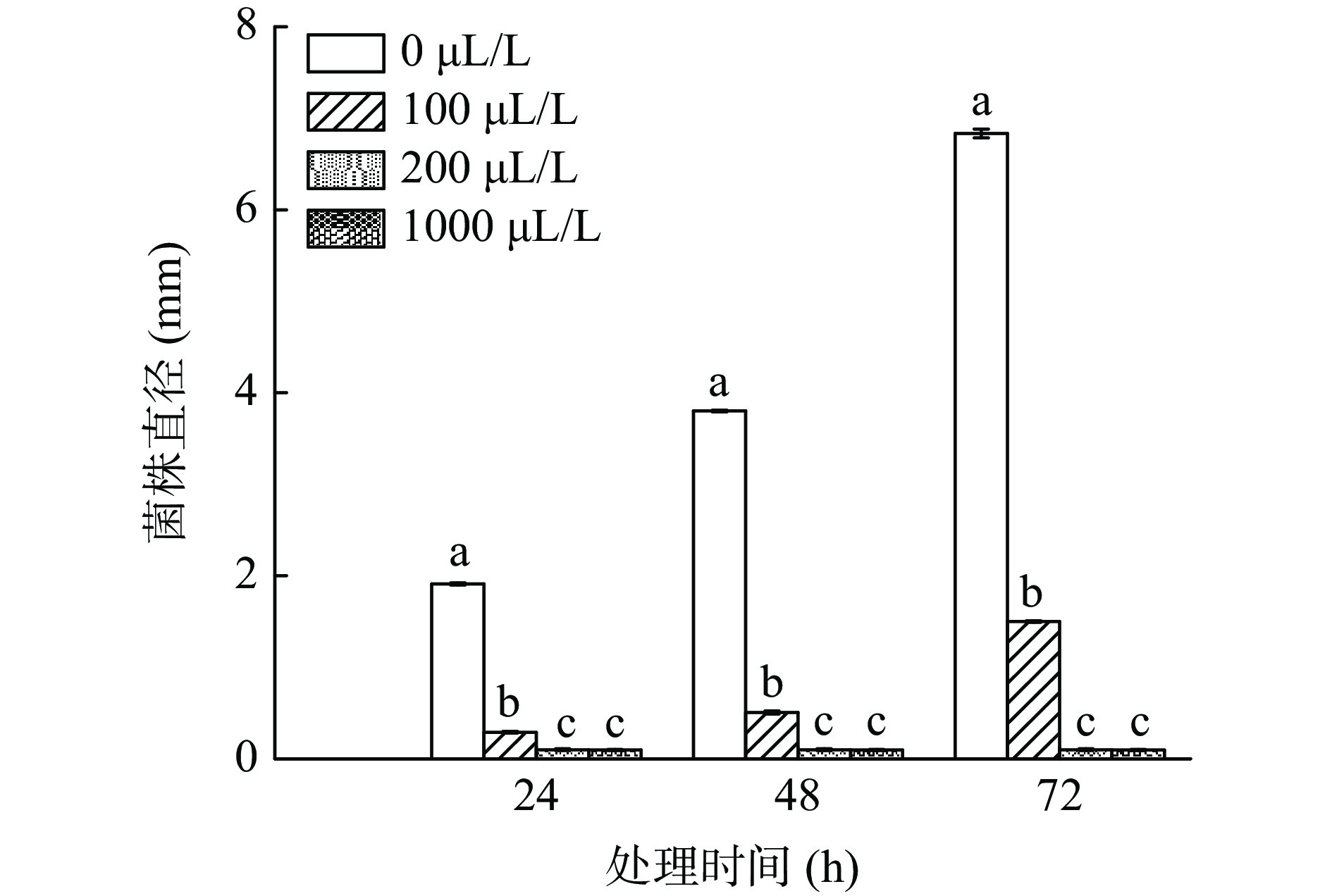
将对甘薯黑斑病病原菌有较强抑菌作用的挥发性物质己醛和2-壬酮按照1:1比例混合。在PDA平板培养基上放置直径为8 mm的甘薯长喙壳菌菌饼,在另一个NA平板培养基上放置直径5 mm的无菌滤纸片,分别滴加50 μL不同浓度的挥发性混合物质,浓度设定为0、100、200、1000 μL/L,将两平板对扣,封口膜密封,28 ℃下培养72 h,每天观察并测量病原菌的菌落直径,每个处理三个重复,试验重复两次。
1.3 数据处理
使用Microsoft Excel 2013整理试验数据,用SigmaPlot 13.0软件作图、计算均值及标准偏差。采用IBM SPSS Statistics 20.0软件进行数据统计分析,用Duncan's新复极差法进行显著性(P<0.05)水平检验。
2. 结果与分析
2.1 拮抗菌菌液熏蒸对甘薯黑斑病病斑扩展的影响
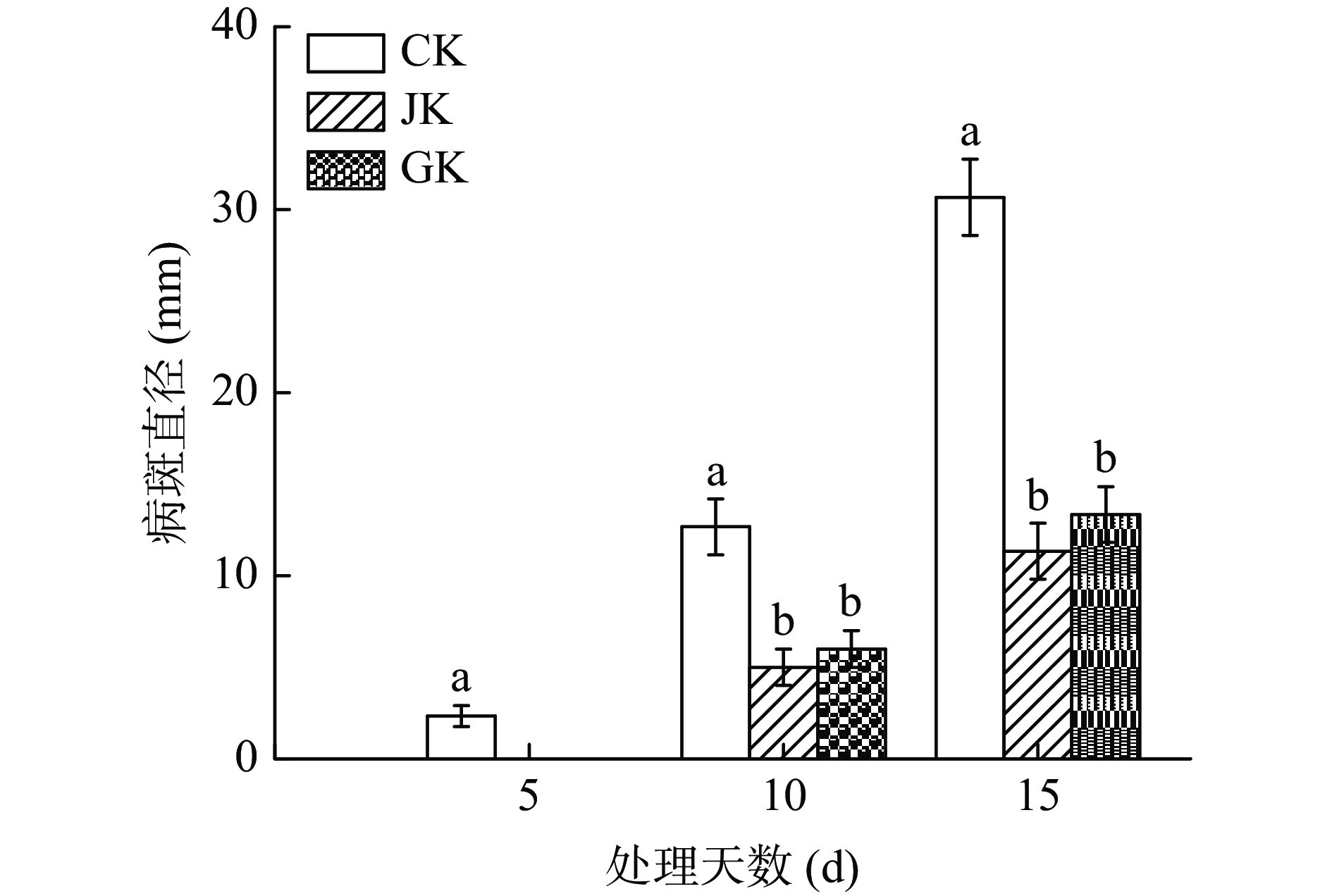
如图1所示,经菌株JK和GK发酵液熏蒸处理后甘薯黑斑病发病时间明显晚于对照,其中,拮抗菌JK发酵液熏蒸处理的薯块对病斑的扩展有较强的抑制作用,在处理薯块15 d后,病斑扩展的抑制率达61.29%;拮抗菌GK发酵液熏蒸薯块15 d后,病斑扩展的抑制达54.84%。表明两种拮抗菌菌液中含有抑制甘薯黑斑病的挥发性代谢成分,且显著(P<0.05)抑制病原菌的生长。同时大量研究也表明,细菌发酵过程中产生的挥发性成分对病原菌具有抑制作用[13-15]。如Xu等[32]研究表明用Bacillus tequilensis XK29的发酵液熏蒸甘薯后,对于甘薯黑斑病有明显的抑制作用,与本试验结果一致。
![]() 图 1 菌株JK及GK挥发性代谢产物对甘薯黑斑病病斑扩展的影响注:图中小写字母相同表示差异未达到显著水平(P>0.05),小写字母不同表示差异达到显著水平(P<0.05);图6同。Figure 1. Effects of volatile metabolites of strain JK and GK on disease development of black spot inoculated with C. fimbriata
图 1 菌株JK及GK挥发性代谢产物对甘薯黑斑病病斑扩展的影响注:图中小写字母相同表示差异未达到显著水平(P>0.05),小写字母不同表示差异达到显著水平(P<0.05);图6同。Figure 1. Effects of volatile metabolites of strain JK and GK on disease development of black spot inoculated with C. fimbriata2.2 拮抗菌挥发性抑菌物质的鉴定结果
2.2.1 GC-IMS测定的拮抗菌挥发性代谢产物
2.2.1.1 两种拮抗菌挥发性代谢产物差异变化
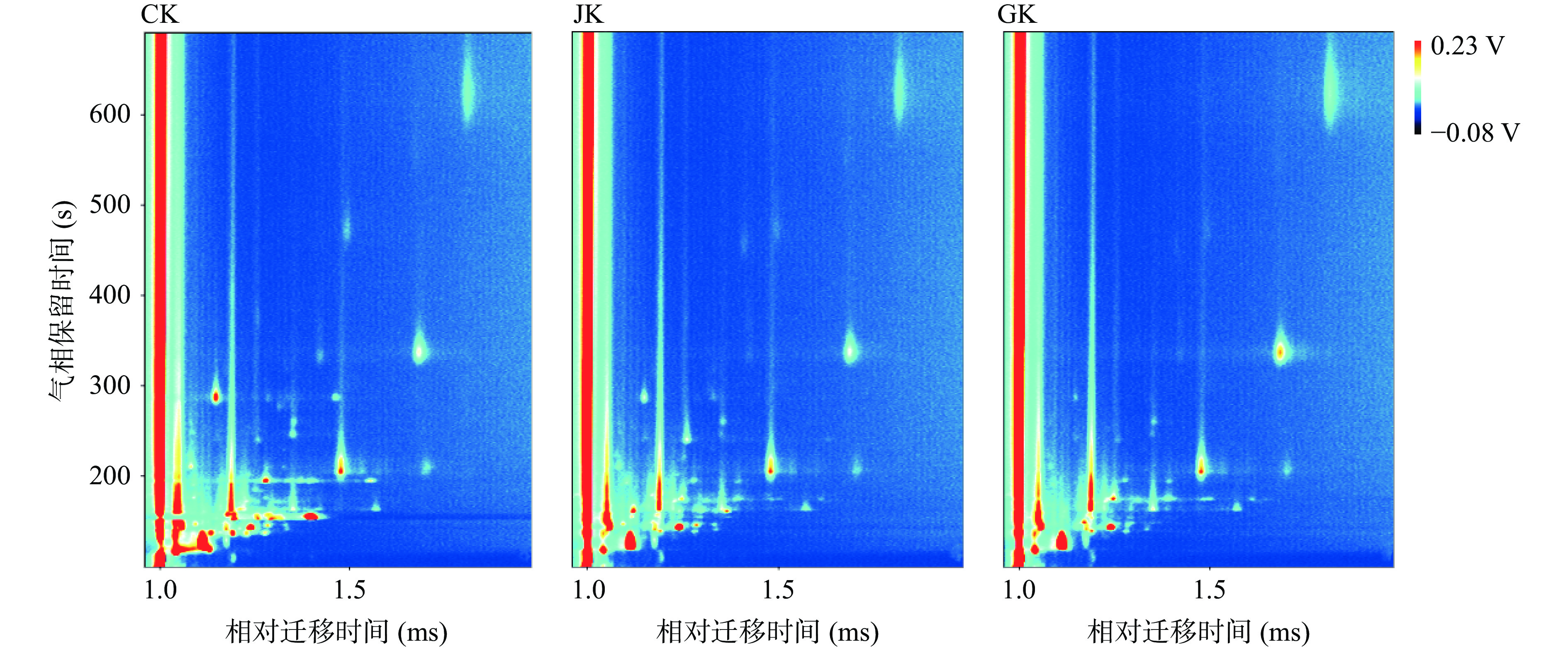
三组样品的GC-IMS谱图如图2所示,整个图背景为蓝色,横坐标1.0处红色竖线为RIP峰(反应离子峰,经归一化处理),RIP峰两侧的每一个点代表一种挥发性有机物。其中颜色代表物质的浓度,白色表示浓度较低,红色表示浓度较高,颜色越深表示浓度越大,点越大颜色越深表明峰信号越强。总体来说,两种拮抗菌的挥发性有机物的迁移时间大都集中在1.0~1.5 ms区间内,保留时间在100~300 s区间,两种样品的挥发性有机物在气相保留时间300 s内完成了GC-IMS分离。
为了进一步比较不同样品的差异,选取空白NB培养基CK对照为背景参照,其他样品的谱图扣减参比,若两种拮抗菌挥发性代谢产物一致,则扣减后的背景为白色;若浓度高于参比,则扣减后的背景为红色;若浓度低于参比,则扣减后的背景为蓝色。从图3可以看出以空白培养基作参比时,JK和GK谱图中的背景颜色为蓝色,表明挥发性有机物含量均比培养基中的挥发性有机物少,为更好比较挥发性有机物的变化情况,框选这些挥发性有机物的峰,形成样品指纹图谱进行对比。
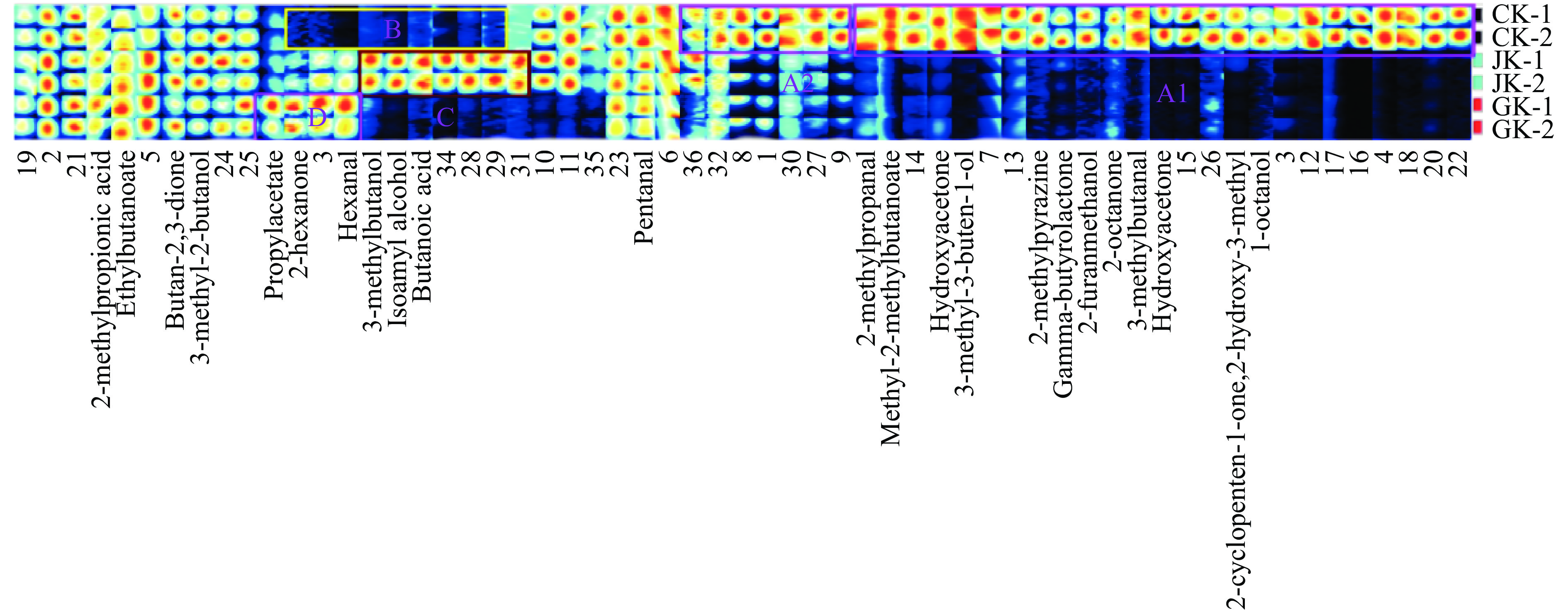
2.2.1.2 两种拮抗菌中挥发性有机物指纹图谱对比
由图4和表1所示,区域A1中标出的物质正辛醇(1-Octanol)、甲基环戊烯醇酮(2-Cyclopenten-1-one-2-hydroxy-3-methyl)、羟基丙酮(Hydroxyacetone)、3-甲基丁醛(3-Methylbutanal)、2-辛酮(2-Octanone)、糠醇(2-Furanmethanol)、4-羟基丁酸内酯(Gamma-butyrolactone)、2-甲基吡嗪(2-Methylpyrazine)、3-甲基-3-丁烯-1-醇(3-Methyl-3-buten-1-ol)、2-甲基丁酸甲酯(Methyl-2-methylbutanoate)、2-甲基丙醛(2-Methylpropanal)等物质仅在培养中存在,在两株拮抗菌中未发现,可作为培养基的特征标记物,原因可能是被拮抗菌作为营养物质在生长过程中被消耗,或者是拮抗菌生长抑制这些物质的挥发。区域A2中标出的1、8、9、27、32、36(未定性出)等物质在培养基中含量最高,在两株拮抗菌中含量较少。区域B标出的物质在培养基中未发现,在两株拮抗菌中存在,但含量不同。区域C中物质为JK的特征挥发性有机物,如丁酸(Butanoic acid)、异戊醇(Isoamyl alcohol)、3-甲基-1-丁醇(3-Methyl-1-butanol)等,在培养基和GK中均未发现。区域D中标出的物质如乙酸丙酯(Propyl acetate)、2-己酮(2-Hexanone)、己醛(Hexanal)在GK中含量高于对照和JK菌株。由于有些物质在GC-IMS数据库中未能定性,所以有必要结合GC-MS进行定性。
表 1 两种拮抗菌及NB培养基挥发性有机物定性分析Table 1. Qualitative analysis of volatile organic compounds in two antagonistic and Nutrient Broth样品 组分 CAS# 分子式 分子质量 相对保留指数 保留时间(s) 备注 NB培养基 羟基丙酮(Hydroxyacetone) 116-09-6 C3H6O2 74.1 639.3 136.624 单体 羟基丙酮(Hydroxyacetone) 116-09-6 C3H6O2 74.1 637.1 136.243 二聚体 2-甲基丁酸甲酯(Methyl-2-methylbutanoate) 868-57-5 C6H12O2 116.2 743.5 158.338 糠醇(2-Furanmethanol) 98-00-0 C5H6O2 98.1 865.7 195.698 4-羟基丁酸内酯(Gamma-butyrolactone) 96-48-0 C4H6O2 86.1 905.4 211.491 3-甲基丁醛(3-Methylbutanal) 590-86-3 C5H10O 86.1 653.2 139.1 2-甲基丙醛(2-Methylpropanal) 78-84-2 C4H8O 72.1 533.2 121.073 2-辛酮(2-Octanone) 111-13-7 C8H16O 128.2 980.7 247.997 正辛醇(1-Octanol) 111-87-5 C8H18O 130.2 1046.2 288.134 甲基环戊烯醇酮(2-Cyclopenten-1-one, 2-hydroxy-3-methyl-) 80-71-7 C6H8O2 112.1 1043.4 286.266 3-甲基-3-丁烯-1-醇(3-Methyl-3-buten-1-ol) 763-32-6 C5H10O 86.1 741.9 157.942 2-甲基吡嗪(2-Methylpyrazine) 109-08-0 C5H6N2 94.1 811.9 177.343 JK 异戊醇(3-Methyl-1-butanol) 123-51-3 C5H12O 88.1 737.0 156.761 戊醇(Isoamyl alcohol) 30899-19-5 C5H12O 88.1 761.5 162.944 丁酸(Butanoic acid) 107-92-6 C4H8O2 88.1 821.6 180.418 JK、GK 己醛(Hexanal) 66-25-1 C6H12O 100.2 805.8 175.474 乙酸丙酯(Propyl acetate) 109-60-4 C5H10O2 102.1 710,0 150.512 2-己酮(2-Hexanone) 591-78-6 C6H12O 100.2 805,7 175.444 NB培养基、JK、GK 戊醛(Pentanal) 110-62-3 C5H10O 86.1 680.2 144.238 双乙酰(Butan-2,3-dione) 431-03-8 C4H6O2 86.1 600.4 130.26 2-甲基丙酸(2-Methylpropionic acid) 79-31-2 C4H8O2 88.1 797.7 173.03 3-甲基-2-丁醇(3-Methyl-2-butanol) 598-75-4 C5H12O 88.1 680.7 144.355 丁酸乙酯(Ethyl butanoate) 105-54-4 C6H12O2 116.2 819.4 179.703 2.2.1.3 两种拮抗菌中挥发性有机物指纹图谱主成分分析
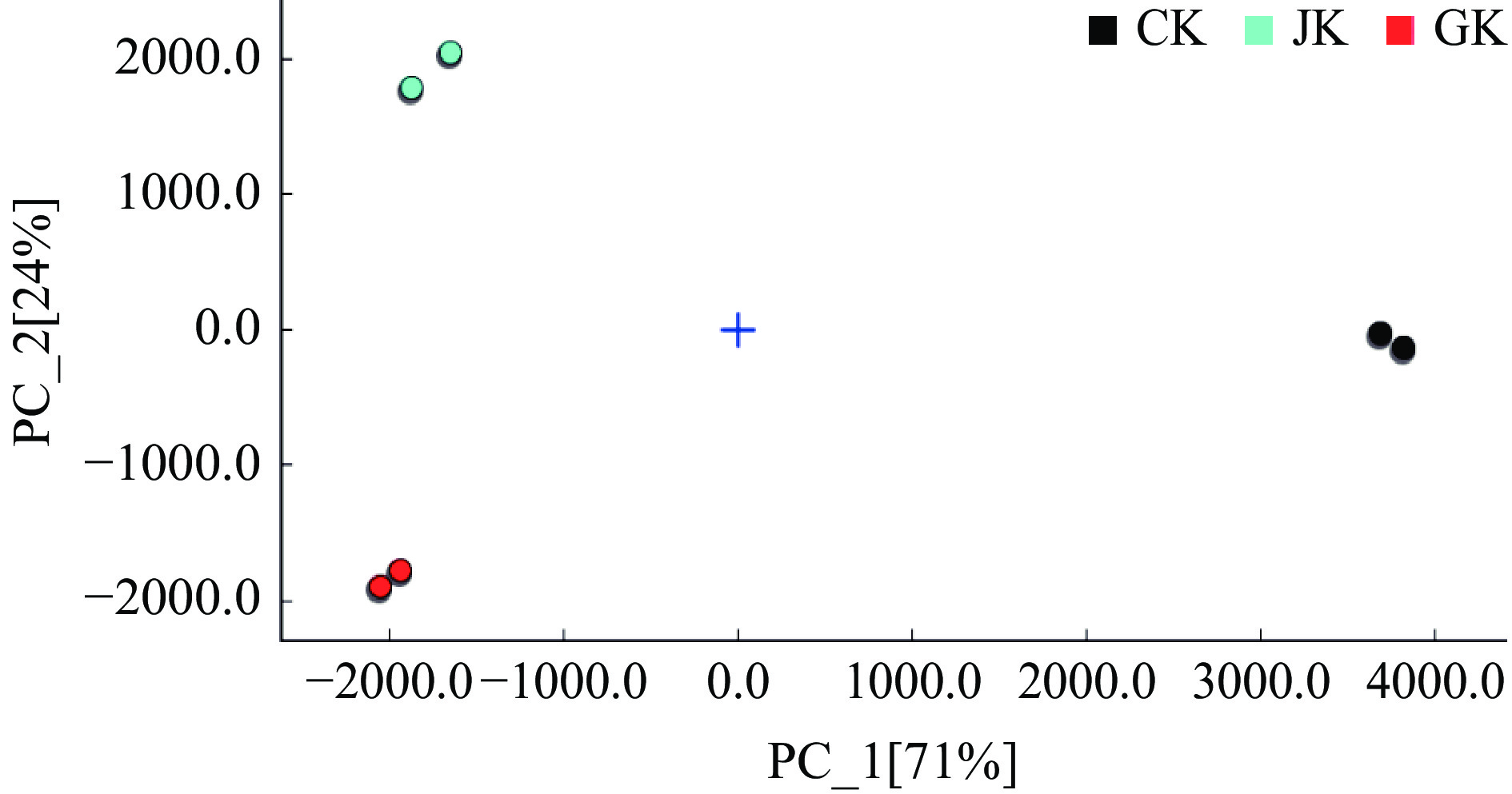
根据图4构建的两种拮抗菌挥发性产物指纹图谱,采用Dynamic PCA插件进行PCA处理,比较2种拮抗菌挥发性代谢产物的差异,如图5所示,培养基和两种拮抗菌分据PCA图的两侧,区分非常明显,两种拮抗菌差异区分亦非常明显,分据PCA两端。
2.2.2 GC-MS测定的拮抗菌挥发性代谢产物
如表2所示,在 GC-MS分析后,对测得的每种化合物依据NIST标准谱库对比及相对保留值进行定性,去除对照组中含有的物质后,JK和GK所产生的挥发性物质分别为17和9种(其中两种萃取头测定出的相同物质,以峰面积大的萃取头为准),属于酮类、烷类、醇类、酯类、醛类等物质,这与Rajaofera等[14]的报道一致,萎缩芽孢杆菌HAB-5发酵产生的挥发性有机化合物也主要包括烷烃、烯烃、醇类和有机酸。其中十四甲基六硅氧烷(Hexasiloxane, tetradecamethyl-)和2-壬酮(2-Nonanone)是菌株JK和GK挥发性代谢产物中共有的物质,峰面积分别为3.98%和1.22%。
表 2 菌株JK和GK挥发性代谢产物的主要成分及相对含量Table 2. Relative content of main volatile components of strain JK and GK组分 保留时间(min) 峰面积(%) CAS# JK GK 2-乙基-1-己醇(2-Ethyl-1-hexanol) 8.393 2.81 − 104-76-7 2-壬酮(2-Nonanone) 10.163 1.22 1.22 821-55-6 十二烷(Dodecane) 13.225 0.44 − 112-40-3 2-十一酮(2-Undecanone) 15.84 1.34 − 112-12-9 2-三癸醇(2-Tridecanol) 16.023 0.9 − 1653-31-2 2,6-二叔丁基-1,4-苯醌(2,5-Cyclohexadiene-1,4-dione, 2,6-bis(1,1-dimethylethyl)-) 20.432 0.44 − 719-22-2 Pentanoic acid, 2,2,4-trimethyl-3-carboxyisopropyl, isobutyl ester 23.572 2.85 − NA 2,6,10-三甲基十五烷(Pentadecane, 2,6,10-trimethyl-) 24.672 0.26 − 3892-00-0 2,6,10,14-四甲基十五烷(Pentadecane, 2,6,10,14-tetramethyl-) 25.948 0.43 − NA 4-十八烷基吗啉(Morpholine, 4-octadecyl-) 30.323 0.53 − NA 3,5-二异丙氧基-1,1,1,1,7,7,7-六甲基-3,5-双(三甲基甲硅烷氧基)四硅氧烷(3,5-(Diisopropoxy-
1,1,1,7,7,7-hexamethyl-3,5-bis (trimethylsiloxy) tetrasiloxane)18.929 3.82 − NA 3,7-Bis[(trimethylsilyl)oxy]-9-methoxy-1-methyl(6H)dibenzo[b,d]pyran-6-one 22.62 1.37 − NA 1,1,3,3,5,5,7,7,9,9,11,11,13,13,15,15-十六甲基八硅氧烷(Octasiloxane,
1,1,3,3,5,5,7,7,9,9,11,11,13,13,15,15-hexadecamethyl-)24.892 0.14 − NA Bis (pentamethylcyclotrisiloxy) hexamethyltrisiloxane 30.477 0.47 − NA 2,6-二(叔丁基)-4-(1-甲基丙基)酚(Phenol, 2,6-bis(1,1-dimethylethyl)-4-(1-methylpropyl-) 24.506 14.06 − 17540-75-9 正二十一烷(Heneicosane) 25.811 0.15 − 629-94-7 十四甲基六硅氧烷(Hexasiloxane, tetradecamethyl-) 30.629 3.98 3.98 107-52-8 Cyclononasiloxane, octadecamethyl- 28.993 − 1.83 556-71-8 2,2,4-三甲基-1,3-戊二醇二异丁酸(2,2,4-Trimethyl-1,3-pentanediol diisobutyrate) 23.513 − 0.49 6846-50-0 Methoxyacetic acid, 2-tridecyl ester 25.935 − 0.42 NA 2-壬酮(2-Nonanone) 10.163 − 1.22 821-55-6 Bis(heptamethylcyclotetrasiloxy)hexamethyltrisiloxane 26.317 − 0.8 71449-67-7 邻苯二甲酸二异丁酯(1,2-Benzenedicarboxylic acid, bis(2-methylpropyl) ester) 29.984 − 0.29 84-69-5 十四甲基六硅氧烷(Hexasiloxane, tetradecamethyl-) 30.622 − 1.98 107-52-8 1,1,1,5,7,7,7-Heptamethyl-3,3-bis(trimethylsiloxy)tetrasiloxane 31.491 − 0.55 38147-00-1 十六烷基七硅氧烷(Heptasiloxane, hexadecamethyl-) 35.594 − 1.2 541-01-5 2.3 挥发性单物质的抑菌作用
如表3所示,七种物质中异辛醇(1-Hexanol, 2-ethyl-)对病原菌的抑制率最高,能完全抑制病原菌的生长,己醛(Hexanal)、2-壬酮(2-Nonanone)和2,2,4-三甲基-1,3-戊二醇二异丁酸酯(2,2,4-Trimethyl-1,3-pentanediol diisobutyrate)的抑菌率分别为93.15%、81.19%和58.62%,对病原菌的抑制效果较好,但是2-己酮(2-Hexanone)、甲基壬基甲酮(2-Undecanone)和乙酸丙酯(Propyl acetate)抑菌作用较弱。
表 3 七种挥发性单物质对甘薯黑斑病病原菌的抑制作用Table 3. Antifungal activity of seven compounds against C. fimbriata组分 对照菌落直径(mm) 处理菌落直径(mm) 抑制率(%) 己醛(Hexanal) 66.46±0.25 4.55±0.15 93.15 2-己酮(2-Hexanone) 66.46±0.25 54.75±0.16 17.62 乙酸丙酯(Propyl acetate) 66.46±0.25 55.35±0.43 16.72 异辛醇(1-Hexanol, 2-ethyl-) 66.46±0.25 0 100 2-壬酮(2-Nonanone) 66.46±0.25 12.50±0.25 81.19 甲基壬基甲酮(2-Undecanone) 66.46±0.25 56.28±0.33 15.32 2,2,4-三甲基-1,3-戊二醇二异丁酸(2,2,4-Trimethyl-1,3-pentanediol diisobutyrate) 66.46±0.25 27.5±0.12 58.62 注:表中数据为均值±标准偏差。 2.4 挥发性混合物质的抑菌作用
异辛醇(1-Hexanol, 2-ethyl-)能完全抑制甘薯黑斑病病原菌的生长,其次是己醛(Hexanal)和2-壬酮(2-Nonanone)。考虑到己醛和2-壬酮的安全性高,常被用作食品添加剂,同时在果蔬病害的防治上已有明显的效果。此前有研究者发现用己醛熏蒸香蕉果实后,在800 ppm浓度下,香蕉果实的炭疽菌和焦腐病菌两种病原菌的菌丝生长被完全抑制[23]。同时Romina等[26]发现2-壬酮能明显抑制灰霉病菌的生长。因此结合安全性和实际应用效果选择将己醛和2-壬酮两者混合后探究其抑菌效果。如图6所示,当混合液浓度为100、200、1000 μL/L时对甘薯黑斑病病原菌的生长均有很强的抑制作用。在培养72 h后,100 μL/L的混合物浓度抑菌率达到70%,浓度为200 μL/L时,菌斑直径不再增加,病原菌停止生长。
3. 讨论与结论
与化学杀菌剂相比较,生物防治被认为是一种安全高效的防治手段。Bu等[33]发现枯草芽孢杆菌L1-21对番茄的灰霉病有明显的抑制作用。Mu等[34]的研究结果表明,从土壤中分离到的萎缩芽孢杆菌J-1可以有效控制苹果轮纹病。本研究从甘薯表面及甘薯地土壤中分离到两株对甘薯黑斑病有较强抑制作用的菌株解淀粉芽孢杆菌JK和克雷伯氏杆菌GK,可产生挥发性抑菌成分。
许多研究发现,芽孢杆菌在发酵过程中产生的挥发性代谢产物能够作用于果蔬,抑制病原菌的生长,延缓果蔬发病。Zhang等[35]发现枯草芽孢杆菌ZD01发酵产生的6-甲基-庚酮对马铃薯上的茄链格孢菌有明显抑制作用。Xu等[32]发现特基拉芽孢杆菌发酵能产生21中挥发性化合物,其中异戊酸、异丁酸和2-甲基丁酸能有效抑制甘薯长喙壳菌的生长。本研究分别用JK和GK发酵液熏蒸处理甘薯果实后,发现熏蒸后出现病斑的时间晚于对照,同时期内病斑直径显著小于对照,说明两株拮抗菌发酵其产生的挥发性代谢产物可有效的抑制黑斑病,延缓甘薯薯块发病。通过GC-IMS和GC-MS对菌株JK和GK的挥发性物质进行检测,发现挥发性物质主要有酮类、烷类、醇类、酯类、醛类等物质。经过平板抑菌实验发现己醛、2-壬酮、异辛醇和2,2,4-三甲基-1,3-戊二醇二异丁酸酯是抑制黑斑病的主要气体成分,己醛和2-壬酮对黑斑病的抑制率分别为93.15%和81.19%,将两者按照1:1的比例混合后,混合液浓度为100 μL/L时,对甘薯黑斑病病原菌菌丝生长的抑制率达到70%,浓度高于200 μL/L时,菌丝停止生长。
芽孢杆菌在发酵过程中除了可以产生具有抑菌作用的挥发性代谢产物之外,发酵液中的代谢产物对病原菌也有抑制作用。汪静杰等[36]研究发现筛选到的拮抗菌株解淀粉芽孢杆菌的发酵滤液中含有明显抑制球孢白僵菌的物质,经提取鉴定后,确定有效成分为芬枯草菌素和伊枯草菌素。Zhang等[37]发现从番茄根际中分离到的解淀粉芽孢杆菌对多种植物病原菌有广谱抑菌性,鉴定抑菌物质为伊枯草素和芬枯草菌素,说明发酵菌液中含有能抑制真菌生长的物质。因此在后续研究中可以对分离到的两株拮抗菌中的活性物质进行进一步研究。
本研究中的两株拮抗菌生长所需营养简单,繁殖速度快,产生的挥发代谢产物对于黑斑病有较强的抑制效果,在甘薯采后病害控制中有一定的应用前景,为减少化学杀菌剂的使用提供了新途径。
-
图 1 菌株JK及GK挥发性代谢产物对甘薯黑斑病病斑扩展的影响
注:图中小写字母相同表示差异未达到显著水平(P>0.05),小写字母不同表示差异达到显著水平(P<0.05);图6同。
Figure 1. Effects of volatile metabolites of strain JK and GK on disease development of black spot inoculated with C. fimbriata
表 1 两种拮抗菌及NB培养基挥发性有机物定性分析
Table 1 Qualitative analysis of volatile organic compounds in two antagonistic and Nutrient Broth
样品 组分 CAS# 分子式 分子质量 相对保留指数 保留时间(s) 备注 NB培养基 羟基丙酮(Hydroxyacetone) 116-09-6 C3H6O2 74.1 639.3 136.624 单体 羟基丙酮(Hydroxyacetone) 116-09-6 C3H6O2 74.1 637.1 136.243 二聚体 2-甲基丁酸甲酯(Methyl-2-methylbutanoate) 868-57-5 C6H12O2 116.2 743.5 158.338 糠醇(2-Furanmethanol) 98-00-0 C5H6O2 98.1 865.7 195.698 4-羟基丁酸内酯(Gamma-butyrolactone) 96-48-0 C4H6O2 86.1 905.4 211.491 3-甲基丁醛(3-Methylbutanal) 590-86-3 C5H10O 86.1 653.2 139.1 2-甲基丙醛(2-Methylpropanal) 78-84-2 C4H8O 72.1 533.2 121.073 2-辛酮(2-Octanone) 111-13-7 C8H16O 128.2 980.7 247.997 正辛醇(1-Octanol) 111-87-5 C8H18O 130.2 1046.2 288.134 甲基环戊烯醇酮(2-Cyclopenten-1-one, 2-hydroxy-3-methyl-) 80-71-7 C6H8O2 112.1 1043.4 286.266 3-甲基-3-丁烯-1-醇(3-Methyl-3-buten-1-ol) 763-32-6 C5H10O 86.1 741.9 157.942 2-甲基吡嗪(2-Methylpyrazine) 109-08-0 C5H6N2 94.1 811.9 177.343 JK 异戊醇(3-Methyl-1-butanol) 123-51-3 C5H12O 88.1 737.0 156.761 戊醇(Isoamyl alcohol) 30899-19-5 C5H12O 88.1 761.5 162.944 丁酸(Butanoic acid) 107-92-6 C4H8O2 88.1 821.6 180.418 JK、GK 己醛(Hexanal) 66-25-1 C6H12O 100.2 805.8 175.474 乙酸丙酯(Propyl acetate) 109-60-4 C5H10O2 102.1 710,0 150.512 2-己酮(2-Hexanone) 591-78-6 C6H12O 100.2 805,7 175.444 NB培养基、JK、GK 戊醛(Pentanal) 110-62-3 C5H10O 86.1 680.2 144.238 双乙酰(Butan-2,3-dione) 431-03-8 C4H6O2 86.1 600.4 130.26 2-甲基丙酸(2-Methylpropionic acid) 79-31-2 C4H8O2 88.1 797.7 173.03 3-甲基-2-丁醇(3-Methyl-2-butanol) 598-75-4 C5H12O 88.1 680.7 144.355 丁酸乙酯(Ethyl butanoate) 105-54-4 C6H12O2 116.2 819.4 179.703 表 2 菌株JK和GK挥发性代谢产物的主要成分及相对含量
Table 2 Relative content of main volatile components of strain JK and GK
组分 保留时间(min) 峰面积(%) CAS# JK GK 2-乙基-1-己醇(2-Ethyl-1-hexanol) 8.393 2.81 − 104-76-7 2-壬酮(2-Nonanone) 10.163 1.22 1.22 821-55-6 十二烷(Dodecane) 13.225 0.44 − 112-40-3 2-十一酮(2-Undecanone) 15.84 1.34 − 112-12-9 2-三癸醇(2-Tridecanol) 16.023 0.9 − 1653-31-2 2,6-二叔丁基-1,4-苯醌(2,5-Cyclohexadiene-1,4-dione, 2,6-bis(1,1-dimethylethyl)-) 20.432 0.44 − 719-22-2 Pentanoic acid, 2,2,4-trimethyl-3-carboxyisopropyl, isobutyl ester 23.572 2.85 − NA 2,6,10-三甲基十五烷(Pentadecane, 2,6,10-trimethyl-) 24.672 0.26 − 3892-00-0 2,6,10,14-四甲基十五烷(Pentadecane, 2,6,10,14-tetramethyl-) 25.948 0.43 − NA 4-十八烷基吗啉(Morpholine, 4-octadecyl-) 30.323 0.53 − NA 3,5-二异丙氧基-1,1,1,1,7,7,7-六甲基-3,5-双(三甲基甲硅烷氧基)四硅氧烷(3,5-(Diisopropoxy-
1,1,1,7,7,7-hexamethyl-3,5-bis (trimethylsiloxy) tetrasiloxane)18.929 3.82 − NA 3,7-Bis[(trimethylsilyl)oxy]-9-methoxy-1-methyl(6H)dibenzo[b,d]pyran-6-one 22.62 1.37 − NA 1,1,3,3,5,5,7,7,9,9,11,11,13,13,15,15-十六甲基八硅氧烷(Octasiloxane,
1,1,3,3,5,5,7,7,9,9,11,11,13,13,15,15-hexadecamethyl-)24.892 0.14 − NA Bis (pentamethylcyclotrisiloxy) hexamethyltrisiloxane 30.477 0.47 − NA 2,6-二(叔丁基)-4-(1-甲基丙基)酚(Phenol, 2,6-bis(1,1-dimethylethyl)-4-(1-methylpropyl-) 24.506 14.06 − 17540-75-9 正二十一烷(Heneicosane) 25.811 0.15 − 629-94-7 十四甲基六硅氧烷(Hexasiloxane, tetradecamethyl-) 30.629 3.98 3.98 107-52-8 Cyclononasiloxane, octadecamethyl- 28.993 − 1.83 556-71-8 2,2,4-三甲基-1,3-戊二醇二异丁酸(2,2,4-Trimethyl-1,3-pentanediol diisobutyrate) 23.513 − 0.49 6846-50-0 Methoxyacetic acid, 2-tridecyl ester 25.935 − 0.42 NA 2-壬酮(2-Nonanone) 10.163 − 1.22 821-55-6 Bis(heptamethylcyclotetrasiloxy)hexamethyltrisiloxane 26.317 − 0.8 71449-67-7 邻苯二甲酸二异丁酯(1,2-Benzenedicarboxylic acid, bis(2-methylpropyl) ester) 29.984 − 0.29 84-69-5 十四甲基六硅氧烷(Hexasiloxane, tetradecamethyl-) 30.622 − 1.98 107-52-8 1,1,1,5,7,7,7-Heptamethyl-3,3-bis(trimethylsiloxy)tetrasiloxane 31.491 − 0.55 38147-00-1 十六烷基七硅氧烷(Heptasiloxane, hexadecamethyl-) 35.594 − 1.2 541-01-5 表 3 七种挥发性单物质对甘薯黑斑病病原菌的抑制作用
Table 3 Antifungal activity of seven compounds against C. fimbriata
组分 对照菌落直径(mm) 处理菌落直径(mm) 抑制率(%) 己醛(Hexanal) 66.46±0.25 4.55±0.15 93.15 2-己酮(2-Hexanone) 66.46±0.25 54.75±0.16 17.62 乙酸丙酯(Propyl acetate) 66.46±0.25 55.35±0.43 16.72 异辛醇(1-Hexanol, 2-ethyl-) 66.46±0.25 0 100 2-壬酮(2-Nonanone) 66.46±0.25 12.50±0.25 81.19 甲基壬基甲酮(2-Undecanone) 66.46±0.25 56.28±0.33 15.32 2,2,4-三甲基-1,3-戊二醇二异丁酸(2,2,4-Trimethyl-1,3-pentanediol diisobutyrate) 66.46±0.25 27.5±0.12 58.62 注:表中数据为均值±标准偏差。 -
[1] 汤丽琴, 徐玉娟, 唐道邦, 等. 4种甘薯的营养成分分析[J]. 食品工业,2020,41(11):336−339. [TANG L Q, XU Y J, TANG D B, et al. Analysis of the nutritional content of four sweet potatoes[J]. The Food Industry,2020,41(11):336−339. [2] PAN Y F, CHEN L, PANG L L, et al. Ultrasound treatment inhibits browning and improves antioxidant capacity of fresh-cut sweet potato during cold storage[J]. RSC Advances,2020,10(16):9193−9202. doi: 10.1039/C9RA06418D
[3] DOVENE A K, WANG L, BOKHARY S U F, et al. Effect of cutting styles on quality and antioxidant activity of stored fresh-cut sweet potato (Ipomoea batatas L.) cultivars[J]. Foods,2019,8(12):674. doi: 10.3390/foods8120674
[4] PAUL N C, NAM S-S, KACHROO A, et al. Characterization and pathogenicity of sweet potato (Ipomoea batatas) black rot caused by Ceratocystis fimbriata in Korea[J]. European Journal of Plant Pathology,2018,152(3):833−840. doi: 10.1007/s10658-018-1522-8
[5] XING K, LI T J, LIU Y F, et al. Antifungal and eliciting properties of chitosan against Ceratocystis fimbriata in sweet potato[J]. Food Chemistry,2018,268:188−195. doi: 10.1016/j.foodchem.2018.06.088
[6] WANG C J, WANG Y Z, CHU Z H, et al. Endophytic Bacillus amyloliquefaciens YTB1407 elicits resistance against two fungal pathogens in sweet potato (Ipomoea batatas (L.) Lam.)[J]. Journal of Plant Physiology,2020,253:153260. doi: 10.1016/j.jplph.2020.153260
[7] 申燕飞, 吴玲艳, 郑剑英, 等. 甘薯贮藏冷害研究现状[J]. 保鲜与加工,2017,17(6):132−135. [SHEN Y F, WU L Y, ZHENG J Y, et al. The research situation on chilling injury of sweet potatos during storage[J]. Storage and Process,2017,17(6):132−135. [8] 解则义, 李洪民, 马代夫, 等. 低温胁迫影响甘薯贮藏的研究进展[J]. 植物生理学报,2017,53(5):758−767. [XIE Z Y, LI H M, MA D F, et al. Research progress of the effects of low temperature stress on the sweet potato during storage[J]. Plant Physiology Journal,2017,53(5):758−767. [9] CAO S F, YANG Z F, CAI Y T, et al. Antioxidant enzymes and fatty acid composition as related to disease resistance in postharvest loquat fruit[J]. Food Chemistry,2014,163:92−96. doi: 10.1016/j.foodchem.2014.04.084
[10] CHEN Y, ZHOU Y D, LABORDA P, et al. Mode of action and efficacy of quinolinic acid for the control of Ceratocystis fimbriata on sweet potato[J]. Pest Management Science,2021,77(10):4564−4571. doi: 10.1002/ps.6495
[11] DROBY S, WISNIEWSKI M, TEIXIDÓC N, et al. The science, development, and commercialization of postharvest biocontrol products[J]. Postharvest Biology and Technology,2016,122:22−29. doi: 10.1016/j.postharvbio.2016.04.006
[12] OKSANA L, MARYAM S, SASAN A, et al. Bacillus spp
. : Efficient biotic strategy to control postharvest diseases of fruits and vegetables[J]. Plants,2019,8(4):97. doi: 10.3390/plants8040097 [13] ZHANG Y, LI T J, LIU Y F, et al. Volatile organic compounds produced by Pseudomonas chlororaphis subsp. aureofaciens SPS-41 as biological fumigants to control Ceratocystis fimbriata in postharvest sweet potato[J]. Journal of Agricultural and Food Chemistry,2019,67(13):3702−3710. doi: 10.1021/acs.jafc.9b00289
[14] RAJAOFERA M J N, WANG Y, DAHAR G Y, et al. Volatile organic compounds of Bacillus atrophaeus HAB-5 inhibit the growth of colletotrichum gloeosporioides[J]. Pesticide Biochemistry and Physiology,2019,156:170−176. doi: 10.1016/j.pestbp.2019.02.019
[15] ZHOU M S, LI P Z, WU S Y, et al. Bacillus subtilis CF-3 volatile organic compounds inhibit Monilinia fructicola growth in peach fruit[J]. Frontiers in Microbiology,2019,10:1804. doi: 10.3389/fmicb.2019.01804
[16] 卫郑霞. 甘薯采后黑斑病拮抗菌的筛选和拮抗效果的研究[D]. 泰安: 山东农业大学, 2018 WEI Z X. Selection of antagonistic microorganisms and their control effect against Ceratocystis fimbriata disease of postharvest Ipomoeabatatas[D]. Taian: Shandong Agricultural University, 2018.
[17] LIU C, YIN X H, WANG Q G, et al. Antagonistic activities of volatiles produced by two Bacillus strains against Monilinia fructicola in peach fruit[J]. Journal of the Science of Food and Agriculture,2018,98(15):5756−5763. doi: 10.1002/jsfa.9125
[18] GAO H Y, LI P Z, XU X X, et al. Research on volatile organic compounds from Bacillus subtilis CF-3: Biocontrol effects on fruit fungal pathogens and dynamic changes during fermentation[J]. Frontiers in Microbiology,2018,9:456. doi: 10.3389/fmicb.2018.00456
[19] 邵悦春, 付晓婷, 许加超, 等. 基于气相离子迁移谱的发酵海带风味分析[J]. 食品工业科技,2021,42(12):300−306. [SHAO Y C, FU X T, XU J C, et al. Flavor analysis of fermented laminaria japonica based on gas chromatograph-ion mobility spectrometer (GC-IMS)[J]. Science and Technology of Food Industry,2021,42(12):300−306. [20] 王明林, 乔鲁芹, 张莉, 等. 固相微萃取-气相色谱/质谱测定植物叶片中的挥发性物质[J]. 色谱,2006(4):343−346. [WANG M L, QIAO L Q, ZHANG L, et al. Analysis of volatile conatituents from leaves of plants by gas chromatograph/mass spectrometry with solid-phase microextraction[J]. Chinese Journal of Chromatography,2006(4):343−346. [21] OSAKI C, YAMAGUCHI K, URAKAWA S, et al. The bacteriological properties of Bacillus Strain TM-I-3 and analysis of the volatile antifungal compounds emitted by this bacteria[J]. Biocontrol Science,2019,24(3):129−136. doi: 10.4265/bio.24.129
[22] 陈雪, 倪鹏, 喻勇新, 等. 李斯特属细菌特征挥发性代谢物的鉴定分析[J]. 食品科学,2013,34(10):231−237. [CHEN X, NI P, YU Y X, et al. Characterization of volatile metabolites of Listeria spp. strain [J]. Food Science,2013,34(10):231−237. doi: 10.7506/spkx1002-6630-201310051 [23] DHAKSHINAMOORTHY D, SUNDARESAN S, IYADURAI A, et al. Hexanal vapor induced resistance against major postharvest pathogens of banana (Musa acuminata L.)[J]. Plant Pathology Journal,2020,36(2):133−147. doi: 10.5423/PPJ.OA.03.2019.0072
[24] LI M F, SUN K L, FANG Y S, et al. Toxic effects of acetone, 2-pentanone, and 2-hexanone on physiological indices of wheat (Triticum aestivum L.) germination and seedlings[J]. Environmental Science and Pollution Research International,2021,28(45):64552−64560. doi: 10.1007/s11356-021-15496-9
[25] LEE B, LIN P C, CHA H S, et al. Characterization of volatile compounds in cowart muscadine grape (Vitis rotundifolia) during ripening stages using GC-MS combined with principal component analysis[J]. Food Science and Biotechnology,2016,25(5):1319−1326. doi: 10.1007/s10068-016-0207-3
[26] ROMINA L A, RODRÍGUEZ F J, GUARDA A, et al. Application of β-cyclodextrin/2-nonanone inclusion complex as active agent to design of antimicrobial packaging films for control of Botrytis cinerea[J]. Food and Bioprocess Technology,2017,10(9):1584−1594.
[27] 余璐, 魏琛, 张凯歌, 等. 异辛醇对稻谷中霉菌及其毒素的抑制作用研究[J]. 粮食与油脂,2022,35(5):65−69,79. [YU L, WEI C, ZHANG K G, et al. Inhibitory effect of isooctanol on molds and mycotoxins in paddy rice[J]. Cereals and Oils,2022,35(5):65−69,79. doi: 10.3969/j.issn.1008-9578.2022.05.016 [28] SATISH K R, MOSHE S. The bacillary postbiotics, including 2-undecanone, suppress the virulence of pathogenic microorganisms[J]. Pharmaceutics,2022,14(962):962.
[29] MADDALENA R, RUSSELL M, SULLIVAN D P, et al. Formaldehyde and other volatile organic chemical emissions in four FEMA temporary housing units[J]. Environmental Science and Technology,2009,43(15):5626−5632. doi: 10.1021/es9011178
[30] WU Y C, YUAN J, E Y, et al. Effects of volatile organic compounds from Streptomyces albulus NJZJSA2 on growth of two fungal pathogens[J]. Journal of Basic Microbiology,2015,55(9):1104−1117. doi: 10.1002/jobm.201400906
[31] GU R X, ZHU S H, ZHOU J, et al. Inhibition on brown rot disease and induction of defence response in harvested peach fruit by nitric oxide solution[J]. European Journal of Plant Pathology,2014,139(2):369−378. doi: 10.1007/s10658-014-0393-x
[32] XU M J, GUO J H, LI T J, et al. Antibiotic effects of volatiles produced by Bacillus tequilensis XK29 against the black spot disease caused by Ceratocystis fimbriata in postharvest sweet potato[J]. Journal of Agricultural and Food Chemistry,2021,69:13045−13054. doi: 10.1021/acs.jafc.1c04585
[33] BU S W, MUNIR S, HE P F, et al. Bacillus subtilis L1-21 as a biocontrol agent for postharvest gray mold of tomato caused by Botrytis cinerea[J]. Biological Control,2021,157:104568. doi: 10.1016/j.biocontrol.2021.104568
[34] MU Y P, YUE Y, GU G R, et al. Identification and characterization of the Bacillus atrophaeus strain J-1 as biological agent of apple ring rot disease[J]. Journal of Plant Diseases and Protection,2020,127:367−378. doi: 10.1007/s41348-020-00309-x
[35] ZHANG D, QIANG R, ZHAO J, et al. Mechanism of a volatile organic compound (6-methyl-2-heptanone) emitted from Bacillus subtilis ZD01 against Alternaria solani in potato[J]. Frontiers in Microbiology,2022,12:808337. doi: 10.3389/fmicb.2021.808337
[36] 汪静杰, 赵东洋, 刘永贵, 等. 解淀粉芽孢杆菌SWB16菌株脂肽类代谢产物对球孢白僵菌的拮抗作用[J]. 微生物学报,2014,54(7):778−785. [WANG J J, ZHAO D Y, LIU Y G, et al. Antagonism against Beauveria bassiana by lipopeptide metabolites produced by entophyte Bacillus amyloliquefaciens strain SWB16[J]. Microbiology China,2014,54(7):778−785. [37] ZHANG Q X, ZHANG Y, SHAN H H, et al. Isolation and identification of antifungal peptides from Bacillus amyloliquefaciens W10[J]. Environmental Science and Pollution Research International,2017,24(32):25000−25009. doi: 10.1007/s11356-017-0179-8





 下载:
下载:

 下载:
下载:



