Optimization of Fermentation Technology and Evaluation of Antioxidant Activity of Black Soybean Meal Beverage
-
摘要: 以黑豆粕为原料,通过乳酸菌发酵制备具有抗氧化活性的乳酸饮料。实验采用单因素和响应面分析法优化乳酸菌发酵工艺,以DPPH•清除率为指标,考察料液比、接种量、发酵温度、发酵时间对发酵过程的影响;再通过DPPH•清除实验、•OH清除实验、ABTS+•清除实验、脂质过氧化抑制实验来评价发酵产物的抗氧化功效。结果表明:最佳发酵菌株为嗜热链球菌,最佳的发酵工艺为料液比1:5 g/mL、接种量5%、温度37.6 ℃、时间36 h。在最佳发酵工艺下,发酵液的DPPH•清除率为71.56%。黑豆粕发酵产物的DPPH、OH、ABTS自由基的半抑制浓度分别为2.43、1.30和0.37 mg/mL,且有效抑制脂质过氧化反应,说明发酵产物具有较好的体外抗氧化活性。饮料的感官评价可达90.21,悬浮稳定性为96.8%。本研究将为开发以黑豆粕为原料的功能性食品提供一个新思路,也为实现农副产品的进一步开发提供参考。Abstract: Black soybean meal was used as raw material to prepare lactic acid beverage with antioxidant activity through lactic acid bacteria fermentation. Single factor and response surface methodology were used to optimize the fermentation process of lactic acid bacteria. The effects of the solid-liquid ratio, inoculation quantity, fermentation temperature, and fermentation time on the fermentation process were investigated with DPPH radical scavenging ratio as an index. The DPPH radical scavenging experiment, OH radical scavenging experiment, ABTS radical scavenging experiment, and lipid peroxidation inhibition experiment were tested to assess the antioxidant effect of fermented products. The results showed that Streptococcus thermophilus was the best fermentation strain, and the optimum fermentation processes were solid-liquid ratio 1:5 g/mL, inoculation quantity 5%, fermentation temperature 37.6 ℃, and fermentation time 36 h, respectively. Under the optimal fermentation conditions, the DPPH radical scavenging ratio was 71.56%. The semi-inhibitory concentrations of DPPH, OH and ABTS free radicals in the fermentation products of black soybean meal were 2.43, 1.30 and 0.37 mg/mL, respectively, and the lipid peroxidation was effectively inhibited, indicating that the fermentation products had good antioxidant activity in vitro. The sensory evaluation and suspension stability of beverage were 90.21 and 96.8%, respectively. This study provides a new idea for the development of functional foods with black soybean meal as raw material, and also provides a reference for the further development of agricultural by-products.
-
黑豆(Black soybean),又名乌豆、冬豆子,属于蝶形花科(Papilionaceae)之一年生草本植物[1],富含多种生物活性物质,具有抗氧化、降血脂、降胆固醇等功能[2]。而黑豆粕作为黑豆经榨油后的副产品,呈现不规则的浅褐色硬块状,具有烤豆类的香味,约有50%的蛋白含量[3]。目前,榨油后的黑豆粕主要作为饲料,其低表观消化率使得豆蛋白没有得到充分的利用[4],造成大量豆蛋白资源的浪费。因此,黑豆粕的开发研究对于实现蛋白质的高效利用具有重要意义。
微生物发酵方法可通过降解抗营养因子(如大豆球蛋白、胰蛋白酶抑制剂和植酸等)来增加豆粕中蛋白质的消化率和营养价值[5]。乳酸菌作为一种革兰氏阳性非孢子性厌氧或兼性需氧球菌和杆菌,在参与食品发酵过程中,可改善产品的口感、香气和质地等特性[6]。更重要的是,有研究表明利用乳酸菌发酵水解原料中的蛋白质,可产生生物活性多肽[7-9],如抗氧化肽。因此,可通过乳酸菌发酵的方法生产具有活性的营养物质,并提高产品的感官特性。此外,在乳酸菌产品研发中,乳酸菌发酵饮料成为21世纪新兴的健康功能饮料,其丰富的营养价值和口感滋味受到了广大消费者的青睐。因此,开发一款具有抗氧化活性的乳酸菌发酵饮料具有广大的应用前景。
本文以黑豆粕为原料,采用单因素和响应面分析法优化乳酸菌发酵工艺,以DPPH•清除率为指标,考察料液比、接种量、发酵温度、发酵时间对发酵过程的影响。并通过体外抗氧化实验评估发酵产物的抗氧化功效。本研究为开发以黑豆粕为原料的功能性食品提供理论依据,也为其他富含蛋白质的农副产品资源的深度开发提供参考,从而为实现农产品的高值化利用开辟有效途径。
1. 材料与方法
1.1 材料与仪器
黑豆粕 福建元成豆业有限公司;嗜热链球菌(Streptococcus thermophilus)、发酵乳杆菌(Lactobacillus fermenti)、德氏乳杆菌(Lactobacillus delbrueckii) 福建农业科学院生物资源所提供;M17培养基 青岛高科技工业园生物技术有限公司;三氯乙酸、过硫酸钾、水杨酸 西陇科学股份有限公司;甲醛 国药集团化学试剂有限公司;1,1-二苯基-2-三硝基苯肼(DPPH) 东京化成工业株式会社;2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)、对羟基联苯、亚油酸 上海麦克林生化科技有限公司;蒽酮、双缩脲试剂、谷胱甘肽 上海源叶生物科技有限公司;其他化学试剂均为分析纯。
CARY300型紫外可见分光光度计 美国Varian公司;YXQ-LS-50S型立式蒸汽灭菌器 上海博迅有限公司医疗设备厂;SY-5508型全温型恒温培养摇床 天津市泰斯特仪器有限公司;FD-1C-50型冷冻干燥机 北京博医康实验仪器有限公司;HH-4型数显恒温水浴锅 国华电器有限公司;Q-250A3型高速多功能粉粹机 上海冰都电器有限公司;HYP-1014型消化炉、KDN-102C定氮仪 上海纤检仪器有限公司;TGL-16gR型高速冷冻离心机 上海安亭科学仪器厂;TP-CJ-1A型超洁净工作台 苏州同平净化设备有限公司;FJ200-SH型高速分散均质机 上海标本模型厂。
1.2 实验方法
1.2.1 饮料制作流程
1.2.2 操作要点
1.2.2.1 黑豆粕浆的制备
黑豆粕进行粉碎处理,过200目数的筛网后得到黑豆粕粉末。称取黑豆粕粉末于锥形瓶中,以一定料液比添加超纯水,最后于灭菌锅中进行灭菌处理(121 ℃,20 min),自然冷却后得到黑豆粕浆。
1.2.2.2 菌种活化及扩大培养
将保藏完好的乳酸菌接种至M17液体培养基中,在37 ℃、180 r/min条件下进行活化24 h,活化后的乳酸菌可存于4 ℃下保藏一周。在相同培养条件下进行扩大培养,扩培时间根据菌株生长曲线确定。
1.2.2.3 接种、发酵
黑豆粕浆中接种一定量的乳酸菌,于培养箱中进行发酵(37 ℃、180 r/min)。
1.2.2.4 调配、均质、灭菌
往发酵黑豆粕浆中添加8%蔗糖和0.3%羧甲基纤维素(Carboxymethylcellulose,CMC)进行调配,通过均质机均质(30 MPa,5 min),高温灭菌(121 ℃,20 min),得到饮料成品。
1.2.3 发酵工艺优化
1.2.3.1 菌株生长曲线
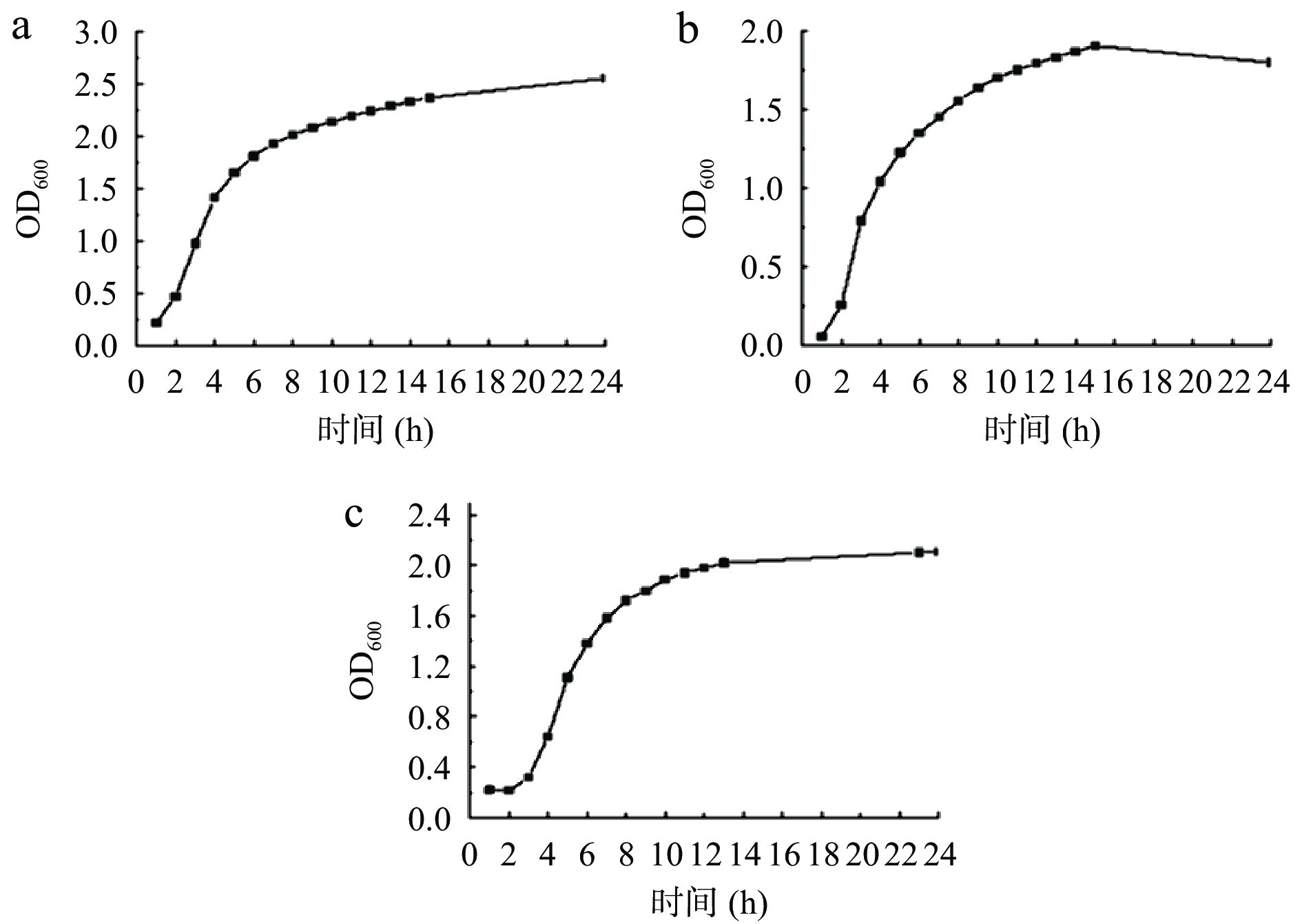
参考樊庆涛等[10]的方法并略作修改。活化后的菌株于M17液体培养基中,在37 ℃、180 r/min条件下进行培养。根据比浊法,在λ=600 nm条件下,每2 h测定其吸光度。以时间为横坐标,吸光度为纵坐标,制作菌种的生长曲线图,并取处于生长对数期的菌种进行接种。
1.2.3.2 菌株筛选
将扩大培养后的菌株接种至黑豆粕浆中,在接种量为1%,培养温度为37 ℃条件下发酵24 h后,8000 r/min离心15 min,取上清发酵液并测定其多肽浓度、水解度和DPPH自由基清除率以筛选最优发酵菌株。
1.2.3.3 单因素实验
本试验以DPPH•清除率为主要指标,水解度为辅助指标(监测黑豆粕发酵进程和验证黑豆粕的发酵水解反应),探究不同因素对黑豆粕发酵的影响。
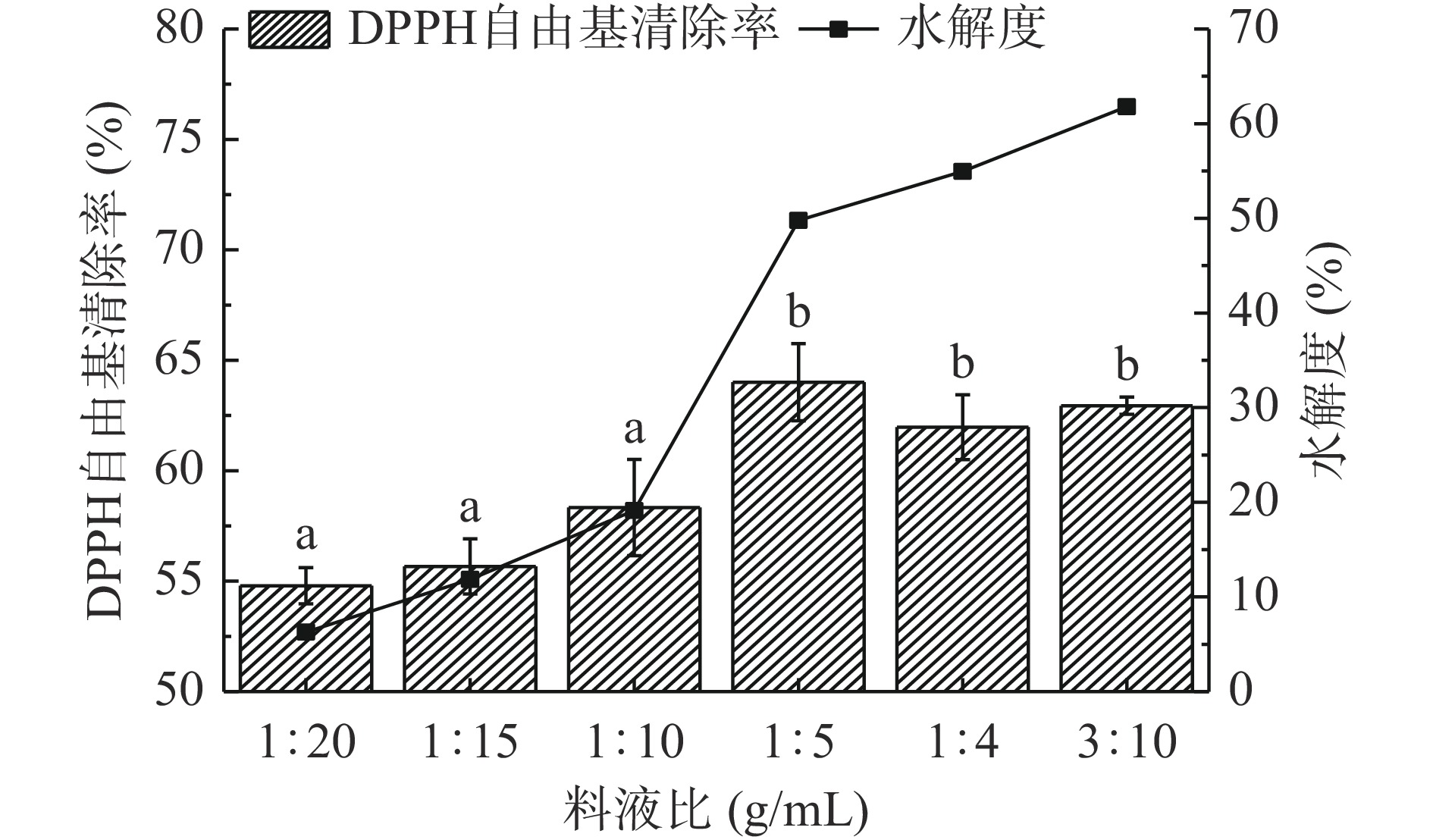
固定接种量3%、发酵温度37 ℃,发酵时间24 h,考察料液比1:20、1:15、1:10、1:5、1:4、3:10 g/mL对黑豆粕发酵的影响。
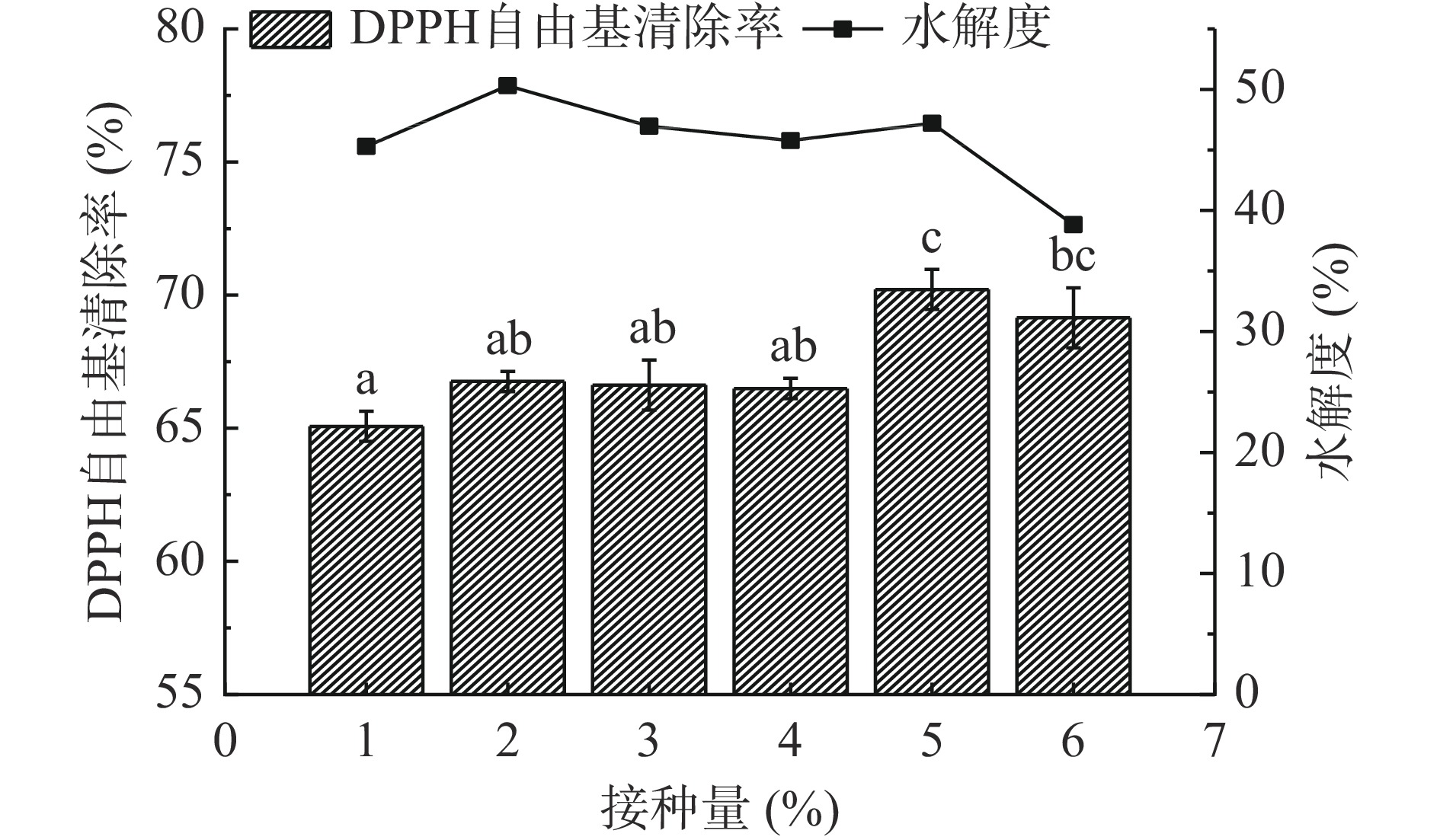
固定料液比1:5 g/mL,发酵温度37 ℃,发酵时间24 h,考察接种量1%、2%、3%、4%、5%、6%对黑豆粕发酵的影响。
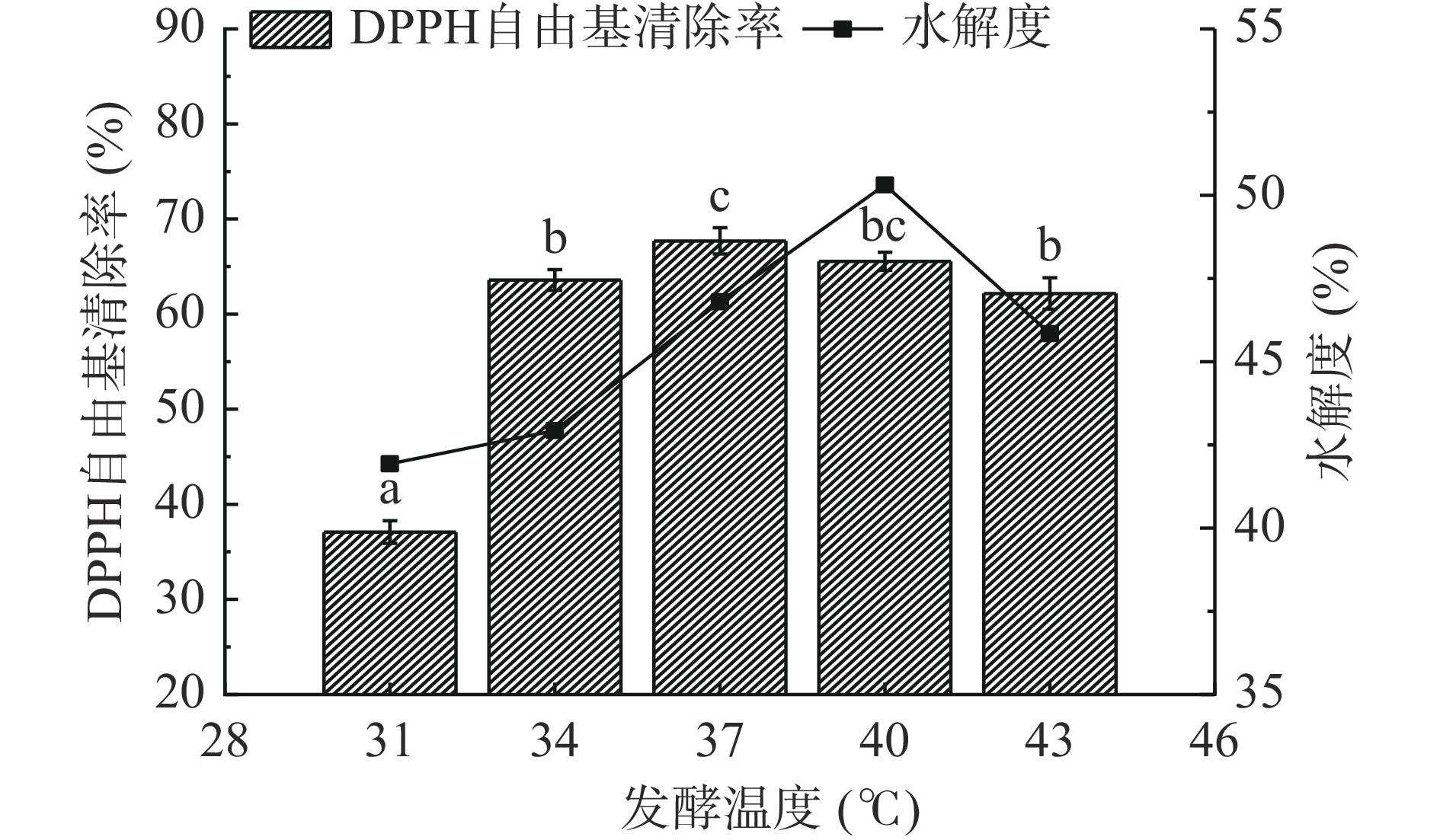
固定料液比1:5 g/mL,接种量5%,发酵时间24 h,考察发酵温度31、34、37、40、43 ℃对黑豆粕发酵的影响。
固定料液比1:5 g/mL,接种量5%,发酵温度37 ℃,考察发酵时间6、12、18、24、30、36、42、48 h对黑豆粕发酵的影响。
1.2.3.4 响应面试验
在单因素实验的基础上,选择料液比、接种量、发酵温度和发酵时间作为自变量,以DPPH自由基清除率作为响应值,根据Box-Behnken实验设计的原理进行4因素3水平的组合设计实验,最后确定其最佳的发酵工艺条件,其响应面因素水平表如表1所示。
表 1 响应面试验因素水平表Table 1. Factors and levels of response surface experiment因素 水平 −1 0 1 A 料液比(g/mL) 1:10 1:5 3:10 B 接种量(%) 4 5 6 C 发酵温度(℃) 34 37 40 D 发酵时间(h) 24 30 36 1.2.4 检测和评价方法
1.2.4.1 多肽浓度测定
参考卫国等[11]的方法并略作修改。福林酚甲液:1 g NaCO3溶于0.1 mol/L NaOH溶液中;0.2 g酒石酸钾溶于20 mL超纯水中;0.1 g CuSO4•5H2O溶于20 mL酒石酸钾溶液中,混匀后以体积比1:50加入NaCO3溶液。样品液与福林酚甲液以体积比1:5充分混匀,室温下放置10 min,再加入福林酚乙液,体积为福林酚甲液的0.1倍,迅速混匀,室温放置30 min后,于540 nm下测定OD值,对照标准曲线y=0.0047x+0.0169,R2=0.998获得发酵液中多肽浓度。
1.2.4.2 水解度测定
参考李皖光等[12]的方法并略作修改。采用甲醛滴定方法进行测定黑豆粕发酵水解度,即10倍稀释的发酵液中加入3滴酚酞,并用NaOH溶液(0.01 mol/L)滴定至pH8.2,加入中性甲醛(5 mL)后混匀,用NaOH溶液(0.01 mol/L)滴定至pH9.2,记为V(mL),用去离子水代替发酵液滴定作为空白V0(mL)。水解度根据下式进行计算:
DH(%)=(V−V0)×CNaOH×14×251000×2.5×M2×100 式中:CNaOH—NaOH浓度,mol/L;M2为原料总氮,kg,采用凯氏定氮法[13]测定。
1.2.4.3 发酵产物体外抗氧化试验
将发酵黑豆粕浆于8000 r/min离心15 min,取清液,经冷冻干燥后用超纯水将其配制成不同浓度的样品进行体外抗氧化试验。
a. DPPH自由基清除活性:参照Tu等[14]的方法进行测定。将样品(1、2、3、4、5、6、7、8、9、10 mg/mL)与以95%乙醇配制的0.1 mmol/L DPPH溶液等体积充分混匀,室温避光静置30 min后,在517 nm下测定吸光值;用95%乙醇溶液代替DPPH溶液为样品参比组;空白组为DPPH溶液与95%乙醇溶液。样品的DPPH自由基清除活力根据下式进行计算:
DPPH自由基清除率(%)=(1−Ai−AjA0)×100 式中:Ai—样品组吸光值;Aj—样品参比组吸光值;A0—空白组吸光值。
b. 羟基自由基清除活性:参照Zhou等[15]的方法进行测定。1 mL样品(1.0、1.5、2.0、2.5、3.0、3.5、4.0 mg/mL)与0.3 mL 8 mmol/L FeSO4、1 mL 3 mmol/L水杨酸及0.25 mL 20 mmol/L H2O2溶液混匀,37 ℃保温30 min,流水冷却后,再加入0.45 mL蒸馏水,3000 g离心10 min,于510 nm下测定上清液吸光值,蒸馏水代替样品作为空白对照。
羟基自由基清除率(%)=Acontrol−AsampleAcontrol×100 式中:Acontrol—空白组吸光值;Asample—样品组吸光值。
c. ABTS自由基清除活性:参照Huang等[16]的方法进行测定。配制7 mmol/L的ABTS贮存母液及2.45 mmol/L的过硫酸钾溶液,临用前以1:1的比例混合,室温放置16 h后,用5 mmol/L、pH7.4的磷酸盐缓冲液稀释至734 nm处吸光值为0.70±0.02,即ABTS自由基溶液。ABTS自由基溶液与不同浓度的样品(0.1、0.2、0.3、0.4、0.5、0.6 mg/mL)等体积混合,室温反应10 min后,于734 nm下测定吸光值,用5 mmol/L、pH7.4的磷酸盐缓冲液调零。空白组用蒸馏水代替样品。样品的ABTS自由基清除活力按下式进行计算:
ABTS自由基清除率(%)=Acontrol−AsampleAcontrol×100 式中:Acontrol—空白组吸光值;Asample—样品组吸光值。
d. 脂质过氧化抑制活性:样品脂质过氧化抑制活性利用亚油酸体系进行测定,参照Osawa等[17]的方法并稍加修改。取1 mL不同浓度样品(0.2、0.4、1.0 mg/mL)于具塞比色管中,加入2 mL 95%乙醇、26 μL亚油酸及2 mL 50 mmol/L、pH7.0的磷酸盐缓冲液,充分混匀后,密闭放在暗处并保持40 ℃恒温。空白组用1 mL蒸馏水代替样品。每24 h测定一次体系过氧化程度。脂质过氧化水平采用硫氰酸铁法进行测定。取混合液100 μL与4.7 mL 75%乙醇溶液、100 μL 30%硫氰酸铵混匀,加入100 μL以3.5%盐酸溶液配制成20 mmol/L的FeCl2溶液,充分混匀后准确计时3 min,于500 nm下测定吸光值。脂质过氧化抑制活性越高,吸光值越低。
1.2.4.4 饮料悬浮稳定性
将饮料于λ=660 nm下测定吸光度A1,再取饮料10 mL于4200 r/min离心15 min后,取上次清液于λ=660 nm下测定吸光度A2,则A1/A2即为饮料的悬浮稳定性[18]。
1.2.4.5 饮料成分测定
蛋白质:参照GB 5009.5—2010[13]。
粗脂肪:参考GB 5009.6—2016[19]。
总糖:参考文献[20]的方法并略作修改。称取0.5 g样品,置于50 mL三角瓶中,加入超纯水15 mL,盐酸10 mL,沸水浴20 min后定容至50 mL并过滤得到提取液。取10 mL提取液定容至200 mL。0.2 g蒽酮溶于100 mL浓硫酸得到蒽酮试剂。吸取0.5 mL稀释后的提取液于试管中,加入2 mL蒽酮试剂,迅速浸入冰水中冷却,并进行沸水浴处理10 min,再次冰浴冷却至室温,在λ=620 nm下测定吸光度,对照标准曲线(y=0.093x+10.491,R2=0.998)得到糖含量。样品的总糖含量按照下式进行计算:
总糖含量(%)=C×50×DW×0.5×103×100 式中:C—标曲上糖浓度,mg/mL;D—稀释倍数;W—样品重量,g。
乳酸:参考文献[21]的方法并略作修改。0.667 mol/L硫酸与10%钨酸钠溶液等体积混合得到钨酸工作液;1.5 g对羟基联苯溶于100 mL NaOH溶液(0.125 mol/L)中,得到1.5%对羟基联苯溶液。样品于5000 r/min离心10 min,取0.5 mL上清液与等体积的硫酸(1 mol/L)混合,10000 r/min离心10 min。取一定量的上清液与钨酸工作液等体积混合,静置10 min,10000 r/min离心10 min。上清液于60 ℃保温30 min后冷却至室温。吸取5 mL上清液,加入0.05 g Ca(OH)2混匀,再加入0.8 mL 20% CuSO4溶液,迅速混匀后沸水浴3 min,水浴冷却,3000 r/min离心5 min。取上清液0.5 mL,加入6 mL浓硫酸,沸水浴5 min,冰浴冷却。加1.5%对羟基联苯溶液0.125 mL,充分混匀后静置15 min,沸水浴5 min,冰浴冷却,于λ=565 nm下测定吸光度,对照标准曲线(y=0.0076x+0.034,R2=0.977)得到乳酸含量。
1.2.4.6 饮料的感官评价
参考杨柳等[22]的评价指标并略作修改。以色泽形态、香味、滋味作为感官评价指标,各选择5个不同年龄段的男女,对饮料进行打分,满分为100分。其中色泽形态占30分,香味占30分,滋味占40分,具体评价指标与分数见表2。
表 2 饮料的感官评价方法Table 2. Sensory evaluation methods for beverages评价项目 评价指标 得分(分) 色泽形态 浅黄色,无分层 21~30 色泽稍深或稍浅,放置一段时间出现分层 11~20 色泽过深或过浅,分层现象明显 0~10 香味 豆子香味浓郁,清爽的酸味 21~30 豆子香味较淡,酸味较重 11~20 酸味过重 0~10 滋味 入口有豆沙的绵密感,酸甜可口 31~40 滋味偏甜或偏酸,但有原材料的滋味 16~30 滋味过甜或过酸,原材料滋味被掩盖 0~15 1.3 数据处理
数据处理采用Origin 2017软件。所有数据进行三次平行实验,均以平均值±SD值报告。采用Duncan’s multiple range检验进行统计学意义分析,P<0.05。不同字母代表差异显著(P<0.05)。
2. 结果与分析
2.1 菌种生长曲线
菌株的生长曲线反映了其生长繁殖规律,因此通过测定菌株的生长曲线,可以根据需求有效利用和控制其生长[23]。如图1所示,三种乳酸菌的生长趋势相同,均经历缓慢生长期、对数生长期到稳定期的繁殖过程。对数生长期是微生物繁殖速率最快阶段,因此选取处于对数生长期的乳酸菌进行接种。其中,嗜热链球菌的对数生长期为2~6 h,发酵乳杆菌为1~4 h,德式乳杆菌为3~6 h。
2.2 菌种筛选
以DPPH自由基清除率为主要指标,多肽浓度和水解度为辅助指标,考察四种乳酸菌对黑豆粕发酵情况。从表3可以看出,在三种不同乳酸菌作用下,黑豆粕发生了水解作用,产生了多肽。其中三种乳酸菌对黑豆粕的发酵程度不同,且三个指标都存在显著性差异(P<0.05)。发酵乳杆菌的水解度最大,因此其水解产生的多肽含量最高,次之为德氏乳杆菌,而后嗜热链球菌。但是对于DPPH自由基清除率而言,嗜热链球菌发酵黑豆粕产物的DPPH自由基清除率显著高于德氏乳杆菌和发酵乳杆菌(P<0.05)。这种现象可能是因为过度水解造成具有抗氧化活性的多肽发生降解。因此选取嗜热链球菌为发酵菌种进行下一步的发酵工艺优化。
表 3 不同菌种对黑豆粕发酵情况Table 3. Fermentation of black soybean meal by different strains菌种 多肽浓度(μg/mL) 水解度(%) DPPH自由基清除率(%) 嗜热链球菌 944.18±4.36a 13.13±0.46a 64.24±2.62c 发酵乳杆菌 1508.01±3.98c 47.03±0.63c 45.95±2.10a 德氏乳杆菌 1124.33±2.11b 26.25±3.24b 57.35±0.50b 注:同列不同小写字母表示差异显著(P<0.05)。 2.3 发酵工艺的单因素实验
2.3.1 料液比对黑豆粕发酵的影响
由图2可知,随着料液比不断增大,水解度不断增加,说明黑豆粕在嗜热链球菌的作用下发生了水解。另外发酵液的DPPH•清除率也在不断增加,当料液比为1:5 g/mL时,DPPH•清除率达到最大64.01%,且与前面几组存在显著性差异(P<0.05);继续增大料液比,发酵液的DPPH•清除率有所降低,但与1:5 g/mL结果不存在显著性差异(P>0.05)。这可能是因为水添加量的过多或过少均不利于嗜热链球菌的生长。因此在响应面实验中,料液比选择1:5 g/mL为宜。
2.3.2 接种量对黑豆粕发酵的影响
由图3可知,在1%~4%接种量间,嗜热链球菌的接种量对黑豆粕水解度影响不明显。接种量为5%时,发酵液的DPPH•清除率最大,为69.59%,且与接种量1%~4%存在显著性差异(P<0.05)。随着接种量继续增大,DPPH•清除率和水解度降低。这可能是因为发酵培养基营养物质有限,不能满足嗜热链球菌生长的需要,从而导致发酵液的DPPH•清除率和水解度下降。因此在响应面实验中,接种量选择5%为宜。
2.3.3 发酵温度对黑豆粕发酵的影响
由图4可知,随着温度的不断上升,水解度先增大后下降。温度从31 ℃升高至34 ℃时,发酵液的DPPH•清除率迅速增大,当温度升至37 ℃时,清除率达到最大67.7%,且与前面两组存在显著性差异(P<0.05),继续升高温度,发酵液的DPPH•清除率发生了不同程度的下降。由此说明37 ℃为嗜热链球菌发酵黑豆粕较为适宜的温度,因此在响应面实验中,发酵温度选择为37 ℃。
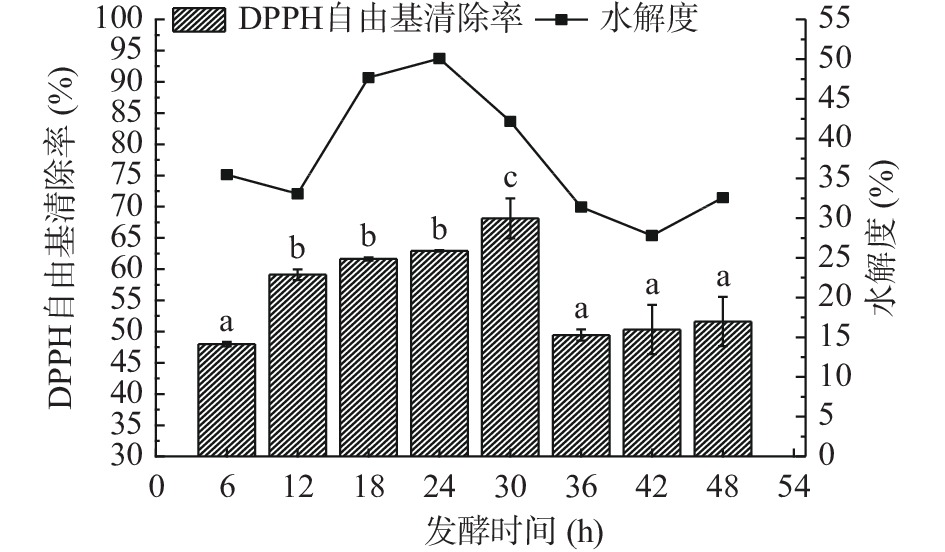
2.3.4 发酵时间对黑豆粕发酵的影响
由图5可知,水解度变化呈现不规律趋势,但是总体为先上升后下降。这种不规律的原因可能是嗜热链球菌在不同发酵时间同时发生蛋白质的酶解和多肽的吸收,因此黑豆粕的水解程度具有不规律性。对于DPPH•清除率,随着发酵时间的增加,发酵液的DPPH•清除率逐渐增大而后下降。当发酵时间为30 h时,发酵液的DPPH•清除率最大,为65.63%,且与其他组存在显著性差异(P<0.05)。发酵液的DPPH•清除率下降的原因有可能是嗜热链球菌在适宜的发酵时间下,产生一些具有抗氧化作用的短肽产物,但是随着发酵时间增加,具有抗氧化作用的短肽被嗜热链球菌进一步吸收利用,使其抗氧化能力和水解度下降[24]。因此在响应面实验中,选择发酵时间30 h为宜。
2.4 发酵工艺的响应面试验
2.4.1 数学模型的建立及显著性检验
根据Box-Behnken实验设计的原理确定各因素水平,进行响应面设计,结果见表4。
表 4 响应面试验设计与结果Table 4. Experimental design and results for response surface analysis试验号 A 料液比(g/mL) B 接种量(%) C 发酵温度(℃) D 发酵时间(h) DPPH自由基
清除率(%)1 1:10 4 37 30 42.29 2 3:10 4 37 30 56.97 3 1:10 6 37 30 52.49 4 3:10 6 37 30 45.77 5 1:5 5 34 24 58.47 6 1:5 5 40 24 60.19 7 1:5 5 34 36 57.08 8 1:5 5 40 36 62.50 9 1:10 5 37 24 55.97 10 3:10 5 37 24 60.70 11 1:10 5 37 36 54.98 12 3:10 5 37 36 62.69 13 1:5 4 34 30 55.68 14 1:5 6 34 30 46.17 15 1:5 4 40 30 45.37 16 1:5 6 40 30 58.56 17 1:10 5 34 30 52.67 18 3:10 5 34 30 37.59 19 1:10 5 40 30 33.80 20 3:10 5 40 30 59.72 21 1:5 4 37 24 62.19 22 1:5 6 37 24 60.70 23 1:5 4 37 36 61.69 24 1:5 6 37 36 62.69 25 1:5 5 37 30 69.91 26 1:5 5 37 30 70.60 27 1:5 5 37 30 71.30 28 1:5 5 37 30 70.37 29 1:5 5 37 30 69.91 利用Design-Expert 8.0.6统计软件对表4数据进行回归拟合,得到DPPH自由基清除率Y与料液比A、接种量B、发酵温度C、发酵时间D的二次多项回归模型为:Y=70.42+2.60A+0.18B+1.04C+0.28D−5.35AB+10.25AC+0.74AD+5.68BC+0.62BD+0.93CD−12.71A2−8.34B2−11.19C2+0.32D2。
由表5可知,该回归模型P<0.0001,表明该回归模型达到极显著水平。预测值与实验值有极高的相关性(R2=0.9940),表明超过99%的实验数据可用该模型进行解释。根据F值和P值均可以看出,影响因素的主次顺序是:料液比>发酵温度>发酵时间>接种量。其中一次项A、C,交互项AB、AC、BC,二次项A2、B2、C2对实验结果影响极显著(P<0.01);一次项B、D,交互项AD、BD、CD,二次项D2对实验结果影响不显著(P>0.05),表明实验因素与响应值之间不是简单的线性关系,而是非线性关系。因此可用该模型来分析和预测发酵工艺结果。
表 5 发酵工艺模型回归方程方差分析Table 5. ANOVA of regression equation for fermentation process变异来源 平方和 自由度 均方和 F值 P值 显著性水平 模型 2633.89 14 188.13 165.67 < 0.0001 *** A 料液比 81.33 1 81.33 71.62 < 0.0001 *** B 接种量 0.40 1 0.40 0.35 0.5625 C 发酵温度 12.98 1 12.98 11.43 0.0045 *** D 发酵时间 0.97 1 0.97 0.85 0.3713 AB 114.49 1 114.49 100.82 < 0.0001 *** AC 420.25 1 420.25 370.07 < 0.0001 *** AD 2.22 1 2.22 1.95 0.1838 BC 128.82 1 128.82 113.44 < 0.0001 *** BD 1.55 1 1.55 1.36 0.2622 CD 3.42 1 3.42 3.01 0.1045 A2 1047.76 1 1047.76 922.65 < 0.0001 *** B2 451.51 1 451.51 397.60 < 0.0001 *** C2 812.13 1 812.13 715.15 < 0.0001 *** D2 0.65 1 0.65 0.57 0.4615 残差 15.90 14 1.14 失拟 14.57 10 1.46 4.38 0.0836 不显著 净误差 1.33 4 0.33 注:***代表P<0.01,**代表P<0.05。 2.4.2 响应面试验分析及对发酵条件的优化
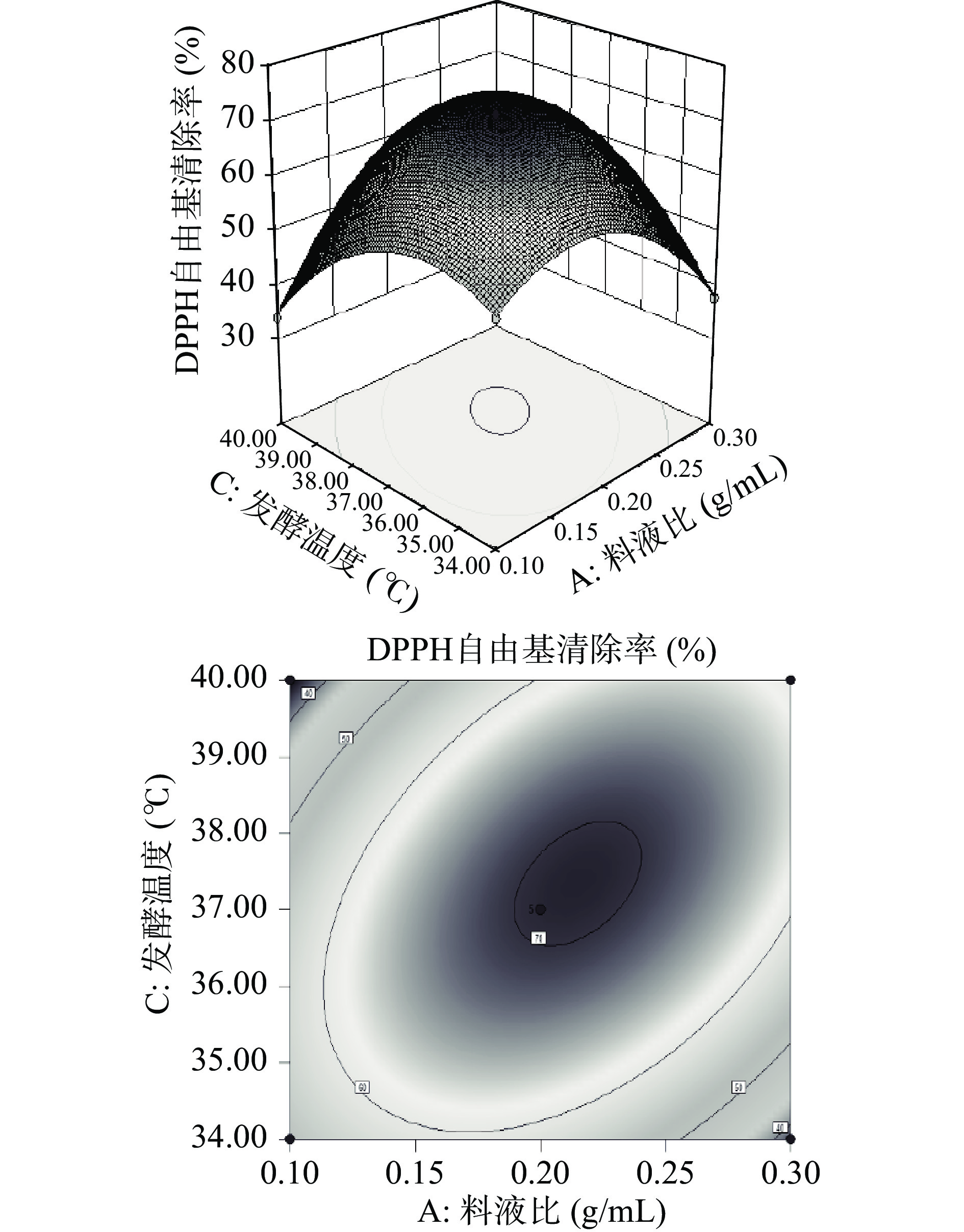
对交互作用影响显著的AB、AC和BC做等高线图和三维空间响应面图。等高线的形状可反映交互效应的强弱,椭圆形表示两因素交互作用显著,而圆形则与之相反[25]。响应面的曲面形状可以看出影响因素的显著水平,曲面较陡说明影响显著,曲面较圆说明影响不显著[26-27]。由图6、图7、图8可看出等高线呈椭圆形,具有显著的相互作用,并且通过响应面图可观察到最高点,说明料液比与接种量、料液比与发酵温度、接种量与发酵温度之间存在显著的相互关系。
对二次回归模型进行拟合,获得黑豆粕发酵工艺的最佳条件为:料液比1:5 g/mL、接种量5.05%、发酵温度37.57 ℃、发酵时间36 h。为实验操作方便,发酵条件调整为:料液比1:5 g/mL、接种量5%、发酵温度37.6 ℃、发酵时间36 h,预测此时嗜热链球菌发酵黑豆粕得到的发酵液的DPPH•清除率为71.56%。对优化后的发酵工艺条件进行验证实验,所得的发酵液的DPPH•清除率为71.03%±1.02%,与预测值相接近,说明了数学模型的有效性。
2.5 发酵产物的体外抗氧化评价
2.5.1 DPPH自由基清除实验
由图9可看出,DPPH•清除率与发酵产物浓度具有显著的相关性。在浓度1~6 mg/mL范围内,随着发酵产物浓度增大,DPPH•清除率急剧上升,当浓度进一步加大时,DPPH•清除率增幅减缓,并且发酵产物对DPPH•的半抑制浓度IC50为2.43 mg/mL。强抗氧化剂VC对DPPH自由基清除率的IC50约为0.54 mg/mL[28],黑豆粕发酵产物对DPPH自由基的清除能力与VC相比仍然有限。尹乐斌等[29]使用乳酸菌发酵豆清夜获得的抗氧化多肽对DPPH自由基清除率的IC50为7.61 mg/mL,是黑豆粕发酵产物的3.13倍。因此黑豆粕发酵产物具有良好的DPPH自由基清除活力。
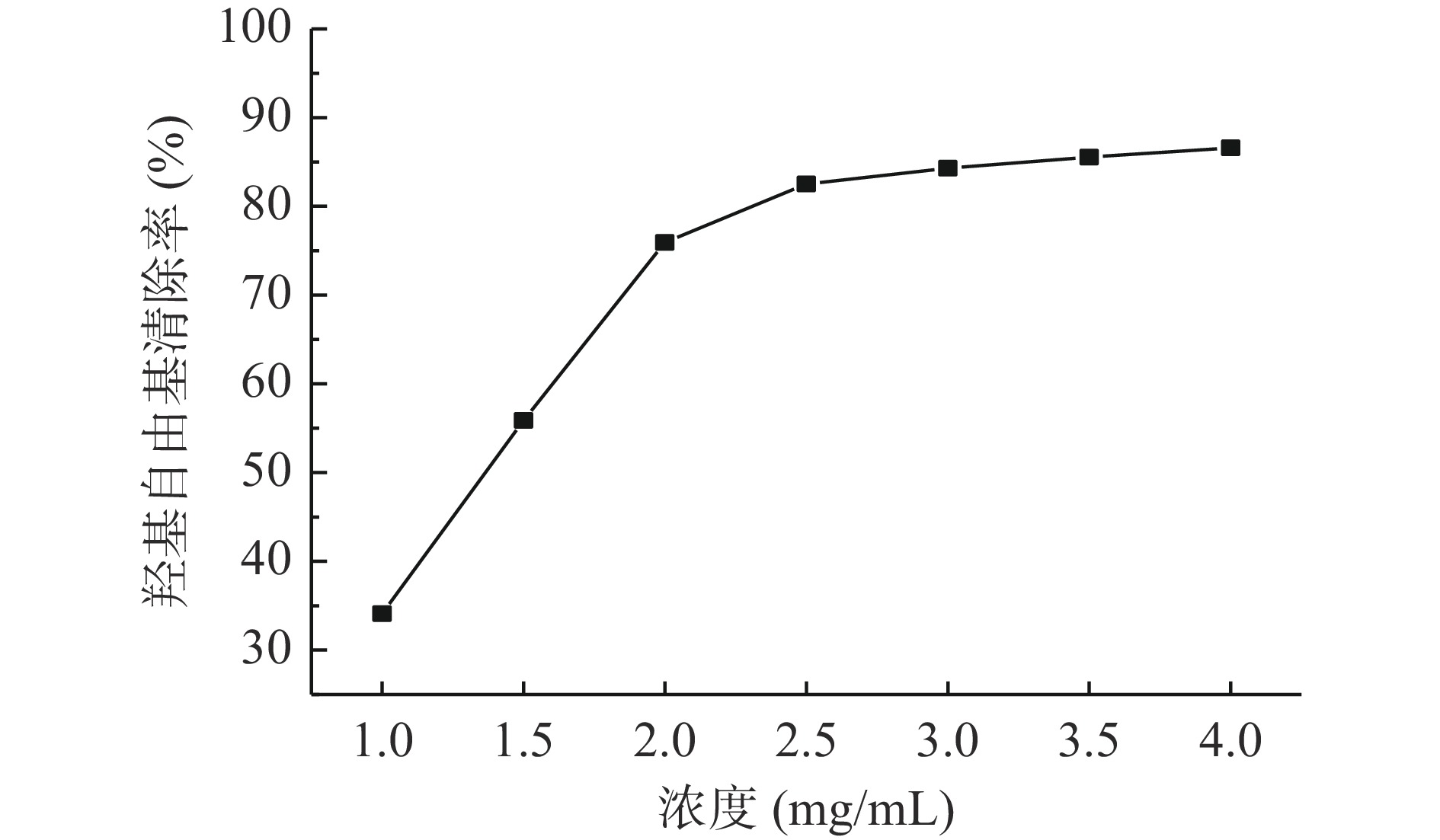
2.5.2 羟基自由基清除实验
由图10可看出,当发酵产物的浓度在1~2 mg/mL时,随着浓度的增大,•OH的清除率迅速增大,继续增大发酵产物的浓度,•OH的清除率增幅减缓。因此•OH的清除率与发酵产物浓度具有显著的相关性。发酵产物对•OH的半抑制浓度IC50为1.30 mg/mL,与尹乐斌等[30]研究的豆清多肽发酵液对•OH的半抑制浓度结果一致。
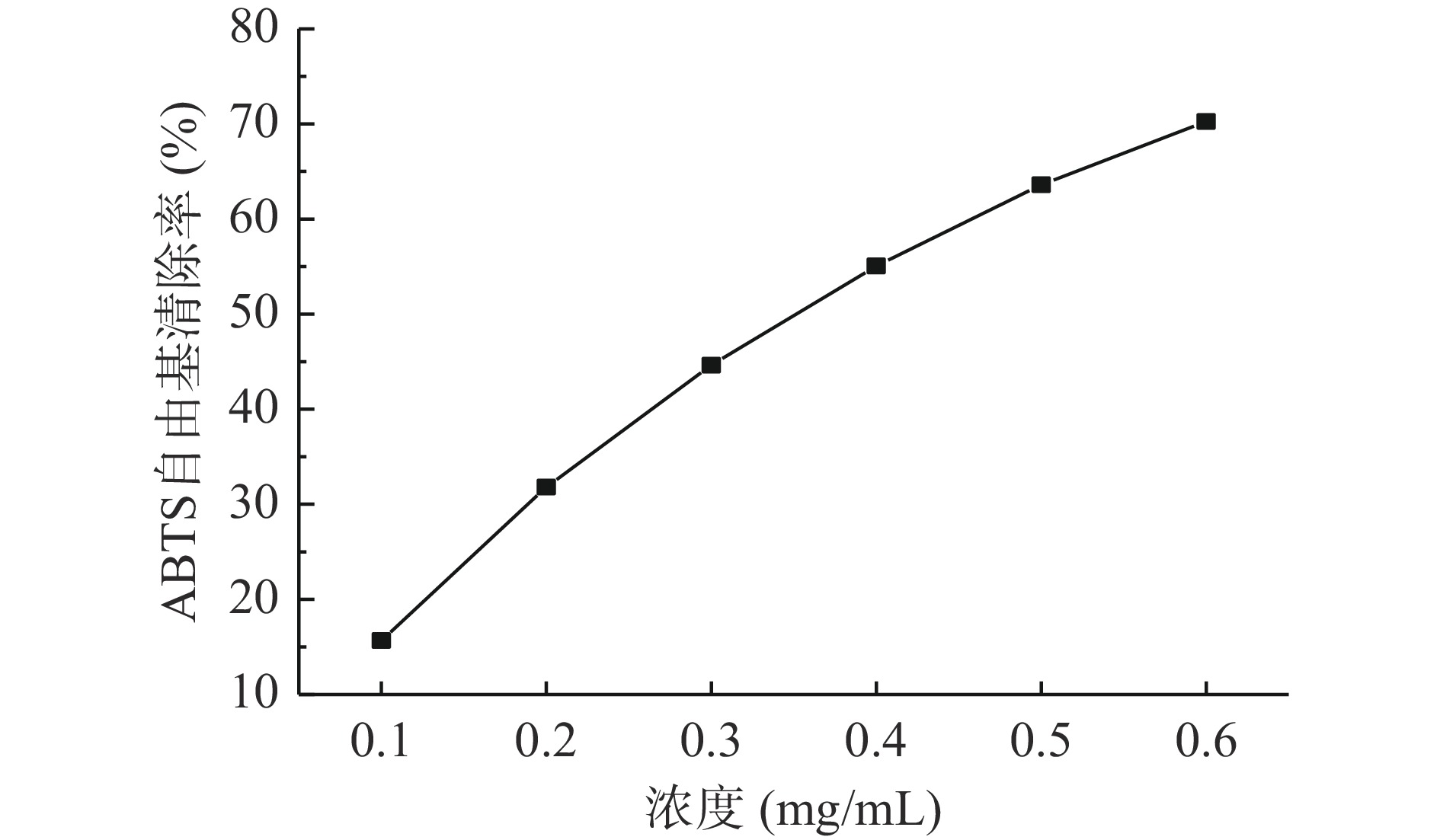
2.5.3 ABTS自由基清除实验
由图11可看出,当提高发酵产物浓度时,ABTS+•清除率也随之增大,说明ABTS+•的清除率与发酵产物浓度具有显著的相关性,并且发酵产物对ABTS+•的半抑制浓度IC50为0.37 mg/mL。尹乐斌等[31]利用枯草芽孢杆菌发酵豆渣制备多肽,其ABTS+•的半抑制浓度IC50为2.97 mg/mL,是黑豆粕发酵产物的8.02倍,因此黑豆粕发酵产物具有较好的ABTS自由基清除活力。
2.5.4 脂质过氧化抑制实验
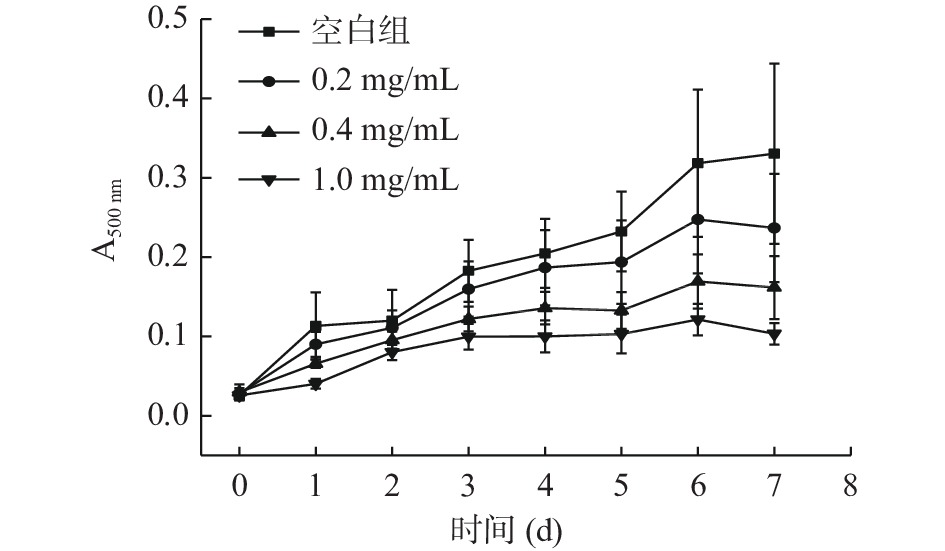
由图12可看出,空白组在一周时间内,吸光度急剧上升,亚油酸自氧化明显。当添加发酵产物后,亚油酸的脂质过氧化程度受到抑制。且随着发酵产物浓度的增大,亚油酸的脂质过氧化程度的抑制作用增加。当发酵产物的浓度为1 mg/mL时,亚油酸在第1、2 d时,氧化程度较大,在之后的5 d时间里,其氧化程度趋于平缓。因此,发酵产物可能存在能阻断脂质过氧化反应链的抗氧化物质。
2.6 饮料评价与成分分析
根据感官评定标准评定饮料,该款饮料的感官评分为90.21,另外饮料的悬浮稳定性达到96.8%。由表6可知,饮料中含有蛋白质8.69%、粗脂肪6.06%和总糖21.2%,另外通过乳酸菌发酵,饮料中含有0.36 mg/mL的乳酸。根据T/LYFIA 004-2019标准,该款饮料符合灭菌型乳酸菌饮料。
表 6 饮料成分分析与评价Table 6. Component analysis and evaluation of beverage组分 蛋白质
(%)粗脂肪
(%)总糖
(%)乳酸
(mg/mL)悬浮稳定性
(%)感官
评分(分)含量 8.69±0.19 6.06±0.85 21.2±1.23 0.36±0.07 96.8±1.2 90.21±2.2 3. 结论
本文以黑豆粕为原料,通过嗜热链球菌发酵研制一款乳酸饮料,并对其发酵产物的体外抗氧化活性进行评价。试验结果表明,发酵工艺的最优条件为:料液比1:5 g/mL、接种量5%、温度37.6 ℃、时间36 h,在最佳发酵工艺下,发酵液的DPPH•清除率为71.56%。黑豆粕发酵产物的DPPH、OH、ABTS自由基的IC50分别为2.43、1.30和0.37 mg/mL,且有效抑制脂质过氧化反应,说明发酵产物具有较好的体外抗氧化活性。该款饮料口感细腻、酸甜适中、且稳定性较好。该研究为开发以黑豆为原料的功能性食品提供理论依据,为实现农副产品资源的深度开发的高值化开辟有效途径。
-
表 1 响应面试验因素水平表
Table 1 Factors and levels of response surface experiment
因素 水平 −1 0 1 A 料液比(g/mL) 1:10 1:5 3:10 B 接种量(%) 4 5 6 C 发酵温度(℃) 34 37 40 D 发酵时间(h) 24 30 36 表 2 饮料的感官评价方法
Table 2 Sensory evaluation methods for beverages
评价项目 评价指标 得分(分) 色泽形态 浅黄色,无分层 21~30 色泽稍深或稍浅,放置一段时间出现分层 11~20 色泽过深或过浅,分层现象明显 0~10 香味 豆子香味浓郁,清爽的酸味 21~30 豆子香味较淡,酸味较重 11~20 酸味过重 0~10 滋味 入口有豆沙的绵密感,酸甜可口 31~40 滋味偏甜或偏酸,但有原材料的滋味 16~30 滋味过甜或过酸,原材料滋味被掩盖 0~15 表 3 不同菌种对黑豆粕发酵情况
Table 3 Fermentation of black soybean meal by different strains
菌种 多肽浓度(μg/mL) 水解度(%) DPPH自由基清除率(%) 嗜热链球菌 944.18±4.36a 13.13±0.46a 64.24±2.62c 发酵乳杆菌 1508.01±3.98c 47.03±0.63c 45.95±2.10a 德氏乳杆菌 1124.33±2.11b 26.25±3.24b 57.35±0.50b 注:同列不同小写字母表示差异显著(P<0.05)。 表 4 响应面试验设计与结果
Table 4 Experimental design and results for response surface analysis
试验号 A 料液比(g/mL) B 接种量(%) C 发酵温度(℃) D 发酵时间(h) DPPH自由基
清除率(%)1 1:10 4 37 30 42.29 2 3:10 4 37 30 56.97 3 1:10 6 37 30 52.49 4 3:10 6 37 30 45.77 5 1:5 5 34 24 58.47 6 1:5 5 40 24 60.19 7 1:5 5 34 36 57.08 8 1:5 5 40 36 62.50 9 1:10 5 37 24 55.97 10 3:10 5 37 24 60.70 11 1:10 5 37 36 54.98 12 3:10 5 37 36 62.69 13 1:5 4 34 30 55.68 14 1:5 6 34 30 46.17 15 1:5 4 40 30 45.37 16 1:5 6 40 30 58.56 17 1:10 5 34 30 52.67 18 3:10 5 34 30 37.59 19 1:10 5 40 30 33.80 20 3:10 5 40 30 59.72 21 1:5 4 37 24 62.19 22 1:5 6 37 24 60.70 23 1:5 4 37 36 61.69 24 1:5 6 37 36 62.69 25 1:5 5 37 30 69.91 26 1:5 5 37 30 70.60 27 1:5 5 37 30 71.30 28 1:5 5 37 30 70.37 29 1:5 5 37 30 69.91 表 5 发酵工艺模型回归方程方差分析
Table 5 ANOVA of regression equation for fermentation process
变异来源 平方和 自由度 均方和 F值 P值 显著性水平 模型 2633.89 14 188.13 165.67 < 0.0001 *** A 料液比 81.33 1 81.33 71.62 < 0.0001 *** B 接种量 0.40 1 0.40 0.35 0.5625 C 发酵温度 12.98 1 12.98 11.43 0.0045 *** D 发酵时间 0.97 1 0.97 0.85 0.3713 AB 114.49 1 114.49 100.82 < 0.0001 *** AC 420.25 1 420.25 370.07 < 0.0001 *** AD 2.22 1 2.22 1.95 0.1838 BC 128.82 1 128.82 113.44 < 0.0001 *** BD 1.55 1 1.55 1.36 0.2622 CD 3.42 1 3.42 3.01 0.1045 A2 1047.76 1 1047.76 922.65 < 0.0001 *** B2 451.51 1 451.51 397.60 < 0.0001 *** C2 812.13 1 812.13 715.15 < 0.0001 *** D2 0.65 1 0.65 0.57 0.4615 残差 15.90 14 1.14 失拟 14.57 10 1.46 4.38 0.0836 不显著 净误差 1.33 4 0.33 注:***代表P<0.01,**代表P<0.05。 表 6 饮料成分分析与评价
Table 6 Component analysis and evaluation of beverage
组分 蛋白质
(%)粗脂肪
(%)总糖
(%)乳酸
(mg/mL)悬浮稳定性
(%)感官
评分(分)含量 8.69±0.19 6.06±0.85 21.2±1.23 0.36±0.07 96.8±1.2 90.21±2.2 -
[1] 徐飞, 葛阳阳, 刘新春, 等. 黑豆营养成分及生物活性的研究进展[J]. 中国食物与营养,2019,25(9):55−61. [XU F, GE Y Y, LIU X C, et al. Research advancement of nutritional composition and biological activiey of black soybean[J]. Food and Nutrition in China,2019,25(9):55−61. [2] 黄强, 郏弋萍, 黄磊, 等. 黑豆的营养价值及其利用[J]. 饮食科学,2018(22):123. [HUANG Q, JIA Y P, HUANG L, et al. Nutritional value and utilization of black bean[J]. Diet Science,2018(22):123. [3] 于栋, 高洋, 何新蕾. 酶法制备黑豆粕粉多肽的工艺研究[J]. 中国酿造,2021,40(4):143−147. [YU D, GAO Y, HE X L. Preparation of polypeptides from black bean meal by enzymatic method[J]. China Brewing,2021,40(4):143−147. [4] 何明, 喻一峰, 李小勤, 等. 大口黑鲈饲料中发酵豆粕营养价值的评定[J]. 动物营养学报,2020,32(10):4943−4955. [HE M, YU Y F, LI X Q, et al. Evaluation of nutrient value of fermented soybean meal in diet for largemouth bass (Micropterus salmoides)[J]. Chinese Journal of Animal Nutrition,2020,32(10):4943−4955. [5] AMADOU I, KAMARA T, AMZA T, et al. Physicochemical and nutritional analysis of fermented soybean protein meal by Lactobacillus plantarum Lp6[J]. World Journal of Dairy & Food Sciences,2010,5:114−118.
[6] PAPAGIANNI M. Metabolic engineering of lactic acid bacteria for the production of industrially important compounds[J]. Computational and Structural Biotechnology Journal,2012,3(4):e201210003. doi: 10.5936/csbj.201210003
[7] KITAEVSKAYA S V, PONOMAREV V Y, YUNUSOV E S. Research of fermentation processes of protein substrates by consortiums of lactic acid bacteria[J]. IOP Conference Series: Earth and Environmental Science, 2022, 978(1): 012052 (6pp).
[8] YU S, LIU L, BU T, et al. Purification and characterization of hypoglycemic peptides from traditional Chinese soy-fermented douchi[J]. Food & Function,2022,13(6):3343−3352.
[9] PANCHAL G K, DAS S, SAKURE A, et al. Production and characterization of antioxidative peptides during lactic fermentation of goat milk[J]. Journal of Food Processing and Preservation,2021,45(12):e15992.
[10] 樊庆涛, 孙湘沛, 刘梁, 等. 藤茶中二氢杨梅素对乳酸菌生长及活性的影响[J]. 中国酿造,2021,40(5):134−139. [FAN Q T, SUN X P, LIU L, et al. Effect of dihydromyricetin in Ampelopsis grossedentata on the growth and activity of lactic acid bacteria[J]. China Brewing,2021,40(5):134−139. [11] 卫国, 边海旭, 奚苗苗, 等. 福林酚比色法测定优泌嘉胶囊中多肽[J]. 中成药,2016,38(1):91−93. [WEI G, BIAN H X, XI M M, et al. Determination of polypeptide in Youmijia Capsulesby Folin-phenolcolorimetry[J]. Chinese Traditional Patent Medicine,2016,38(1):91−93. [12] 李皖光, 汪桃花, 王新文, 等. 4种大米蛋白水解度测定方法比较[J]. 粮食科技与经济,2017,42(5):35−37. [LI W G, WANG T H, WANG X W, et al. The comparison of four methods in testing degree of hydrolysis[J]. Grain Science and Technology and Economy,2017,42(5):35−37. [13] 刘军. 食品中蛋白质凯氏定氮法测定比较[J]. 食品安全导刊,2021(12):147−149. [LIU J. Comparison of Kjeldahl determination of protein in food[J]. China Food Safety,2021(12):147−149. [14] TU J M, SHI D D, WEN L R, et al. Identification of moracin N in mulberry leaf and evaluation of antioxidant activity[J]. Food and Chemical Toxicology,2019,132:110730. doi: 10.1016/j.fct.2019.110730
[15] ZHOU S Y, HUANG G L. Extraction, derivatization, and antioxidant activity of Morinda citrifolia polysaccharide[J]. Chemical Biology & Drug Design,2022,99(4):603−608.
[16] HUANG C W, LIN I J, LIU Y M, et al. Composition, enzyme and antioxidant activities of pineapple[J]. International Journal of Food Properties,2021,24(1):1244−1251. doi: 10.1080/10942912.2021.1958840
[17] OSAWA T, NAMIKI M. A novel type of antioxidant isolated from leaf wax of Eucalyptus leaves[J]. Agricultural Biological Chemistry,1981,45(3):735−739.
[18] 杨旭, 朱新鹏, 吕远平. 加工工艺对浑浊型银耳饮料稳定性的影响[J]. 食品与机械,2016,32(8):196−201. [YANG X, ZHU X P, LÜ Y P. Influence of processing technology on stability of Tremella fuciformis cloudy drik[J]. Food & Machinery,2016,32(8):196−201. [19] 张晓婷, 潘建君, 王知, 等. 食品中脂肪测定国家标准的分析与探讨[J]. 食品工业科技,2018,39(20):348−351. [ZHANG X T, PAN J J, WANG Z, et al. Analysis and discussion of national standard for determination of fat in food[J]. Science and Technology of Food Industry,2018,39(20):348−351. [20] 曲祖乙, 刘靖. 食品分析与检验[M]. 北京: 中国环境科学出版社, 2006: 96−112 QU Z Y, LIU J. Analysis and detection of food[M]. Beijing: China Environmental Science Press, 2006: 96−112.
[21] 梁琼, 鲁明波, 卢正东, 等. 对羟基联苯法定量测定发酵液中的乳酸[J]. 食品科学,2008,29(6):357−360. [LIANG Q, LU M B, LU Z D, et al. Determination of lactic acid in fermentation broth by p-hydroxybiphenol colorimetry[J]. Food Science,2008,29(6):357−360. [22] 杨柳, 陈宇飞. 黑豆纳豆饮料发酵条件的研究[J]. 粮食与饲料工业,2014,12(10):39−42. [YANG L, CHEN Y F. Study on fermentation conditions of black beans and natto beverage[J]. Cereal and Feed Industry,2014,12(10):39−42. [23] 陶令霞, 夏铁骑, 常慧萍. 两种测定固氮菌NT06菌株生长曲线方法的比较[J]. 生物学杂志,2007,24(5):57−58. [TAO L X, XIA T Q, CHANG H P. Comparing with two different methods of measuring Azotobacter NT06 growth[J]. Journal of Biology,2007,24(5):57−58. [24] 张友维. 枯草芽孢杆菌发酵花生粕制备抗氧化肽的研究[D]. 无锡: 江南大学, 2012 ZHANG Y W. Preparation of antioxidant peptides from peanut meal fermented by Bacillus subtilis[D]. Wuxi: Jiangnan University, 2012.
[25] 易军鹏, 朱文学, 马海乐, 等. 牡丹籽油超声波辅助提取工艺的响应面法优化[J]. 农业机械学报,2009,40(6):103−110. [YI J P, ZHU W X, MA H L, et al. Optimization on ultrasonic-assisted extraction technology of oil from Paeonia suffruticosa Andr. seeds with response surface analysis[J]. Transactions of the Chinese Society for Agricultural Machinery,2009,40(6):103−110. [26] EJIKEME P M. Investigation of the physicochemical properties of microcrystalline cellulose from agricultural wastes I: Orange mesocarp[J]. Cellulose,2008,15(1):141−147. doi: 10.1007/s10570-007-9147-7
[27] 薛勇, 赵明明, 王超, 等. 响应面法优化南极磷虾蛋白自溶工艺的研究[J]. 食品工业科技,2012,33(4):346−348. [XUE Y, ZHAO M M, WANG C, et al. Optimization of autolysis of Antarctic krill by response surface method[J]. Science and Technology of Food Industry,2012,33(4):346−348. [28] 林款, 周梅, 田香, 等. 4种抗氧化剂抗氧化活性和稳定性的比较[J]. 食品科技,2020,45(6):328−332. [LIN K, ZHOU M, TIAN X, et al. Comparison of antioxidant activity and stability of four antioxidants[J]. Food Science and Technology,2020,45(6):328−332. [29] 尹乐斌, 周娟, 何平, 等. 乳酸菌发酵豆清液制备多肽及其体外抗氧化活性研究[J]. 食品与发酵工业,2020,46(11):131−137. [YIN L B, ZHOU J, HE P, et al. Preparation of peptide from soybean processing waste water by lactic acid bacteria fermentation and its antioxidant activity in vitro[J]. Food and Fermentation Industries,2020,46(11):131−137. [30] 尹乐斌, 周娟, 何平, 等. 豆清多肽发酵液不同超滤组分抗氧化及抑菌活性[J]. 食品工业,2020,41(10):176−180. [YIN L B, ZHOU J, HE P, et al. Antioxidant and antibacterial activities of different ultrafiltration components of soybean peptide fermentation broth[J]. The Food Industry,2020,41(10):176−180. [31] 尹乐斌, 李乐乐, 何平, 等. 枯草芽孢杆菌发酵豆渣制备多肽及其活性研究[J]. 中国酿造,2022,41(1):75−79. [YIN L B, LI L L, HE P, et al. Preparation and activity of peptides from soybean dregs by fermentation with Bacillus subtilis[J]. China Brewing,2022,41(1):75−79. -
期刊类型引用(3)
1. 路晓,李文钊,徐艳朋,李玉爽,王智珍,张亚旭,刘馨阳,阮美娟. 不同预处理对六种药食同源食材加工特性及其饼干品质影响研究. 食品与发酵工业. 2024(12): 258-265 .  百度学术
百度学术
2. 邱心茹,张源,蒋远帅,高文慧,刘友雪,衣春颖,李悦,孔峰. 鸡骨粉理化性质及其对全麦饼干品质的影响. 食品科技. 2024(06): 147-152 .  百度学术
百度学术
3. 傅新征,林思琦,罗培轩. 响应面法优化超声波辅助酸酶法制备荸荠抗性淀粉工艺. 湖北民族大学学报(自然科学版). 2024(04): 551-558 .  百度学术
百度学术
其他类型引用(5)






 下载:
下载:








 下载:
下载:
