Simultaneous Determination of Nitrite and Ascorbic Acid in Fruits and Vegetables by Differential Pulse Voltammetry
-
摘要: 采用对苯二酚(Hydroquinone,HQ)催化甲烷氧化菌素(Methanobactin,Mb)还原氯金酸合成纳米金(Gold Nanoparticles,AuNPs),利用电沉积法将Mb@AuNPs修饰到裸金电极表面,制备Mb@AuNPs/Au电极。采用差分脉冲伏安法对亚硝酸盐和抗坏血酸进行同时测定并对条件进行优化,结果表明:电极组装条件为电沉积扫速100 mV/s、扫描圈数为40圈;检测体系为浓度0.20 mol/L pH6.5的磷酸盐缓冲溶液,在2~5600 μmol/L和1~6000 μmol/L的线性范围内,Mb@AuNPs/Au对亚硝酸盐和抗坏血酸同时检测的氧化峰电流与浓度呈良好的线性关系(R2>0.9928),检出限分别为0.31和0.57 μmol/L。实际样品中亚硝酸盐和抗坏血酸的加标回收率范围分别为92.59%~109.26%、90.01%~103.51%,表明该方法具有良好的重现性和稳定性,可用于果蔬中亚硝酸盐和抗坏血酸的同时测定。Abstract: Hydroquinone (HQ) was used to catalyze Methanobactin (Mb) to reduce chlorauric acid to prepare Gold Nanoparticles (AuNPs). Mb@AuNPs was modified onto the surface of a bare gold electrode via electrodeposition to prepare the Mb@AuNPs/Au electrode. Subsequently, differential pulse voltammetry was conducted for the simultaneous determination of nitrite and ascorbic acid concentrations as well as condition optimization. For the electrode assembly, electrodeposition was performed with a 0.20 mol/L and pH6.5 PBS at a 100 mV/s scan rate for 40 cycles. In the linear range of 2~5600 μmol/L and 1~6000 μmol/L, the oxidation peak current of both nitrite and ascorbic acid detected by Mb@AuNPs/Au showed a good linear relationship with the concentration (R2>0.9928), and the limit of detection (LOD) was 0.31 and 0.57 μmol/L, respectively. The recovery rates of standard addition for the actual samples were 92.59%~109.26%, 90.01%~103.51%. The method has good reproducibility and stability and can be used for simultaneous determination of nitrite and ascorbic acid in fruits and vegetables.
-
Keywords:
- nitrite /
- ascorbic acid /
- differential pulse voltammetry /
- modified electrode
-
果蔬作为人体维生素和矿物质的摄入来源,在人们的日常饮食中发挥着重要作用[1-2]。然而果蔬农作物在种植过程中,若过量的使用氮肥,会导致大量硝酸盐内源性地转化成亚硝酸盐[3-4]。在果蔬贮藏期间,亚硝酸盐的含量会随着果蔬贮存期的延长而逐渐增加,但果蔬自身含有的抗坏血酸(Ascorbic acid,AA)可在一定程度上抑制亚硝酸盐的积累,这一过程中抗坏血酸会发生氧化、分解,而使含量下降。因此,亚硝酸盐和抗坏血酸的含量可作为评价果蔬贮藏保鲜效果和品质的重要指标。此外食用过多的亚硝酸盐会危害人体健康,如导致癌症、贫血症等[5-7]。因此,为了保证食品安全,需要严格把控食品中的亚硝酸盐的含量。而在亚硝酸盐检测过程中,由于食品组分的复杂多样性,导致其检测经常会受到其它物质的干扰。其中,抗坏血酸就是食品,如啤酒、水产品、肉制品中亚硝酸盐定量检测的主要干扰物质之一。因此对于实现亚硝酸盐和抗坏血酸快速、简便和灵敏的检测为评价果蔬品质以及亚硝酸盐的准确定量都具有研究意义。
目前,关于亚硝酸盐、抗坏血酸的检测方法主要包括:色谱法[8-9]、光谱法[10-11]、电化学法[12-16]等。相比其他方法,电化学方法能更好地规避检测过程耗时长、操作复杂等问题,具有简单、快速、高灵敏度和低成本等优点[17]。电化学检测是基于抗坏血酸分子(L-型和D-型)结构中的呋喃环羟基在电极上易被氧化成羰基,而亚硝酸根离子可被氧化成硝酸根离子这一氧化过程产生电子传递,从而使产生的电信号被捕捉可形成相应的氧化特征峰谱的原理进行检测(如图1),但由于亚硝酸盐、抗坏血酸分子在相对较高的过电位下可直接在裸电极表面被氧化,在一定程度上限制了裸电极的应用,从而降低了传感体系的灵敏度和准确度。因此,须对电极表面进行适当的修饰,以改善待测离子的氧化响应信号及扩大分析测定的动态范围[18]。Jilani等[18]通过在四甲基喹啉氧桥联酞菁修饰玻碳电极(CoTM-QOPc/GCE)上,采用差分脉冲伏安法(Differential pulse voltammetry,DPV)和循环伏安法(Cyclic voltammetry,CV)对亚硝酸盐进行检测,检出限为0.06 μmol/L,线性范围为0.20~0.25 μmol/L。Mejry等[19]采用DPV方法,以姜黄素修饰的铅笔石墨电极为载体,负载纳米二硫化钼修饰的泡沫金,构建了一种非酶传感器。该传感器可以灵敏地同时定量联氨和亚硝酸盐,检出限分别为18.3 nmol/L和21.7 nmol/L。Wang等[20]采用自组装和电沉积法对玻碳电极进行修饰,构建的新型PMo10V2/GO/PDDA杂化纳米复合修饰玻碳电极对亚硝酸盐、抗坏血酸和多巴胺(DA)的氧化性进行测定,且浓度与安培信号呈线性关系。Zhang等[21]采用氨氮化法制备了菊花状氮化钛(CL-TiN),制备了一种基于锡修饰玻碳电极(CL-TiN/GCE),对抗坏血酸(AA)和尿酸(UA)的电化学同时检测,抗坏血酸和尿酸的线性范围分别为50~1500 μmol/L和10~300 μmol/L,AA和UA的检出限分别为1.5和0.28 μmol/L。电极的修饰会显著提高待测离子的电化学信号响应和电化学工作传感平台的灵敏度和准确性。但电极修饰物的选择以及组装条件对建立高精准性的电化学传感体系极其重要。目前对两种以上物质进行同时检测的修饰电极,一般采用两种以上物质进行复合物修饰,修饰物的制备与负载至电极表面均以多步实现。这一过程耗时长,操作复杂,且层层组装的过程,电极上的修饰物因保存时间长易发生氧化而损失。
本文采用对苯二酚催化具有过氧化物酶活性的甲烷氧化菌素还原氯金酸合成纳米金,通过电沉积方法一步制备修饰电极Mb@AuNPs/Au,加快电极制备效率;借助DPV法可扣除电容电流,提高分辨率的优势,实现亚硝酸盐和抗坏血酸的同时测定。分别考察电沉积扫速、电沉积圈数、缓冲溶液种类、缓冲溶液pH、缓冲溶液浓度等因素对同时检测的影响,优化检测条件。以期获得高灵敏度、高稳定性、快速响应的电化学传感检测体系,用于果蔬食品中亚硝酸盐和抗坏血酸含量的测定。
1. 材料与方法
1.1 材料与仪器
甲基弯菌M. trichosporium OB3b 由清华大学邢新会教授提供;甲烷 纯度为99.99%,北京海普气体有限公司;氯金酸 阿拉丁试剂有限公司;过氧化氢、铁氰化钾、氯化钾、浓硫酸、柠檬酸钠、柠檬酸、亚硝酸钠、抗坏血酸、无水乙醇、甲醇、磷酸二氢钾、磷酸氢二钾、乙酸、乙酸钠 天津市天力化学试剂有限公司;所用试剂均为分析纯;菠菜、大白菜、西红柿、胡萝卜、梨 由超市购买。
BSA224S电子天平、BSA2202S电子天平 北京赛多利斯科学仪器有限公司;DHG-9203A型电热恒温鼓风干燥箱、R-20旋转蒸发仪 上海恒科仪器有限公司;HDL洁净工作台 北京东联哈尔仪器制造有限公司;HSB-HSB-Ⅲ循环水式多用真空泵 郑州长城科工贸有限公司;HNY-100B恒温培养振荡器 天津欧诺仪器仪表有限公司;TGL-16高速台式离心机 上海医疗器械六厂;PB-10 pH计 赛丽朵思公司;PGSTAT302N电化学工作站 瑞士万通中国有限公司;Pt 213铂电极、R0302 氯化银电极 天津艾达试剂公司;φ=3 mm金盘电极 上海辰华仪器公司;FDU-1200冷冻干燥机 东京理化器械公司;UV-2550紫外光谱仪 日本岛津公司。
1.2 实验方法
1.2.1 修饰电极的制备
1.2.1.1 Mb@AuNPs的制备
采用本课题组方法从甲烷氧化菌中分离纯化甲烷氧化菌素(Methanobactin,Mb)(0.25 mmol/L),将纯化后Mb稀释至0.02 mmol/L备用。取两个10 mL离心管分别标记为1号和2号,向1号管中加入3 mL 0.3 mmol/L氯金酸和1 mL 0.02 mmol/L Mb后密封;2号管中加入3 mL 0.3 mmol/L氯金酸、1 mL 0.02 mmol/L Mb 和500 μL 0.5 mmol/L 对苯二酚溶液后密封。将两只离心管于50 ℃水浴锅中加热50 min,待溶液颜色由淡黄色变粉红色后,停止加热,冷却至室温,在300~800 nm紫外波长下借助紫外光谱对HQ催化Mb还原氯金酸合成纳米金进行分析。
1.2.1.2 裸金电极的制备
根据文献[22]方法:将金电极在食人鱼溶液(70%浓硫酸和30%过氧化氢混合而成)中浸泡5 min后,用双蒸水将金电极表面的食人鱼溶液清洗干净,金电极(φ=3 mm)分别用粒径为0.25和0.05 μm的氧化铝悬浮液抛光成镜面,再用甲醇和水超声清洗30 s,从而得到预处理好的裸金电极。
1.2.1.3 Mb@AuNPs/Au的制备
采用电沉积法制备Mb@AuNPs/Au。取制备好的裸金电极分别置于3 mL未经HQ催化合成Mb@AuNPs溶液和经HQ催化合成的Mb@AuNPs溶液中,在−0.2~0.6 V电位范围内[23]以100 mV/s进行循环伏安扫描40圈,1200 s后,用双蒸水淋洗,经高纯氮气将电极表面吹干,借助循环伏安法和交流阻抗法(Electrochemical impedance spectrum,EIS)对修饰电极电化学性能进行表征。
1.2.2 AA和NO2−在修饰电极上的电化学行为考察
将修饰好的Mb@AuNPs电极,置于装有2 mL pH6.0 0.1 mol/L磷酸盐缓冲溶液(Phosphate buffered solution,PBS)、5 mmol/L 1 mL AA和5 mmol/L 1 mL NO2−的电化学专用瓶中在−0.1~1.0 V电势下进行DPV测定,以氧化峰电流为指标,考察AA和NO2−在电极上的电化学行为,如图1。
1.2.3 Mb@AuNPs修饰电极组装条件优化及电化学性能的表征
1.2.3.1 修饰电极电沉积扫速的选择
将预先抛光打磨好的裸金电极置于装有3 mL经HQ催化合成的Mb@AuNPs溶液中,在−0.2~0.6 V电势内,分别以50、100、200、300、400 mV/s电沉积扫速进行循环伏安扫描40圈,制备Mb@AuNPs修饰电极,在电解液中通过CV和EIS图谱考察电沉积扫速对修饰电极电化学性能的影响。
1.2.3.2 修饰电极电沉积扫描圈数的选择
将预先抛光打磨好的裸金电极置于装有3 mL经HQ催化合成的Mb@AuNPs溶液中,在−0.2~0.6 V 电势内,循环伏安扫速为100 mV/s,依次改变电沉积扫描圈数为10、20、30、40、50圈,制备Mb@AuNPs修饰电极,在电解液中通过CV和EIS图谱考察电沉积扫描圈数对修饰电极电化学性能的影响。
1.2.4 NO2−和AA同时检测条件的优化
1.2.4.1 缓冲溶液种类的选择
取1 mL 1 mmol/L NO2−溶液和1 mL 1 mmol/L AA溶液分别与2 mL 0.1 mol/L pH6醋酸盐缓冲溶液、磷酸盐缓冲溶液、柠檬酸盐缓冲溶液混合,并置于电化学专用瓶中,利用修饰电极在−0.1~1.0 V 电势范围,扫描速度为100 mV/s 参数下进行DPV法测定,根据DPV图谱分析缓冲溶液种类对NO2−和AA电化学行为的影响。
1.2.4.2 缓冲溶液pH的选择
取1 mL 1 mmol/L NO2−溶液和1 mL 1 mmol/L AA溶液分别与2 mL 0.1 mol/L pH6.0、pH6.5、pH7.0、pH7.5、pH8.0、pH8.5磷酸盐缓冲溶液混合,并置于电化学专用瓶中,利用修饰电极在−0.1~1.0 V电势范围,扫描速度为100 mV/s参数下进行DPV法测定,根据DPV图谱分析缓冲溶液pH对NO2−和AA电化学行为的影响。
1.2.4.3 缓冲溶液浓度的选择
取1 mL 1 mmol/L NO2−溶液和1 mL 1 mmol/L AA溶液分别与2 mL 0.05、0.10、0.15、0.20、0.25、0.30 mol/L pH6.5磷酸盐缓冲溶液混合,并置于电化学专用瓶中,利用修饰电极在−0.1~1.0 V电势范围,扫描速度为100 mV/s参数下进行DPV法测定,根据DPV图谱分析缓冲溶液浓度对NO2−和AA电化学行为的影响。
1.2.5 NO2−和AA标准曲线的测定
1.2.5.1 抗坏血酸标准曲线
取0.20 mol/L pH6.5的磷酸缓冲溶液置于电化学专用瓶中,并加入1 mL 0.001 mmol/L NO2−溶液和1 mL 0.002 mmol/L AA溶液,反应1 min后,利用修饰电极在−0.1~1.0 V电势范围,扫描速度为100 mV/s参数下进行DPV法对NO2−和AA同时测定。依次改变AA溶液的浓度为0.40、0.80、1.20、1.60、2.60、3.60、4.60、5.60 mmol/L重复上述实验。
1.2.5.2 亚硝酸钠标准曲线
取0.20 mol/L pH6.5的磷酸缓冲溶液置于电化学专用瓶中,并加入1 mL 0.001 mmol/L NO2−溶液和1 mL 0.002 mmol/L AA溶液,反应1 min后,利用修饰电极在−0.1~1.0 V电势范围,扫描速度为100 mV/s参数下进行DPV法对NO2−和AA同时测定。依次改变NO2−溶液的浓度为0.50、1.00、1.50、2.00、3.00、4.00、5.00、6.00 mmol/L重复上述实验。
1.2.6 重现性和稳定性
采用Mb@AuNPs修饰电极对含有亚硝酸盐和抗坏血酸的样品溶液进行重复测定10次;将制备好的修饰电极在空气中放置14 d后对样品溶液进行测定,用来确定该方法对亚硝酸盐和抗坏血酸同时检测的重现性和稳定性。
1.2.7 样品测定
将新鲜的菠菜、大白菜、西红柿、水晶梨、苹果、橘子六种果蔬作为实际样品。取一定量新鲜的菠菜、大白菜在研钵内进行捣碎处理,将残渣和汁液进行过滤,取滤液1 mL用PBS缓冲溶液稀释100倍后备用;将西红柿、水晶梨、苹果、橘子进行榨汁,汁液移入离心管中,8500 r/min离心5 min,取上清液1 mL稀释100倍后备用[24-25]。采用标准加入法[16]对前处理后的样品溶液中NO2−和AA的加标回收率进行平行测定3次,计算加标回收率;并将大白菜和苹果分别贮藏3、6、9 d后,对其进行前处理后,测定样品在贮藏期间的NO2−和AA含量及回收率。
1.3 数据处理
所有实验均重复3次,采用Origin 2019软件作图和SPSS 26.0软件,以LSD法进行显著性分析,显著性水平P<0.05。
2. 结果与分析
2.1 HQ催化Mb制备Mb@AuNPs的紫外光谱
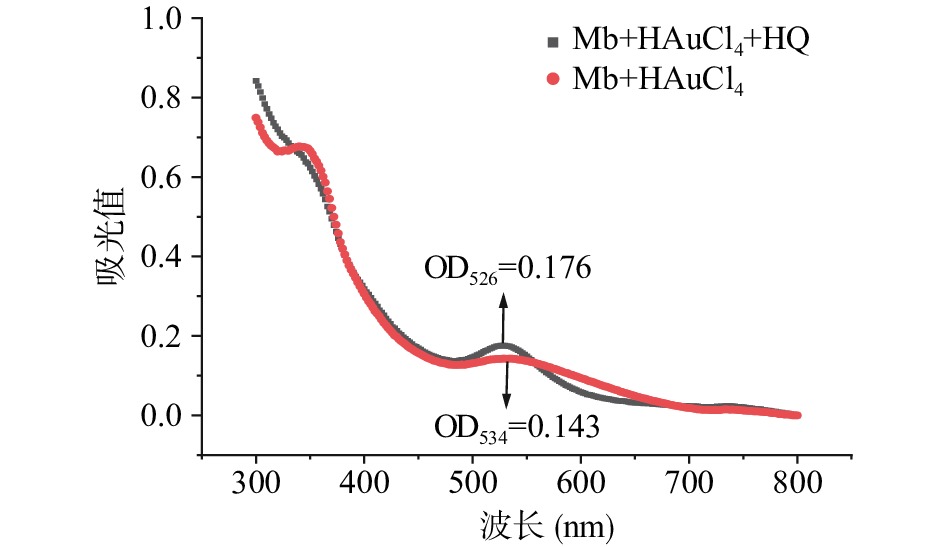
由图2可知,当仅加入Mb还原氯金酸时,紫外光谱在534 nm处出现纳米金吸收特征峰;当加入HQ催化Mb还原氯金酸时,紫外光谱在526 nm处出现明显的纳米金吸收特征峰。加入HQ后,紫外光谱发生蓝移且吸收峰值增加。据研究报道[26],这一结果可能由于Mb本身具有催化Au(Ⅲ)还原能力,虽然未加入HQ,也可直接催化还原Au(Ⅲ)为Au(0)进而生成纳米金。但Mb本身电子供给能力有限、还原能力较弱,不能持续还原Au(Ⅲ),加入HQ后,利用Mb具有催化电子由电子供体向金属离子传递的还原酶活性的能力,将HQ作为电子供体,进而催化纳米金持续合成,紫外光谱特征峰峰值增加,证明了体系中纳米金的合成数量也在不断的增加。而紫外光谱发生蓝移,表明合成的纳米金粒径在减小,纳米金分散性较好[27]。因此可推断HQ的加入对于Mb@AuNPs修饰物的制备具有促进作用。
2.2 不同方法制备Mb@AuNPs电化学性能比较
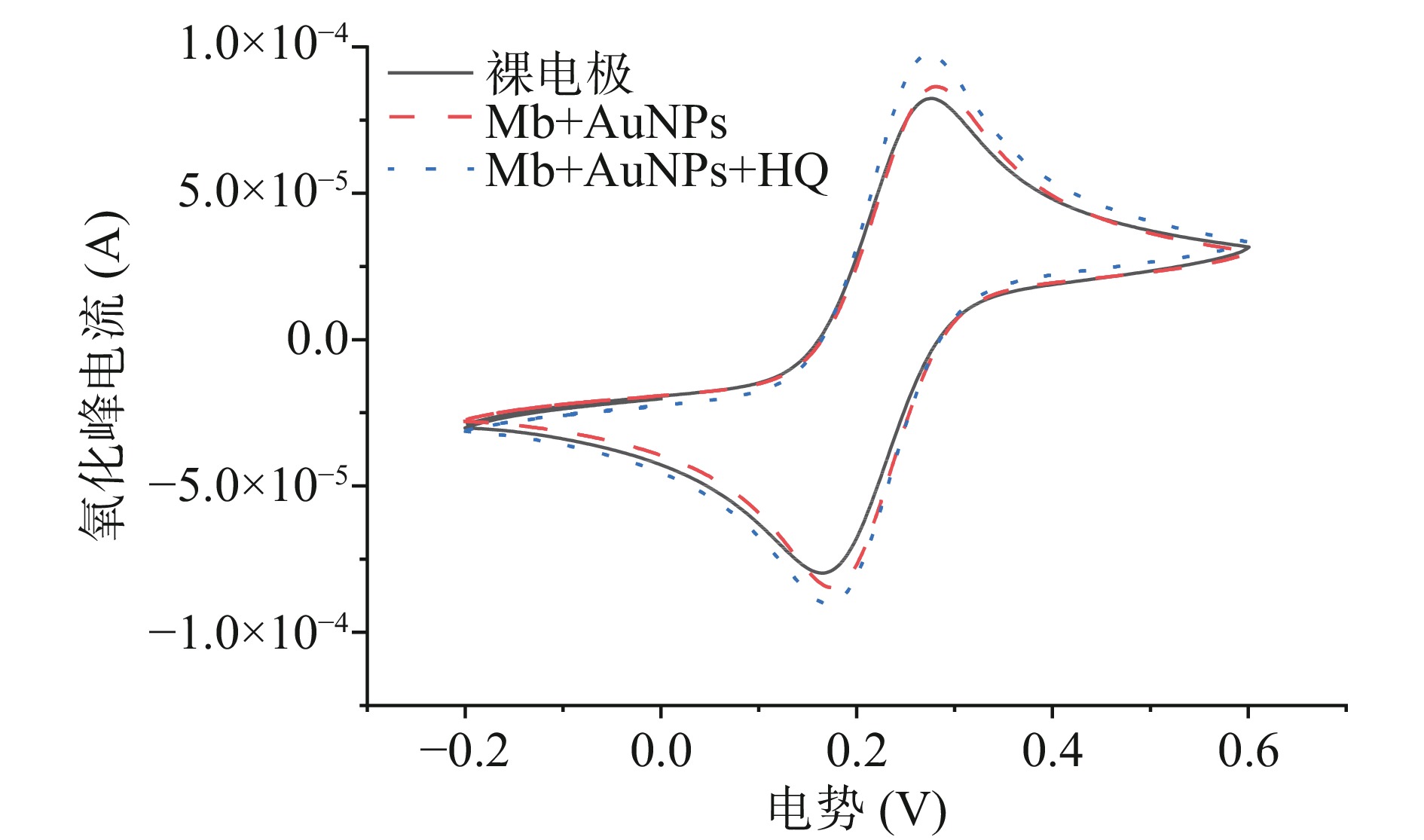
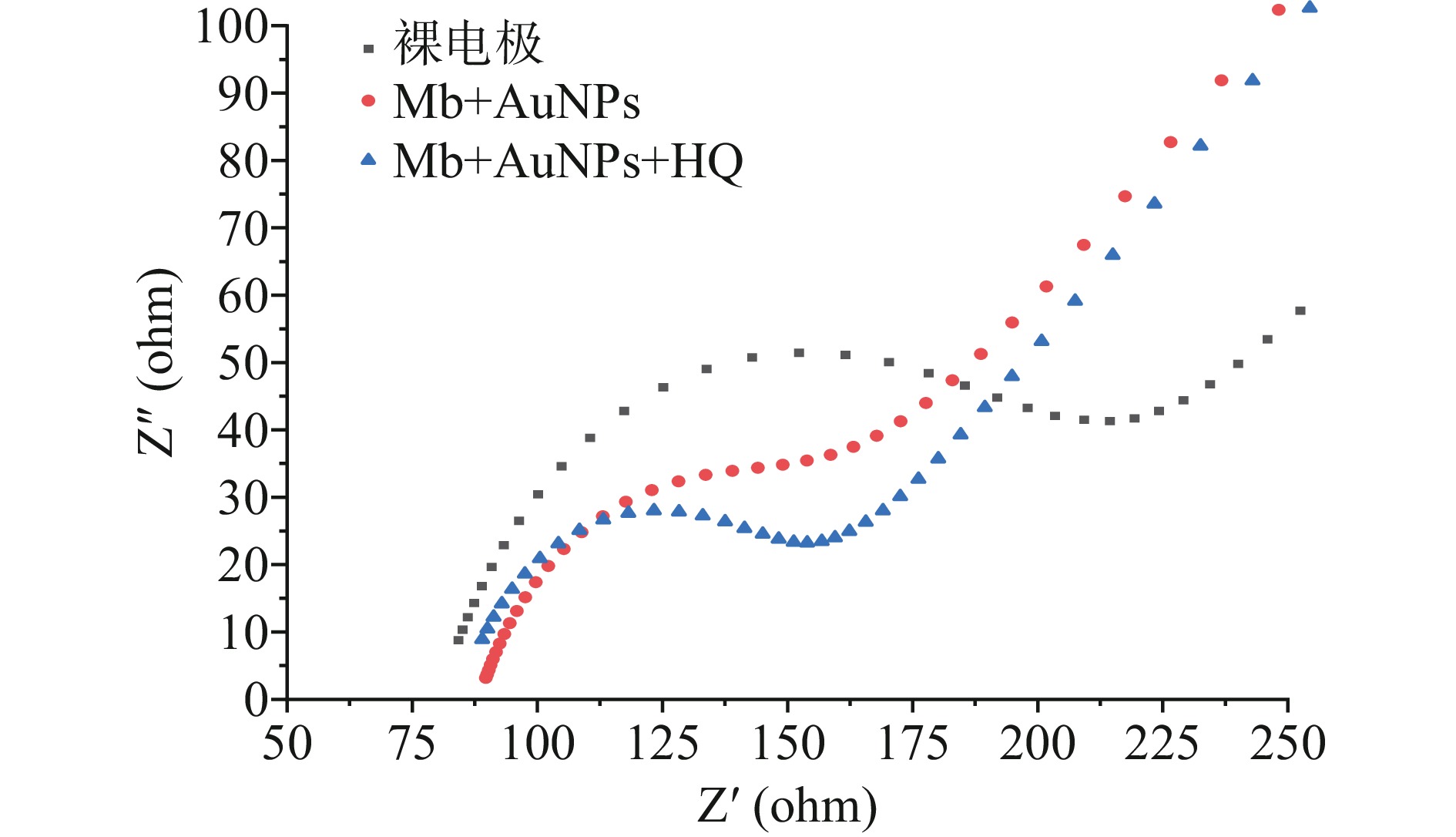
分别将未加入HQ催化Mb合成的Mb@AuNPs和加入HQ催化合成的Mb@AuNPs采用一步电沉积方法修饰到预先处理好的裸金电极表面,采用CV和EIS方法进行表征。由图3可知,当两种方法制备的Mb@AuNPs修饰到裸金电极表面后氧化峰电流均呈增加趋势,表明Mb@AuNPs对电子的转移具有良好的促进作用,且经HQ催化合成的Mb@AuNPs氧化峰电流显著高于未加入HQ催化合成的Mb@AuNPs,表明功能化物质对电子具有良好的转移作用。通过图4可知,与裸电极相比,修饰电极的阻抗弧半径逐渐变小,经HQ催化合成的Mb@AuNPs的阻抗弧半径最小。据文献报道[26],EIS图谱阻抗弧半径的大小表明了电子转移动力学,半径越小,说明功能化物质对电子转移的阻碍作用较小从而促进了电极表面上电子的转移。这一实验结果说明经HQ催化合成的Mb@AuNPs对电极电子转移较好。这是由于HQ的添加,使得HQ和Mb良好地结合在了纳米金的表面,阻止了纳米金的聚集,因此制备的纳米金稳定性更好,呈单分散[28],从而使得经HQ催化合成的Mb@AuNPs氧化峰电流最高,交流阻抗弧半径最小。进一步表明了HQ的添加对Mb还原氯金酸合成纳米金具有正向促进作用。为了提高实验的准确性,本实验采用HQ催化Mb还原氯金酸合成纳米金的方法进行后续实验。
2.3 AA和NO2−在Mb@AuNPs修饰电极上的电化学行为
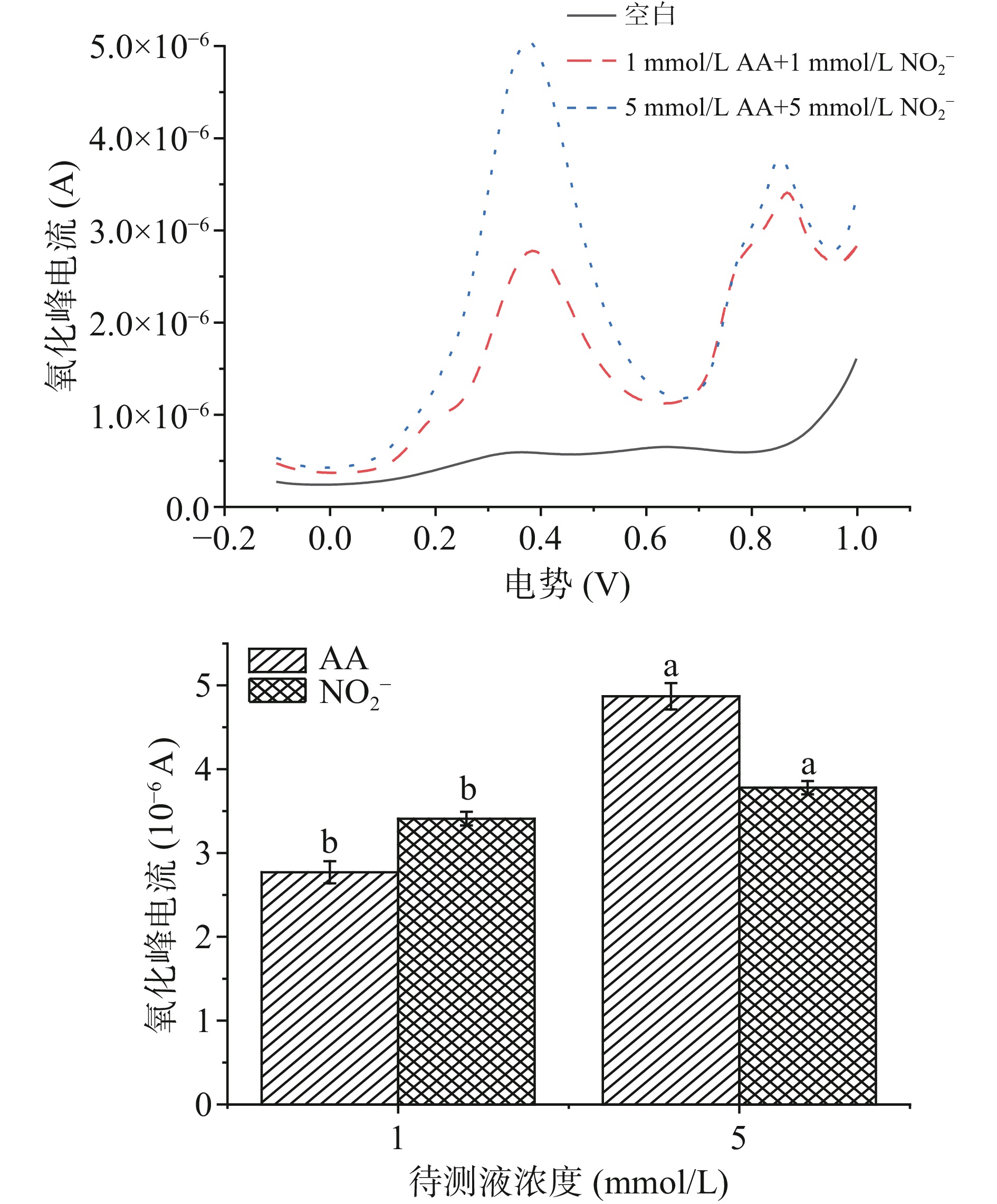
分别取AA和NO2−标准溶液于2 mL 0.1mol/L PBS缓冲溶液中,采用DPV法,对AA和NO2−在Mb@AuNPs修饰电极上的电化学行为进行初步考察。由图5可知,当未加入AA和NO2−标准溶液时,曲线不存在明显的氧化特征峰;当向体系内加入1 mmol/L AA和1 mmol/L NO2−时,出现两个明显且独立的氧化特征峰,且改变AA和NO2−浓度为5 mmol/L AA和5 mmol/L NO2−后,两个独立氧化特征峰峰电流由原来的2.77×10−6 A和3.41×10−6 A显著提高至5.06×10−6 A和3.78×10−6 A(P<0.05),表明Mb@AuNPs修饰电极在检测体系中对AA和NO2−有良好的电流响应,这一实验结果与Kannan等[29]的结果一致,可进一步对实验条件进行优化。
2.4 Mb@AuNPs/Au组装条件优化及电化学性能的表征
2.4.1 电沉积扫速的影响
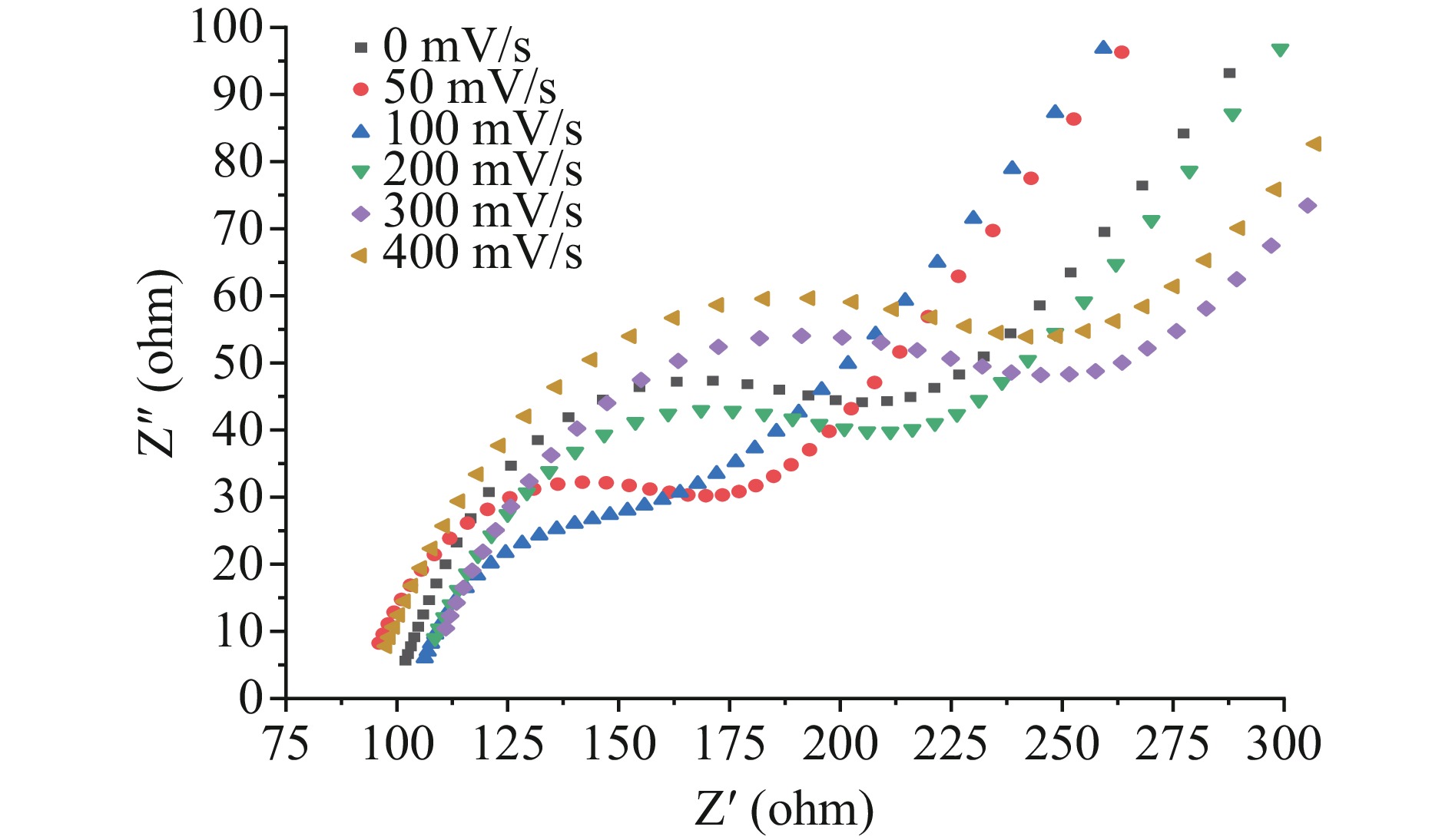
由图6可知,随着电沉积扫速在50~400 mV/s范围内的增加,CV曲线的氧化特征峰峰电流呈先增大后减小的趋势,100 mV/s时呈现最高峰电流。这是由于随着扫速的增加,Mb@AuNPs在电极表面的成膜速度增加,峰电流升高,当扫速过快时,Mb@AuNPs无法在电极表面形成致密的组装膜,从而导致峰电流降低,反应速率下降。由图7可知,圆弧半径同样呈现先减小后增大的趋势。扫速为50~400 mV/s范围制备出的修饰电极Rtc分别为:95.21、87.21、105.67、145.55、170.61 Ω。根据Bahadoran等[11]研究可知,在EIS曲线中,圆弧半径越大对电子传递阻碍作用越大。而这一电阻半径变化的可能原因为随着扫速的增加,电子传递能力呈先升高后降低趋势,当扫速逐渐增加,扫速过快可能导致形成的膜不完整,使电子传递效率下降,从而导致氧化峰电流下降。根据CV和EIS图谱数据,选择100 mV/s作为组装电极的电沉积扫速。
2.4.2 电沉积圈数的影响
由图8可知,随着电沉积圈数的增加,修饰电极的CV曲线氧化峰电流呈先增大后减小的趋势,这一结果与梁彩云等[30]实验结果一致,这可能是由于电沉积圈数的增加会增加修饰物质在电极上的沉积量,因此随着电沉积扫描圈数的增加Mb@AuNPs在电极上形成的膜趋于完整,从而加快了电子传递效率,促进了电子传递,使响应电流增大;但随着电沉积扫描圈数的持续增加,膜厚增加,电子在膜中传递阻力变大, 导致响应电流降低。当制备Mb@AuNPs电极的电沉积圈数为40圈时,获得了较高的响应电流,由图9可知,圆弧半径随沉积圈数的增加呈先减小后增大的趋势,这是因为随着电沉积扫描圈数的增加Mb@AuNPs在电极上形成的膜趋于完整,从而增加了电子传递路径,加快了电子转移速率,因此Rtc减小,但随着电沉积扫描圈数的持续增加,膜厚增加,阻碍了电子的转移[31]。两种表征方法的实验结果相吻合,因此选择电沉积圈数为40圈用于组装电极。
2.5 NO2−和AA同时检测体系条件的优化
2.5.1 缓冲溶液种类的影响
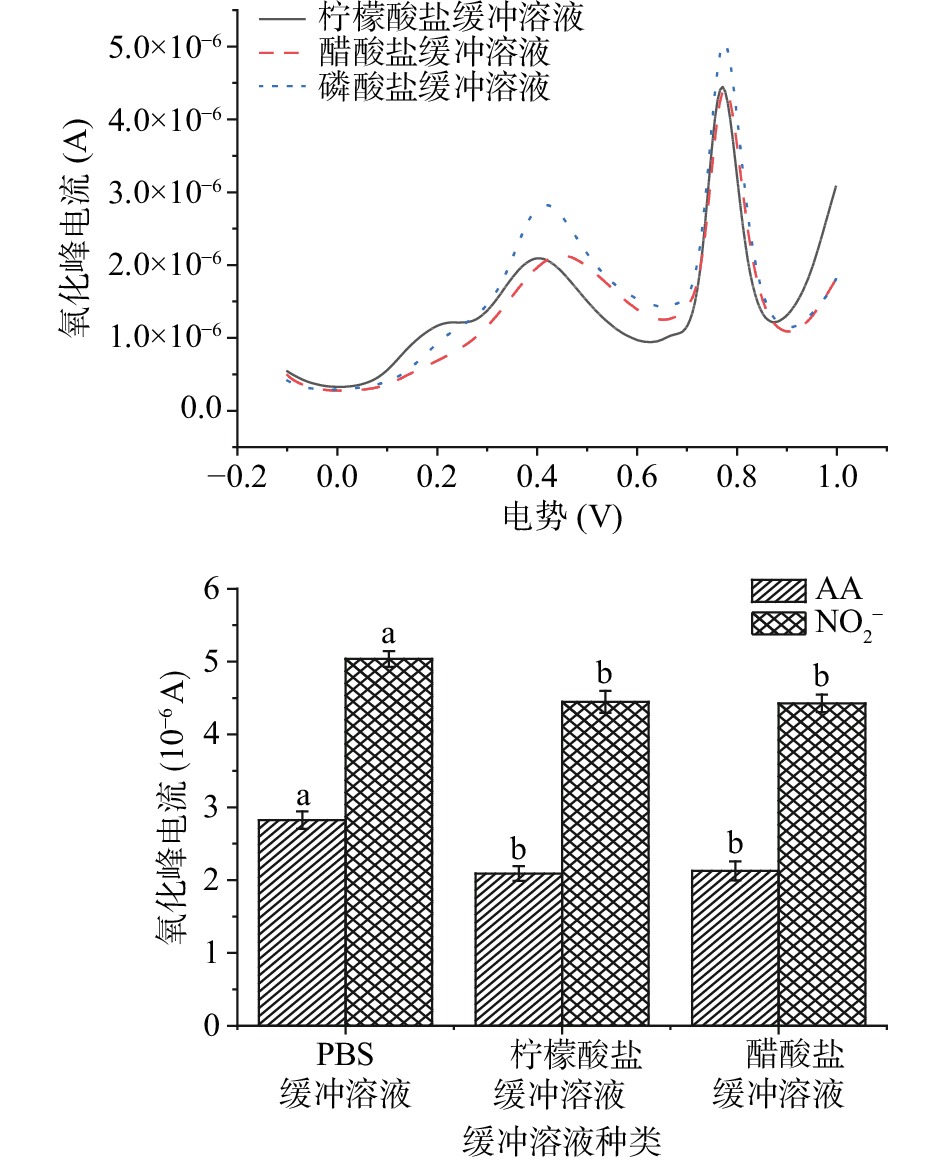
由图10可知,当检测体系缓冲溶液分别为柠檬酸盐、醋酸盐、磷酸盐缓冲溶液时,NO2−和AA氧化峰电流随缓冲溶液种类的不同而发生改变。三种缓冲溶液检测体系中,当缓冲溶液为PBS时,AA和NO2−氧化峰电流均显著高于醋酸盐和柠檬酸盐缓冲溶液(P<0.05),这一实验结果与Chi等[32]研究结果相似。可能是由于检测体系缓冲溶液种类的不同,导致溶液的pKa不同,使得检测体系呈现不同的有效pH,从而在溶液中的电子转移速率不同[33]。因此,为了提高实验灵敏度,选用磷酸盐溶液作为同时检测缓体系的缓冲溶液。
2.5.2 缓冲溶液pH的影响
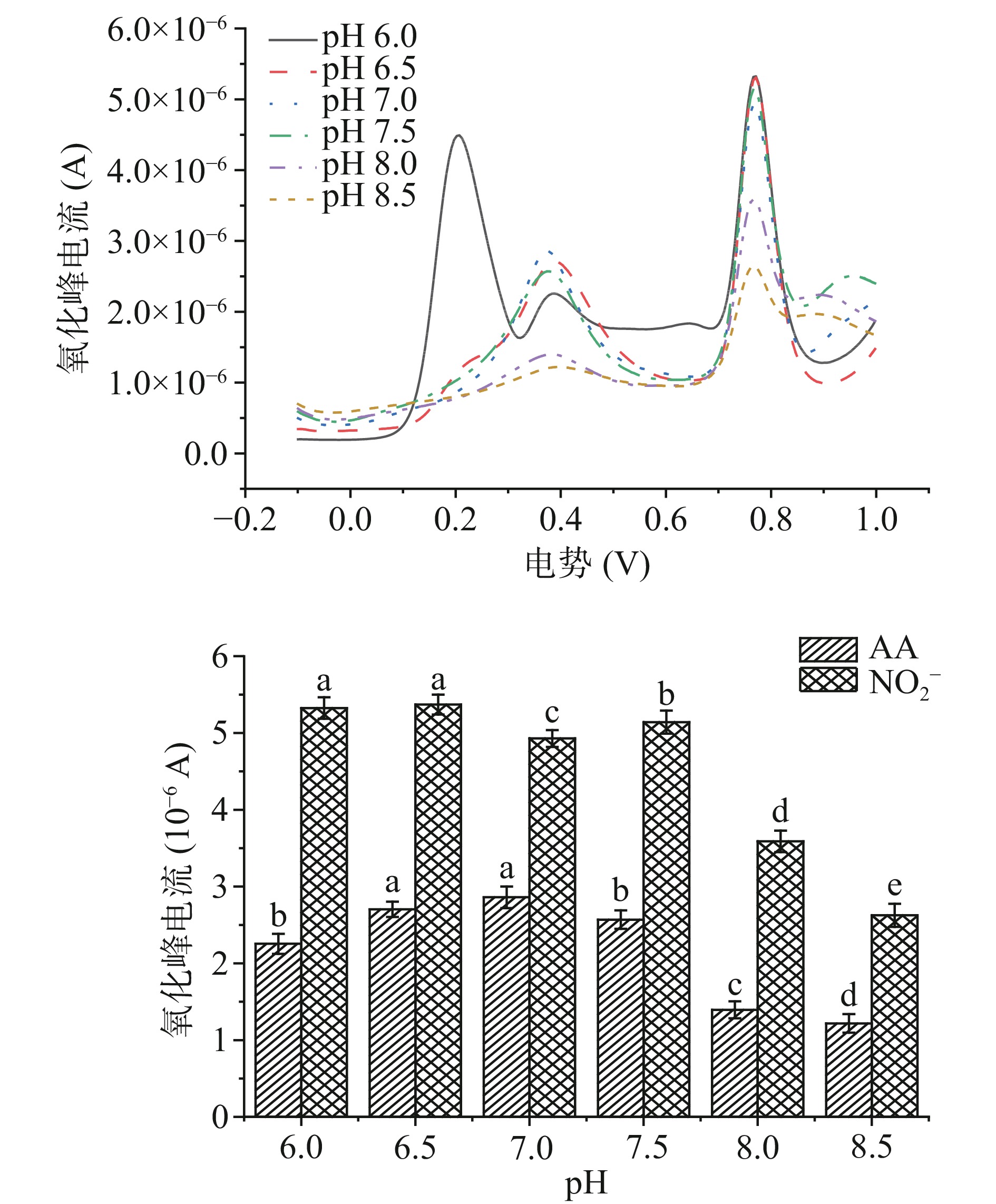
由图11可知,随着缓冲溶液pH的增加,NO2−和AA氧化峰电流呈先增大后减小的趋势;不同pH的缓冲溶液检测NO2−和AA时,氧化峰电流之间具有显著性差异(P<0.05)。这一实验结果与Sun等[34]研究结果相似,其原因可能为根据能斯特方程对溶液中电子转移数进行计算分析结果表明,不同pH导致氧化峰电流不同是由于溶液中质子参与了电极反应过程。当PBS的pH>6.5时,溶液中质子数量降低,导致AA和NO2−在电极上的氧化还原反应能力降低[35]。因此,为了保证试验的准确性和精密度,选用pH6.5的PBS溶液继续后续实验。
2.5.3 缓冲溶液浓度的影响
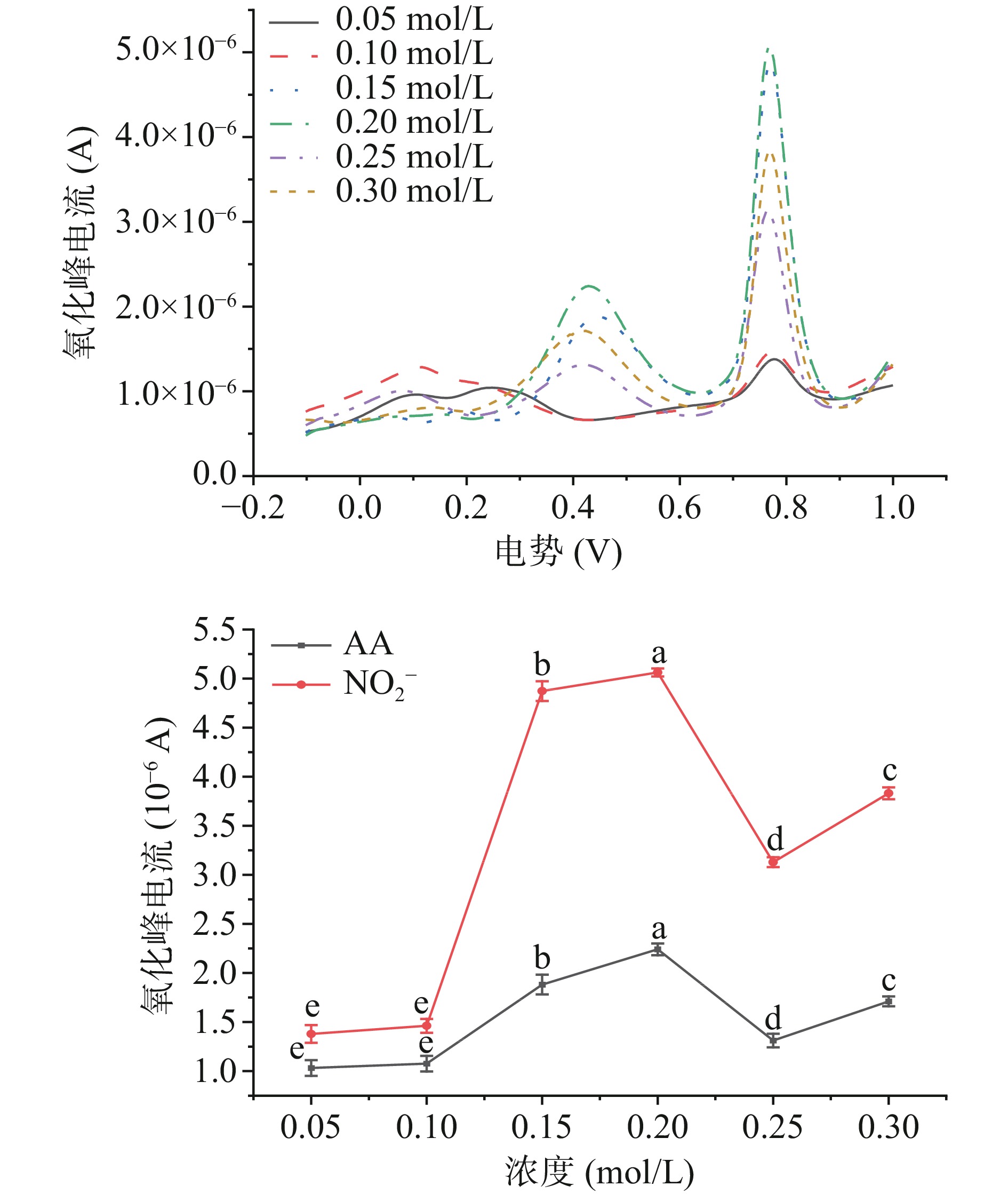
由图12可知,当加入0.05~0.30 mol/L PBS缓冲溶液时,对应的峰电流呈现先增大后减小的趋势。在0.20 mol/L PBS缓冲溶液中,NO2−和AA特征峰获得了最优的电流响应;这一实验结果可能是由于随着缓冲溶液浓度的升高缓冲容量会有一定程度的增大,进而促进电极表面的电子传递速率,氧化峰电流会增,但由于AA和NO2−在电极表面能发生可逆反应,因此当体系缓冲溶液浓度过大时还会限制电子的转移速率,因此电流会发生下降[36]。同时根据DPV可观察到,0.20 mol/L PBS缓冲溶液中AA和NO2−氧化特征峰电位差相比于其余五种浓度相对较大。根据Dodevska等[37]研究可知,不同检测物质之间的特征峰峰电位△E是考察修饰电极进行多组分检测时电化学性能的重要因素。因此,使用0.20 mol/L磷酸缓冲溶液时,不仅提高了NO2−和AA特征峰峰电流,并且改善了Mb@AuNPs修饰电极对NO2−和AA的选择性。
2.6 Mb@AuNPs修饰电极同时检测NO2−和AA标准曲线
如图13所示,随着检测体系内AA和NO2−浓度的升高,氧化还原峰电流明显升高,在线性浓度为2~5600 μmol/L范围内AA浓度和氧化峰电流之间存在明显线性关系,采用Origin 2021软件得到AA拟合曲线及曲线方程分别为Ip=0.31C+1.49,R2=0.9979;在线性浓度为1~6000 μmol/L范围内NO2−浓度和氧化峰电流之间同样存在明显线性关系,采用Origin 2021软件得到NO2−拟合曲线及曲线方程分别为和Ip=3.59C+2.69,R2=0.9978和Ip=1.55C+6.99,R2=0.9928。这一结果说明在此范围内 AA 和NO2−浓度与其峰电流均呈现出良好的线性关系,满足分析要求。采用信噪比(S/N=3)计算其AA和NO2−最低检出限分别为0.57和0.31 μmol/L;定量限分别为1.90和1.03 μmol/L。
为了更好地评估Mb@AuNPs/Au电极对AA和NO2−检测性能,将结果与文献报道结论进行比较,如表1所示。与表1其他研究相比,本法检测体系以对苯二酚催化Mb还原氯金酸合成纳米金,制备的Mb@AuNPs/Au具有功能化物质结构简单,修饰电极稳定性高且纳米金在电极表面分散性好等优势,使得构建的同时检测体系在相对较宽线性范围内具有良好的灵敏度和较低的检出限。
表 1 几种修饰电极同时检测NO2−和AA的比较Table 1. Comparison of some modified electrodes in the determination of NO2− and AA2.7 Mb@AuNPs修饰电极同时检测的重现性和稳定性
采用相同的Mb@AuNPs/Au对NO2−和AA进行同时测定,重复测定10次,Mb@AuNPs/Au对AA和NO2−同时测定的平均峰电流分别为4.460×10−5 A和5.860×10−5 A;RSD分别为0.59%和0.64%,证明了该修饰电极具有良好的重现性;将制备好的电极放置空气14 d后,对AA和NO2−同时测定时,氧化峰电流分别为4.366×10−5 A和5.754×10−5 A,与平均峰电流相比分别下降2.11%和1.81%(<5%),证明以对苯二酚催化Mb合成的纳米金在金电极表面分散好,提高了Mb@AuNPS/Au的稳定性。
2.8 实际样品分析
按1.2.7对实际样品进行前处理,采用标准加入法对样品中NO2−和AA的加标回收率进行测定,结果如表2所示。将大白菜和苹果分别在常温下贮藏3、6、9 d后,进行样品前处理后,对其进行回收率测定,测定结果如表3。
表 2 同时测定时AA和NO2−的回收率Table 2. Recovery rate of AA and NO2− in simultaneous determination样品 AA初始量
(mg/100 mL)NO2−初始量
(mg/L)加标量
(mg/L)AA测定量
(mg/100 mL)NO2−测定量
(mg/L)AA回收率
(%)NO2−回收率
(%)AA RSD
(%)NO2− RSD
(%)菠菜 0.47 0.72 1 1.48 1.78 102.84 109.26 1.87 2.03 5 5.44 5.73 93.60 102.15 2.64 2.89 10 10.46 10.69 102.84 96.75 2.64 2.12 大白菜 0.32 0.61 1 1.30 10.58 93.75 95.08 1.83 2.33 5 5.33 5.60 103.13 98.90 2.80 1.99 10 10.31 10.31 99.03 99.02 1.39 1.87 西红柿 0.19 0.41 1 1.18 1.38 94.74 93.49 2.16 2.07 5 5.20 5.19 99.99 101.76 2.91 1.54 10 10.20 10.20 103.51 103.51 1.89 1.63 水晶梨 0.4 未检出 1 1.36 0.98 90.01 98.00 2.45 2.23 5 5.37 5.09 94.89 101.80 1.72 1.43 10 10.39 9.99 97.50 99.90 1.70 2.74 苹果 0.51 0.39 1 1.48 1.38 94.12 97.44 2.12 2.21 5 5.50 5.37 98.03 94.87 1.81 1.98 10 10.49 10.39 96.08 99.99 1.99 2.01 橘子 1.48 0.27 1 2.49 1.26 100.68 96.30 1.23 1.81 5 6.46 5.25 98.65 92.59 1.51 1.02 10 11.48 10.27 99.99 100.00 2.44 1.07 表 3 果蔬中NO2−和AA贮存期间测定的回收率Table 3. Recovery rate of NO2− and AA in fruits and vegetables during storage样品 不同贮存时间
NO2−含量(mg/L)不同贮存时间
NO2−测定回收率(%)不同贮存时间
AA含量(mg/100 mL)不同贮存时间
AA测定回收率(%)0 d 3 d 6 d 9 d 3 d 6 d 9 d 0 d 3 d 6 d 9 d 3 d 6 d 9 d 大白菜 0.61c 0.62c 0.71b 0.75a 95.17 91.55 92.00 0.32a 0.31a 0.31a 0.27b 90.32 93.54 92.60 苹果 0.39c 0.39c 0.44b 0.47a 94.89 93.18 91.50 0.51a 0.51a 0.47b 0.44c 94.12 95.74 90.91 由表2可知,蔬菜中亚硝含量明显高于水果中,不同样品中NO2−和AA同时测定时加标回收率分别为92.59%~109.26%和90.01%~103.51%,RSD均小于5%,根据GB 2760-2014《食品添加剂使用标准》,对果蔬中抗坏血酸和亚硝酸钠最大使用量分别为0.15和5.0 g/kg,本法实际样品中的NO2−和AA的加标量符合国家标准添加量,表明实验具有良好的准确性和可靠性。
由表3可知,随着贮藏时间的延长,同时测定时果蔬中亚硝酸盐的含量呈现上升的趋势,而抗坏血酸有下降的趋势[40],且AA和NO2−含量变化具有显著性差异(P<0.05)。对贮藏不同天数大白菜和苹果中NO2−和AA的回收率进行测定,其回收率区间为91.50%~95.17%和90.32%~95.74%。表明该实检测体系对亚硝酸盐和抗坏血酸的测定可进行实际应用。
3. 结论
本文采用对苯二酚催化甲烷氧化菌素还原氯金酸合成纳米金,降低了纳米金团聚的可能,使得纳米金能够稳定的分散在金电极表面。通过电沉积法将HQ催化合成的Mb@AuNPs修饰到裸金电极表面,制备出的Mb@AuNPs/Au相比于未加入HQ的Mb@AuNPs/Au具有对电子传递速率加快和电子转移阻碍更小的优势。考察了AA和NO2−在修饰电极上的电化学行为,并最终得到优化条件,优化条件下修饰电极同时检测AA和NO2−的线性关系良好,相关系数R2>0.9928,检出限分别为0.57和0.31 μmol/L;同时通过实际样品加标回收率实验表明该方法具有良好的准确性和可靠性,因此本法可用于亚硝酸盐和抗坏血酸含量的同时检测,为果蔬中及其制品品质评价指标的测定方法提供参考。但目前由于电极表面易受空气氧化,经功能性物质修饰后,在本实验中电极在空气中贮存期为14 d较短,以期在今后相关研究中,可实现延长电极在空气中贮存时间,但不影响对实际样品的检测效果的目标。
-
表 1 几种修饰电极同时检测NO2−和AA的比较
Table 1 Comparison of some modified electrodes in the determination of NO2− and AA
表 2 同时测定时AA和NO2−的回收率
Table 2 Recovery rate of AA and NO2− in simultaneous determination
样品 AA初始量
(mg/100 mL)NO2−初始量
(mg/L)加标量
(mg/L)AA测定量
(mg/100 mL)NO2−测定量
(mg/L)AA回收率
(%)NO2−回收率
(%)AA RSD
(%)NO2− RSD
(%)菠菜 0.47 0.72 1 1.48 1.78 102.84 109.26 1.87 2.03 5 5.44 5.73 93.60 102.15 2.64 2.89 10 10.46 10.69 102.84 96.75 2.64 2.12 大白菜 0.32 0.61 1 1.30 10.58 93.75 95.08 1.83 2.33 5 5.33 5.60 103.13 98.90 2.80 1.99 10 10.31 10.31 99.03 99.02 1.39 1.87 西红柿 0.19 0.41 1 1.18 1.38 94.74 93.49 2.16 2.07 5 5.20 5.19 99.99 101.76 2.91 1.54 10 10.20 10.20 103.51 103.51 1.89 1.63 水晶梨 0.4 未检出 1 1.36 0.98 90.01 98.00 2.45 2.23 5 5.37 5.09 94.89 101.80 1.72 1.43 10 10.39 9.99 97.50 99.90 1.70 2.74 苹果 0.51 0.39 1 1.48 1.38 94.12 97.44 2.12 2.21 5 5.50 5.37 98.03 94.87 1.81 1.98 10 10.49 10.39 96.08 99.99 1.99 2.01 橘子 1.48 0.27 1 2.49 1.26 100.68 96.30 1.23 1.81 5 6.46 5.25 98.65 92.59 1.51 1.02 10 11.48 10.27 99.99 100.00 2.44 1.07 表 3 果蔬中NO2−和AA贮存期间测定的回收率
Table 3 Recovery rate of NO2− and AA in fruits and vegetables during storage
样品 不同贮存时间
NO2−含量(mg/L)不同贮存时间
NO2−测定回收率(%)不同贮存时间
AA含量(mg/100 mL)不同贮存时间
AA测定回收率(%)0 d 3 d 6 d 9 d 3 d 6 d 9 d 0 d 3 d 6 d 9 d 3 d 6 d 9 d 大白菜 0.61c 0.62c 0.71b 0.75a 95.17 91.55 92.00 0.32a 0.31a 0.31a 0.27b 90.32 93.54 92.60 苹果 0.39c 0.39c 0.44b 0.47a 94.89 93.18 91.50 0.51a 0.51a 0.47b 0.44c 94.12 95.74 90.91 -
[1] 张遴, 姚晓瑜, 王昌钊, 等. 11种蔬菜中亚硝酸盐含量稳定性研究[J]. 食品研究与开发,2017,38(9):188−191. [ZHANG L, YAO X Y, WANG C Z, et al. Study on stability of the nitrite content in 11 kinds of vegetables[J]. Food Research and Development,2017,38(9):188−191. [2] 刘俊, 谢骏, 金根娣. 常用食品添加剂对果蔬汁中维生素C含量的影响研究[J]. 食品安全导刊,2021(21):120−121. [LIU J, XIE J, JIN G D. Effect of common food additives on vitamin C content in fruit and vegetable juice[J]. China Food Safety Magazine,2021(21):120−121. [3] KUNTOLAKSONO S, JOELIANINGSIH J, YOSHI L A, et al. Bibliometric analysis of global research trends on electrochemical nitrite sensing using scopus database[J]. Analytical and Bioanalytical Electrochemistry,2022,14(7):680−695.
[4] 冷桃花, 万丽佳, 翁史昱, 等. 蔬菜中亚硝酸盐和硝酸盐检测技术研究进展[J]. 食品安全质量检测学报,2020,11(19):6970−6976. [LENG T H, WAN L J, WENG S Y, et al. Research progress in the detection technology of nitrite and nitrate in vegetables[J]. Food Safe Qual Detec Technol,2020,11(19):6970−6976. [5] ÜZER A, SAĞLAM Ş, CAN Z, et al. Electrochemical determination of food preservative nitrite with gold nanoparticles/p-aminothiophenol-modified gold electrode[J]. International Journal of Molecular Sciences,2016,17(8):1253. doi: 10.3390/ijms17081253
[6] 杨建飞, 马倩, 左勇, 等. 亚硝酸盐快速检测试剂研究及其在酱腌菜中的应用[J]. 食品科学,2021,42(18):321−328. [YANG J F, MA Q, ZUO Y, et al. A spectrophotometric reagent for the rapid detection of nitrite and its application to pickles[J]. Food Sci,2021,42(18):321−328. [7] WANG Q H, YU L J, LIU Y, et al. Methods for the detection and determination of nitrite and nitrate: A review[J]. Talanta,2017,165:709−720. doi: 10.1016/j.talanta.2016.12.044
[8] SIEGEL J M, SCHILLY K M, WIJESINGHE M B, et al. Optimization of a microchip electrophoresis method with electrochemical detection for the determination of nitrite in macrophage cells as an indicator of nitric oxide production[J]. Analytical Methods,2019,11(2):148−156. doi: 10.1039/C8AY02014K
[9] 冯亮, 余科, 杨艳, 等. pH值对“L-抗坏血酸-L-半胱氨酸-甘氨酸”体系挥发性物质形成的影响[J]. 中国食品学报,2022, 22(4): 44-54. FENG L, YU K, YANG Y, et al. Effects of pH on the formation of flavor compounds in the L-ascorbic acid-L-cysteine-glycine[J]. Journal of Chinese Institute of Food Science and Technology System,2022, 22(4): 44-54.
[10] LI X, ZHOU C H, ZI Q, et al. An electrochemical signal transduction amplification strategy for ultrasensitive detection of ascorbic acid[J]. Journal of Electroanalytical Chemistry,2016,780:321−326. doi: 10.1016/j.jelechem.2016.09.038
[11] BAHADORAN Z, MIRMIRAN P, JEDDI S, et al. Nitrate and nitrite content of vegetables, fruits, grains, legumes, dairy products, meats and processed meats[J]. Journal of Food Composition and Analysis,2016,51:93−105. doi: 10.1016/j.jfca.2016.06.006
[12] REDDY Y V M, SRAVANI B, AGARWAL S, et al. Electrochemical sensor for detection of uric acid in the presence of ascorbic acid and dopamine using the poly (DPA)/SiO2@ Fe3O4 modified carbon paste electrodee electrode[J]. Journal of Electroanalytical Chemistry,2018,820:168−175. doi: 10.1016/j.jelechem.2018.04.059
[13] 徐艺伟, 朱丹, 石吉勇, 等. 原位合成铜基金属有机框架差分脉冲伏安法快速检测肉制品中亚硝酸盐[J]. 食品科学,2021,42(16):267−272. [XU Y W, ZHU D, SHI J Y, et al. Rapid detection of nitrite in meat products by in-situ synthesized Cu-based metal organicframeworks coupled with differential pulse voltammetry[J]. Food Sci,2021,42(16):267−272. [14] LI L, LIU D, WANG K, et al. Quantitative detection of nitrite with N-doped graphene quantum dots decorated N-doped carbon nanofibers composite-based electrochemical sensor[J]. Sensors and Actuators B: Chemical,2017,252:17−23. doi: 10.1016/j.snb.2017.05.155
[15] LIN H, DING L, ZHANG B, et al. Detection of nitrite based on fluorescent carbon dots by the hydrothermal method with folic acid[J]. Royal Society Open Science,2018,5(5):172149. doi: 10.1098/rsos.172149
[16] 罗大娟, 刘冰倩, 覃蒙颜, 等. 基于Au/rGO/FeOOH的新型电化学传感器一步检测亚硝酸盐[J/OL]. 电化学: 1−14[2022−06−07]. DOI: 10.13208/j. electrochem. 211019. LUO D J, LIU B Q, QIN M Y, et al. A Novel electrochemical sensor based on Au/GO/FeOOH for one-step detection of nitrite[J/OL]. Electrochemistry: 1−14[2022−06−07]. DOI: 10.13208/j.electrochem.211019.
[17] YAN M, YU B, DONG X H, et al. Research progress on nitrite electrochemical sensor[J]. Chinese Journal of Analytical Chemistry,2018,46(2):147−155. doi: 10.1016/S1872-2040(17)61066-1
[18] JILANI B S, MALATHESH P, MRUTHYUNJAYACHARI C D, et al. Cobalt (II) tetra methyl-quinoline oxy bridged phthalocyanine carbon nano particles modified glassy carbon electrode for sensing nitrite: A voltammetric study[J]. Materials Chemistry and Physics,2020,239:121920. doi: 10.1016/j.matchemphys.2019.121920
[19] MEJRI A, MARS A, ELFIL H, et al. Curcumin graphite pencil electrode modified with molybdenum disulfide nanosheets decorated gold foams for simultaneous quantification of nitrite and hydrazine in water samples[J]. Analytica Chimica Acta,2020,1137:19−27.
[20] WANG Q, KHUNGWA J, LI L, et al. Fabrication of polyoxometalate/GO/PDDA hybrid nanocomposite modified electrode and electrocatalysis for nitrite ion, ascorbic acid and dopamine[J]. Journal of Electroanalytical Chemistry,2018,824:91−98. doi: 10.1016/j.jelechem.2018.07.043
[21] ZHANG L, FENG J, CHOU K C, et al. Simultaneously electrochemical detection of uric acid and ascorbic acid using glassy carbon electrode modified with chrysanthemum-like titanium nitride[J]. Journal of Electroanalytical Chemistry,2017,803:11−18. doi: 10.1016/j.jelechem.2017.09.006
[22] 张伟. 甲烷氧化菌素模拟SOD的光谱学与电化学研究[D]. 哈尔滨: 哈尔滨商业大学, 2018 ZHANG W. Spectroscopic and electrochemical investigations of methanbactin Mimic SOD[D]. Harbin: Harbin University of Commerce, 2018.
[23] 窦博鑫, 辛嘉英, 王振兴, 等. 甲烷氧化菌素功能化金纳米层层自组装修饰电极上过氧化氢的催化还原[J]. 分子催化,2017,31(6):534−543. [DOU B X, XIN J Y, WANG Z X, et al. Multilayer self-assembly modified electrode of methanobactin functionalized goldnanoparticle to catalytic reduction of hydrogen peroxide[J]. Molecular Catalysis,2017,31(6):534−543. [24] 王春艳, 周健, 汤洪波, 等. 基于石墨烯构建的电化学传感器测定抗坏血酸[J]. 现代食品科技,2021,37(5):319−324, 295. [WANG C Y, ZHOU J, TANG H B, et al. Determination of ascorbic acid by electrochemical sensor based on graphene[J]. Modern Food Science & Technology,2021,37(5):319−324, 295. [25] HE B S, ZHANG J X. Rapid detection of ascorbic acid based on a dual-electrode sensor system using a powder microelectrode embedded with carboxyl multi-walled carbon nanotubes[J]. Sensors,2017,17(7):1549. doi: 10.3390/s17071549
[26] 张铁男, 辛嘉英, 张秀凤, 等. 甲烷氧化菌素催化纳米金合成[J]. 分子催化,2013,27(2):192−197. [ZHANG T N, XIN J Y, ZHANG X F, et al. Methanobactin-catalyzed synthesis of gold nanoparticles[J]. Molecular Catalysis,2013,27(2):192−197. [27] 王艳辉. 多酚相互作用对金纳米法测定抗氧化能力结果的影响[D]. 北京: 北京林业大学, 2020. WANG Y H. Interaction effects on a gold nanoparticles-based assay for antioxidantcapacity evaluation of polyphenols[J]. Beijing: Beijing Forestry University, 2020.
[28] 陈丹丹. 甲烷氧化菌素介导纳米金合成检测三聚氰胺的机理[D]. 哈尔滨: 哈尔滨商业大学, 2014 CHEN D D. Mechanism of melamine detection bymethanobactin-mediated synthesis of goldnanoparticles[D]. Harbin: Harbin University of Commerce, 2014.
[29] KANNAN A, SIVANESAN A, KALAIVANI G, et al. A highly selective and simultaneous determination of ascorbic acid, uric acid and nitrite based on a novel poly-N-acetyl-l-methionine (poly-NALM) thin film[J]. RSC advances,2016,6(99):96898−96907. doi: 10.1039/C6RA18440E
[30] 梁彩云, 刘凤平, 张翠忠, 等. 基于铜纳米粒子/氧化锌/石墨烯修饰电极的电化学方法测定硫酸卡那霉素[J]. 分析化学,2019,47(5):739−747. [LIANG C Y, LIU F P, ZHANG C Z, et al. Electrochemical determination of kanamycin sulfate based on copper nanoparticle/zincoxide/graphene modified electrode[J]. Analytical Chemistry,2019,47(5):739−747. [31] 赵燕荣. 基于电化学传感器的吗啡检测方法研究[D]. 苏州: 苏州大学, 2009: 21 ZHAO Y R. Study on detection method of morphine based on electrochemical sensor[D]. Suzhou: Suzhou University, 2009: 21.
[32] CHI K N, HU R, YANG Y H. An ultrasensitive photoelectrochemistry sensor for ascorbic acid based on etching perylenediimide modified CoOOH nanosheets[J]. Materials Express,2019,9(7):741−748. doi: 10.1166/mex.2019.1554
[33] KOYUN O, SAHIN Y. Voltammetric determination of nitrite with gold nanoparticles/poly (methylene blue)-modified pencil graphite electrode: Application in food and water samples[J]. Ionics,2018,24(10):3187−3197. doi: 10.1007/s11581-017-2429-7
[34] SUN L P, LI H J, LI M J, et al. Simultaneous determination of ascorbic acid, dopamine, uric acid, tryptophan, and nitrite on a novel carbon electrode[J]. Journal of Electroanalytical Chemistry,2016,783:167−175. doi: 10.1016/j.jelechem.2016.11.026
[35] CHEN H Y, YANG T, LIU F Q, et al. Electrode position of gold nanoparticles on Cu-based metal-organic framework for the electrochemical detection of nitrite[J]. Sensors and Actuators,2019,286(18):401−407.
[36] 叶耘峰. 基于碳纳米金复合材料电化学检测 BHA[J]. 食品工业,2020,41(11):293−296. [YE Y F. Electrochemical detection of BHA based on carbon nano gold composite[J]. Food Industry,2020,41(11):293−296. [37] DODEVSKA T, SHTEREV I, LAZAROVA Y. An electrochemical sensing platform based on iridium oxide for highly sensitive and selective detection of nitrite and ascorbic acid[J]. Acta Chimica Slovenica,2018,65(4):970−979.
[38] ZHANG Y, WEN F, HUANG Z, et al. Nitrogen doped lignocellulose/binary metal sulfide modified electrode: Preparation and application for non-enzymatic ascorbic acid, dopamine and nitrite sensing[J]. Journal of Electroanalytical Chemistry,2017,806:150−157. doi: 10.1016/j.jelechem.2017.10.066
[39] KEMMEGNE-MBOUGUEN J C, ANGNES L. Simultaneous quantification of ascorbic acid, uric acid and nitrite using a clay/porphyrin modified electrode[J]. Sensors and Actuators B: Chemical,2015,212:464−471. doi: 10.1016/j.snb.2015.02.046
[40] 毛燚杰, 何晋浙. 新鲜蔬菜与烹调蔬菜中亚硝酸盐及VC的变化规律[J]. 食品与发酵工业,2016,42(8):166−170. [MAO Y J, HE J Z. The changes of nitrite and VC in fresh vegetables and cooked vegetables[J]. Food and Fermentation Industries,2016,42(8):166−170. -
期刊类型引用(3)
1. 郭新颖. 柱前衍生-高效液相色谱法测定鱼类中组胺. 化学分析计量. 2024(01): 12-16 .  百度学术
百度学术
2. 王建凤,冯月超,王颖,刘艳,周阳,刘佳. 鱼露中章鱼胺含量分析及衍生化产物结构推断. 分析仪器. 2024(04): 64-69 .  百度学术
百度学术
3. 卢竹阳,邵彪,王琳琳,许晶晶,张霞,李玲玉,沈蕾. 冷藏时间对大黄鱼、鲳鱼中生物胺含量变化的影响. 肉类研究. 2024(11): 41-46 .  百度学术
百度学术
其他类型引用(1)






 下载:
下载:




 下载:
下载:



