Comparison of Peptide Composition and in Vitro Antioxidant Activity of Different Hydrolysates of Turbot Meat
-
摘要: 为研究熟化、模拟消化和酶解对多宝鱼肉水解物抗氧化活性的影响,本研究分别采用碱性蛋白酶和胃蛋白酶-胰蛋白酶水解多宝鱼生肉和熟肉,制备生肉碱性蛋白酶水解物、熟肉碱性蛋白酶水解物、生肉体外模拟消化产物和熟肉模拟消化产物,并评价其水解度、相对分子质量分布、氨基酸组成、肽段组成和体外抗氧化活性的差异。结果表明:生肉碱性蛋白酶水解物的水解度最高,为20.18%;4种水解物的分子质量分布差异明显,共有肽段仅有1条,但氨基酸组成没有显著性差异;碱性蛋白酶水解物以肽段小于1000 Da的组分为主,2~4肽的含量达64.57%~51.73%,而模拟消化产物中1000~3000 Da的组分占比超过50%,以多肽(>10)为主,熟化过程会减少小肽(<6)的比例;体外抗氧化活性分析显示,碱性蛋白酶水解物的抗氧化活性均高于模拟消化样品,熟化会降低生肉碱性蛋白酶水解物的抗氧化能力,生肉碱性蛋白酶水解物具有最高的超氧阴离子和羟基自由基清除能力,以及最佳的铁离子还原能力。因此,碱性蛋白酶是优于模拟消化的多宝鱼蛋白水解方式,鱼肉的熟化总体上会降低水解物的抗氧化能力。Abstract: To investigate the effect of ripening, simulated digestion and enzymatic hydrolysis on the antioxidant ability of turbot hydrolysis, alcalase and simulated digestion were applied to hydrolyze the raw and ripening turbot meat to prepare the raw meat alkaline protease hydrolysate, ripening meat alkaline protease hydrolysate, raw meat simulated digestion product and ripening meat simulated digestion product. The degree of hydrolysis, molecular weight distribution, amino acid composition, peptides composition and in vitro antioxidant activities were compared. The results showed that the degree of hydrolysis of the raw meat alkaline protease hydrolysate was the highest, which was 20.18%. The molecular weight (MW) distribution of four samples varied greatly, only one peptides were shared, but the amino acid composition presented insignificant difference. The MW distribution of alcalase hydrolysates were mainly lower than 1000 Da, the 2~4 peptides accounted for 64.57%~51.73% of the detected peptides sequences. While, in the simulated digestion samples, the 1000~3000 Da peptides fraction accounted for over 50%, and dominated by polypeptides (>10 length). Ripening diminished the proportion of small peptides (<6 length). In vitro antioxidant ability assays indicated that alcalase hydrolysates exhibited stronger antioxidant abilities than simulated digestion products, ripening reduced the antioxidant abilities of the raw meat alkaline protease hydrolysate. The raw meat alkaline protease hydrolysate presented the best superoxide anion and hydroxyl radical scavenging ability, as well as the highest ferric reducing ability. Therefore, alcalase is superior to simulated digestion in hydrolyzing turbot meat, ripening will ameliorate the antioxidant ability of turbot meat hydrolysates.
-
Keywords:
- turbot /
- enzymatic hydrolysis /
- simulated digestion /
- antioxidation /
- amino acid composition /
- bioactive peptide
-
人体细胞中过多的自由基若无法及时清除,就会攻击机体内的生物大分子及各种细胞器,产生的一系列氧化应激反应将造成机体损伤,进而加速衰老进程并诱发各种疾病,如癌症、糖尿病、冠心病和阿尔茨海默氏症等诸多疾病[1-2]。目前,市场上的化学合成抗氧剂虽能有效地清除自由基,减缓氧化应激反应,但对人体有一定的副作用,不利于健康[3]。因此,寻找安全有效天然的抗氧化剂成为功能性食品领域的研究热点。研究发现,蛋白质经降解后将形成由2~20个氨基酸组成的生物活性肽,其具有抗氧化、抗菌、降血压、免疫调节等多种生物学功能[4]。大量研究表明,抗氧化肽可通过清除活性氧、螯合过渡金属和抑制脂质过氧化等方式来保护机体[5-6],这也使生物活性肽成为天然抗氧化剂研发的重点方向之一。
鱼肉蛋白质含量丰富,是抗氧化肽的重要来源。如包斐等[7]以体外抗氧化活性为指标,优化了长蛇鲻鱼抗氧化肽的最佳制备条件;李亚会等[8]从远东拟沙丁鱼水解物中鉴定出氨基酸序列为Phe-Ala-His-Asp-Asp-Pro的多肽,其ABTS阳离子自由基清除率达76.35%。在日常饮食中,鱼肉以熟食、生鱼片这2种形式被人们食用摄入,在胃肠道消化过程中进一步被消化酶水解转化为多肽和氨基酸,最终被人体吸收发挥其营养价值和生理活性。有研究表明,胃肠消化过程会降低[9]或增加[10]蛋白水解物的抗氧化活性。因此,当原料相同时,酶解和胃肠道消化以及原料的预熟化对鱼肉酶解特性及产物抗氧化活性的影响还有待进一步研究。
多宝鱼(Scophthalmus maximus)又称大菱鲆,是我国引入的海水养殖品种,具有蛋白含量高,肉质鲜美和生长迅速等优点,在中国年产量约为6万吨,位居世界首位[11]。已有研究表明多宝鱼是制备抗氧化肽的良好来源[12-13],且本课题组前期对石斑鱼、多宝鱼、章红鱼、马鲛鱼、金鲳鱼、白鲳鱼及扒皮鱼等7种海水鱼肉碱性蛋白酶水解物的抗氧化活性进行预实验,发现多宝鱼水解物的抗氧化活性最高。故本研究以多宝鱼鱼肉为原料,分别采用胃肠道消化、碱性蛋白酶水解多宝鱼熟肉和生肉,制备不同的多宝鱼水解物,通过比较水解度、相对分子质量分布、氨基酸组成、体外抗氧化活性和肽段组成差异,明确鱼肉加工方式对多宝鱼肽抗氧化活性的影响,为多宝鱼肉的利用提供科学依据。
1. 材料与方法
1.1 材料与仪器
鲜活多宝鱼 南昌水产品综合批发市场;胃蛋白酶(250000 U/g)、胰蛋白酶(250000 U/g)、碱性蛋白酶(200000 U/g)、2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2'-Azinobis-(3-ethylbenzthiazoline-6-sulphonate,ABTS) 北京Solarbio公司;焦性没食子酸(分析纯)、细胞色素C(色谱纯)、甲酸(色谱纯) 上海阿拉丁生化科技有限公司;乙腈、甲醇 色谱纯,上海泰坦科技股份有限公司;抑肽酶、L-羟脯氨酸(色谱纯)、L-氧化型谷胱甘肽(色谱纯) 上海源叶生物科技有限公司;其他试剂均为国产分析纯。
SR-AON-50型冷冻干燥机 上海舍岩仪器有限公司;SKD-800型自动凯氏定氮仪 上海沛欧分析仪器有限公司;EASY-nLC 1000型高效液相 赛默飞世尔科技(中国)有限公司;PHSJ-4F pH计 上海仪电科学仪器有限公司;Synergy H1酶标仪 美国Bio Tek公司;L-8900型氨基酸分析仪 日本Hitachi公司。
1.2 实验方法
1.2.1 鱼糜制备
鲜活多宝鱼→去鱼鳞内脏→去皮去骨取肉→搅碎→生肉鱼糜→−20 ℃冰箱中保存待用。
蒸制熟化:多宝鱼肉→100 ℃沸水蒸制10 min→搅碎→熟肉泥→−20 ℃冰箱中保存待用。
1.2.2 碱性蛋白酶水解物的制备
参照Ma等[14]的方法进行酶解,各取12 g生肉鱼糜和熟肉泥,加入240 mL去离子水,调节pH至9,最后加入600 mg碱性蛋白酶在55 ℃恒温水浴锅酶解3 h。结束后于沸水中灭酶10 min,冷却至室温后用蒸馏水定容至250 mL,抽滤除去未消化的肉渣,滤液经7000 r/min离心15 min后取上清液获得生肉碱性蛋白酶酶解液(alkaline protease hydrolysate of raw meat,RAH)和熟肉碱性蛋白酶酶解液(alkaline protease hydrolysate of steamed meat,SAH),−20 ℃保存用于后续分析。
1.2.3 体外模拟消化
参照Papungkorn等[15]的方法进行体外模拟胃肠消化,各取12 g生肉鱼糜和熟肉泥,加入240 mL去离子水后调节pH为2.0,接着加入300 mg胃蛋白酶37 ℃水浴消化1 h,调节pH至7.5,加入480 mg胰蛋白酶继续消化2 h。消化结束后于沸水中灭酶10 min,冷却至室温后用蒸馏水定容至250 mL,抽滤除去未消化的肉渣,滤液经7000 r/min离心15 min后取上清液获得生肉模拟消化液(raw meat simulates digestive products,RSD)和蒸肉模拟消化液(steamed meat simulates digestive products,SSD),−20 ℃保存用于后续分析。
1.2.4 水解度
采用甲醛滴定法[16]测定水解物中的游离氨基氮含量,参照GB 5009.5-2016《食品安全国家标准食品中蛋白质的测定》[17]中凯氏定氮法测定原料中的总氮含量。按公式(1)计算酶解液的水解度:
水解度(%)=酶解液中游离氨基氮含量原料肉中的总氮含量×100 (1) 1.2.5 相对分子质量分布
采用液相色谱法[18]测定酶解液中多肽的相对分子质量分布,液相色谱条件为:色谱柱:Waters XBridge Protein BEH 125Å SEC(3.5 μm,7.8 mm×300 mm);流动相:体积分数为40%乙腈水溶液;紫外检测波长:220 nm;流速:0.4 mL/min;进样量:10 μL;以细胞色素C(12384 Da)、抑肽酶(6511.51 Da)、L-氧化型谷胱甘肽(612.63 Da)和L-羟脯氨酸(131.13 Da)为标准品绘制相对分子质量校正曲线。随后,将酶解液稀释10倍,过0.22 μm水系滤膜后上机测样,利用校正曲线方程计算酶解物的相对分子质量分布。
1.2.6 氨基酸组成分析
按照GB/T 5009.124-2016《食品安全国家标准食品中氨基酸的测定》[19]中的方法测定,使用L-8900型氨基酸分析仪上样测定。
1.2.7 多肽序列鉴定
使用3000 Da的超滤膜超滤过滤水解液,收集分子质量小于3000 Da的组分,然后使用C18小柱除盐后浓缩干燥。采用Nano-LC-ESI-Q-Orbitrap-MS/MS测定样品中肽段的氨基酸序列。色谱条件如下,预柱:AcclaimR PepMap100 column(100 μm ID,2 cm length,C18,5 μm,100 Å);色谱柱:AcclaimR PepMap RSLC (50 μm×150 mm,C18,2 μm,100 Å);流动相A:0.1%甲酸水溶液;流动相B:0.1%甲酸-乙腈溶液;流速:220 nL/min;洗脱梯度:0~2 min,4%~12% B;3~25 min,12~22% B;26~32 min,22~32% B;33~37 min,32~75% B;38~40 min,75% B等度洗脱。通过Xcalibur 2.2 SP1软件采集质谱数据,一级质谱扫描范围为250~1250 m/z,分辨率为70000;选择信号排名前20的多肽进行碎裂,碎裂模式为HCD,能量为27%,采用Xcalibur软件分析质谱数据,采用PEAKS软件对肽段序列进行de novo分析。
1.2.8 ABTS自由基清除能力评价
参照张露等[20]的方法测定样品的ABTS自由基清除能力。取50 μL稀释10倍的酶解液与150 μL ABTS阳离子溶液于96孔酶标板上混匀,室温下避光反应6 min后于734 nm处测定吸光值为A1,以50 μL蒸馏水替代样品溶液为反应体系,测定吸光值为A0,以150 μL蒸馏水替代ABTS阳离子溶液为反应体系,测定吸光值为A2。按公式(2)计算ABTS阳离子自由基清除能力,结果用百分清除率表示。
ABTS自由基清除率(%)=(1−A1−A2A0)×100 (2) 1.2.9 羟自由基清除能力评价
参照郭洪辉等[21]的方法测定样品的羟自由基清除能力。向96孔酶标板中依次加入50 μL酶解液,50 μL 8.0 mmol/L FeSO4溶液和20 μL 20 mmol/L H2O2溶液,37 ℃反应10 min后加入100 μL 4.0 mmol/L水杨酸溶液,混匀,37 ℃反应30 min,结束后冷却至室温,最后于510 nm测定吸光值为A1,以50 μL蒸馏水替代样品溶液为反应体系,测定吸光值为A0,以20 μL蒸馏水替代H2O2溶液为反应体系,测定吸光值为A2。清除率按公式(3)计算:
羟基自由基清除率(%)=(1−A1−A2A0)×100 (3) 1.2.10 超氧阴离子清除能力
参照朱敏方[22]所用方法评价样品的超氧阴离子清除能力。75 μL酶解液和75 μL 50 mmol/L Tris-HCl缓冲液(pH8.0)于25 ℃反应10 min后,加入50 μL 1.5 mmol/L焦性没食子酸溶液(1.0 mmol/L盐酸配制)反应5 min,最后于320 nm处测定吸光值,总测定时长10 min,每隔1 min测定一次。以蒸馏水代替样品作空白组。超氧阴离子清除能力的计算公式(4)如下:
超氧阴离子清除速率=A0−ASA0 (4) 式中:A0,空白组的吸光值曲线斜率;AS,样品组的吸光值斜率。
1.2.11 还原能力分析
参照陈丽花等[10]的方法并进行适当调整。依次取50 μL稀释2倍的酶解液、75 μL磷酸盐缓冲液(pH6.6)和50 μL质量分数为1%的铁氰化钾溶液于96孔酶标板中,50 ℃反应30 min后加入50 μL质量分数为10%的三氯乙酸溶液,最后取100 μL上清液与100 μL蒸馏水和20 μL质量分数为0.1%的FeCl3溶液反应,最后测定反应体系在700 nm处的吸光值,吸光值越高,说明待测液的还原性越强。
1.3 数据处理
实验所得数据使用SPSS 20.0软件进行处理与分析,实验重复3次,结果以平均值±标准偏差表示,采用Duncan检验进行显著性统计分析,P<0.05表示差异显著,采用Origin 8.6软件绘图。
2. 结果与分析
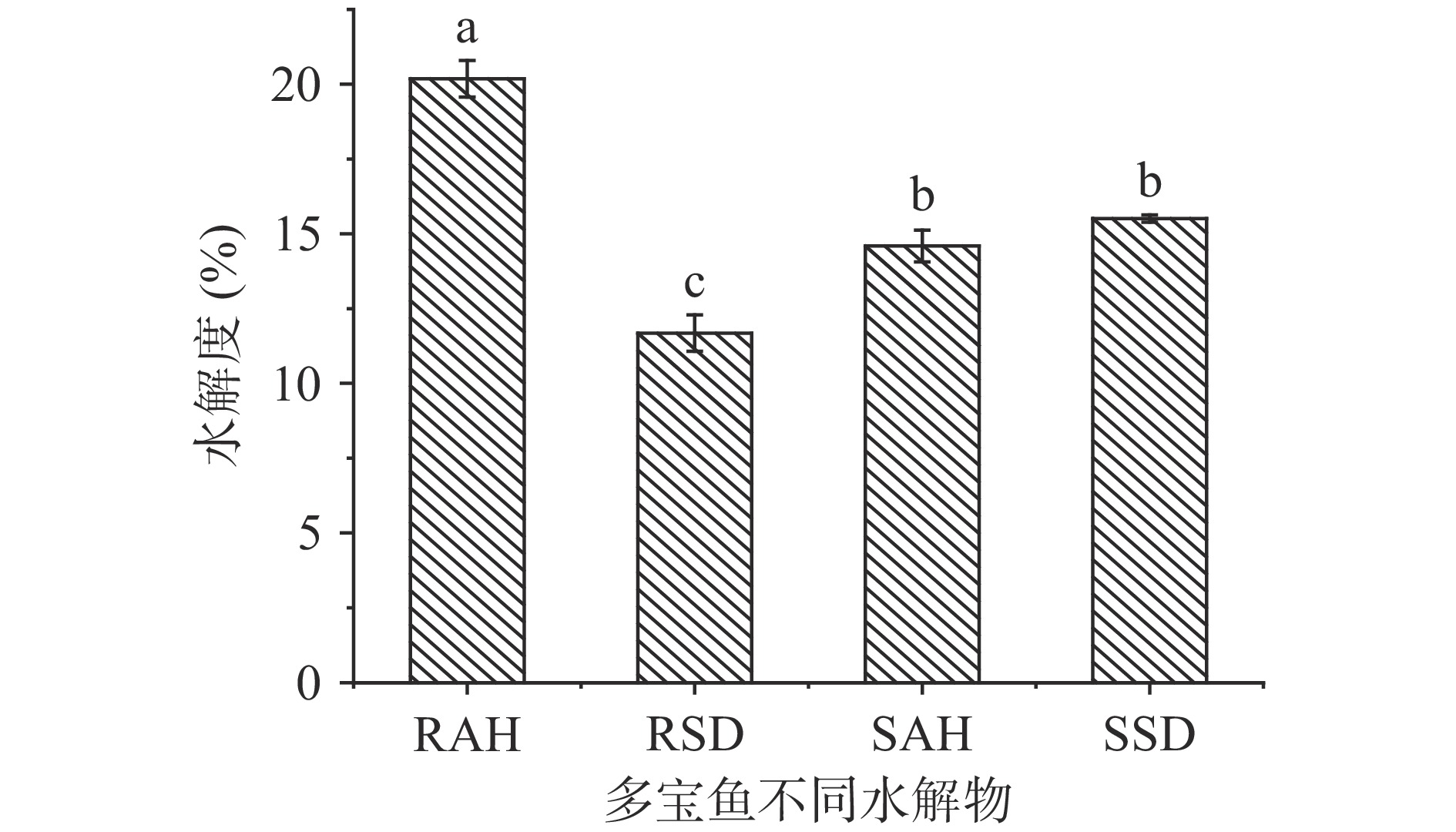
2.1 水解度
水解度是反映蛋白质水解程度的一个重要指标,也是决定蛋白质水解物功能性质和生物活性的重要因素[23]。不同预处理和水解方式对多宝鱼水解物的水解度影响如图1所示,RAH的水解度最高(P<0.05),为20.18%±0.61%,其次为SSD和SAH,RSD的水解度最低,其中碱性蛋白酶水解物较模拟消化产物的水解度高,这可能得益于碱性蛋白酶高的酶切效率[24];熟化提高了鱼肉在胃肠消化中的水解度,这与韦婕妤等[25]对羊肉蛋白的研究结果相似。研究表明,生肉中的肌原纤维蛋白可在胃消化过程中形成对胃蛋白酶有一定抵抗力的融合块而不利于消化[26],此外,短时间熟化可使部分鱼肉蛋白质展开,氢键和二硫键的部分断裂,蛋白质空间构象的改变使得更多的消化酶酶切位点暴露,从而使其水解程度增加[27]。但熟化降低了碱性蛋白酶的酶解效率,这可能是因为加热产生的鱼肉蛋白质构象的改变不利于碱性蛋白酶的酶切,从而降低了蛋白质的水解度。
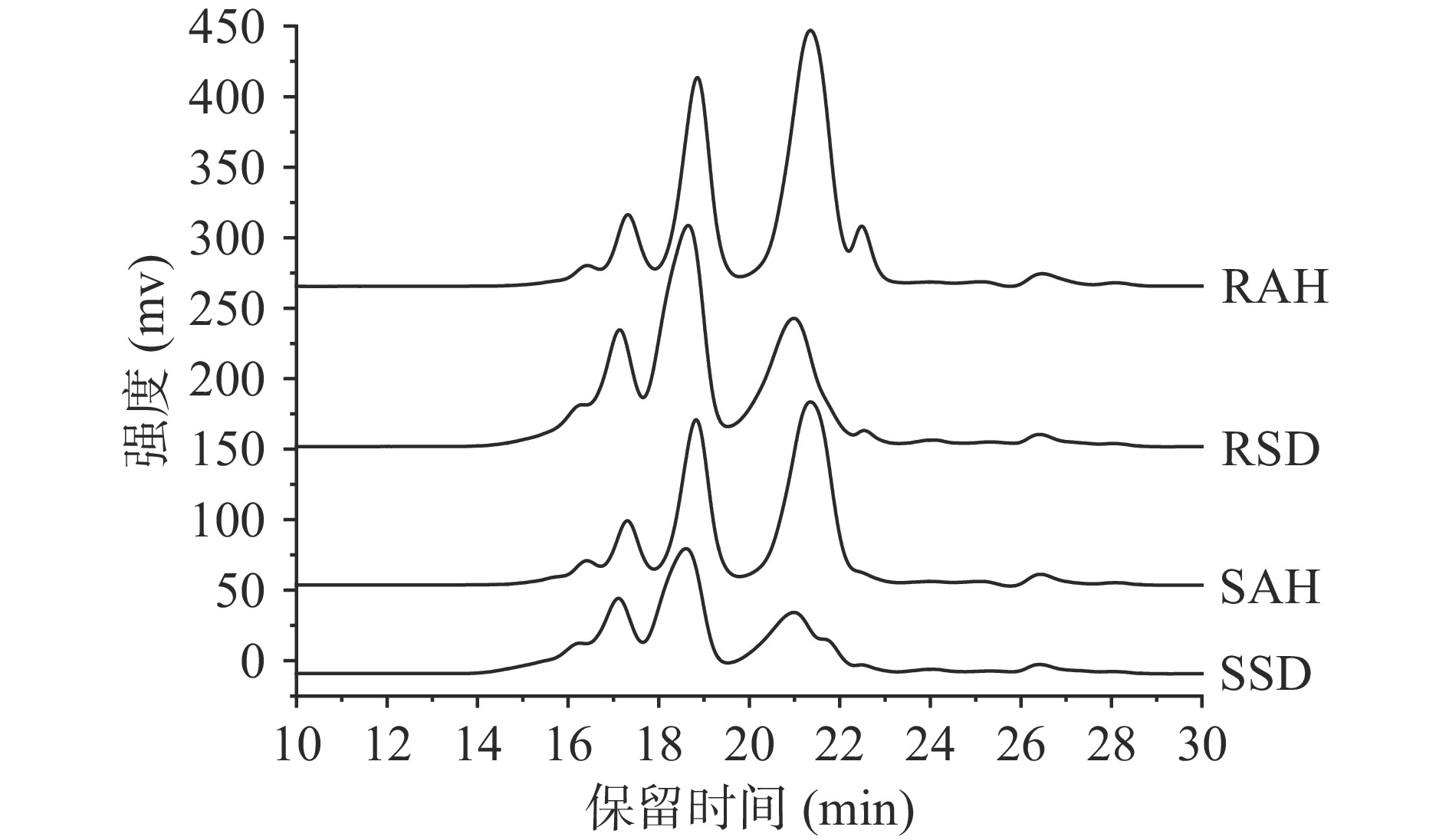
2.2 相对分子质量分布
利用4种标准品的HPLC色谱图得到相对分子质量校正曲线:lg(MW)=−0.1882x+6.6417(R2=0.9966),多宝鱼不同水解物的尺寸排阻色谱图如图2所示,通过校正曲线计算的4种水解物的相对分子质量分布范围如表1所示。在同一预处理方式下,RAH和SAH中分子质量低于1000 Da的占比分别为58.97%和53.97%,低于500 Da的占比超过40%,均远高于RSD和SSD,RAH和SAH分子质量高于2000 Da的占比分别为11.41%和14.64%,均低于RSD和SSD,这表明碱性蛋白酶比胃蛋白酶和胰蛋白酶具有更高的催化效率。在同一酶解条件下,熟化处理后的水解物中分子质量大于2000 Da的多肽含量要高于生肉水解物,这可能是加热过程中部分蛋白质发生了交联及氧化修饰,产生了抵抗酶切的密集结构和氧化型氨基酸残基,导致这部分蛋白质序列不能够被有效水解[28]。
表 1 多宝鱼不同水解物相对分子质量分布Table 1. Relative molecular weight distribution of different hydrolysates of turbot水解物 相对含量(%) <500 Da 500~1000 Da 1000~2000 Da 2000~3000 Da >3000 Da RAH 46.81 12.16 29.62 8.18 3.23 RSD 17.98 17.33 40.49 14.42 9.78 SAH 41.48 12.49 31.41 9.79 4.83 SSD 17.05 14.66 39.14 15.73 13.43 2.3 氨基酸组成
由表2可以看出,多宝鱼鱼肉的必需氨基酸达44.26%,具有较高的营养价值。氨基酸组成可进一步提供有关蛋白质水解物抗氧化活性的详细信息。研究表明,Tyr、Phe、Pro、Ala、Leu和His这6种氨基酸的高含量通常与多肽高抗氧化活性相关,鱼肉水解前这些氨基酸的占比达到了31.28%,水解以后,氨基酸组成未发生较大改变,这表明多宝鱼肉是制备抗氧化肽的优质来源[1]。从氨基酸摩尔分数来看,4种水解物无较大差异,因此,4种水解物的抗氧化活性的差异可能与多肽的一级结构有关,包括氨基酸序列和肽链长度。
表 2 多宝鱼不同水解物的氨基酸组成Table 2. Amino acid composition of different hydrolysates of turbot氨基酸 摩尔分数(%) 鱼肉 RAH RSD SAH SSD 天冬氨酸(Asp) 10.57 10.51 10.52 10.66 10.31 苏氨酸(Thr) 5.57 5.49 5.45 5.49 5.12 丝氨酸(Ser) 5.32 5.49 5.55 5.53 5.50 谷氨酸(Glu) 13.89 13.66 13.79 14.41 14.29 甘氨酸(Gly) 7.65 8.93 8.87 8.92 9.96 丙氨酸(Ala) 8.65 9.05 8.90 9.30 9.45 缬氨酸(Val) 5.41 5.29 5.21 5.08 4.90 甲硫氨酸(Met) 2.50 2.39 2.30 2.29 1.80 异亮氨酸(Ile) 4.33 4.05 4.10 3.62 3.46 亮氨酸(Leu) 14.23 13.86 13.82 14.28 14.40 酪氨酸(Tyr) 1.25 1.08 1.09 0.81 0.66 苯丙氨酸(Phe) 3.49 3.35 3.32 3.11 3.03 赖氨酸(Lys) 8.74 8.24 8.41 8.37 8.70 组氨酸(His) 1.58 1.51 1.50 1.44 1.37 精氨酸(Arg) 4.74 4.66 4.73 4.45 4.81 脯氨酸(Pro) 2.08 2.45 2.42 2.25 2.23 疏水性氨基酸 40.68 40.44 40.07 39.94 39.28 必需氨基酸 44.26 42.66 42.62 42.25 41.43 2.4 肽段组成
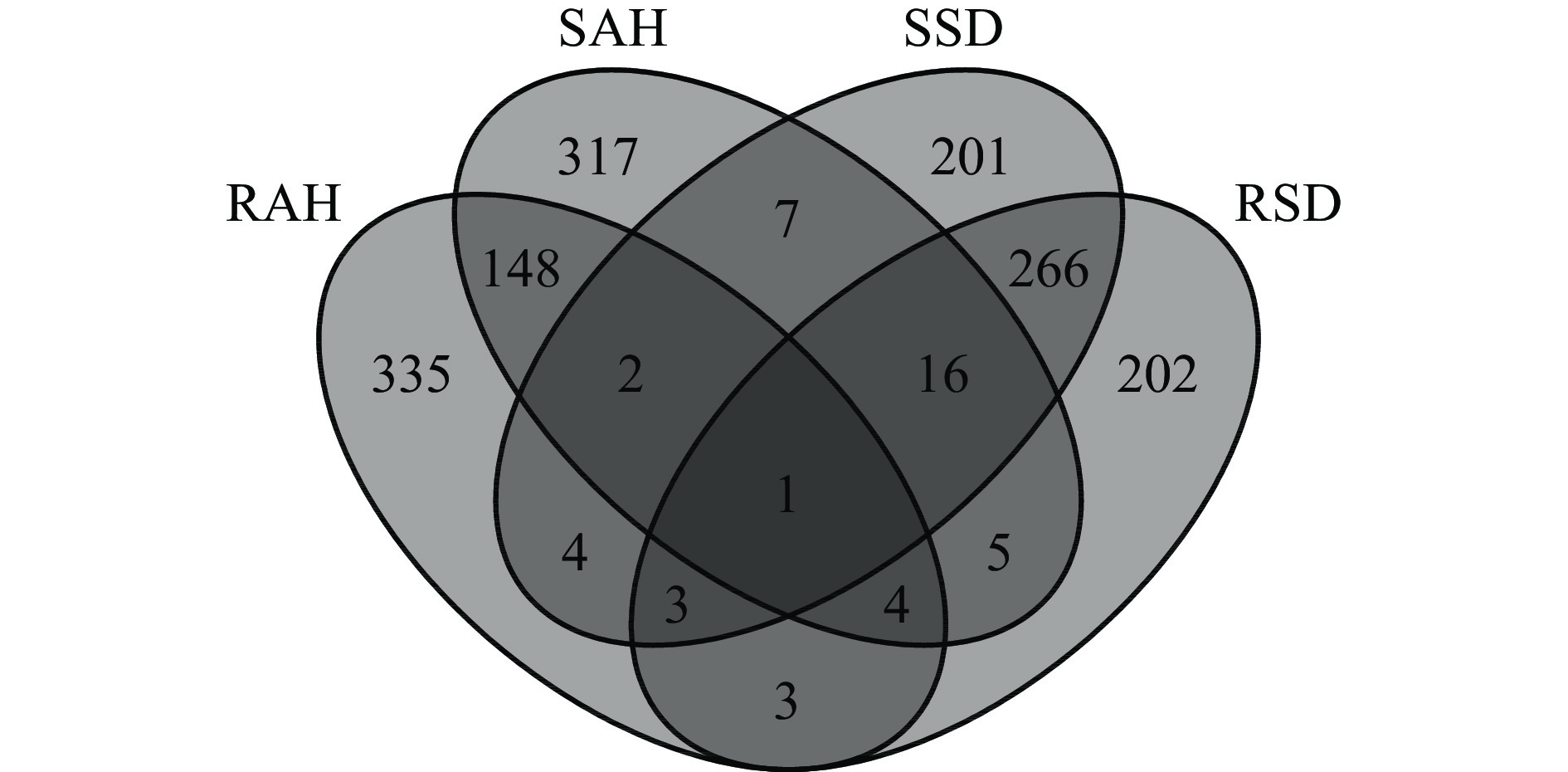
在质谱鉴定的多肽中,选取丰度前500的主要肽段进行分析。从图3可以看出,4种水解物中共有多肽仅1条,RSD和SSD中共有多肽为286条,而RAH和SAH中共有多肽为155条,SAH和RAH、SSD和RSD中的多肽差异表明,在同一酶解条件下,不同的处理方式使得水解物的肽段组成差异性较大,这可能是热处理使鱼肉蛋白的空间结构发生改变,蛋白质侧链被氧化修饰以及蛋白质之间发生交联,从而影响酶切位点的暴露[29]。而在同一预处理方式下,RAH和RSD共有多肽为11条,SAH和SSD的共有多肽为26条,这是由于不同酶的酶切位点不同,导致水解后多肽产生了明显差异。综上,相比不同的处理方式,酶解方式的不同对多肽差异性的产生影响更大。
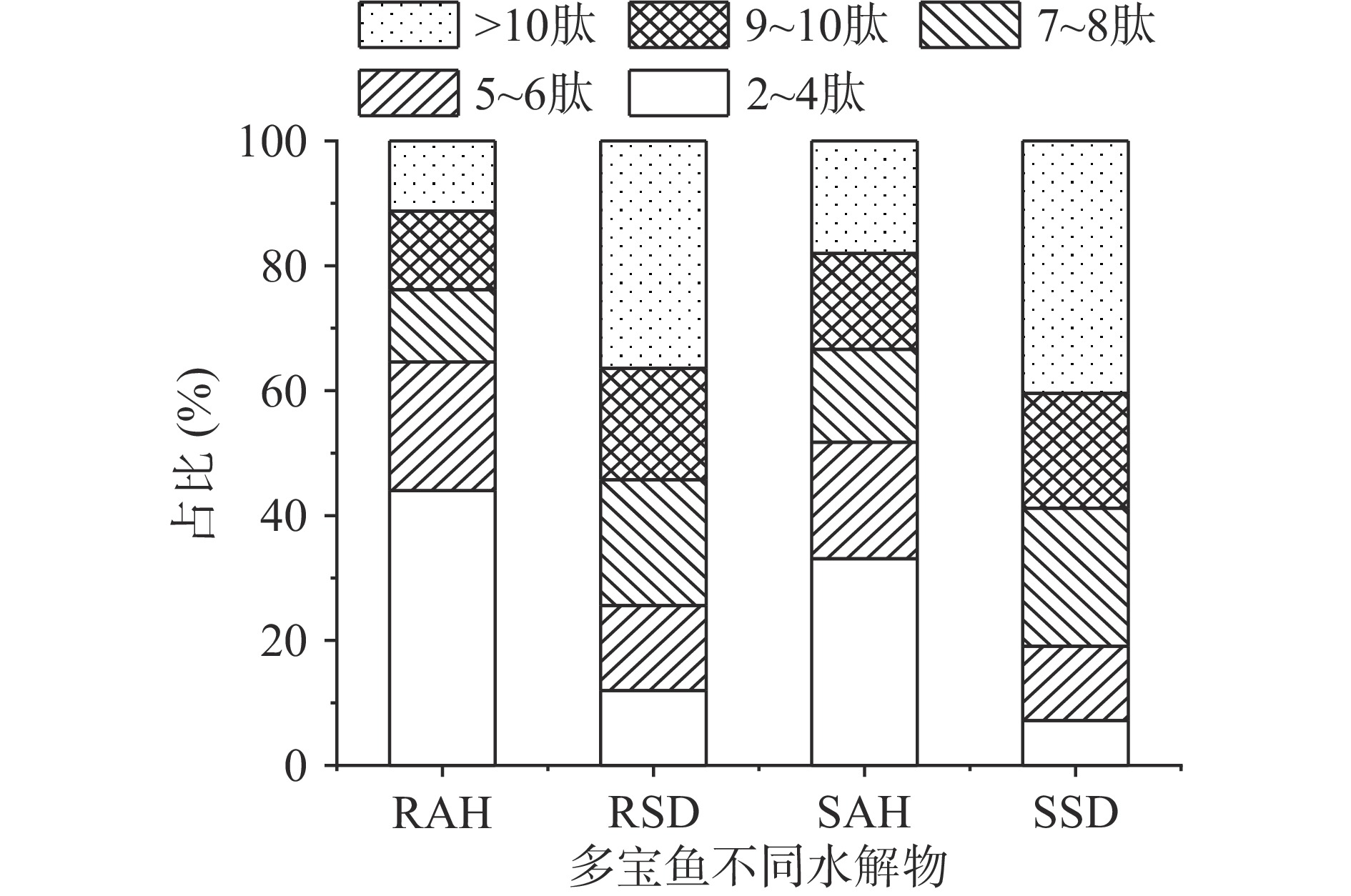
2.5 肽段分布
图4显示的是多宝鱼不同水解物中质谱鉴定出的丰度前500位的多肽的肽段分布。可以看出,RAH具有最高占比的短肽和最低占比的长肽,RAH、RSD、SAH和SSD中的小肽(2~6肽)占比分别为64.57%、25.6%、51.73%和19.06%,而对于大于10个氨基酸残基的多肽占比分别为11.26%、36.43%、18.05%和40.43%。这表明碱性蛋白酶水解物中的短肽占比要远高于模拟消化产物,而大于10个氨基酸残基的多肽则相反,这与表1分子质量分布测定结果一致。另外,熟化会减弱碱性蛋白酶和胃肠道模拟消化效果,降低2~6肽的占比,而增加了大于10个氨基酸残基的多肽的占比。
2.6 体外抗氧化活性
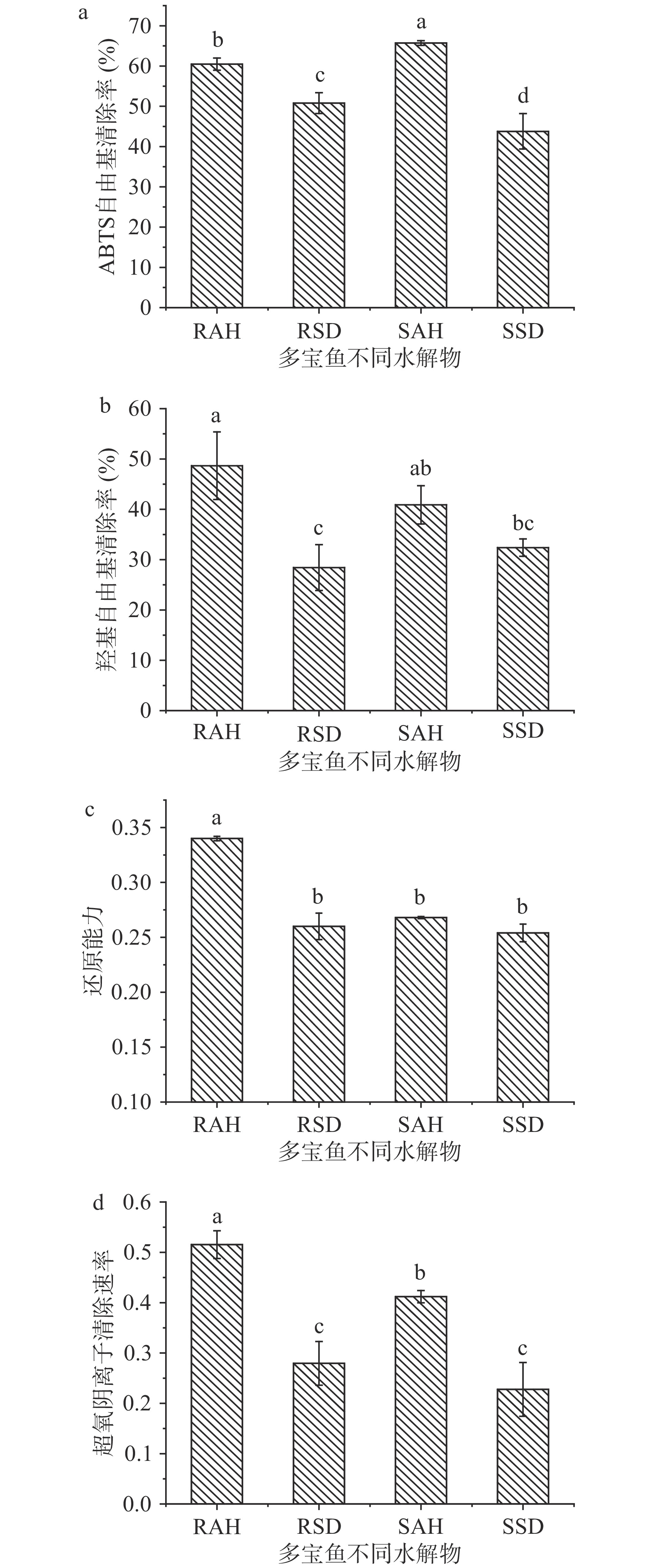
为了综合考察不同水解物的抗氧化能力,本实验测定了水解物的ABTS自由基清除率、还原力、超氧阴离子清除能力和羟基自由基清除活性等4个抗氧化活性指标。由图5可知,碱性蛋白酶水解物的抗氧化活性均高于模拟消化的水解物,但熟化并没有表现出明显的增强或者降低模拟消化产物抗氧化能力的效果。RAH 和 SAH 的 ABTS 自由基清除率显著高于 RSD 和SSD(P<0.05),清除率分别为60.48%和65.71%;超氧阴离子清除能力和羟基自由基清除活性测定结果也显示出了同样的变化趋势,但SAH、RSD和SSD之间的还原能力无显著性差异(P>0.05)。RAH的超氧阴离子清除速率、羟基自由基清除率和铁离子还原能力均高于其它样品,其超氧阴离子清除速率、羟基自由基清除率和还原力值分别为 0.515、48.66% 和 0.34,但 RAH 和 SAH 的羟基自由基清除率没有显著性差异(P>0.05)。结合4种抗氧化活性指标测定结果可以看出,碱性蛋白酶水解物的体外抗氧化活性总体要高于模拟胃肠消化产物,这与马思彤等[30]对蛋清蛋白粉酶解液抗氧化活性的研究结果一致。RAH的抗氧化活性最好,这可能是由于RAH较高的水解度以及高含量的短肽贡献的。另外,研究表明水解物的分子质量越低,抗氧化活性越强,如Gómez等[31]研究红罗非鱼时发现分子质量小于1000 Da多肽抗氧化活性最强;Wu等[32]也发现分子质量小于3000 Da的鲑鱼皮胶原多肽的DPPH自由基清除率要显著高于分子质量大于3000 Da的组分。另外,RSD和SSD的抗氧化活性无较大差异,尽管SSD的水解度更大,但SSD中分子质量小于1000 Da的多肽占比为31.71%,略少于RSD的35.31%,因此SSD的抗氧化活性没有表现出比RSD更强。此外,加热熟化过程通常会产生一些自由基,同时导致蛋白质中部分活性巯基损失[33],这可能也是导致RAH抗氧化活性高于SAH的另一原因。
3. 结论
本实验分析了RAH、RSD、SAH和SSD这4种多宝鱼水解物的水解度、相对分子质量分布、氨基酸组成和肽段组成,并进一步比较了它们的抗氧化活性差异。结果表明,RAH具有最高的水解度(20.18%)且水解物中的多肽以分子质量小于1000 Da小分子肽为主(58.97%)。RAH、RSD、SAH和SSD中肽段差异显著,且不同酶酶解所产生的差异更大,但4种水解物的氨基酸组成无明显差异。碱性蛋白酶水解物的抗氧化活性明显优于模拟消化产物,其中RAH的抗氧化活性最强。熟化提高了RSD的水解度,但降低了水解过程中小分子肽的释放、碱性蛋白酶的水解效率及RAH的抗氧化活性,所以熟化可能不利于多宝鱼肉抗氧化肽的制备。因此,相比于人体直接食用,使用碱性蛋白酶酶解生肉可以获得大量的低分子质量及潜在抗氧化活性更强的多肽,进而提高多宝鱼肉利用价值。本研究一定程度上表明多宝鱼肉加工的重要性,为鱼肉活性多肽的制备和研究提供了一定的参考。
-
表 1 多宝鱼不同水解物相对分子质量分布
Table 1 Relative molecular weight distribution of different hydrolysates of turbot
水解物 相对含量(%) <500 Da 500~1000 Da 1000~2000 Da 2000~3000 Da >3000 Da RAH 46.81 12.16 29.62 8.18 3.23 RSD 17.98 17.33 40.49 14.42 9.78 SAH 41.48 12.49 31.41 9.79 4.83 SSD 17.05 14.66 39.14 15.73 13.43 表 2 多宝鱼不同水解物的氨基酸组成
Table 2 Amino acid composition of different hydrolysates of turbot
氨基酸 摩尔分数(%) 鱼肉 RAH RSD SAH SSD 天冬氨酸(Asp) 10.57 10.51 10.52 10.66 10.31 苏氨酸(Thr) 5.57 5.49 5.45 5.49 5.12 丝氨酸(Ser) 5.32 5.49 5.55 5.53 5.50 谷氨酸(Glu) 13.89 13.66 13.79 14.41 14.29 甘氨酸(Gly) 7.65 8.93 8.87 8.92 9.96 丙氨酸(Ala) 8.65 9.05 8.90 9.30 9.45 缬氨酸(Val) 5.41 5.29 5.21 5.08 4.90 甲硫氨酸(Met) 2.50 2.39 2.30 2.29 1.80 异亮氨酸(Ile) 4.33 4.05 4.10 3.62 3.46 亮氨酸(Leu) 14.23 13.86 13.82 14.28 14.40 酪氨酸(Tyr) 1.25 1.08 1.09 0.81 0.66 苯丙氨酸(Phe) 3.49 3.35 3.32 3.11 3.03 赖氨酸(Lys) 8.74 8.24 8.41 8.37 8.70 组氨酸(His) 1.58 1.51 1.50 1.44 1.37 精氨酸(Arg) 4.74 4.66 4.73 4.45 4.81 脯氨酸(Pro) 2.08 2.45 2.42 2.25 2.23 疏水性氨基酸 40.68 40.44 40.07 39.94 39.28 必需氨基酸 44.26 42.66 42.62 42.25 41.43 -
[1] AHN C, JE J, CHO Y. Antioxidant and anti-inflammatory peptide fraction from salmon byproduct protein hydrolysates by peptic hydrolysis[J]. Food Research International,2012,49(1):92−98. doi: 10.1016/j.foodres.2012.08.002
[2] CUI Q, SUN Y, GUO M. Effect of two-step enzymatic hydrolysis on the antioxidant properties and proteomics of hydrolysates of milk protein concentrate[J]. Food Chemistry,2022,366:130711. doi: 10.1016/j.foodchem.2021.130711
[3] LV R, DONG Y, SUN N. Advances in the activity evaluation and cellular regulation pathways of food-derived antioxidant peptides[J]. Trends in Food Science & Technology,2022,122:171−186.
[4] 李晓杰, 李富强, 朱丽萍, 等. 生物活性肽的制备与鉴定进展[J]. 齐鲁工业大学学报,2021,35(1):23−28. [LI X J, LI F Q, ZHU L P, et al. Progress of preparation and identification of bioactive peptides[J]. Journal of Qilu University of Technology,2021,35(1):23−28. doi: 10.16442/j.cnki.qlgydxxb.2021.01.005 [5] ZHANG J, LI M, DU H. Identification of novel antioxidant peptides from snakehead (Channa argus) soup generated during gastrointestinal digestion and insights into the antioxidation mechanisms[J]. Food Chemistry,2021,337:127921. doi: 10.1016/j.foodchem.2020.127921
[6] ZHANG Q, TONG X, SUI X, et al. Antioxidant activity and protective effects of alcalase-hydrolyzed soybean hydrolysate in human intestinal epithelial Caco-2 cells[J]. Food Research International,2018,111:256−264. doi: 10.1016/j.foodres.2018.05.046
[7] 包斐, 孙丽霞, 孙建华, 等. 长蛇鲻鱼蛋白水解制备抗氧化肽工艺研究[J]. 食品科技,2019,44(8):241−247. [BAO F, SUN L X, SUN J H, et al. Optimization of technology conditions for antioxidant peptides from protein hydrolysates of lizard fish[J]. Food Science and Technology,2019,44(8):241−247. doi: 10.13684/j.cnki.spkj.2019.08.043 [8] 李亚会, 李积华, 吉宏武, 等. 远东拟沙丁鱼抗氧化肽的分离纯化及结构解析[J]. 中国食品学报,2021,21(2):229−238. [LI Y H, LI J H, JI H W, et al. Isolation, purification and structural analysis of antioxidant peptides from Sardinops sagaxs[J]. Journal of Chinese Institute of Food Science and Technology,2021,21(2):229−238. doi: 10.16429/j.1009-7848.2021.02.028 [9] 蔡金秀, 夏姗姗, 马佳雯, 等. 马面鱼皮胶原抗氧化肽的分离制备及稳定性研究[J]. 核农学报,2021,35(11):2569−2577. [CAI J X, XIA S S, MA J W, et al. Isolation preparation and stability of collagen antioxidant peptides from the skin of navodon septentrionalis[J]. Journal of Nuclear Agricultural Sciences,2021,35(11):2569−2577. doi: 10.11869/j.issn.100-8551.2021.11.2569 [10] 陈丽花, 朱楚楚, 李冉冉. 体外消化对金瓜籽抗氧化肽抗氧化活性的影响[J]. 食品科学,2019,40(3):78−86. [CHEN L H, ZHU C C, LI L L. Effect of in vitro digestion on antioxidant activity of antioxidant peptides from marrow seeds[J]. Food Science,2019,40(3):78−86. doi: 10.7506/spkx1002-6630-20170829-343 [11] 孙松, 胡玉龙, 吕丁, 等. 中国大菱鲆引进群体三代选育之后的收获体重遗传进展评估[J]. 中国农学通报,2021,37(35):118−123. [SUN S, HU Y L, LÜ D, et al. Evaluation of genetic gain for harvest body weight in turbot (Scophthalmus maximus, Linnaeus) after three generations[J]. Chinese Agricultural Science Bulletin,2021,37(35):118−123. doi: 10.11924/j.issn.1000-6850.casb2021-0016 [12] 王志, 赵峰, 王珊珊, 等. 大菱鲆鱼皮抗氧化胶原肽的制备及特性分析[J]. 食品安全质量检测学报,2020,11(22):8267−8275. [WANG Z, ZHAO F, WANG S S, et al. Preparation and characteristic analysis of antioxidant collagen peptides from turbot skins[J]. Journal of Food Safety & Quality,2020,11(22):8267−8275. doi: 10.19812/j.cnki.jfsq11-5956/ts.2020.22.023 [13] FANG B, SUN J, MAO X. Conversion of turbot skin wastes into valuable functional substances with an ecofriendly fermentation technology[J]. Journal of Cleaner Production,2017,156:367−377. doi: 10.1016/j.jclepro.2017.04.055
[14] MA T X, FU Q Q, MEI Q G, et al. Extraction optimization and screening of angiotensin-converting enzyme inhibitory peptides from Channa striatus through bioaffinity ultrafiltration coupled with LC-Orbitrap-MS/MS and molecular docking[J]. Food Chemistry,2021,354:129589. doi: 10.1016/j.foodchem.2021.129589
[15] PAPUNGKORN S, SITTIRUK R, JIRAWAT Y. Angiotensin converting enzyme (ACE) inhibitory peptides derived from the simulated in vitro gastrointestinal digestion of cooked chicken breast[J]. Journal of Functional Foods,2019,29:77−83.
[16] 杨文博, 张英华. 蛋白质水解度的测定方法研究[J]. 中国调味品,2014,39(3):88−90. [YANG W B, ZHANG Y H. Study on the determination methods for hydrolysis degree of protein[J]. China Condiment,2014,39(3):88−90. doi: 10.3969/j.issn.1000-9973.2014.03.022 [17] 国家卫生和计划生育委员会, 国家食品药品监督管理总局. GB 5009.5-2016食品安全国家标准 食品中蛋白质的测定[S]. 北京: 中国标准出版社, 2016. National Health and Family Planning Commission of the People's Republic of China, State Food and Drug Administration. GB 5009.6-2016 National standard for food safety Determination of protein in foods[S]. Beijing: China Standard Press, 2016.
[18] 李军, 罗娟, 涂宗财, 等. 鲢鱼骨胶原多肽的制备及其抗氧化活性研究[J]. 食品与发酵工业,2020,46(2):222−230. [LI J, LUO J, TU Z C, et al. Study on the preparation and antioxidant activity of collagen polypeptide from silver carp bone[J]. Food and Fermentation Industries,2020,46(2):222−230. doi: 10.13995/j.cnki.11-1802/ts.021999 [19] 国家卫生和计划生育委员会, 国家食品药品监督管理总局. GB 5009.124-2016 食品安全国家标准 食品中氨基酸的测定[S]. 北京: 中国标准出版社, 2016. National Health and Family Planning Commission of the People's Republic of China, State Food and Drug Administration. GB 5009.124-2016 National standard for food safety Determination of amino acids in foods[S]. Beijing: China Standard Press, 2016.
[20] 张露, 刘鹏飞, 涂宗财, 等. 香榧不同部位提取物的抗氧化和酶抑制活性比较分析[J]. 食品科学,2018,39(10):78−83. [ZHANG L, LIU P F, TU Z C, et al. Comparison of antioxidant activity and enzyme inhibitory activity of different plant parts of Torreya grandis cv. Merrillii[J]. Food Science,2018,39(10):78−83. doi: 10.7506/spkx1002-6630-201810013 [21] 郭洪辉, 张怡评, 洪专, 等. 河豚鱼皮胶原寡肽螯合锌的体内体外抗氧化活性研究[J]. 食品工业科技,2021,42(5):66−71. [GUO H H, ZHANG Y P, HONG Z. Study onin vivo and in vitro antioxidant activity of collagen oligopeptide chelated zinc from puffer skin[J]. Science and Technology of Food Industry,2021,42(5):66−71. [22] 朱敏方. 草鱼鱼肉抗氧化肽的制备、分离鉴定及其活性研究[D]. 南昌: 江西师范大学, 2020. ZHU M F. Preparation, Isolation, identification and activity of antioxidant peptides from grass carp (Ctenopharyngodon idella) muscle[D]. Nanchang: Jiangxi Normal University, 2020.
[23] ZHENG Z, LI J, LI J, et al. Physicochemical and antioxidative characteristics of black bean protein hydrolysates obtained from different enzymes[J]. Food Hydrocolloids, 97: 105222.
[24] VEYMR G, TACIAS P, BOBERTO M S, et al. Use of alcalase in the production of bioactive peptides: A review[J]. International Journal of Biological Macromolecules,2020,165:2143−2196. doi: 10.1016/j.ijbiomac.2020.10.060
[25] 韦婕妤, 唐善虎, 杨琪. 不同热加工方法对羊肉制品体外模拟可消化性研究[J]. 食品科技,2018,43(12):125−130. [WEI J Y, TANG S H, YANG Q. Study on the digestion of mutton products in vitro by different heat processing methods[J]. Food Science and Technology,2018,43(12):125−130. doi: 10.13684/j.cnki.spkj.2018.12.024 [26] KAUR L, MAUDENS E, SINGH H. Microstructure and protein digestibility of beef: The effect of cooking conditions as used in stews and curries[J]. LWT-Food Science and Technology,2014,2(55):612−620.
[27] BHAT Z F, MORTON J, DBEKHIT A E, et al. Thermal processing implications on the digestibility of meat, fish and seafood proteins[J]. Wiley,2021,20(5):4511−4548.
[28] YU T, MORTON J D, CLERENS S, et al. Cooking induced protein modifications in meat[J]. Comprehensive Reviews in Food Science and Food Safety,2016,16(1):141−159.
[29] BAX M, AUBRY L, FERREIRA C, et al. Cooking temperature is a key determinant of in vitro meat protein digestion rate: Investigation of underlying mechanisms[J]. Journal of Agricultural and Food Chemistry,2012,60(10):2569−2576. doi: 10.1021/jf205280y
[30] 马思彤, 刘静波, 张婷, 等. 体外模拟胃肠消化及碱性蛋白酶处理后蛋清肽抗氧化活性差异及肽序列解析[J]. 食品科学,2020,41(21):113−120. [MA S T, LIU J B, ZHANG T, et al. Differences in antioxidant activity and sequence analysis of egg white peptides derived from simulated gastrointestinal digestion and alkaline protease treatment[J]. Food Science,2020,41(21):113−120. doi: 10.7506/spkx1002-6630-20191024-255 [31] GÓMEZ L J, GÓMEZ N, ALEGRA A. In vitro antioxidant capacity and cytoprotective/cytotoxic effects upon Caco-2 cells of red tilapia (Oreochromis spp.) viscera hydrolysates[J]. Food Research International,2019,120:52−61. doi: 10.1016/j.foodres.2019.02.029
[32] WU R, WU C, HE H. Antioxidant and antifreezing peptides from salmon collagen hydrolysate prepared by bacterial extracellular protease[J]. Food Chemistry,2018,248:346−352. doi: 10.1016/j.foodchem.2017.12.035
[33] YIN Y, ZHOU L, PEREIRA J, et al. Insights into digestibility and peptide profiling of peef muscle proteins with different cooking methods[J]. Journal of Agricultural and Food Chemistry,2020,68(48):14243−14251. doi: 10.1021/acs.jafc.0c04054
-
期刊类型引用(2)
1. 杨戬,刘伯扬,王丹慧,高永亮,赵三军,赵凯,李慧,仪虹伯. 基于中红外光谱的牛乳中A 2β-酪蛋白检测方法研究. 中国乳业. 2024(11): 144-148+156 .  百度学术
百度学术
2. 张立佳,莫楠,刘丽君,韩晓旭,赖世云,任一平,尹睿杰,李翠枝. 羊乳婴幼儿配方粉中牛乳成分鉴别与测定模型的建立. 食品安全质量检测学报. 2023(08): 195-203 .  百度学术
百度学术
其他类型引用(1)









 下载:
下载:
 下载:
下载:



