Authenticity Certification of Pu'er Raw Tea in Different Years Based on the Stable Isotope Ratios of Carbon and Nitrogen in Caffeine and Amino Acids
-
摘要: 采用咖啡碱和氨基酸中碳氮稳定同位素比率分析方法(气相色谱-燃烧-同位素比值质谱,GC-C-IRMS)开展不同年份普洱生茶真实性认证研究。化学计量学分析表明,基于茶叶咖啡碱和氨基酸中碳氮稳定同位素比率结合化学计量学模型可以对不同年份普洱生茶进行有效区分,预测和验证准确率均达到80%以上,其中BP-ANN认证性能最优,预测和验证准确率均达到100%;进一步筛选和鉴定,得到不同年份普洱生茶的3种化学标记,包括δ15NThea、δ13CGlu和δ15NGlu。因此,基于GC-C-IRMS分析的咖啡碱和氨基酸中碳氮稳定同位素比率分析方法可以用于不同年份普洱生茶的真实性认证。本研究初步建立了普洱生茶产品认证的指标体系及技术体系,也为其他食品的认证研究提供研究思路和方法参考。
-
关键词:
- 普洱生茶 /
- 生产年份 /
- 咖啡碱 /
- 氨基酸 /
- 碳氮稳定性同位素比率
Abstract: The method of carbon and nitrogen stable isotope ratio analysis in caffeine and amino acids (gas chromatography combustion isotope ratio mass spectrometry, GC-C-IRMS) was used to carry out the authenticity certification of Pu'er raw tea in different years. Chemometrics analysis showed that the stable isotope ratios of carbon and nitrogen in caffeine and amino acids combined with chemometrics model could effectively distinguish Pu'er raw tea in different years. And the accuracy of prediction and verification were more than 80%, BP-ANN had the best certification performance, whose accuracy of prediction and verification were 100%. Through further screening and identification, three chemical markers of Pu'er raw tea in different production years were obtained, which included δ15NThea、δ13Cglu and δ15NGlu. Therefore, the analysis method of carbon and nitrogen stable isotope ratios in caffeine and amino acids based on GC-C-IRMS could be used to authenticate the authenticity of Pu'er raw tea in different years. This study preliminarily established the index system and technical system of Pu'er tea product certification, which also provided research ideas and method references for other food certification research. -
中国黑茶(CDT)是一种后发酵茶,是中国六大茶类之一[1]。黑茶在适当的条件下可以通过陈化以确保和提高其质量[2]。普洱茶是具有代表性的黑茶之一,普洱生茶直接由晒青绿茶经蒸压而成[3]。普洱生茶在仓储陈化过程中化学成分均发生显著变化[4-5]。但妥善保存的普洱茶不会变质,陈化后,茶的香气更佳,口感更醇厚[6-7]。近年来,普洱生茶越来越被追求健康生活方式的消费者所接受和重视[8-9]。在适当的贮藏条件下,普洱生茶在一定年限内越陈价格越昂贵[10-11]。因此,消费者对普洱生茶关注最多的是普洱生茶的生产年份(储存年份),其生产年份很大程度上影响了消费者交易的意愿[12-13]。因此,应开发一种可靠、准确的分析和验证不同生产年份普洱生茶产品真实性的方法,以保护消费者和生产者的利益。
稳定同位素技术适合应用于普洱茶真实性认证研究,因为不同元素的同位素组成提供了关于普洱茶来源的充分信息[14-15]。近年来,稳定同位素比值分析在普洱茶真实性认证中得到了广泛的应用,尤其是在产地溯源,但在普洱茶生产年份上的认证还鲜有研究[16-17]。特异性化合物同位素分析(CSIA)不仅是鉴别普洱茶来源的有效方法之一,也是了解茶树代谢的有效方法之一[18-19]。咖啡碱是存在于咖啡(Coffea arabica)或茶(Camellia sinensis)等一些植物的种子、叶子和根部的主要生物碱[20]。咖啡碱碳氮稳定同位素比率已被用作咖啡豆地理来源的化学标记[21-22]。氨基酸(如组氨酸和苯丙氨酸)的δ13C和δ15N特征可用于区分不同植物种类对有效氮源的获取[23]。氨基酸是植物(如茶)中占主导地位的低分子量含氮生物分子,这些化合物合成过程中的同位素分馏模式记录了植物生长环境的一系列信息[24-25]。然而,对普洱茶中咖啡碱和氨基酸中δ13C和δ15N特征分析还鲜有研究,本研究将探讨其分析和真实性认证的可行性。
咖啡碱和氨基酸δ13C和δ15N通常由元素分析同位素比值质谱(EA-IRMS)测定。但是,该方法需要大量的高纯度咖啡碱来进行实验,且咖啡碱的提取和纯化费力且耗时[26]。此外,在EA-IRMS测量之前的咖啡因提取/纯化过程中,咖啡碱的δ13C和δ15N可能会受到非定量恢复的影响。因此,本文提出了一种利用气相色谱-燃烧-同位素比值质谱(GC-C-IRMS)测定普洱茶中咖啡碱和氨基酸δ13C和δ15N的分析方法。
本研究探讨利用咖啡碱和氨基酸中氮和碳稳定同位素比值来进行不同生产年份普洱茶认证的可行性。为了获得准确的δ13C和δ15N值,研究了相关的潜在误差来源。利用GC-C-IRMS测定不同生产年份普洱茶中咖啡碱和6种主要游离态氨基酸的δ13C和δ15N特征,分析差异性及相关关系,建立化学计量学模型,筛选出重要化学标记,以期为构建快速、可靠的不同生产年份普洱茶认证技术提供科学依据。
1. 材料与方法
1.1 材料与仪器
不同生产年份的茶样:采集2014年、2015年、2016年、2017年、2018年来自中国云南省(云南临沧凤庆,纬度24°35',经度100°04')同一厂家生产的同一品牌(香竹菁)普洱生茶样品(每年采集样本数n=9)。普洱生茶样品相对应的即为储存了5~9年的样品。所有样品均为饼茶(嫩度相同),且来自同一采收季节。另外收集了上述同一来源不同年份茶样(n=5)进行模型验证(不用于模型训练),只标记一个序号,作为盲样处理。
氯仿(纯度99.0%)、氢氧化钠(纯度96.0%)、纯商用咖啡碱试剂(纯度98.0%) 日本和光纯药工业株式会社;无水硫酸钠 日本东京关东化学株式会社;IAEA-CH-7(纯度98.5%)、IAEA-600咖啡碱(纯度98.5%)、L-谷氨酸标准品、NBS-22燃料油、IAEA-CH-6蔗糖、IAEA-NO3硝酸钾 北京博研科创生物技术有限公司;USGS 40 L-氨基酸标准品(丙氨酸、茶氨酸、谷氨酸、天门冬氨酸、苏氨酸和丝氨酸,纯度98%)、Amberlite IR120阳离子交换树脂(氢型) 北京普天同创生物科技有限公司;ACN(Acetonitrile)衍生辅助试剂、N-叔丁基二甲基甲硅烷基-N-甲基三氟乙酰胺(N-tert-Butyldimethylsilyl-N-methyltrifluoroacetamide,MTBSTFA)、二氯甲烷(纯度99.8%)、异丙醇(纯度99.5%)、丙酮(纯度95%)、乙酸乙酯(纯度99%)、三乙胺(纯度99.5%)、醋酸酐(纯度98%) 上海吉至生化科技有限公司
X-620型TP型匀浆器、ALC PK 131R离心机、GC IsoLink II+ConFlo IV™ IRMS、ISQ 7610 单四极杆 GC-MS、Delta V Advantage同位素比值质谱仪 美国赛默飞世尔科技公司
1.2 实验方法
1.2.1 样品制备
所有茶样粉碎过筛40目,取0.1 g茶样,加入5 mL超纯水,沸水浴中浸提5 min,冷冻离心机4000 r/min下离心10 min,取上清,冷藏保存,备用[27-28]。
1.2.2 咖啡碱的碳氮稳定同位素比率测定
商业咖啡碱和IAEA-600的δ13C和δ15N采用EA-IRMS法测量[21]。精密量取茶样提取液1 mL,置于10 mL离心管中,加氯化钠饱和,摇匀,加2.5 mL乙腈,涡旋混匀1 min,超声波功率200 W下超声10 min,离心(2500 r/min)2 min,用吸管吸取上清液3 mL于 10 mL容量瓶中,残渣再用2×2.5 mL乙腈提取2次,合并有机层,定容至刻度,加无水硫酸镁1 g和中性氧化铝粉末1 g,摇匀。静置后取1 μL供GC-C-IRMS进样分析。GC柱温程序:起始温度为40 ℃,保持2 min;随即以10 ℃/min 速度升温至300 ℃,保持6 min。注射温度设置为200 ℃,无分流模式;HP-1毛细管柱(30 m×0.32 mm×0.25 μm);载气为氦气,柱流速1 mL/min。IRMS燃烧炉温度设置为1030 ℃,氦反冲从t=0开始,一直持续到700 s,并在1990 s重新开始,直到分析结束。在t=30、80、130、170、1930和1970 s引入6组参考气体(CO2)。在这些条件下,咖啡碱的保留时间约为1200 s[6]。
1.2.3 氨基酸的碳氮稳定同位素比率测定
利用EA-IRMS测量了非衍生的单一氨基酸的δ13C和δ15N值、标准品L-谷氨酸USGS40、燃料油NBS-22、食糖IAEA-CH-6中δ13C值和谷氨酸USGS40、硝酸钾IAEA-NO3的δ15N值[28]。氨基酸衍生条件:称取一定质量的丙氨酸(Ala)、茶氨酸(Thea)、谷氨酸(Glu)、天门冬氨酸(Asp)、苏氨酸(Thr)和丝氨酸(Ser),加0.1 mol/L盐酸超声溶解,配制成除天门冬氨酸、谷氨酸质量浓度分别为3.25、3.11 mmol/L外,其他氨基酸浓度为 2.5 mmol/L的混合氨基酸对照品溶液,4 ℃保存。吸取一定量的氨基酸溶液400 μL放于2 mL自动进样瓶中,加入适量40 nmol/L的正缬氨酸作为内标,置于氮吹仪中于室温下吹干,分别加入40~100 μL的 ACN衍生辅助试剂、40~100 μL的MTBSTFA 衍生试剂(MTBSTFA与ACN 的比例为1:1),加入量依据不同的氨基酸量而定,依设定温度110 ℃衍生30 min,反应完成后冷却至室温,待用[29]。
GC-C-IRMS使用条件:Trace GC Ultra(GC IsoLink+ConFlo IV, Thermo Scientific)与IRMS (DELTA V, Thermo Scientific)通过开放分流界面进行单体氨基酸同位素分析,并使用单四极GC-MS(ISQ Thermo Scientific)。进行δ15N分析时,使用自动取样器以无分裂模式注入0.8~1.0 μL样品。HP-INNOWAX毛细管柱(60 m×0.32 mm×0.25 μm),载气为氦气,柱流速1.4 mL/min,注射温度设置为250 ℃。GC柱温程序:起始温度为40 ℃,保持2 min;随即以40 ℃/min 速度升温至140 ℃,2.5 ℃/min速度升温至180 ℃,6 ℃/min 速度升温至220 ℃,最后40 ℃/min速度升温至250 ℃,保持15 min。进行δ13C分析时,使用自动取样器以无分裂模式注入1.0 μL样品。采用分流模式注入,采用更强的极性柱,可以获得更高更锐利的峰,ZB-FFAP毛细管柱(30 m×0.25 mm×0.25 μm),GC柱温程序:起始温度为40 ℃,保持1 min;随即以15 ℃/min 速度升温至120 ℃,3 ℃/min速度升温至190 ℃,5 ℃/min 速度升温至250 ℃,保持7 min。IRMS燃烧炉温度设置为1030 ℃,用Nafion膜组成的疏水阀除去水蒸气。在对δ15N进行分析时,在燃烧氧化反应器后加入液氮捕集器以从氧化和还原分析物中去除CO2[30-31]。
1.3 数据处理
采用SPSS统计软件(version 23.0,IBM,USA)进行单因素方差分析(ANOVA)、线性判别分析(LDA)和BP人工神经网络(BP-ANN)。使用SIMCA软件(version 13.0,Umetrics,Umea,Sweden)进行层次聚类分析(HCA)、主成分分析(PCA)和偏最小二乘判别分析(PLS-DA)。在进行PCA、HCA、LDA、PLS-DA和BP-ANN应用之前,所有变量都进行了自动放缩[21]。
2. 结果与分析
2.1 方法学验证
2.1.1 GC-C-IRMS测定咖啡碱δ13C和δ15N值方法学验证结果
适用性考察:利用1.2实验方法EA-IRMS测得的商用咖啡碱的δ13C和δ15N值与GC-C-IRMS方法测得的δ13C和δ15N值进行比较,结果表明GC-C-IRMS测定的δ13C和δ15N值与IRMS测定的δ13C和δ15N的精密度值分别为0.14%、0.18%和0.15%、0.20%。其结果在相同精度范围内,且两种方法的标准差相似,均小于0.2%。因此,除了实验部分所描述的标准化之外,GC-C-IRMS无需任何校正因子即可使用。
准确性考察:利用1.2实验方法重复分析商用咖啡碱3次。GC-C-IRMS测定的平均精度为:δ15N为±0.15‰;δ13C为±0.5‰。
不确定度考察:利用1.2实验方法对普洱生茶样品重复提取10次并测量其δ13C和δ15N值。获得的标准偏差δ15N为±0.1‰;δ13C为±1.0‰。
2.1.2 GC-C-IRMS测定氨基酸δ13C和δ15N值方法学验证结果
适用性考察:利用1.2实验方法将GC-C-IRMS测得的标准氨基酸混合物的δ13C和δ15N值与EA-IRMS测得的纯非衍生单氨基酸的同位素值进行了比较,均进行3次重复。经校正后,EA-IRMS和GC-C-IRMS测量值之差分别不高于±0.5‰和±1.6‰。
准确性考察:利用1.2实验方法对氨基酸对照品的重复衍生10次,每个重复进行3次重复。GC-C-IRMS测定的平均精度为:δ15N为±0.1‰;δ13C为±0.5‰。
不确定度考察:利用1.2实验方法对普洱生茶样品进行提取和衍生10次并测量δ13C和δ15N值。获得的标准偏差δ15N为±0.2‰;δ13C为±0.7‰。
2.2 不同生产年份普洱茶中咖啡碱和主要游离态氨基酸中δ13C和δ15N的变化
从表1中可以看出,五个年份生产的普洱茶中不同化合物之间(咖啡碱、6种主要游离态氨基酸)的δ13C和δ15N值差异显著(P<0.05),所有普洱茶中咖啡碱的δ13C平均值(−31.85‰±0.72‰)要低于所有主要游离态氨基酸的δ13C平均值。主要游离态氨基酸中丝氨酸δ13C平均值>天门冬氨酸>谷氨酸>丙氨酸>苏氨酸>茶氨酸。同时研究发现,谷氨酸的δ15N平均值>丙氨酸>天门冬氨酸>茶氨酸>咖啡碱>苏氨酸>丝氨酸,这种差异可能与不同生产年份环境因子影响有关。
表 1 不同生产年份茶中的咖啡碱和氨基酸的δ13C和δ15N值(‰,n=9)Table 1. δ13C and δ15N values of caffeine and amino acid of tea samples with different production years (‰, n=9)变量 2014年普洱茶 2015年普洱茶 2016年普洱茶 2017年普洱茶 2018年普洱茶 F P 值 平均值±
标准差最小值 最大值 平均值±
标准差最小值 最大值 平均值±
标准差最小值 最大值 平均值±
标准差最小值 最大值 平均值±
标准差最小值 最大值 δ13C咖啡碱 −31.04±
0.14a−31.15 −30.68 −31.27±
0.12b−31.41 −31.05 −31.60±
0.15c−31.84 −31.36 −32.50±
0.14d−32.73 −32.35 −32.85±
0.13e−33.05 −32.64 290.27 0.000 δ13C丙氨酸 −22.27±
0.15a−22.38 −21.91 −23.30±
0.16b−23.44 −23.07 −23.54±
0.16c−23.79 −23.29 −24.38±
0.15d−24.62 −24.22 −24.64±
0.14e−24.85 −24.42 391.56 0.000 δ13C茶氨酸 −29.03±
0.17a−29.14 −28.67 −29.24±
0.14b−29.38 −29.02 −29.55±
0.19c−29.79 −29.31 −30.43±
0.19d−30.66 −30.28 −30.76±
0.16e−30.96 −30.55 267.91 0.000 δ13C谷氨酸 −20.46±
0.13a−20.57 −20.10 −21.60±
0.13b−21.75 −21.37 −21.83±
0.13c−22.08 −21.57 −22.65±
0.18d−22.89 −22.50 −22.90±
0.19e−23.11 −22.68 404.76 0.000 δ13C天门冬氨酸 −19.59±
0.19a−19.70 −19.23 −19.90±
0.10b−20.04 −19.68 −20.12±
0.14c−20.36 −19.87 −20.91±
0.12d−21.14 −20.76 −21.14±
0.10e−21.35 −20.93 204.65 0.000 δ13C苏氨酸 −28.47±
0.18a−28.58 −28.11 −29.24±
0.15b−29.38 −29.02 −29.55±
0.17c−29.79 −29.30 −30.43±
0.11d−30.67 −30.28 −30.76±
0.12e−30.96 −30.54 386.53 0.000 δ13C丝氨酸 −15.31±
0.12a−15.42 −14.95 −16.30±
0.18b−16.44 −16.07 −16.47±
0.13c−16.72 −16.21 −17.25±
0.16d−17.49 −17.09 −17.44±
0.18e−17.66 −17.22 309.57 0.000 δ15N咖啡碱 2.60±
0.31c1.91 2.99 2.59±
0.39c2.04 3.14 3.51±
0.63b2.30 4.34 4.71±
0.44a4.03 5.24 4.93±
0.26a4.34 5.16 62.26 0.000 δ15N丙氨酸 3.58±
0.33d2.89 3.97 5.00±
0.53c4.26 5.75 6.24±
0.84b4.63 7.36 7.83±
0.58a6.94 8.52 8.11±
0.34a7.34 8.40 107.32 0.000 δ15N茶氨酸 3.77±
0.35c3.08 4.16 3.88±
0.39c3.33 4.43 4.91±
0.63b3.70 5.75 6.23±
0.44a5.55 6.76 6.57±
0.26a5.98 6.80 83.65 0.000 δ15N谷氨酸 4.97±
0.34d4.28 5.36 7.56±
0.57c6.76 8.36 9.00±
0.89b7.28 10.18 10.79±
0.61a9.85 11.52 11.20±
0.36a10.39 11.51 170.40 0.000 δ15N天门冬氨酸 2.83±
0.30d2.14 3.22 4.39±
0.60c3.55 5.24 5.67±
0.94b3.86 6.93 7.32±
0.64a6.33 8.09 7.32±
0.37a6.49 7.64 89.06 0.000 δ15N苏氨酸 1.50±
0.37c0.81 1.89 1.63±
0.46c0.99 2.28 2.55±
0.73b1.14 3.53 3.79±
0.51a3.00 4.39 3.88±
0.30a3.20 4.14 48.65 0.000 δ15N丝氨酸 1.12±
0.33c0.43 1.51 1.05±
0.43c0.45 1.65 1.87±
0.68b0.56 2.78 3.00±
0.47a2.27 3.57 3.07±
0.28a2.43 3.31 41.22 0.000 注:平均值是三次重复分析的结果,不同小写字母表示不同生产年份普洱茶之间差异显著(Duncan,P<0.05)。 单因素方差分析结果(表1)显示,按照不同生产年份对茶样品进行分组,2018年生产的普洱生茶中咖啡碱、6种主要游离态氨基酸的δ13C显著低于其他年份(P<0.05),这可能是逐年大气中CO2浓度的增加,植物进行光合作用,影响气孔的开闭,继而影响δ13C值[27-28]。同时,2018年和2017年生产的普洱茶中咖啡碱、6种主要游离态氨基酸的δ15N值没有显著变化(P>0.05),但2016年至2014年的普洱生茶中除丝氨酸、咖啡碱外,其余化合物的δ15N值呈逐年降低的趋势(P<0.05)。此外,同一年样品中各化合物的δ13C和δ15N最大值和最小值存在较大差异,单一变量无法准确认证不同年份的普洱茶。为了更加准确认证普洱茶,利用化学计量学结合这些具有统计学意义的多变量(咖啡碱、6种主要游离态氨基酸的δ13C和δ15N)对不同生产年份普洱茶样品进行聚类趋势评价,探讨真实性认证的可能性。
2.3 不同生产年份普洱茶的无监督识别分析
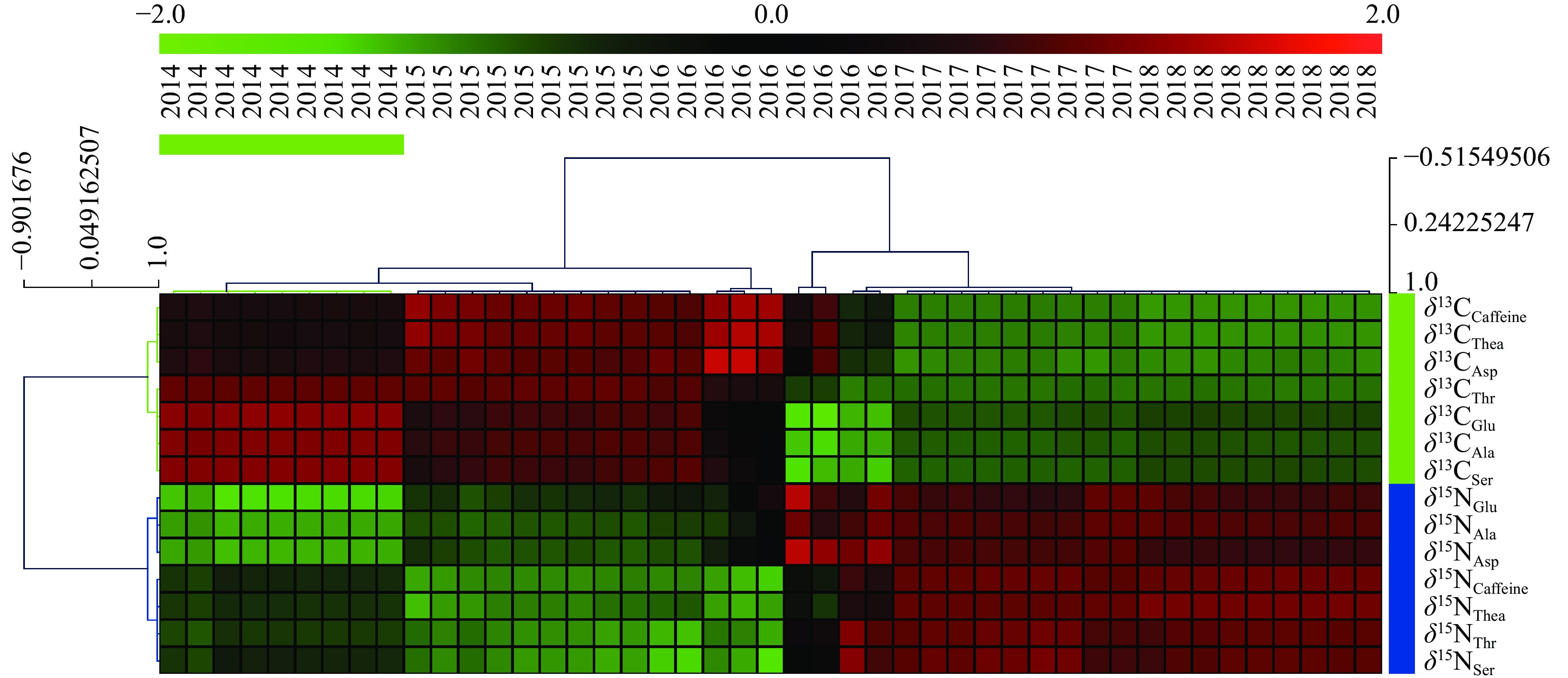
2.3.1 HCA分析
如图1所示,HCA描述了2个变量聚类树。HCA中聚类到同一簇的变量相关性较高[30]。所有化合物的δ13C值聚类到了同一聚类树,证明咖啡碱和6种主要游离态氨基酸的δ13C值之间存在较强相关性。同时可以看出,所有化合物的δ15N值聚类到了同一聚类树,证明咖啡碱和6种主要游离态氨基酸的δ15N值之间也存在较强相关性,这种不同化合物间δ13C值的相互间的相似性和δ15N值相互间的相似性机理是下一步研究重心。此外,HCA显示了多个样本聚类树,对不同生产年份的普洱茶分组效果较差。可以看出,仅有2014年普洱茶能单独聚类到同一个集群。2015年茶样和2016年茶样、2017年茶样和2018年茶样均分别聚类成一个混合集群,无法区分开来,相近年份的普洱茶较难以区分,这可能是由于相近年份生产的茶样其在土壤性质、环境条件的相似性所致[17]。因此,采用HCA结合咖啡碱和6种主要游离态氨基酸的14个δ13C和δ15N值对不同生产年份的普洱茶无法进行有效认证。
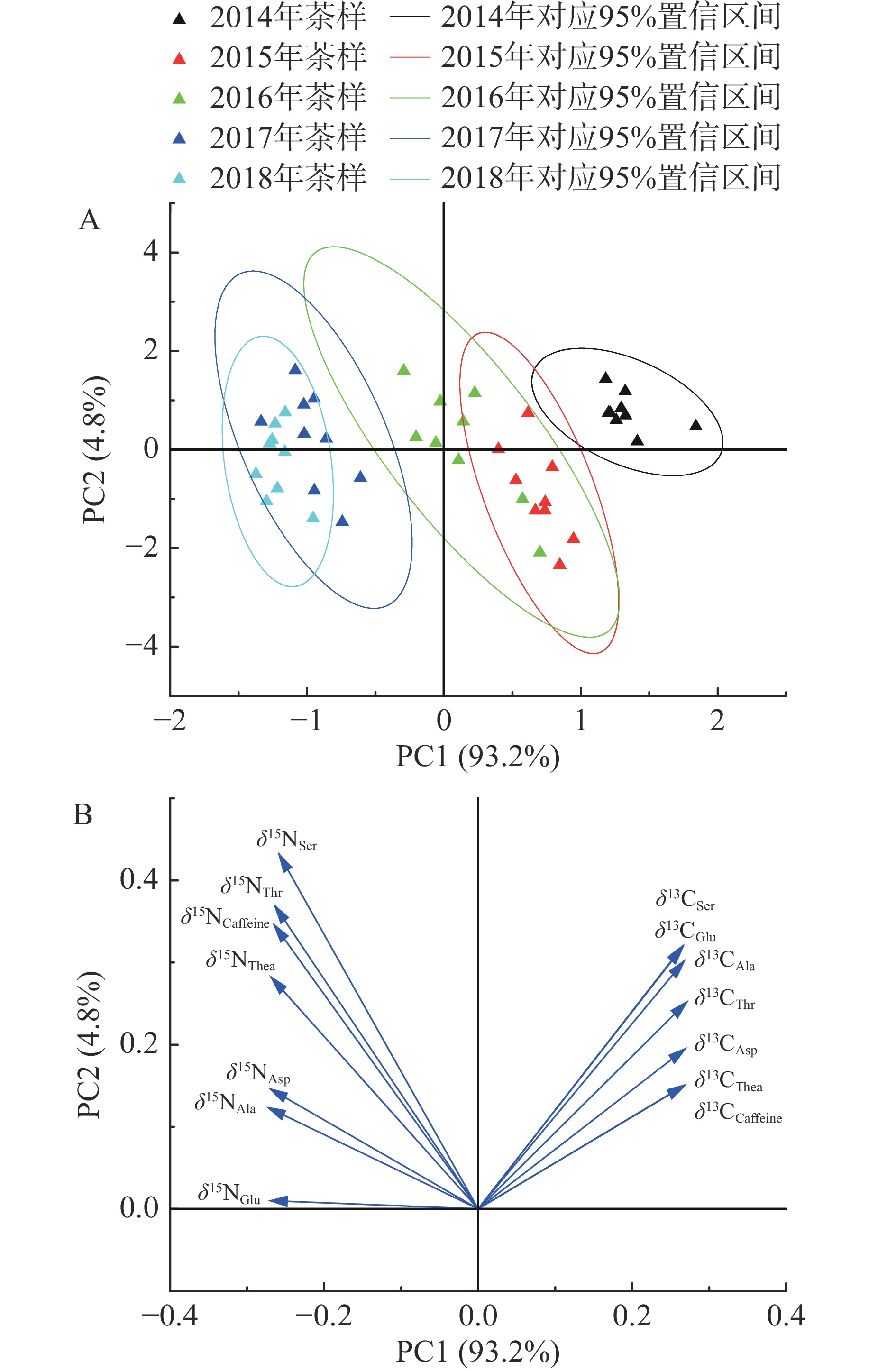
2.3.2 PCA分析
PCA分析结果表明,前二个主成分(PCs)分别代表2014年至2018年普洱茶样品的可变性的方差贡献率的93.2%和4.8%。可见,前二个主成分的累积方差贡献率较高(98.0%),表明此模型PCA分类性能较强。从图2A中可以看出2015年茶样、2016年茶样、2017年茶样和2018年茶样均很难区分出来,仅2014年茶样的鉴别较容易。从图2B所示的加载图中可以观察到PC1和PC2平面中变量的取向,PC1中大部分变量的方差贡献相差不大,均有较大贡献;而PC2的主要特征变量包括δ13C丝氨酸、δ15N苏氨酸、δ15N丝氨酸和δ15N咖啡碱。PC1能将2014年茶样认证出来,PC2很难能将茶样认证出来。总体而言,不同生产年份普洱茶样品可根据咖啡碱和6个主要游离态氨基酸的δ13C和δ15N值图谱的PCA初步分组。
通过两种无监督模式识别方法(HCA和PCA)的应用,无法对2014年至2018年普洱茶样本进行区分。因此,进一步探索其他监督识别化学计量工具,对不同生产年份茶样进行认证。
2.4 不同年份普洱茶的有监督识别证实方法的预测建模
2.4.1 PLS-DA
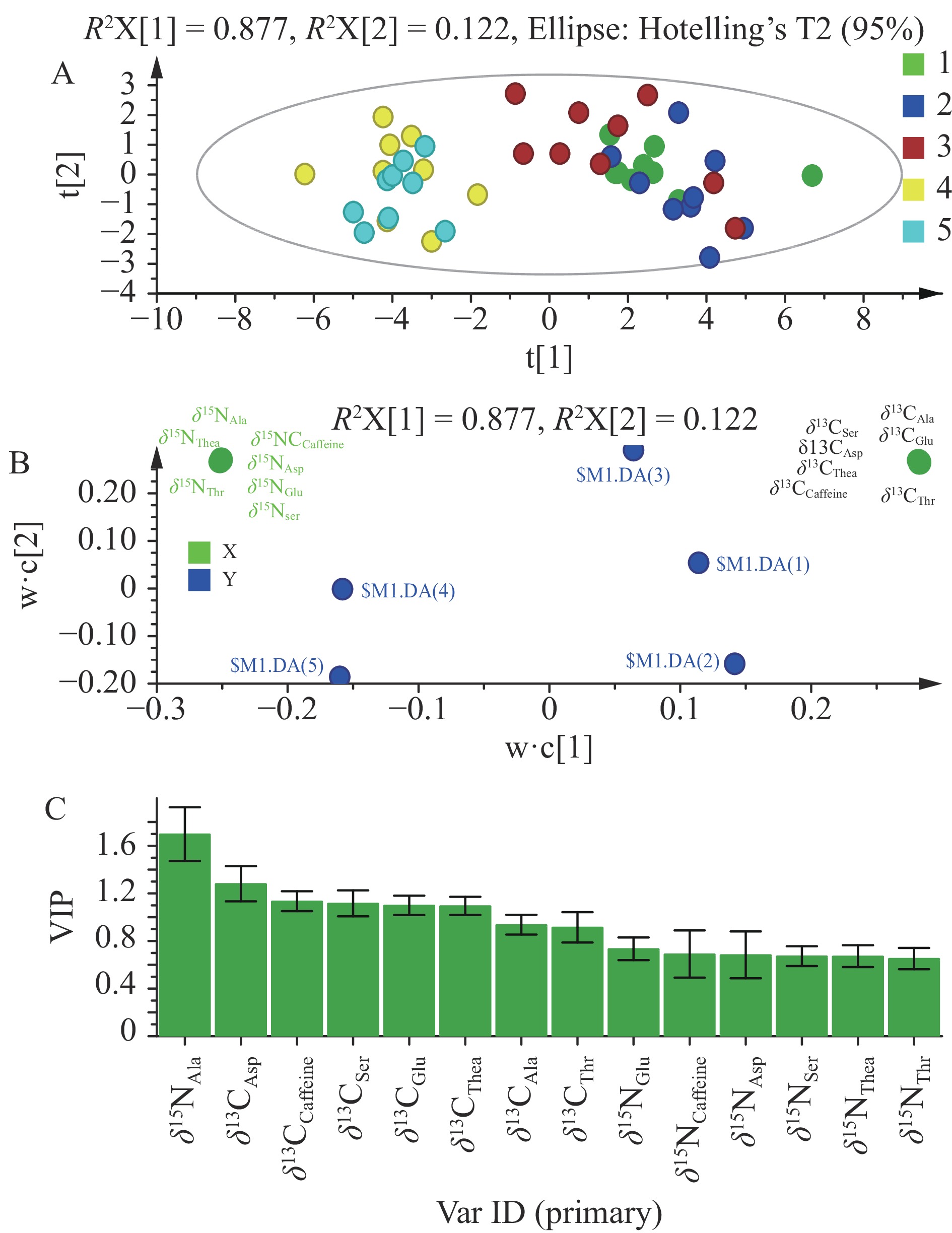
PLS-DA分析结果表明,该方法结合咖啡碱和6个主要游离态氨基酸的δ13C和δ15N值是认证不同生产年份普洱茶的合适方法(图3),因为PLS-DA模型显示了极好的模型性能(R2X=1.00,R2Y=0.86,Q2=0.83)。该模型解释了X的100%变化和Y的86%变化,预测能力Q2为83%。PLS-DA得分图显示了5个生产年份普洱茶的聚类,但研究发现,相近年份的茶样存在重叠现象,2014年茶样、2015年茶样和2016年茶样混淆,2017年茶样和2018年茶样混淆。这与相近年份的相似环境、气候和耕种习俗等综合因素有关[17]。
![]() 图 3 不同年份茶样依据咖啡碱和6个主要游离态氨基酸的δ13C和δ15N的PLS-DA鉴定结果比较注:得分图(A)和PLS-DA(B)的荷载图和PLS-DA模型得到的投影值的变量重要度(C),得分图上在95%置信区间的P<0.05水平上。1、2、3、4、5分别代表2014年、2015年、2016年、2017年、2018年的普洱茶。Figure 3. Comparison of the PLS-DA results derived from δ13C and δ15N of caffeine and six main amino acids of tea of different production years
图 3 不同年份茶样依据咖啡碱和6个主要游离态氨基酸的δ13C和δ15N的PLS-DA鉴定结果比较注:得分图(A)和PLS-DA(B)的荷载图和PLS-DA模型得到的投影值的变量重要度(C),得分图上在95%置信区间的P<0.05水平上。1、2、3、4、5分别代表2014年、2015年、2016年、2017年、2018年的普洱茶。Figure 3. Comparison of the PLS-DA results derived from δ13C and δ15N of caffeine and six main amino acids of tea of different production yearsPLS-DA评分图(图3A)显示,两个排名最高的R2X占总方差的99.9%,覆盖范围广,结果认可度高。第一个R2X占总方差的87.7%,第二个R2X中占该总方差的12.2%。两个R2X均没有特征贡献变量,可见咖啡碱和6个主要游离态氨基酸的δ13C和δ15N值对该模型的总方差影响均衡(图3B)。在PLS-DA模型预测中的变量重要度VIP>1的6个最重要的变量为δ15NAla、δ13CAsp、δ13CCaffeine、δ13CSer、δ13CGlu和δ13CThea可以作为在此模型中证实不同生产年份普洱茶产品的化学标记(图3C)。
2.4.2 BP-ANN
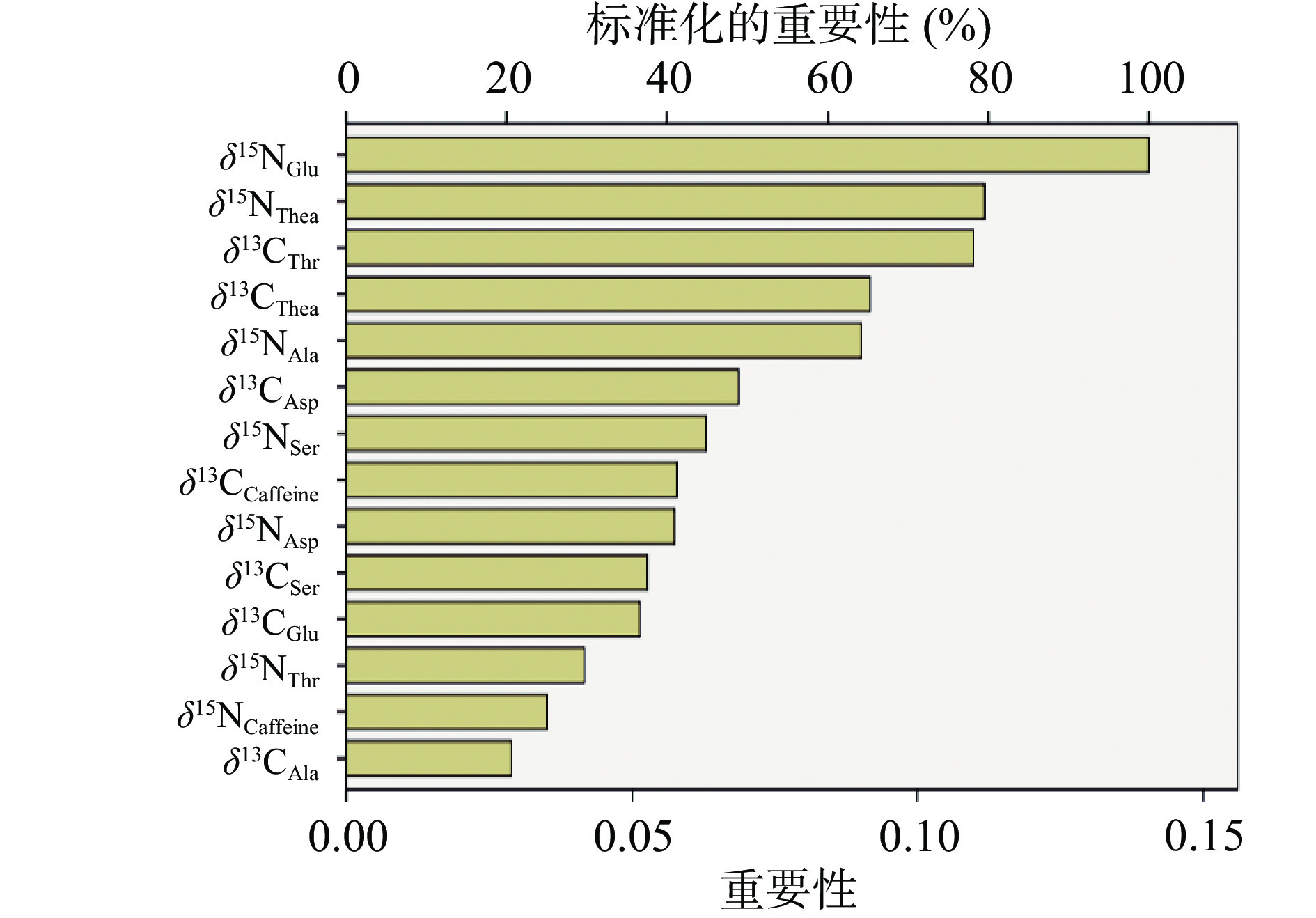
应用BP-ANN对2014年至2018年5个不同年份普洱茶样品进行认证。输入层、隐藏层和输出层分别有14个、4个和5个神经元,隐含层层数为1。并对模型的识别能力和预测能力进行了评价,从茶样中随机抽取70%的样本作为训练集,剩余的30%的样本作为外部验证测试的测试集。所有普洱茶样品可以成功地分为五组代表相应不同生产年份茶样,在模型训练过程中,识别能力的精度为100.0%(表2)。为了进一步测试建立的预测模型的预测能力,用剩下的30%普洱茶样本建立模型外部验证。30%样本中均能够正确预测为5组,总体预测精度为100.0%,说明本BP-ANN模型具有极好的适用性。与PLS-DA模型相比,BP-ANN模型的性能和效果在证实不同生产年份茶样更好,这与BP-ANN算法有关,证明BP-ANN算法相较于PLS-DA算法更适用于不同生产年份茶样的证实。根据模型中的重要性和标准化的重要性得知BP-ANN中可作为证实不同生产年份普洱茶的化学标记的6个最重要的变量为δ15NGlu、δ15NThea、δ13CThr、δ13CThea、δ15NAla和δ13CAsp(图4)。
表 2 BP-ANN模型的模型训练和预测结果Table 2. Model training and prediction results of the BP-ANN model训练集 测试集 2014年茶样 2015年茶样 2016年茶样 2017年茶样 2018年茶样 总计 2014年茶样 2015年茶样 2016年茶样 2017年茶样 2018年茶样 总计 2014年茶样 7 0 0 0 0 7 2 0 0 0 0 2 2015年茶样 0 7 0 0 0 7 0 2 0 0 0 2 2016年茶样 0 0 6 0 0 6 0 0 3 0 0 3 2017年茶样 0 0 0 6 0 6 0 0 0 3 0 3 2018年茶样 0 0 0 0 7 7 0 0 0 0 2 2 准确率(%) 100.0 100.0 100.0 100.0 100.0 100.0 100.0 100.0 100.0 100.0 100.0 100.0 2.4.3 LDA
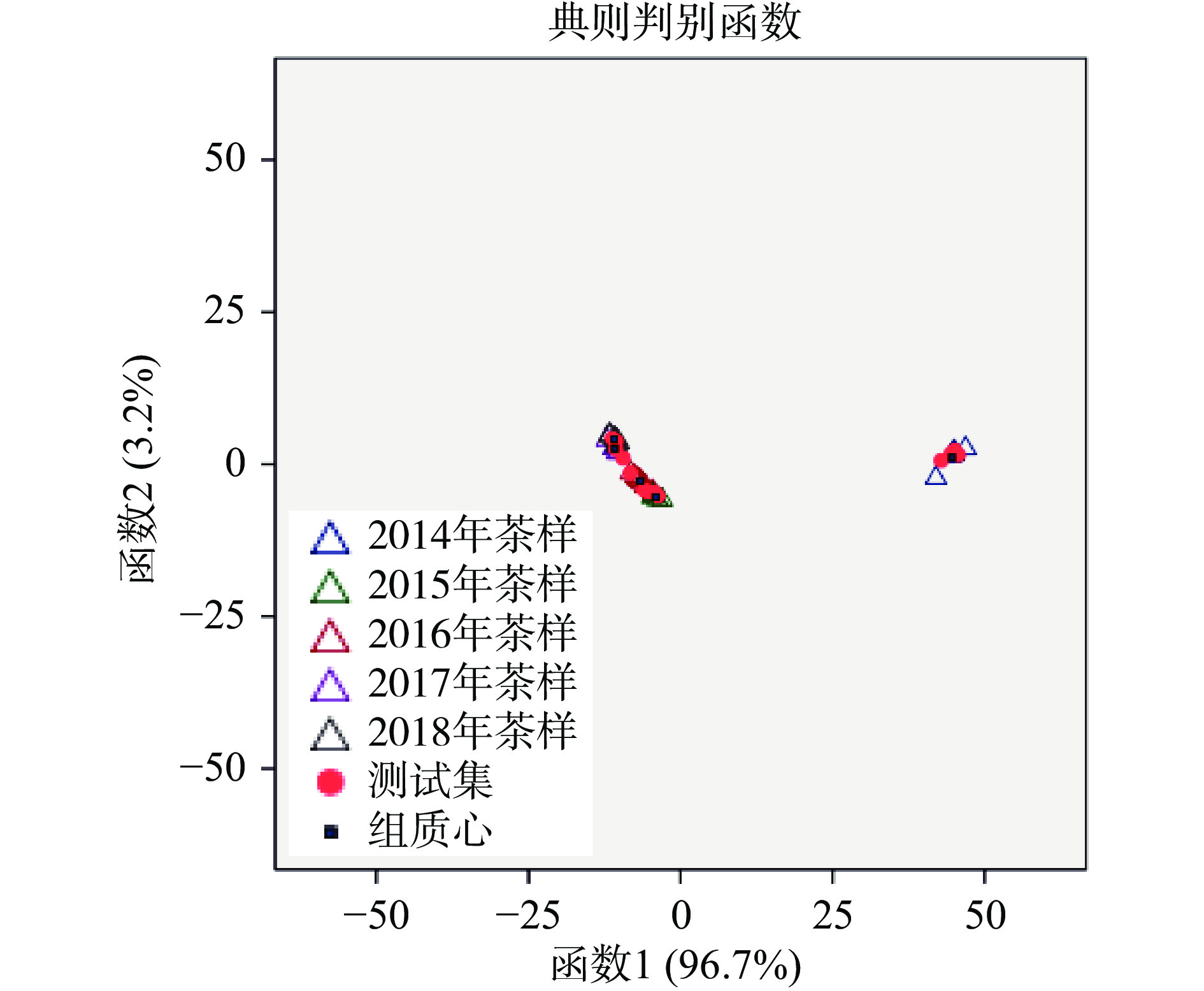
为探索结合咖啡碱和6种主要游离态氨基酸δ13C和δ15N值认证不同生产年份茶样的LDA模型的预测精度,对LDA模型的识别和预测能力进行了评价。将数据分为训练集(70%)和测试集(30%)用于外部验证。结果表明,形成了两个具有统计学意义的Fisher判别函数:第一个Fisher判别函数Wilks’ Lambda=0.000,X2=244.66,df=12,P<0.001;第二个Fisher判别函数Wilks’ Lambda=0.052,X2=79.94,df=6,P<0.001。Wilks值的显著性表明判别函数是种群分化的基础。第一个Fisher判别函数占总方差的96.7%,第二个Fisher判别函数占总方差的3.2%。两者共占总方差的99.9%,结果覆盖面极好。
经Wilks’ Lambda步进式方法选择变量后,简化后的模型中纳入了化学标记δ15NThea、δ13CGlu和δ15NGlu。判别分析表明,5个不同生产年份的茶样均得到了较好的证实(图5)。第一个Fisher判别函数对2014年茶样和2018年茶样具有明显的证实作用。第二个Fisher判别函数对2015年茶样有明显的证实作用。识别能力以模型训练中茶样正确分类的百分比表示,总体准确率为90.6%,结果很好,对2016年茶样、2017年茶样和2018年茶样识别效果相对较差,仅为85.7%。采用典型的交叉验证和外部验证方法以茶样正确分类的百分比表示预测能力。交叉验证方法的预测总准确率为87.5%,外部验证方法的预测总准确率为84.6%,该方法预测结果较好。交叉验证和外部验证方面,2018年茶样的准确率(71.4%和50.0%)低,可能与样本数量有关,后期研究将扩大样本量以提高认证的准确性(图5和表3)。
表 3 LDA模型进行模型训练、交叉验证和预测结果Table 3. Model training, cross-validation and prediction results by the LDA model2014年茶样 2015年茶样 2016年茶样 2017年茶样 2018年茶样 准确率(%) 训练集 2014年茶样 5 0 0 0 0 100.0 2015年茶样 0 6 0 0 0 100.0 2016年茶样 0 1 6 0 0 85.7 2017年茶样 0 0 0 6 1 85.7 2018年茶样 0 0 0 1 6 85.7 识别能力(%) 90.6 交叉验证集 2014年茶样 5 0 0 0 0 100.0 2015年茶样 0 6 0 0 0 100.0 2016年茶样 0 1 6 0 0 85.7 2017年茶样 0 0 0 6 1 85.7 2018年茶样 0 0 0 2 5 71.4 预测能力(%) 87.5 测试集 2014年茶样 4 0 0 0 0 100.0 2015年茶样 0 2 1 0 0 66.7 2016年茶样 0 0 2 0 0 100.0 2017年茶样 0 0 0 2 0 100.0 2018年茶样 0 0 0 1 1 50.0 预测能力(%) 84.6 对比三个预测模型性能,BP-ANN的识别和预测能力优于PLS-DA和LDA。结合咖啡碱和6种主要游离态氨基酸δ13C和δ15N值认证不同生产年份茶样,BP-ANN是最佳证实方法。通过3种不同的有监督识别方法选取的变量中,三种模型共同筛选出δ15NThea、δ13CGlu和δ15NGlu为结合咖啡碱和6种主要游离态氨基酸δ13C和δ15N值认证不同生产年份普洱茶的最重要的化学标记。
2.4.4 预测模型在“盲”数据集下验证
为了进一步检验为预测所开发的化学计量学的稳定性,对各预测模型的性能进行比较,建立PLS-DA、BP-ANN和LDA模型对2014年~2018年茶样盲样(n=5个/每年茶样)进行了“盲”验证。通过盲数据集验证,PLS-DA、BP-ANN和LDA模型的总体准确率分别为88.0%、96.0%和80.0%(表4),预测效果较好(>80%)。结果显示,在PLS-DA、BP-ANN和LDA下,2014年茶样预测准确率均为100%,2015年茶样预测准确率分别为80%、100%和80%,2016年茶样预测准确率均为80%,2017年茶样预测准确率分别为80%、100%和80%,2018年茶样预测准确率均为100%、100%和60%。结果表明,BP-ANN模型结合咖啡碱和6种主要游离态氨基酸δ13C和δ15N值在证实不同生产年份茶样具有最佳的验证性能。
表 4 模型在“盲”数据集验证结果Table 4. Models performance under a “blind” dataset2014年茶样 2015年茶样 2016年茶样 2017年茶样 2018年茶样 准确率 (%) PLS-DA 2014年
茶样5 0 0 0 0 100.0 2015年
茶样0 4 1 0 0 80.0 2016年
茶样0 1 4 0 0 80.0 2017年
茶样0 0 1 4 0 80.0 2018年
茶样0 0 0 0 5 100.0 预测能力(%) 88.0 BP-ANN 2014年
茶样5 0 0 0 0 100.0 2015年
茶样0 5 0 0 0 100.0 2016年
茶样0 1 4 0 0 80.0 2017年
茶样0 0 0 5 0 100.0 2018年
茶样0 0 0 0 5 100.0 预测能力(%) 96.0 LDA 2014年
茶样5 0 0 0 0 100.0 2015年
茶样0 4 1 0 0 80.0 2016年
茶样0 1 4 0 0 80.0 2017年
茶样0 0 1 4 0 80.0 2018年
茶样0 0 0 2 3 60.0 预测能力(%) 80.0 3. 结论
采用GC-C-IRMS成功分析了不同年份普洱茶产品的咖啡碱和6种主要游离态氨基酸δ13C和δ15N指纹图谱,普洱茶中咖啡碱和6种主要游离态氨基酸的δ13C和δ15N分析方法验证效果好,适合普洱茶中分析。采用咖啡碱和6种主要游离态氨基酸的δ13C和δ15N指纹技术对普洱生茶产品的证实是可行的。各模型预测准确率达到80%以上,验证准确率达到85%以上,BP-ANN证实性能最优。同时筛选出了不同年份普洱茶样品认证的重要的化学标记,为普洱茶产品认证的有效的指标体系。综上所述,开发了一种可行的普洱生茶中咖啡碱和6种主要游离态氨基酸δ13C和δ15N分析方法,并结合化学计量学模型对普洱茶产品成功认证。本研究初步建立了普洱茶产品认证的指标体系及技术体系,为普洱茶产品的认证体系的建立提供技术和理论支撑,也为其他食品的证实研究提供研究思路和方法参考。为了完善现有普洱茶产品认证程序,建议在更大的样本集和不同的地点对这种新方法进行测试,以进一步评价咖啡碱和氨基酸化合物碳氮稳定同位素比值分析在普洱茶产品认证中的适用性。
-
图 3 不同年份茶样依据咖啡碱和6个主要游离态氨基酸的δ13C和δ15N的PLS-DA鉴定结果比较
注:得分图(A)和PLS-DA(B)的荷载图和PLS-DA模型得到的投影值的变量重要度(C),得分图上在95%置信区间的P<0.05水平上。1、2、3、4、5分别代表2014年、2015年、2016年、2017年、2018年的普洱茶。
Figure 3. Comparison of the PLS-DA results derived from δ13C and δ15N of caffeine and six main amino acids of tea of different production years
表 1 不同生产年份茶中的咖啡碱和氨基酸的δ13C和δ15N值(‰,n=9)
Table 1 δ13C and δ15N values of caffeine and amino acid of tea samples with different production years (‰, n=9)
变量 2014年普洱茶 2015年普洱茶 2016年普洱茶 2017年普洱茶 2018年普洱茶 F P 值 平均值±
标准差最小值 最大值 平均值±
标准差最小值 最大值 平均值±
标准差最小值 最大值 平均值±
标准差最小值 最大值 平均值±
标准差最小值 最大值 δ13C咖啡碱 −31.04±
0.14a−31.15 −30.68 −31.27±
0.12b−31.41 −31.05 −31.60±
0.15c−31.84 −31.36 −32.50±
0.14d−32.73 −32.35 −32.85±
0.13e−33.05 −32.64 290.27 0.000 δ13C丙氨酸 −22.27±
0.15a−22.38 −21.91 −23.30±
0.16b−23.44 −23.07 −23.54±
0.16c−23.79 −23.29 −24.38±
0.15d−24.62 −24.22 −24.64±
0.14e−24.85 −24.42 391.56 0.000 δ13C茶氨酸 −29.03±
0.17a−29.14 −28.67 −29.24±
0.14b−29.38 −29.02 −29.55±
0.19c−29.79 −29.31 −30.43±
0.19d−30.66 −30.28 −30.76±
0.16e−30.96 −30.55 267.91 0.000 δ13C谷氨酸 −20.46±
0.13a−20.57 −20.10 −21.60±
0.13b−21.75 −21.37 −21.83±
0.13c−22.08 −21.57 −22.65±
0.18d−22.89 −22.50 −22.90±
0.19e−23.11 −22.68 404.76 0.000 δ13C天门冬氨酸 −19.59±
0.19a−19.70 −19.23 −19.90±
0.10b−20.04 −19.68 −20.12±
0.14c−20.36 −19.87 −20.91±
0.12d−21.14 −20.76 −21.14±
0.10e−21.35 −20.93 204.65 0.000 δ13C苏氨酸 −28.47±
0.18a−28.58 −28.11 −29.24±
0.15b−29.38 −29.02 −29.55±
0.17c−29.79 −29.30 −30.43±
0.11d−30.67 −30.28 −30.76±
0.12e−30.96 −30.54 386.53 0.000 δ13C丝氨酸 −15.31±
0.12a−15.42 −14.95 −16.30±
0.18b−16.44 −16.07 −16.47±
0.13c−16.72 −16.21 −17.25±
0.16d−17.49 −17.09 −17.44±
0.18e−17.66 −17.22 309.57 0.000 δ15N咖啡碱 2.60±
0.31c1.91 2.99 2.59±
0.39c2.04 3.14 3.51±
0.63b2.30 4.34 4.71±
0.44a4.03 5.24 4.93±
0.26a4.34 5.16 62.26 0.000 δ15N丙氨酸 3.58±
0.33d2.89 3.97 5.00±
0.53c4.26 5.75 6.24±
0.84b4.63 7.36 7.83±
0.58a6.94 8.52 8.11±
0.34a7.34 8.40 107.32 0.000 δ15N茶氨酸 3.77±
0.35c3.08 4.16 3.88±
0.39c3.33 4.43 4.91±
0.63b3.70 5.75 6.23±
0.44a5.55 6.76 6.57±
0.26a5.98 6.80 83.65 0.000 δ15N谷氨酸 4.97±
0.34d4.28 5.36 7.56±
0.57c6.76 8.36 9.00±
0.89b7.28 10.18 10.79±
0.61a9.85 11.52 11.20±
0.36a10.39 11.51 170.40 0.000 δ15N天门冬氨酸 2.83±
0.30d2.14 3.22 4.39±
0.60c3.55 5.24 5.67±
0.94b3.86 6.93 7.32±
0.64a6.33 8.09 7.32±
0.37a6.49 7.64 89.06 0.000 δ15N苏氨酸 1.50±
0.37c0.81 1.89 1.63±
0.46c0.99 2.28 2.55±
0.73b1.14 3.53 3.79±
0.51a3.00 4.39 3.88±
0.30a3.20 4.14 48.65 0.000 δ15N丝氨酸 1.12±
0.33c0.43 1.51 1.05±
0.43c0.45 1.65 1.87±
0.68b0.56 2.78 3.00±
0.47a2.27 3.57 3.07±
0.28a2.43 3.31 41.22 0.000 注:平均值是三次重复分析的结果,不同小写字母表示不同生产年份普洱茶之间差异显著(Duncan,P<0.05)。 表 2 BP-ANN模型的模型训练和预测结果
Table 2 Model training and prediction results of the BP-ANN model
训练集 测试集 2014年茶样 2015年茶样 2016年茶样 2017年茶样 2018年茶样 总计 2014年茶样 2015年茶样 2016年茶样 2017年茶样 2018年茶样 总计 2014年茶样 7 0 0 0 0 7 2 0 0 0 0 2 2015年茶样 0 7 0 0 0 7 0 2 0 0 0 2 2016年茶样 0 0 6 0 0 6 0 0 3 0 0 3 2017年茶样 0 0 0 6 0 6 0 0 0 3 0 3 2018年茶样 0 0 0 0 7 7 0 0 0 0 2 2 准确率(%) 100.0 100.0 100.0 100.0 100.0 100.0 100.0 100.0 100.0 100.0 100.0 100.0 表 3 LDA模型进行模型训练、交叉验证和预测结果
Table 3 Model training, cross-validation and prediction results by the LDA model
2014年茶样 2015年茶样 2016年茶样 2017年茶样 2018年茶样 准确率(%) 训练集 2014年茶样 5 0 0 0 0 100.0 2015年茶样 0 6 0 0 0 100.0 2016年茶样 0 1 6 0 0 85.7 2017年茶样 0 0 0 6 1 85.7 2018年茶样 0 0 0 1 6 85.7 识别能力(%) 90.6 交叉验证集 2014年茶样 5 0 0 0 0 100.0 2015年茶样 0 6 0 0 0 100.0 2016年茶样 0 1 6 0 0 85.7 2017年茶样 0 0 0 6 1 85.7 2018年茶样 0 0 0 2 5 71.4 预测能力(%) 87.5 测试集 2014年茶样 4 0 0 0 0 100.0 2015年茶样 0 2 1 0 0 66.7 2016年茶样 0 0 2 0 0 100.0 2017年茶样 0 0 0 2 0 100.0 2018年茶样 0 0 0 1 1 50.0 预测能力(%) 84.6 表 4 模型在“盲”数据集验证结果
Table 4 Models performance under a “blind” dataset
2014年茶样 2015年茶样 2016年茶样 2017年茶样 2018年茶样 准确率 (%) PLS-DA 2014年
茶样5 0 0 0 0 100.0 2015年
茶样0 4 1 0 0 80.0 2016年
茶样0 1 4 0 0 80.0 2017年
茶样0 0 1 4 0 80.0 2018年
茶样0 0 0 0 5 100.0 预测能力(%) 88.0 BP-ANN 2014年
茶样5 0 0 0 0 100.0 2015年
茶样0 5 0 0 0 100.0 2016年
茶样0 1 4 0 0 80.0 2017年
茶样0 0 0 5 0 100.0 2018年
茶样0 0 0 0 5 100.0 预测能力(%) 96.0 LDA 2014年
茶样5 0 0 0 0 100.0 2015年
茶样0 4 1 0 0 80.0 2016年
茶样0 1 4 0 0 80.0 2017年
茶样0 0 1 4 0 80.0 2018年
茶样0 0 0 2 3 60.0 预测能力(%) 80.0 -
[1] LIU Z, YUAN Y W, ZHANG Y Z, et al. Geographical traceability of Chinese green tea using stable isotope and multi-element chemometrics[J]. Rapid Communications in Mass Spectrometry: RCM,2019,33:778−788. doi: 10.1002/rcm.8405
[2] ZHAO H Y, ZHANG S L, ZHANG Z W. Relationship between multi-element composition in tea leaves and in provenance soils for geographical traceability[J]. Food Control,2017,76:82−87. doi: 10.1016/j.foodcont.2017.01.006
[3] 吕嘉枥, 杨柳青, 孟雁南. 茯砖茶中金花菌群的研究进展[J]. 食品科学,2020,41(9):316−322. [LÜ J X, YANG L Q, MENG Y N. Development of golden flower fungus community in Fuzhuan brick tea: A review[J]. Food Science,2020,41(9):316−322. [4] WANG L Y, WEI K, JIANG Y W, et al. Seasonal climate effects on flavanols and purine alkaloids of tea (Camellia sinensis L.)[J]. European Food Research and Technology,2011,233:1049−1055. doi: 10.1007/s00217-011-1588-4
[5] 侯粲, 杜昱光, 王曦, 等. 发酵陈皮黑茶的化学成分差异及体外活性[J]. 食品科学,2020,41(18):226−232. [HOU C, DU Y G, WANG X, et al. Differences in chemical components and in vitro activity of fermented orange peel black tea[J]. Food Science,2020,41(18):226−232. [6] WU C, YAMADA K, SUMIKAWA O, et al. Development of a methodology using gas chromatography-combustion-isotope ratio mass spectrometry for the determination of the carbon isotope ratio of caffeine extracted from tea leaves (Camellia sinensis)[J]. Rapid Communications in Mass Spectrometry,2012,26(8):978−982. doi: 10.1002/rcm.6177
[7] 曹永, 赵谋明, 赵甜甜, 等. 不同黑茶提取物功能性成分分析及活性评价[J]. 食品科学,2017,38(18):54−59. [CAO Y, ZHAO M M, ZHAO T T, et al. Functional component analysis and activity evaluation of different black tea extracts[J]. Food Science,2017,38(18):54−59. [8] LV H P, ZHANG Y J, LIN Z, et al. Processing and chemical constituents of Pu-erh tea: A review[J]. Food Research International,2013,53:608−618. doi: 10.1016/j.foodres.2013.02.043
[9] 吕海鹏, 王梦琪, 张 悦, 等. 普洱茶后发酵过程中多酚类成分生物转化的研究进展[J]. 食品科学,2018,39(23):306−312. [LÜ H P, WANG M Q, ZHANG Y, et al. Research progress on biotransformation of polyphenols in post fermentation process of Pu'er tea[J]. Food Science,2018,39(23):306−312. [10] LÜ S D, WU Y S, SONG Y Z, et al. Multivariate analysis based on GC-MS fingerprint and volatile composition for the quality evaluation of Pu-erh green tea[J]. Food Analytical Methods,2015,8:321−333. doi: 10.1007/s12161-014-9900-0
[11] 李孚杰, 潘丹贞, 张丛兰, 等. 纤维素酶法提取板栗壳色素的工艺条件优化[J]. 食品科学,2012,33(2):149−153. [LI F J, PAN D Z, ZHANG C L, et al. Optimization of technological conditions for extracting pigment from chestnut shell by cellulase[J]. Food Science,2012,33(2):149−153. [12] HOU Y, SHAO W F, XIAO R, et al. Pu-erh tea aqueous extracts lower atherosclerotic risk factors in a rat hyperlipidemia model[J]. Experimental Gerontology,2009,44:434−439. doi: 10.1016/j.exger.2009.03.007
[13] CAP Y N, LIU T X. Analysis of aroma composition in Pu-erh raw and ripe teas with different storage time[J]. Agro Food Industry Hi-tech,2011,32(10):64−67.
[14] HAYES J M. Fractionation of carbon and hydrogen isotopes in biosynthetic processes[J]. Rev Mineral Geochem,2001,43:225−277. doi: 10.2138/gsrmg.43.1.225
[15] CENGIZ M F, TURAN O, OZDEMIR D, et al. Geographical origin of imported and domestic teas (Camellia sinensis) from Turkey as determined by stable isotope signatures[J]. International Journal of Food Properties,2017,20(12):3234−3243. doi: 10.1080/10942912.2017.1283327
[16] LOU Y X, FU X S, YU X P, et al. Stable isotope ratio and elemental profile combined with support vector machine for provenance discrimination of oolong tea (wuyi-rock tea)[J]. Journal of Analytical Methods in Chemistry,2017:5454231.
[17] TEECE M A, FOGEL M L. Stable carbon isotope biogeochemistry of monosaccharides in aquatic organisms and terrestrial plants[J]. Org Geochem,2007,38:458−73. doi: 10.1016/j.orggeochem.2006.06.008
[18] REID L M, O'DONNELL C P, DOWNEY G. Recent technological advances for the determination of food authenticity[J]. Trends in Food Science & Technology,2006,17:344.
[19] KELLY S, HEATON K, HOOGEWERFF J. Tracing the geographical origin of food: The application of multi-element and multi-isotope analysis[J]. Trends Food Sci Technol,2005,16:555. doi: 10.1016/j.jpgs.2005.08.008
[20] ASHIHARA H, CROZIER A. Caffeine: A well known but littlementioned compound in plant science[J]. Trends Plant Sci,2001,6:407. doi: 10.1016/S1360-1385(01)02055-6
[21] WECKERLE B, RICHLING E, HEINRICH S, et al. Origin assessment of green coffee (Coffea arabica) by multi-element stable isotope analysis of caffeine[J]. Anal Bioanal Chem,2002,374:886. doi: 10.1007/s00216-002-1560-z
[22] DUNBAR J, WILSON A T. Determination of geographic origin of caffeine by stable isotope analysis[J]. Anal Chem,1982,54:590. doi: 10.1021/ac00240a057
[23] VAN LEEUWEN K A, PRENZLER P D, RYAN D, et al. Gas chromatography-combustion-isotope ratio mass spectrometry for traceability and authenticity in foods and beverages[J]. Compr Rev Food Sci Food Saf,2014,13:814−837. doi: 10.1111/1541-4337.12096
[24] BOL R, OSTLE N J, BALESDENT J, et al. Influence of long-term fertilizer and manure on the distribution and 15N natural abundance values of amino acids in the Versailles ‘42 parcelles’: Preliminary results[J]. Abstr Pap Am Chem Soc,2001,221:534.
[25] BOL R, OSTLE N J, PETZKE K J. Compound specific plant amino acid δ15N values differ with functional plant strategies in temperate grassland[J]. J Plant Nutr Soil Sci,2002,165:661−667. doi: 10.1002/jpln.200290000
[26] RICHLING E, HOHN C, WECKERLE B, et al. Authentication analysis of caffeine-containing foods via elemental analysis combustion/pyrolysis isotope ratio mass spectrometry (EA-C/P-IRMS)[J]. Eur Food Res Technol,2003,216:544. doi: 10.1007/s00217-003-0677-4
[27] PERVA-UZUNALIC A, SKERGET M, KNEZ Z, et al. Extraction of active ingredients from green tea (Camellia sinensis): Extraction efficiency of major catechins and caffeine[J]. Food Chemistry,2006,96:597. doi: 10.1016/j.foodchem.2005.03.015
[28] LAURSEN K H, SCHJOERRING J K, OLESEN J E, et al. Multielemental fingerprinting as a tool for authentication of organic wheat, barley, faba bean, and potato[J]. J Agric Food Chem,2011,59:4385−4396. doi: 10.1021/jf104928r
[29] STYRING A K, KUHL A, KNOWLES T D J, et al. Practical consideration in the determination of compound-specific amino acid δ15N values in animal and plant tissues by gas chromatography-combustion-isotope ratio mass spectrometry, following derivatisation to their N-acetylisopropyl esters[J]. Rapid Commun Mass Spectrom,2012,26:2328−2334. doi: 10.1002/rcm.6322
[30] MAURO P, LUCA Z, KRISTIAN H L, et al. Compound-specific δ15N and δ13C analyses of amino acids for potential discrimination between organically and conventionally grown wheat[J]. J Agric Food Chem,2015,63:5841−5850. doi: 10.1021/acs.jafc.5b00662
[31] FRIEDMAN M, KIM SY, LEE S J, et al. Distribution of catechins, theaflavins, caffeine, and theobromine in 77 teas consumed in the United States[J]. Journal of Food Science,2005,70:C550.
-
期刊类型引用(9)
1. 王晓明,石金明,韩敏义,王孝治,李凌云,靳爽爽,董华发. 巴氏杀菌工艺对白切鸡食用品质及货架期的影响. 食品工业科技. 2024(11): 93-101 .  本站查看
本站查看
2. 张咏彬,于卓然,李汴生,阮征,李瑞清,石金明. 超高压处理后预包装白切鸡安全性及食用品质的变化. 现代食品科技. 2024(11): 229-237 .  百度学术
百度学术
3. 詹磊,徐卓越,蓝国玮,钟庆玲,刘倩桐,陈佩. 基于主成分分析构建混合多糖凝胶品质综合评价模型. 现代食品科技. 2023(04): 214-223 .  百度学术
百度学术
4. 戢得蓉,石晶晶,王艺融,段丽丽. 复配防腐剂在怪味鸡丝中的应用研究. 中国食品添加剂. 2023(05): 233-240 .  百度学术
百度学术
5. 吴世豪,黄天然,黄明. HS-SPME-GC-MS技术结合电子鼻分析热处理对南京盐水鸭高温蒸煮味的影响. 中国农业科学. 2023(17): 3435-3451 .  百度学术
百度学术
6. 孔琪,饶胜其,杭锋. 乳酸菌发酵液对调理牛肉品质及风味的影响. 食品与发酵工业. 2023(21): 74-82 .  百度学术
百度学术
7. 赵银峰,周春燕,吉莉莉,陈玲,陈德群. 喜德阉鸡与市售几种鸡肉的品质比较研究. 成都大学学报(自然科学版). 2022(01): 32-38 .  百度学术
百度学术
8. 张乐乐,黄林玉,陈美珠,汪菲菲,楚艳艳,刘生杰. 荆芥口香糖的工艺优化. 河南科技学院学报(自然科学版). 2022(05): 38-45 .  百度学术
百度学术
9. 陈乐乐,陈嘉澍,黄桂颖,冯卫华,沈畅华,陈俊文,曾晓房,陈海光,石金明,陈伟波. 感官分析在广式传统肉品研制与品控中的应用研究进展. 肉类研究. 2021(12): 64-69 .  百度学术
百度学术
其他类型引用(5)





 下载:
下载:
 下载:
下载:



