Recent Advances in Determination Methods of Fatty Acid Markers in Royal Jelly
-
摘要: 蜂王浆是青年工蜂咽下腺和上颚腺分泌的乳白色、淡黄色或浅橙色浆状物质,脂肪酸是蜂王浆的主要活性成分之一,主要包括反式-10-羟基-2-癸烯酸、10-羟基癸酸、3,10-二羟基-癸酸、8-羟基辛酸、癸二酸等,具有抗炎、抗菌和抗肿瘤等多种生物活性。在国家标准中,蜂王浆脂肪酸是评价蜂王浆质量的重要指标,因此脂肪酸的检测对蜂王浆的质量控制具有十分重要的作用。本文综述了目前蜂王浆脂肪酸的检测方法,简要介绍了检测方法的基本原理,同时对不同检测技术和应用特点进行比较,并对今后检测发展的趋势进行了探讨,为进一步开发高效的脂肪酸检测方法及蜂王浆的质量控制提供一定的理论参考。
-
关键词:
- 蜂王浆 /
- 脂肪酸 /
- 检测方法 /
- 质量控制 /
- 反式-10-羟基-2-癸烯酸
Abstract: Royal jelly is a yellowish, creamy and acidic substance secreted by mandibular and hypopharyngeal glands of young worker bees. Fatty acids including (E)-10-hydroxy-2-decenoic acid, 10-hydroxydecanoic acid, 3,10-dihydroxydecanoic acid, 8-hydroxyoctanoic acid, sebacic acid and so on are one of the major components of royal jelly with a variety of biological activities, such as anti-inflammation, anti-bacteria and anti-tumor. Fatty acids are one of the main active components of royal jelly which are considered an important indicator in quality control. This article summarizes the identification methods of the royal jelly fatty acid including the principle of the method, the comparisons of technology and application features of methods, as well as the future research prospects. This review will provide a reference for the development of determining methods for fatty acids and pave the way for quality control of royal jelly.-
Keywords:
- royal jelly /
- fatty acids /
- determination methods /
- quality control /
- (E)-10-hydroxy-2-decenoic acid
-
蜂王浆是由青年工蜂的咽下腺和上颚腺分泌的乳白色、淡黄色或浅橙色浆状物质[1],味道酸、涩,略带辛辣,用于饲喂蜂王及3日龄以下幼虫,对蜜蜂的级型分化有重要作用[2]。蜂王浆富含蛋白质、碳水化合物、脂类、维生素和矿物质等多种营养成分[3],目前已被证明具有抗氧化[4]、抗菌[5]、抗炎[6]、抗肿瘤[7]、免疫调节[8]等多种生理功能[9]。脂类是蜂王浆的主要成分之一,约占新鲜蜂王浆总量的3%~8%[10],占蜂王浆冻干粉总量的8%~19%[11],其中80%~90%的脂类物质以游离脂肪酸的形式存在[12],目前已从蜂王浆中检测出94种脂肪酸[13],其中主要由反式-10-羟基-2-癸烯酸((E)-10-hydroxy-2-decenoic acid,10-HDA)、10-羟基癸酸、3,10-二羟基-癸酸、8-羟基辛酸、癸二酸组成[14]。蜂王浆中的脂肪酸是其抗炎、抗菌、抗肿瘤、免疫调节等多种功能活性的主要来源之一,蜂王浆中的主要脂肪酸10-HDA是衡量蜂王浆质量的重要指标[14]。因此,准确检测蜂王浆中脂肪酸的组成对蜂王浆的质量控制十分重要。
近年来,已有很多先进的研究技术和方法成功应用于蜂王浆脂肪酸的检测中,如液相色谱法、气相色谱法、酶联免疫吸附剂检测法等[15],其中,液相色谱法作为国家标准(GB 9697-2008)中检测蜂王浆中10-HDA的参考方法,已经广泛应用于蜂王浆的质量控制工作中。同时,针对传统检测方法中检测时间长、消耗高等多方面的不足,许多研究集中于通过改变前处理方法及检测条件来缩短检测时间、提高准确度、降低检出限等,对方法进行了较大的补充与完善,为蜂王浆的检测提供了更高的便利性和可靠性。此外,随着检测技术的不断发展,近红外光谱、高分辨质谱等多种先进技术也开始出现在蜂王浆脂肪酸的检测领域,为快速、简易、无损、精确检测蜂王浆中脂肪酸提供了更多的选择。由于10-HDA在蜂王浆的特殊作用,其中大部分研究集中在主要脂肪酸10-HDA的检测上,应用于蜂王浆的质量检测[16]。本文总结了蜂王浆中脂肪酸检测方法的最新研究进展,分析了各种检测方法的原理及其在蜂王浆脂肪酸检测中的应用,并讨论了蜂王浆中潜在的脂肪酸检测指标,为蜂王浆的质量控制提供科学依据。
1. 蜂王浆中脂肪酸的组成及其生物活性
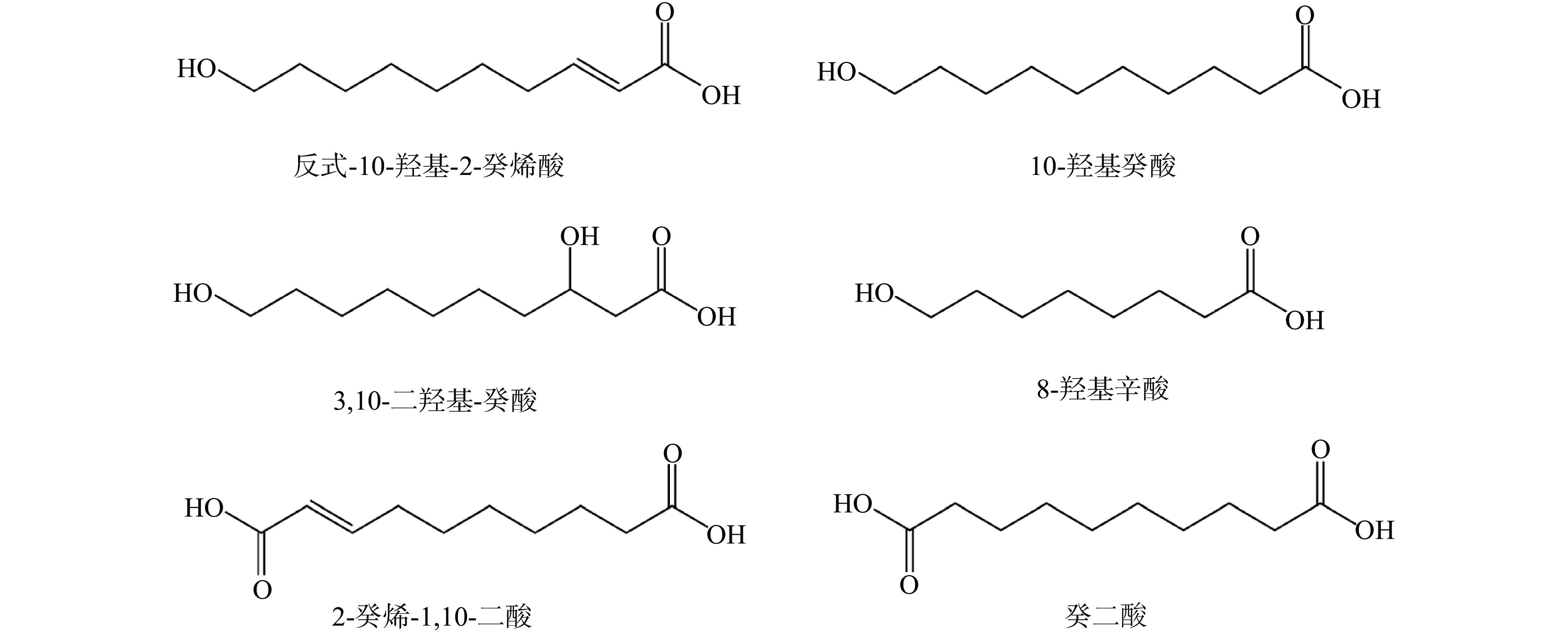
脂肪酸是蜂王浆中脂类成分的重要组成部分,占脂类成分总量的80%~90%,其中大部分为游离脂肪酸[12]。与其他动物源脂肪酸不同,蜂王浆脂肪酸为中链脂肪酸,多含有8~10个碳原子羟基脂肪酸或二元酸[11],其中含量较高的为:反式-10-羟基-2-癸烯酸、10-羟基癸酸、3,10-二羟基-癸酸、8-羟基辛酸、2-癸烯-1,10-二酸和癸二酸,分别占脂肪酸总量的50%~60%、13.0%~17.6%、4.4%~7.8%、3.1%~6.5%、3.1%~5.6%、2.5~4.1%[14],其分子结构式如图1所示。蜂王浆中的主要脂肪酸是10-HDA,也被称为王浆酸,其结构很特殊,是一种含有10个碳原子的直链不饱和脂肪酸,碳链的一端为羟基,另一端为羧基,在2号位上带有一个双键。这是一种仅存在于蜂王浆中的脂肪酸,被视为蜂王浆的特征性物质[17],且含量远大于其他脂肪酸。10-HDA的含量比较稳定,不易受温度和时间变化的影响,有研究表明,无论样品是在−18 ℃、4 °C还是室温下储存,该成分都能保持稳定长达1年之久,所以10-HDA作为检测指标用于蜂王浆的质量分析中[18]。根据蜂王浆国际标准(ISO 12824),新鲜蜂王浆的10-HDA含量需要≥1.4%[19],以此为基准,不同国家又制定了不同的国家标准。我国规定优等品蜂王浆10-HDA含量应≥1.8%,合格品蜂王浆的10-HDA含量应≥1.4%(GB 9697-2008)[20]。
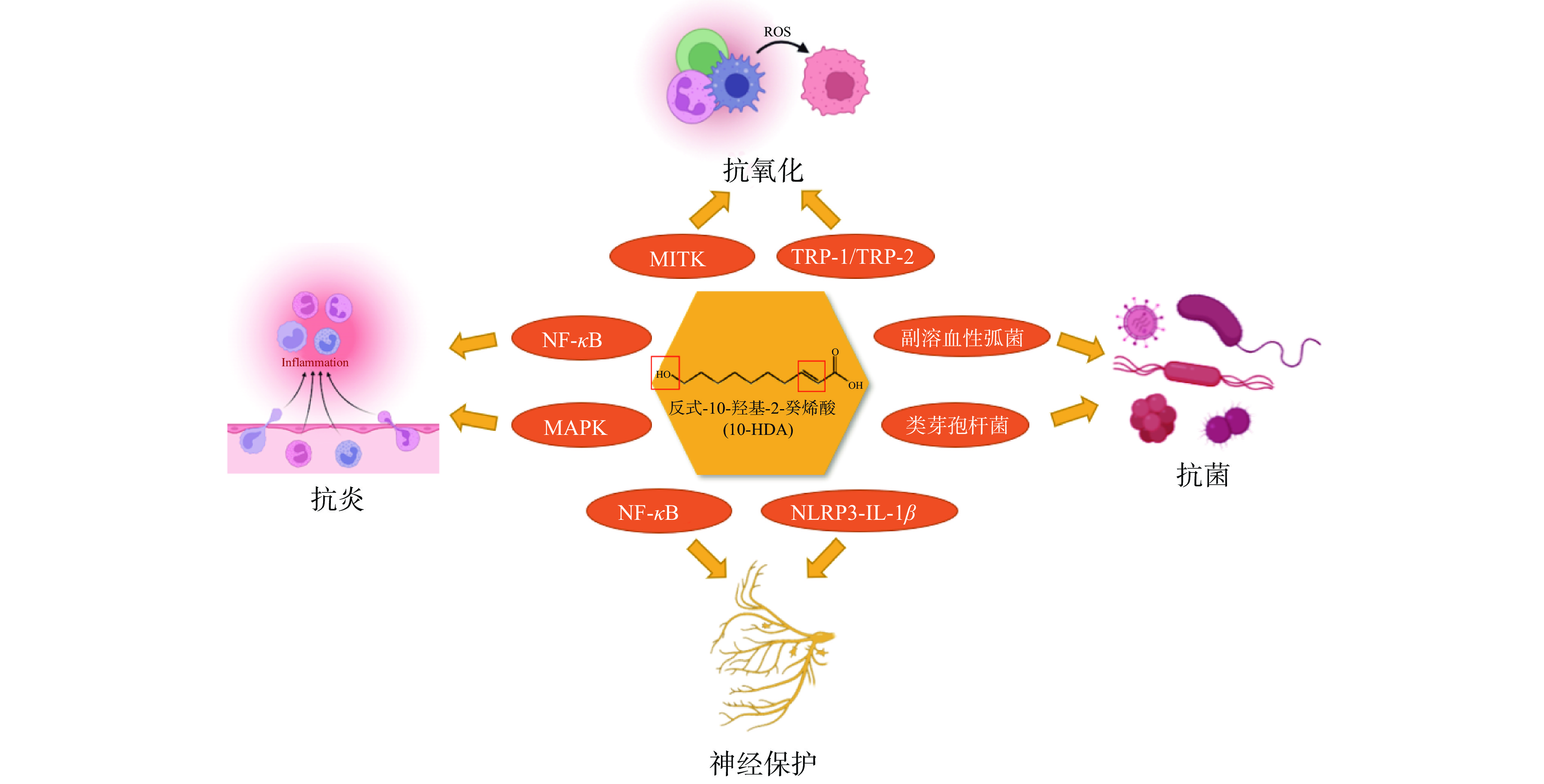
由于其特殊的结构,使得蜂王浆脂肪酸有着十分广泛的生物学活性,如抗炎、神经保护、抗氧化、抗菌等。例如,在抗炎方面,10-HDA、10-羟基癸酸和癸二酸可以通过调节丝裂原活化蛋白激酶和核转录因子kappa B(nuclear factor kappa B,NF-κB)信号转导蛋白,发挥其抗炎作用。其中,10-HDA还可以调节一些关键的炎症基因[21];神经保护方面,10-HDA可以通过下调α肿瘤坏死因子(tumor necrosis factor-α,TNF-α)/NF-κB通路和炎症小体-白介素-1β(interleukin-1β,IL-1β)通路发挥其抗神经炎症作用,而且还可以通过叉头蛋白O1(forkhead box protein O1,FOXO1)介导的自噬激活来保护脂多糖诱导的神经损伤[22];在抗氧化方面,通过抑制B16F10黑色素瘤细胞的酪氨酸酶活性及相关蛋白和相关转录因子的表达,起到抑制皮肤色素沉着、皮肤美白的作用[23];且因其较低的pH,10-HDA还可以发挥其抗菌作用,如保护蜜蜂幼虫免受类芽孢杆菌等细菌引起的感染[24],此外,10-HDA还对动物或人类某些致病菌有杀菌作用,包括金黄色葡萄球菌、副溶血性弧菌、霍乱沙门氏菌等[25]。10-HDA作为蜂王浆脂肪酸的重要组成部分,在发挥生物活性中起到了关键的作用,其生物活性及作用途径示意图如图2所示。正是由于蜂王浆脂肪酸具有多种生理活性,使其广泛应用于保健品、药品、化妆品等行业[26],如将10-HDA作为有效成分制成有动脉粥样硬化症和骨质疏松症治疗效果的胶囊[27]、将10-HDA和金银花等成分结合制成口腔喷雾来治疗口腔中牙龈萎缩等病症[28]、将10-HDA和L-抗坏血酸2-葡糖苷作为有效成分制成一种抗皮肤光老化制剂[29]等。
综上,蜂王浆脂肪酸在质量控制和保健品、化妆品等领域都有了广泛的应用,而蜂王浆脂肪酸的检测是其中的重要步骤之一。蜂王浆脂肪酸检测依赖于分析方法的可靠性和准确性,因此准确、灵敏地从蜂王浆中提取以及检测脂肪酸是至关重要的。
2. 蜂王浆中脂肪酸的检测方法
目前应用于蜂王浆脂肪酸的检测方法主要包括高效液相色谱法、气相色谱法、毛细管电泳、近红外光谱法等,各种脂肪酸检测方法的简要总结可见表1。
表 1 蜂王浆脂肪酸检测方法及脂肪酸种类Table 1. Determination methods and types of fatty acids of royal jelly蜂王浆种类 检测方法 脂肪酸种类 参考文献 新鲜蜂王浆 HPLC 10-HDA Bloodworth等[32] 蜂王浆制剂(冻干粉、颗粒剂、口服液) HPLC 10-HDA 杨江丰等[37] 新鲜蜂王浆 HPLC 10-HDA 张娟等[38] 新鲜蜂王浆 HPLC 10-HDA 罗小凤等[39] 新鲜蜂王浆和蜂王浆制剂 HPLC 10-HDA Genc等[34] 蜂王浆冻干粉、蜂蜜、含有蜂王浆的蜂蜜 HPLC 10-HDA Santos等[40] 新鲜蜂王浆、蜂王浆冻干粉 超高效液相色谱法、HPLC 10-HDA Zhou等[41] 新鲜蜂王浆 超高效液相色谱-串联质谱法 癸二酸 李兴安等[42] 新鲜蜂王浆 高效液相色谱-质谱法 10-HDA、8-羟基辛酸、癸二酸、10-羟基癸酸、
2-十二碳烯二酸和十二烷基二酸刘善菁等[43] 新鲜蜂王浆 液相色谱-高分辨质谱法 10-HDA、10-羟基癸酸、3-羟基癸酸、
癸二酸和2-十二烯二酸Kokotou等[16] 新鲜蜂王浆 气相色谱-质谱联用法 28种脂肪酸(10-HDA、10-羟基癸酸、癸二酸等) Lercker等[49] 蜂王浆冻干粉 气相色谱-质谱联用法 35种脂肪酸(10-HDA、10-羟基癸酸、癸二酸等) Isidorov等[50] 新鲜蜂王浆 顶空固相微萃取-气相色谱-质谱联用法 85种脂肪酸(10-HDA、10-羟基癸酸、癸二酸等) Isidorov等[51] 新鲜蜂王浆 毛细管气相色谱法 14种脂肪酸(10-HDA、10-羟基癸酸、癸二酸等) Ferioli等[52] 蜂王浆制剂 气相色谱法 10-HDA 李小佳等[57] 新鲜蜂王浆 毛细管电泳法、HPLC 10-HDA Ferioli等[60] 新鲜蜂王浆 毛细管电泳法 10-HDA Munoz等[61] 蜂王浆类膳食补充剂 特制毛细管电泳-非接触电导检测法 10-HDA Duong等[63] 新鲜蜂王浆 近红外光谱结合化学计量学法 10-HDA Yang等[66] 新鲜蜂王浆 ATR-FTMIR与近红外光谱结合化学计量学法 10-HDA Yang等[67] 新鲜蜂王浆、蜂王浆冻干粉 酶联免疫吸附检测法 10-HDA Kaljurand等[58] 新鲜蜂王浆 紫外分光光度法 10-HDA 赵静[70] 新鲜蜂王浆 比色法 10-HDA Su等[10] 2.1 高效液相色谱法
高效液相色谱法(high performance liquid chromatography,HPLC)是根据被测样品在固定相和流动相之间的分配系数、吸附力等不同,以液体为流动相,在高压输液系统下,对溶剂的成分进行分离[30-31]。这种方法不需要进行衍生化,简化了分析过程,被广泛应用于脂肪酸的检测中[32]。
10-HDA是蜂王浆中含量最高的脂肪酸[33],常用于评价蜂王浆的质量,也是蜂王浆中的生物活性物质[32],因此大部分研究都集中于10-HDA的测定中。在HPLC中,方法的细微差别会导致测定范围也不同,总体上,蜂王浆中10-HDA的浓度范围在0.75%~6.37%之间[18, 32, 34-35]。Bloodworth等[32]首先提出了采用HPLC测定10-HDA,此方法以萘酚作为内标,分析了39种含有蜂王浆的商品样品中10-HDA的含量。在HPLC中,由液体作为流动相,对不同组分有不同的吸附力,因此流动相可以直接影响组分的分离度[36]。在10-HDA的检测方法中,常用甲醇:水:磷酸( 45:65:0.5)[37]、甲醇:0.1%甲酸(55:45)[38]、甲醇:2%磷酸溶液(55:45)[39]、乙腈:四氢呋喃:水(50.4:21.6:28)[34]等流动相体系分析蜂王浆及制品中的10-HDA含量,线性关系均良好(r>0.9999),并且重现性好,回收率高[39],这些方法的建立对蜂王浆中10-HDA的测定有了初步成效。HPLC的机器参数是影响测定结果的重要条件,其中,通过改变色谱柱的柱温和流动相的流速,可以显著减少HPLC分析的时间。例如将流速设定为1 mL/min,将柱温提升至40 ℃,可以在不到5 min的时间内完成10-HDA的定性和定量检测,并且在这种方法中,采用蒸馏水作为溶剂来溶解蜂王浆,避免了有机溶剂的使用,不仅节省成本,而且增加了安全性[40]。
超高效液相色谱法(ultra-performance liquid chromatography,UPLC)借助于HPLC的原理,使用填充有较小颗粒和较高流速的色谱柱进行分离,使色谱性能得到了进一步的改进,不仅可以提高速度,还具有很高的分辨率和信噪比。为验证这种方法的实用性,将UPLC与HPLC进行比较,来测定蜂王浆及其制品中10-HDA的含量[41],结果显示UPLC在多方面均表现出更好的效果。一方面,运行时间大大缩短:HPLC需要运行6 min才能够完成10-HDA的分离,而使用UPLC可以在1.5 min的时间内实现分离。另一方面,在进样100次后,UPLC的柱子仍然能表现出非常稳定的保留时间,并且10-HDA和内标的峰型保持不变;此外,UPLC还拥有较高的分辨率和信噪比(S/N)。在以前报道的方法中,HPLC的流动相大多采用有机溶剂乙腈和甲醇,具有较高毒性。在此方法中,使用乙醇提取样品后,再使用毒性较小的纯水及较少的甲醇作为流动相,毒性大大减小,并且加入磷酸以保证流动相pH保持在2.5左右,保证了良好的峰分离度[41]。在此基础上,优化萃取方法可以进一步提高脂肪酸的检测效果,如将蜂王浆样品先采用三氯甲烷、甲醇混和溶剂对蜂王浆进行3次连续液-液萃取得到蜂王浆脂类物质,再进一步固相萃取来纯化脂肪酸,去除脂溶性维生素、黄酮、固醇等脂溶性物质。接着采用超高效液相色谱-串联质谱多反应监测进行检测,测定出癸二酸的标准曲线相关系数为0.998410,日内、日间准确度和精密度分别为98%和116%以及1.94%和2.18%,检测限和定量限分别为16和108 ng/mL,进一步提高了检测精度和准确度[42]。
除了10-HDA外,高效液相色谱法也应用于蜂王浆其他脂肪酸的测定当中,例如采用高效液相色谱-四级杆/飞行时间质谱法可以检测出检测蜂王浆中包括10-HDA、8-羟基辛酸、癸二酸、10-羟基癸酸、2-十二碳烯二酸和十二烷基二酸在内的6种脂肪酸,方程线性相关系数为0.9975~0.9997,检出限为0.05~20 mg/L[43]。进一步将液相色谱法与高分辨质谱法结合起来测定蜂王浆中的脂肪酸,可以直接快速定量几种特定的游离脂肪酸,即10-HDA、10-羟基癸酸、3-羟基癸酸、癸二酸和2-十二烯二酸,以及长度相近的常见脂肪酸(癸酸和十二酸),此外,利用高分辨质谱还可发现样品中可能存在的其他游离脂肪酸及其含量范围[16],并且这种方法显现出更高的选择性和灵敏度[44]。
高效液相色谱法是在蜂王浆脂肪酸检测中运用最广泛的一种方法,该方法快速、准确,灵敏度和精密度均保持在较高的水平;但是其设备成本较高,无法从复杂化合物的异构体进行有效的识别,并且所用试剂大多数毒性较大,且消耗量较大,会对人体产生伤害,限制了其应用[45];而超高效液相色谱法因其采用更高的压力和更短的色谱柱,可在此基础上进一步缩短检测时间、减少毒性溶剂的用量、加强分离能力、提高检测效率[46];将高效液相色谱法和高分辨质谱等技术联用,不仅可以解决分子结构难以识别的问题,还可以进一步扩大蜂王浆中可检测到的脂肪酸种类、提高测定结果灵敏度等。
2.2 气相色谱法
气相色谱法是根据被测样品在固定相和流动相之间的吸附力等物理性质的不同,以气体为流动相,对被测样品进行分离鉴定的方法[44]。在分析前,需要从样品中提取脂肪酸并将其转化为挥发性化合物,其中最常见的是将脂肪酸转化为相应的硅烷化衍生物或者甲酯化衍生物[47]。这种方法适用于有机化合物的定量分析,无法进行定性分析[48],所以气相色谱法常常与质谱联用,结合气相色谱优良的分离能力和质谱精确的鉴定能力,用来定性、定量地分离和检测复杂化合物[45]。
Lercker等[49]首次利用气相色谱-质谱联用法(gas chromatograph-mass spectrometer,GC-MS)较为系统地研究了蜂王浆脂肪组分中的脂肪酸成分,鉴定出了28种脂肪酸,其中16种为首次检出;结构上,大部分脂肪酸碳链末端有羟基和羧基,并推测这些基团与本身的生理活性有关。且大部分脂肪酸含有8~10个碳原子,推测这可能是由植物组织中含有18个碳原子的脂肪酸发生降解得到的。随后,Isidorov等[50]采用GC-MS对蜂王浆冻干粉的乙醚和甲醇提取物进行硅烷化并分析,从提取物中鉴定出35种脂肪酸,用气相色谱保留参数和质谱对这些酸进行表征,这些酸类中有8种化合物也曾在蜂王的下颌腺中鉴定出,9种化合物首次在蜂王浆中被检出,包括6种单羟基脂肪酸、2种双羟基酸和1种二元酸。此团队进一步采用高效毛细管气相色谱联用质谱法对17种蜂王浆的乙醚提取物进行鉴定,85种化合物被检出,其中9种脂肪酸首次被检出[51],均为之前研究中[48]已鉴定的羟基酸或氧代酸的同系物;除脂肪酸外,首次检测到了少量芳香族化合物,如4-羟基苯甲酸和4-羟基-3-甲氧基苯乙醇。此外,作者采用顶空固相微萃取法对蜂王浆挥发性物质进行检测,经鉴定,含量最多的是2-庚酮、丙酮、2-壬烷酮和苯甲醛。
气相色谱法常用于蜂王浆的质量检测中,如利用此技术测定了12种意大利本土和市售蜂王浆样品,共鉴定出14种脂肪酸,本土样品的脂肪酸含量明显高于商业样品,在单个脂肪酸的相对含量方面,样品之间无显著差异,其中10-HDA含量是最丰富的,占50%以上,其次是10-羟基癸酸,平均相对含量为17%,与以往在相对脂肪酸含量方面的研究发现一致[52]。魏文挺[53]建立了一种简单有效的气相色谱法用于检测蜂王浆中10-羟基癸酸、3-羟基癸酸、癸二酸三种脂肪酸,采用盐酸水解,乙醇、乙醚两种溶剂分步提取的方法,有效避免了其他物质混入、峰图谱重叠等问题,并且有较高的精密度和重复性。另外,气相色谱法也可以用于蜂王浆制品的检测中:李青等[54]建立了一种检测蜂王浆制品中10-HDA的气相色谱分析方法,样品提取后经大口径毛细柱分离,由氢火焰检测器测定,发现10-HDA能与溶剂和杂质分离完全,并且有较高的准确度和精密度。
气相色谱法拥有快速、准确、灵敏度高等优点,相比高效液相色谱法,此方法避免了测定过程中大量有毒试剂的使用[55];进一步将此技术与质谱联用,可以很好地解决气相色谱法定性能力差的问题,提高测量准确度[56]。但是在此方法中,被测物需有一定的挥发性和热稳定性,所以一般需进行衍生化处理,且繁琐的检测步骤也是一个待解决的问题[57]。因此未来研究可对检测条件进行改进和优化,在保证检测效果的同时,提高检测过程的易操作性及安全性。
2.3 毛细管电泳法
毛细管电泳法(capillary electrophoresis,CE)原理是以毛细管为分离通道,利用高压直流电场使得样品中的各组分之间的淌度和分配行为产生差异,从而实现分离[58-59]。
为检测毛细管电泳法在蜂王浆脂肪酸中的检测效果,CE和HPLC两种方法分别用来测定不同地理来源的蜂王浆样品,发现两种方法测得的蜂王浆中10-HDA的含量均在0.8%~3.2%之间,且CE法测定线性范围宽(0.006~0.808 mg 10-HDA/mL)、灵敏度高(检出限和定量限分别为0.002 mg/mL和0.004 mg/mL),对迁移时间和峰面积具有良好的仪器重复性(相对标准偏差分别小于1.0%和2.0%),并且溶剂的消耗量大大减少[60]。这种方法在智利王浆脂肪酸的质量检测中也有应用[61],测定10-HDA的检出限为12,618 mg/L,定量限为42.06 mg/L,可以准确测定脂质组分中10-HDA的含量,基于此方法操作简单,分析时间短,成本低,可将此方法作为蜂王浆脂肪酸的常规测定与分析方法。毛细管电泳法的主要缺点是样本量小,检测能力低[62],为克服这些缺点,电容耦合非接触电导率检测被提出与毛细管电泳法相结合[63],另外,通过设置双通道,还可以分别独立优化每种被分析物的测定条件,因此可以在一次运行中同时分析蜂王浆中10-HDA和其他物质,在本种方法中,研究者同时测定10-HDA和游离氨基酸,结果表明利用特制毛细管电泳-非接触电导检测法测定结果与标准方法测定结果相吻合,对10-HDA的检出限为0.039 mg/g,并且可以同时检出含量范围为0.039~0.090 mg/g的氨基酸,测定结果的偏差均小于5%[63]。
毛细管电泳法不需要提取和衍生化过程,具有分析速度快、处理量高、操作成本低、试剂消耗少等优点[60],但是同时也存在检测能力相对较弱、对样品纯度要求较高、灵敏度较低的问题。所以,目前毛细管电泳法在蜂王浆脂肪酸类物质的检测中的应用还十分有限,今后可以将毛细管电泳法与激光诱导荧光、核磁共振等技术联用,建立高灵敏度、高稳定性的检测方法。
2.4 近红外光谱法
近红外光谱法是用近红外辐射对被测物进行辐照,获取被测定物质在近红外谱区的特征光谱,用化学计量学方法获取相关的信息后,对被测物质进行定性、定量分析的一种方法[35, 64]。
近红外光谱主要反映了C-H、O-H和N-H等X-H官能团的振动吸收和转动吸收的倍频和频率之和,以此来进行定性、定量分析[65]。作为一种脂肪酸,10-HDA含有不同的X-H官能团,在近红外区有明显的吸收。以此为基础,Yang等[66]建立了近红外光谱与偏最小二乘法相结合的蜂王浆中10-HDA含量的快速定量分析模型:首先对收集的232个不同浓度10-HDA的近红外光谱进行二阶导数处理,构建全光谱偏最小二乘(partial least squares,PLS)模型,用58个样品筛选出10-HDA含量的最佳预测模型,结果表明,选择合适的波长后构建的PLS模型比全光谱模型具有更高的精确度[66]。在此基础上,此团队又建立了一种衰减全反射傅里叶变换中红外光谱(attenuated total reflectance-Fourier transform mid-infrared,ATR-FTMIR)和近红外光谱结合数据融合技术测定蜂王浆中的10-HDA的方法,结果表明,中层数据融合构建的PLS分析模型优于独立数据融合和低层数据融合构建的PLS模型,在这些模型中,选择协同区间-偏最小二乘变量后进行中层数据融合所构建的偏最小二乘模型的预测精度最高。因此,基于ATR-FTMIR和近红外光谱的中层数据融合策略可以作为10-HDA定量的一种方法[67]。
由此可见,近红外光谱法已经在蜂王浆脂肪酸的检测中有了探索性的应用,由于近红外光谱法是对被测物进行辐照,所以与其他方法相比,该方法的样品保留度较高,且无需化学试剂,此外还具有快速、灵敏度高的优点,但是此方法对设备及实验条件要求较高,所以在生产应用上还十分有限。目前近红外光谱的应用仅仅集中在新鲜蜂王浆中10-HDA这一种脂肪酸的测定中,更多的蜂王浆原料和蜂王浆中多种脂肪酸的测定还需要更深入、更详细的研究,进一步为蜂王浆质量控制及应用相关工作奠定基础。
2.5 其他方法
酶联免疫吸附剂检测法是指将可溶性的抗原或抗体结合到聚苯乙烯等固相载体上,利用抗原抗体结合专一性进行免疫反应的定性和定量检测方法[68]。采用混合酸酐法将10-HDA与载体蛋白偶联,可制备10-HDA人工合成免疫原,以此为基础,建立10-HDA免疫学检测方法,将此方法范围检测与液相色谱法作平行对比实验,两者平均符合率可达95.3%[58]。紫外分光光度法是可通过特定波长范围内物质对紫外可见光的吸收作用来对物质进行分析的方法[69],10-HDA甲醇溶液在210 nm有吸收峰,所以作者建立一种三波长紫外吸收光谱法,可以较为准确地检测出蜂王浆中10-HDA的含量,并且解决了单波长测定法所存在的数据偏高问题[70]。Su等[10]建立了一种基于比色传感器的10-HDA检测方法,10-HDA通过与Ag(I)发生螯合作用,阻止Ag(I)与四甲基联苯胺反应结合产生显色物质,随着显色物质数量的减少,652 nm处波长的吸光度也会下降,从而实现10-HDA的定性、定量检测。这种方法可以通过肉眼直接观测到显色结果,用智能手机进行读数、定量,为实现蜂王浆脂肪酸即时检测提供了理论基础。
以上检测方法均无需大型精密仪器,操作简单、快捷,具有广泛的应用价值和市场开发前景。但是,或因精密度不高,或因特异性较强,导致其在蜂王浆脂肪酸检测应用中受到限制,在后续研究中,如何有效提高精密度,扩大检测范围将成为未来需要重点解决的问题。
3. 结论与展望
在过去的几十年中,蜂王浆因其多种生物活性获得了越来越多的关注。其中,蜂王浆脂肪酸在其生物活性的发挥中起到了举足轻重的作用,同时也是蜂王浆质量检测的一个重要指标,并且在保健品、药品、化妆品行业都有了一定的应用。但是蜂王浆脂肪酸的研究大多还都处于实验阶段,很多问题尚未得到解决,如脂肪酸类物质多为粗制品、脂肪酸分离困难、检测方法尚未统一、构效关系不清楚等,这同时也导致我国蜂王浆质量难以控制,在国际市场上竞争能力低等问题。因此,从蜂王浆中快速、精准地检测和定量产品中的脂肪酸,进而鉴定蜂王浆质量、评价蜂王浆优劣是目前研究的难点与重点。
目前,对于蜂王浆脂肪酸独特的分子结构,尚无公认有效的检测方法。高效液相色谱法、气相色谱法、毛细管电泳法等传统检测方法都在蜂王浆脂肪酸的检测中有了广泛的应用,并且随着现代化学分析、生物技术方法的不断成熟完善,越来越多的检测方法被开发出来,如高分辨质谱法、近红外光谱法等。这些方法具有简便、快捷、灵敏和高效的优点,为蜂王浆脂肪酸的检测提供了更多的选择。每种方法都有自身的特点,本文将每种方法的优缺点总结为表2。在蜂王浆脂肪酸的测定中,应注意结合脂肪酸自身性质,根据实际情况充分发挥每种检测方法的优势,选择合适的方法进行检测,以提高检测效率。另外,根据蜂王浆国际标准(ISO 128240),新鲜蜂王浆的10-HDA含量需要≥1.4%,即在蜂王浆质量控制中,仅涉及到10-HDA这一种脂肪酸含量作为质量评价指标,其脂肪酸组成并未列入蜂王浆质量评价指标中,所以目前的检测方法大多数集中于10-HDA这一种成分的检测,很少对其他脂肪酸进行分析。但是,除10-HDA外,其他脂肪酸与蜂王浆的质量优劣也有着密切的联系,同时在蜂王浆的多种生物活性中起到了十分重要的作用,所以亟需建立一种检测范围更大的检测方法,能够同时较为全面地检测出蜂王浆存在的多种脂肪酸;现有的检测方法没有统一的评价指标,缺乏系统性和全面性,这极大地限制了蜂王浆的应用前景。此外,开发新技术或多种技术联用,实现技术的更新及多元化交叉联合也为蜂王浆脂肪酸的检测提供了新的选择,如稳定同位素技术已应用于多种农产品的真伪鉴定、质量检测中,并且表现出操作性强、稳定性好、判别率高和前处理简单等多种优势[71]。脂肪酸指纹信息法也是应用于评价脂肪酸质量的一种先进的检测分析方法,在检测灵敏度和检测通量上具有极大优势。通过获取蜂王浆脂肪酸含量,构建特定脂肪酸指纹图谱,可为蜂王浆脂肪酸定性定量提供一种基于GC-MS技术的检测分析方法。
表 2 不同蜂王浆脂肪酸检测方法的比较Table 2. Comparison of different determination methods of fatty acids in royal jelly检测方法 优势 劣势 高效液相色谱法 检测范围广、检出率高、重复性好 设备成本较高、检测时间较长、试剂消耗量大 高效液相色谱-质谱联用法 灵敏度高、选择性高、分离能力好 仪器复杂、价格昂贵、试剂消耗量大 超高效液相色谱法 准确度高、检测时间短、检测效率高 设备成本较高、操作步骤复杂、对样品前处理要求高 气相色谱-质谱联用法 有毒试剂消耗量小、灵敏度高、准确性好 需衍生化、操作复杂、设备成本高 毛细管电泳法 操作简便、分离效率高、溶剂消耗少、成本低 精确性较差、重复性较差、对样品纯度要求较高 近红外光谱法 快速、无损、无需消耗化学试剂 需结合统计学方法建立分析模型 酶联免疫吸附剂检测法 检测成本低、效率高、操作简便 应用范围小、准确度低、定量效果差 紫外分光光度法 设备成本较低、操作便捷、分析速度快 应用范围小、灵敏度低、对样品纯度要求较高 比色传感器检测法 分析速度快、可直接观测检测效果、可用手机进行读数定量 应用范围小、特异性较强 总之,随着科学技术的发展,蜂王浆脂肪酸分析检测方法会日趋完善。高效的前处理技术和先进的检测技术联用,建立快速、全面、高效、低成本、无污染、选择性高的方法将是未来发展的必然趋势,为蜂王浆的掺假鉴别、真实性验证、新鲜度鉴定等相关工作提供一定的理论和技术支持。
-
表 1 蜂王浆脂肪酸检测方法及脂肪酸种类
Table 1 Determination methods and types of fatty acids of royal jelly
蜂王浆种类 检测方法 脂肪酸种类 参考文献 新鲜蜂王浆 HPLC 10-HDA Bloodworth等[32] 蜂王浆制剂(冻干粉、颗粒剂、口服液) HPLC 10-HDA 杨江丰等[37] 新鲜蜂王浆 HPLC 10-HDA 张娟等[38] 新鲜蜂王浆 HPLC 10-HDA 罗小凤等[39] 新鲜蜂王浆和蜂王浆制剂 HPLC 10-HDA Genc等[34] 蜂王浆冻干粉、蜂蜜、含有蜂王浆的蜂蜜 HPLC 10-HDA Santos等[40] 新鲜蜂王浆、蜂王浆冻干粉 超高效液相色谱法、HPLC 10-HDA Zhou等[41] 新鲜蜂王浆 超高效液相色谱-串联质谱法 癸二酸 李兴安等[42] 新鲜蜂王浆 高效液相色谱-质谱法 10-HDA、8-羟基辛酸、癸二酸、10-羟基癸酸、
2-十二碳烯二酸和十二烷基二酸刘善菁等[43] 新鲜蜂王浆 液相色谱-高分辨质谱法 10-HDA、10-羟基癸酸、3-羟基癸酸、
癸二酸和2-十二烯二酸Kokotou等[16] 新鲜蜂王浆 气相色谱-质谱联用法 28种脂肪酸(10-HDA、10-羟基癸酸、癸二酸等) Lercker等[49] 蜂王浆冻干粉 气相色谱-质谱联用法 35种脂肪酸(10-HDA、10-羟基癸酸、癸二酸等) Isidorov等[50] 新鲜蜂王浆 顶空固相微萃取-气相色谱-质谱联用法 85种脂肪酸(10-HDA、10-羟基癸酸、癸二酸等) Isidorov等[51] 新鲜蜂王浆 毛细管气相色谱法 14种脂肪酸(10-HDA、10-羟基癸酸、癸二酸等) Ferioli等[52] 蜂王浆制剂 气相色谱法 10-HDA 李小佳等[57] 新鲜蜂王浆 毛细管电泳法、HPLC 10-HDA Ferioli等[60] 新鲜蜂王浆 毛细管电泳法 10-HDA Munoz等[61] 蜂王浆类膳食补充剂 特制毛细管电泳-非接触电导检测法 10-HDA Duong等[63] 新鲜蜂王浆 近红外光谱结合化学计量学法 10-HDA Yang等[66] 新鲜蜂王浆 ATR-FTMIR与近红外光谱结合化学计量学法 10-HDA Yang等[67] 新鲜蜂王浆、蜂王浆冻干粉 酶联免疫吸附检测法 10-HDA Kaljurand等[58] 新鲜蜂王浆 紫外分光光度法 10-HDA 赵静[70] 新鲜蜂王浆 比色法 10-HDA Su等[10] 表 2 不同蜂王浆脂肪酸检测方法的比较
Table 2 Comparison of different determination methods of fatty acids in royal jelly
检测方法 优势 劣势 高效液相色谱法 检测范围广、检出率高、重复性好 设备成本较高、检测时间较长、试剂消耗量大 高效液相色谱-质谱联用法 灵敏度高、选择性高、分离能力好 仪器复杂、价格昂贵、试剂消耗量大 超高效液相色谱法 准确度高、检测时间短、检测效率高 设备成本较高、操作步骤复杂、对样品前处理要求高 气相色谱-质谱联用法 有毒试剂消耗量小、灵敏度高、准确性好 需衍生化、操作复杂、设备成本高 毛细管电泳法 操作简便、分离效率高、溶剂消耗少、成本低 精确性较差、重复性较差、对样品纯度要求较高 近红外光谱法 快速、无损、无需消耗化学试剂 需结合统计学方法建立分析模型 酶联免疫吸附剂检测法 检测成本低、效率高、操作简便 应用范围小、准确度低、定量效果差 紫外分光光度法 设备成本较低、操作便捷、分析速度快 应用范围小、灵敏度低、对样品纯度要求较高 比色传感器检测法 分析速度快、可直接观测检测效果、可用手机进行读数定量 应用范围小、特异性较强 -
[1] HU F L, BILIKOVA K, CASABIANCA H, et al. Standard methods for Apis mellifera royal jelly research[J]. Journal of Apicultural Research,2019,58(2):1−68.
[2] 王华峰, 任铎锋, 刘玲. 蜂王的分化发育与表观遗传[J]. 生物学通报,2018,53(11):6−8. [WANG H F, LIU Z F, LIU L. Epigenetic regulation of queen-worker differentiation[J]. Bulletin of Biology,2018,53(11):6−8. doi: 10.3969/j.issn.0006-3193.2018.11.003 [3] RAMANATHAN A N K G, NAIR A J, SUGUNAN V S. A review on royal jelly proteins and peptides[J]. Journal of Functional Foods,2018,44:255−264. doi: 10.1016/j.jff.2018.03.008
[4] CHI X, LIU Z, WANG H, et al. Royal jelly enhanced the antioxidant activities and modulated the gut microbiota in healthy mice[J]. Journal of Food Biochem,2021,45(5):e13701.
[5] PARK H G, KIM B Y, PARK M J, et al. Antibacterial activity of major royal jelly proteins of the honeybee (Apis mellifera) royal jelly[J]. Journal of Asia-Pacific Entomology,2019,22(3):737−741. doi: 10.1016/j.aspen.2019.06.005
[6] El-SEEDI H R, EID N, ABD EL-WAHED A A, et al. Honey bee products: Preclinical and clinical studies of their anti-inflammatory and immunomodulatory properties[J]. Frontiers in Nutrition,2022,8:1−8.
[7] ABU-SERIE M M, HABASHY N H. Two purified proteins from royal jelly with in vitro dual anti-hepatic damage potency: Major royal jelly protein 2 and its novel isoform X1[J]. International Journal of Biological Macromolecules,2019,128:782−795. doi: 10.1016/j.ijbiomac.2019.01.210
[8] FAN P, HAN B, HU H, et al. Proteome of thymus and spleen reveals that 10-hydroxydec-2-enoic acid could enhance immunity in mice[J]. Expert Opinion on Therapeutic Targets,2020,24(3):267−279. doi: 10.1080/14728222.2020.1733529
[9] KHAZAEI M, ANSARIAN A, GHANBARI E. New findings on biological actions and clinical applications of royal jelly: A review[J]. J Diet Suppl,2018,15(5):757−775. doi: 10.1080/19390211.2017.1363843
[10] SU S X, LI S S, HU J, et al. A colorimetric sensing strategy for detecting 10-hydroxy-2-decenoic acid in royal jelly based on Ag(I)-tetramethylbenzidine[J]. Sensors and Actuators B-Chemical,2022,354:1−7.
[11] RAMADAN M F, AL-GHAMDI A. Bioactive compounds and health-promoting properties of royal jelly: A review[J]. Journal of Functional Foods,2012,4(1):39−52. doi: 10.1016/j.jff.2011.12.007
[12] COLLAZO N, CARPENA M, NUNEZ-ESTEVEZ B, et al. Health promoting properties of bee royal jelly: Food of the queens[J]. Nutrients,2021,13(2):543. doi: 10.3390/nu13020543
[13] 陈伊凡. 蜂王浆脂肪酸的抗炎活性及其机制研究[D]. 杭州: 浙江大学, 2019, 15−16 CHEN Y F. Anti-inflammatory effects and underlying mechanisms of royal jelly fatty acids[D]. Hangzhou: Zhejiang University, 2019, 15−16.
[14] ISIDOROV V A, BAKIER S, GRZECH I. Gas chromatographic-mass spectrometric investigation of volatile and extractable compounds of crude royal jelly[J]. Journal of Chromatography B,2012,885-886:109−116. doi: 10.1016/j.jchromb.2011.12.025
[15] 缪卓宁, 胡福良. 蜂王浆特有成分10-HDA的研究进展[J]. 蜜蜂杂志,2020,40(2):4−9. [MIAO Z N, HU F L. Research progress in the unique component 10-HDA in royal jelly[J]. Journal of Bee,2020,40(2):4−9. [16] KOKOTOU M G, MANTZOURANI C, BABAITI R, et al. Study of the royal jelly free fatty acids by liquid chromatography-high resolution mass spectrometry (LC-HRMS)[J]. Metabolites,2020,10(1):392.
[17] KORANY M A, MONEE M S, ASAAD A M, et al. A validated stability-indicating HPLC assay for determination of 10-hydroxy-2-decenoic acid content in royal jelly products using robust regression methods[J]. Journal of Chromatographic Science,2020,58(6):520−534. doi: 10.1093/chromsci/bmaa016
[18] ANTINELLI J F, ZEGGANE S, DAVICO R, et al. Evaluation of (E)-10-hydroxydec-2-enoic acid as a freshness parameter for royal jelly[J]. Food Chemistry,2003,80(1):85−89. doi: 10.1016/S0308-8146(02)00243-1
[19] SABATINI A G. Quality and standardization of royal jelly[J]. Journal of ApiProduct and ApiMedical Science,2009,1(1):16−21. doi: 10.3896/IBRA.4.01.1.04
[20] 中华人民共和国国家质量监督检验检疫总局. 中国国家标准化管理委员会. GB 9697-2008 蜂王浆[S]. 北京: 中国标准出版社, 2008 General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. GB 9697-2008 Royal jelly[S]. Beijing: Standards Press of China, 2008.
[21] CHEN Y F, WANG K, ZHANG Y Z, et al. In vitro anti-inflammatory effects of three fatty acids from royal jelly[J]. Mediators Inflamm,2016,2016:3583684.
[22] YOU M M, MIAO Z N, TIAN J, et al. Trans-10-hydroxy-2-decenoic acid protects against LPS-induced neuroinflammation through FOXO1-mediated activation of autophagy[J]. European Journal of Nutrition,2020,59(7):2875−2892. doi: 10.1007/s00394-019-02128-9
[23] PENG C C, SUN H T, LIN I P, et al. The functional property of royal jelly 10-hydroxy-2-decenoic acid as a melanogenesis inhibitor[J]. Bmc Complementary and Alternative Medicine,2017,17:392. doi: 10.1186/s12906-017-1888-8
[24] SEDIVA M, LAHO M, KOHUTOVA L, et al. 10-HDA, a major fatty acid of royal jelly, exhibits pH dependent growth-inhibitory activity against different strains of Paenibacillus larvae[J]. Molecules,2018,23(12):3236. doi: 10.3390/molecules23123236
[25] YANG Y C, CHOU W M, WIDOWATI D A, et al. 10-Hydroxy-2-decenoic acid of royal jelly exhibits bactericide and anti-inflammatory activity in human colon cancer cells[J]. BMC Complement Altern Med,2018,18(1):202. doi: 10.1186/s12906-018-2267-9
[26] PASUPULETI V R, SAMMUGAM L, RAMESH N, et al. Honey, propolis, and royal jelly: A comprehensive review of their biological actions and health benefits[J]. Oxidative Medicine and Cellular Longevity,2017,21:1.
[27] 雷泽, 付正启, 木晓云, 等. 王浆酸钙及与维生素K2制成的抗动脉粥样硬化和骨质疏松症保健品: CN102659569A[P]. 2012-03-12. LEI Z, FU Z Q, MU X Y, et al. Calcium royal plasma late and vitamin K2 made of anti-atherosclerosis and osteoporosis health products: CN102659569A[P]. 2012-03-12.
[28] 苏静, 王丽, 王瑞明, 等. 一种含10-HDA的口腔喷雾剂及其制备方法: CN113577162A[P]. 2021-07-27. SU J, WANG L, WANG R M, et al. An oral spray containing 10-HDA and preparation method thereof: CN113577162A[P]. 2021-07-27.
[29] 郑锦芬. 一种用于皮肤的抗光老化制剂: CN103505378A[P]. 2012-06-20. ZHENG J F. An anti-photoaging preparation for the skin: CN103505378A[P]. 2012-06-20.
[30] 吕树梅. 高效液相色谱法(HPLC)在食品添加剂检测中的应用[J]. 食品安全导刊,2020(30):166−167. [LÜ S M. Application of high-performance liquid chromatography (HPLC) in the detection of food additives[J]. China Food Safety Magazine,2020(30):166−167. doi: 10.16043/j.cnki.cfs.2020.30.124 [31] 林楠, 周欣蕊, 王婷, 等. 高效液相色谱法在食品安全检测中的应用[J]. 食品安全质量检测学报,2019,10(6):1431−1437. [LIN N, ZHOU X R, WANG T, et al. Application of high-performance liquid chromatography in food safety detection[J]. Journal of Food Safety & Quality,2019,10(6):1431−1437. doi: 10.3969/j.issn.2095-0381.2019.06.001 [32] BLOODWORTH B C, HARN C S, HOC C T, et al. Liquid chromatographic determination of trans-10-hydroxy-2-decenoic acid content of commercial products containing royal jelly[J]. Journal of AOAC International,1995,78(4):1019−1023. doi: 10.1093/jaoac/78.4.1019
[33] CORNARA L, BIAGI M, XIAO J B, et al. Therapeutic properties of bioactive compounds from different honeybee products[J]. Frontiers in Pharmacology,2017,8:1.
[34] GENC M, ASLAN A. Determination of trans-10-hydroxy-2-decenoic acid content in pure royal jelly and royal jelly products by column liquid chromatography[J]. Journal of Chromatography A,1999,839(1-2):265−268. doi: 10.1016/S0021-9673(99)00151-X
[35] NICOLAI B M, BEULLENS K, BOBELYN E, et al. Nondestructive measurement of fruit and vegetable quality by means of NIR spectroscopy: A review[J]. Postharvest Biology and Technology,2007,46(2):99−118. doi: 10.1016/j.postharvbio.2007.06.024
[36] NIKOLIN B, IMAMOVIC B, MEDANHODZIC-VUK S, et al. High perfomance liquid chromatography in pharmaceutical analyses[J]. Bosn J Basic Med Sci,2004,4(2):5−9. doi: 10.17305/bjbms.2004.3405
[37] 杨江丰, 陈理. HPLC法测定中成药制剂中10-羟基-2-癸烯酸的含量[J]. 色谱,1998(2):90−91. [YANG J F, CHEN L. Determination of 10-hydroxy-2-decenoic acid (10-HDA) in Chinese traditional medicine preparations by high performance liquid chromatography[J]. Chinese Journal of Chromatography,1998(2):90−91. [38] 张娟, 邹丽君, 谭婷. HPLC法检测不同温度和时间对蜂王浆中癸烯酸的影响[J]. 食品科技,2014,39(3):270−272. [ZHANG J, ZOU L J, TAN T. Determination of 10-hydroxy-2-decenoic acid in royal jelly at different temperature and time by high performance liquid chromatography[J]. Food Science and Technology,2014,39(3):270−272. [39] 罗小凤, 邹盛勤, 刘传安. 反相高效色谱法测定蜂王浆中10-HDA的含量[J]. 食品科技,2006(8):249−251. [LUO X F, ZOU S Q, LIU C A. Determination of 10-HDA in royal jelly by RP-HPLC[J]. Food Science and Technology,2006(8):249−251. doi: 10.3969/j.issn.1005-9989.2006.08.074 [40] CAPARICA-SANTOS C, MARCUCCI M C. Quantitative determination of trans-10-hydroxy-2-decenoic acid (10-HDA) in Brazilian royal jelly and commercial products containing royal jelly[J]. Journal of Apicultural Research,2015,46(3):149−153.
[41] ZHOU J H, ZHAO J, YUAN H C, et al. Comparison of UPLC and HPLC for determination of trans-10-hydroxy-2-decenoic acid content in royal jelly by ultrasound-assisted extraction with internal standard[J]. Chromatographia,2007,66(3-4):185−190. doi: 10.1365/s10337-007-0305-8
[42] 李兴安, 王建伟, 周奕含, 等. 固相萃取/超高效液相色谱-串联质谱多反应监测法测定蜂王浆中癸二酸含量[J]. 营养学报,2019,41(5):494−500. [LI X A, WANG J W, ZHOU Y H, et al. Determination of sebacic acid in honeybee royal jelly by solid phase extraction combined with ultra-performance liquid chromatography tandem mass spectrometry under multiple reaction monitoring[J]. Acta NutrimentaSinica,2019,41(5):494−500. doi: 10.3969/j.issn.0512-7955.2019.05.015 [43] 刘善菁, 陈磊, 张睿, 等. 蜂王浆中脂肪酸的高效液相色谱-质谱法检测[J]. 扬州大学学报(自然科学版),2015,18(2):40−44. [LIU S J, CHEN L, ZHANG R, et al. Determination of fatty acids in royal jelly by liquid chromatography-mass spectrometry[J]. Journal of Yangzhou University (Natural Science Edition),2015,18(2):40−44. doi: 10.19411/j.1007-824x.2015.02.011 [44] SPANIK I, MACHYNAKOVA A. Recent applications of gas chromatography with high-resolution mass spectrometry[J]. Journal of Separation Science,2018,41(1):163−179. doi: 10.1002/jssc.201701016
[45] 方芳, 王凤忠. 植物黄酮醇的检测方法研究进展[J]. 食品工业科技,2018,39(11):327−332. [FANG F, WANG F Z. Research progress on the detection methods of flavanols in plants[J]. Science and Technology of Food Industry,2018,39(11):327−332. doi: 10.13386/j.issn1002-0306.2018.11.056 [46] 黄思瑜, 董宪兵, 周纯洁, 等. 超高效液相色谱串联-质谱法同时测定香辛料中7种真菌毒素[J]. 食品工业科技,2019,40(14):270−274, 279. [HUANG S Y, DONG X B, ZHOU C J, et al. Determination of 7 mycotoxin contaminants in spices by ultra-high-performance liquid chromatography-tandem mass spectrometry[J]. Science and Technology of Food Industry,2019,40(14):270−274, 279. doi: 10.13386/j.issn1002-0306.2019.14.044 [47] CHIU H H, KUO C H. Gas chromatography-mass spectrometry-based analytical strategies for fatty acid analysis in biological samples[J]. Journal of Food and Drug Analysis,2020,28(1):60−73. doi: 10.1016/j.jfda.2019.10.003
[48] GRONEMAN A F, POSTHUMUS M A, TUINSTRA L G M T, et al. Identification and determination of metabolites in plant cell biotechnology by gas chromatography and gas chromatography/mass spectrometry: Application to nonpolar products of chrysanthemum cineraria folium and targets species[J]. Analytica Chimica ACTA,1984,163:43−54. doi: 10.1016/S0003-2670(00)81492-0
[49] LERCKER G, CAPELLA P, CONTE L S, et al. Components of royal jelly. 1. Identification of the organic-acids[J]. Lipids,1981,16(12):912−919. doi: 10.1007/BF02534997
[50] ISIDOROV V A, CZYZEWSKA U, ISIDOROVA A G, et al. Gas chromatographic and mass spectrometric characterization of the organic acids extracted from some preparations containing lyophilized royal jelly[J]. Journal of Chromatography B-Analytical Technologies in the Biomedical and Life Sciences,2009,877(29):3776−3780. doi: 10.1016/j.jchromb.2009.09.016
[51] ISIDOROV V A, BAKER S, GRZECH I. Gas chromatographic-mass spectrometric investigation of volatile and extractable compounds of crude royal jelly[J]. Journal of Chromatography B-Analytical Technologies in the Biomedical and Life Sciences,2012,885:109−116.
[52] FERIOLI F, ARMAFORTE E, CABONI M F. Comparison of the lipid content, fatty acid profile and sterol composition in local Italian and commercial royal jelly samples[J]. Journal of the American Oil Chemists' Society,2014,91(6):875−884. doi: 10.1007/s11746-014-2446-x
[53] 魏文挺. 基于蜂王浆与盐酸显色反应和脂肪酸组成的蜂王浆质量控制研究[D]. 杭州: 浙江大学, 2014, 89-93 WEI W T. Study on quality control of royal jelly based on chromogenic reaction between royal jelly and HCl and fatty acids composition[D]. Hangzhou: Zhejiang University, 2014, 89-93.
[54] 李青, 方赤光, 杨明远, 等. 气相色谱法直接测定保健食品中10-羟基-2-癸烯酸[J]. 中国公共卫生,2000(6):73−74. [LI Q, FANG C G, YANG M Y, et al. Determination of 10-hydroxy-2-decenoic acid in health food by gas chromatography[J]. China Public Health,2000(6):73−74. [55] 张美峰. 气相色谱法在药食同源食品安全检测中的应用[J]. 食品安全导刊,2022(8):173−175, 182. [ZHANG M F. Application of gas chromatography in the safety detection of food and medicine homologous foods[J]. China Food Safety Magazine,2022(8):173−175, 182. [56] LY T K, HO T D, BEHRA P, et al. Determination of 400 pesticide residues in green tea leaves by UPLC-MS/MS and GC-MS/MS combined with QuEChERS extraction and mixed-mode SPE clean-up method[J]. Food Chemistry 2020, 326: 126928.
[57] 李小佳, 赵志红, 杨扬, 等. 气相色谱法检测食品中脂肪酸的研究进展[J]. 食品安全质量检测学报,2016,7(8):3114−3120. [LI X J, ZHAO Z H, YANG Y, et al. Research progress on detection of fatty acids in food by gas chromatography[J]. Journal of Food Safety & Quality,2016,7(8):3114−3120. doi: 10.19812/j.cnki.jfsq11-5956/ts.2016.08.019 [58] KALJURAND M, SAAR-REISMAA P, VAHER M, et al. Capillary electrophoresis as a monitoring tool for flow composition determination[J]. Molecules,2021,26(16):4918. doi: 10.3390/molecules26164918
[59] PRZYBYLSKA A, GACKOWSKI M, KOBA M. Application of capillary electrophoresis to the analysis of bioactive compounds in herbal raw materials[J]. Molecules,2021,26(8):4918.
[60] FERIOLI F, MARCAZZAN G L, CABONI M F. Determination of (E)-10-hydroxy-2-decenoic acid content in pure royal jelly: A comparison between a new CZE method and HPLC[J]. Journal of Separation Science,2007,30(7):1061−1069. doi: 10.1002/jssc.200600416
[61] MUNOZ O, DECAP S, RUIZ F, et al. Determination of 10-hydroxy-2-decenoic acid in royal jelly by capillary electrophoresis[J]. Journal of the Chilean Chemical Society,2011,56(3):738−740. doi: 10.4067/S0717-97072011000300004
[62] SOGA T, IMAIZUMI M. Capillary electrophoresis method for the analysis of inorganic anions, organic acids, amino acids, nucleotides, carbohydrates and other anionic compounds[J]. Electrophoresis,2001,22(16):3418−3425. doi: 10.1002/1522-2683(200109)22:16<3418::AID-ELPS3418>3.0.CO;2-8
[63] DUONG H A, VU M T, NGUYEN T D, et al. Determination of 10-hydroxy-2-decenoic acid and free amino acids in royal jelly supplements with purpose-made capillary electrophoresis coupled with contactless conductivity detection[J]. Journal of Food Composition and Analysis,2020,87:103422. doi: 10.1016/j.jfca.2020.103422
[64] YU H W, GUO L L, KHARBACH M, et al. Multi-way analysis coupled with near-infrared spectroscopy in food industry: models and applications[J]. Foods,2021,10(4):802. doi: 10.3390/foods10040802
[65] ZENG J, GUO Y, HAN Y Q, et al. A review of the discriminant analysis methods for food quality based on near-infrared spectroscopy and pattern recognition[J]. Molecules,2021,26(3):749. doi: 10.3390/molecules26030749
[66] YANG X H, LI Y P, WANG L, et al. Determination of 10-hydroxy-2-decenoic acid of royal jelly using near-infrared spectroscopy combined with chemometrics[J]. Journal of Food Science,2019,84(9):2458−2466. doi: 10.1111/1750-3841.14748
[67] YANG X, LI Y, WANG L, et al. Determination of 10-HDA in royal jelly by ATR-FTMIR and NIR spectral combining with data fusion strategy[J]. Optik,2020,203:164052. doi: 10.1016/j.ijleo.2019.164052
[68] 朱瑞萱, 张淼, 王朋倩, 等. 免疫分析法用于中药活性成分检测和质量控制研究进展[J]. 中国新药杂志,2021,30(4):339−346. [ZHU R X, ZHANG M, WANG P Q, et al. Research progress in detection and of active ingredients in traditional Chinese medicine based on immunoassay[J]. Chinese Journal of New Drugs,2021,30(4):339−346. [69] 翟晓霏. 紫外可见分光光度法在食品检测中的应用研究进展[J]. 山东化工,2021,50(7):76−78, 80. [ZHAI X F. Search progress on application of ultraviolet and visible spectrophotometry in food detection[J]. Shandong Chemical Industry,2021,50(7):76−78, 80. doi: 10.3969/j.issn.1008-021X.2021.07.029 [70] 赵静. 利用三波长-紫外光谱法测定纯鲜王浆中10-羟基-△-2-癸烯酸含量的探讨[J]. 中国养蜂,1998(5):32−33. [ZHAO J. Determination of 10-hydroxy-2-decene acid in pure fresh royal jelly by three wavelength-ultraviolet spectroscopy[J]. Apiculture of China,1998(5):32−33. [71] 唐甜甜, 解新方, 任雪, 等. 稳定同位素技术在农产品产地溯源中的应用[J]. 食品工业科技,2020,41(8):360−367. [TANG T T, XIE X F, REN X, et al. Application of stable isotope technology in tracing the geographical origin of agricultural products[J]. Science and Technology of Food Industry,2020,41(8):360−367. doi: 10.13386/j.issn1002-0306.2020.08.058 -
期刊类型引用(3)
1. 张玉龙,屈佩,徐可东,初永忠,孙畅,宫于琛,霍明宇,王宗灵,张学雷,庞敏. 毒死蜱水生生物毒性效应研究进展. 生态毒理学报. 2024(05): 135-150 .  百度学术
百度学术
2. 貌达,刘美,杨诗嘉,向昕,王涛,闵宇航. 食品抽检监测新风险挖掘及应对策略. 食品工业. 2023(10): 316-321 .  百度学术
百度学术
3. 王珺冀,林枧在,张茜,曹德艳,赵思源,朱美霖. 沿海地区水产品中多溴联苯醚污染水平及健康风险评估. 现代食品. 2023(19): 146-156 .  百度学术
百度学术
其他类型引用(2)





 下载:
下载:
 下载:
下载:



