Study on High-efficiency Fusion Expression and Enzymatic Properties of Chondroitinase ABC Ⅱ
-
摘要: 目的:本研究旨在实现硫酸软骨素裂解酶ABC Ⅱ(chondroitinase ABC Ⅱ,ChSase ABC Ⅱ)的高效可溶性表达并研究其酶学性质,为ChSase ABC Ⅱ在药品和保健食品生产中的应用奠定基础。方法:在优化ChSase ABC Ⅱ基因原始序列的基础上,构建重组质粒pET-28a-His-ChSase ABC Ⅱ并优化其表达条件;利用亲和层析得到带有多聚组氨酸标签(polyhistidine-tag,His-tag)的ChSase ABC Ⅱ融合蛋白后,研究了His-ChSase ABC Ⅱ的部分酶学性质。结果:构建的His-ChSase ABC Ⅱ融合蛋白表达系统能在大肠杆菌中实现可溶性表达;在表达宿主为E.coli BL21(DE3)和诱导剂(异丙基-β-D-硫代半乳糖苷)浓度为125 μmol/L的优化条件下,发酵液酶活力可达到7206.83±184.27 IU/L;纯化后的His-ChSase ABC Ⅱ酶比活力为22.02±0.39 IU/mg蛋白,最适pH和温度分别为7.5和40 ℃,其在30~40 ℃条件下较为稳定,且半衰期在2 h以上。His-ChSase ABC Ⅱ能特异性有效分解硫酸软骨素,其Km值为10.4±0.8 μmol/L,Kcat值为9.4±0.2 s−1。结论:本论文通过基因优化和融合表达等策略实现了His-ChSase ABC Ⅱ的高效表达和纯化。此外,His-ChSase ABC Ⅱ的酶学性质可基本满足其在医药和营养产品工业生产中的应用需求。
-
关键词:
- 硫酸软骨素裂解酶ABC Ⅱ /
- 低分子量硫酸软骨素(LMWCSs) /
- 酶学性质 /
- 融合表达 /
- 多聚组氨酸标签
Abstract: Objectives: The present study aimed to achieve the efficient and soluble expression of chondroitinase ABC Ⅱ (ChSase ABC Ⅱ) and investigate its enzymatic properties. The study thus laid the groundwork for the application of ChSase ABC Ⅱ in pharma- and nutraceutical production industries. Methods: Based on the optimization of the original sequence of ChSase ABC Ⅱ gene, the recombinant plasmid pET-28a-His-ChSase ABC Ⅱ was constructed and the expression conditions of the recombinant plasmid were optimized. The partial enzymatic properties of His-ChSase ABC Ⅱ were studied after obtaining ChSase ABC Ⅱ fusion protein with a polyhistidine-tag (His-tag) using affinity chromatography. Results: The results showed that the constructed His-ChSase ABC II fusion protein expression system successfully achieved the soluble expression of the protein in Escherichia coli. In the optimal conditions that the expression host was E. coli BL21(DE3) and inducer (isopropyl-β-D-thiogalactoside) concentration was 125 μmol/L, the enzyme activity of fermentation broth reached 7206.83±184.27 IU/L. Furthermore, the purified His-ChSase ABC Ⅱ had an enzyme specific activity of 22.02±0.39 IU/mg protein, with optimal pH and temperature of 7.5 and 40 ℃, respectively. The enzyme was also found to be stable at 30~40 °C with a half-life of over 2 h. Moreover, the His-ChSase ABC II was determined to specifically and effectively decompose chondroitin sulfate, with a Km value of 10.4±0.8 μmol/L and a Kcat value of 9.4±0.2 s−1. Conclusions: Efficient expression and purification of His-ChSase ABC Ⅱ were achieved using gene optimization and fusion expression strategies in this study. Moreover, the enzymatic properties of the recombinant fusion protein could fundamentally meet the standards essential for its application in the industrial production of pharma- and nutraceutical products. -
硫酸软骨素(chondroitin sulfate,CS)是一类硫酸化的糖胺聚糖,广泛分布于动物的细胞外基质和细胞表面[1]。CS具有抗炎[2-3]、抗氧化[4]、调节免疫力[5]、保护心脑血管[6-7]、保护神经系统[8-9]等多种药理功效,目前主要作为一种安全有效的抗骨关节炎药物和功能性食品而被广泛应用[10-11]。尽管CS具有多种生理功能和药理活性,但由于其相对分子质量较大(一般在50000~100000之间),因而生物利用度不高,在抗炎、抗氧化和免疫保护等方面的许多功效得不到有效发挥。研究表明,通过CS降解制备而来的相对分子质量低于10000的低分子量硫酸软骨素(low-molecular-weight chondroitin sulfates,LMWCSs),较易通过胃肠道吸收并能有效克服以上缺点[11-12]。因此,探索高效且安全的LMWCSs制备技术和方法具有重要的现实意义[13]。
目前,低分子量糖胺聚糖的生产方法有物理降解法、化学降解法和酶解法。前两种方法因受设备条件限制[14],或由于使用有毒化学品[15]和放射性物质[16],均难以推广。而酶解法对高分子多糖的降解影响最小[17],并且在环境友好性、分子质量可控性和选择性等方面颇具优势[18],是目前通过高分子量CS降解来制备LMWCSs的最有发展前景的方法[19]。硫酸软骨素裂解酶ABC(chondroitinase ABC,ChSase ABC)是一类能将糖胺聚糖降解为寡糖和不饱和二糖的裂解酶,根据裂解机理的不同,可分为ChSase ABC Ⅰ和ChSase ABC Ⅱ[20-21]。其底物特异性广泛,在国际上受到的关注越来越多[22-23]。由于硫酸软骨素的分子结构复杂且不均一[24-25],仅单一的硫酸软骨素裂解酶并不能得到各种不同分子量范围的LMWCSs产品,将作用机制不同的ChSase ABC Ⅰ、Ⅱ配伍使用并建立复合酶法可解决上述问题,从而为酶法生产LMWCSs提供新思路。
ChSase ABC通常采用微生物发酵的方式获得,但发酵法生产的ChSase ABC酶活性偏低、分离纯化步骤过于繁琐,工业化成本太高[26-27]。异源重组表达是替代发酵法生产ChSase ABC的有效方案。但异源重组表达易形成无活性的包涵体,且酶活性很低[28-29]。融合蛋白技术可以解决异源重组表达中容易形成包涵体的问题,同时还可实现酶的高效分离纯化,从而大大降低酶的生产成本。目前,ChSase ABC的外源表达研究主要集中在ChSase ABC Ⅰ,Chen等[30-31]在大肠杆菌(Escherichia coli,E. coli)中利用融合表达技术获得了高表达量的可溶性ChSase ABC Ⅰ。但ChSase ABC Ⅱ的重组表达研究鲜有报道,只有Prabhakar等[32]在大肠杆菌中成功表达了ChSase ABC Ⅱ,但其表达量和活性都不高。这制约了复合酶法制备LMWCSs的技术发展以及LMWCSs的应用研究。
多聚组氨酸标签(polyhistidine-tag,His-tag)是融合表达技术中最常用的蛋白标签之一,由6个或6个以上连续的组氨酸残基组成[33]。His-Tag分子量小,一般不会影响融合蛋白的结构和功能[34],而且His-Tag对固定化金属离子(例如,Ni2+或Cu2+)有很强的亲和力,因此带有His-Tag的融合蛋白可以采用固定化金属离子亲和色谱法实现一步高效纯化[35]。本研究为实现ChSase ABC Ⅱ的高效重组表达,在基因优化的基础上,将His-Tag与ChSase ABC Ⅱ进行融合表达,然后对其表达条件进行优化,并利用His纯化柱实现His-ChSase ABC Ⅱ融合蛋白的一步纯化,最后对其部分酶学性质进行研究,旨在为 ChSase ABC Ⅱ的工业化生产和后续应用于LMWCSs的制备研究奠定基础。
1. 材料与方法
1.1 材料与仪器
E. coli BL21(DE3)、E. coli JM109、E. coli DH10B、E. coli HB101、E. coli OrgamiB (DE3)感受态细胞 北京全式金生物技术有限公司;质粒pET-28a、DNA聚合酶、T4 DNA连接酶、限制性内切酶 美国New England Biolabs公司;凝胶回收试剂盒、细菌DNA提取试剂盒、质粒提取试剂盒 天根生化科技(北京)有限公司;蛋白质定量试剂盒(BCA法) 北京普利莱基因技术有限公司;硫酸软骨素(平均分子质量68000 Da) 中国合肥博美生物科技有限责任公司;LB培养基 美国AMRESCO公司;其它试剂均为国产分析纯。
HisTrap HP亲和层析柱 美国GE Healthcare公司;BILON-R1200非接触式全自动超声破碎仪 上海比朗仪器有限公司;UV-1800PC-DS2紫外-可见分光光度计 上海美普达仪器有限公司;NanoDrop2000微量核酸蛋白检测仪 美国 Thermo Fisher公司;AR2140型电子分析天平 美国OHAOUS公司。
1.2 实验方法
1.2.1 ChSase ABC Ⅱ基因的优化
在NCBI的GenBank数据库获取ChSase ABC II基因原始序列(GenBank登录号:HW119649.1),根据大肠杆菌的密码子偏好性,利用GenSmart™密码子优化软件(金斯瑞生物科技股份有限公司)对ChSase ABC II基因原始序列进行优化,在不改变氨基酸序列的前提下,用高频密码子替换低频密码子,同时调整鸟嘌呤(guanine,G)和胞嘧啶(cytosine,C)含量,排除常用酶切位点pstI,避免3个多聚腺苷酸结构(poly A)和2个多聚胸苷酸(poly T)结构。ChSase ABC II基因被优化后,由金斯瑞公司(GenScript)按照优化后的序列进行基因合成。
1.2.2 ChSase ABC Ⅱ基因的扩增
以优化后的ChSase ABC II基因序列为模板,上游引物为GGGAAACATATGCTGCCGACCCTGAGCCACGAAG(下划线为NdeI酶切位点),下游引物为GGGAAAGGATCCTTATTTCACCAGGTTGATAACGGTCGG(下划线为BamHI酶切位点);加入PCR体系中其他成分(NEB phusion聚合酶、buffer、dNTPs和H2O)进行PCR,反应条件为:94 ℃预变性300 s,94 ℃变性60 s,54 ℃退火60 s,72 ℃延伸180 s。PCR产物进行琼脂糖凝胶电泳检测和胶回收。回收后产物送到生工生物工程上海(股份)有限公司进行测序验证。
1.2.3 重组质粒pET-28a-His-ChSase ABC Ⅱ的构建
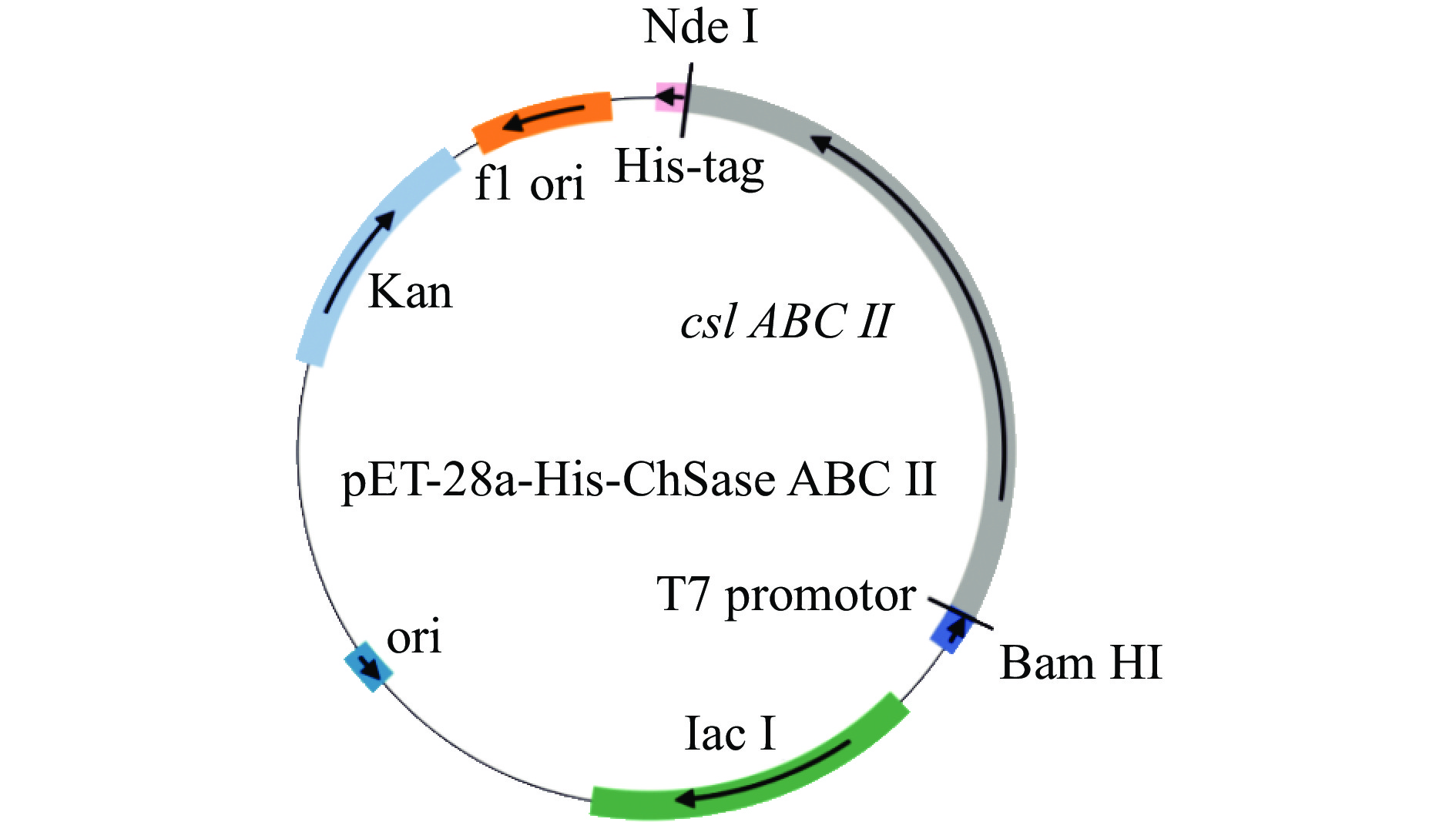
将回收得到ChSase ABC Ⅱ基因片段用Nde I和Bam HI进行酶切,同时质粒pET-28a也用同样的内切酶进行酶切,酶切后的产物进行胶回收后再进行连接,并转化至E. coli BL21(DE3)中,涂在带有卡纳抗性的的平板上。37 ℃培养12 h后,挑取菌落至带有卡纳抗性的3 mL LB培养基中,37 ℃,220 r/min培养12 h,提取质粒,得到重组质粒pET-28a-His-ChSase ABC II(见图1)。以重组质粒为模板,采用与1.2.2相同的上、下游引物和条件进行 PCR鉴定,以验证所提重组质粒的正确性,同时将重组质粒送去进行DNA测序,经测序比对正确后备用。
1.2.4 融合蛋白His-ChSase ABC Ⅱ表达条件的优化
宿主优化:以空白质粒为对照,将构建好的重组质粒pET-28a-His-ChSase ABC II分别转化到宿主E. coli BL21(DE3)、E. coli JM109、E. coli DH10B、E. coli HB101、E. coli OrgamiB (DE3)的感受态细胞中,从而得到转化体。挑取转化体至带有卡纳抗性的3 mL LB培养基中,37 ℃,200 r/min培养2 h后,按照1%接种量转接至带有卡纳抗性的50 mL LB培养基中,37 ℃,180 r/min培养至对数生长期(OD600为0.6左右),加入终浓度为100 μmol/L的诱导剂IPTG,放入摇床中,20 ℃,180 r/min诱导培养20 h,最后收集菌体,破碎细胞进行酶活性测定。
诱导剂异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside,IPTG)浓度优化:在使用最佳表达宿主的条件下,加入终浓度分别为50、75、100、125和150 μmol/L的IPTG,以用于进行诱导表达,从而分析诱导剂IPTG对融合蛋白His-ChSase ABC Ⅱ表达的影响。
1.2.5 融合蛋白His-ChSase ABC Ⅱ的纯化
将上述诱导培养结束后的菌液倒入离心管中,在温度为4 ℃,离心力为6250×g的条件下,离心10 min后,弃去上清液,加入15 mL 50 mmol/L Tris-HCl,100 mmol/L NaAc,pH7.4缓冲液重悬菌体,重悬液用超声破碎仪破碎10 min(功率150 W,每超声3 s后暂停5 s)后,在温度为4 ℃,离心力为6250×g的条件下再次离心10 min后,收集上清液。所得上清液即为带有His-tag的ChSase ABC Ⅱ粗酶液。将粗酶液用0.22 μm的滤膜过滤后,取适量到HisTrap HP亲和层析柱上按照说明书进行纯化。融合蛋白His-ChSase ABC Ⅱ纯化后,进行SDS-PAGE分析验证。
1.2.6 His-ChSase ABC Ⅱ酶活力和酶比活力的测定
融合蛋白His-ChSase ABC Ⅱ酶活力的测定参照吴敬君等[36]报道的方法进行。ChSase ABC Ⅱ酶活定义为每分钟内生成1 μmol 4, 5-不饱和糖醛酸所需要的酶量。以1 mg/mL的CS为底物,在37 ℃、缓冲溶液(Tris-HCl,pH7.4)中测定ChSase ABC Ⅱ酶活力。酶比活力为单位重量的蛋白质中所具有的酶活力单位数,通常用IU/mg蛋白来表示。采用北京普利莱基因技术有限公司的蛋白质定量试剂盒(BCA法)测定待测酶液蛋白浓度。
1.2.7 融合蛋白His-ChSase ABC Ⅱ最适温度和pH的测定
1.2.7.1 最适温度测定
选取6个温度梯度,其分别为30、35、40、45、50和55 ℃。在上述每个温度下,分别测量融合蛋白的酶活,平行测定三次,以确定最适作用温度。
1.2.7.2 最适pH 测定
选取6个pH梯度,其分别为6.0、6.5、7.0、7.5、8.0和8.5。将融合蛋白在以上每个对应的pH下测量酶活,平行测定三次,以确定最适pH。测定酶活时,分别用反应缓冲液和底物溶液来控制整个反应体系的pH。
反应缓冲液:100 mmol/L NaAc、50 mmol/L Tris,用1 mol/L的盐酸调节pH至合适梯度,充分搅拌后4 ℃保存;底物溶液:100 mmol/L NaAc、50 mmol/L Tris、1 g/L CS,用1 mol/L的盐酸调节pH至合适的梯度,充分搅拌后4 ℃保存。
1.2.8 融合蛋白His-ChSase ABC Ⅱ热稳定性的测定
在最适pH的条件下,将融合蛋白His-ChSase ABC Ⅱ分别放在30、35、40和45 ℃等不同温度条件下各保温30、60、90、120、150、180和210 min后,分别加入底物测量残存的酶活,平行测定三次,以确定酶的热稳定性。
1.2.9 融合蛋白His-ChSase ABC Ⅱ底物特异性的测定
在最适反应条件下,参考Prabhakar等[32]的报道,以肝素(heparin,Hep)、硫酸乙酰肝素(heparan sulfate,HS),CS和硫酸皮肤素(dermatan sulfate,DS)为底物,按照中国药典(2015年版)中的高效液相色谱法(通则0512)[37]分析融合蛋白His-ChSase ABC Ⅱ的底物特异性。
1.2.10 融合蛋白His-ChSase ABC Ⅱ动力学常数的测定
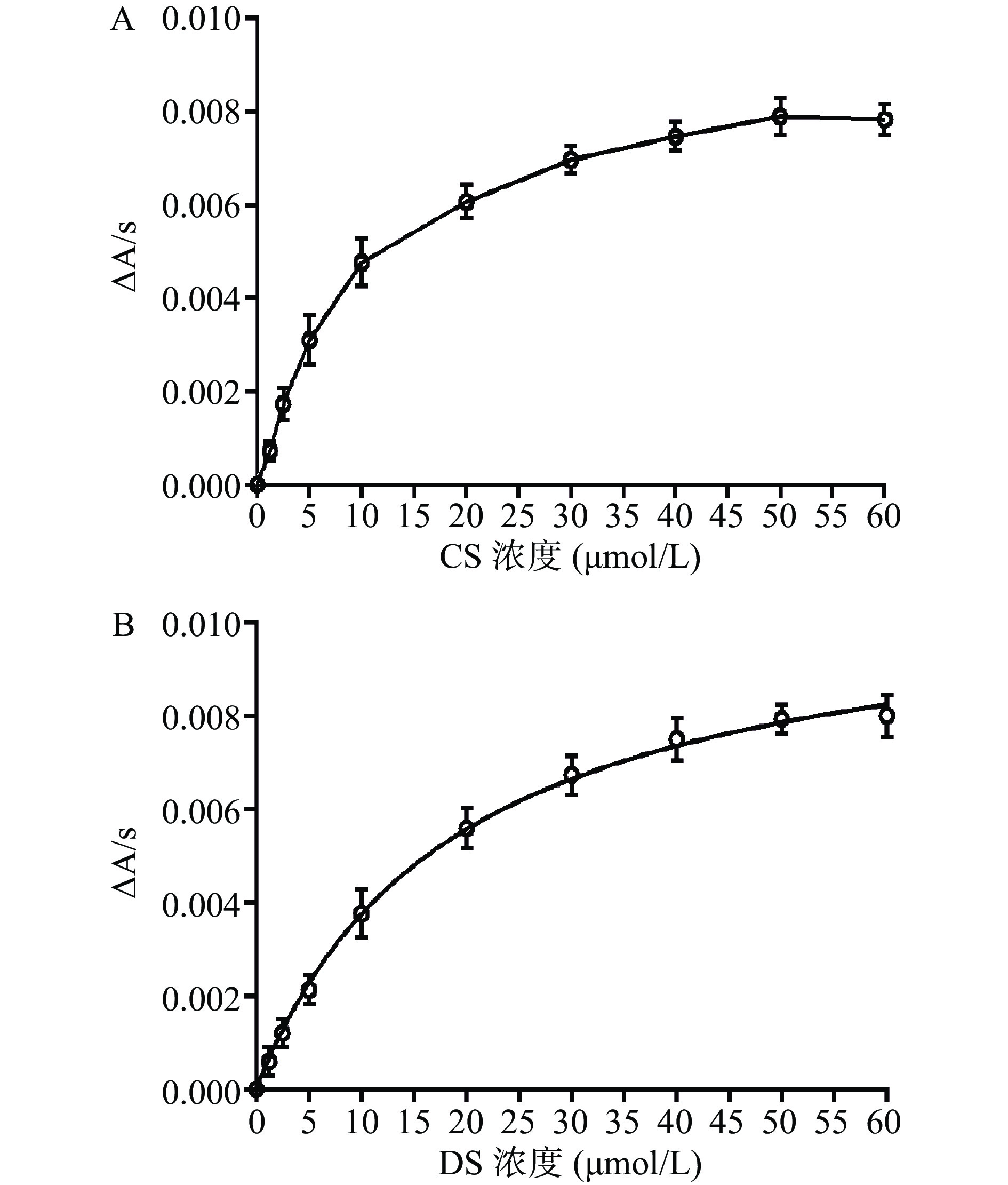
在融合蛋白His-ChSase ABC Ⅱ的最适温度和pH下测定其酶动力学常数。用紫外-可见分光光度计测定酶促反应速度时,参考Prabhakar 等[32]的报道,分别以CS和DS为底物,用Tris-HCl缓冲溶液(见1.2.7.2节)配制浓度为1.25、2.5、5、10、20、30、40、50和60 μmol/L的底物溶液。底物在设为最适温度的水浴中预热30 min后,吸取2 mL于比色皿中进行调零。调零后,吸取50 μL酶液,232 nm处测定1 min反应液光吸收值的变化。根据光吸收值变化,分别计算各个底物浓度条件下酶促反应初速度。每个底物浓度下平行测定3次。利用GraphPad Prism 6.0软件拟合米氏方程,然后计算His-ChSase ABC Ⅱ的米氏常数(Michaelis constant,Km)、催化常数(Catalytic constant,Kcat)和特异性常数(Kcat/Km)。
1.3 数据处理
采用SPSS 22.0统计软件(IBM Co., Armonk, NY, USA)的AVONA程序对所有数据进行统计分析,并对不同组别的平均值进行多重比较(Duncan,P=0.05和P=0.01),以P<0.05和P<0.01作为统计学显著和极显著意义。
2. 结果与分析
2.1 ChSase ABC Ⅱ基因的优化
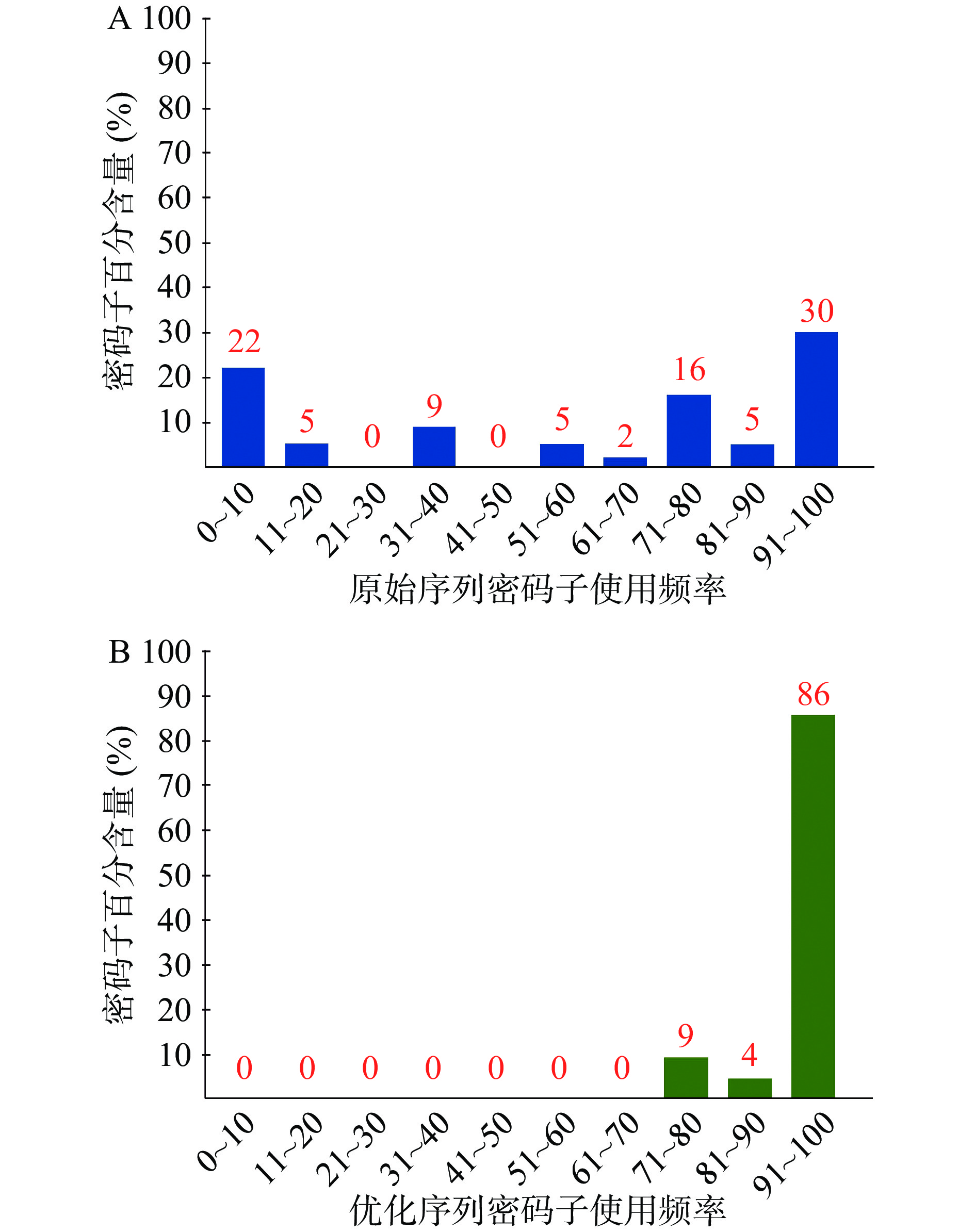
通过GenSmart™密码子优化软件分析,ChSase ABC Ⅱ基因原始序列(见图2)的密码子适应性指标(codon adaptability index,CAI)为0.35(见图3A),GC含量为36.40%。理论上讲,当一段基因序列的CAI 值<0.8时,表明该序列在大肠杆菌中不易实现高水平表达[38],因此推测ChSase ABC Ⅱ基因原始序列的理论表达量较低。大肠杆菌密码子偏好性是其实现异源重组基因高水平表达的一个主要问题[39]。此外,基因序列中的GC含量、限制酶识别位点和碱基重复等对蛋白能否实现高效表达也有一定影响[40]。本研究对ChSase ABC Ⅱ基因密码子、GC含量、酶切位点pstI、3个poly A结构和2个poly T结构进行优化后,ChSase ABC Ⅱ基因优化序列的CAI增加到0.97(见图3B),GC含量为55.56%,并且大肠杆菌偏好密码子的百分比,以使用频率为91~100间的数据为例分析,优化后的数值是86%,优化前的此部分对应值为30%,故优化后的值是优化前的2.9倍(见图4),这些均有利于ChSase ABC Ⅱ在大肠杆菌中表达量的提高。
2.2 重组质粒pET-28a-His-ChSase ABC Ⅱ的PCR验证
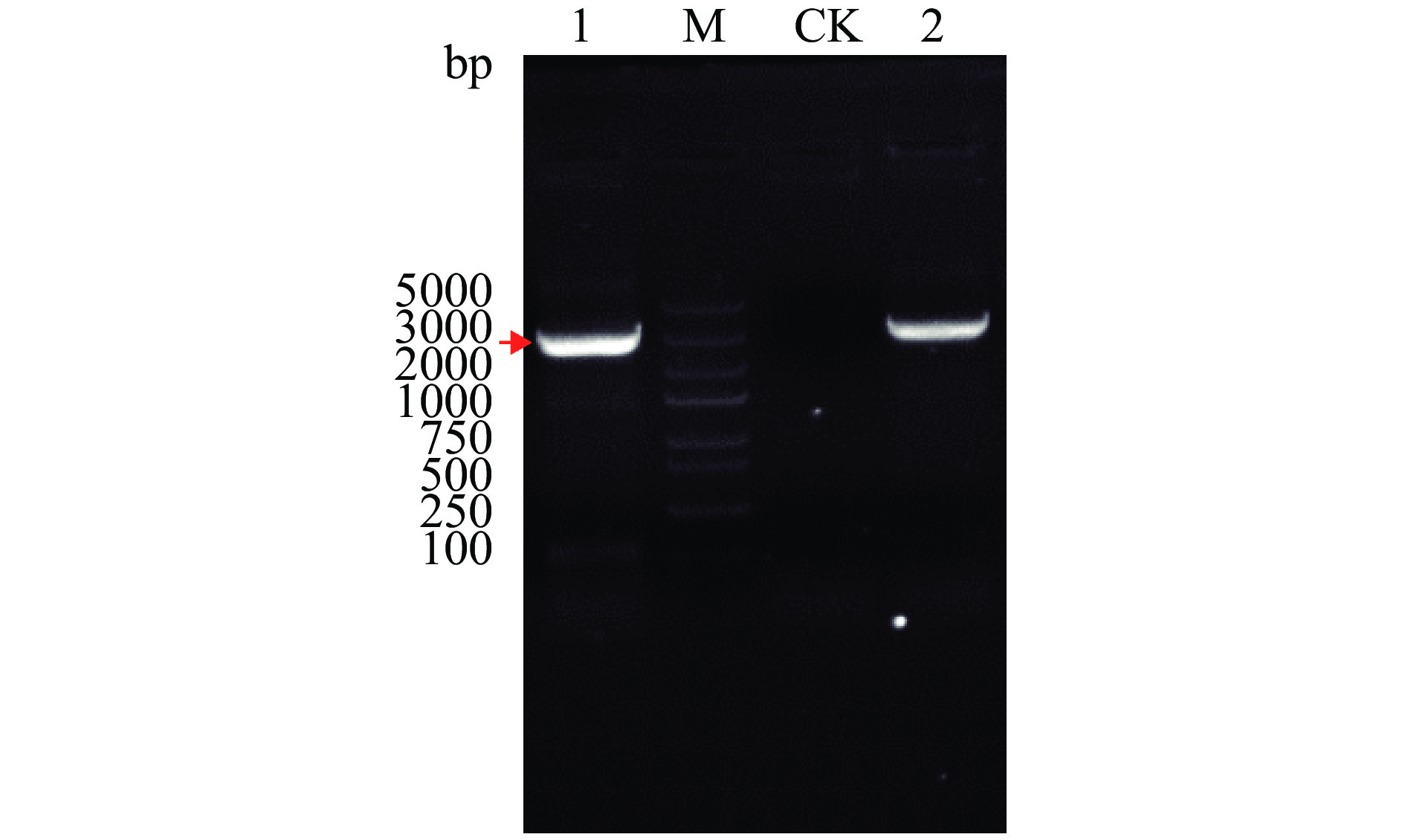
将1.2.2中扩增得到的ChSase ABC Ⅱ基因(大小为2973 bp的片段)与本实验所提的重组质粒一起采用相同的上、下游引物组合进行PCR。由于重组质粒是将优化后的ChSase ABC Ⅱ基因序列与载体pET-28a连接转化进行克隆后再提取的,因此,若重组质粒连接正确,1%琼脂糖凝胶电泳检测将显示两次 PCR产物的片段大小一致。
1%琼脂糖凝胶电泳结果(图5)显示,两次PCR产物的片段大小基本一致,都在3000 bp左右,而未加模板的对照无条带产生,说明引物本身未发生自连和形成引物二聚体。以上结果表明,重组质粒pET-28a-His-ChSase ABC Ⅱ构建成功。
2.3 融合蛋白His-ChSase ABC Ⅱ表达宿主和IPTG浓度的优化
选择合适的表达宿主有利于目的蛋白的高表达水平。将重组质粒分别转化到E. coli BL21(DE3)、E. coli JM109、E. coli DH10B、E. coli HB101和E. coli OrgamiB(DE3)等5种不同的感受态细胞中进行表达,用CS测定其总酶活。结果表明,除E. coli BL21(DE3)菌株发酵酶活力为5394.76±72.7 IU/L外,其余菌株的表达产物均未被检测出酶活性。其原因可能在于大肠杆菌宿主菌株大量表达重组蛋白依赖于所使用的表达载体,要在含有T7启动子的pET-28a载体中表达基因,要求表达宿主能为T7启动子产生RNA聚合酶[41]。E. coli BL21(DE3)因携带T7 RNA聚合酶基因,且具有蛋白表达量高、生长速度快、产醋酸盐少、分泌能力强等优点,已成为重组蛋白生产的首选宿主[42]。本研究中5种表达宿主的筛选结果也证明E. coli BL21(DE3)是高效表达融合蛋白His-ChSase ABC Ⅱ的最佳宿主。
IPTG是目前可溶性重组蛋白表达研究中应用最广泛的诱导剂[39]。研究表明,优化IPTG浓度可促进可溶性重组蛋白高效表达[36, 43]。由图6可知,诱导剂浓度在50~125 μmol/L时,发酵酶活力随浓度呈上升趋势。当诱导剂浓度为125 μmol/L时,His-ChSase ABC Ⅱ在E. coli BL21(DE3)中可以高效表达,其发酵酶活力(7206.83±184.27 IU/L)达到最高。当诱导剂浓度超过125 μmol/L后,发酵酶活力不升反降,因为诱导剂浓度过高时,目的蛋白翻译的正确折叠率会降低,从而导致不溶性错误折叠中间体在细胞质中积累为包涵体[39],进而使发酵酶活力下降。
2.4 融合蛋白His-ChSase ABC Ⅱ的纯化
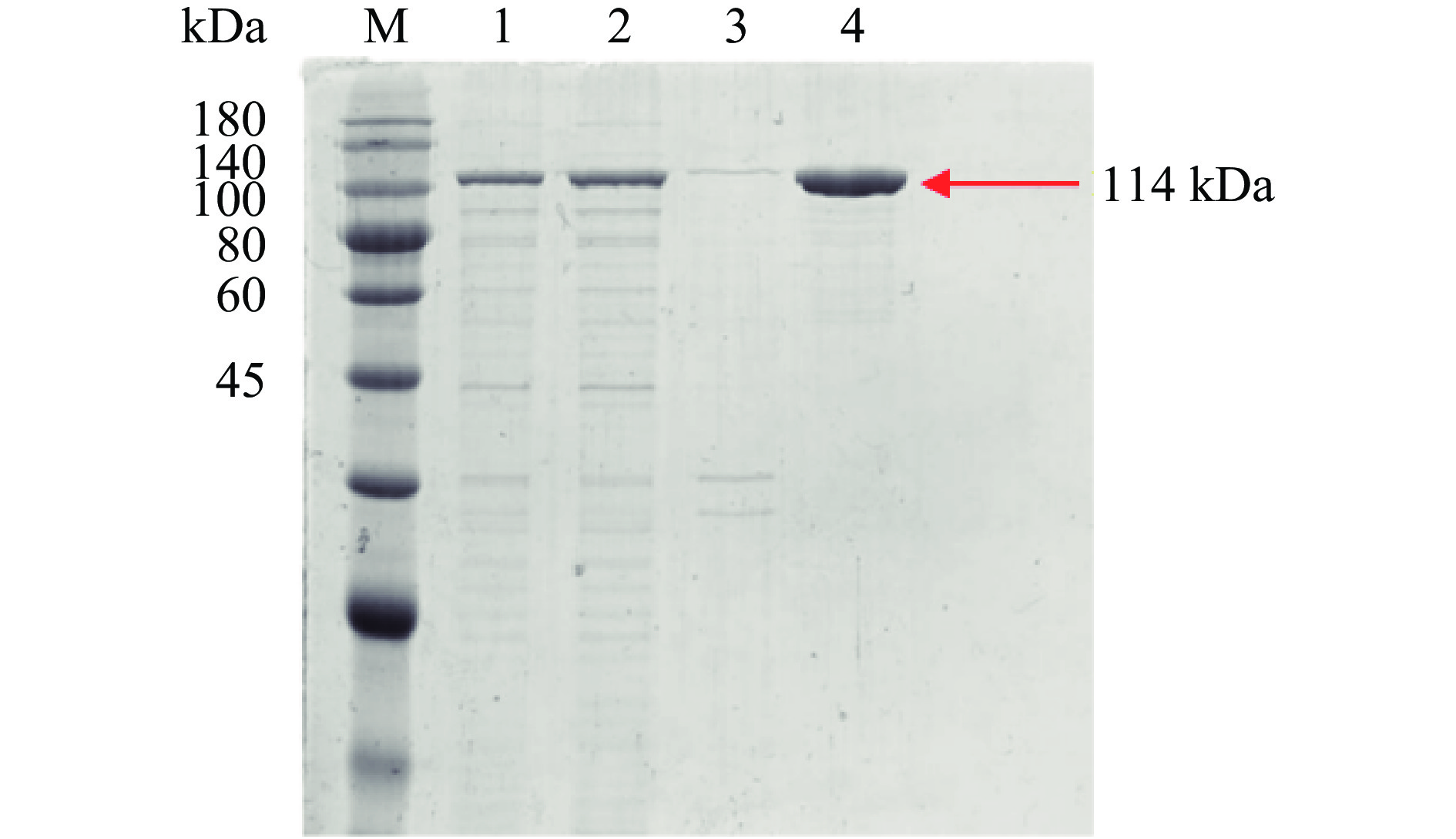
将以E. coli BL21(DE3)为宿主表达并破碎得到的His-ChSase ABC Ⅱ粗酶液用HisTrap HP亲和层析柱一步纯化后,进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electropheresis,SDS-PAGE)分析验证,验证结果见图7。融合蛋白分子量大概在114 kDa,与预期的酶分子量基本一致。从图7可看出,菌体细胞破碎离心后的上清液条带(条带2)颜色很深,菌体细胞破碎离心后的沉淀条带(条带3)颜色很浅,说明实验所得的His-ChSase ABC Ⅱ大量存在于上清液中,其可溶性很高。同时,从表1可看出,HisTrap HP亲和层析柱的一步纯化回收率可达到 83.11%,纯化倍数为1.75。此外,纯化后的His-ChSase ABC Ⅱ的酶比活力为22.02±0.39 IU/mg 蛋白,与Hamai等[44]报道的天然、无标签的ChSase ABC Ⅱ的酶比活力(31 IU/mg 蛋白)接近。
2.5 融合蛋白His-ChSase ABC Ⅱ的最适温度和pH
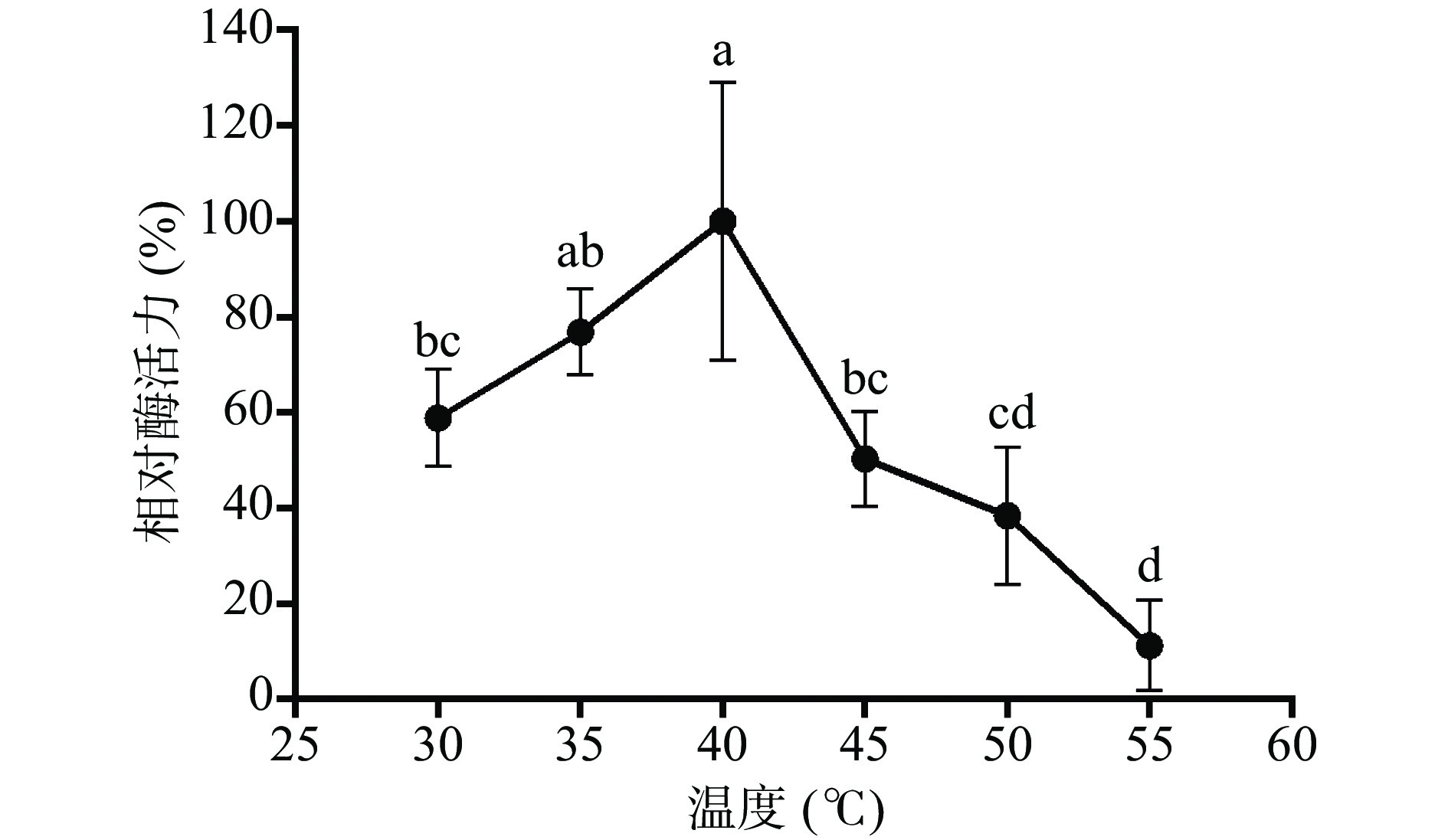
融合蛋白 His-ChSase ABC Ⅱ最适温度的优化结果如图8所示,酶活从30 ℃到 40 ℃随着温度的增加而增加,在40 ℃达到最大值(此温度下的酶活定为100%),再升高温度,酶活力开始显著下降(P<0.05)。作用温度超过40 ℃ 时酶活明显降低的原因,主要是酶的空间结构可能被破坏,底物与酶活性中心不能有效结合。这些结果说明,40 ℃是融合蛋白His-ChSase ABC Ⅱ的最适作用温度,这与Hamai等[44]报道的天然、无标签的ChSase ABC Ⅱ的最适温度完全一致。
![]() 图 8 温度对纯化后融合蛋白His-ChSase ABC Ⅱ的影响(n=3)注:两组数据后标注相同字母表示两个处理间不存在显著性差异,两组数据后标注不同字母表示两个处理间存在显著性差异(P<0.05);图9同。Figure 8. Effect of temperature on purified His-ChSase ABC Ⅱ (n=3)
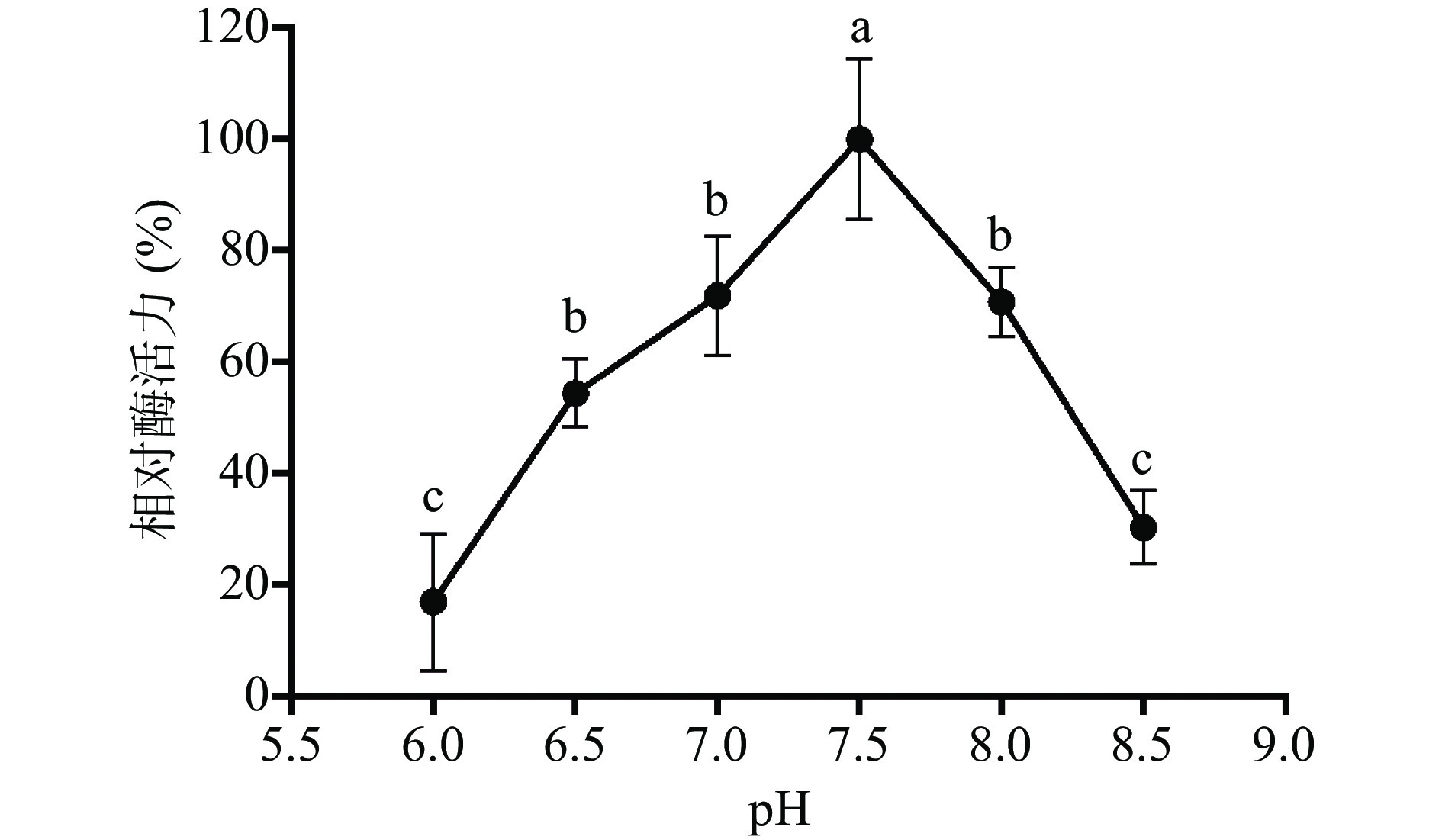
图 8 温度对纯化后融合蛋白His-ChSase ABC Ⅱ的影响(n=3)注:两组数据后标注相同字母表示两个处理间不存在显著性差异,两组数据后标注不同字母表示两个处理间存在显著性差异(P<0.05);图9同。Figure 8. Effect of temperature on purified His-ChSase ABC Ⅱ (n=3)酶催化需要适宜的pH环境,融合蛋白His-ChSase ABC Ⅱ最适pH的优化结果如图9所示,融合蛋白His-ChSase ABC Ⅱ的酶活从pH6.0到7.5呈现上升趋势,在pH7.5 时达到最大值(酶活定为100%),随后再升高 pH,酶活显著降低(P<0.05)。实验结果表明融合蛋白 His-ChSase ABC Ⅱ最适pH为7.5,略低于Hamai等[44]报道的天然、无标签的ChSase ABC Ⅱ的最适pH8,这种变化可能跟His-ChSase ABC Ⅱ带有融合标签His有关。
2.6 融合蛋白His-ChSase ABC Ⅱ的热稳定性
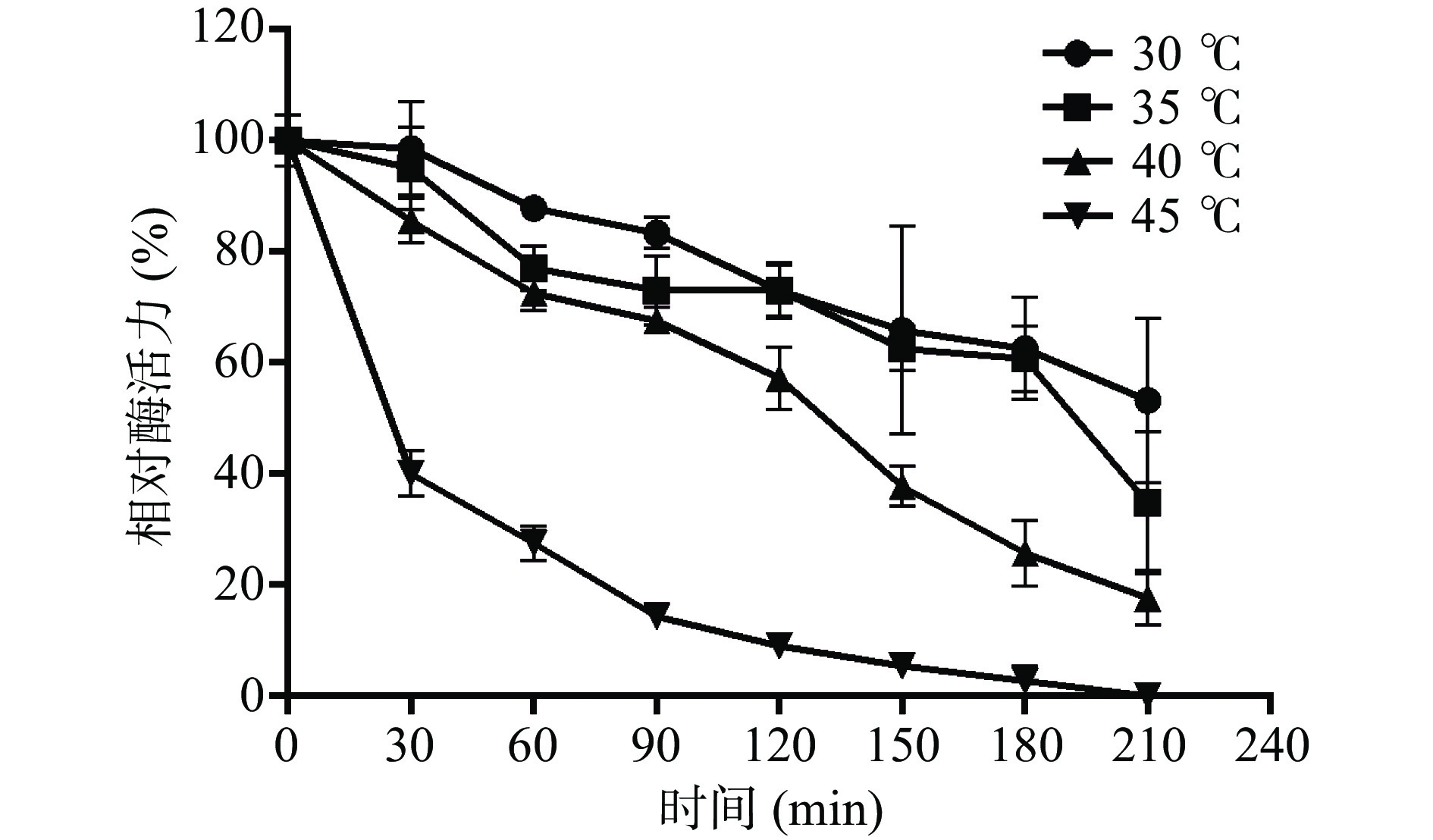
酶的热稳定性研究对于选择适宜的催化反应温度具有重要的指导意义。在一定的温度范围内,酶反应速度会随酶反应温度的升高而加快。但温度太高也可能会导致酶蛋白失活。因此,需要明确融合蛋白His-ChSase ABC Ⅱ在一定温度条件下的热稳定性。如图10所示,温度对其稳定性的影响非常明显,随着孵育温度的增加,酶活逐渐降低;随着时间不断延长,酶活也逐渐降低。当孵育温度为30 ℃时,融合蛋白 His-ChSase ABC Ⅱ在90 min后仍能保留80%以上的相对酶活力,180 min时为62.6%,直到210 min,其相对活力降低至53.2%。当孵育温度为 35 ℃时,90 min后其相对酶活力仍能保留70%以上,180 min时降低到60.8%,到210 min时降低到34.7%。在40 ℃时,90 min后,His-ChSase ABC Ⅱ相对活力为67.6%,在120 min后仍保持55%以上,到210 min时降至17.6%。当孵育温度为45 ℃时,在30 min内其相对活力迅速降低到40%左右,在210 min时已检测不到酶活。
表 1 融合蛋白His-ChSase ABC Ⅱ的酶活和比酶活(n=3)Table 1. Enzyme activity and specific activity of recombinant His-ChSase ABC Ⅱ (n=3)
融合蛋白蛋白总量
(mg)总酶活力
(IU)酶比活力
(IU/mg 蛋白)
纯化
倍数
回收率
(%)粗酶 纯酶 粗酶 纯酶 粗酶 纯酶 His-ChSase ABC Ⅱ 28.60±
0.7913.59±
0.31359.83±
4.85299.07±
1.6112.59±
0.1922.02±
0.391.75 83.11 实验结果说明融合蛋白His-ChSase ABC Ⅱ在30~40 ℃条件下较为稳定,能够持续保持较高的酶活力,半衰期均在2 h以上,可以满足一般工业应用。随着温度的升高,融合蛋白His-ChSase ABC Ⅱ活力降低速度加快,当温度达到45 ℃时,融合蛋白开始变性失活,从而导致酶活力急剧下降。结合2.5节的实验结果,可以看出融合蛋白His-ChSase ABC Ⅱ适宜的催化反应温度范围为30~40 ℃。
2.7 融合蛋白His-ChSase ABC Ⅱ的底物特异性
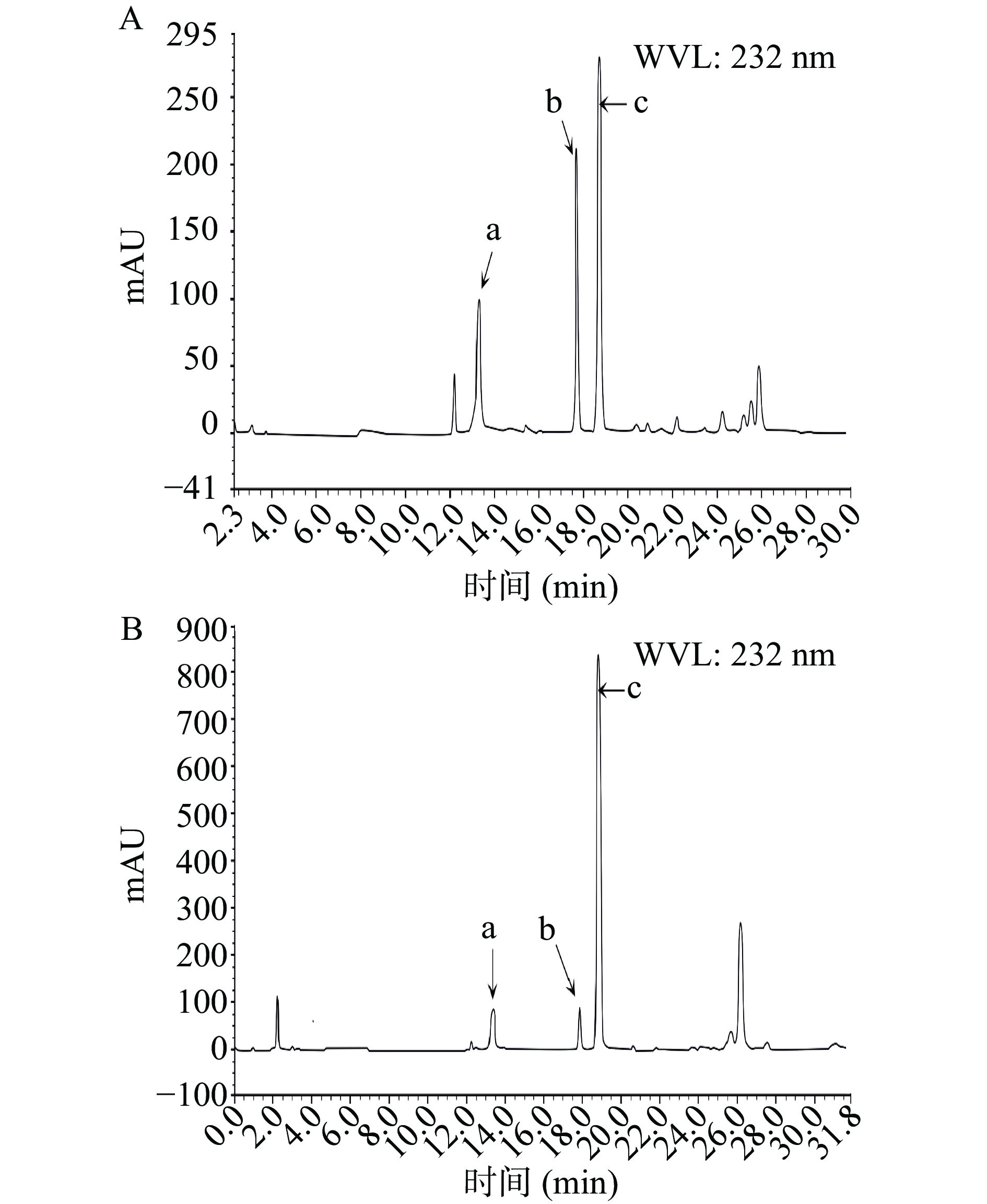
本实验中得到的His-ChSase ABC Ⅱ分别与Hep和HS在37 ℃水浴反应1 h后,HPLC检测Hep和HS酶解后的产物,未检测到对应的二糖:软骨素二糖、6-硫酸软骨素二糖和4-硫酸软骨素二糖,说明本实验制备的His-ChSase ABC Ⅱ不能降解 Hep和HS,这与Prabhakar等[32]的报道一致。
本实验中得到的融合蛋白His-ChSase ABC Ⅱ分别与CS和DS在37 ℃水浴反应1 h后,HPLC检测CS和DS酶解后的产物,测试结果见图11A和图11B。
图11A和图11B表明CS和DS酶解后软骨素二糖、6-硫酸软骨素二糖和4-硫酸软骨素二糖都被检测到,说明本实验制备的融合蛋白His-ChSase ABC Ⅱ对CS和DS具有较强的降解能力,20 min后的杂峰有可能是未彻底降解的CS和DS,可能是因为底物CS和DS过量所致。
2.8 融合蛋白His-ChSase ABC Ⅱ的动力学常数
分别以0~60 μmol/L的CS溶液和DS溶液为底物,测定融合蛋白His-ChSase ABC Ⅱ的动力学常数。利用GraphPad Prism 6.0 软件拟合米氏方程曲线(见图12),并计算出融合蛋白His-ChSase ABC Ⅱ的Km、Kcat和Kcat/ Km(见表2)。Km可以反映酶与底物亲和力的大小。Km值越大,则酶与底物的亲和力越小;反之,则越大。从表2可看出,His-ChSase ABC Ⅱ作用于CS时的Km小于其作用于DS时的Km,说明融合蛋白His-ChSase ABC Ⅱ与CS的亲和力大于其与DS的亲和力,这与之前报道的结果[32]相似。此外,融合蛋白His-ChSase ABC Ⅱ对CS的催化效率高于DS,前者的Kcat/Km为0.9 L/(μmol·s),后者为0.6 L/(μmol·s)。
表 2 融合蛋白His-ChSase ABC Ⅱ的动力学常数(n=3)Table 2. Kinetic constants of the fusion protein His-ChSase ABC Ⅱ (n=3)底物 Km
(μmol/L)Kcat
(s-1)Kcat/Km
(L/(μmol·s))CS 10.4±0.8 9.4±0.2 0.9 DS 18.9±1.7 10.8±0.4 0.6 3. 结论
本研究通过采取ChSase ABC Ⅱ基因密码子优化、融合表达和表达条件优化等策略,成功制备并纯化获得了大量的带His标签的ChSase ABC Ⅱ可溶性蛋白,发酵酶活力可达到7206.83±184.27 IU/L,是目前报道的最高水平。所得的融合蛋白His-ChSase ABC Ⅱ最适反应温度为40 ℃、酶比活力为22.02±0.39 IU/mg 蛋白,与天然、无标签的ChSase ABC Ⅱ[44]基本一致,两者最适pH也比较接近。所得的His-ChSase ABC Ⅱ在30~40 ℃条件下较为稳定,半衰期均在2 h以上,可以满足一般工业生产应用。此外,其底物特异性和动力学参数测定结果也与之前报道的结果[32]基本一致。上述结果表明,基因优化、融合表达等策略提高了ChSase ABC Ⅱ的表达量,但对其酶学性质影响不大,这为未来ChSase ABC Ⅱ的工业化生产和在LMWCSs制备中的应用研究奠定了坚实的基础。
-
图 8 温度对纯化后融合蛋白His-ChSase ABC Ⅱ的影响(n=3)
注:两组数据后标注相同字母表示两个处理间不存在显著性差异,两组数据后标注不同字母表示两个处理间存在显著性差异(P<0.05);图9同。
Figure 8. Effect of temperature on purified His-ChSase ABC Ⅱ (n=3)
表 1 融合蛋白His-ChSase ABC Ⅱ的酶活和比酶活(n=3)
Table 1 Enzyme activity and specific activity of recombinant His-ChSase ABC Ⅱ (n=3)
融合蛋白蛋白总量
(mg)总酶活力
(IU)酶比活力
(IU/mg 蛋白)
纯化
倍数
回收率
(%)粗酶 纯酶 粗酶 纯酶 粗酶 纯酶 His-ChSase ABC Ⅱ 28.60±
0.7913.59±
0.31359.83±
4.85299.07±
1.6112.59±
0.1922.02±
0.391.75 83.11 表 2 融合蛋白His-ChSase ABC Ⅱ的动力学常数(n=3)
Table 2 Kinetic constants of the fusion protein His-ChSase ABC Ⅱ (n=3)
底物 Km
(μmol/L)Kcat
(s-1)Kcat/Km
(L/(μmol·s))CS 10.4±0.8 9.4±0.2 0.9 DS 18.9±1.7 10.8±0.4 0.6 -
[1] MIZUMOTO S, YAMADA S, SUGAHARA K. Molecular interactions between chondroitin-dermatan sulfate and growth factors/receptors/matrix proteins[J]. Current Opinion in Structural Biology,2015,34:35−42. doi: 10.1016/j.sbi.2015.06.004
[2] PECCHI E, PRIAM S, MLADENOVIC Z, et al. 156 Inhibition of prostaglandin e2 and matrix metalloproteinases synthesis in interleukin-1b-stimulated osteoblasts: A potential role of chondroitin sulfate on bone in osteoarthritis[J]. Osteoarthritis & Cartilage,2010,18:S77−S77.
[3] ROMAN-BLAS J A, MEDIERO A, TARDÍO L, et al. The combined therapy with chondroitin sulfate plus glucosamine sulfate or chondroitin sulfate plus glucosamine hydrochloride does not improve joint damage in an experimental model of knee osteoarthritis in rabbits[J]. European Journal of Pharmacology,2017,794:8−14. doi: 10.1016/j.ejphar.2016.11.015
[4] MÜLLER A, LETELIER M E, GALLEGUILLOS M A, et al. Comparison of the antioxidant effects of synovial fluid from equine metacarpophalangeal joints with those of hyaluronic acid and chondroitin sulfate[J]. American Journal of Veterinary Research,2010,71(4):399−404. doi: 10.2460/ajvr.71.4.399
[5] SAKAI S, AKIYAMA H, SATO Y, et al. Chondroitin sulfate intake inhibits the IgE-mediated allergic response by down-regulating Th2 responses in mice[J]. Journal of Biological Chemistry,2006,281(29):19872−19880. doi: 10.1074/jbc.M509058200
[6] HAN L K, SUMIYOSHI M, TAKEDA T, et al. Inhibitory effects of chondroitin sulfate prepared from salmon nasal cartilage on fat storage in mice fed a high-fat diet[J]. International Journal of Obesity,2000,24(9):1131−1138. doi: 10.1038/sj.ijo.0801378
[7] WU N, ZHANGY, YE X, et al. Sulfation pattern of fucose branches affects the anti-hyperlipidemic activities of fucosylated chondroitin sulfate[J]. Carbohydrate Polymers,2016,147:1−7. doi: 10.1016/j.carbpol.2016.03.013
[8] KARUMBAIAH L, ENAM S F, BROWN A C, et al. Chondroitin sulfate glycosaminoglycan hydrogels create endogenous niches for neural stem cells[J]. Bioconjugate Chemistry,2015,26(12):2336−2349. doi: 10.1021/acs.bioconjchem.5b00397
[9] ZHANG Q, LI J, LIU C, et al. Protective effects of low molecular weight chondroitin sulfate on amyloid beta (Aβ)-induced damage in vitro and in vivo[J]. Neuroscience,2015,305:169−182. doi: 10.1016/j.neuroscience.2015.08.002
[10] 肖玉良, 李平利, 程艳娜, 等. 硫酸软骨素的药理作用及应用研究进展[J]. 中国药学杂志,2014,49(13):1093−1098. [XIAO Y L, LI P L, CHENG Y N, et al. Progress in the study of pharmacology and application of chondroitin sulfate[J]. Chinese Pharmaceutical Journal,2014,49(13):1093−1098. [11] XIAO Y, LI P, CHENG Y, et al. Enhancing the intestinal absorption of low molecular weight chondroitin sulfate by conjugation with α-linolenic acid and the transport mechanism of the conjugates[J]. International Journal of Pharmaceutics,2014,465(1-2):143−158. doi: 10.1016/j.ijpharm.2014.02.009
[12] HENROTIN Y, MATHY M, SANCHEZ C, et al. Chondroitin sulfate in the treatment of osteoarthritis: From in vitro studies to clinical recommendations[J]. Therapeutic Advances in Musculoskeletal Disease,2010,2(6):335−348. doi: 10.1177/1759720X10383076
[13] SOMMERS C D, YE H, KOLINSKI R E, et al. Characterization of currently marketed heparin products: Analysis of molecular weight and heparinase-I digest patterns[J]. Analytical & Bioanalytical Chemistry,2011,401(8):2445−2454.
[14] GUO X, YE X, SUN Y, et al. Ultrasound effects on the degradation kinetics, structure, and antioxidant activity of sea cucumber fucoidan[J]. Journal of Agricultural and Food Chemistry,2014,62(5):1088−1095. doi: 10.1021/jf404717y
[15] MOU J, WANG C, LI Q, et al. Preparation and antioxidant properties of low molecular holothurian glycosaminoglycans by H2O2/ascorbic acid degradation[J]. International Journal of Biological Macromolecules,2018,107:1339−1347. doi: 10.1016/j.ijbiomac.2017.10.161
[16] KIM J K, SRINIVASAN P, KIM J H, et al. Structural and antioxidant properties of gamma irradiated hyaluronic acid[J]. Food Chemistry,2008,109(4):763−770. doi: 10.1016/j.foodchem.2008.01.038
[17] KAPADNIS G, DEY A, DANDEKAR P, et al. Effect of degree of deacetylation on solubility of low molecular weight chitosan produced via enzymatic breakdown of chitosan[J]. Polymer International,2019,68(6):1054−1063. doi: 10.1002/pi.5795
[18] RIGOUIN C, LADRAT C D, SINQUIN C, et al. Assessment of biochemical methods to detect enzymatic depolymerization of polysaccharides[J]. Carbohydrate Polymers,2009,76(2):279−284. doi: 10.1016/j.carbpol.2008.10.022
[19] KANG Z, ZHOU Z, WANG Y, et al. Bio-based strategies for producing glycosaminoglycans and their oligosaccharides[J]. Trends in Biotechnology,2018,36(8):806−818. doi: 10.1016/j.tibtech.2018.03.010
[20] YAMAGATA T, SAITO H, HABUCHI O, et al. Purification and properties of bacterial chondroitinases and chondrosulfatases[J]. Journal of Biological Chemistry,1968,243(7):1523−1535. doi: 10.1016/S0021-9258(18)93574-X
[21] 李晔, 陈振娅, 袁其朋. 硫酸软骨素裂解酶ABC的研究进展[J]. 生物工程学报,2015,31(5):621−633. [LI Y, CHEN Z Y, YUAN Q P, et al. Research progress in chondroitinase ABC[J]. Chinese Journal of Biotechnology,2015,31(5):621−633. doi: 10.13345/j.cjb.140459 [22] CHEN X R, LIAO S J, YE L X, et al. Neuroprotective effect of chondroitinase ABC on primary and sondary brain injury after stroke in hypertensive rats[J]. Brain Research,2014,1543:324−333. doi: 10.1016/j.brainres.2013.12.002
[23] MAKRIS E A, MACBARB R F, PASCHOS N K, et al. Combined use of chondroitinase-ABC, TGF-β1, and collagen crosslinking agent lysyl oxidase to engineer functional neotissues for fibrocartilage repair[J]. Biomaterials,2014,35(25):6787−6796. doi: 10.1016/j.biomaterials.2014.04.083
[24] YAMADA K S. Potential therapeutic application of chondroitin sulfate/dermatan sulfate[J]. Current Drug Discovery Technologies,2008,5(4):289−301. doi: 10.2174/157016308786733564
[25] LAUDER R M. Chondroitin sulphate: A complex molecule with potential impacts on a wide range of biological systems[J]. Complementary Therapies in Medicine,2009,17(1):56−62. doi: 10.1016/j.ctim.2008.08.004
[26] 刘万顺, 付静芸, 常菁, 等. 硫酸软骨素酶高产菌株的筛选、鉴定和发酵培养条件的研究[J]. 中国海洋大学学报(自然科学版),2012,42(11):39−57. [LIU W S, FU J Y, CHANG J, et al. Screening and identification of two high chondroitinase producing bacterial strains and determination of their fermenting condition[J]. Periodical of Ocean University of China,2012,42(11):39−57. [27] 陶科, 王忠彦, 国锦琳, 等. 硫酸软骨素裂解酶ABC产生菌的筛选及发酵工艺研究[J]. 中国抗生素杂志,2004,29(3):138−141. [TAO K, WANG Z Y, GUO J L, et al. Study on the screening of chondroitinase ABC producing strain and their fermentation technology[J]. Chinese Journal of Antibiotics,2004,29(3):138−141. doi: 10.3969/j.issn.1001-8689.2004.03.003 [28] FAHNERT B, LILIE H, NEUBAUER P. Inclusion bodies: Formation and utilisation[J]. Advances in Biochemical Engineering/Biotechnology,2004,89:93−142.
[29] VALLEJO F L, RINAS U. Strategies for the recovery of active proteins through refolding of bacterial inclusion body proteins[J]. Microbial Cell Factories,2004,3(1):11. doi: 10.1186/1475-2859-3-11
[30] CHEN Z, LI Y, YUAN Q, et al. Expression, purification and thermostability of MBP-chondroitinase ABC I from Proteus vulgaris[J]. International Journal of Biological Macromolecules Structure Function & Interactions,2015,72:6−10.
[31] CHEN Z, LI Y, YUAN Q. Study the effect of His-tag on chondroitinase ABC I based on characterization of enzyme[J]. International Journal of Biological Macromolecules,2015,78:96−101. doi: 10.1016/j.ijbiomac.2015.03.068
[32] PRABHAKAR V, CAPILA I, SOUNDARARAJAN V, et al. Recombinant expression, purification, and biochemical characterization of chondroitinase ABC II from Proteus vulgaris[J]. Journal of Biological Chemistry,2009,284(2):974−982. doi: 10.1074/jbc.M806630200
[33] WAUGH D S. Making the most of affinity tags[J]. Trends in Biotechnology,2005,23(6):316−320. doi: 10.1016/j.tibtech.2005.03.012
[34] MIKE, CARSON, DAVID, et al. His-tag impact on structure[J]. Acta Crystallographica stion D Biological Crystallography,2007,63(3):295−301. doi: 10.1107/S0907444906052024
[35] SPRIESTERSBACH A, KUBICEK J, SCHÄFER F, et al. Purification of his-tagged proteins[J]. Methods in Enzymology,2015,559:1−15.
[36] 吴敬君, 李晔, 张翀, 等. 肝素黄杆菌硫酸软骨素酶AC的高效重组表达体系构建及其酶学性质研究[J]. 食品科学,2013,34(9):127−134. [WU J J, LI Y, ZHANG C, et al. Gene cloning and recombinant expression of chondroitinase AC from Pedobacter heparinus and characterization of recombinant fusion enzyme[J]. Food Science,2013,34(9):127−134. doi: 10.7506/spkx1002-6630-201309027 [37] 国家药典委员会. 中华人民共和国药典(二部)[S]. 北京: 中国医药科技出版社, 2015: 1340−1341 Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (Volume II)[S]. Beijing: China Medical Science Press, 2015: 1340−1341.
[38] CHEN Y, FU Z, YAN G, et al. Optimization of expression conditions and determination the proteolytic activity of codon-optimized SARS-CoV-2 main protease in Escherichia coli[J]. Sheng Wu Gong Cheng Xue Bao = Chinese Journal of Biotechnology,2021,37(4):1334−1345.
[39] KAUR J, KUMAR A, KAUR J. Strategies for optimization of heterologous protein expression in E. coli: Roadblocks and reinforcements[J]. International Journal of Biological Macromolecules,2018,106:803−822. doi: 10.1016/j.ijbiomac.2017.08.080
[40] 杨云彭, 马晓焉, 霍毅欣. 密码子优化策略在异源蛋白表达中的应用[J]. 生物工程学报,2019,35(12):2227−2237. [YANG Y P, MA X Y, HUO Y X, et al. Application of codon optimization strategy in heterologous protein expression[J]. Chinese Journal of Biotechnology,2019,35(12):2227−2237. doi: 10.13345/j.cjb.190280 [41] GOUY M, GAUTIER C. Codon usage in bacteria: Correlation with gene expressivity[J]. Nucleic Acids Research,1982,10(22):7055−7074. doi: 10.1093/nar/10.22.7055
[42] ROSANO G L, MORALES E S, CECCARELLI E A. New tools for recombinant protein production in Escherichia coli: A 5-year update: Recombinant protein production in Escherichia coli[J]. Protein Science,2019,28:1412−1422. doi: 10.1002/pro.3668
[43] GARCIA-FRAGA B, DA SILVA A F, LOPEZ-SEIJAS J, et al. Optimized expression conditions for enhancing production of two recombinant chitinolytic enzymes from different prokaryote domains[J]. Bioprocess & Biosystems Engineering,2015,38(12):2477−2486.
[44] HAMAI A, HASHIMOTO N, MOCHIZUKI H, et al. Two distinct chondroitin sulfate ABC lyases. An endoeliminase yielding tetrasaccharides and an exoeliminase preferentially acting on oligosaccharides[J]. Journal of Biological Chemistry,1997,272(14):9123−9130. doi: 10.1074/jbc.272.14.9123





 下载:
下载:



 下载:
下载:
