Impact of Environmental Conditions on the Biofilm Formation of Pseudomonas lundensis
-
摘要: 为研究环境条件对食品腐败菌隆德假单胞菌(Pseudomonas lundensis,PL)生物被膜形成能力的影响,采用微孔板结晶紫法测定不同的营养条件、接种浓度、pH、NaCl和Mg2+浓度条件下其生物被膜量,用激光共聚焦扫描显微镜观测其在不锈钢材料上的黏附和结构特征。结果表明,PL生物被膜的形成量在营养胁迫下降低,稀释TSB培养基50倍造成的营养胁迫使其生物被膜量从1.75±0.35降低至0.24±0.17。PL接种量从1.3×107 CFU/mL降至2.5×104 CFU/mL时,其生物被膜的形成量无显著差异(P>0.05),在pH为8.0时PL形成生物被膜量最多,1.25%以上的葡萄糖、4%以上的NaCl和0.5%的Mg2+能够显著(P<0.05)抑制PL生物被膜的形成。激光共聚焦显微镜观测结果表明该菌在一定浓度下具有在不锈钢表面形成典型生物被膜的能力。PL生物被膜形成能力受营养条件、葡萄糖浓度、pH、NaCl浓度、Mg2+等环境因子的影响。Abstract: In order to investigate the influence of environmental conditions on biofilm formation ability of food spoilage strain Pseudomonas lundensis (PL), the biofilm amount was measured by microplate crystal violet method under different nutritional conditions, inoculation concentration, pH, NaCl and Mg2+ concentration conditions. The adhesion and structural characteristics of PL on stainless steel surface were investigated by laser scanning confocal microscope. The results showed that nutritional stress formed by dilute tryptone soy broth reduced the amount of PL biofilm formation, and the nutrient stress caused by 50-fold dilution of TSB medium reduced the amount of biofilm from 1.75±0.35 to 0.24±0.17. There was no significant difference in biofilm formation when PL inoculation amount decreased from 1.3×107 CFU/ mL to 2.5×104 CFU/mL (P>0.05). The highest biofilm production was observed at pH 8.0. The biofilm formation was significantly inhibited respectively when the addition of glucose exceeded 1.25%, NaCl exceeded 4% and Mg2+ exceeded 0.5%. The observation results of laser scanning confocal microscopy showed that the PL had the ability to form typical biofilm on stainless steel surface at a certain concentration. The ability of PL biofilm formation was influenced by environmental factors such as nutrient stress, glucose concentration, pH, NaCl and Mg2+ concentration.
-
Keywords:
- Pseudomonas lundensis /
- biofilm /
- environmental conditions /
- spoilage bacteria
-
生物被膜(Biofilm,BF)是细菌抵抗不良生存条件、适应环境的一种生存模式,多数细菌以生物被膜状态群居生长[1]。生物被膜是由胞外多糖类、蛋白类、eDNA、脂类等胞外基质(Matrix)包裹着细菌形成的结构化、组织化的三维复合结构[2]。这些生物被膜基质将细菌群体包裹起来并紧密黏附在接触面上,增加了内部细菌对抗生素、营养不足、酸碱和温度改变等不良生存条件的耐受性和适应性[3]。因此,细菌一旦在食品或食品设备表面形成生物被膜就具有更强的适应性和抵抗力,会导致常规的抑菌手段、清洗和消毒等卫生措施达不到应有效果,往往难以清除并成为持续的污染源,会反复污染食品并引发食品腐败和食源性疾病[4-5]。食源性细菌的生物被膜已成为影响食品安全和卫生的新的危害因子。在食品工业中控制被膜态的细菌对预防和阻止食品腐败非常重要[6]。
隆德假单胞菌(Pseudomonas lundensis,PL)是腐败冷藏肉中经常分离到的优势腐败菌[7-8],也是生牛奶中的主要腐败菌[9-10],还是少量水产品中的腐败菌[11-12]。采用经典的结晶紫染色定量法和激光共聚焦显微镜结构观察对PL的研究表明:PL具有较强的生物被膜产生能力,较短生物被膜形成周期,能在12~24 h内形成大量的胞外复合物,而且其生物被膜的产量与蛋白酶的活性具有正相关性[13]。在腐败肉中,采用原位荧光染色和激光共聚焦观察发现:PL在冷藏猪肉腐败过程能够形成易于分散的生物被膜,与莓实假单胞菌(Pseudomonas fragi)相比,PL在肉表面的生物被膜更具有立体性[14]。同时该菌在10 ℃的低温条件下比在25 ℃时在牛肉中形成更多的生物被膜[15]。鉴于该菌在导致肉类腐败中的危害,有研究者针对性地探索了肉桂醛、3-蒈烯对该菌的抑菌作用,以促进冷藏肉类保鲜[16-17]。在自然和食品加工环境中,细菌生物被膜的形成或消除受到多种环境条件的影响。目前,国内外对隆德假单胞菌生物被膜的研究已确定了其在冷藏条件的生物被膜特征,但缺少更多食品相关环境条件下其生物被膜形成能力的研究。本文主要研究不同环境条件对隆德假单胞菌生物被膜形成能力的影响,为更好地认识与防控隆德假单胞菌生物被膜的潜在危害提供研究基础。
1. 材料与方法
1.1 材料与仪器
隆德假单胞菌106 分离自冷藏的猪肉,甘油管−80 ℃保存于本实验室[13];胰蛋白胨大豆肉汤(Try-ptone Soy Broth, TSB) 青岛海博生物科技有限公司;营养肉汤(Nutrient Broth, NB)、LB培养基 杭州百思生物技术有限公司;氯化钠、乙酸 天津市大众试剂研发中心;氯化镁、甲醇 天津市百世化工有限公司;葡萄糖 广州化学试剂厂;结晶紫 天津市大茂化学试剂厂。
BXM-30R立式压力蒸汽灭菌器 上海博讯实业有限公司医疗设备厂;SHA-B数显水浴恒温振荡器 常州普天仪器制造有限公司;SW-CJ-1D单人单面净化工作台 苏州净化设备有限公司;SM600酶标仪 上海水创医疗器械有限公司,Zeiss LSM 710激光共聚焦显微镜(Confocal Laser scanning microscopy,CLSM) 德国Carl Zeiss公司。
1.2 实验方法
1.2.1 菌种活化与菌悬液制备
将甘油保藏的德隆假单胞菌平板划线,在30 ℃培养24 h,连续活化二次。再挑取第二次平板画线活化后的单菌落于装有5 mL TSB培养基的试管中,在30 ℃下180 r/min摇床过夜培养两次,取第二次液体活化的菌种,用无菌TSB培养基稀释至OD600 nm为0.5待用。
1.2.2 生物被膜的形成与测定
将制备好的菌液5 μL接种在含195 μL TSB培养基的96孔酶标板中,每个测试至少接种5个平行孔,以无菌的TSB培养基为空白对照。将接种好的酶标板,放入恒温生化培养箱中,30 ℃静置培养12 h后取出,小心除去未黏附的浮游菌培养液。再用无菌生理盐水清洗3次,随后用200 μL甲醇固定15 min,移去甲醇并晾干,再用1%的结晶紫200 μL/孔染色5 min后用流水冲洗至没有颜色流出,自然晾干后用200 μL/孔的33%乙酸溶解5 min,最后用酶标仪测定630 nm处的吸光度,以OD630值表示隆德假单胞菌生物被膜形成量或生物被膜形成能力[18-19]。
1.2.3 不同培养基和营养胁迫对隆德假单胞菌生物被膜形成的影响
取制备好的菌液5 μL分别接种在含195 μL的TSB培养基、NB培养基和LB培养基的96孔酶标板中,30 ℃静置培养生物被膜12 h,处理后测定OD630值,比较不同培养基对隆德假单胞菌生物被膜形成的影响。
为探究培养基浓度对隆德假单胞菌的影响,以TSB培养基为基础,用蒸馏水将培养基分别稀释10倍、20倍、50倍和100倍,以不稀释的培养基为对照组样品,然后分别将隆德假单胞菌按1.2.2方法接种在5种不同浓度的培养基中进行生物被膜培养和测定,评价细菌在营养胁迫下的生物被膜形成能力。
1.2.4 不同接种量对生物被膜形成的影响
将二次过夜活化后的菌液稀释分成6个不同的菌密度,使OD600分别为1.00、0.50、0.20、0.10、0.05和0.01。当接种菌液的OD600为1.00时,采用平板计数法测定隆德假单胞菌的菌落数约为5.0×108 CFU/mL。分别取5 μL菌液接种在含195 μL TSB培养基的96孔板中,接种后不同梯度的孔板中菌落数分别为:1.3×107、6.3×106、2.5×106、1.3×106、6.3×105、2.5×104 CFU/mL。按1.2.2方法培养并测定不同接种量对生物被膜形成的影响。
1.2.5 不同理化因素对隆德假单胞菌生物被膜形成的影响
1.2.5.1 葡萄糖浓度对生物被膜形成的影响
所购TSB培养基含有葡萄糖,按使用说明配制成1 L液体TSB培养,其中含有0.25%的葡萄糖,在此基础上分别额外添一定浓度的葡萄糖,使培养基中的葡萄糖最终浓度分别为0.25%、0.50%、0.75%、1.25%、2.25%、4.25%、6.25%和8.25%,按1.2.2方法培养并测定不同葡萄糖浓度对隆德假单胞菌生物被膜形成的影响。
1.2.5.2 pH对生物被膜形成的影响
分别用稀盐酸和稀氢氧化钠溶液配制pH分别为4.0、5.0、6.0、7.0、8.0、9.0和10.0的TSB培养基,按1.2.2方法比较不同pH对隆德假单胞菌生物被膜形成的影响。
1.2.5.3 NaCl添加量对生物被膜形成的影响
分别配制最终质量分数为0.50%、1.00%、1.50%、2.00%、3.00%、4.00%、5.00%、6.00%、7.00%、8.00% NaCl的TSB培养基,按1.2.2方法培养测定不同NaCl浓度下PL生物被膜的形成情况。
1.2.5.4 Mg 2+浓度对生物被膜形成的影响
分别配制含0.00%、0.25%、0.50、1.00%、1.50% MgCl2的TSB培养基,培养并测定生物被膜,按1.2.2方法比较不同浓度的Mg2+对PL生物被膜形成的影响。
1.2.6 在不锈钢表面的生物被膜形成能力
将制备好的PL菌液按照1%的比例接种于含无菌不锈钢片(12 mm×12 mm×1 mm,304)和1 mL TSB培养基的24孔板中。将24孔板至于30 ℃条件下分别培养12 h,在30 ℃条件下分别培养12 h后取出。取出后将菌液轻轻吸出,用0.05 mol/L的PBS清洗3次,每次3~5 min。然后用2.5%戊二醛固定2 h并再次用PBS清洗;吸干水份后用50 µg/mL的FITC-conA荧光染色[20],置于4 ℃避光染色30 min后用PBS冲洗出去染料,用激光共聚焦显微镜采集图像,并用仪器自带软件处理图片,观测生物被膜特征。
1.3 数据处理
所有试验至少重复两次,实验数据用SPSS 19.0进行分析,显著性水平设定为P<0.05,数据用Excel软件处理并绘图,CLSM成像图由设备自带软件生成。
2. 结果与分析
2.1 培养基和营养对生物被膜形成的影响
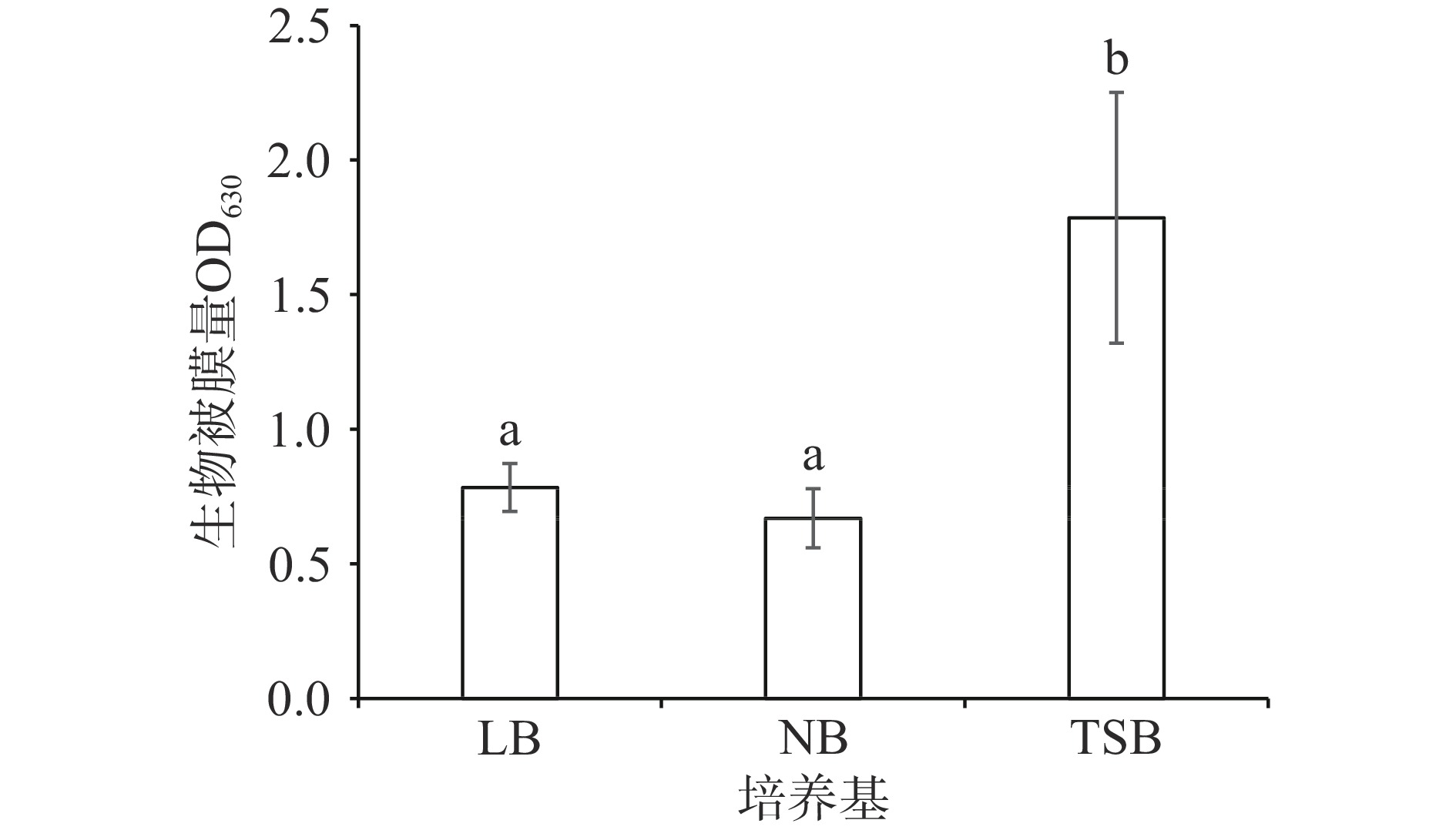
细菌生物被膜能够抵抗营养不良的生长环境,而营养物质的可利用情况也对细菌生物被膜的形成有直接影响。营养成分的限制可能会导致细菌在传代的过程中发生更多的适应性变异,如浮游型铜绿假单胞菌(Pse. aeruginosa)在只含有葡糖糖、乳酸和氨基酸的培养基中,出现了典型的生物被膜调控基因表达增加和由于群体感应基因激活而诱导的毒力基因表达增加等现象[21]。隆德假单胞菌在LB培养基和NB培养基中生物被膜形成量无显著差异(P>0.05),但其在TSB培养基中的生物被膜形成量显著高于其在LB培养基和NB培养基中的生物被膜形成量(P<0.05),如图1所示。对比三种培养基的具体成分发现,TSB培养基中含有葡萄糖,而LB培养基和NB培养基中无葡萄糖添加。这表明含葡萄糖的TSB培养基更适合隆德假单胞菌产生生物被膜。后续实验的培养基均采用了TSB培养基。
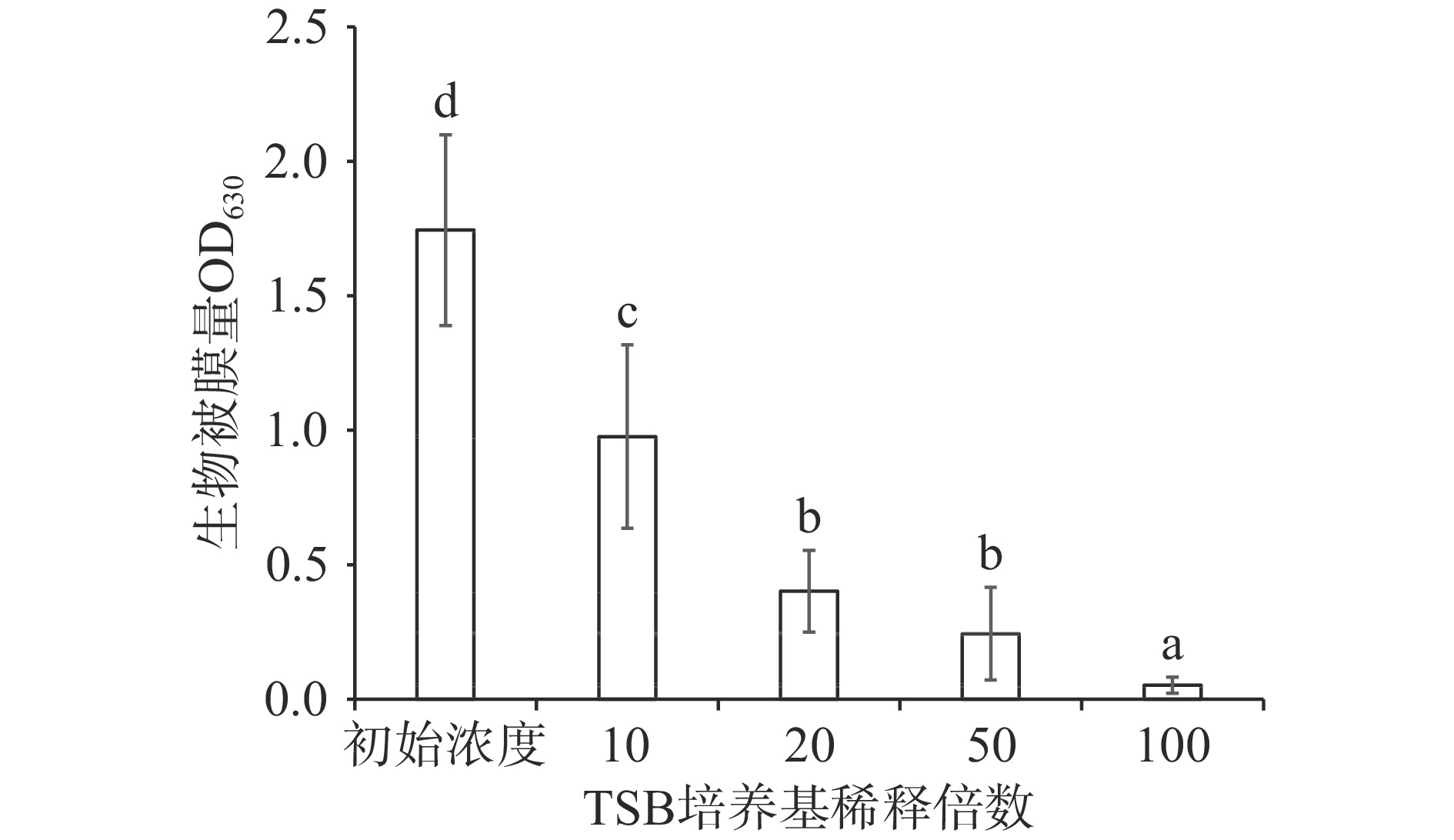
以TSB初始浓度为对照,将TSB稀释不同的倍数测定不同营养胁迫对隆德假单胞菌生物被膜形成能力的影响,结果如图2所示。随着培养基的稀释倍数增大和营养物质浓度降低,各梯度之间有显著差异,隆德假单胞菌的生物被膜形成量呈现下降趋势。当培养基稀释100倍时,隆德假单胞菌的培养基呈透明状,生物被膜形成量极低,生物被膜量值为0.05±0.03,远低于营养充足的初始浓度组的生物被膜量1.75±0.35,也低于培养基稀释50倍造成的营养胁迫下形成的生物被膜量0.24±0.17。对于成熟的生物被膜,营养缺乏会促进生物被膜的扩散而减少。对于恶臭假单胞菌(Pseudomonas putida)的生物膜,营养缺乏会导致细胞中磷酸二酯酶 BifA 水解 c-di-GMP,进而导致粘附素 LapA 蛋白水解,随后释放生物膜细胞,最终导致生物被膜扩散而减少生物被膜[22]。而在细菌生物被膜形成初期,营养限制可能会直接限制细菌生物被膜的形成。在多菌生物被膜系统中,往往会出现营养竞争性限制。当铜绿假单胞菌和金黄色葡萄球菌(Staphylococcus aureus)的混合生物被膜发展到成熟阶段后出现了营养竞争压力,导致了群体感应信号的释放和调控二者细胞表型变化以适应营养不足[23]。
2.2 菌液起始生物量对隆德假单胞菌生物被膜形成的影响
为探究菌液中隆德假单胞菌的生物量对生物被膜形成的影响,将接种了不同起始生物量的微孔板进行了生物被膜孵化培养,结果如图3所示。在营养充足的情况下,隆德假单胞菌初始接种生物量相差1000倍的情况下,接种菌液OD600从0.01到1.00的变化过程中,即微孔板中该菌菌落数在2.5×104至1.3×107 CFU/mL范围时,各组生物被膜的形成量没有显著差异(P>0.05)。这表明在一定范围内,隆德假单胞菌生物被膜的形成能力并没有因初始生物量降低而减弱。这种现象可能是与该菌的生物被膜形成能力较强有关。对该菌的生物被膜形成周期的研究表明,在30 ℃时该菌的生物被膜成熟期较短,在6~8 h内就能够形成较多的生物被膜[13];而6~8 h的培养时间属于细菌的对数增长初期,此时的菌密度相对稳定期仍然较低。在该菌数量较低的初始阶段就应注意防控其生物被膜的形成。
2.3 pH对隆德假单胞菌生物被膜形成的影响
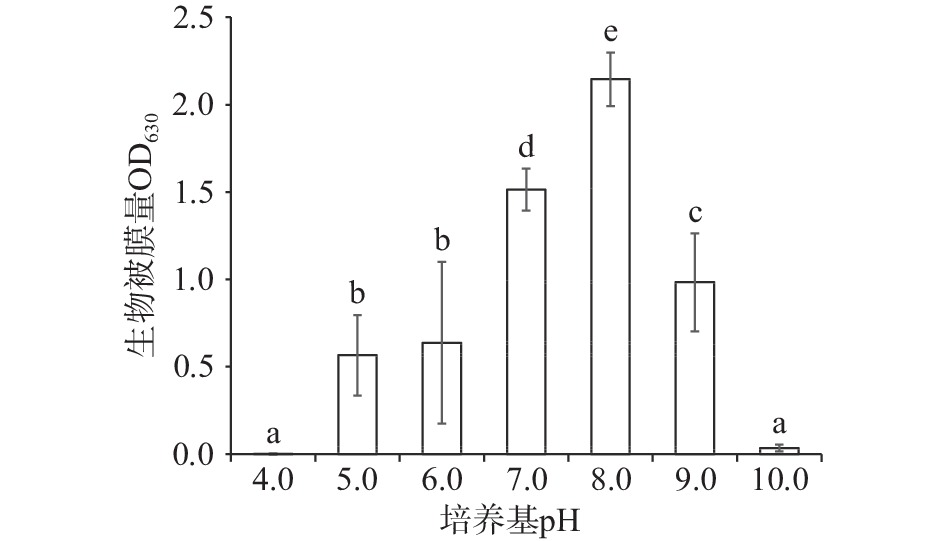
生物被膜作为其内部微生物的保护性外壳,被生物被膜包裹在内部的被膜菌比浮游菌能够更好地抵抗极端pH压力[24]。生物被膜菌适应极端酸性环境的原因可能与极端酸性pH条件下酸和重金属的结合导致生物被膜胞外复合物组成发生显著改变有关[25] 本研究以浮游菌为起点测定了不同pH对其生物被膜形成的影响,发现培养基pH的变化对隆德假单胞菌生物被膜形成有较大影响,如图4所示。隆德假单胞菌的生物被膜形成量随培养基的pH升高呈现先出现倒V形变化趋势,在pH低于4.0或大于10.0时基本不生长,无生物被膜形成。在pH为8.0时,隆德假单胞菌的生物被膜产生量均达到最高值。这表明隆德假单胞菌在偏弱碱性的条件下能够较好地形成生物被膜,而在过酸或过碱的环境中其生长和生物被膜的形成受到抑制。细菌形成生物被膜有利于抵抗偏酸的环境,但是当pH偏离细菌正常代谢的适宜条件时,细菌的生长代谢整体受到了抑制[26]。因此pH对细菌生物被膜形成的影响或者生物被膜菌对pH的适应范围,与细菌对酸碱环境的实用功能能力密切相关。变形链球菌(Streptococcus mutans)、茸毛链球菌(Streptococcus sobrinus)、嗜酸乳杆菌(Lactobacillus acidophilus)的生物膜量在pH为7.0~7.5时最大,而在pH为5.0或5.5时因菌落数低于在较高pH的菌落数而生物被膜量较小[27]。而对于创伤弧菌(Vibrio vulnificus)分别在pH为5.5、7.5和8.5培养时,野生型菌株和分离得到的致病菌株都在pH5.5时观察到更高的生物膜产量[28]。
2.4 葡萄糖浓度对生物被膜形成的影响
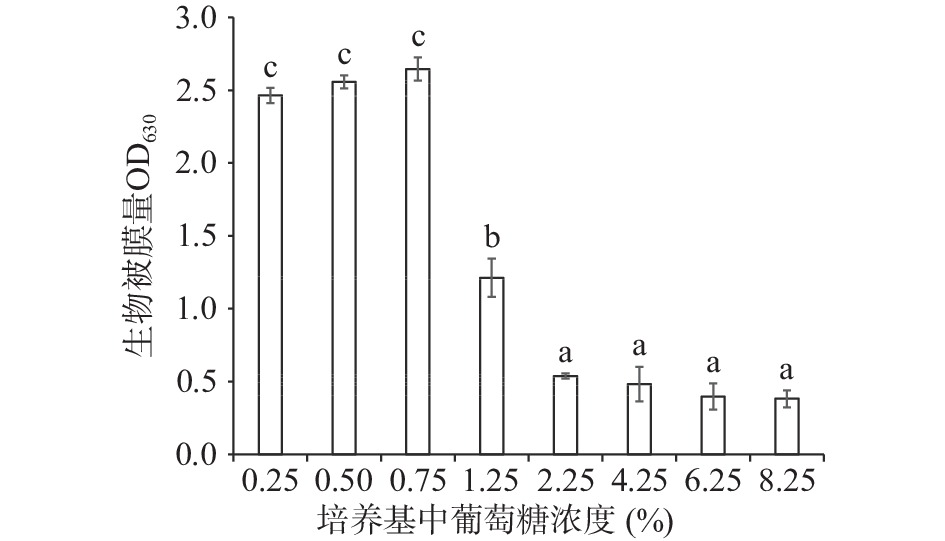
环境或食品基质中糖含量对其中的微生物的生长代谢有较大影响。对于隆德假单胞菌,当TSB培养基中的葡萄糖浓度为0.25%、0.50%和0.75%时,其生物被膜的形成量无显著差异(P>0.05),但当葡萄糖浓度达到1.25%以上时,隆德假单胞菌的生物被膜产生量显著降低(P<0.05)(如图5所示)。本研究发现当培养基中的葡萄糖质量分数达到2.25%、4.25%、6.25%和8.25%时,隆德假单胞菌生物被膜的形成量无显著差异(P>0.05)。这表明低浓度的葡萄糖环境对隆德假单胞菌生物被膜的形成没有影响,而高于1.25%的葡萄糖浓度形成了较高的渗透压,抑制了细菌生长,进而抑制了隆德假单胞菌生物被膜的形成。
2.5 NaCl 添加量对生物被膜形成的影响
NaCl添加量对隆德假单胞菌生物被膜的生长有明显的影响,如图6所示。随着TSB培养基中NaCl添加量的增加,隆德假单胞菌生物被膜的形成量呈现先增加后降低的趋势。在NaCl的添加量在1%~3%时,该菌的生物被膜形成量之间无显著差异(P>0.05),与没有在培养基中额外添加NaCl的培养条件相比(图3,OD600=0.5)也无显著差异(P>0.05)。在添加的NaCl质量分数大于3%后,其生物被膜形成量随NaCl质量分数的升高而降低;添加的NaCl的质量分数在6%及以上时,隆德假单胞菌几乎没有形成生物被膜,其生物被膜形成量与无菌空白对照无差异。这可能是因为在4%和5%的NaCl质量分数下隆德假单胞菌的生长受到了一定的抑制;而NaCl质量分数超过6%时,该菌的生长完全受到了高渗透压的抑制。但也有研究指出,部分隆德假单胞菌具有较高的耐盐性,在9% NaCl浓度下仍然能够生长[11]。
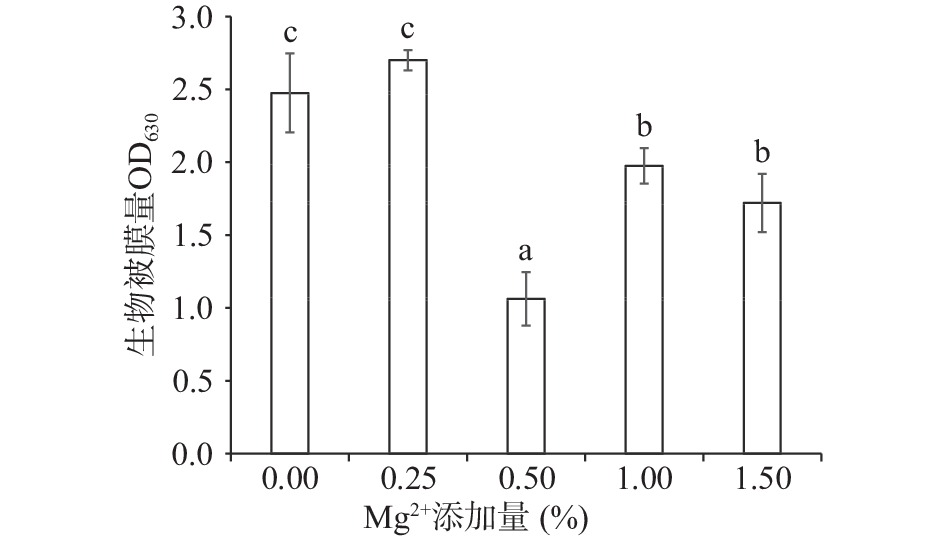
2.6 Mg2+ 对生物被膜形成的影响
低浓度的Mg2+对部分细菌的生物被膜形成有促进作用[29],Mg2+对细菌生物被膜的结构也有影响。对于隆德假单胞菌,不添加Mg2+与Mg2+添加量为0.25%试验组对比,其生物被膜形成量无显著差异(P>0.05),如图7所示。这表明在此浓度区间内,Mg2+的添加量对隆德假单胞菌生物被膜的生长无显著影响。当Mg2+的添加量超过0.50%后,生物被膜量显著降低(P<0.05),且Mg2+浓度为0.50%时,隆德假单胞菌生物被膜形成量最少,与其他各组均有显著差异(P<0.05)。这表明,在测试范围内,低浓度的Mg2+对隆德假单胞菌生物被膜的形成有促进,高浓度的Mg2+对隆德假单胞菌生物被膜的形成有一定抑制作用;高于本研究中的Mg2+对该菌生物被膜形成的影响趋势仍需要进一步研究。对于部分细菌,高浓度的Mg2+胁迫可能通过抑制pilV和pilW基因表达,减少IV型菌毛形成,进而减弱细菌的附着能力和运动能力,使细菌生物膜变得更薄、更松散,最终减少了生物膜的形成[30]。对于流动的物料体系,在流体动力学模拟下,低浓度的Mg2+有利于铜绿假单胞菌(Pse. aeruginosa)形成生物被膜,增加其在流动工程系统下游的定植;而高Mg2+浓度可能会使铜绿假单胞菌的生物膜转向粘塑性机械状态,这导致对临界剪切应力的特征响应,生物膜变脆例而容易撕裂或脱落[31]。
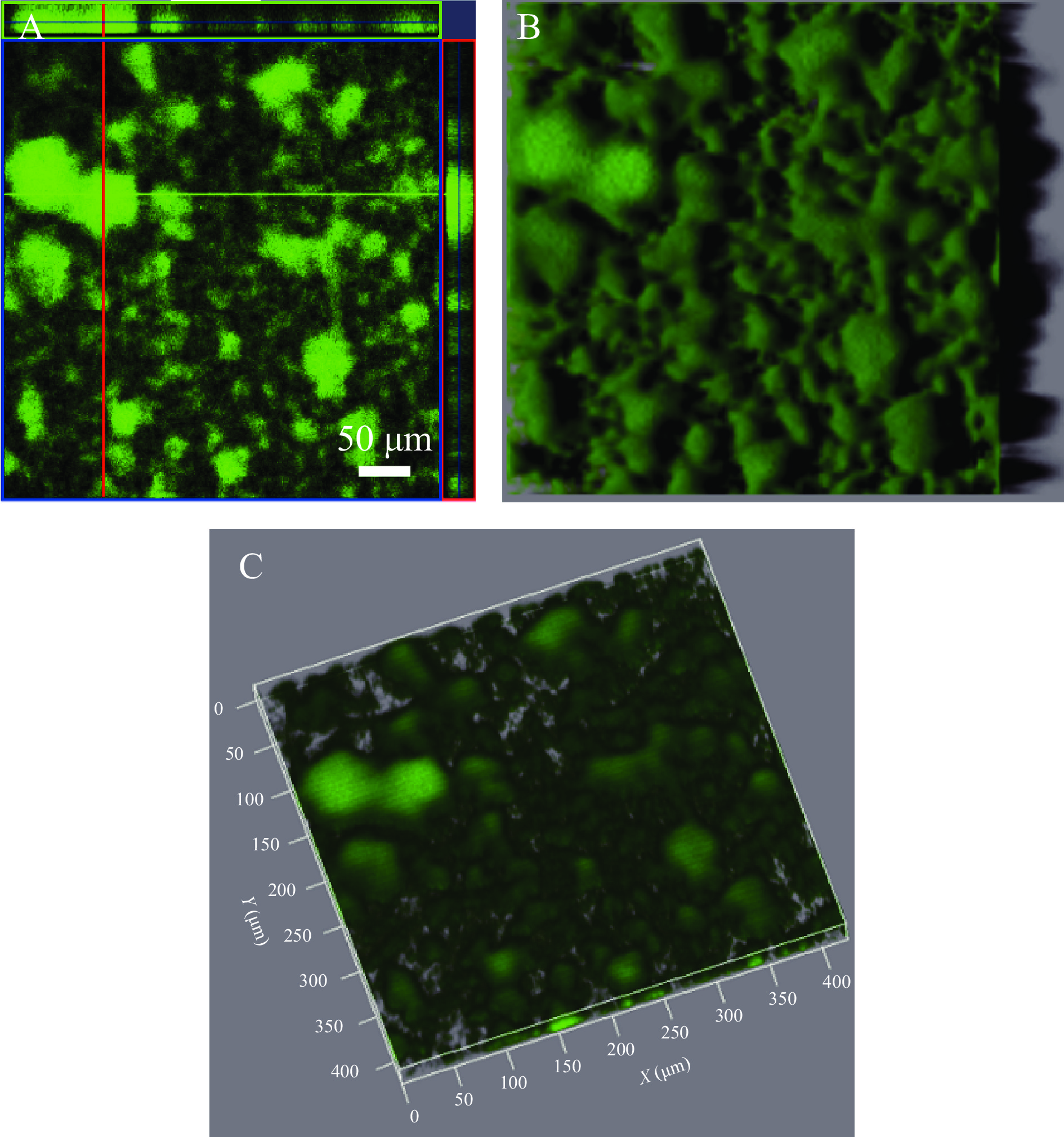
2.7 隆德假单胞菌在不锈钢表面的黏附
部分细菌在不锈钢食品加工设备表面能够形成生物被膜,被膜菌则会对食品造成持续的污染。实验观察了隆德假单胞菌在不锈钢表面的黏附情况。通过激光共聚焦显微镜的观察研究发现,该菌在304不锈钢表面能够形成较致密的生物被膜(如图8A),其在不锈钢表面形成的生物被膜能够较致密地黏附在不锈钢接触面,其生物被膜厚度达到50 µm以上,且具有一定的蘑菇样立体结构(图8B和图8C),符合典型的细菌生物被膜结构特征。有研究指出荧光假单胞菌(Pseudomonas fluorescens)在不锈钢表面能够快速黏附并形成生物被膜[32]。该菌在不锈钢表面形成生物被膜的能力与荧光假单胞菌类似。这表明隆德假单胞菌具有在食品加工的金属设备表面形成生物被膜并造成污染的潜力。
3. 结论
本文研究了不同环境条件对隆德假单胞菌生物被膜形成能力的影响。隆德假单胞菌能够在较低的接种密度下形成生物被膜,其生物被膜形成能力受营养条件、葡萄糖浓度、pH、NaCl浓度、Mg2+等环境因子的影响。该菌在pH为8.0的弱碱性的条件下形成生物被膜量最多。1.25%以上的葡萄糖浓度、4%以上的NaCl浓度和0.5%的Mg2+浓度能够显著抑制隆德假单胞菌生物被膜的形成(P<0.05),同时,该菌在一定浓度下具有在不锈钢表面形成典型生物被膜的能力。本研究结果为调节食品加工环境,防控隆德假单胞菌生物被膜形成提供了理论支持。
-
-
[1] BAI X, NAKATSU C H, BHUNIA A K. Bacterial biofilms and their implications in pathogenesis and food safety[J]. Foods,2021,10(9):2117. doi: 10.3390/foods10092117
[2] FERRIOL-GONZÁLEZ C, DOMINGO-CALAP P. Phages for biofilm removal[J]. Antibiotics,2020,9(5):268−283. doi: 10.3390/antibiotics9050268
[3] ALLAWI M, OPITZ M, LIELEG O. Modulation of the mechanical properties of bacterial biofilms in response to environmental challenges[J]. Biomater Science,2017,5(5):887−900. doi: 10.1039/C6BM00832A
[4] GIAOURIS E, SIMÕES M, DUBOIS-BRISSONNET F. The role of biofilms in the development and dissemination of microbial resistance within the food industry[J]. Foods,2020,9(6):816−821. doi: 10.3390/foods9060816
[5] CARRASCOSA C, RAHEEM D, RAMOS F, et al. Microbial biofilms in the food industry—a comprehensive review[J]. International Journal of Environmental Research and Public Health,2021,18(4):2014−2045. doi: 10.3390/ijerph18042014
[6] TYK A, YM A, SONG L. Biofilm dispersal induced by mechanical cutting leads to heightened foodborne pathogen dissemination[J]. Food Microbiology,2021,102:103914.
[7] KOLBECK S, ABELE M, HILGARTH M, et al. Comparative proteomics reveals the anaerobic lifestyle of meat-spoiling Pseudomonas species[J]. Frontiers in Microbiology,2021,12(4):695−709.
[8] NYCHAS G J, SKANDAMIS P N, TASSOU C C, et al. Meat spoilage during distribution[J]. Meat Science,2008,78(1−2):77−89. doi: 10.1016/j.meatsci.2007.06.020
[9] MAIER C, HOFMANN K, HUPTAS C, et al. Simultaneous quantification of the most common and proteolytic Pseudomonas species in raw milk by multiplex qPCR[J]. Applied Microbiology and Biotechnology,2021,105(4):1693−1708. doi: 10.1007/s00253-021-11109-0
[10] DE JONGHE V, COOREVITS A, VAN HOORDE K, et al. Influence of storage conditions on the growth ofPseudomonas species in refrigerated raw milk[J]. Applied and Environmental Microbiology,2011,77(2):460−470. doi: 10.1128/AEM.00521-10
[11] DUMAN M, MULET M, ALTUN S, et al. The diversity of Pseudomonas species isolated from fish farms in Turkey[J]. Aquaculture,2021,535(3):736369.
[12] OLADOSU-AJAYI R N, GEORGE F O A, OBASA S O, et al. Effects of some plant extracts on some biological parameters of catfish Clarias gariepinus (burchell, 1822)[J]. Journal of Fisheries and Aquatic Science,2012,8(1):142−147. doi: 10.3923/jfas.2013.142.147
[13] LIU Y J, XIE J, ZHAO L J, et al. Biofilm formation characteristics of Pseudomonas lundensis isolated from meat[J]. Journal of Food Science,2015,80(12):2904−2910. doi: 10.1111/1750-3841.13142
[14] WICKRAMASINGHE N N, RAVENSDALE J T, et al. In situ characterisation of biofilms formed by psychrotrophic meat spoilage pseudomonads[J]. Biofouling,2019,35(8):1−16.
[15] WICKRAMASINGHE N N, HLAING M M, RAVENSDALE J T, et al. Characterization of the biofilm matrix composition of psychrotrophic, meat spoilage pseudomonads[J]. Scientific Reports,2020,10(1):16457. doi: 10.1038/s41598-020-73612-0
[16] 顾春涛, 王雅莹, 朱军莉, 等. 顺反式肉桂醛对肉源隆德假单胞菌生物被膜和致腐性的抑制作用[J]. 微生物学报,2020,60(1):26−35. [GU Chuntao, WANG Yaying, ZHU Junli, et al. Inhibitory activity of trans-cinnamaldehyde and cinnamaldehyde on biofilm formation and spoilage of Pseudomonas lundensis[J]. Acta Microbiologica Sinica,2020,60(1):26−35. doi: 10.13343/j.cnki.wsxb.20180541 [17] TANG Z, CHEN H, ZHANG M, et al. Antibacterial mechanism of 3-carene against the meat spoilage bacterium Pseudomonas lundensis and its application in pork during refrigerated storage[J]. Foods,2021,11(1):92−109. doi: 10.3390/foods11010092
[18] PICKERING B S, SMITH D R, WATNICK P I. Glucose-specific enzyme IIA has unique binding partners in the Vibrio cholerae biofilm[J]. MBio,2012,3(6):e00228−12.
[19] STEPANOVIC S, VUKOVIC D, DAKIC I, et al. A modified microtiter-plate test for quantification of staphylococcal biofilm formation[J]. Journal of Microbiological Methods,2000,40(2):175−179. doi: 10.1016/S0167-7012(00)00122-6
[20] QUILES F, POLYAKOV P, HUMBERT F, et al. Production of extracellular glycogen by Pseudomonas fluorescens: Spectroscopic evidence and conformational analysis by biomolecular recognition[J]. Biomacromolecules,2012,13(7):2118−2127. doi: 10.1021/bm300497c
[21] SCRIBNER M R, STEPHENS A C, HUONG J L, et al. The nutritional environment is sufficient to select coexisting biofilm and quorum sensing mutants of Pseudomonas aeruginosa[J]. Journal of Bacteriology,2022,204(3):e0044421. doi: 10.1128/jb.00444-21
[22] DÍAZ-SALAZAR C, CALERO P, ESPINOSA-PORTERO R, et al. The stringent response promotes biofilm dispersal in Pseudomonas putida[J]. Scientific Reports,2017,7(1):18055−18068. doi: 10.1038/s41598-017-18518-0
[23] CHIRATHANAMETTU T R, PAWAR P D. Quorum sensing-induced phenotypic switching as a regulatory nutritional stress response in a competitive two-species biofilm: An individual-based cellular automata model[J]. Journal of Biosciences,2020,45:122. doi: 10.1007/s12038-020-00092-9
[24] YIN W, WANG Y, LIU L, et al. Biofilms: The microbial “protective clothing” in extreme environments[J]. International Journal of Molecular Sciences,2019,20(14):3423. doi: 10.3390/ijms20143423
[25] BLANCO Y, RIVAS L A, GONZALEZ TORIL E, et al. Environmental parameters, and not phylogeny, determine the composition of extracellular polymeric substances in microbial mats from extreme environments[J]. Sci Total Environ,2019,650:384−393. doi: 10.1016/j.scitotenv.2018.08.440
[26] 张悦, 贺银凤, 顾悦, 等. 高产生物膜乳酸菌抗逆性及其抗氧化特性[J]. 农业工程学报,2021,37(6):282−288. [ZHANG Yue, HE Yinfeng, GU Yue, et al. Stress resistance and antioxidant properties of lactic acid bacteria with high biofilm production[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE),2021,37(6):282−288. doi: 10.11975/j.issn.1002-6819.2021.06.034 [27] SCHULTZE LB, MALDONADO A, LUSSI A, et al. The impact of the pH value on biofilm formation[J]. Monographs in Oral Science,2021,29:19−29.
[28] ÇAM S, BRINKMEYER R. The effects of temperature, pH, and iron on biofilm formation by clinical versus environmental strains of Vibrio vulnificus[J]. Folia Microbiol (Praha),2020,65(3):557−566. doi: 10.1007/s12223-019-00761-9
[29] 张秀平, 郭占达, 陈陆, 等. 不同培养条件对鸭源鸡杆菌生物被膜形成的影响[J]. 中国兽医学报,2014,34(7):1083−1088, 1168. [ZHANG Xiuping, GUO Zhanda, CHEN Lu, et al. Influence of different culture conditions on the formation of Gallibacterium anatis biofilm[J]. Chinese Journal of Veterinary Science,2014,34(7):1083−1088, 1168. doi: 10.16303/j.cnki.1005-4545.2014.07.009 [30] TANG D, GAO Q, ZHAO Y, et al. Mg2+ reduces biofilm quantity in Acidithiobacillus ferrooxidans through inhibiting Type IV pili formation[J]. FEMS Microbiology Letters,2018,365(4):266.
[31] JESSE GREENER, WILLIAM Y HARVEY, CYNTHIA GAGNÉ-THIVIERGE, et al. Critical shear stresses of Pseudomonas aeruginosa biofilms from dental unit waterlines studied using microfluidics and additional magnesium ions[J]. Physics of Fluids,2022,34(2):021902. doi: 10.1063/5.0076737
[32] WANG Huhu, CAI Linlin, LI Yunhan, et al. Biofilm formation by meat-borne Pseudomonas fluorescens on stainless steel and its resistance to disinfectants[J]. Food Control,2018,91(9):397−403.
-
期刊类型引用(6)
1. 杨悦,刘梦圆,肖文军. 表没食子儿茶素没食子酸酯与L-茶氨酸对乙醇脱氢酶和乙醛脱氢酶活性的体外协同作用. 食品安全质量检测学报. 2024(04): 260-265 .  百度学术
百度学术
2. 丁树洽,谢昕雅,刘助生,廖贤军,刘仲华,蔡淑娴. 茶叶成分EGCG与L-theanine联合应用的神经保护作用研究. 茶叶科学. 2024(05): 779-792 .  百度学术
百度学术
3. 韦柳花,赖兆荣,邓慧群,罗小梅,邱勇娟,诸葛天秋,黄金丽. 茶树良种紫鹃不同茶类适制性研究. 农业与技术. 2023(12): 4-6 .  百度学术
百度学术
4. 薛璐,邢宇航,段志豪,陈绵鸿,周伟,李如一,李积华. 表没食子儿茶素没食子酸酯与燕麦β-葡聚糖复合物的形成及表征. 食品工业科技. 2022(08): 124-132 .  本站查看
本站查看
5. 吴颖,曲爱丽,纪荣全,王程安. 高花青素柏塘紫芽茶适制性的研究. 食品安全质量检测学报. 2022(12): 3875-3883 .  百度学术
百度学术
6. 程倩,冯雪萍,陈昭,李春阳,张雪,张海波. 高效液相色谱法测定复合果汁饮品中茶氨酸的含量. 食品安全导刊. 2022(24): 87-91 .  百度学术
百度学术
其他类型引用(4)





 下载:
下载:


 下载:
下载:



