Colorimetric Detection of Sudan Based on the Aptamer and Cationic Compound Induced Gold Nanoparticles Aggregation
-
摘要: 本研究以苏丹红Ⅲ适配体为识别元件,以未修饰的纳米金传感信号,以聚二烯丙基二甲基氯化铵(PDDA)作为纳米金聚集的诱导剂,构建了一种简单、经济、快速的苏丹红比色检测方法。在优化条件下评估本方法的检测灵敏度、准确性和特异性,最后应用于食品中苏丹红快速检测,并将检测结果与国标法(GB/T 19681-2005)对比验证。结果显示,在PDDA浓度20 nmol/L、适配体浓度5 nmol/L、反应时间4 min等优化条件下,纳米金吸光度比值(A650nm/A530nm)与苏丹红III浓度呈良好线性关系(R=0.986),线性检测范围为3.13~50 ng/mL,可视化检测限为3.13 ng/mL,检测时间约为5 min。特异性分析显示,本方法对苏丹红I、II、III和IV有高的特异性,与柠檬黄、日落黄、分散橙11等无交叉反应。将本方法应用于食品中苏丹红检测,加标回收率为85.4%~102.5%,相对标准偏差为3.37%~6.75%。本方法具有操作简便、快速、结果易读等优点,适用于批量样品中苏丹红的现场快速检测。Abstract: In this study, a simple, economical and rapid colorimetric assay was developed for the detection of Sudan, in which Sudan-binding aptamer was used as recognition element, unmodified gold nanoparticles (AuNPs) as sensing signal, and poly(diallyldimethylammonium chloride) (PDDA) as inducer for gold nanoparticle aggregation. The sensitivity, accuracy and specificity of developed method were evaluated under optimized condition. Finally, the colorimetric sensor was applied to detection Sudan in food samples, and the results were compared with GB standard method (GB/T 19681-2005). The best procedure for Sudan analysis in our system was: The concentration of aptamer at 5 nmol/L, the concentration of PDDA at 20 nmol/L, and the reaction time was 4 min. The correlation between concentration of Sudan III and absorbance ratio of gold nanoparticles (A650nm/A530nm) was observed to be linear within the range of 3.13 to 50 ng/mL. The limit of visual detection was 3.13 ng/mL by naked-eye observation. The detection time was 5 min. The colorimetric sensor had high specificity for Sudan I, II, III and IV, and no cross-reactivity towards sunset yellow, tartrazine, and 1-amino-2-methylanthraquinone. Further, the colorimetric sensor was applied to measure Sudan Ⅲ in spiked real samples, and the recoveries were in the range of 85.4%~102.5%, with relative standard deviations of 3.37%~6.75%. Our study provides a simple, fast, and easy to read method for Sudan analysis, which can be applied in future on-site detection in food samples.
-
Keywords:
- Sudan dyes /
- aptamer /
- gold nanoparticles /
- colorimetric assay
-
苏丹红(Sudan dyes)是一种人工合成的亲脂类偶氮染料,主要包括苏丹红Ⅰ、Ⅱ、Ⅲ、Ⅳ四种类型,常被应用于溶剂、油、蜡和汽油的增色以及鞋、地板的增光。苏丹红被国际癌症研究机构(International Agency for ResearchonCancer,IARC)列为三类致癌物,其中苏丹红Ⅲ的初级代谢产物4-氨基偶氮苯(4-aminoazobenzene)被列为二类致癌物[1]。我国及欧盟等规定苏丹红作为违法添加非食用物质严禁在食品中使用,但由于其增色效应显著,常被作为非法添加剂用于改良番茄、辣椒等产品外观,对人体健康造成严重危害。除了人为添加,一些农产品和食品在生产过程中也存在苏丹红污染风险,主要是由于生产环境污染,以及肥料、农药、塑料包装等物资的不规范使用等因素,导致生产原料和产品中苏丹红污染残留[2]。因此,准确、灵敏、快速的苏丹红检测方法对保障食品安全具有重要意义。
目前,苏丹红常用检测方法主要包括色谱法[3]和液质联用技术[4]。仪器分析技术虽然结果准确可靠,但操作步骤繁琐、设备昂贵、且需要专业的操作人员,不适合在中小食品加工企业以及基层检测部门推广应用。与仪器分析方法比较,基于抗原-抗体识别的免疫分析方法具有特异性强、操作简单、快速等优点,是目前应用较广泛的食品安全快速检测方法[5],但存在抗体制备周期长,成本高等不足。
适配体(Aptamer)作为抗体技术的补充在分析领域成为人们研究的焦点[6-7]。基于随机文库的庞大库容和单链核苷酸空间结构的多样性,适配体几乎可以与所有种类的靶标发生结合[8-10]。与传统的抗体相比,适配体不受免疫原限制,具有应用范围广、可人工合成、成本低廉、易于标记和保存等优点[11-12]。因此,适配体在食品分析领域得到广泛应用[13-15]。针对苏丹红,Wang等[16]以苏丹红III为靶标,经过12轮体外筛选,获得1条高亲和力的适配体,解离常数(Kd值)达到22.37 nmol/L。但尚未见到适配体应用于食品中苏丹红检测的研究报道。
目前,大部分基于适配体识别的生物传感检测技术,需要对适配体进行修饰标记,操作步骤较为复杂,有的则需要专业仪器,限制了其在食品分析中进一步应用[11-15]。纳米金(Goldnanoparticles, AuNPs)具有制备简单、便于吸附生物分子等优点,同时它还具有强烈的粒子间距光学效应,其在分散状态下呈红色,发生凝聚后变为蓝色。为此,本研究以苏丹红Ⅲ适配体为识别元件,以阳离子化合物诱导纳米金聚集作为传感信号,构建了一种简单、快速、低成本的苏丹红比色检测方法,为食品中苏丹红的快速检测提供新的技术支撑。
1. 材料与方法
1.1 材料与仪器
苏丹红Ⅰ(842-07-9)、苏丹红Ⅱ(3118-97-6)、苏丹红Ⅲ(85-86-9)、苏丹红Ⅳ(85-83-6)标准物质 纯度≥96%,上海安谱实验科技股份有限公司;日落黄(2783-94-0)、分散橙11(82-28-0)、柠檬黄(1934-21-0) 标准品,北京中科质检生物技术有限公司;氯金酸(HACl4·3H2O) Sigma公司;柠檬酸三钠、聚二烯丙基二甲基氯化铵(Poly(diallyldimethylammonium),PDDA) 上海麦克林试剂有限公司;96-well酶标板 生物工程(上海)股份有限公司;乙腈、正己烷等其余常规试剂 国药集团化学试剂有限公司;实验用水为超纯水;辣椒酱(7个样品)、辣椒粉(7个样品)、番茄酱(6个样品)等食品 本地超市。
苏丹红Ⅲ适配体[16]由生物工程(上海)股份有限公司合成,适配体序列如下:5’-TGC TAG ACG ATA TTC GTC CAT CCG GCG GCA TCC GAC GCT GTG ACC GGG GCT AGA CCC TTG CCC GCT GTC AGA CTG AAT ATG TCA-3’。
FEI Tecnai G2 F20场发射透射电子显微镜 美国FEI公司;UV-2800紫外可见分光光度计 尤尼柯(上海)仪器有限公司;5424R台式冷冻离心机 德国艾本德公司;MS3 basic涡旋混合器 德国IKA公司;QB-8002 96孔微孔板混匀仪 海门市其林贝尔仪器制造有限公司;Milli-Q Reference超纯水系统 美国Millipore公司;N-WVAP 112水浴氮吹仪 美国Organomation公司;VS22-600B超声波清洗仪 无锡沃信仪器有限公司。
1.2 实验方法
1.2.1 纳米金的制备与表征
根据本团队前期报道的方法制备胶体金溶液[17],将100 mL 0.01%氯金酸溶液置于磁力加热搅拌器上煮沸2 min,加入2 mL 1%柠檬酸三钠水溶液,继续加热直到溶液变成透亮的酒红色,持续加热10 min后,冷却至室温,4 ℃保存6个月。将制备的胶体金溶液在400~800 nm波长范围进行扫描。同时采用透射电镜表征纳米金颗粒的形貌及粒径。
1.2.2 基于适配体识别-阳离子化合物诱导纳米金聚集比色检测苏丹红
取200 μL纳米金溶液加入96孔酶标板中,加入2 μL适配体(0.5 μmol/L)溶液和待测样品苏丹红标准物质溶液,室温反应4 min,然后加入8 μL PDDA(0.5 μmol/L)溶液,观察颜色变化,并采用紫外-可见分光光度计在400~800 nm波长范围进行扫描,记录溶液在530和650 nm处的吸光值,A530 nm和A650 nm分别代表游离和聚集的纳米金吸光值。以苏丹红标准物质浓度作为横坐标,A650 nm/A530 nm的比值为纵坐标制定标准曲线,求线性方程。将待测样品测定的吸光值代入线性方程,以计算样品中苏丹红的含量。
1.2.3 检测性能评价
灵敏度和线性范围:在优化条对下,用乙腈将苏丹红III标准溶液稀释系列梯度浓度(0、1.56、3.13、6.25、12.5、25、50 ng/mL),采用1.2.2方法进行检测,观察溶液颜色变化,并记录溶液在530和650 nm处吸光值,以A650 nm/A530 nm的比值为纵坐标,苏丹红III浓度作为横坐标,求线性方程和相关系数,基于3σ/S(σ为空白样品检测10次的平均标准偏差,S为斜率)计算方法检测限(LOD)。实验重复3次。
特异性分析:采用1.2.2方法检测同等浓度(50 ng/mL)的苏丹红Ⅰ~Ⅳ、柠檬黄、日落黄和分散橙11,观察溶液颜色变化,并用紫外-可见吸收光谱进行表征。设置不添加苏丹红为空白对照组。每个实验3个重复。
加标回收率:样品进行前处理参考国标方法GB 19681-2005[18]稍作修改。称取辣椒酱、辣椒粉、番茄酱等样品2 g(精确到0.001 g),分别添加低、中、高三种浓度水平的苏丹红III,使其终浓度分别为10、50、100 ng/g,加入10 mL正己烷,样品振荡混匀,超声提取10 min,在5000 r/min条件下离心5 min,移取正己烷层,残渣用正己烷重复提取1次,合并上清液,氮吹仪浓缩,用乙腈定容至0.5 mL,采用1.2.2进行检测,根据标准曲线计算样品中苏丹红浓度、加标回收率和其相对标准偏差(RSD)。每个添加水平设置3个重复。
1.2.4 方法的应用
称取辣椒酱、辣椒粉、番茄酱等样品2 g(精确到0.001 g),加入10 mL正己烷,样品振荡混匀,置于超声波清洗仪中,在超声温度40 ℃、功率600 W条件下提取10 min,在5000 r/min条件下离心5 min,移取正己烷层,残渣用正己烷重复提取1次,合并上清液,氮吹仪浓缩,用乙腈定容至0.5 mL,采用1.2.2进行检测,根据标准曲线计算样品中苏丹红浓度。同时采用国标法(GB 19681-2005)对样品进行检测,并对检测结果进行比较。
1.3 数据处理
实验数据用平均值±标准偏差表示,使用Origin 7.5软件制图。
2. 结果与分析
2.1 纳米金制备与表征
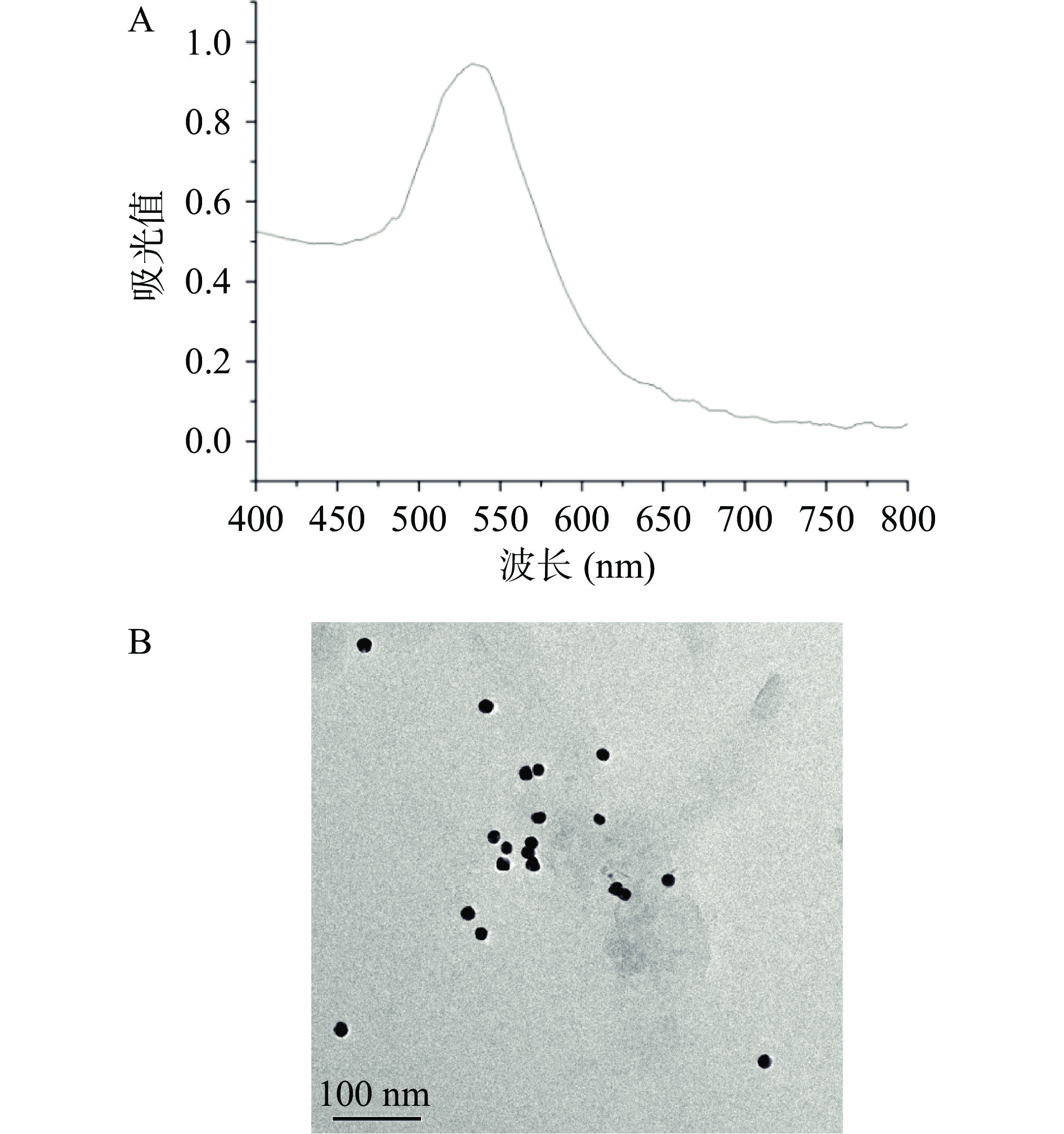
采用紫外-可见分光光度计和透射电子显微镜对制备的纳米金进行表征。紫外-可见分光光谱分析结果如图1A所示,胶体金溶液在530 nm处出现特征吸收峰。透射电镜表征结果(图1B)显示,纳米金颗粒形貌为球型,分散性良好,粒径均一。
2.2 基于适配体-PDDA诱导纳米金聚集比色检测苏丹红原理及可行性分析
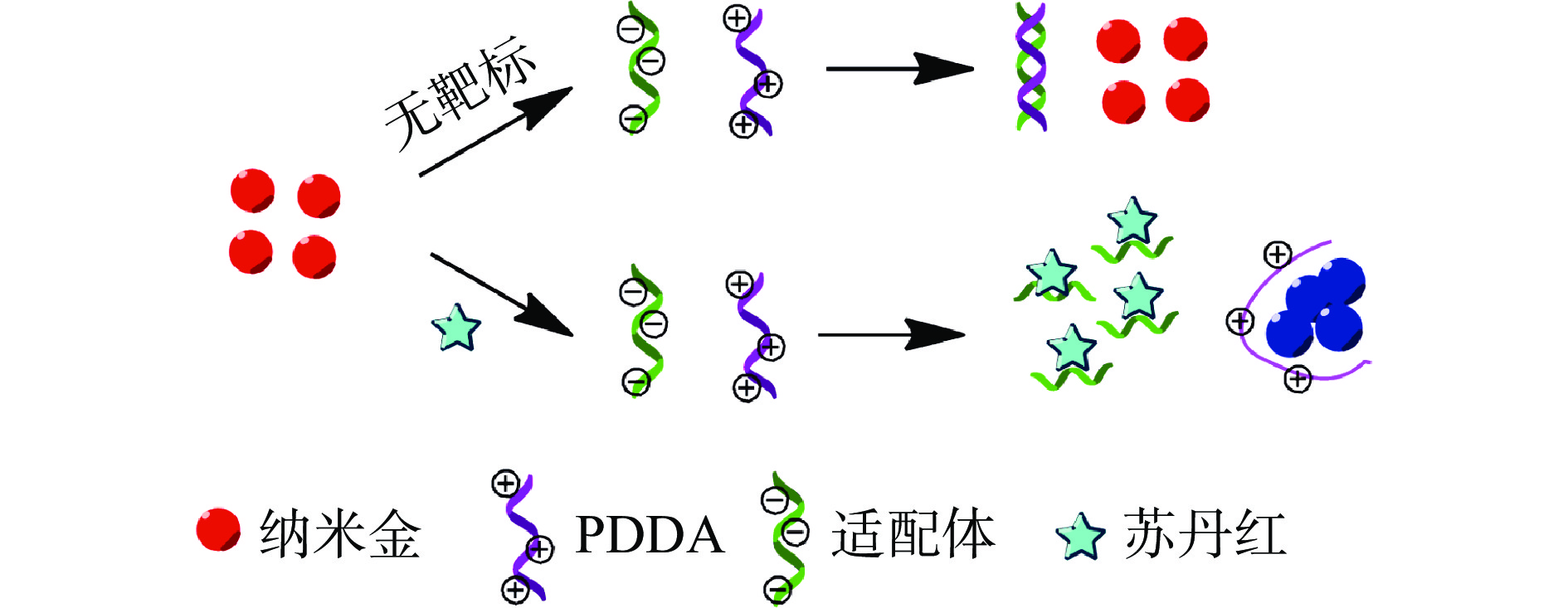
有研究表明,一些聚合物在一定条件下可介导纳米金自组装[19]。依据这一现象,本研究建立了基于PDDA诱导的纳米比色检测苏丹红方法,检测原理如图2所示。含有高密度正电荷的PDDA,可打破纳米金颗粒电荷平衡使其聚集变色,当加入适配体后,PDDA通过静电作用与适配体结合,形成类似双螺旋的“Duplex”结构,进而抑制PDDA诱导纳米金发生凝聚;当检测体系中含有苏丹红时,靶标与适配体特异性结合,游离的PDDA则诱导纳米金凝聚变色。随着靶标浓度的增加,纳米金团聚变色的程度也随之增大。
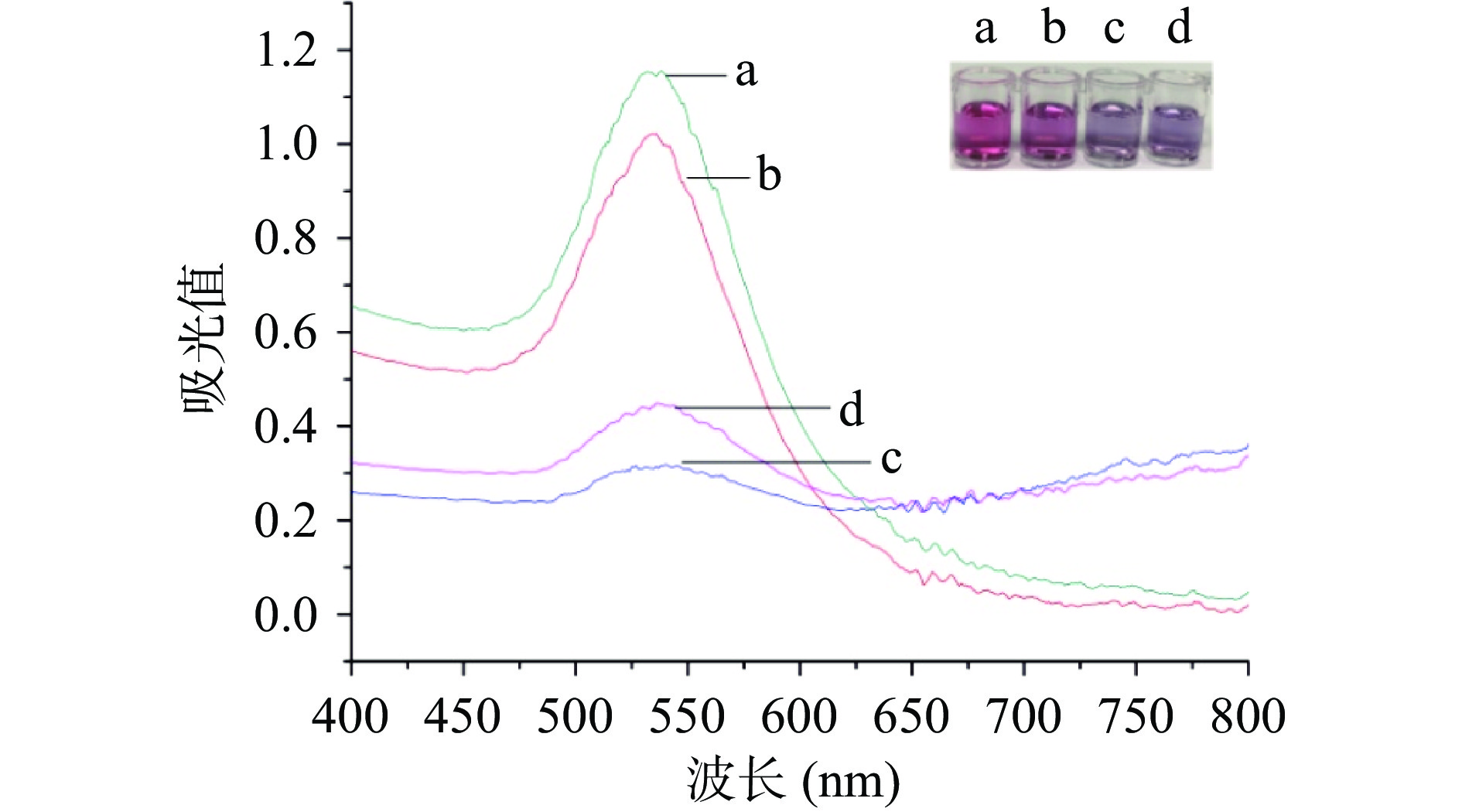
为了验证本方法检测原理的可行性,采用紫外-可见分光光度计分别测定了纳米金加入PDDA、适配体和苏丹红后的紫外光谱,如图3所示。对比曲线和反应溶液a、c可知,PDDA可诱导AuNPs发生聚集,530 nm处吸光值明显降低,溶液变蓝色。当加入适配体后(b),纳米金在溶液中重新呈现分散状态,呈红色,530 nm处吸光值与曲线a接近,证明正电聚合物PDDA与适配体发生结合。而检测体系中同时含有适配体、苏丹红和PDDA时(d),纳米金聚集变色,530 nm处吸光值再次降低。表明适配体特异性结合了苏丹红,游离的PDDA诱导纳米金聚集。
2.3 检测条件优化
2.3.1 PDDA浓度
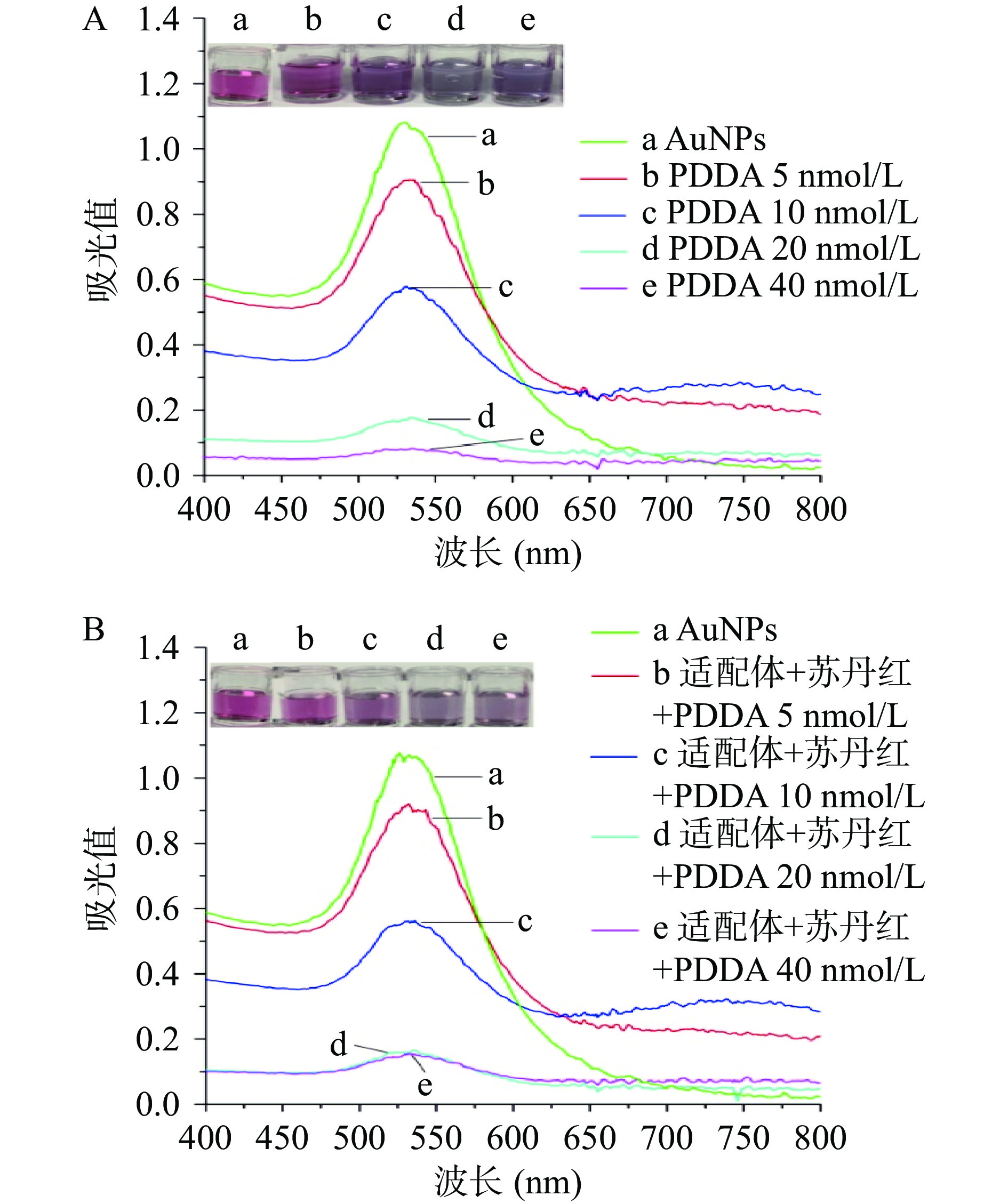
在检测体系中,PDDA是致使AuPNs聚集的关键化合物,因此,PDDA浓度是影响传感体系的关键因素。浓度过高会降低传感体系的灵敏度,浓度太低无法使AuPNs完全聚集。本文首先测定了纳米金在无适配体时的PDDA耐受性,将PDDA加入纳米金溶液,使其终浓度分别为5、10、20、40 nmol/L。结果如图4A所示,随着PDDA浓度的升高,胶体金溶液在530 nm处吸光值逐渐下降,当浓度增加至20 nmol/L时,纳米金完全沉淀聚集,颜色变蓝。当胶体金溶液中含有适配体时(终浓度5 nmol/L),引发纳米金完全沉聚变色的PDDA浓度也是>20 nmol/L,(图4B)。故后续实验选择PDDA浓度为20 nmol/L。
2.3.2 适配体浓度
适配体浓度对检测灵敏度至关重要。本实验固定苏丹红Ⅲ浓度为200 ng/mL,分别向纳米金溶液中加入不同浓度的适配体(0、5、10、20、40、80、160 nmol/L),室温孵育5 min后加入PDDA溶液(终浓度20 nmol/L),观察适配体浓度对检测性能的影响,选择纳米金聚集变蓝的适配体浓度即为最佳适配体用量。结果显示(图5),当适配体终浓度为5 nmol/L时,胶体金溶液聚集变蓝,随着适配体浓度增加,纳米金溶液逐渐呈红色,530 nm处吸光度上升。结果表明,适配体浓度过饱和时,与苏丹红特异性结合后,剩余的适配体与PDDA结合,使纳米金在溶液中呈现分散状态。因此,适配体浓度选择5 nmol/L。
2.3.3 反应时间
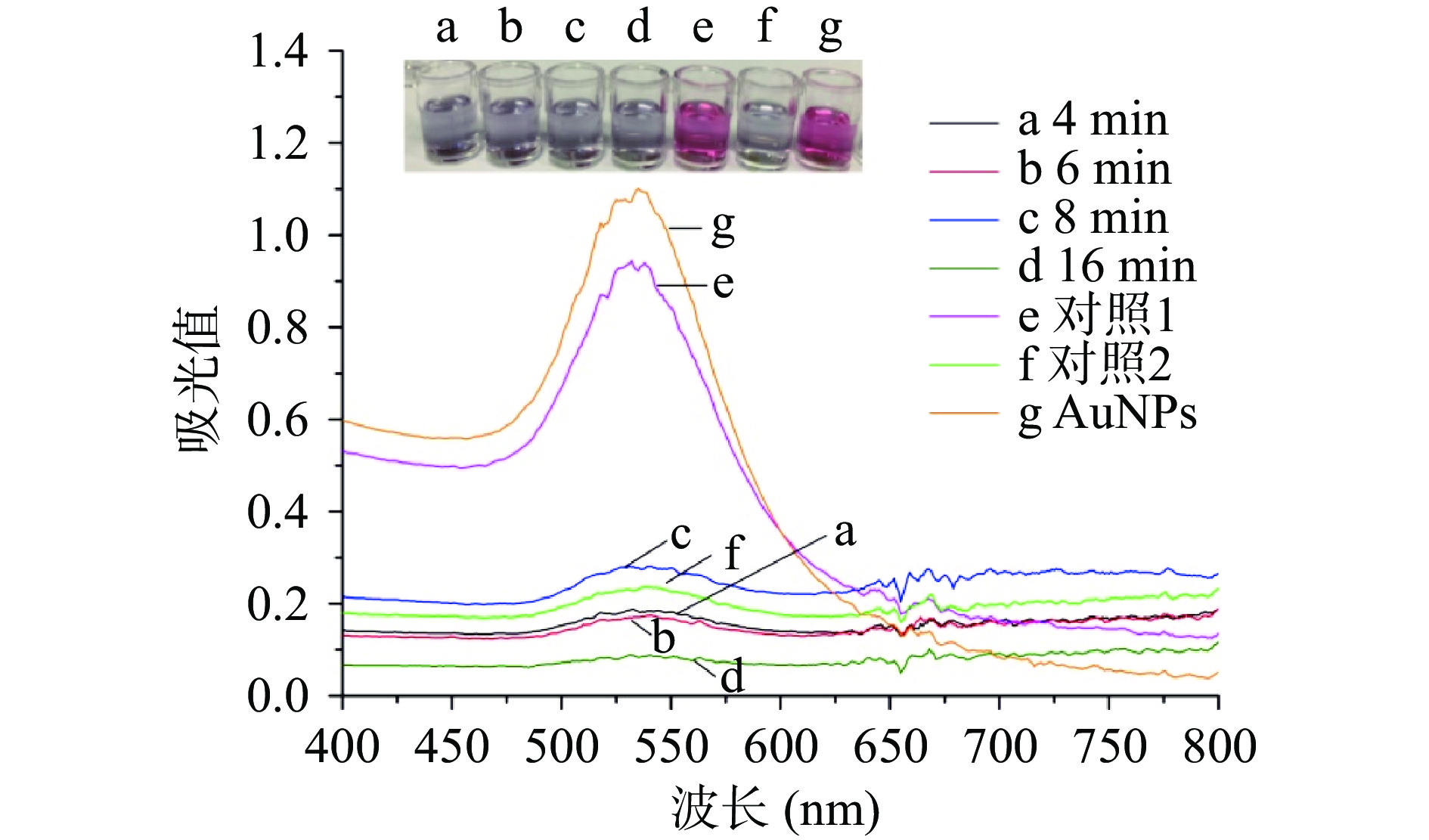
固定适配体浓度为5 nmol/L、PDDA浓度为20 nmol/L、苏丹红Ⅲ浓度为200 ng/mL,观察适配体与苏丹红Ⅲ作用时间(4、6、8、16 min)对检测性能的影响。从结果(图6)中可以看出,靶标与适配体反应4 min即可充分结合,在加入PDDA后,纳米金颗粒无适配体保护而沉聚变色。故靶标与适配体反应时间为4 min。
![]() 图 6 苏丹红与适配体反应时间优化注:对照组1:AuNPs+适配体5 nmol/L+PDDA 20 nmol/L;对照组2:AuNPs+PDDA 20 nmol/L;图8同。Figure 6. The optimization of reaction time between Sudan dyes and aptamer
图 6 苏丹红与适配体反应时间优化注:对照组1:AuNPs+适配体5 nmol/L+PDDA 20 nmol/L;对照组2:AuNPs+PDDA 20 nmol/L;图8同。Figure 6. The optimization of reaction time between Sudan dyes and aptamer2.4 检测性能评价
2.4.1 检测限、线性范围
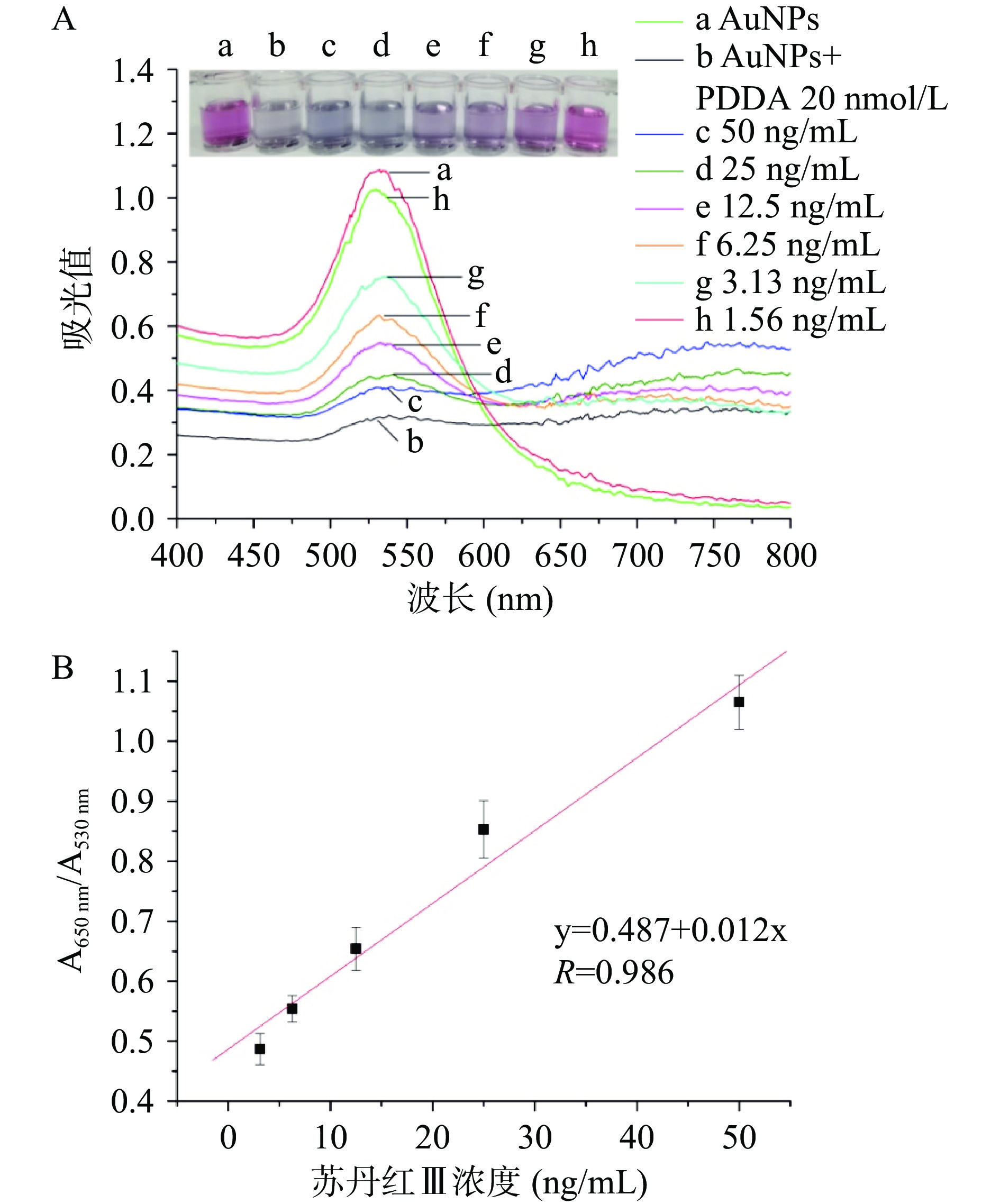
在优化条件下,采用本方法测定不同浓度(0、1.56、3.13、6.25、12.5、25、50 ng/mL)的苏丹红III标准溶液,观察纳米金溶液颜色变化,并测其吸光值。结果如图7A所示,随着苏丹红III浓度的增加,纳米金颜色由红变蓝,当浓度≥3.13 ng/mL时,肉眼可见纳米金有明显颜色变化,故该方法比色检测限为3.13 ng/mL。采用紫外可见光谱进行分析,结果显示当苏丹红浓度为1.56 ng/mL时,其反应溶液在530 nm处吸光度与对照组纳米金溶液没有明显变化,随着浓度的进一步增加,530 nm处吸光度明显下降。从标准曲线中可知(图7B),苏丹红Ⅲ在3.13~50 ng/mL浓度范围内与A650 nm/A530 nm比值呈良好线性关系(R=0.986),基于3σ/S计算方法检测限为2.15 ng/mL。与国标方法和文献报道的方法相比(表1),本方法具有样品前处理简单、检测步骤少、检测时间短(5 min)、成本低等优势。
表 1 苏丹红检测方法比较Table 1. Comparison of methods reported for detection of Sudan dyes分析方法 分析物 识别元件 检测限 线性范围 检测时间 参考文献 HPLC Sudan I~IV - 0.33~2.27 μg/g 0.5~5.0 μg/mL - [3] HPLC SudanI~IV - 10 ng/g - - [18] MIP-HPLC Sudan I~IV MIP 5~9 ng/g 31~4000 ng/g - [20] HPL-MS/MS Sudan I~IV - 0.2~1.0 ng/g 1~100 ng/mL - [21] GC-MS/MS Sudan III - 2~10 ng/g 0.1~4.0 μg/mL - [22] ELISA Sudan III 抗体 0.1~0.8 ng/mL - 105 min [23] 电化学传感器 SudanI - 0.093 μmol/L 0.3~700 μmol/L - [24] 比色 SudanIII 适配体 2.15 ng/mL 3.1~50 ng/mL 5 min 本方法 注:-代表文献未涉及该部分内容。 2.4.2 特异性分析
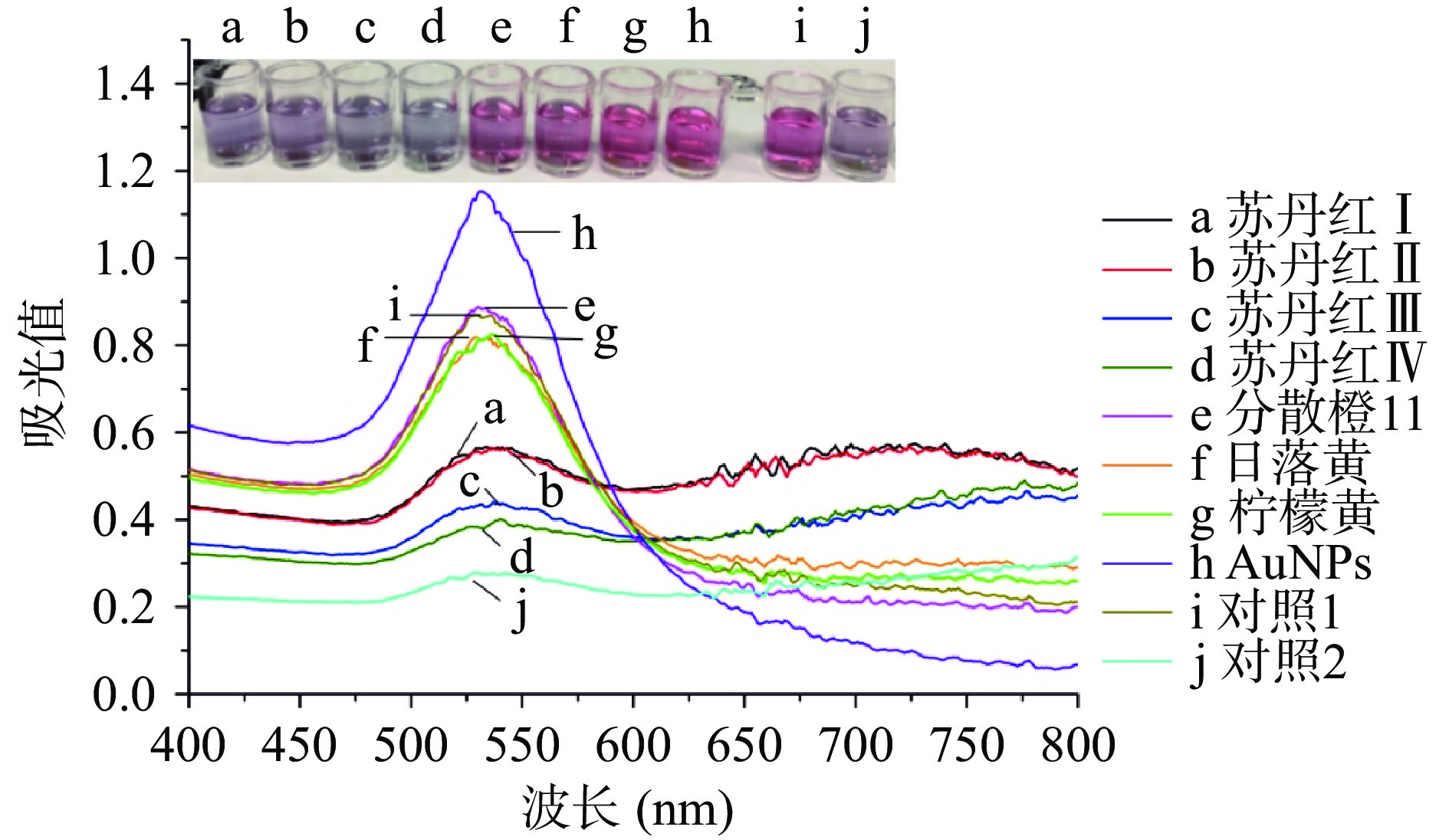
在优化条件下,采用本方法分别检测苏丹红Ⅰ~Ⅳ、分散橙11、日落黄和柠檬黄,以评估方法的特异性,结果如图8所示,当检测体系中含有苏丹红Ⅰ~Ⅳ时,纳米金聚集变色;相应地,检测体系在530 nm处吸光值明显降低。而检测体系中含有日落黄、柠檬黄和分散橙11时,并未引起纳米金聚集变色,紫外光谱也无明显变化。结果表明,该适配体是一种广谱型适配体,可选择性识别苏丹红Ⅰ~Ⅳ,这对检测结构相似的一类靶标时更有应用意义。
2.4.3 加标回收率
为验证本方法的准确性,以苏丹红III为检测靶标,采用本方法进行空白样品加标回收实验。检测结果显示(表2),苏丹红III加标回收率为85.4%~102.5%,相对标准偏差3.37%~6.75%。结果表明本方法具有高的准确性和精密度,检测结果准确可靠。
表 2 本方法加标回收率(n=3)Table 2. The recovery of the proposed method (n=3)样品 添加量(ng/g) 检测值(ng/g) 加标回收率(%) 相对标准偏差(%) 辣椒粉 10 8.83±0.45 88.3 5.09 50 46.20±1.76 92.4 3.81 100 93.80±5.22 93.8 5.56 辣椒酱 10 9.19±0.62 91.9 6.75 50 45.40±1.53 90.8 3.37 100 102.50±6.35 102.5 6.20 番茄酱 10 8.54±0.38 85.4 4.45 50 44.50±2.03 89.0 4.56 100 94.60±5.57 94.6 5.88 2.5 方法的应用
采用本方法分别对购自超市的辣椒酱、辣椒粉、番茄酱等20个样品进行检测,所有样品未检出苏丹红,与国标法检测结果一致。
3. 结论
本研究以苏丹红Ⅲ适配体为识别分子,纳米金为比色信号,构建了一种简便、灵敏、快速的苏丹红可视化比色检测方法,在优化条件下,该比色法对苏丹红III的可视化检测限为3.13 ng/mL,加标回收率为85.4%~102.5%,检测时间仅为5 min左右。与国标方法比较,本方法具有检测步骤少、检测速度快,样品前处理简单、不需要固相萃取处理,不需要大型仪器等优势。与传统的免疫方法相比,不需要制备抗体,成本低廉,检测时间短,同时也可满足高通量检测需求。本研究为批量样品中苏丹红快速检测提供了新的技术支撑。
-
图 6 苏丹红与适配体反应时间优化
注:对照组1:AuNPs+适配体5 nmol/L+PDDA 20 nmol/L;对照组2:AuNPs+PDDA 20 nmol/L;图8同。
Figure 6. The optimization of reaction time between Sudan dyes and aptamer
表 1 苏丹红检测方法比较
Table 1 Comparison of methods reported for detection of Sudan dyes
分析方法 分析物 识别元件 检测限 线性范围 检测时间 参考文献 HPLC Sudan I~IV - 0.33~2.27 μg/g 0.5~5.0 μg/mL - [3] HPLC SudanI~IV - 10 ng/g - - [18] MIP-HPLC Sudan I~IV MIP 5~9 ng/g 31~4000 ng/g - [20] HPL-MS/MS Sudan I~IV - 0.2~1.0 ng/g 1~100 ng/mL - [21] GC-MS/MS Sudan III - 2~10 ng/g 0.1~4.0 μg/mL - [22] ELISA Sudan III 抗体 0.1~0.8 ng/mL - 105 min [23] 电化学传感器 SudanI - 0.093 μmol/L 0.3~700 μmol/L - [24] 比色 SudanIII 适配体 2.15 ng/mL 3.1~50 ng/mL 5 min 本方法 注:-代表文献未涉及该部分内容。 表 2 本方法加标回收率(n=3)
Table 2 The recovery of the proposed method (n=3)
样品 添加量(ng/g) 检测值(ng/g) 加标回收率(%) 相对标准偏差(%) 辣椒粉 10 8.83±0.45 88.3 5.09 50 46.20±1.76 92.4 3.81 100 93.80±5.22 93.8 5.56 辣椒酱 10 9.19±0.62 91.9 6.75 50 45.40±1.53 90.8 3.37 100 102.50±6.35 102.5 6.20 番茄酱 10 8.54±0.38 85.4 4.45 50 44.50±2.03 89.0 4.56 100 94.60±5.57 94.6 5.88 -
[1] TING X U, WEI K Y, WANG J, et al. Development of an enzyme linked immunosorbent assay specific to Sudan red I[J]. Analytical Biochemistry,2010,405:41−49. doi: 10.1016/j.ab.2010.05.031
[2] 张卫明, 赵伯涛, 卢庆国, 等. 基于辣椒红素提取的辣椒原料生产质量安全控制技术[J]. 中国野生植物资源,2013,32(5):55−58. [ZHANG W M, ZHAO B T, LU Q G, et al. The quality and safety control technology of hot pepper based on the extraction of capsanthin[J]. Chinese Wild Plant Resources,2013,32(5):55−58. doi: 10.3969/j.issn.1006-9690.2013.05.014 [3] 钟丽琪, 曹进, 钱和, 等. 高效液相色谱法测定食品中可能掺杂的16种工业染料[J]. 食品科学,2021,42(22):305−310. [ZHONG L Q, CAO J, QIAN H, et al. Determination of 16 industrial dyes illegally addition in food by high performance liquid chromatography[J]. Food Science,2021,42(22):305−310. doi: 10.7506/spkx1002-6630-20201127-286 [4] PHAM T C, DANG X T, NGUYEN B N, et al. Determination of Sudan I and II in food by high-performance liquid chromatography after simultaneous adsorption on nanosilica[J]. Journal of Analytical Methods in Chemistry,2021(1):1−9.
[5] SHAN W C, XI J Z, SUN J, et al. Production of the monoclonal antibody against Sudan 4 for multi-immunoassay of Sudan dyes in egg[J]. Food Control,2012,27(1):146−152. doi: 10.1016/j.foodcont.2012.03.017
[6] LI J B, YANG Y Q, WANG J H, et al. Resonance rayleigh scattering detection of the epidermal growth factor receptor based on an aptamer-functionalized gold-nanoparticle probe[J]. Analytical Methods,2018,10:2910−2916. doi: 10.1039/C8AY00860D
[7] LU C X, LIU C B, SHI G Q. Colorimetric enzyme-linked aptamer assay utilizing hybridization chain reaction for determination of bovine pregnancy-associated glycoproteins[J]. Microchimica Acta,2020,187:316−324. doi: 10.1007/s00604-020-04301-y
[8] RUBAYE A A, NABOK A, CATANANTE G, et al. Detection of Ochratoxin A in aptamer assay using total internal reflection ellipsometry[J]. Sensor Actuat B-Chem,2018,263:48−251.
[9] 王红旗, 张玲, 刘冬梅, 等. 小分子靶标核酸适配体研究进展[J]. 食品与生物技术学报,2015,34(8):790−798. [WANG H Q, ZHANG L, LIU D M, et al. Research progress of aptamer for small molecule target[J]. Journal of Food Science and Biotechnology,2015,34(8):790−798. doi: 10.3969/j.issn.1673-1689.2015.08.002 [10] XU X M, MA X Y, WAND H T, et al. Aptamer based SERS detection of Salmonella typhimurium using DNA-assembled gold nanodimers[J]. Microchimica Acta,2018,185:325−332. doi: 10.1007/s00604-018-2852-0
[11] LI D L, LIU L Y, HUANG Q L, et al. Recent advances on aptamer-based biosensors for detection of pathogenic bacteria[J]. World Journal of Microbiology & Biotechnology,2021,37:45.
[12] MEHLHORN A, RAHIMI P, JOSEPH Y. Aptamer-based biosensors for antibiotic detection: A review[J]. Biosensors 2018, 8: 54.
[13] SCHÜLING T, EILERS A, SCHEPER T, et al. Aptamer-based lateral flow assays[J]. AIMS Bioengineering,2018,5(2):78−102. doi: 10.3934/bioeng.2018.2.78
[14] KIM Y S, RASTON N H A, GU M B. Aptamer-based nanobiosensors[J]. Biosensors & Bioelectronics,2016,76:2−19.
[15] YUAN, Q, LU D Q, ZHANG X B, et al. Aptamer-conjugated optical nanomaterials for bioanalysis[J]. Trac-Trends in Analytical Chemistry,2012,39:72−86. doi: 10.1016/j.trac.2012.05.010
[16] WANG Y, LI J, QIAO P, et al. Screening and application of a new aptamer for the rapid detection of Sudan dye III[J]. European Journal of Lipid Science and Technology,2018,120(6):1700112. doi: 10.1002/ejlt.201700112
[17] 卢春霞, 李红敏, 孙凤霞, 等. 基于适配体识别的侧向层析法快速检测单核细胞增生李斯特氏菌[J]. 食品与生物技术学报,2020,4:85−92. [LU C X, LI H M, SUN F X, et al. Aptamer-based lateral flow strip for rapid detection of Listeria monocytogenes[J]. Journal of Food Science and Biotechnology,2020,4:85−92. doi: 10.3969/j.issn.1673-1689.2020.04.012 [18] 国家质量监督检验检疫总局, 国家标准化管理委员会. GB/T 19681-2005食品中苏丹红燃料的检测方法高效液相色谱法[S]. 北京: 中国标准出版社, 2005. Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. GB/T 19681-2005 The method for the determination of Sudan dyes in foods-high performance liquid chromatography[S]. Beijing: Standards Press of China, 2005.
[19] OFIR Y, SAMANTA B, ROTELLO V M. Polymer and biopolymer mediated self-assembly of gold nanoparticles[J]. Chemical Society Reviews,2008,37:1814−1825. doi: 10.1039/b712689c
[20] YAN H Y, QIAO J D, PEI Y N, et al. Molecularly imprinted solid-phase extraction coupled to liquid chromatography for determination of Sudan dyes in preserved beancurds[J]. Food Chemistry,2012,132:649−654. doi: 10.1016/j.foodchem.2011.10.105
[21] 杨光勇, 薛光, 郭金喜, 等. 超高效合相色谱-串联质谱法测定中药材中10种偶氮染料[J]. 质谱学报,2021,42(6):1509−1067. [YANG G Y, XUE G, GUO J X, et al. Determination of ten kinds of azo dyes in Chinese medicinal materials by ultra performance convergence chromatography-tandem mass spectrometry[J]. Journal of Chinese Mass Spectrometry Society,2021,42(6):1509−1067. [22] 张胜帮, 韩超, 刘继东, 等. 食品中苏丹红I~IV及对位红的GC-MS/SIM法研究[J]. 中国食品学报,2009,9(2):187−193. [ZHANG S B, HAN C, LIU J D, et al. Study on simultaneous determination of sudanI-Sudan IV and para red in food by GC-MS/SIM[J]. Journal of Chinese Institute of Food Science and Technology,2009,9(2):187−193. doi: 10.3969/j.issn.1009-7848.2009.02.031 [23] QI Y H, SHAN W C, LIU Y Z, et al. Production of the polyclonal antibody against Sudan 3 and immunoassay of Sudan dyes in food samples[J]. Journal of Agricultural and Food Chemistry,2012,60:2116−2122. doi: 10.1021/jf300026x
[24] EBRAHIMI-TAZANGI F, BEITOLLAHI H, HEKMATARA H, et al. Design of a new electrochemical sensor based on the CuO/GO nanocomposites: Simultaneous determination of Sudan I and bisphenol A[J]. Journal of the Iranian Chemical Society,2021,18:191−199. doi: 10.1007/s13738-020-02016-8





 下载:
下载:

 下载:
下载:



