AuNPs Enhanced Microwave Coupled Lipase Synthesis of Starch Oleate Ester
-
摘要: 以预处理玉米淀粉和油酸为底物,纳米金固定后的南极假丝酵母脂肪酶(CAL@AuNPs)为催化剂,实现油酸淀粉酯的绿色高效制备。以油酸转化率为指标进行CAL@AuNPs制备条件的优化,取代度为指标探究游离酶、商品化固定化酶及纳米金固定化脂肪酶在微波辅助条件下的催化效率。结果表明,在40 ℃的条件下添加4 mL纳米金(14 nm)为载体对CAL固定6 h后,获得的CAL@AuNPs催化能力最强。在微波功率400 W,温度35 ℃的条件下CAL@AuNPs催化10 mL油酸和2 g淀粉反应40 min后,可以制得取代度最高为0.0259的油酸淀粉酯。与游离酶和商品化固定化酶相比,在微波辅助下,CAL@AuNPs催化能力强,能够有效缩短反应时间、提高产物取代度。Abstract: The nano-gold immobilized lipase (CAL@AuNPs) was prepared to synthesize starch oleate ester efficiently by using pre-treated corn starch and oleic acid as raw materials. Optimisation of the preparation conditions of CAL@AuNPs was carried out using oleic acid conversion rate as an indicator. The substitution degree was used as an indicator to investigate the catalytic efficiency of free enzyme, commercial immobilised enzyme and nanogold immobilised lipase under microwave-assisted conditions. The experimental results showed that the immobilized lipase with the strongest catalytic activity could be obtained by using AuNPs of 14 nm as carrier at 40 ℃ for 6 h. The starch oleate ester with the highest substitution degree of 0.0259 could be prepared by using CAL@AuNPs as catalyst under the condition of 400 W, 35 ℃ for 40 min. Compared with free enzyme, and commercial immobilized enzyme , the CAL@AuNPs could shorten reaction time and improve the degree of substitution.
-
在食品工业生产中常用的改性玉米淀粉包括复合改性淀粉、酯化淀粉、交联淀粉、冷水可溶性淀粉、酸水解淀粉和糊精等[1-2]。不同改性淀粉添加到食品中后不仅可以改善食品的质构,起到增稠、悬浮、保水和稳定的作用,还可以有效延长食品的保质期,其主要用于饮料、糖果、面制品、肉制品以及调味料等食品的加工中[3-5]。而脂肪酸淀粉酯是一类新型的改性淀粉,因具有优于传统工业材料的理化特性,现已成为变性淀粉工业中的一个新兴研究热点[6]。脂肪酸淀粉酯制备分为两大体系,即有溶剂体系和无溶剂体系。聂卉等[7]以离子液体为反应介质,采用化学法制备了阿魏酸淀粉酯,并对馒头预发酵冷冻面团物化性质的影响进行研究,证明适量添加阿魏酸淀粉酯有助于改善馒头硬度、韧性及其内部结构的紧致性。Zhang等[8]利用硬脂酸和月桂酸与淀粉在水介质的条件下制备硬脂酸淀粉酯和月桂酸淀粉酯,探究了酯化条件对取代度(DS)及产物结构和性能的影响。Winkler等[9]利用月桂酸、脂肪酸乙烯酯在二甲基亚砜(DMSO)体系中进行酯交换反应或在吡啶中与脂肪酸氯化物反应从而制得月桂酸酯。
无溶剂反应体系由于绿色环保,产品无有机试剂残留而备受关注。目前,无溶剂体系中脂肪酸淀粉酯的制备主要是借助脂肪酶的界面催化特性,通过酯化或转酯化反应实现。Sn等[10]在无溶剂条件下利用固定化脂肪酶催化反应成功制备了辛酸木糖酰基酯、癸酸木糖酰基酯、月桂酸木糖酰基酯和肉豆蔻酸木糖酰基酯。Allana等[11]利用鲸蜡醇与棕榈酸在无溶剂体系中通过酯化反应合成十六烷基棕榈酸酯,并对该酶促反应动力学进行了探究。微波技术和酶催化技术是淀粉改性研究中两种重要的绿色合成手段,且将二者联合应用于淀粉的改性,会产生相互促进的耦合效应。Horchani等[12]利用CaCO3固定化金黄色葡萄球菌脂肪酶,在无溶剂体系下通过微波加热成功制备了油酸淀粉酯。但是在无溶剂体系下利用微波辅助脂肪酶催化油酸淀粉酯还存在一定的弊端,当淀粉和脂肪酸作为底物时,极性相差较大不易混溶,且淀粉并非脂肪酶的天然底物,因此脂肪酶不易催化淀粉与脂肪酸发生酯化反应,产物的取代度较低[13]。
为解决以上问题,本实验拟采用纳米金为载体固定游离脂肪酶制备纳米金固定化酶,借助纳米金与酶之间良好的生物相容性和其对微波的强吸收能力,在无溶剂体系下有效提高微波辅助酶催化脂肪酸淀粉酯的合成效率,为改性淀粉的制备与酯化反应的绿色合成提供新思路。
1. 材料与方法
1.1 材料与仪器
预处理玉米淀粉 黑龙江省食品科学与工程高校重点实验室自制[14];油酸(AR) 天津天力化学试剂有限公司;氯金酸(99%) 沈阳兴惠达化工有限公司;南极假丝酵母脂肪酶(10000 U/g) 上海源叶生物科技有限公司;固定于大孔丙稀酸树脂的南极假丝酵母脂肪酶Novozym 435(L477710000 U/g) 丹麦公司;柠檬酸钠及其他常用试剂 均为国产分析纯。
UV2550型紫外-可见分光光度计 日本岛津公司;XH-100A微波反应器 北京祥鹄科技发展公司;GC-7890F气相色谱仪 上海天美仪器有限公司;Perkin Elmer 100傅里叶变换红外光谱仪 美国 Perkin Elmer 公司;F-7000荧光分光光度计 日本日立公司;DHG-9053电热恒温鼓风干燥箱 上海一恒科学仪器有限公司;AVANCEIII300核磁共振波谱仪 布鲁克(北京)科技有限公司。
1.2 实验方法
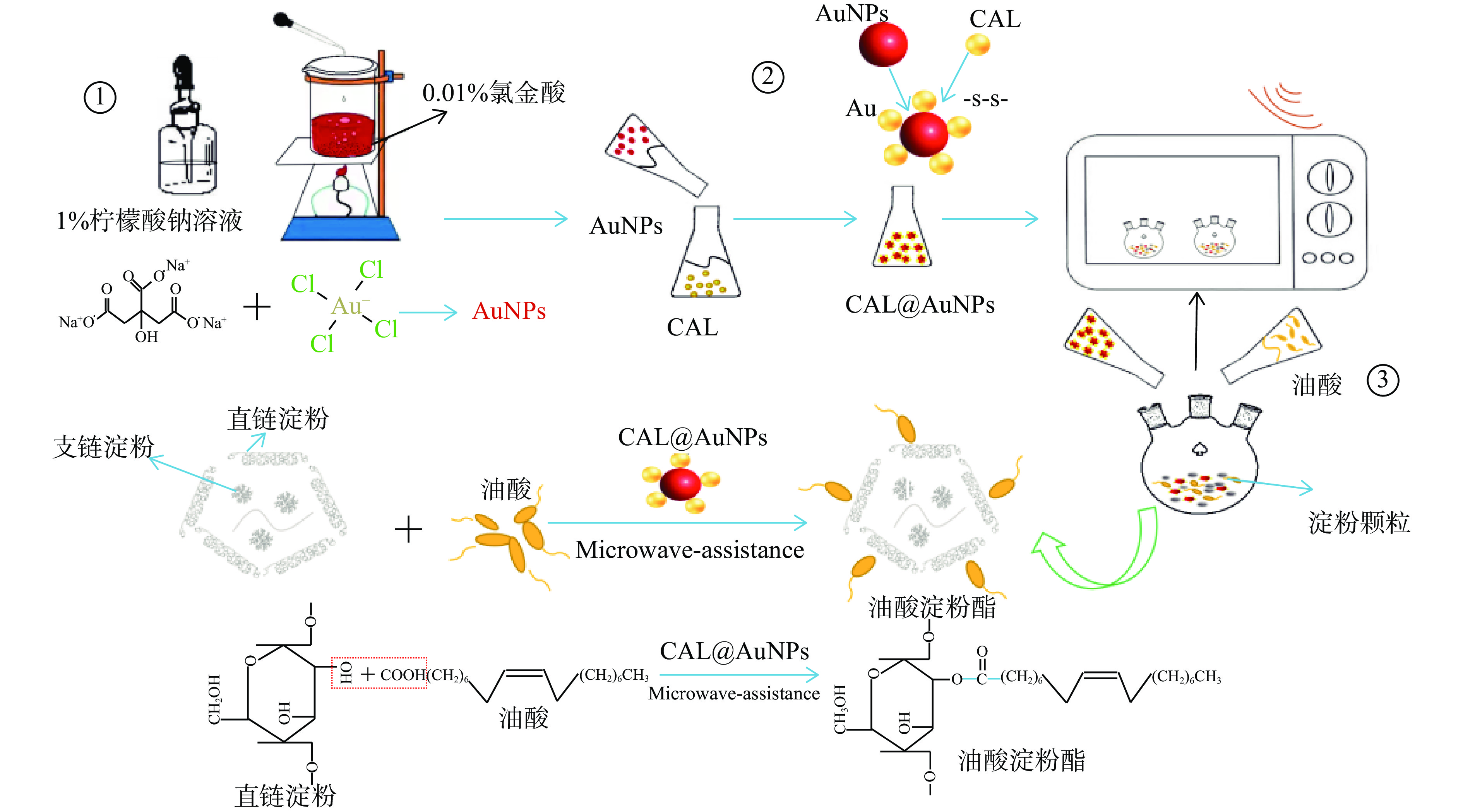
本实验以脂肪酶催化油酸与玉米淀粉发生酯化反应为研究模型,在无溶剂体系下借助微波辅助技术提高脂肪酶催化酯化反应效率,其原理如图1所示,将脂肪酶与油酸、淀粉混合后放入微波反应器中,在无溶剂体系下进行油酸淀粉酯的合成制备。对比分析不同微波参数对游离的南极假丝酵母脂肪酶(CAL)、商品化固定化南极假丝酵母脂肪酶(Novozym 435)和本实验制备的纳米金固定化南极假丝酵母脂肪酶(CAL@AuNPs)催化油酸与淀粉发生酯化反应的能力的影响。并以油酸淀粉酯的取代度为指标,利用甲醇醇解-气相色谱法分析产物油酸淀粉酯的合成进程。实现微波辅助酶催化油酸淀粉酯的高效合成,缩短反应时间,提高取代度。
1.2.1 纳米金的制备
参考王艳等[15]的实验方法,准确量取0.01%的氯金酸溶液50 mL置于平底烧瓶内,加热至溶液沸腾后逐滴加入1.4~1.75 mL的浓度为1%的柠檬酸钠溶液,持续搅拌加热至溶液成酒红色,冷却至室温后4 ℃低温保存,即制得粒径为10~18 nm纳米金,以蒸馏水为空白进行紫外光谱检测。纳米金粒径计算公式如下:
式中:AsPr表示纳米金溶液在紫外下最高峰的吸光度值;AuSo表示纳米金溶液在450 nm处的紫外吸光度值。
1.2.2 CAL@AuNPs的制备
准确称取0.10 g南极假丝酵母脂肪酶,加入2 mL的超纯水配制成浓度为50 mg/mL脂肪酶溶液后分别加入纳米金溶液,将其充分混合后密封于恒温培养箱中反应后进行冷冻干燥,即为CAL@AuNPs。
1.2.3 单因素实验
单因素采用控制变量法,将2 g淀粉、10 mL油酸、浓度为50 mg/mL的脂肪酶置于功率为400 W、温度35 ℃的微波反应器中充分反应40 min,制备油酸淀粉酯,以油酸转化率为指标确定纳米金粒径大小、纳米金添加量、固定化反应时间、温度四个因素的最佳反应条件。
1.2.3.1 纳米金粒径的大小对酶催化效果的影响
固定化温度为30 ℃、时间8 h、纳米金添加量4 mL为固定因素,依次以10、12、14、16、18 nm,5个梯度考察纳米金粒径大小对酶催化效果的影响。
1.2.3.2 纳米金添加量对酶催化效果的影响
固定化温度为30 ℃、时间8 h、纳米金粒径14 nm为固定因素,依次以1、2、3、4、5 mL,5个梯度考察纳米金添加量对酶催化效果的影响。
1.2.3.3 固定化时间对酶催化效果的影响
固定化温度为30 ℃、纳米金粒径14 nm、纳米金添加量为4 mL为固定因素,依次以4、5、6、7、8 h,5个梯度考察固定化反应时间对酶催化效果的影响。
1.2.3.4 固定化温度对酶催化效果的影响
固定化时间6 h、纳米金粒径14 nm、纳米金添加量为4 mL为固定因素,依次以30、35、40、45、50 ℃,5个梯度考察固定化反应温度对酶催化效果的影响。
1.2.4 油酸转化率的测定
1.2.4.1 标准曲线的绘制
参考课题组前期建立的气相色谱法[16]并稍作改动。配制浓度为1×10−4、2.5×10−4、5×10−4、7.5×10−4、1×10−3 mg/L的油酸甲酯标准溶液,抽取1 μL进入气相色谱进行测定。以油酸甲酯溶液的浓度C为横坐标,气相色谱峰的面积S为纵坐标构建曲线,得到油酸甲酯溶液的标准曲线,获得回归方程为:S=96.853C−879.2(R2=0.9998)。
1.2.4.2 色谱条件
色谱柱:DM-FFAP 石英毛细管柱,30 m×0.32 mm×0.25 μm;炉温220 °C、进样器温度250 °C、检测器温度为260 °C、氮气流速为4.5 mL/min、空气流速为5.5 mL/min、尾吹为5.0 mL/min。进样量:1 μL。
1.2.4.3 产物甲酯化
参考文献[17]并改动,取1.2.3中制备的油酸淀粉酯30 mg加入0.5 mL二甲基亚砜中进行溶解。然后加入1 mL 0.07 mol/L的甲醇甲醇钠溶液后在70 ℃下回流40 min,冷却,加入1 mL去离子水和1 mL正庚烷充分搅拌1 min后静置沉淀,上层油相即为油酸甲酯。
1.2.4.4 油酸转化率的计算
采用外标法算得1.2.4.3实验中所得油酸甲酯的量从而换算出油酸淀粉酯的量,进而得到已反应油酸的量,并与油酸总量10 mL进行对比,可推导出油酸淀粉酯中油酸的转化率计算公式如下:
式中:α表示油酸的转化率,%;n0表示油酸的总量,mol;n1表示生成油酸淀粉酯所消耗的油酸的量,mol。
1.2.5 CAL@AuNPs的表征
准确称取0.10 g南极假丝酵母脂肪酶,加入2 mL的超纯水配制成浓度为50 mg/mL脂肪酶溶液后加入4 mL粒径为14 nm的纳米金溶液,将其充分混合后密封于40 ℃恒温培养箱中反应6 h,取出进行冷冻干燥,即为CAL@AuNPs,参考文献[14]并稍作改动分别进行紫外光谱、荧光光谱、红外光谱进行测定结构表征。
1.2.5.1 紫外光谱分析
取浓度为 50 mg/mLCAL@AuNPs溶液于石英比色皿中,通过紫外分光光度计全波长进行扫描,得到紫外图谱对比分析。
1.2.5.2 荧光光谱分析
将配制好南极假丝酵母脂肪酶溶液进行紫外全波长扫描,确定其激发波长。荧光扫描激发狭缝与发射狭缝均设置为5 nm,光电倍增管电压为700 V,扫描速度为2400 nm/min,固定激发波长为λex=275 nm。取1 mL浓度为50 mg/mL南极假丝酵母酶液作为底物置于荧光比色皿中,30 ℃下每间隔5 min添加20 μL的纳米金溶液,观察分析荧光光谱发射峰的变化。
1.2.5.3 红外光谱分析
将冷冻干燥得到的CAL@AuNPs粉末和未经处理的南极假丝酵母脂肪酶各取5 mg,置于傅里叶变换红外光谱仪中,扣除平衡空白背景采用常规压片法,在波数范围为4000~450 cm−1,分辨率4 cm−1的条件下,扫描收集样品的红外光谱,分析固定化脂肪酶样品分子基团的变化。
1.2.6 微波辅助脂肪酶催化油酸淀粉酯的制备
称取2 g淀粉与油酸混合后分别加入CAL@AuNPs、游离酶(南极假丝酵母脂肪酶)、Novozym 435于三颈烧瓶内后充分搅拌1 min,置于微波反应器中。反应结束后用80 ℃无水乙醇进行冲洗后放入105 ℃烘箱内烘干2 h至恒重,即油酸淀粉酯。
1.2.7 单因素实验
单因素实验采用控制变量法,以2 g淀粉为固定因素,以取代度为指标确定微波反应功率、时间、温度、脂肪酶添加量、油酸添加量五个因素的最佳反应条件,并用以探究微波辅助条件下CAL@AuNPs与Novozym 435固定化酶催化活性的影响。
1.2.7.1 微波功率对脂肪酶催化活性的影响
在2 g淀粉,油酸添加量为10 mL,脂肪酶添加量为5%(淀粉干重),微波反应温度为40 ℃,时间为40 min的条件下,依次以200、300、400、500、600 W,5个梯度功率考察功率对脂肪酶催化活性的影响
1.2.7.2 微波反应时间对脂肪酶催化活性的影响
在2 g淀粉,油酸添加量为10 mL,脂肪酶添加量为5%(淀粉干重),微波反应温度为40 ℃,功率400 W的条件下,依次以20、30、40、50、60 min,5个梯度时间考察微波反应时间对脂肪酶催化活性的影响。
1.2.7.3 微波反应温度对脂肪酶催化活性的影响
在2 g淀粉,油酸添加量为10 mL,脂肪酶添加量为5%(淀粉干重),微波反应时间为40 min,功率400 W的条件下,依次以25、30、35、40、45 ℃,5个梯度温度考察微波反应温度对脂肪酶催化活性的影响。
1.2.7.4 脂肪酶添加量对脂肪酶催化活性的影响
在2 g淀粉,油酸添加量为10 mL,微波反应时间为40 min,功率400 W,温度为35 ℃的条件下依次加入3%、4%、5%、6%、7%(淀粉干基)的脂肪酶,5个梯度脂肪酶添加量考察脂肪酶添加量对脂肪酶催化活性的影响。
1.2.7.5 油酸添加量对脂肪酶催化活性的影响
在2 g淀粉,脂肪酶添加量为5%,微波反应时间为40 min,功率400 W,温度为35 ℃的条件下,依次加入6、8、10、12、14 mL油酸,5个梯度油酸添加量考察油酸添加量对脂肪酶催化活性的影响。
1.2.8 产物取代度的测定
取代度的测定方法采用本课题组前期建立的甲醇醇解-气相色谱检测法进行测定[16]。计算公式为
式中:n表示发生酯化的油酸的物质的量,mol;M0表示样品质量,g;M1表示葡萄糖残基的分子量,162;M2表示油酸分子量,282.46;
1.2.9 油酸淀粉酯的定性分析和结构表征
1.2.9.1 红外光谱分析
取适量原玉米淀粉与单因素最佳实验条件下制备的油酸淀粉酯,操作同1.2.5.3,分别收集二者红外光谱,并进行分析。
1.2.9.2 核磁共振氢谱分析
参考王艳等[13]的方法。取单因素最佳实验条件下制备的油酸淀粉酯溶于二甲基亚砜分析纯溶液中进行检测。具体参数为:观察频率:400 MHz,谱宽(δ):0~15,探头:5 mm,脉冲序列:30,测定温度:25 ℃。在此实验条件下,进行结果分析。
1.3 数据处理
每个单因素反应条件重复实验3次,测定固定化脂肪酶结构及油酸淀粉酯结构实验3次,利用Origin18进行作图,单因素显著性分析利用SPSS软件进行分析,利用Excel进行数据计算。
2. 结果与分析
2.1 CAL@AuNPs的制备
2.1.1 CAL@AuNPs制备条件优化
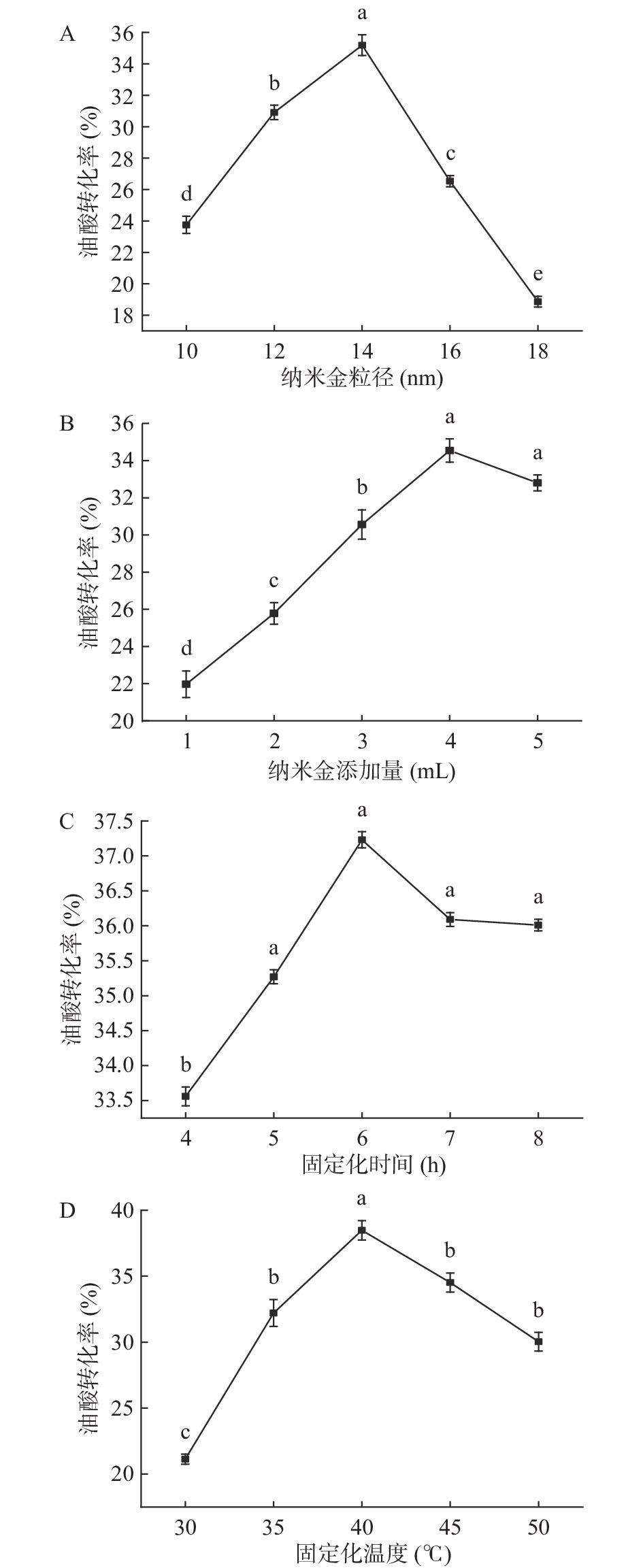
纳米金粒径的大小、纳米金添加量、固定化时间及固定化温度均能影响CAL@AuNPs的催化活性,其中AuNPs粒径大小不仅可以改变酶的结构来影响酶的活性中心,还可以影响底物吸收微波的能力从而影响酶的催化效果。如图2A所示,当粒径小于14 nm时,CAL@AuNPs催化效果随AuNPs粒径增大而增强。这是因为微波辐射对AuNPs具有选择性加热的特点,从而产生热点效应,进一步提高酶的催化活性[18]。当粒径大于14 nm时,油酸转化率迅速下降,随着粒径的增大,纳米金占据脂肪酶在底物中的位置,从而减弱底物的吸波能力使得脂肪酶的催化活性下降,导致油酸转化率的降低,且纳米金粒径所选择的5个粒径大小均存在显著性差异(P<0.05),因此选用粒径为14 nm的纳米金溶液进行CAL@AuNPs的制备。
纳米金添加量能够在一定程度上影响脂肪酶的活性中心从而影响酶的催化活性。如图2B所示,随着AuNPs添加量的增加,油酸转化率呈先上升后下降的趋势,当AuNPs添加量为4 mL时, CAL@AuNPs催化效果最好,油酸转化率最高为34.54%。这是因为AuNPs添加量影响酶与AuNPs的接触面积[19],随着AuNPs添加量的增加,酶与AuNPs的接触面积增大,从而保持了酶的催化稳定性,且在一定程度上限制了脂肪酶的聚集现象,保持酶的活性状态,使得底物与酶充分发生反应。AuNPs在此也提供了一个有利于促进脂肪酶催化反应的环境,使微波能够有效均匀发挥作用提高酶促反应,提高油酸转化率。但是,随着纳米金溶液的进一步增加,AuNPs的密度增加会阻碍酶与底物的接触,同时高浓度的纳米金形成聚集现象,从而降低了脂肪酶催化底物的活性。且在纳米金添加量为1、2、3 mL时存在显著性差异(P<0.05),4、5 mL时没有显著性差异(P>0.05),因此选用4 mL添加量进行下一步实验。
固定化时间也会对酶的催化活性产生影响,由图2C所示,CAL@AuNPs制备时间在4~8 h范围内,形成的CAL@AuNPs催化能力随时间的增加先增强后减弱,6 h时效果最佳,油酸转化率为37.23%。当固定化时间继续增加,所得固定化酶的催化能力会迅速降低。这是因为随着时间的增加,纳米金表面已经被成功固定化的脂肪酶可能会继续被酶分子覆盖,互相折叠掩盖酶催化活性中心,其余酶的活性基团可能与AuNPs键合反而使其催化酯化反应的效果下降。且当反应时间为5、6、7、8 h时无明显差异(P>0.05),与4 h时有显著性差异(P<0.05)。因此,选择5~8 h内固定化最佳时间为6 h。
温度在酶催化反应中影响脂肪酶的结构从而直接影响着酶的活性和稳定性。固定化温度对酶催化效果如图2D所示,温度在30~40 ℃时油酸转化率不断增加,这是因为随着温度的升高,分子运动速率加快,促进AuNPs与CAL的有效结合,酶催化效果随温度的升高而增强,温度为40 ℃时油酸的转化率最高为38.48%。继续升高温度,CAL的结构随着温度的升高遭到破坏,且已经固定化成功的CAL@AuNPs随着温度升高纳米金吸收热量增加也会导致CAL@AuNPs的结构破坏,致使酶的催化活性下降。且35 ℃与45、50 ℃之间没有显著性差异(P>0.05),而30、40 ℃与其他三组存在显著性差异(P<0.05)。因此,采用40 ℃作为制备固定化酶的最佳温度。
综上所述,CAL@AuNPs的最佳制备条件为,50 mg/mL的CAL溶液中添加4 mL粒径为14 nm的纳米金后置于40 ℃下固定化6 h。
2.1.2 CAL@AuNPs的表征
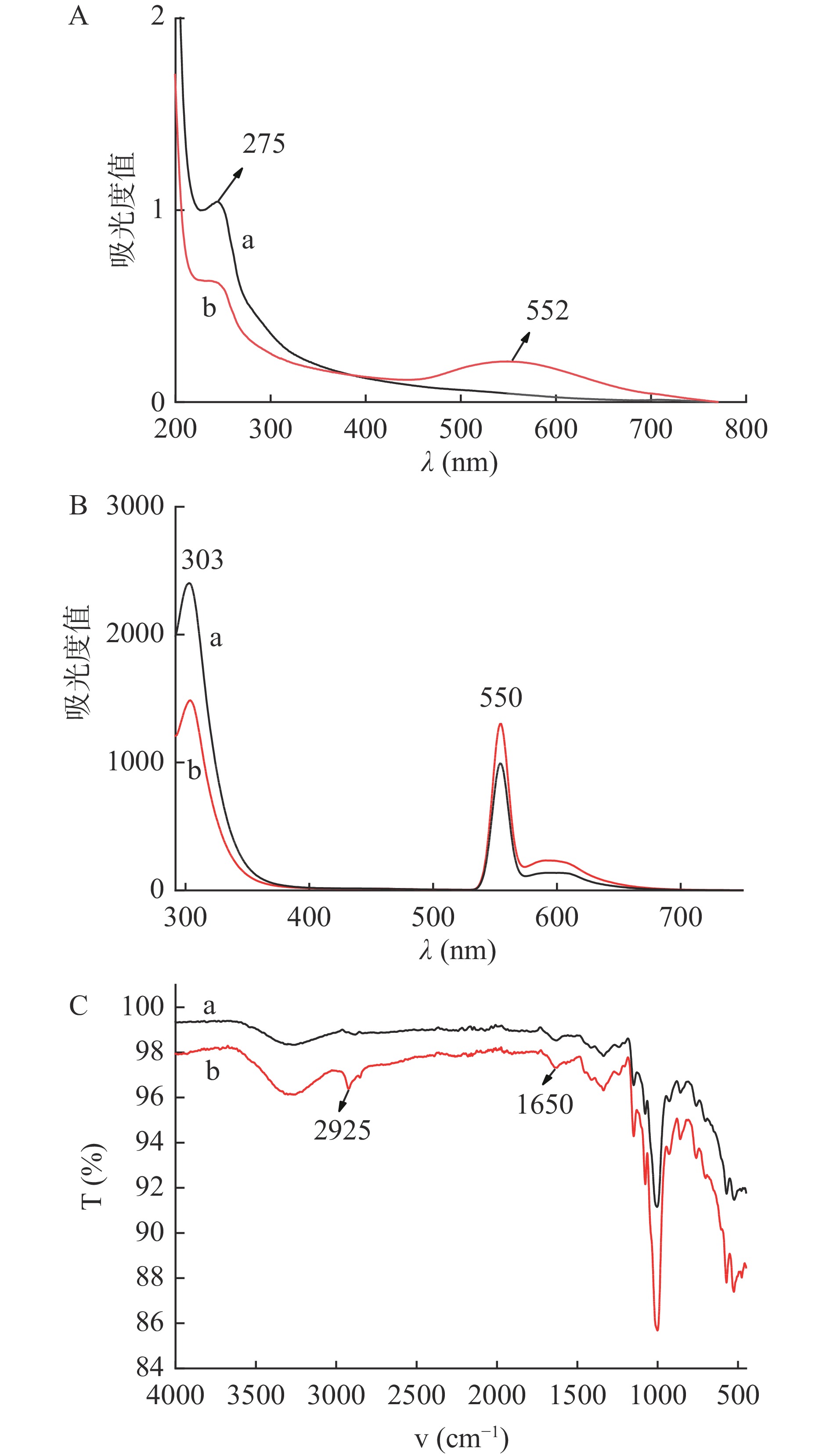
CAL是由317个氨基酸组成的球状蛋白质结构,大多数脂肪酶都具有3种能产生荧光发射光谱的内源性氨基酸,分别是酪氨酸、色氨酸和苯丙氨酸。CAL固定在AuNP上后必然引起CAL的结构发生变化,通过紫外光谱特征峰、荧光光谱以及红外光谱对该现象进行表征。从图3A中可以看出CAL固定在AuNPs上后,其特征峰从275 nm处发生蓝移且峰值下降,这可能是因为CAL中酪氨酸中含有苯环等大的不饱和基团,且酪氨酸中的-OH存在给电子共轭效应。由于共轭体系中酪氨酸有n→π*跃迁,纳米金粒子引起原苯环的振动以及AuNPs能够稳定而迅速的吸附蛋白质,这两种作用共同引起特征峰的蓝移且峰值下降。已知AuNPs的特征峰在520 nm左右,在图中可以看出在552 nm处出现新的特征峰,说明AuNPs的颗粒在脂肪酶的作用下间距变小,发生聚集,更加准确的说明了固定化酶结构的变化。
从荧光光谱中(图3B)也可看出脂肪酶中氨基酸的变化。酪氨酸、色氨酸和苯丙氨酸荧光峰位波长分别在348、303、282 nm附近[20]。当激发波长为275 nm时,色氨酸和酪氨酸被同时激发,在图3B可以看出AuNPs的引入致使303 nm处色氨酸特征峰发生明显的下降及蓝移,且在550 nm纳米金特征峰处的峰值升高,说明脂肪酶上的色氨酸与AuNPs结合形成固定化酶CAL@AuNPs。
红外光谱图也可以用来分析脂肪酶结构的变化,脂肪酶的酰胺Ⅰ带(1600~1700 cm−1)可以反映脂肪酶的二级结构,脂肪酶的蛋白质二级结构是指多肽链骨架中局部肽段的构象。α-螺旋和β-折叠结构中存在较多的氢键,其作用使得规则二级结构具有一定的稳定性和刚性[21]。在1682~1700 cm−1为β-折叠结构,1650~1660 cm−1为α-螺旋结构[22]。如图3C所示,由AuNPs制备的CAL@AuNPs峰型较CAL峰型有些许变化,在2925 cm−1处为C-H键的吸收峰,在1650 cm−1处为C=C键吸收峰,而CAL@AuNPs在此处的峰值增强,说明此时β-折叠结构和α-螺旋结构都有改变,且在525 nm处-S-S-键峰值减弱,结合紫外与荧光图谱说明CAL中色氨酸与酪氨酸中的-S-S-与AuNPs粒子偶联,形成Au-S键,成功制备CAL@AuNPs。
2.2 微波辅助脂肪酶催化油酸淀粉酯合成条件优化及脂肪酶催化活性对比分析
2.2.1 微波功率对脂肪酶催化活性的影响
在微波辅助CAL@AuNPs催化制备油酸淀粉酯的过程中,低功率微波能够促进酯化反应,Lukasiewicz 等[23]在实验中也证明了这一点。如图4所示随着功率的增大,Novozym 435 和 CAL@AuNPs的催化效果均呈现先上升后下降的趋势,400 W时CAL@AuNPs催化效果最强,测得取代度为0.0234,而Novozym 435在500 W时催化效果最强,取代度为0.0188。这是因为微波功率的增大能够改善底物与酶分子之间的分子间的碰撞运动,促进酶与底物的反应接触均匀,进而加速酯化反应的完成。继续增大功率,取代度下降,过大的微波功率对脂肪酶结构造成破坏,降低脂肪酶催化活性。
在图中可以看出CAL@AuNPs催化效果要优于Novozym 435,这是因为纳米金作为吸收微波载体产生热点效应,400 W前纳米金的热点效应随着功率的增大而增大,因此催化效果较强。随着微波功率的增大,微波能量直接作用于吸附在大孔树脂上的Novozym 435使其结构破坏,而CAL@AuNPs中纳米金起到对CAL的保护作用减小受破坏程度,酶不易失活,因此而催化活性虽然下降,但CAL@AuNPs催化活性依旧优于Novozym 435。且CAL@AuNPs在300与600 W之间催化所得取代度没有显著性差异(P>0.05),其他三组存在显著性差异(P<0.05);Novozym 435在400与600 W之间没有显著性差异(P>0.05),其他三组存在显著性差异(P<0.05)。因此选用400 W为CAL@AuNPs、500 W为Novozym 435催化最佳微波功率进行后续实验。
2.2.2 微波反应时间对脂肪酶催化活性的影响
AuNPs的加入能够有效延长酶促反应时间,在其保护下脂肪酶不会迅速失活。从图5中可以看出随着微波作用时间的增加,二者取代度均随着反应时间的增大先增加后下降。在40 min时,CAL@AuNPs催化活性最强,取代度为0.0247,而Novozym 435在50 min时催化活性最强,取代度为0.0189。这是因为微波能够在一定程度上改变酶的分子结构,促进酶活性中心暴露出来,充分与底物进行反应,提高酶的催化效率[24]。且随着时间的增加,底物分子运动相互接触的时间增加也会促进产物的生成。继续延长反应时间,分子之间的碰撞运动也会促使体系温度升高,脂肪酶的结构受到严重破坏会使酶的活性迅速下降甚至失活,从而取代度下降[14]。
在图中可以看出,CAL@AuNPs催化活性优于Novozym 435,这是因为由于AuNPs具有热点效应,吸收微波能量的能力强,且AuNPs对脂肪酶具有良好的保护作用,因此所需催化时间短,催化活性高。且CAL@AuNPs在20~50 min内催化所得取代度存在显著性差异(P<0.05),而60 min与30 min所得取代度无显著性差异(P>0.05);Novozym 435在20~50 min内存在显著性差异(P<0.05),而60 min与40 min所得取代度无显著性差异(P>0.05)。因此,选定40 min为CAL@AuNPs、50 min为Novozym 435最佳反应时间进行后续反应。
2.2.3 微波反应温度对脂肪酶催化活性的影响
反应温度是酯化反应的重要影响因素之一,适宜的温度会促进脂肪酶活性基团的暴露及淀粉-OH的暴露,从而更好地发生酯化反应[25]。如图6所示,随着温度的增大,二者取代度均随着温度的增大呈先上升后下降的趋势。当温度为35 ℃时,CAL@AuNPs催化活性最强为0.0259,而Novozym 435在温度为40 ℃时催化活性最强,取代度为0.0197。这是因为随着温度的升高,淀粉的结构逐渐打开,淀粉的-OH和油酸中-COOH充分结合发生酯化反应,且酶的活性中心充分暴露,酶促反应更容易进行[26]。随着温度的继续上升,取代度随之下降。这是因为酶作为催化剂在微波场中被加热速度比周围介质更快,引起酶在体系内吸收热量更多,酶结构被破坏,使得催化活性下降。
在图中可以看出,CAL@AuNPs催化活性优于Novozym 435,但其耐热效果低于Novozym 435。这是因为Novozym 435本身属于耐热性酶,在一定温度下会保持酶的活性,且CAL@AuNPs中AuNPs的热点效应随着温度的升高而增强,吸收热量增大[13],因此酶结构被破坏,从而降低催化活性。且CAL@AuNPs在25~40 ℃之间催化所得取代度存在显著性差异(P<0.05),当温度升高至45 ℃时所得取代度与30 ℃时所得取代度无显著性差异(P>0.05);Novozym 435在25~40 ℃之间催化所得取代度存在显著性差异(P<0.05),温度升高至45 ℃时,与35、40 ℃之间所得取代度没有显著性差异(P>0.05),因此,选定35 ℃为CAL@AuNPs、40 ℃为Novozym 435最佳反应温度进行后续实验。
2.2.4 脂肪酶添加量对酶促反应的影响
从图7中可以看出,随着脂肪酶添加量的增大,取代度呈先上升后下降的趋势。当CAL@AuNPs添加量(淀粉干基)为5%时,取代度最大为0.0203。而Novozym 435添加量为6%时,取代度最大为0.0179。这是因为随着酶量的增加,酶的催化活性增强,底物与酶活性位点的接触面积增大,二者酶催化活性增强。继续增加酶量,过量的酶加入会使体系内酶浓度与底物浓度饱和,由于Novozym 435固定于大孔树脂上,酶含量的增加导致酶聚集作用增强,使得酶催化活性下降。CAL@AuNPs含量的增加导致体系内AuNPs含量增加,从而导致微波作用于AuNPs产生的热点效应增强,吸收微波能量增强温度升高,高温导致酶的结构被破坏,催化效果减弱[27]。
在图中可以看出,CAL@AuNPs催化活性不仅优于Novozym 435,且用量前者少于后者,节省酶用量,降低成本。且CAL@AuNPs在酶添加量为3%~6%时催化所得取代度存在显著性差异(P<0.05),当酶添加量增加至7%时所得取代度与4%时所得取代度无显著性差异(P>0.05);Novozym 435在酶添加量为3%~5%时催化所得取代度存在显著性差异(P<0.05),当添加量增加至6%与7%时均与5%时所得取代度没有显著性差异(P>0.05),因此,选定5%为CAL@AuNPs、6%为Novozym 435酶添加量作为最佳酶添加量进行后续反应实验。
2.2.5 油酸添加量对酶促反应的影响
在酯化反应中底物比也是影响酯化反应的重要因素。由于固定化酶在非水相介质中的催化反应属于非均相反应,酶的扩散程度较在水相介质中小,受限制程度较大[28],因此要选定适当的底物比,使得酶在体系内扩散均匀。从图8中可以看出,随着油酸添加量的增大,取代度均呈现先上升后下降的趋势。当添加量为10 mL时,经CAL@AuNPs和Novozym 435催化所得油酸淀粉酯取代度均最大。前者为0.0259,后者为0.0198。这是因为在本实验中油酸提供-COOH与淀粉中的-OH相结合生成酯化反应,随着油酸含量的增加-COOH的量增加与直链淀粉螺旋结构上的-OH相结合,促进反应中更多油酸淀粉酯的生成,取代度增大[16]。继续增加油酸含量,取代度随之下降。过量的油酸会出现脂肪酶活性中心被包裹的现象,使酶的活性位点不能完全暴露,限制了酶的催化效果,取代度降低。
在图中可以看出,当取代度下降时,经CAL@AuNPs催化得到的油酸淀粉酯取代度下降平缓,进一步说明AuNPs热点效应增强体系吸收微波能力,使得CAL@AuNPs活性减弱缓慢。且CAL@AuNPs与Novozym 435在油酸添加量为6~10 mL时催化所得取代度存在显著性差异(P<0.05),当油酸添加量增加至12时,所得取代度与10 mL时所得取代度无显著性差异(P>0.05);因此,均选定10 mL油酸添加量作为最佳油酸添加量。
2.2.6 油酸淀粉酯的结构分析
2.2.6.1 红外光谱图分析
如图9所示,为淀粉与油酸在微波辅助下分别以游离的CAL、Novozym 435脂肪酶及CAL@AuNPs作为催化剂,单因素最佳条件下催化合成的产物油酸淀粉酯的红外光谱图。由图可知,红外光谱的特征峰在3000~2800 cm−1之间归属于氢键缔合的C-H伸缩振动;3600~3000 cm−1之间较为宽大的峰是由-OH的伸缩振动产生;在1336 cm−1处是由葡萄糖残基AGU的伸缩振动产生的。与原玉米淀粉相比,经过Novozym 435脂肪酶与CAL@AuNPs催化产生的油酸淀粉酯结构中在3400~3200 cm−1处-OH特征峰的强度小于原玉米淀粉,这是因为原玉米淀粉上部分-OH被取代而减少,且在1730 cm−1处均会出现一个新的特征峰且峰值明显,2882 cm−1处出现了微弱的亚甲基C-H吸收峰,此结果证明酯键的生成[29],且后者的酯键峰值大于前者。由此可以判定Novozym 435脂肪酶和CAL@AuNPs在该体系下均能催化油酸淀粉酯的合成。另外,对比油酸淀粉酯和原淀粉的红外谱图可以看出,油酸淀粉酯图谱中除了在1730 cm−1处出现酯键特征峰外,并没有出现其他特征峰,由此可以证明无其他副产物产生。但以游离的CAL为催化剂制备的产物红外图谱中并没有看到酯键的生成,说明该体系下CAL催化酯化反应的能力极弱甚至不能催化酯化反应的发生。因此选用Novozym 435脂肪酶和CAL@AuNPs进行后续实验。
2.2.6.2 核磁共振图谱分析
如图10所示为CAL@AuNPs催化生成油酸淀粉酯的核磁共振图谱,其中δ 3.3~5.6产生的吸收峰为淀粉分子中氢核的吸收峰。油酸淀粉酯在δ 3.3~5.6产生的吸收峰与淀粉产生的峰重叠,为淀粉中氢核的吸收峰。而δ 0.5~2.3范围内的峰为油酸上氢原子的吸收峰。在δ 6以后没有出现吸收峰,说明油酸淀粉酯中没有残留的油酸,这也进一步证明了用乙醇可以有效地除去未反应的油酸。因此,结合红外图谱可以判定本实验制备的CAL@AuNPs可以在微波条件下催化油酸与淀粉发生酯化反应制备油酸淀粉酯,且无其它副产物产生。
3. 结论
本研究制备了新型的固定化南极假丝酵母脂肪酶,并以此方式将AuNPs引入到微波辅助酶催化体系,有效提高了微波辅助脂肪酶催化油酸淀粉酯的合成效率。在单因素实验下得到CAL@AuNPs最佳制备条件为:纳米金添加量4 mL、粒径14 nm、反应温度40 ℃、反应时间6 h。微波辅助条件下,商品化固定化Novozym 435和本实验制备的CAL@AuNPs均可高效催化油酸淀粉酯的合成,且CAL@AuNPs的催化能力高于Novozym 435。微波条件下CAL@AuNPs催化油酸淀粉酯合成的最佳制备条件为:微波功率400 W、反应温度35 ℃、反应时间40 min、脂肪酶添加量5%(淀粉干基)、油酸添加量10 mL,此时取代度最高为0.0259。与商品化固定化Novozym 435相比,在微波条件下CAL@AuNPs催化活性较高,反应时间短,有效解决无溶剂体系下微波辅助脂肪酶催化效果差,微波辐射能利用率低的难题。但目前,无溶剂体系下CAL@AuNPs催化油酸淀粉酯合成的催化反应机制并不明确,纳米金是否具备催化活性仍需进一步探讨。
-
-
[1] MASINA N, CHOONARA Y E, KUMAR P, et al. A review of the chemical modification techniques of starch[J]. Carbohydrate Polymers,2016,157:1−11.
[2] OTACHE M A, DURU U R, ACHUGASIM O, et al. Advances in the modification of starch via esterification for enhanced properties[J]. Journal of Polymers and the Environment,2021,29(5):1365−1379. doi: 10.1007/s10924-020-02006-0
[3] OLTRAMARI K, MADRONA G S, ANDRÉ MONGE NETO, et al. Citrate esterified cassava starch: Preparation, physicochemical characterisation, and application in dairy beverages[J]. Starch-Stärke,2017,69(11-12):1−26.
[4] YAN H, LU Q. Physicochemical properties of starch-wheat germ oil complex and its effects on water distribution and hardness of noodles[J]. LWT,2020(135):1−7.
[5] ASHOGBON A O. Dual modification of various starches: Synthesis, properties and applications[J]. Food Chemistry,2020,342(11):1−38.
[6] AMARAWEERA S M, GUNATHILAKE C, GUNAWARDENE O, et al. Development of starch-based materials using current modification techniques and their applications: A review[J]. Molecules (Basel, Switzerland),2021,26(22):6880. doi: 10.3390/molecules26226880
[7] 聂卉, 闵玉涛, 李玉玲, 等. 阿魏酸淀粉酯制备与表征及其对馒头预发酵冷冻面团物化性质的影响研究[J]. 中国食品添加剂,2021,32(11):123−128. [NIE H, MIN Y T, LI L Y, et al. Effect of starch ferulate on physicochemical properties of prefermented frozen dough and steamed bread[J]. China Food Additives,2021,32(11):123−128. doi: 10.19804/j.issn1006-2513.2021.11.017 [8] ZHANG K, CHENG F, ZHANG K, et al. Synthesis of long-chain fatty acid starch esters in aqueous medium and its characterization[J]. European Polymer Journal,2019,119:136−147. doi: 10.1016/j.eurpolymj.2019.07.021
[9] WINKLER H, VORWERG W, WETZEL H. Synthesis and properties of fatty acid starch esters[J]. Carbohydr Polym,2013,98(1):208−216. doi: 10.1016/j.carbpol.2013.05.086
[10] SN A, RV A, AD B, et al. Ultrasound-assisted enzymatic synthesis of xylitol fatty acid esters in solvent-free conditions[J]. Ultrasonics Sonochemistry,2021,7(75):1−8.
[11] ALLANA C N, GOMES Q C, LÚCIO C M, et al. Enzymatic kinetics of cetyl palmitate synthesis in a solvent-free system[J]. Biochemical Engineering Journal,2018,137:116−124. doi: 10.1016/j.bej.2018.05.021
[12] HORCHANI H, CHAÂBOUNI M, GARGOURI Y, et al. Solvent-free lipase-catalyzed synthesis of long-chain starch esters using microwave heating: Optimization by response surface methodology[J]. Carbohydrate Polymers,2010,79(2):466−474. doi: 10.1016/j.carbpol.2009.09.003
[13] 王艳, 高鹏, 辛嘉英, 等. 纳米金辅助微波耦合脂肪酶催化阿魏酸淀粉酯的合成[J]. 食品研究与开发,2018,39(24):1−6. [WANG Y, GAO P, XING J Y, et al. Gold nanoparticles assisted microwave coupling lipase catalyzed synthesis of ferulic acid starch ester[J]. Food Research and Development,2018,39(24):1−6. doi: 10.3969/j.issn.1005-6521.2018.24.001 [14] 石佳. 微波辅助脂肪酶催化合成油酸淀粉脂的研究[D]. 哈尔滨: 哈尔滨商业大学, 2014. SHI J. Study on lipase-catalyzed esterification of starch using oleic acid under microwave[D]. Harbin: Harbin University of Commerce, 2014.
[15] 王艳, 赵宁, 王悦, 等. Mb耦合脂肪酶生物传感器差分脉冲伏安法对Cu~(2+)的检测[J/OL]. 食品科学, 1−12 [2022-04-19]. http://kns.cnki.net/kcms/detail/11.2206.TS.20210913.1057.020.html WANG Y, ZHAO N, WANG Y, et al. Detection of Cu2+ by mb-coupled lipase biosensor with differential pulse voltammetry[J/OL]. Food Science: 1−12 [2022-04-19]. http://kns.cnki.net/kcms/detail/11.2206.TS.20210913.1057.020.html
[16] 王艳. 中长链脂肪酸淀粉酯的酶法合成及其性质研究[D]. 哈尔滨: 哈尔滨商业大学, 2013. WANG Y. Study on enzymatic synthesis and properties of middle long chain fatty acid starch ester[D]. Harbin: Harbin University of Commerce, 2013.
[17] 王艳, 辛嘉英, 石佳, 等. 微波辅助酶促月桂酸淀粉酯的合成[J]. 分子催化,2014,28(1):67−74. [WANG Y, XIN J Y, SHI J, et al. Lipase-catalyzed esterification of starch using lauric acid under microwave[J]. Journal of Molecular Catalysis (China),2014,28(1):67−74. doi: 10.16084/j.cnki.issn1001-3555.2014.01.010 [18] CABELLO G, DAVOGLIO G A, LUIS G. The role of small nanoparticles on the formation of hot spots under microwave-assisted hydrothermal heating[J]. Inorganic Chemistry: A Research Journal that Includes Bioinorganic, Catalytic, Organometallic, Solid-State, and Synthetic Chemistry and Reaction Dynamics,2018,57(12):7252−7258.
[19] 张宏迪. 纳米金杂化脂肪酶催化拆分反应研究[D]. 哈尔滨: 哈尔滨商业大学, 2020. ZHANG H D. Study on the lipase-gold nanoparticles hybridase-catalyzed resolution reaction[D]. Harbin: Harbin University of Commerce, 2020.
[20] 王致禹, 陈晓倩, 孟庆凤, 等. 有机溶剂和混合油脂对脂肪酶活性恢复的影响[J]. 中国食品学报,2021,21(2):55−62. [WANG Z Y, CHEN X Q, MENG Q F, et al. Effect of organic solvents and mixed oils on the recovery of lipase avity[J]. Journal of Chinese Institute of Food Science and Technology,2021,21(2):55−62. doi: 10.16429/j.1009-7848.2021.02.007 [21] 敖敦格日乐, 杨体强, 包斯琴高娃, 等. 电场对脂肪酶二级结构及其活性的影响[J]. 食品与生物技术学报,2015,34(12):1256−1261. [AO D G R L, YANG T Q, BAO S Q G W, et al. Study on the effect of electric field on the secondary structure and activity of lipase[J]. Journal of Food Science and Biotechnology,2015,34(12):1256−1261. doi: 10.3969/j.issn.1673-1689.2015.12.004 [22] UPPENBERG J, HANSEN M T, PATKAR S, et al. The sequence, crystal structure determination and refinement of two crystal forms of lipase B from Candida antarctica[J]. Structure,1994,2(4):293−308. doi: 10.1016/S0969-2126(00)00031-9
[23] LUKASIEWICZ M, KOWALSKI S. Low power microwave-assisted enzymatic esterification of starch[J]. Starch Stä rke,2011,64(3):188−197.
[24] REJASSE B, BESSONEN T, LEGOY M D, et al. Influence of microwave radiation on free Candida antarctica lipase B activity and stability[J]. Organic & Biomolecular Chemistry,2006,4(19):3703−3707.
[25] SRI KAJA B, LUMOR S, BESONG S, et al. Investigating enzyme activity of immobilizedCandida rugosa lipase[J]. Journal of Food Quality,2018,4(19):1−9.
[26] 孙纯锐. 硬脂酸淀粉酯的制备及其性质研究[D]. 济南: 齐鲁工业大学, 2016. SUN C Y. The study of preparation and roperties of starch stearate[D]. Jinan: Qilu University of Technology, 2016.
[27] 高鹏. 好食脉孢菌发酵麸皮制备游离阿魏酸及其改性研究[D]. 哈尔滨: 哈尔滨商业大学, 2020. GAO P. Study on the preparation and modification of free ferulic acid from fermentation bran of neurospora fastidious[D]. Harbin: Harbin University of Commerce, 2020.
[28] 金子. 毕赤酵母细胞展示的CALB脂肪酶的表征及非水相催化特性研究[D]. 广州: 华南理工大学, 2013. JIN Z. Characterization and catalytic properties of Candida antarctica lipase B- displaying Pichia pastoris cells in non-aqueous phase[D]. Guangzhou: South China University of Technology, 2013.
[29] KAPUSNIAK J, SIEMION P. Thermal reactions of starch with long-chain unsaturated fatty acids. Part 2. linoleic acid[J]. Journal of Food Engineering,2007,78(1):323−332. doi: 10.1016/j.jfoodeng.2005.09.028
-
期刊类型引用(1)
1. 张涛,周芷夷,邓文奇,张婷,马杰,王艺诺,于俊飞,周建中. 苦杏仁多肽/壳聚糖复合膜的制备及其对奶酪的保鲜效果. 食品与发酵工业. 2025(06): 232-238 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:











 下载:
下载:



