Research Progress in Glucose Enzyme-free Rapid Detection Technology
-
摘要: 葡萄糖的检测在食品与医疗行业中尤为重要,电化学无酶检测与可视化检测因其测量快、便捷、操作简单而广泛应用于食品工业、生物检测、医疗卫生等领域,并成为研究人员关注的热点。本文综述了国内外的葡萄糖无酶快检技术,对无酶葡萄糖传感技术的研究进展进行了总结,其中,构建模拟酶技术在电化学与可视化检测中均得到了广泛研究,讨论了它们在临床医学与食品分析葡萄糖检测中的应用,并对葡萄糖无酶检测技术的未来研究方向进行了展望,为后续开发研究及在医疗和农业行业应用提供了理论依据。Abstract: Glucose detection is particularly important in the food and medical industry. Electrochemical enzyme-free detection and visual detection are widely used in the food industry, biological detection, medical and health and other fields because of its fast, convenient measurement and simple operation. And it has become a hot topic for researchers. This paper summarizes the technology of enzyme-free fast glucose detection at home and abroad. The research progress of enzyme-free glucose sensing technology is reviewed. And the application of these technology is discussed. Among them, the construction simulation enzyme technology in the electrochemical and visual detection are extensive research, discusses their application in clinical medicine and food analysis glucose detection, and the future of glucose enzyme-free detection technology research direction is prospected, for the subsequent development research and application in medical and agricultural industry provides a theoretical basis.
-
葡萄糖是常见的有机化合物,更是人体所需的重要能源物质。作为血糖含量的重要指标,其含量的变化通常伴随着人体一些疾病的产生;作为糕点、饮料及营养品等食品加工工业中的主要营养成分,其含量的变化又是检测食物质地风味的重要指标[1]。因此,葡萄糖检测在食品工业、医疗健康、生物监测等领域均具有非常重要的意义[2]。目前,葡萄糖的检测方法主要有荧光色谱法、比色法和电化学法等。其中,电化学检测和比色法因其测量快、便捷、操作简单而备受关注[3]。
近年来,电化学无酶检测与可视化检测成为了研究人员研究的热点。电化学酶基葡萄糖检测传感器需要将天然酶固定到电极上,而天然酶价格较昂贵、保存条件苛刻、在过酸、过碱条件下容易失活、不易保存;另外,固定化步骤也较为繁琐,不稳定,使用寿命较短,并且酶基葡萄糖传感器在制造、储存和使用过程中很难不发生热变性或化学反应[4]。而无酶葡萄糖传感器是一种基于葡萄糖分子的电催化氧化,是在相关催化活性材料表面上直接发生的,依据反应信号对其进行定性及定量检测的传感装置[5]。可视化无酶检测分为比色传感检测和荧光传感检测,利用模拟酶催化葡萄糖氧化的过氧化氢与显色底物或荧光染料发生反应,引起的颜色或荧光强度的变化来判断葡萄糖浓度。本文综述了国内外的葡萄糖无酶快检技术,对无酶葡萄糖传感技术的研究进展进行了总结,并讨论了他们在葡萄糖检测中的应用。
1. 基于电化学的葡萄糖无酶快速检测
电化学无酶型葡萄糖传感器检测过程不受天然酶的限制,而是借助传感器具有的模拟酶活性实现对葡萄糖的检测。该方法具有成本低、制备过程简单、反应迅速、检测限低、稳定性高、良好重现性等优点[4]。下述将围绕酶促反应和非酶促反应对无酶型葡萄糖传感器进行介绍。
1.1 基于酶促反应机制的葡萄糖无酶快速检测
1.1.1 通过葡萄糖氧化酶模拟酶实现葡萄糖的无酶快速检测
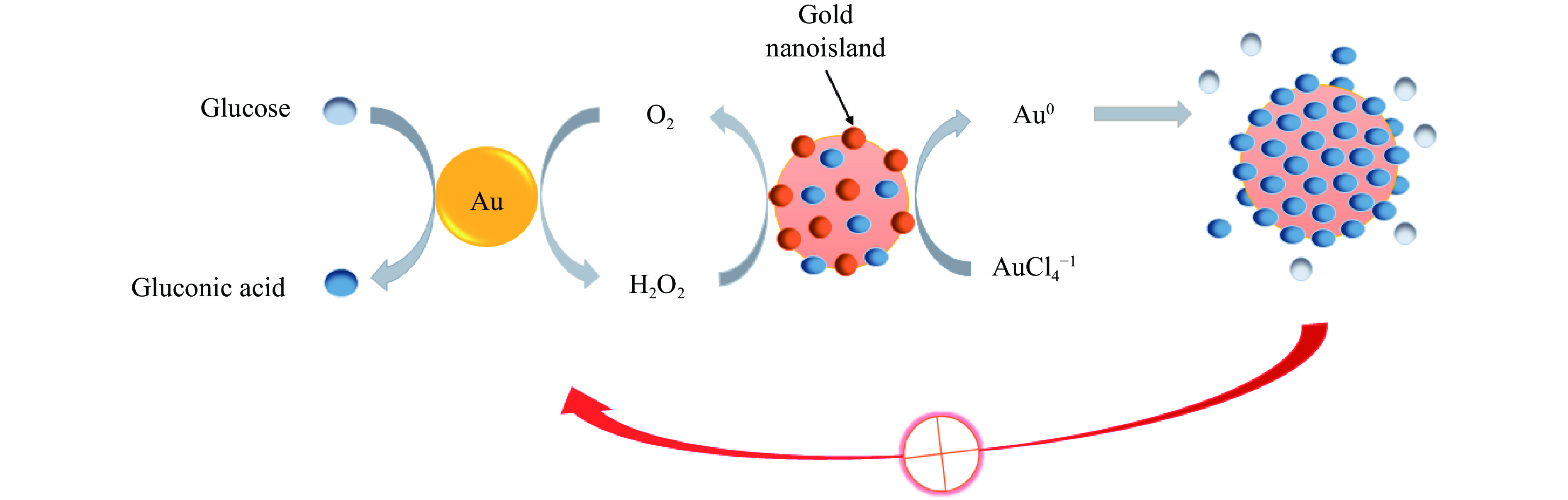
葡萄糖氧化酶(GOD)是葡萄糖生物传感器研究中应用最广泛的一种酶,是一种特征明确的糖蛋白,由2个相同的亚基与2个黄素腺嘌呤二核苷酸(FAD)辅酶结合而成[6]。GOD可以催化D-葡萄糖(C6H12O6)氧化为D-葡萄糖酸(C6H12O7)和过氧化氢(H2O2),反应过程中消耗氧,可用电极测出氧电流变化值,根据氧电流变化值与葡萄糖之间的线性关系从而实现对葡萄糖的高度特异性检测。但由于葡萄糖氧化酶的固定化过程复杂费时且不稳定、成本较高,近年来许多研究者便开发了模拟葡萄糖氧化酶活性的催化材料,旨在避免GOD的弊端。Luo等[7]发现AuNPs具备葡萄糖氧化酶活性,因为AuNPs能够在过氧化氢酶不存在的情况下,催化氧化葡萄糖生成葡萄糖酸(Gluconic acid)和H2O2,并且发现其催化葡萄糖的机理与天然GOD相似,并且证明了AuNPs的大小、催化活性受多种因素的影响,包括催化反应条件、AuNPs的扩大、AuNPs的表面钝化;除AuNPs自身的特性具备葡萄糖氧化酶活性外,尺寸效应也是影响AuNPs活性的因素之一。他们将AuNPs作为原料和催化剂,葡萄糖和O2作为酶的底物,HAuCl4作为反应物,AuNPs首先催化葡萄糖氧化反应,原位生成的产物H2O2将HAuCl4还原为Au0,Au0以纳米岛(Gold nanoisland)的形式沉积在AuNP种子上,导致AuNPs逐渐增大,抑制了葡萄糖氧化过程,如图1所示。因此发现粒径较小的AuNPs类葡萄糖氧化酶活性也较好,此结论在其他实验中也得到证实[8]。
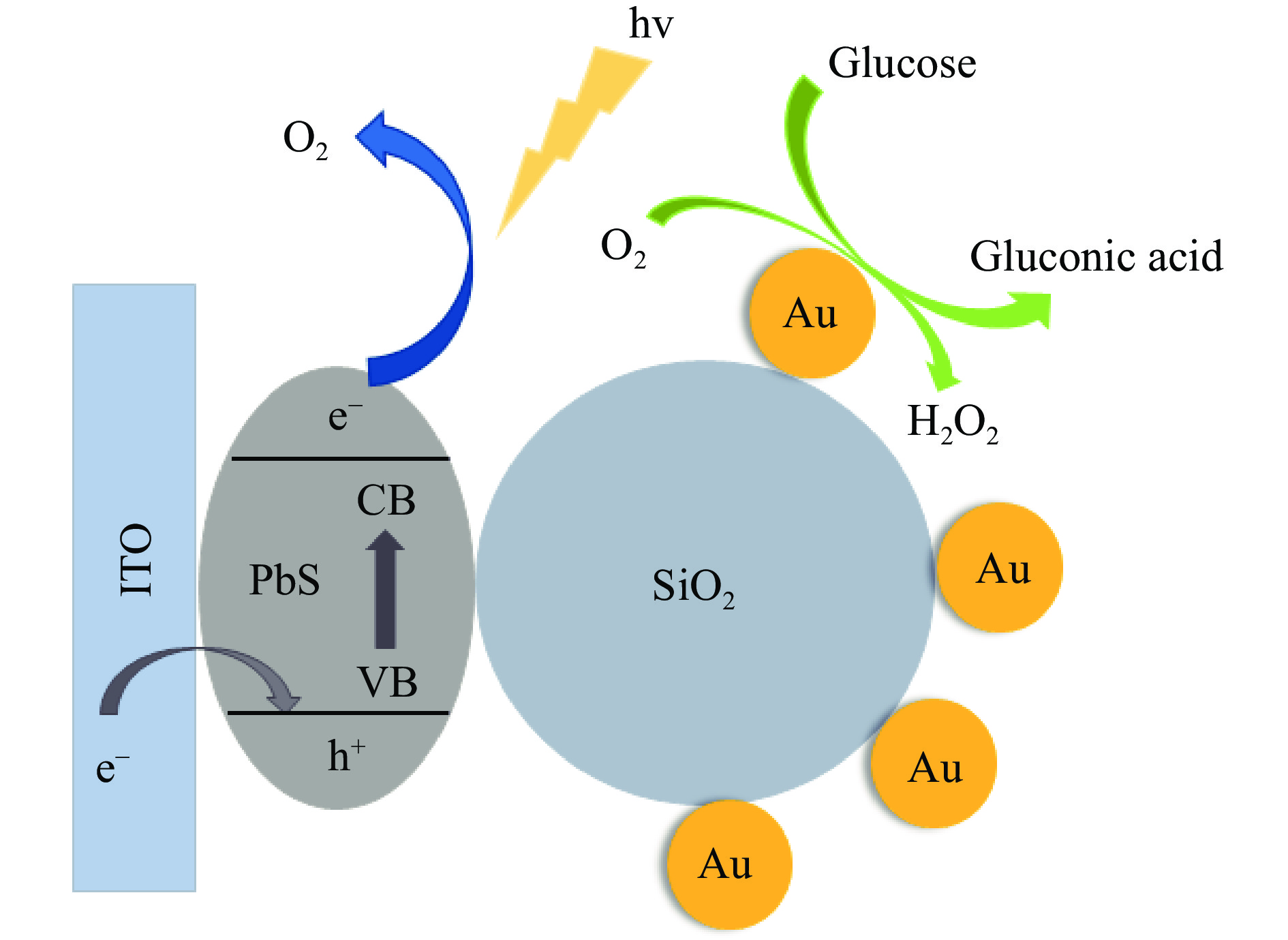
基于小粒径AuNPs有类葡萄糖氧化酶活性的特性,Cao等[9]以AuNPs为核心构建了ITO/PbS/SiO2/AuNPs葡萄糖模拟酶光电化学(PEC)传感器。铋锡氧化物电极(ITO)的表面采用多层PbS量子点(PbSQD)制造,可产生有效的光电流响应。使用小的AuNPs作为GOD模拟酶,使葡萄糖催化氧化产生葡萄糖酸和H2O2,H2O2在三电极体系中发生氧化还原反应,并释放氧气。在PbS和AuNPs层之间插入隔离的SiO2纳米微球(SiO2Ns)可以有效地降低基极电流并提高检测极限(如图2)。结果表明,该纳米酶生物传感器可以替代天然酶,成功地应用于葡萄糖的光电化学(PEC)检测。以上研究都是直接利用AuNPs构建无酶葡萄糖传感器,而关桦楠等[10]发现多种废弃果壳中都可以提取出AuNPs,于是利用柑橘提取液制备了AuNPs,结合天然聚谷氨酸(PGA)绿色还原法制备Fe3O4-PGA微粒,并通过一步自组装法制备具了核壳结构的新型金磁微粒(Fe3O4-PGA@Au)。利用循环伏安法(CV法)评价了Fe3O4-PGA@Au在电化学体系下检测葡萄糖的性能。结果表明,电极表面的金磁微粒能代替葡萄糖氧化酶催化氧化葡萄糖水解产生葡萄糖酸和H2O2,利用电化学系统中产生的氧化还原峰信号值与葡萄糖浓度之间的线性关系实现对葡萄糖的快速检测。除使用AuNPs构建无酶葡萄糖检测传感器外,Li等[11]发现了Co,N共掺杂HPC(Co,N-HPC)也具备类葡萄糖氧化酶的活性。通过一步法直接热解ZIF-67前驱体制备Co,N-HPC,ZIF-67既可以作为模板,又可以作为富氮碳源,Co,N-HP的高比表面积和分层孔有助于溶解氧快速扩散到催化活性位点,从而产生新型高效的Co,N-HPC氧化酶纳米酶,利用此纳米酶结合电化学传感器,也可以高效地应用于葡萄糖的无酶检测中。
1.1.2 通过过氧化物模拟酶实现葡萄糖的无酶快速检测
随着纳米技术的高速发展,许多纳米材料已被证实具有类过氧化物酶活性,同时一些复合纳米材料展现出更优良的模拟酶活性。Cao等[12]合成了氧化铁纳米线阵列,并对其进行了电化学表征,证明了纳米氧化铁具有类过氧化物酶的催化活性,是一种理想的电极材料,在没有葡萄糖氧化酶的作用下纳米线也可以检测血清中葡糖糖的含量。Zhang等[13]通过电子顺磁光谱证明了CoFe2O4MNPs能有效催化H2O2分解产生诱导鲁米诺产生化学发光的羟基自由基,此结果证明了CoFe2O4MNPs的过氧化物模拟酶的催化机理。最后,利用CoFe2O4MNPs的过氧化物模拟酶的催化活性建立了一种测定雨水中H2O2和血清样品中葡萄糖的新方法。Li等[14]在半胱胺存在下,四氯金酸氢(III)与硼氢化钠还原合成了(+)AuNPs。制备的AuNPs由于吸附了带正电荷的半胱胺-NH3+基团,其电位为正。通过测试H2O2存在下过氧化物酶底物3, 3’, 5, 5’-四甲基联苯胺(TMB)的催化氧化活性,证实了(+)AuNPs具有过氧化物酶活性,通过偶联GOD模拟酶催化葡萄糖氧化,进一步建立了葡萄糖的定量分析方法。张雪红[15]基于水溶性的柠檬酸盐稳定的AuNPs的类葡萄糖氧化酶活性以及脂溶性的四氧化三铁纳米颗(Fe3O4NPs)的类过氧化物酶活性,将脂溶性的Fe3O4NPs封装在脂质体的双分子夹层,水溶性的AuNPs则被包封在水相的闭合囊泡中组成一个闭合的多酶体系。构建了同时具有葡萄糖氧化酶-过氧化物酶(GOD-POD)活性的脂质体多酶体系用于葡萄糖的一步检测。
1.2 基于非酶促反应机制的葡萄糖无酶快速检测
为了弥补天然酶的缺点,如价格昂贵、不易保存、固定化不稳定等,特别是在极端环境中酶功能的丧失,非酶促葡萄糖传感器是一种很有必要的替代方法。其原理在于将功能性纳米材料修饰在电化学三电极体系中的工作电极上,代替天然酶催化氧化葡萄糖,该过程发生氧化还原反应的同时会产生电信号,该信号通过电化学工作站传出,经过数据处理后方可得出葡萄糖的含量。而金属[16]、金属合金[17]、金属硫化物[18]、金属氮化物[19]、金属氧化物[20-21],因其在中性和碱性环境下具有催化葡萄糖氧化的能力而被关注。其中,金属氧化物因其比金属或金属合金具有更好的稳定性和易接近性,在电化学葡萄糖检测中受到了推崇[16-17]。
1.2.1 利用金属氧化物实现葡萄糖的无酶快速检测
1.2.1.1 铜氧化物
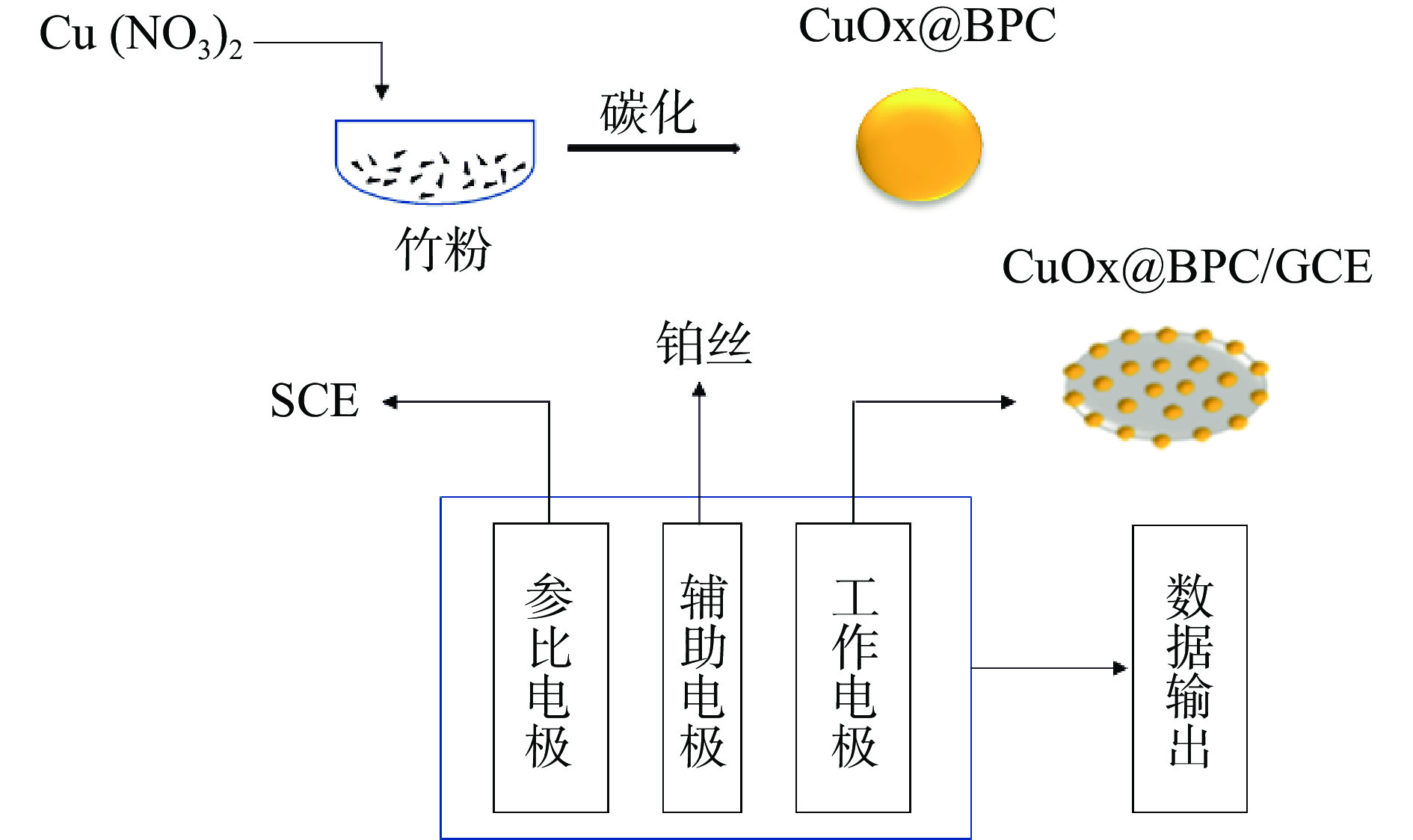
氧化铜(CuO)天然丰富,生产成本低,具有良好的电化学和催化性能,是电气、光学器件、多相催化、磁性存储介质、气体传感器和锂离子电极等的最佳材料之一。与铜元素相比CuO纳米材料在电分析中具有较高的稳定性,因而,被作为葡萄糖传感器的电极也得到了广泛的认可[22]。刘东等[23]将竹粉分散于硝酸铜溶液中,经静置、过滤、干燥后高温碳化,制备了氧化亚铜/铜/生物质多孔碳复合材料(CuOx@BPC),采用循环伏安法、安培时间法研究其对葡萄糖非酶检测的电化学性能,证实了CuOx@BPC/GCE电化学性能优良,且基于其构建的传感器对葡萄糖展现出良好的检测性能(如图3)。
随着葡萄糖无酶检测技术的快速发展,一系列CuO纳米材料也被广泛设计和合成,以增强其在葡萄糖传感器中的内在特性和性能,包括纳米盘[24]、纳米花[25]、纳米线[26]和纳米棒[27]等。见表1,特殊的多孔泡沫状CuO微纳米纤维能够增大电极比表面积从而提高与葡萄糖的反应活性[28],但灵敏度较低;相比之下,饼干状CuO、CuO纳米盘、CuO@C/AuNPs灵敏度相对提高,线性范围宽;CuO纳米花、CuO-PANI、CuO/Cu2O/SnO2纳米棒的灵敏度最高,CuO/Cu2O/SnO2纳米棒与莠草状CuO/Cu2O纳米线相比,由于SnO2的复合,加强了电子的迁移率,进而加快了电极与葡萄糖分子之间的电子传输速度。上述纳米材料的结构具有小尺寸效应、表面与界面效应,该效应可有效增加电极的导电性,增强电子的转移。此外,纳米材料的比表面积较大,且无毒副作用,具有良好的生物相容性、耐腐蚀性。
表 1 CuO基非酶促葡萄糖传感器性能Table 1. CuO-based non-enzymatic glucose sensor performance电极材料 灵敏度
(µA mmol−1cm−2)线性范围
(mmol/L)检出限
(µmol/L)缓冲溶液 参考文献 CuO纳米盘/SPCE 627.3 0.002~2.5 0.2 0.1 mol/L KOH [24] Cu3(BTC)2-衍生CuO 1523.5 <1.25 1 0.1mol/L NaOH [29] CuO纳米花/GCE 2634.4 5×10−4~2.67 0.26 0.05 mol/L NaOH [25] CuO-PANI 2800 2.5×10−4~0.28 0.24 0.1mol/L NaOH [30] -NF/FTO 1359 0.28~4.6 CuO饼干状/SPCE 308.7 0.0005~4.03 0.1 0.1 mol/L NaOH [31] 3D-KSC/CuO @C/AuNPs 935 3.71×10−3~8.5 1.22 0.1 mol/L NaOH [32] CuO/MoS2 1055 0.1~10 − 0.1 mol/L NaOH [33] 莠草状 1281 0.05~2.0 16.7 0.1 mol/L NaOH [34] CuO/Cu2O纳米线 CuO/Cu2O/SnO2纳米棒 2043 0.05~2.0 16.7 0.1 mol/L NaOH [27]
多孔泡沫状CuO
6.17
<1
65.3
0.1 mol/L NaOH
[35]注:−表示参考文献中作者未标注线性范围、检出限,表示未检出明确的范围与检出限,表2、表3同。 1.2.1.2 钴氧化物
钴氧化物是应用于无酶葡萄糖传感器的一类主要金属氧化物,有三种常见的形态:氧化钴(CoO)、三氧化二钴(Co2O3)和四氧化三钴(Co3O4)。对于非酶促葡萄糖传感,Co3O4由于其成本低、环境友好、相对良好的导电性和电催化性能,已被多项研究证明是一种有前途的材料,应用于许多领域[21,36],见表2。Co3O4微薄片灵敏度较低,线性范围窄,但电极使用Co3O4微薄片修饰的电极表现出良好的重现性和稳定性,能够循环扫描1000次,多孔Co3O4纳米板同样具有良好的稳定性;Co3O4纳米颗粒均匀嵌入3D多孔激光诱导石墨烯(Co3O4NPs-LIG)电极因具有多个高活化位点显示出优异的导电性,可以增强电荷转移,从而提高葡萄糖传感性能;针状Co3O4纳米阵列线性范围广泛,灵敏度高,具有较高的催化活性,均受益于密集排列和独立的具有大表面积的Co3O4纳米针;Co-Co3O4/碳纳米管/碳泡沫(Co-Co3O4/CNT/CF)纳米复合材料中的Co3O4纳米粒子生长在CF的外部,而CNTs大量地生长在CF的表面,这大大提高了碳纳米管的电导率,使该电极具有较宽的线性范围;Co3O4/Au、Au@Co3O4-S因结合了Au纳米材料灵敏度大大提高,扩宽了线性范围。
表 2 Co3O4基非酶促葡萄糖传感器性能Table 2. Co3O4-based non-enzymatic glucose sensor performance
电极材料灵敏度
(µA mmol−1cm−2)线性范围
(mmol/L)检出限
(µmol/L)
缓冲溶液
参考文献Co3O4微薄片 339.5 <0.22 — 0.1 mol/L KOH [36] Co3O4NPs-LIG 214 1×10−3~9 0.41 0.1 mol/L NaOH [21] 针状Co3O4/柔性碳布 2591.6 2×10−3~1.0 0.23 0.1 mol/L NaOH [37] 271.2 1.0~10 多孔Co3O4纳米板 212.92 0.05~3.2 2.7 0.1 mol/L NaOH [38] Co-Co3O4/CNT/CF 637.5 1.2×10−3~2.29 0.4 0.1 mol/L NaOH [39] Co3O4/Au 4470.4 2×10−3~2.11 0.085 0.1 mol/L NaOH [40] Au@Co3O4-S 1127.3 2×10−4~3.1 0.09 0.1 mol/L NaOH [41] 1.2.1.3 镍氧化物
NiO具有低毒性、天然丰度、低成本、良好的电化学活性和稳定性,是无酶葡萄糖传感器极有希望的电极材料。葡萄糖在NiO修饰电极上的电化学氧化是基于NiO衍生的Ni(OH)2/NiOOH的氧化还原对,类似于镍基电极。见表3,Ni/NiO/NG的灵度低,但具有较宽的线性范围,并且展现出出色的选择性、良好的重现性和长期稳定性;Au@NiO纳米管中Au具有双功能效应,能够增加电荷转移并充当葡萄糖氧化的直接催化剂,使传感器具有高的灵敏度和宽的线性范围;利用火焰合成法在碳布上合成的NiO纳米颗粒,具有高的灵敏度,响应时间迅速,短至3 s;NiO/FTO、NiO@CF、NiONC-rGO/GCE和NiO/碳多孔复合材料的设计原理基于特殊的结构以及丰富的活性位点,旨在增大电极的比表面积,提高灵敏度;使用掠射角沉积(GLAD)技术在镍箔上制造纳米结构的NiO电极显示出较高灵敏度和卓越的检测范围,具有理想的选择性和重现性。
表 3 NiO基的非酶促葡萄糖传感器性能Table 3. NiO-based non-enzymatic glucose sensor performance
电极材料灵敏度
(µA mmol−1cm−2)线性范围
(mmol/L)检出限
(µmol/L)
缓冲溶液
参考文献
NiO纳米结构/镍板
206.9
0.1~10
1.160.1 mol/L KCl
0.5 mol/L NaOH
[42]Ni/NiO/NG 3.2518 1×10−3~3.568 0.032 0.1 mol/L NaOH [43] Au@NiO 5536.2 1×10−3~6 0.25 0.1 mol/L NaOH [44] NiO/FTO 2632.53 5×10−3~0.825 0.084 0.1 mol/L NaOH [45] NiO-PPy/GCE 1094.8
62.90.01~0.5
1~205.8 0.1 mol/L PBS [46] NiO@CF 878.6 — 0.37 0.1 mol/L KOH [47] NiO/CC 5752 6×10−3~2 7.45 0.1 mol/L NaOH [48] NiO NC-rGO/GCE 4254 0.5~20 0.079 0.1 mol/L NaOH [49] NiO/碳多孔复合材料 2918.2 5×10−3~4.1 0.92 0.1 mol/L NaOH [50] NiO/PMB/GCE 413.06 3×10−3~0.8 2.1 0.1 mol/L NaOH [51] GLAD NiO 4400 5×10−4~9 — 0.1 mol/L NaOH [52] 1.2.1.4 其他金属氧化物
ZnO是II-VI族半导体的重要成员,具有较大的孔隙,由于其纳米结构的多样性、高电子迁移率、化学稳定性、电化学活性和高等电点,是制备酶生物传感器的一个有吸引力的候选材料[53]。MnO2材料具有低电导率,生物相容性和压电性能,能够促进酶的吸附,因此最大限度地利用MnO2设计出具有高导电性的纳米结构是实现MnO2基电极材料的一项热门研究[54]。其中,包括MnO2与其他金属及氧化物材料复合材料,如MnO2与Ni、CuO、Co3O4等[55-56]。除上述金属氧化物外,其他几种化合物也被探索作为电催化剂,在无酶葡萄糖传感器中有潜在的应用,Fe3O4的纳米棒、纳米管、纳米花以及磁性粒子等材料电化学活性强,具有良好的电催化性能、热稳定性和操作稳定性[57],TiO2材料成本低,毒性弱,稳定性强,催化活性强,近年来常被作用于制备电极用于葡萄糖的检测[58]。以上的研究都能够证明金属氧化物能够作为天然酶的替代方法实现非酶促机制的葡萄糖无酶快速检测。
1.2.2 利用金属及合金复合材料实现葡萄糖的无酶快速检测
对葡萄糖的氧化具有电催化活性并可用于葡萄糖测定的金属修饰电极材料有铂、金、铱、铑、钌、铜、钴和镍等[16]。纳米结构的金属因其极小的特征尺寸而受到人们的广泛关注,与体积金属相比,纳米结构金属表现出优异的性能,从而适用于广泛的应用,并且纳米结构金属在电化学传感中的应用也越来越受欢迎。纳米结构Au因其独特的光学、物理和催化性能,在生物应用和生物传感方面引起了极大的兴趣。同时,越来越多的研究也致力于钯和碳纳米材料的纳米杂化,如石墨烯和碳纳米管(CNTs),由于这些材料提高了对葡萄糖氧化的灵敏度和选择性,在非酶促葡萄糖传感中有很大的前景。尽管许多材料可以在不需要GOD的情况下成功氧化葡萄糖,但它们大多数在生理pH下不起作用,而是在更高的pH下具有电活性。铂基和金基纳米材料在生理pH条件下能够催化葡萄糖的电化学氧化。Wang等[59]通过微波水热合成海胆状CuO,随后在HAuCl4和NaBH4存在下自生酸蚀刻海胆状CuO,制备了具有二维纳米材料特性和优异葡萄糖传感性能的花状CuO/Au纳米颗粒,在酸蚀刻后,Au纳米颗粒均匀分布在CuO纳米薄片的表面,该电极显示出更高的比表面积、导电性能和催化活性。随着金属材料的深入研究,合金复合材料也不断涌出,人们发现复合材料的形成不仅经济,而且通过在具有高导电性和大表面积的基材上均匀分布纳米粒子,可使电催化活性最大化。Wang等[16]将Pt和Ni层被溅射在基板上,然后退火形成双金属PtNi材料,作为葡萄糖检测的敏感材料,具有较高的灵敏度,用于检测人体血清中的葡萄糖含量。因此,金属及合金复合材料可以作为一种基于非酶促机制的葡萄糖无酶快速检测方法。
2. 基于颜色反应实现葡萄糖的无酶快速检测
可视化葡萄糖传感器是以颜色变化为分析基础,通过裸眼观察或使用分光光度计,直接或间接实现对引起颜色变化的现象进行定性、定量检测。可视化葡萄糖传感器不需要复杂和昂贵的设备,并且可用于即时诊断和现场分析[60]。
2.1 利用非荧光染料实现葡萄糖的无酶颜色反应快速检测
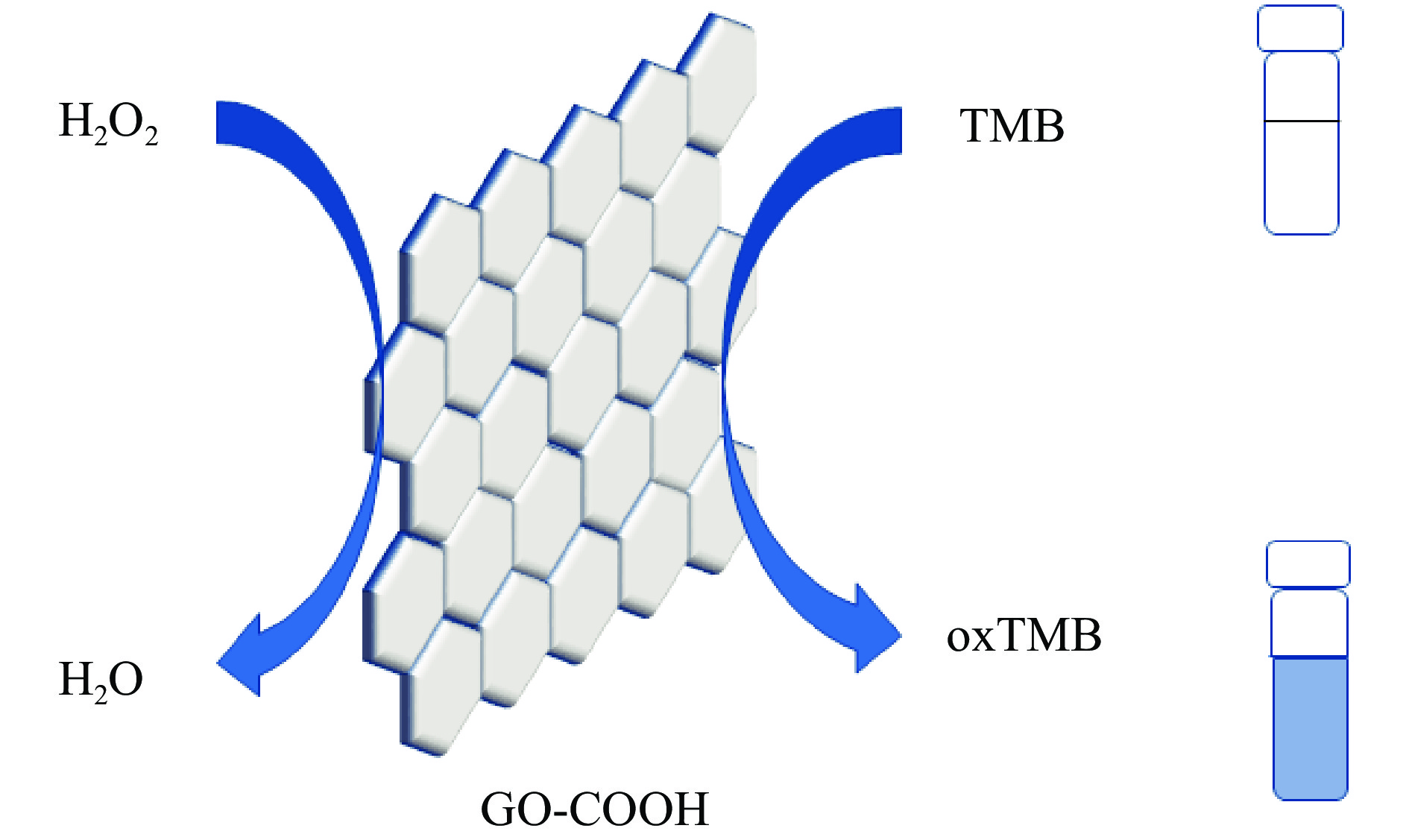
利用非荧光染料检测的原理是基于目标物和传感探针之间的特定化学反应迅速引起的颜色信号来对目标物检测分析的。在葡萄糖检测中,通常利用过氧化物酶底物3, 3', 5, 5'-四甲基联苯胺(TMB)与H2O2发生化学反应,引起底物的颜色发生改变,通过肉眼直接观察溶液颜色变化,从而快速大致区分葡萄糖浓度。同电化学无酶葡萄糖传感器类似,许多金属及金属氧化物(纳米材料)可以模拟过氧化物酶活性,与非荧光染料底物联用实现葡萄糖可视化快速检测。李甜等[61]构建了一种基于纳米金银染放大的可视化葡萄糖传感器。采用柠檬酸钠还原法制备了纳米金(酒红色)。加入葡萄糖时,托伦试剂被还原为单质Ag沉积在纳米金的表面,形成Au-Ag核壳型纳米颗粒,使溶液的吸收光谱发生蓝移,颜色由酒红色变为黄色。测量430 nm处的吸光度,从而得出葡萄糖浓度。AuNPs催化氧化葡萄糖生成H2O2,H2O2继续溶解腐蚀纳米银(AgNPs),引起AgNPs紫外吸光度的改变,基于此原理制备的无酶葡萄糖比色传感器用于测定葡萄糖[62]。杨敏等[63]构建出Fe3O4@SiO2@IL结构体,其具有比辣根过氧化物酶更高的催化活性,并能催化H2O2与过氧化物酶底物TMB形成蓝色产物,用于葡萄糖的比色检测。Huang等[64]报道了AuNPs结合金属卟啉MOFs作为双酶串联催化体系比色检测葡萄糖。使AuNPs在二维金属卟啉MOFs纳米片上生长,得到具有过氧化物模拟酶活性的AuNPs/Cu-TCPP(M)复合材料。而AuNPs又具有类葡萄糖氧化酶活性,所以该复合材料能够用于葡萄糖比色检测。吴科研等[65]通过共沉淀法制备了Fe3O4磁性纳米粒子,并发现其具有过氧化酶活性,Fe3O4磁性纳米粒子能够在H2O2存在的情况下氧化2,2-联氮-双-3-乙基-苯并噻唑-6-磺酸二铵盐生成有色产物。Ganganboina等[66]采用快速沉淀法制备的水溶性纳米CuO,可用作过氧化物酶的纳米模拟物,建立了H2O2和葡萄糖的比色检测方法。这些CuO纳米粒子相当稳定,在很宽的pH和温度范围内具有几乎不变的催化活性。除金属及金属氧化物基模拟酶外,Qu等[67]发现GO-COOH也具有内在的过氧化物模拟酶活性,能催化H2O2氧化辣根过氧化物酶底物TMB,生成蓝色氧化产物(如图4)。建立了简便、便宜、高灵敏和高选择检测血清和果汁中葡萄糖的新方法。Wei等[68]成功制备的六边形状的Co-Al LDH也表现出过强的过氧化物酶活性,他们用L-天冬酰胺作为剥离剂将Co-Al LDH成功剥离,与未剥离的LDH相比,剥离之后的Co-Al LDH表现出更强的过氧化物模拟酶活性,由此构建了灵敏、快速的定量检测H2O2和葡萄糖比色分析平台。为了验证该检测平台的实用性,将其进一步应用于果汁中葡萄糖浓度的检测,展现出良好的选择性和稳定性。以上研究均利用非荧光染料实现了对葡萄糖的无酶快速检测,与电化学无酶葡萄糖传感器比较,具有可见可控的优点。
2.2 利用荧光染料实现葡萄糖的无酶颜色反应快速检测
荧光染料葡萄糖无酶检测法是利用荧光团供体到受体的共振能量转移,共振能量转移依赖于供体和受体之间的距离,模拟酶与荧光供体之间的共振能量转移导致荧光猝灭,这种猝灭机制使发光生物传感器获得高信噪比,荧光强度改变,根据变化后的荧光强度与葡萄糖浓度的线性关系实现葡萄糖的无酶检测。同时,荧光与比色联用,通过颜色和荧光强度的变化反映葡萄糖的浓度,实现了荧光染料葡萄糖无酶可视化检测。Kuo等[69]以HAuCl4的柠檬酸盐溶液为原料合成了含有Au纳米颗粒的溶液,然后再将含Ag+的溶液与其混合,制备了Ag-Au/AgCl纳米复合物。研究发现,所制备的Ag-Au/AgCl纳米复合物具有优异的类过氧化物酶和类氧化酶活性,在H2O2或O2存在时能催化荧光红染料(AR)在585 nm处产生强荧光强度。由此构建了一种基于H2O2/AR-Ag-Au/AgCl纳米复合物的传感平台。Liu等[70]建立了基于Au@Ag的双金属核壳纳米粒子(Au@AgNPs)和碳纳米点(C-dots)的双信号葡萄糖检测传感器。C-dots点作为该传感器的表面等离子体增强能量转移(SPEET)的供体,其荧光被Au@AgNPs的银壳(受体)淬灭,Au@AgNPs作为比色传感器,通过颜色和荧光的变化反应葡萄糖浓度(如图5)。Chen等[71]将荧光素酶生物发光蛋白(Rluc)与β-环糊精(β-CD)偶联。当AuNPs与β-CD共价结合时,AuNPs可猝灭Rluc的生物发光强度。加入葡萄糖时,AuNPs被取代并通过竞争反应远离Rluc,导致Rluc的发光强度发生变化。变化后的发光强度与葡萄糖对数浓度呈线性关系。Mai等[72]利用水热法合成了氧化锌纳米棒(NRs),并装饰了金纳米颗粒(NPs),用于荧光非酶促葡萄糖检测。Mai等[72]聚合物(PVDMA)中的二甲基内酯环用作连接器作用于结构易打开的亲核物质。此外,ARS扫描3-氨基苯硼酸(APBA)将VDMA的氮内酯基团与氨基反应结合到PVDMA连接器上合成PVDMA-APBA-ARS荧光探针。由于多荧光染料ARS固定在聚合物链上,PVDMA-APBA-ARS荧光聚合物探针具有更高的灵敏度。当ARS被葡萄糖取代后,荧光发射降低,可用于葡萄糖检测。除此之外,一些分子识别化合物也用于无酶的光学葡萄糖传感器,它们包括苯基硼酸功能化水凝胶、含硼酸荧光团和硼酸衍生物等。
3. 葡萄糖无酶检测的应用
3.1 葡萄糖无酶检测在临床医学中的应用
葡萄糖的代谢与许多疾病有关,人体中葡萄糖的含量过高容易引发糖尿病、胰腺炎、心肌梗死、肝硬化、脑瘤、脑膜炎等疾病,含量过低也会引起急性肝炎、肝癌、甲状腺功能不全、低血糖症等。因此葡萄糖含量的检测广泛应用于临床医学中,而快速简便的检测方法更易得到青睐。Rashtbari等[73]报道了纳米层锰钙(Mn-Ca)氧化物纳米颗粒(NL-Mn CaO2)模拟葡萄糖氧化酶的活性,建立了一种非酶促比色法检测葡萄糖的方法,该方法不仅可用于葡萄糖的肉眼可视化快速检测和分析,还可用于葡萄糖的分光光度法定量分析,可应用于人血清中葡萄糖的检测。朱巍然等[74]通过在氧掺杂氮化碳(OCN)的分散液中化学沉淀MnO2晶体制备得到二氧化锰-氧掺杂氮化碳(MnO2-OCN)复合材料,单体的MnO2具有类葡萄糖氧化酶活性,而引入的OCN具有类过氧化物酶活性,二者结合构建了一种级联催化无酶比色葡萄糖传感器。在检测血清中葡萄糖时,此传感器表现出较高的精确性,可应用于实际样品中葡萄糖的检测。目前,很多研究设计纳米酶代替天然酶进行检测,但常用的纳米酶不能同时显示串联酶活性和显色性能,因此需要进一步添加天然酶或显色剂,为了克服这些问题,Zhang等[75]开发了人工纳米酶替代天然酶,设计了一种基于MnO2/葡萄糖直接氧化还原反应的一步法无指示剂的血糖比色检测。二氧化锰纳米材料可作为活性纳米氧化剂,以及用于血糖水平检测的彩色纳米指示剂。在目标葡萄糖存在的情况下,MnO2纳米氧化剂被还原为Mn2+,导致黄色MnO2溶液的吸光度急剧下降并褪色。此外,该方法在人体血糖监测中具有良好的适用性。它为便携式血糖和尿糖快速检测技术提供了新的思路,对缓解人类糖尿病的高发具有一定的社会价值和现实意义。因此,无论是电化学无酶葡萄糖传感器还是可视化无酶葡萄糖传感器,在临床医学方面具有巨大潜力。
3.2 葡萄糖无酶检测在食品分析中的应用
现如今,葡萄糖在人体中起着非常重要的作用,它能够保护肝脏,促进肝脏的解毒功能;能够补充热能和体液;促进身体代谢,参与代谢过程等。因此,食品中葡萄糖的检测不容小觑。目前,葡萄糖的检测方法有很多,但近些年葡萄糖无酶检测技术因方便、快速、低成本等优点脱颖而出。该技术较多应用于果汁、饮料等饮品的检测,Qu等[67]发现类过氧化物酶活性的GO-COOH应用于果汁中葡萄糖含量的检测,实现了可视化的无酶检测。Wei等[68]制备的六边形状的Co-Al LDH,表现出更强的过氧化物模拟酶活性,构建了灵敏、快速的定量检测葡萄糖比色分析平台,应用于果汁中葡糖含量的检测。吴雪梅[76]以AuNPs为催化剂,环肽模拟物为葡萄糖受体,分别以4-NP和TMB为显色剂,建立了两种葡萄糖比色传感器,实现了可视化的检测,不需要其他复杂仪器的辅助就可以实现葡萄糖的定性、定量分析。其中,4-NP显色比色检测方法可应用于蔬菜、水果和主食样品中葡萄糖含量的检测。TMB显色比色检测方法也可应用于白菜、梨和小麦面粉等样品中葡萄糖含量的检测。可以看出,葡萄糖无酶检测技术已成功应用于各种食品实际样品的葡萄糖检测中,未来还具有更大的发展前景。
4. 结论与展望
无酶检测技术分为两类:电化学无酶葡萄糖传感器、可视化无酶葡萄糖传感器。其中电化学无酶葡萄糖传感器又分为修饰电极的电化学传感器和模拟酶电化学传感器;可视化无酶传感器分为比色传感器和光学传感器。随着科学技术的发展,更多的研究者致力于葡萄糖无酶技术的开发,并且这项技术成功地应用于临床医学、食品分析等领域中。
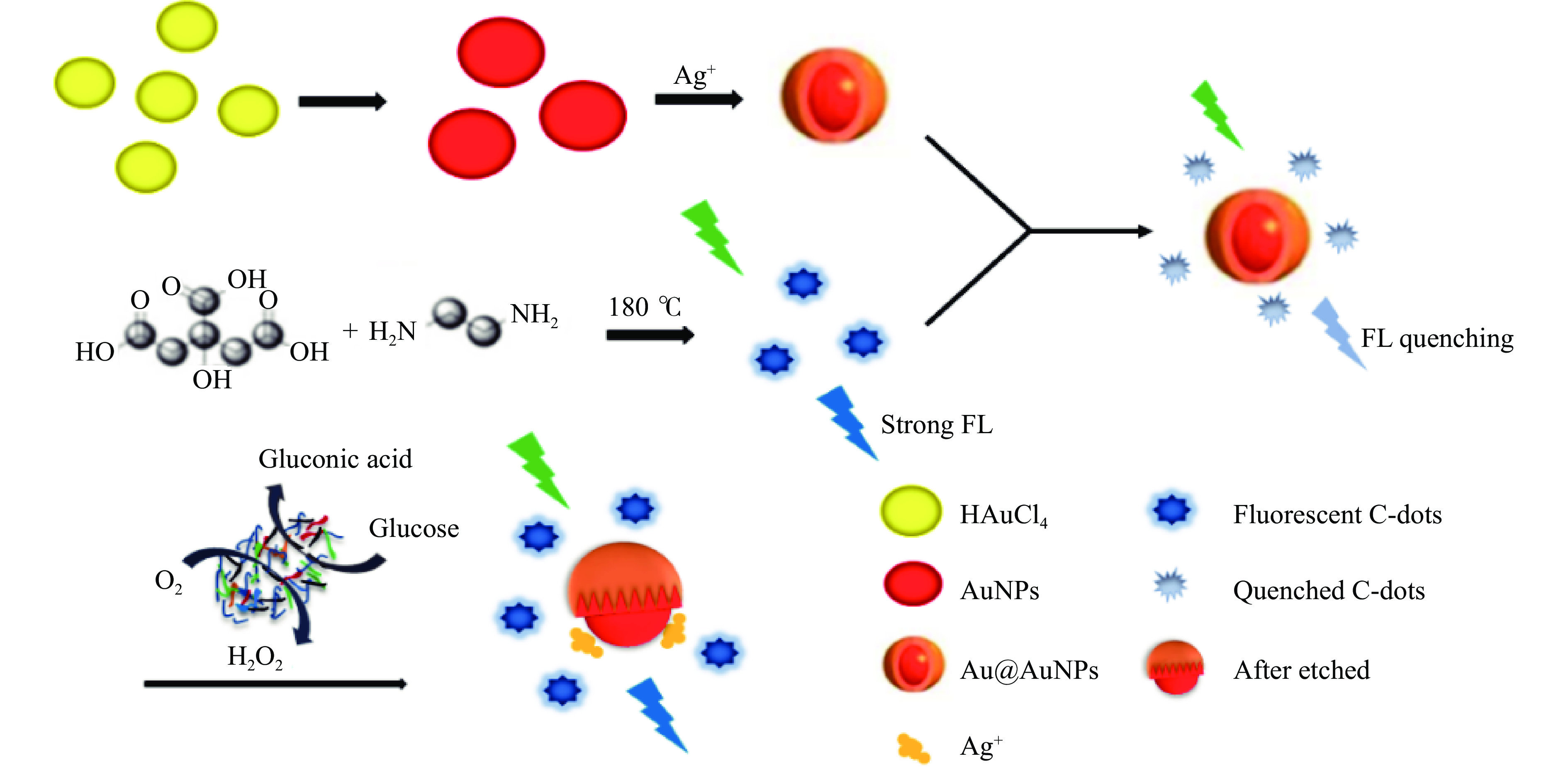
在生物检测中,无酶葡萄糖传感器目前用于人体血糖水平检测,而人体血液的构成复杂,蛋白质、糖类、Cl−等一些不稳定因素都应待考虑,因此,新电极还有待开发,技术的进一步成熟和普及将造福糖尿病患者。此外,对无酶葡萄糖传感器进行农业生物检测的研究很少,这仍需要科学家进一步探索,以促进农业智能的发展。检测无酶葡萄糖传感器的方法也为使用无酶检测方法的其他生物分子提供了广泛的平台。未来将建立更多的无酶检测方法来代替使用一些需要酶作为催化剂的检测,例如:新型的模拟酶、染色剂等。
-
表 1 CuO基非酶促葡萄糖传感器性能
Table 1 CuO-based non-enzymatic glucose sensor performance
电极材料 灵敏度
(µA mmol−1cm−2)线性范围
(mmol/L)检出限
(µmol/L)缓冲溶液 参考文献 CuO纳米盘/SPCE 627.3 0.002~2.5 0.2 0.1 mol/L KOH [24] Cu3(BTC)2-衍生CuO 1523.5 <1.25 1 0.1mol/L NaOH [29] CuO纳米花/GCE 2634.4 5×10−4~2.67 0.26 0.05 mol/L NaOH [25] CuO-PANI 2800 2.5×10−4~0.28 0.24 0.1mol/L NaOH [30] -NF/FTO 1359 0.28~4.6 CuO饼干状/SPCE 308.7 0.0005~4.03 0.1 0.1 mol/L NaOH [31] 3D-KSC/CuO @C/AuNPs 935 3.71×10−3~8.5 1.22 0.1 mol/L NaOH [32] CuO/MoS2 1055 0.1~10 − 0.1 mol/L NaOH [33] 莠草状 1281 0.05~2.0 16.7 0.1 mol/L NaOH [34] CuO/Cu2O纳米线 CuO/Cu2O/SnO2纳米棒 2043 0.05~2.0 16.7 0.1 mol/L NaOH [27]
多孔泡沫状CuO
6.17
<1
65.3
0.1 mol/L NaOH
[35]注:−表示参考文献中作者未标注线性范围、检出限,表示未检出明确的范围与检出限,表2、表3同。 表 2 Co3O4基非酶促葡萄糖传感器性能
Table 2 Co3O4-based non-enzymatic glucose sensor performance
电极材料灵敏度
(µA mmol−1cm−2)线性范围
(mmol/L)检出限
(µmol/L)
缓冲溶液
参考文献Co3O4微薄片 339.5 <0.22 — 0.1 mol/L KOH [36] Co3O4NPs-LIG 214 1×10−3~9 0.41 0.1 mol/L NaOH [21] 针状Co3O4/柔性碳布 2591.6 2×10−3~1.0 0.23 0.1 mol/L NaOH [37] 271.2 1.0~10 多孔Co3O4纳米板 212.92 0.05~3.2 2.7 0.1 mol/L NaOH [38] Co-Co3O4/CNT/CF 637.5 1.2×10−3~2.29 0.4 0.1 mol/L NaOH [39] Co3O4/Au 4470.4 2×10−3~2.11 0.085 0.1 mol/L NaOH [40] Au@Co3O4-S 1127.3 2×10−4~3.1 0.09 0.1 mol/L NaOH [41] 表 3 NiO基的非酶促葡萄糖传感器性能
Table 3 NiO-based non-enzymatic glucose sensor performance
电极材料灵敏度
(µA mmol−1cm−2)线性范围
(mmol/L)检出限
(µmol/L)
缓冲溶液
参考文献
NiO纳米结构/镍板
206.9
0.1~10
1.160.1 mol/L KCl
0.5 mol/L NaOH
[42]Ni/NiO/NG 3.2518 1×10−3~3.568 0.032 0.1 mol/L NaOH [43] Au@NiO 5536.2 1×10−3~6 0.25 0.1 mol/L NaOH [44] NiO/FTO 2632.53 5×10−3~0.825 0.084 0.1 mol/L NaOH [45] NiO-PPy/GCE 1094.8
62.90.01~0.5
1~205.8 0.1 mol/L PBS [46] NiO@CF 878.6 — 0.37 0.1 mol/L KOH [47] NiO/CC 5752 6×10−3~2 7.45 0.1 mol/L NaOH [48] NiO NC-rGO/GCE 4254 0.5~20 0.079 0.1 mol/L NaOH [49] NiO/碳多孔复合材料 2918.2 5×10−3~4.1 0.92 0.1 mol/L NaOH [50] NiO/PMB/GCE 413.06 3×10−3~0.8 2.1 0.1 mol/L NaOH [51] GLAD NiO 4400 5×10−4~9 — 0.1 mol/L NaOH [52] -
[1] SHOFARUL W, ACHILLEAS S. Enzyme-free detection of glucose with a hybrid conductive gel electrode[J]. Advanced Materials Interfaces,2019,1800928:1−10.
[2] JOSEPH M P, CORNELIUS J F, ELIAS C C. Diabesity and antidiabetic drugs[J]. Molecular Aspects of Medicine,2019,66:3−12. doi: 10.1016/j.mam.2018.10.004
[3] 朱正卫, 王敬元. 金属化合物无酶葡萄糖传感器研究进展[J]. 广州化工,2021,49(20):11−12, 19. [ZHU Zhengwei, WANG Jingyuan. Progress in the enzyme-free glucose sensors of metal compounds[J]. Guangzhou Chemical Industry,2021,49(20):11−12, 19. doi: 10.3969/j.issn.1001-9677.2021.20.006 [4] 杨林鑫, 王研, 陈嘉茵, 等. 无酶葡萄糖电化学传感器的研究进展[J]. 东莞理工学院学报,2021,28(5):9. [YANG Linxin, WANG Yan, CHEN Jiayin, et al. Progress in the enzyme-less glucose electrochemical sensor[J]. Journal of Dongguan Institute of Technology,2021,28(5):9. doi: 10.16002/j.cnki.10090312.2021.05.012 [5] 肖沐航. 无酶葡萄糖传感器研究进展综述[J]. 萍乡学院学报,2015,32(6):55−58. [XIAO Muhang. Review of the research progress of enzyme-free glucose sensors[J]. Journal of Pingxiang College,2015,32(6):55−58. doi: 10.3969/j.issn.1007-9149.2015.06.014 [6] CHEN J X, MA Q, LI M H, et al. Glucose-oxidase like catalytic mechanism of noble metal nanozymes[J]. Nature Communications,2021,12(1):1−9. doi: 10.1038/s41467-020-20314-w
[7] LUO W, ZHU C, SU S, et al. Self-catalyzed, self-limiting growth of glucose oxidase-mimicking gold nanoparticles[J]. Acs Nano,2010,4(12):7451−7458. doi: 10.1021/nn102592h
[8] ZHANG H, LIANG X, HAN L, et al. “Non-Naked” gold with glucose oxidase-like activity: A nanozyme for tandem catalysis[J]. Small,2018,14(44):183−256.
[9] CAO L, WANG P, CHEN L, et al. A photoelectrochemical glucose sensor based on gold nanoparticles as a mimic enzyme of glucose oxidase[J]. RSC Advances,2019,9(27):15307−15313. doi: 10.1039/C9RA02088H
[10] 关桦楠, 龚德状, 宋岩, 等. 基于Fe3O4-PGA@Au构建无酶电化学生物传感器检测葡萄糖[J]. 食品科学,2020,41(12):267−272. [GUAN Huanan, GONG Dezhuang, SONG Yan, et al. Build an enzyme-free electrochemical biosensor based on Fe3O4-PGA@Au to detect glucose[J]. Food Science,2020,41(12):267−272. doi: 10.7506/spkx1002-6630-20190319-239 [11] LI S Q, WANG L T, ZHANG X D, et al. A Co, N co-doped hierarchically porous carbon hybrid as a highly efficient oxidase mimetic for glutathione detection[J]. Sensors & Actuators B Chemical,2018,264:312−316.
[12] CAO X, WANG N. A novel non-enzymatic glucose sensor modified with Fe2O3 nanowire arrays[J]. Analyst,2011,136(20):4241−4246. doi: 10.1039/c1an15367f
[13] SHI W, ZHANG X, HE S, et al. CoFe2O4 magnetic nanoparticles as a peroxidase mimic me-diated chemiluminescence for hydrogen peroxide and glucose[J]. Chemical Communications,2011,47(38):10785−10787. doi: 10.1039/c1cc14300j
[14] JV Y, LI B, et al. Positively-charged gold nanoparticles as peroxidiase mimic and their application in hydrogen peroxide and glucose detection[J]. Chemical Communications Royal Society of Chemistry,2010,46(42):8017−8019. doi: 10.1039/c0cc02698k
[15] 张雪红. 基于金纳米颗粒的可视化传感器的构建与应用[D]. 兰州: 西北师范大学, 2019. ZHANG Xuehong. Construction and application of visual sensors based on gold nanoparticles[D]. Lanzhou: Northwest Normal University, 2019.
[16] WANG M, LIU F, CHEN D. An electrochemical enzyme-free glucose sensor based on bimetallic PtNi materials[J]. Journal of Materials Science: Materials in Electronics,2021,32(18):23445−23456. doi: 10.1007/s10854-021-06832-3
[17] KHAIRULLINA E M, TUMLIN E M, TUMLIN I I, et al. Laser-assisted surface modification of Ni microstructures with Au and Pt toward cell biocompatibility and high enzyme-free glucose sensing[J]. ACS Omega,2021,6(28):18099−18109. doi: 10.1021/acsomega.1c01880
[18] CHANDRASEKARAN N I, HARSHIMY M, THANGASAMY P, et al. A robust enzymeless glucose sensor based on tin nickel sulfide nanocomposite modified electrodes[J]. Applied Physics A,2021,127(1):1−9. doi: 10.1007/s00339-020-04132-x
[19] DARABDHARA G, BORDOLOI J, MANNA P, et al. Biocompatible bimetallic Au-Ni doped graphitic carbon nitride sheets: A novel peroxidase-mimicking artificial enzyme for rapid and highly sensitive colorimetric detection of glucose[J]. Sensors and Actuators B: Chemical,2019,285:277−290. doi: 10.1016/j.snb.2019.01.048
[20] BABULAL S M, CHEN S M, PALANI R, et al. Graphene oxide template based synthesis of NiCo2O4 nanosheets for high performance non-enzymatic glucose sensor[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects,2021,621:126600. doi: 10.1016/j.colsurfa.2021.126600
[21] ZHAO J, ZHENG C, GAO J, et al. Co3O4 nanoparticles embedded in laser-induced graphene for a flexible and highly sensitive enzyme-free glucose biosensor[J]. Sensors and Actuators B: Chemical,2021,347:130653. doi: 10.1016/j.snb.2021.130653
[22] PATIL A S, LOHAR G M, et al. Facile synthesis of CuO nanostructures for non-enzymatic glucose sensor by modified SILAR method[J]. Applied Physics A,2021,127(2):1−10.
[23] 刘东, 王周雷, 李帆, 等. CuOx@BPC 化学修饰电极的制备及其对葡萄糖检测研究[J]. 化学与生物工程,2021,38(4):59−64. [LIU Dong, WANG Zhoulei, LI Fan, et al. Preparation of chemically modified electrodes of CuOx@BPC and its study on glucose detection[J]. Chemistry and Bioengineering,2021,38(4):59−64. doi: 10.3969/j.issn.1672-5425.2021.04.011 [24] JAQAGADEESAN M S, MOVLAEE K, KRISHNAKUMAR T, et al. One-step microwave-assisted synthesis and characteri-zation of novel CuO nanodisks for non-enzymatic glucose sensing[J]. Journal of Electroanalytical Chemistry,2019,835:161−168. doi: 10.1016/j.jelechem.2019.01.024
[25] WANG X, GE C, CHEN K, et al. An ultrasensitive non-enzymatic glucose sensors based on controlled petal-like CuO nanostructure[J]. Electrochimica Acta,2018,259:225−232. doi: 10.1016/j.electacta.2017.10.182
[26] LU N, SHAO C, LI X, et al. CuO/Cu2O nanofibers as electrode materials for non-enzymatic glucose sensors with improved sensitivity[J]. RSC Advances,2014,4(59):310561.
[27] ZHAO Y, BO X, GUO L. Highly exposed copper oxide supported on three-dimensional porous reduced graphene oxide for non-enzymatic detection of glucose[J]. Electrochimica Acta,2015,176:1272−1279. doi: 10.1016/j.electacta.2015.07.143
[28] WANG X, LIU E, ZHANG X. Non-enzymatic glucose biosensor based on copper oxide-reduced graphene oxide nanocomposites synthesized from water-isopropanol solution[J]. Electrochimica Acta,2014,130(4):253−260.
[29] KIM K, LIM S, LEE H N, et al. Electrochemically derived CuO nanorod from copper-based metal-organic framework for non-enzymatic detection of glucose[J]. Applied Surface Science,2019,479.15):720−726.
[30] ESMAEELI A, GHAFFARINEJIA A, ZAHEDI A, et al. Copper oxide-polyaniline nanofiber modified fluorine doped tin oxide (FTO) electrode as non-enzymatic glucose sensor[J]. Sensors and Actuators B: Chemical,2018,266:294−301. doi: 10.1016/j.snb.2018.03.132
[31] VELMURUGAN M, KARIKALAN N, CHEN S M. Synthesis and characterizations of biscuit-like copper oxide for the non-enzymatic glucose sensor applications[J]. Journal of Colloid & Interface Science,2017,493:349−355.
[32] QIAN C, HAN K, WENG W, et al. Electrochemical glucose sensor based on microporous Carbon/CuO@Carbon/AuNPs integrated electrode[J]. ChemistrySelect,2019,4(19):5633−5640. doi: 10.1002/slct.201900245
[33] ARUNBALAJI S, VASUDEVAN R, ARIVANANDHAN M, et al. CuO/MoS2 nanocomposites for rapid and high sensitive non-enzymatic glucose sensors[J]. Ceramics International,2020,46(10):16879−16885. doi: 10.1016/j.ceramint.2020.03.265
[34] 周清清. 氧化铜/氧化亚铜的多级结构与组成调控及其在无酶葡萄糖传感器中的应用[D]. 苏州: 苏州大学, 2020. ZHOU Qingqing. Multistage structure and composition regulation of copper oxide/copper oxide and its application in enzyme-free glucose sensors[D]. Suzhou: Soochow University, 2020.
[35] 王永鹏, 徐子勃, 刘梦竹, 等. 多孔泡沫状CuO微纳米纤维的制备及用于无酶葡萄糖传感器[J]. 高等学校化学学报,2019,40(6):1310−1316. [WANG Yongpeng, XU Zibo, LIU Mengzhu, et al. Preparation of porous foam CuO micronanofibers and their use for an enzyme-free glucose sensor[J]. Journal of Higher Chemistry,2019,40(6):1310−1316. doi: 10.7503/cjcu20180854 [36] PORE O C, FULARI A V, KAMBLE R K, et al. Hydrothermally synthesized Co3O4 microflakes for supercapacitor and non-enzymatic glucose sensor[J]. Journal of Materials Science: Materials in Electronics,2021,32(15):20742−20754. doi: 10.1007/s10854-021-06586-y
[37] XU J, GAO Z, DOU X, et al. Needle-like Co3O4 nanoarrays as a dual-responsive amperometric sensor for enzyme-free detection of glucose and phosphate anion[J]. Journal of Electroanalytical Chemistry,2021,897:115605. doi: 10.1016/j.jelechem.2021.115605
[38] KANG M, ZHOU H, ZHAO H, et al. Porous Co3O4 nanoplates as an efficient electromaterial for non-enzymatic glucose sensing[J]. Cryst Eng Comm,2020,22(1):35−43. doi: 10.1039/C9CE01396B
[39] HAN J, MIAO L, SONG Y. Preparation of co-Co3O4/carbon nanotube/carbon foam for glucose sensor[J]. Journal of Molecu-lar Recognition,2020,33(3):112820.
[40] PEI Y, HU M, TANG X, et al. Ultrafast one-pot anodic preparation of Co3O4/nanoporous gold composite electrode as an efficient nonenzymatic amperometric sensor for glucose and hydrogen peroxide[J]. Analytica Chimica Acta,2019,1059:49−58. doi: 10.1016/j.aca.2019.01.059
[41] YANG Z, BAI X. Synthesis of Au core flower surrounding with sulphur-doped thin Co3O4 shell for enhanced nonenzymatic detection of glucose[J]. Microchemical Journal,2021,160:105601. doi: 10.1016/j.microc.2020.105601
[42] HEYSER C, SCHREBLER R, GREZ P. New route for the synthesis of nickel (II) oxide nanostructures and its application as non-enzymatic glucose sensor[J]. Journal of Electroanalytical Chemistry,2019,832:189−195. doi: 10.1016/j.jelechem.2018.10.054
[43] WANG Q, ZHENG S, LI T, et al. Ni/NiO multivalent system encapsulated in nitrogen-doped graphene realizing efficient activation for non-enzymatic glucose sensing[J]. Ceramics International,2021,47(16):22869−22880. doi: 10.1016/j.ceramint.2021.04.307
[44] ZHOU J, YIN H, WANG L, et al. Electrodeposition of Au@NiO nanotube arrays for highly sensitive non-enzymatic glucose sensing[J]. Journal of Electronic Materials,2021,50(11):6392−6402. doi: 10.1007/s11664-021-09154-6
[45] CHAKRABORTY P, DEKA N, PATRA D C, et al. Salivary glucose sensing using highly sensitive and selective non-enzymatic porous NiO nanostructured electrodes[J]. Surfaces and Interfaces,2021,26:101324. doi: 10.1016/j.surfin.2021.101324
[46] ZHOU Y, FANG Y, RAMASAMY R P. Non-covalent fun-ctionalization of carbon nanotubes for electrochemical biosensor development[J]. Sensors,2019,19(2):392. doi: 10.3390/s19020392
[47] PORE O C, FULARI A V, VEHAL N B, et al. Hydrothermally synthesized urchinlike NiO nanostructures for supercapacitor and nonenzymatic glucose biosensing application[J]. Materials Science in Semiconductor Processing,2021,134:105980. doi: 10.1016/j.mssp.2021.105980
[48] ZHOU F, WANG Q, HUANG K, et al. Flame synthesis of NiO nanoparticles on carbon cloth: An efficient non-enzymatic sensor for glucose and formaldehyde[J]. Microchemical Journal,2020,159:105505. doi: 10.1016/j.microc.2020.105505
[49] ZHANG Y, LIU Y Q, BAI Y, et al. Confinement preparation of hierarchical NiO-N-doped carbon@ reduced graphene oxide microspheres for high-performance non-enzymatic detection of glucose[J]. Sensors and Actuators B: Chemical,2020,309:127779. doi: 10.1016/j.snb.2020.127779
[50] YIN H, ZHAN T, CHEN J, et al. Polyhedral NiO/C porous composites derived by controlled pyrolysis of Ni-MOF for highly efficient non-enzymatic glucose detection[J]. Journal of Materials Science: Materials in Electronics,2020,31(5):4323−4335. doi: 10.1007/s10854-020-02990-y
[51] ZHU L, WEI Z, WANG J, et al. An electrochemical biosensor based on NiO nanoflowers/polymethylene blue composite for non-enzymatic glucose detection[J]. Journal of The Electrochemical Society,2020,167(14):146512. doi: 10.1149/1945-7111/abc5dc
[52] SINGER N, PILLAI R G, JOHNSON A I D, et al. Nanostructured nickel oxide electrodes for non-enzymatic electrochemical glucose sensing[J]. Microchimica Acta,2020,187(4):1−10.
[53] RAHMAN M M, HUSSIN M M, ASIRI A M. Glucose sensor based on ZnO· V2O5 NRs by an enzyme-free electrochemical approach[J]. RSC Advances,2019,9(54):31670−31682. doi: 10.1039/C9RA06491E
[54] HUANG M, FENG S, YANG C, et al. Construction of an MnO2 nanosheet array 3D integrated electrode for sensitive enzyme-free glucose sensing[J]. Analytical Methods,2021,13(10):1247−1254. doi: 10.1039/D0AY02163F
[55] JUANG F R, WANG T M. Surfactant-free synthesis of self-assembled CuO spheres composited with MnO2 nanorods for non-enzymatic glucose detection[J]. Physica E Low-dimensional Systems and Nanostructures,2021,134:114831. doi: 10.1016/j.physe.2021.114831
[56] SINHA L, PAKHIRA S, BHJANE P, et al. Hybridization of Co3O4 and α-MnO2 nanostructures for high-performance nonenzymatic glucose sensing[J]. ACS Sustainable Chemistry & Engineering,2018,6(10):13248−13261.
[57] MAO Q, JING W, GAO W, et al. High-sensitivity enzymatic glucose sensor based on ZnO urchin-like nanostructure modified with Fe3O4 magnetic particles[J]. Micromachines,2021,12(8):977. doi: 10.3390/mi12080977
[58] HOVANCOVA J, SISOLAKOVA I, VANYSEK P, et al. Ligand-to-metal charge transfer (LMCT) complex: New approach to non-enzymatic glucose sensors based on TiO2[J]. Journal of Electroanalytical Chemistry,2020,878:114589. doi: 10.1016/j.jelechem.2020.114589
[59] WANG S Z, ZHENG M, ZHANG X, et al. Flowerlike CuO/Au nanoparticle heterostructures for nonenzymatic glucose detection[J]. ACS Applied Nano Materials,2021,4(6):5808−5815. doi: 10.1021/acsanm.1c00607
[60] HAO N, HUA R, CHEN S, et al. Multiple signal-amplification via Ag and TiO2, decorated 3D Ni-trogen doped graphene hydrogel for fabricating sensitive label-free photoelectrochemical thrombin aptasensor[J]. Biosensors and Bioelectronics,2018,101:14−20. doi: 10.1016/j.bios.2017.10.014
[61] 李甜, 吴心茹, 石京慧, 等. 基于纳米金银染放大的葡萄糖可视化检测[J/OL]. 分析试验室: 1−6 [2022-01-16]. http://kns.cnki.net/kcms/detail/11.2017.TF.20211220.1115.008.html. LI Tian, WU Xinru, SHI Jinghui, et al. Glucose visualization detection based on nanosilver dye magnification[J/OL]. Analysis Laboratory: 1−6 [2022-01-16]. http://kns.cnki.net/kcms/detail/11.2017.TF.20211220.1115.008.html.
[62] 高妍. 基于金/银纳米材料的无酶葡萄糖光化学传感研究[D]. 苏州: 苏州大学, 2016. GAO Yan. Enzyme-free glucose photochemical sensing studies based on gold/silver nanomaterials[D]. Suzhou: Soochow University, 2016.
[63] 杨培昕, 喻昌木, 杨敏, 等. 固载离子液体修饰Fe3O4纳米酶用于H2O2和葡萄糖的检测[J]. 食品科学,2021,42(20):252−259. [YANG Peixi, YU Changmu, YANG Min, et al. Solid-loading ionic liquid-modified Fe3O4 nanoenzymes were used for the detection of H2O2 and glucose[J]. Food Science,2021,42(20):252−259. doi: 10.7506/spkx1002-6630-20200924-296 [64] HUANG Y, ZHAO M T, HAN S K, et al. Growth of Au nanoparticles on 2D metalloporphyrinic metal-organic framework nanosheets used as biomimetic catalysts for cascade reactions[J]. Adv Mater,2017,29(32):1700102−1700107. doi: 10.1002/adma.201700102
[65] 吴科研. 杂原子掺杂碳纳米材料过氧化物模拟酶的合成与应用研究[D]. 长春: 东北师范大学, 2021. WU Keyan. Synthesis and application of the doped carbon nanomaterials[D]. Changcun: Northeast Normal University, 2021.
[66] GANGANBOINA A B, DONG R A. V2O5 nanosheets as nanozyme with peroxidase-like activity and their application for rapid and sensitive detection of glutathione[C]//256th ACS National Meeting, 2018.
[67] SONG Y, QU K, ZHAO C, et al. Graphene oxide: Intrinsic peroxidase catalytic activity and its application to glucose detection[J]. Advanced Materials,2010,22:2206−2210. doi: 10.1002/adma.200903783
[68] SHI W B, WANG Q L, LONG Y J, et al. Carbon nanodots as peroxide-se mimetics and their ap-plications to glucose detection[J]. Chem Commun,2011,47(23):6695−6697. doi: 10.1039/c1cc11943e
[69] KUO P C, LIEN C W, MAO J Y, et al. Detection of urinary spermine by using silver-gold/silver chloride nanozymes[J]. Anal Chim Acta,2018,1009:89−97. doi: 10.1016/j.aca.2018.01.018
[70] LIU W, DING F, WANG Y, et al. Fluorometric and colorimetric sensor array for discrimination of glucose using enzymatic-triggered dual-signal system consisting of Au@Ag nanoparticles and carbon nanodots[J]. Sensors and Actuators B: Chemical,2018,265:310−317. doi: 10.1016/j.snb.2018.03.060
[71] CHEN L, DOTZERT M. Nanostructured biosensor using bioluminescence quenching technique for glucose detection[J]. Journal of Nanobiotechnology,2017,15(1):59. doi: 10.1186/s12951-017-0294-1
[72] HH MAI, JANSSENS E. Au nanoparticle-decorated ZnO nanorods as fluorescent non-enzymatic glucose probe[J]. Microchimica Acta,2020,187(10):1−11.
[73] RASHTBARI S, DEHGHAN G, AMINI M. An ultrasensitive label-free colorimetric biosensor for the detection of glucose based on glucose oxidase-like activity of nanolayered manganese-calcium oxide[J]. Analytica Chimica Acta,2020,1110:98−108. doi: 10.1016/j.aca.2020.03.021
[74] 朱巍然, 郝楠, 杨小弟, 等. 基于二氧化锰-氧掺杂氮化碳级联催化的无酶比色检测葡萄糖研究[J]. 分析化学,2020,48(6):727−732. [ZHU Weiran, HAO Nan, YANG Xiaodi, et al. Study on enzyme-free colorimetric glucose detection based on manganese dioxide-oxygen-doped carbon nitride cascade catalysis[J]. Analytical Chemistry,2020,48(6):727−732. doi: 10.19756/j.issn.0253-3820.201047 [75] ZHANG J, DAI X, SONG Z L, et al. One-pot enzyme-and indicator-free colorimetric sensing of glucose based on MnO2 nano-oxidizer[J]. Sensors and Actuators B: Chemical,2020,304:127304. doi: 10.1016/j.snb.2019.127304
[76] 吴雪梅. 基于环肽模拟物的葡萄糖可视化比色检测技术[D]. 天津: 天津科技大学, 2020. WU Xumei. Glucose visualization and colorimetric detection techniques based on cyclic peptide mimics[D]. Tianjin: Tianjin University of Science and Technology, 2020.
-
期刊类型引用(2)
1. 杜康,花扬扬,魏帅飞,王婷婷,曲冠男,赵猛,蔡红星. 基于内标法的低质量浓度葡萄糖溶液拉曼测定研究. 光学学报(网络版). 2024(05): 4-10 .  百度学术
百度学术
2. 韩春然,岳振歌,遇世友,王鑫,张丝瑶. 检测葡萄糖的Ni基电化学传感器研究进展. 食品工业科技. 2023(14): 482-489 .  本站查看
本站查看
其他类型引用(2)





 下载:
下载:
 下载:
下载:
