Study on Extraction Method of Melanotic Characteristics of Infected Cooked Shrimp
-
摘要: 本文提出了一种基于颜色简化模型的熟对虾褐变特征提取方法。通过在线图像采集装备获取动态生产线上正常熟对虾以及褐变熟对虾的大批量图像,采用灰度差异法与形态学操作实现熟对虾图像的感兴趣区域提取,并通过三种颜色空间提取熟对虾褐变特征;对训练集中151幅正常虾与66幅褐变虾图像进行颜色模型构建,将熟对虾的褐变区域占比作为判别熟对虾是否发生褐变的基准条件,并进行分级。结果表明,所设B分量范围为0~77的RGB颜色模型效果最优,在测试116幅正常虾与50幅褐变虾图像时识别速率能达到91.36 ms/只,与传统二元线性判别分析法相比,算法复杂度由O(n²)降低为O(n),识别准确率达到92.77%,提高了7.3%。该方法具有较大实用优势和应用前景,为机器视觉技术应用于南美白对虾外观品质在线无损检测提供性能支撑。Abstract: In this paper, a method for extracting browning features from cooked shrimps based on a simplified color model was proposed. A large number of images of normal cooked shrimps and melanotic cooked shrimps in the dynamic production line were obtained by online image acquisition equipment, and the region of interest of cooked shrimps was extracted by using the grey-scale difference method and morphological operations, and the browning features of cooked shrimps were extracted by three color spaces; a color model was constructed for 151 images of normal shrimps and 66 images of melanotic shrimps in the training set, and the percentage of browning areas of cooked shrimps were used as the benchmark condition to determine whether browning occurred in cooked shrimps, and were graded. The results showed that the RGB color model with the B-component range of 0~77 was the most effective, and the recognition rate could reach 91.36 ms/each of the 116 normal and 50 browned shrimp images, which reduced the complexity of the algorithm from O(n²) to O(n) and improved the recognition accuracy by 7.3% to 92.77% compared with the traditional binary linear discriminant analysis method. The method has greater practical advantages and application prospects, providing performance support for the application of machine vision technology to the online non-destructive inspection of the appearance quality of South American white shrimp.
-
正常养殖或从海里捕获的对虾受到环境中细菌或病毒的侵染,抑或在运输、加工过程中保鲜不当均可能导致对虾关联产品新鲜度下降[1]。新鲜度作为衡量虾主要的品质指标,保证了对虾产品质量安全的基础,新鲜的虾即使价格高,也同样畅销[2-3]。南美白对虾,因其味美、营养价值高,需求量持续增大,据2020年中国渔业统计年鉴显示,我国南美白对虾养殖产量已达181.56万吨,年总产量一直居于所有养殖虾类的首位,是我国养殖产量最高的虾种[4-6]。冻熟对虾作为我国近年来一种新的熟制对虾加工产品,主要以南美白对虾为原料加工制成[7],自投放市场后,需求不断增长,但由于我国保鲜技术仍未能获得实质性突破,在冷藏和运输过程中出现的褐变现象降低了对虾感官品质,影响对虾产品实际销售,已成为影响水产业发展的主要问题之一[8-10]。
熟对虾的典型品质衰减特征即体内产生了褐变物质,由于南美白对虾富含酪氨酸及其衍生物,易被酪氨酸酶催化氧化成醌类化合物,其进一步发生酶促反应生成大分子的黑色物质,在外壳沉积大量黑色素,极易褐变[11-12]。但虾体内部发生氧化反应并非导致褐变的唯一因素,也可能是病毒性疾病、寄生虫性疾病、细菌性疾病等[13]因素造成的结果,非正常氧化形成的褐变虾流入市场后可能会造成食物中毒[14]、流行性病毒传播等不可估量的危害。目前,我国虾类水产品行业分选褐变熟对虾主要以人工方式为主,工人通过肉眼观察对虾褐变部位和面积来甄选出不同品质的对虾,人工分选方式存在主观性强、生产效率低且分选精度不稳定等缺点,难以满足对虾日益增长的市场需求,自动化的对虾检测装置应运而生[15]。Luzuriaga等[16]设计开发了一种可重复、精准测量虾的视觉质量装置,该装置量化了冷藏期间对虾的褐变程度,并计算虾仁的黑变面积占比与其人工分级的相关性。Mohebbi等[17]运用自动阈值法研究熟虾仁在干燥过程中颜色变化与水分含量的关系。以上研究均能实现对虾的自动化检测,本文基于以上方法构建不同颜色模型提取对虾褐变特征,将褐变区域占比作为熟对虾品质分级的核心条件,实现对褐变虾的精准识别与快速剔除。
本研究综合利用传感技术、光谱技术、几何代数学、统计学模式识别等多领域技术手段,以熟对虾为研究对象,将动态图像采集技术与图像处理技术相结合,从图像中提取重要的信息,构建熟对虾品质的在线实时检测系统,以实现熟对虾分选的自动化、智能化,并提高分级效率,保障对虾品质,从而让消费者吃上放心、安全的对虾产品[18-21]。
1. 材料与方法
1.1 材料与仪器
试验所选取的冷冻熟对虾 购置于嘉兴秀洲区大润发超市,其中少数对虾样本存在轻微褐变,大部分为未发生褐变的正常虾。
DELL G3 3590笔记本电脑,Intel(R) Core(TM) i5-9300H CPU @ 2.40 GHz处理器,内存8 GB 美国Dell公司;德国映美精30万像素彩色工业相机,型号为DFK-23G618,镜头型号为VT-LEM0618-MP3 德国映美精公司。
1.2 实验方法
1.2.1 设备组装和原理
本研究通过构建机器视觉系统来获取动态生产线上的对虾图像,通过计算机对图像进行特征提取与分析,判别对虾是否发生褐变,从而进一步剔除褐变虾。对虾图像采集装置如图1所示,主要由CCD工业相机与LED条状照明光源构成。
图像采集装置的主体是光照箱,主要由工业相机、白色和红色光源带、反光贴纸、吸光贴纸、挡光板、变压器组成。白色光源带起增加亮度作用,红色光源带起降低光源反光率作用。壁上的反光贴纸可以增大LED射出光子的反射率,外侧的黑色吸光贴纸可以减少部分光照溢出。挡光板可以阻挡自然光等外界光干扰,变压器可以控制光源开合。此光照箱可达到拍摄区域亮度合适,拍摄照片清晰易处理的效果,装置具体搭建过程如图2所示。
1.2.2 数据采集
试验中多数褐变虾样本通过正常虾暴露在常温有氧环境下一段时间得到,不同虾的褐变程度存在差异,部分样本图像如图3所示。
为提高采图效率,训练集和测试集均采用对虾正反面拍照的形式,其中正常熟对虾样品为134只,褐变熟对虾为58只。经过图像装置采集到单只熟对虾训练集图像共217幅,单只熟对虾测试集图像共166幅,追加单只熟对虾验证集图像共100幅。其中单只熟对虾训练集图像包括正常熟对虾图像151幅,褐变熟对虾图像66幅;单只熟对虾测试集图像包括正常熟对虾图像116幅,褐变熟对虾图像50幅;单只熟对虾验证集图像包括正常熟对虾70幅,褐变熟对虾图像30幅。
为了实现褐变虾的在线检测,本研究基于Visual Studio 2015开发了一套利用机器视觉技术的南美白对虾褐变检测软件,操作人员只需在软件界面上点击指定按钮即可实现检测,用户终端界面是由微软基础类库(Microsoft Foundation Classes, MFC)所搭建,图像处理中所使用的开源计算机视觉库(OPENCV)版本为3.4.2。
1.2.3 对虾图像预处理
本研究利用图像采集装置获取动态生产线上的熟对虾图像,其中包括正常虾以及褐变虾图像,分辨率均为640×480 dpi。首先,针对原始的熟对虾图像,提取的目标对虾的灰度峰值与背景峰值存在较大差异,运用背景灰度差异法[22]可实现对感兴趣区域对虾图像的分割与提取,从而得到二值图像,但分割后的二值图像仍然存在不完整的情况,图像整体虽在人肉眼中能够被识别,但计算机难以分辨存在边缘及其轮廓内部不连续的图像。随后采用连通区域处理技术[23],并用中值滤波[24]来处理图像轮廓边缘出现的不平滑情况,使轮廓边缘更为流畅,从而得到适应人眼视觉的感兴趣区域灰度图像。经过以上步骤处理,能够得到接近完整轮廓图像,图4显示了图像预处理的主要流程。
1.3 对虾褐变判别
1.3.1 图像颜色特征提取
颜色特征的提取,必须在特定的颜色空间中进行。最常用的颜色空间是RGB空间,多用于颜色显示和图像处理,但它的均匀性非常差,两种不同颜色之间的直觉差异色差不能用颜色空间模型中两点间的距离差表示,描述方式难以按人眼关注的焦点进行表达[25]。相对于RGB空间,HSV空间能够更直观地展示色彩的明暗、色调以及鲜艳程度,更接近于人类视觉经验和对色彩的认识[26];Lab颜色空间则具有更宽广的色域[27],其表现在位图获得同样的精度下,需求更多的像素数据。褐变作为一种颜色特征在图像整体中具有显著特点,但在不同颜色空间中的表达也存在差异。为了更好地提取对虾褐变特征,本研究分别在RGB、HSV、Lab三种颜色空间中构建相应的颜色模型,颜色模型主要由各通道分量决定。
1.3.2 对虾褐变特征提取
对虾褐变是由于虾体内的多酚氧化酶发生酶促反应而产生黑色素[28],酶促反应的持续时间决定了褐变程度,本节主要阐述使用不同颜色空间提取褐变特征的过程。由RGB颜色空间构成可知:黑色主要与B通道值有关,而与R、G通道关系较小,B分量越小,颜色越趋于黑色。对虾在褐变过程中,颜色主要由橙色变成褐色,再由褐色转变为黑色。因此,B分量可作为表征褐变程度的指标,将该分量设定在一定范围内能够提取对虾褐变特征,本研究将B分量范围设定为0~77。
使用HSV颜色空间提取颜色特征需由RGB图像进行转换,转换公式[29]如式(1)~(3)所示,max(R, G, B)表示所取三通道分量的最大值。HSV颜色空间显示了各个基本色对应的色调(H),饱和度(S),亮度(V)三个参数的模糊取值范围,例如黑色对应H分量在0~180,S分量在0~255,V分量在0~46。本文中的熟对虾可能存在酶促反应时间较短而呈现轻微褐变的情况,仅使用黑色所对应三个分量范围提取褐变特征存在局限性,需扩大设定分量范围。本研究提取褐变特征的H分量范围设为0~180,S分量设为0~255,V分量设为0~70。
H={60×(G−B)/(S×V),如果S≠0并且max(R,G,B)=R,60×(2+(B−R)/(S×V)),如果S≠0并且max(R,G,B)=G,60×(4+(R−G)/(S×V)),如果S≠0并且max(R,G,B)=B,如果H<0,那么H=H+360. (1) S=max(R,G,B)−min(R,G,B)max{R,G,B},H未定义,如果S=0 (2) V=max(R,G,B) (3) Lab颜色空间中的明度和颜色是分开的,L通道对应亮度,而a通道和b通道对应颜色。L分量表示从纯黑到纯白,取值范围是[0, 100];a分量表示从红色至绿色的范围,取值范围为[−128, 127];b分量表示从黄色到蓝色的范围,取值范围是[−128, 127]。因此,L分量是最能表征对虾褐变程度的指标。Lab通过RGB的转换公式如式(4)~(8)所示,其中式(4)~(7)中的X、Y、Z由式(8)矩阵相乘得出,本研究将L分量范围设定为0~60。
L=116f(Y)−16(4) (4) a=500(f(X0.982)−f(Y)) (5) b=200(f(Y)−f(Z1.183)) (6) 其中:
f(X)={1.187x+0.138(x⩽ (7) \left(\begin{array}{c} {\rm X}\\ {\rm Y}\\ {\rm Z}\end{array}\right) = \left(\begin{array}{ccc}0.490& 0.310& 0.200\\ 0.177& 0.812& 0.011\\ 0.000& 0.010& 0.660\end{array}\right)\left(\begin{array}{c} R\\ G\\ B\end{array}\right) (8) 由于褐变特征与虾眼区域的颜色特征相似,使用以上颜色模型提取到的褐变区域均包含虾眼区域。故第一步提取到的褐变特征区域需剔除虾眼,保留实际褐变区域,虾眼与褐变区域之和占比e1以及褐变区域占比e2公式如式(9)~(10)所示:
\rm {e}_{1}=\frac{area1}{whole\_area} (9) \rm {e}_{2}=\frac{area2}{whole\_area} (10) 其中,area1表示包含未剔除虾眼的褐变区域面积;area2表示剔除虾眼后的褐变区域面积;whole_area表示求得的对虾整体面积,以上三个指标的单位均为像素。
此外,由于正常虾不存在褐变,即可直接通过以上所构建的模型得到虾眼区域,从而依据公式(9)得到虾眼占比即e1,虾眼提取准确率EA(Eye Accuracy)由以下公式得出:
\mathrm{E}\mathrm{A}({\text{%}})=\frac{\mathrm{E}\mathrm{S}}{\mathrm{T}\mathrm{I}}\times 100 (11) 其中ES(Number of eyes successfully segmented)表示通过以上方法成功提取虾眼图像数目,TI(Total number of images)表示该集合中的所有图像数目。
2015年,洪寒梅[30]采用双阈值分割法提取变质对虾的褐变特征,但对虾足部及产生的阴影区域易被误认为是褐变区域。阈值分割法是根据图像各个像素点的灰度差异,选择合适灰度级作为阈值,将目标区域与背景区域分割出来,但如果部分像素点灰度级近似,尤其在剔除虾眼区域时,所属虾眼区域的像素点与一些冗余像素点灰度相近,易导致误分割,因此,分割后的对虾褐变区域需要进一步剔除虾眼部分,才能得到真实的褐变区域。2016年,刘子豪[31]提出了通过获取虾头点及骨架线端点坐标的方法提取虾眼,该方法虽能够准确的定位虾眼,但流程较为复杂,耗时较长。
以本团队的前期研究[30-31]为基础,本文提出了一种剔除虾眼区域的方法,在一定程度上简化了虾眼的分割流程,提高了程序运行速度。首先,通过阈值分割法提取熟对虾二值图像,再提取二值图像轮廓特征;其次,计算轮廓矩,并提取对虾轮廓质心centroid,得到质心坐标p1;然后,构建颜色模型提取褐变区域,并定位褐变区域坐标p2;最后,根据p1到centroid的距离一般大于p2到centroid的距离以及虾眼区域相较于部门冗余联通区域面积更大的特点实现虾眼定位,并以黑色像素点填充剔除。
1.3.3 对虾褐变程度分级
浙江省地方标准[32]中给出了对虾产品的人工分级标准,其中,一级品不存在褐变,二级品存在轻微褐变,三级品存在多部位褐变,本文根据该标准以褐变区域占比e2对熟对虾品质分级,e2由式(10)得到,具体见下表1。褐变区域占比e2越小,则对虾的品质等级越高,更为新鲜。
表 1 熟对虾分级标准Table 1. Grading standard for cooked shrimp熟对虾等级 褐变区域占比e2 一级品 0 二级品 (0,0.05] 三级品 (0.05,+∞) 2. 结果与分析
2.1 熟对虾训练集的试验结果与分析
2.1.1 虾眼提取试验结果分析
基于以上所提研究方法,表2给出了训练集中正常熟对虾图像经过不同颜色模型提取后的结果,其中包含三种颜色模型相应虾眼占比的各项数值,虾眼提取准确率可由式(11)得出。通过表中数据可知,构建的三种颜色模型均能以较高的准确率提取正常虾的虾眼,由此能够为后续的褐变判别试验提供支持。由于正常虾不发生褐变,提取后只存在虾眼区域,虾眼占比即e1,而褐变虾的褐变区域仍包含虾眼区域,因此e1的大小可以初步判断对虾是否褐变,其由上述式(9)得出。
表 2 不同颜色模型下正常熟对虾训练集虾眼提取试验结果Table 2. Test results of eye extraction from normal cooked shrimp training set under different color models类别 RGB HSV Lab 虾眼提取准确率 94.70% 98.68% 97.35% 虾眼占比平均值 0.011 0.0093 0.0094 虾眼占比最大值 0.027 0.019 0.021 虾眼占比最小值 0.0029 0.0017 0.0015 2.1.2 三种颜色模型的训练结果
提取褐变特征首先需要排除虾眼的干扰,虾眼剔除方法已在上述给出,在经过图像预处理后,褐变虾与正常虾剔除虾眼并提取褐变特征的整个过程如图5所示,正常虾由于未发生褐变,删除虾眼区域后,呈现图像为纯黑。
此外,所构建的不同颜色模型提取对虾褐变区域的效果存在差异,使用RGB颜色模型提取的褐变区域较HSV、Lab颜色模型更为完整,但也可能存在过分割的问题,这是由于不同模型所使用的对应分量存在差异,图6为三种颜色模型提取熟对虾褐变特征的主要过程。
基于上述结果,三种不同颜色模型下熟对虾训练集的试验结果见表3,分割准确率表示成功剔除虾眼保留褐变区域的对虾图像数目与图像总数比,该情况下的分割准确率即为识别准确率。耗时表示单只虾所耗费的时间,包括图像预处理中读取图像时间、提取感兴趣区域二值图像的时间、中值滤波及连通域方法等形态学操作的时间与剔除虾眼、保留褐变特征等消耗的时间总和。从中可以得出,剔除虾眼提取褐变特征的方法对褐变虾的识别率相较于正常虾更高,但对未出现褐变的正常虾,显然不必进行褐变特征提取。为了简化流程并提高正常虾识别率,可将虾眼与褐变区域之和占比e1作为初始阈值,由于正常虾褐变区域占比e2为0,将e1作为判断该对虾是否正常的指标,若e1小于设定阈值,则为正常;若e1大于设定阈值,则初步判断其为褐变虾,需进一步剔除虾眼提取褐变特征。
表 3 不同颜色模型下熟对虾训练集试验结果Table 3. Test results of cooked shrimp training set in different color models类型
RGB
HSV
Lab分割准确率(%) 耗时(ms) 分割准确率(%) 耗时(ms) 分割准确率(%) 耗时(ms) 正常虾 82.12 67 86.09 70 86.09 79 褐变虾 92.42 68 93.94 71 89.39 89 三种颜色模型下的虾眼占比数据已在表2给出,根据该表设定了不同阈值e1进行试验,结果如表4所示,表明设定阈值e1的方法既提高了正常虾识别率,又使褐变虾识别率保持在原先附近水平。
表 4 不同颜色模型下熟对虾训练集设定阈值e1的试验结果Table 4. Test results of setting threshold e1 of cooked shrimp training set in different color models阈值e1
RGB
HSV
Lab正常虾识别率
(%)褐变虾识别率
(%)平均识别率
(%)正常虾识别率
(%)褐变虾识别率
(%)平均识别率
(%)正常虾识别率
(%)褐变虾识别率
(%)平均识别率
(%)0.025 99.34 89.39 96.31 100 80.30 94.01 100 74.24 92.17 0.024 98.68 90.91 96.31 100 80.30 94.01 100 75.76 92.63 0.023 98.01 90.91 95.85 100 81.82 94.47 100 77.27 93.09 0.022 98.01 92.42 96.31 100 84.85 95.39 100 77.27 93.09 0.021 98.01 92.42 96.31 100 86.36 95.85 100 78.79 93.55 0.02 98.01 92.42 96.31 100 86.36 95.85 99.34 78.79 93.09 0.019 97.35 92.42 95.85 100 86.36 95.85 99.34 80.30 93.55 0.018 97.35 92.42 95.85 99.34 89.39 96.31 98.68 80.30 93.09 0.017 95.36 92.42 94.47 99.34 92.42 97.24 98.01 80.30 92.62 0.016 94.04 92.42 93.55 98.68 92.42 96.78 98.01 80.30 92.62 0.015 87.42 92.42 88.94 98.01 93.94 96.78 96.69 81.82 92.17 0.014 82.12 92.42 85.25 92.72 93.94 93.09 93.38 86.36 91.24 0.013 78.81 92.42 82.95 89.40 93.94 90.78 90.73 87.88 89.86 0.012 69.54 92.42 76.50 86.09 93.94 88.48 88.74 87.88 88.48 0.011 54.97 92.42 66.36 78.15 93.94 82.95 80.79 87.88 82.95 注:表中斜体加粗表示当前颜色空间对应识别率的最优数据。 2.2 熟对虾测试集及验证集的试验结果与分析
根据表4给出的熟对虾训练集试验结果,选取三种颜色模型对应最优阈值e1对测试集进行试验,见表5。结果显示,所构建RGB颜色模型平均识别率最高,达到92.77%,但耗时略长于HSV、Lab颜色模型,单只虾识别的平均耗时需91.36 ms。Lab在三种颜色模型中耗时最短,平均识别率仅次于RGB颜色模型。
表 5 不同颜色模型下熟对虾测试集在最优阈值下的试验结果Table 5. Test results of cooked shrimp test set under optimal threshold in different color models颜色空间类型 正常虾识别率(%) 褐变虾识别率(%) 平均识别率(%) 平均耗时(ms) RGB 96.55 84.00 92.77 91.36 HSV 98.28 70.00 89.76 91.17 Lab 100.00 68.00 90.36 90.44 本研究在此基础上就对虾褐变判别追加了相应的验证集,以此进一步验证方法的可靠性。试验结果见表6,结果显示在验证集试验中,各个颜色模型同样表现出良好的应用效果。
表 6 不同颜色模型下熟对虾验证集在最优阈值下的试验结果Table 6. Test results of cooked shrimp verification set under optimal threshold in different color models颜色模型类型 正常虾识别率(%) 褐变虾识别率(%) 平均识别率(%) 平均耗时(ms) RGB 100.00 93.33 98 86.1 HSV 100.00 86.67 96 89.1 Lab 98.57 80.00 93 90.2 综上,通过引入颜色简化模型提取对虾的颜色特征,判别对虾是否发生褐变的方法在识别率与运行效率上均具有一定可行性。
2.3 所提方法对比试验结果与分析
本文所提颜色空间提取方法适用于识别正常熟对虾以及褐变熟对虾的情况,对虾次品杂质包含了褐变虾、残缺虾,剔除次品杂质中的褐变虾具有显著意义。列举了本文构建三种颜色特征模型识别方法与传统对虾次品识别方法的对比结果,如表7所示。
表 7 本文所提方法与此前提出的方法对比Table 7. Comparison between the method proposed in this paper and the methods proposed before从表7中可以看出,本研究所提方法的算法复杂度较低,较此前方法的识别率与运行效率均有所提高。通过试验分析,RGB颜色模型在三种颜色模型中识别率最高,能够很有效地运用于检测对虾褐变,且在运行效率上也具有良好表现。
2.4 基于RGB颜色特征的对虾褐变程度分级试验
对虾不同部位多酚氧化酶的酶活性不同[35],导致各个部位褐变的顺序和程度不同。在实际生产中,工作人员根据褐变面积、褐变深浅对熟对虾进行品质分类。图7为不同程度褐变的熟对虾经过颜色模型提取褐变区域并剔除虾眼的结果。
本文选用以上构建的RGB模型根据表1的分级标准用于测试集试验,设定初始阈值e1为0.02,试验结果见表8,其中一级品数目112只,二级品17只,三级品29只。116幅正常熟对虾图像中作为一级品的数目112只,其中4只正常虾被判别为褐变虾;而50幅褐变熟对虾图像中仅4幅被误判为正常虾,及未成功提取褐变特征4幅。
表 8 测试集熟对虾分级结果Table 8. The grading results of tested cooked shrimps熟对虾等级 分级数目 一级品 112 二级品 13 三级品 29 表7结果显示了总体分级准确率可达到92.77%,因此,本研究方法能够代替人工对熟对虾褐变程度分级,从而剔除鲜度较低的对虾,甄选出品质良好的对虾。
3. 结论
本文针对褐变熟对虾在传统人工挑拣方式下存在分选效率低、精度差的问题,提出了一种基于颜色简化模型的熟对虾褐变特征提取方法。通过试验,本文可得出结论如下:
a.本研究构建了三种颜色模型分别提取对虾的褐变区域,将褐变区域占比作为判别对虾是否发生褐变的条件,相较于双阈值分割法[30],不易发生误分割现象,能取得较高的识别率。在对116幅正常虾和50幅褐变虾测试集样本的试验中,所构建的RGB颜色模型识别率最高,可达到92.77%,识别速率达到91.36 ms/只,在识别率及运行效率上均具有一定优势。
b.本文所提方法避免了传统分拣中受到人为主观意志的影响,具有快速无损检测、识别精度高、智能化的特点,有助于保证虾类产品的鲜度。在实际的运用中相较于人工筛选具有更大的优越性,在未来的对虾加工产业有较高的商业价值和良好的商业前景。
本研究也存在一些不足,未将不同部位发生褐变的虾分类,只是从宏观上将发生褐变的虾识别出来并分级。在今后的研究中,将探究其他方法实现对不同部位发生褐变的虾分类,并提高识别准确率。
-
表 1 熟对虾分级标准
Table 1 Grading standard for cooked shrimp
熟对虾等级 褐变区域占比e2 一级品 0 二级品 (0,0.05] 三级品 (0.05,+∞) 表 2 不同颜色模型下正常熟对虾训练集虾眼提取试验结果
Table 2 Test results of eye extraction from normal cooked shrimp training set under different color models
类别 RGB HSV Lab 虾眼提取准确率 94.70% 98.68% 97.35% 虾眼占比平均值 0.011 0.0093 0.0094 虾眼占比最大值 0.027 0.019 0.021 虾眼占比最小值 0.0029 0.0017 0.0015 表 3 不同颜色模型下熟对虾训练集试验结果
Table 3 Test results of cooked shrimp training set in different color models
类型
RGB
HSV
Lab分割准确率(%) 耗时(ms) 分割准确率(%) 耗时(ms) 分割准确率(%) 耗时(ms) 正常虾 82.12 67 86.09 70 86.09 79 褐变虾 92.42 68 93.94 71 89.39 89 表 4 不同颜色模型下熟对虾训练集设定阈值e1的试验结果
Table 4 Test results of setting threshold e1 of cooked shrimp training set in different color models
阈值e1
RGB
HSV
Lab正常虾识别率
(%)褐变虾识别率
(%)平均识别率
(%)正常虾识别率
(%)褐变虾识别率
(%)平均识别率
(%)正常虾识别率
(%)褐变虾识别率
(%)平均识别率
(%)0.025 99.34 89.39 96.31 100 80.30 94.01 100 74.24 92.17 0.024 98.68 90.91 96.31 100 80.30 94.01 100 75.76 92.63 0.023 98.01 90.91 95.85 100 81.82 94.47 100 77.27 93.09 0.022 98.01 92.42 96.31 100 84.85 95.39 100 77.27 93.09 0.021 98.01 92.42 96.31 100 86.36 95.85 100 78.79 93.55 0.02 98.01 92.42 96.31 100 86.36 95.85 99.34 78.79 93.09 0.019 97.35 92.42 95.85 100 86.36 95.85 99.34 80.30 93.55 0.018 97.35 92.42 95.85 99.34 89.39 96.31 98.68 80.30 93.09 0.017 95.36 92.42 94.47 99.34 92.42 97.24 98.01 80.30 92.62 0.016 94.04 92.42 93.55 98.68 92.42 96.78 98.01 80.30 92.62 0.015 87.42 92.42 88.94 98.01 93.94 96.78 96.69 81.82 92.17 0.014 82.12 92.42 85.25 92.72 93.94 93.09 93.38 86.36 91.24 0.013 78.81 92.42 82.95 89.40 93.94 90.78 90.73 87.88 89.86 0.012 69.54 92.42 76.50 86.09 93.94 88.48 88.74 87.88 88.48 0.011 54.97 92.42 66.36 78.15 93.94 82.95 80.79 87.88 82.95 注:表中斜体加粗表示当前颜色空间对应识别率的最优数据。 表 5 不同颜色模型下熟对虾测试集在最优阈值下的试验结果
Table 5 Test results of cooked shrimp test set under optimal threshold in different color models
颜色空间类型 正常虾识别率(%) 褐变虾识别率(%) 平均识别率(%) 平均耗时(ms) RGB 96.55 84.00 92.77 91.36 HSV 98.28 70.00 89.76 91.17 Lab 100.00 68.00 90.36 90.44 表 6 不同颜色模型下熟对虾验证集在最优阈值下的试验结果
Table 6 Test results of cooked shrimp verification set under optimal threshold in different color models
颜色模型类型 正常虾识别率(%) 褐变虾识别率(%) 平均识别率(%) 平均耗时(ms) RGB 100.00 93.33 98 86.1 HSV 100.00 86.67 96 89.1 Lab 98.57 80.00 93 90.2 表 7 本文所提方法与此前提出的方法对比
Table 7 Comparison between the method proposed in this paper and the methods proposed before
表 8 测试集熟对虾分级结果
Table 8 The grading results of tested cooked shrimps
熟对虾等级 分级数目 一级品 112 二级品 13 三级品 29 -
[1] LIU Z H, JIA X J, XU X S. Study of shrimp recognition methods using smart networks[J]. Computers and Electronics in Agriculture,2019,165:104926. doi: 10.1016/j.compag.2019.104926
[2] MATSUMOTO M, YAMANAKA H. Post-mortem biochemical changes in the muscle of Kuruma shrimp during storage and evaluation of the freshness[J]. Bull Jap Soc Sei Fish,1990,56(7):1145−1149. doi: 10.2331/suisan.56.1145
[3] 殷磊. 即食干制对虾加工工艺及货架期预测[D]. 保定: 河北农业大学, 2018 YIN L. Ready-to-eat dried shrimp processing technology and shelf life prediction[D]. Baoding: Hebei Agricultural University, 2018.
[4] 陈飞东, 戴志远, 王宏海. 虾保鲜冰对南美白对虾保鲜效果影响[J]. 食品研究与开发,2009,31(1):120−123. [CHEN F D, DAI Z Y, WANG H H. Study on preparation effect of fresh ice for white leg shrimp[J]. Food Research and Development,2009,31(1):120−123. doi: 10.3969/j.issn.1005-6521.2009.01.036 CHEN F D, DAI Z Y, WANG H H. Study on preparation effect of fresh ice for white leg shrimp[J]. Food Research and Development, 2009, 31(1): 120-123. doi: 10.3969/j.issn.1005-6521.2009.01.036
[5] 农业农村部渔业渔政管理局. 2020中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2021 Fishery Administration of Ministry of Agriculture and Rural Affairs. China fishery statistics yearbook 2020[M]. Beijing: China Agriculture Press, 2021.
[6] 张高静, 韩丽萍, 孙剑锋, 等. 南美白对虾营养成分分析与评价[J]. 中国食品学报,2013,13(8):254−260. [ZHANG G J, HAN L P, SUN J F, et al. Analysis and evaluation of nutritive composition in Penaeus vannamei[J]. J Chin Inst Food Sci Technol,2013,13(8):254−260. ZHANG G J, HAN L P, SUN J F, et al. Analysis and evaluation of nutritive composition in Penaeus vannamei[J]. J Chin Inst Food Sci Technol, 2013, 13(8): 254‒260.
[7] 中华人民共和国农业部. 中华人民共和国水产行业标准. 冻熟对虾[S]. 2012, 1−2 The Ministry of Agriculture of the People's Republic of China. Fishery industry standard of the People's Republic of China. Frozen cooked shrimp[S]. 2012, 1−2.
[8] 徐德峰, 李彩虹, 孙力军, 等. 冷藏南美白对虾丝氨酸蛋白酶活力与黑变相关性研究[J]. 现代食品科技,2014,30(2):100−104. [XU D F, LI C H, SUN L J, et al. The melanosis, serine protease activity and their correlation of Litopenaeus vannamei during cold storage[J]. Modern Food Science and Technology,2014,30(2):100−104. XU D F, LI C H, SUN L J, et al. The melanosis, serine protease activity and their correlation of Litopenaeus vannamei during cold storage[J]. Modern Food Science and Technology, 2014, 30(2): 100-104.
[9] 吕艳芳, 蔡路昀, 李颖畅, 等. 冰温下复合保鲜剂和焦亚硫酸钠对南美白对虾防黑变保鲜效果比较[J]. 中国食品学报,2017,17(7):129−138. [LÜ Y F, CAI L Y, LI Y C, et al. The comparison between compound preservatives and sodium metabisulfitetreatment on the anti-melanosis effect of Penaeus vannamei under ice-temperature[J]. Chinese Journal of Food,2017,17(7):129−138. LÜ Y F, CAI L Y, LI Y C, etal. The comparison between compound preservatives and sodium metabisulfitetreatment on the anti-melanosis effect of Penaeus vannamei under ice-temperature[J]. 2017, 17(7): 129-138.
[10] LIU Z H, CHENG F, ZHANG W. Recognition-based image segmentation of touching pairs of cooked shrimp (Penaeus orientalis) using improved pruning algorithm for quality measurement[J]. Journal of Food Engineering,2017,195(feb.):166−181.
[11] 黄万有, 吉宏武, 刘书成, 等. 凡纳滨对虾PPO的组织分布和活性与其贮藏过程中黑变的关系[J]. 现代食品科技,2014,30(2):89−94. [HUANG W Y, JI H W, LIU S C, et al. Relation of tissue distribution and activity of polyphenol oxidase from Litopenaeus vannamei and its melanosis during storage[J]. Modern Food Science and Technology,2014,30(2):89−94. HUANG W Y, JI H W, LIU S C, et al. Relation of tissue distribution and activity of polyphenol oxidase from Litopenaeus vannamei and its melanosis during storage[J]. Modern Food Science and Technology, 2014, 30(2): 89-94.
[12] 凌萍华, 谢晶. 冰温技术结合保鲜剂对南美白对虾品质的影响[J]. 食品科学,2010,31(14):280−284. [LING P H, XIE J. Effects of super-chilling combined with preservatives on chemical, biochemical and sensory properties of Pacific white shrimp[J]. Food Science,2010,31(14):280−284. LING P H, XIE J. Effects of super-chilling combined with preservatives on chemical, biochemical and sensory properties of Pacific white shrimp[J]. Food Science, 2010, 31(14): 280-284.
[13] 陈田聪, 谢达祥, 陈晓汉. 南美白对虾淡水养殖常见病害及防治措施[J]. 南方农业,2018,12(20):145−147. [CHEN T C, XIE D X, CHEN X H. Common diseases of freshwater shrimp and control measures[J]. South China Agriculture,2018,12(20):145−147. CHEN T C, XIE D X, CHEN X H. Common diseases of freshwater shrimp and control measures[J]. South China Agriculture, 2018, 12(20): 145-147.
[14] 高学礼, 李月娟. 对虾加工鲜度控制及检验[J]. 中国酿造,2009(6):144−145. [GAO X L, LI Y J. Control and inspection of shrimp freshness during processing[J]. China Brewing,2009(6):144−145. doi: 10.3969/j.issn.0254-5071.2009.06.046 GAO X L, LI Y J. Control and inspection of shrimp freshness during processing[J]. China Brewing, 2009(6): 144-145. doi: 10.3969/j.issn.0254-5071.2009.06.046
[15] LIU Z H, CHENG F, GONG Z Y, et al. Automatic system for eliminating shrimp impurities using iteration algorithm[J]. International Agricultural Engineering Journal,2016,25(4):210−224.
[16] LUZURIAGA D A, BALABAN M O, YERALAN S. Analysis of visual quality attributes of white shrimp by machine vision[J]. Journal of Food Science,1997,62(1):113−118. doi: 10.1111/j.1365-2621.1997.tb04379.x
[17] MOHEBBI M, AKBARZADEH-T M R, SHAHIDI F, et al. Computer vision systems (CVS) for moisture content estimation in dehydrated shrimp[J]. Computers and Electronics in Agriculture,2009,69(2):128−134. doi: 10.1016/j.compag.2009.07.005
[18] 贾磊, 陈俊超. 机器视觉的水产食品外观品质检测系统[J]. 食品工业,2021,42(5):266−268. [JIA L, CHEN J C. Machine vision inspection system for appearance quality of aquatic food[J]. Food Industry,2021,42(5):266−268. JIA L, CHEN J C. Machine vision inspection system for appearance quality of aquatic food[J]. Food Industry, 2021, 42(5): 266‒268.
[19] 章建设, 陈玉玲, 谢主兰. 对虾产品质量安全标准要求[J]. 食品安全导刊,2015(15):154−156. [ZHANG J S, CHEN Y L, XIE Z L. Quality and safety standard requirements for prawn products[J]. China Food Safety Magazine,2015(15):154−156. ZHANG J S, CHEN Y L, XIE Z L. Quality and safety standard requirements for prawn products[J]. China Food Safety Magazine, 2015(15): 154‒156.
[20] 黄卉, 李来好, 杨贤庆, 等. 对虾产品质量分级要素及评价技术[J]. 中国水产科学,2010,17(6):1371−1376. [HUANG H, LI L H, YANG X Q, et al. Quality grading factors and evaluation technology of prawn[J]. Journal of Fishery Sciences of China,2010,17(6):1371−1376. HUANG H, LI L H, YANG X Q, et al. Quality grading factors and evaluation technology of prawn[J]. Journal of Fishery Sciences of China, 2010, 17(6): 1371-1376.
[21] 贾志鑫, 傅玲琳, 杨信廷, 等. 机器视觉技术在水产食品感官检测方面的应用研究进展[J]. 食品科学,2019,40(13):320−325. [JIA Z X, FU Z L, YANG X T, et al. A review of the application of machine vision technique in sensory testing of aquatic foods[J]. Food Science,2019,40(13):320−325. doi: 10.7506/spkx1002-6630-20180730-364 JIA Z X, FU Z L, YANG X T, et al. A review of the application of machine vision technique in sensory testing of aquatic foods[J]. Food Science, 2019, 40(13): 320-325. doi: 10.7506/spkx1002-6630-20180730-364
[22] 余博文. 数字图像阈值分割研究与应用[J]. 科学技术创新,2021(19):91−92. [YU B W. Research and application of digital image threshold segmentation[J]. Scientific and Technological Innovation,2021(19):91−92. doi: 10.3969/j.issn.1673-1328.2021.19.040 YU B W. Research and application of digital image threshold segmentation[J]. Scientific and Technological Innovation, 2021(19): 91‒92. doi: 10.3969/j.issn.1673-1328.2021.19.040
[23] 王羿翔. 激光标刻扫描路径生成算法研究[D]. 武汉: 武汉大学, 2017 WANG Y X. Research on laser marking scan path generation algorithm[D]. Wuhan: Wuhan University, 2017.
[24] 燕红文, 邓雪峰. 中值滤波在数字图像去噪中的应用[J]. 计算机时代,2020(2):47−49. [YAN H W, DENG X F. Application of median filter in digital image denoising[J]. Computer Era,2020(2):47−49. YAN H W, DENG X F. Application of median filter in digital image denoising[J]. Computer Era, 2020(2): 47‒49.
[25] 孙全鑫. 基于颜色特征提取的辣椒自动分类系统的设计与实现[D]. 长春: 吉林大学, 2013 SUN Q X. Design and implementation based on color feature extraction of pepper automatic classification system[D]. Changchun: Jilin University, 2013.
[26] 杨奥博, 盛家川, 李玉芝, 等. 基于HSV空间的颜色特征提取[J]. 电脑知识与技术,2017,13(18):193−195. [YANG A B, SHENG J C, LI Y Z, et al. Color feature extraction based on HSV space[J]. Computer Knowledge and Technology,2017,13(18):193−195. YANG A B, SHENG J C, LI Y Z, et al. Color feature extraction based on HSV space[J]. Computer Knowledge and Technology, 2017, 13(18): 193-195.
[27] GUPTE V. Color constancy, by Marc Ebner (Wiley; 2007) pp 394 ISBN 978-0-470-05829-9 (HB)[J]. Coloration Technology,2009,125(6):366−367. doi: 10.1111/j.1478-4408.2009.00219.x
[28] BASIRI S, SHEKARFOROUSH S S, AMINLARI M, et al. The effect of pomegranate peel extract (PPE) on the polyphenol oxidase (PPO) and quality of Pacific white shrimp (Litopenaeus vannamei) during refrigerated storage[J]. LWT-Food Science and Technology,2015,63(1):798−798. doi: 10.1016/j.lwt.2015.04.001
[29] 石美红, 申亮, 龙世忠, 等. 从RGB到HSV色彩空间转换公式的修正[J]. 纺织高校基础科学学报,2008(3):351−356. [SHI M H, SHEN L, LONG S Z, etal. The revision of conversion formula from RGB color space to HSV color space[J]. Basic Sciences Journal of Textile Universitles,2008(3):351−356. doi: 10.3969/j.issn.1006-8341.2008.03.023 SHI M H, SHEN L, LONG S Z, etal. The revision of conversion formula from RGB color space to HSV color space[J]. Basic Sciences Journal of Textile Universitles, 2008(3): 351-356. doi: 10.3969/j.issn.1006-8341.2008.03.023
[30] 洪寒梅. 黑变熟对虾的机器视觉识别方法研究[D]. 杭州: 浙江大学, 2015 HONG H M. Research of melanotic cooked shrimp recognition method using machine vision[D]. Hangzhou: Zhejiang University, 2015.
[31] 刘子豪. 基于机器视觉技术的南美白对虾分类算法研究与在线实现[D]. 杭州: 浙江大学, 2016 LIU Z H. Study and online verification for shrimp classification algorithm based on machine vision technology[D]. Hangzhou: Zhejiang University, 2016.
[32] 浙江省海洋与渔业局. DB4155-2003 海捕虾质量要求[S]. 2003 Zhejiang Ocean and Fishery Bureau. DB14155-2003, Quality requirements for marine shrimp fishing[S]. 2003.
[33] 张伟. 基于机器视觉技术的缺损对虾在线识别与剔除系统研究[D]. 杭州: 浙江大学, 2018 ZHANG W. Study of on-line identification and elimination system for incomplete shrimp based on machine vision technology[D]. Hangzhou: Zhejiang University, 2018.
[34] LIU Z H, CHENG F, HONG H M. Identification of impurities in fresh shrimp using improved majority scheme-based classifier[J]. Food Analytical Methods,2016,9(11):1−10.
[35] 蔡燕萍, 张建友. 虾体多酚氧化酶特性及其抑制技术研究进展[J]. 食品工业科技,2012,33(13):424−428. [CAI Y P, ZHANG J Y. Research progress in characterizationand inhibition of shrimp polyphenol oxidase[J]. Science and Technology of Food Industry,2012,33(13):424−428. CAI Y P, ZHANG J Y. Research progress in characterizationand inhibition of shrimp polyphenol oxidase[J]. Science and Technology of Food Industry, 2012, 33(13): 424-428.
-
期刊类型引用(1)
1. 程娟娟,程江华,蔡永萍,万娅琼,徐雅芫. 大豆肽的功能活性及在食品加工产业中的应用. 中国调味品. 2024(06): 200-205 .  百度学术
百度学术
其他类型引用(0)






 下载:
下载:







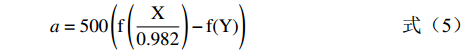
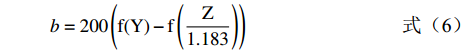
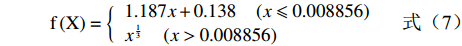
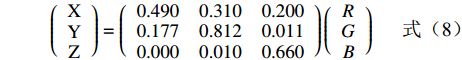






 下载:
下载:



