Protective Effect and Mechanism of D-ribose on Doxorubicin-induced Cardiotoxicity
-
摘要: 目的:研究D-核糖对阿霉素(Doxorubicin,DOX)诱导的小鼠心脏毒性保护作用及机制。方法:8周龄雄性ICR小鼠随机分为对照组(Con),模型组(DOX)组,D-核糖低剂量组(LDR),D-核糖高剂量组(HDR),每组10只。采用单次腹腔注射大剂量阿霉素(15 mg/kg)建立DOX急性心脏毒性小鼠模型,检测血清中乳酸脱氢酶(lactate dehydrogenase,LDH)活性和心脏组织三磷酸腺苷(adenosine triphosphate,ATP)含量;通过苏木素-伊红(hematoxylin-eosin stain,HE)染色观察心肌组织病理变化;通过检测心肌组织内总超氧化物歧化酶(Total superoxide dismutase,T-SOD)、过氧化氢酶(Catalase,CAT)活性以及丙二醛(Malondialdehyde,MDA)含量,评价心脏氧化应激水平;采用蛋白免疫印迹法(Western blot)检测沉默信息调节因子2相关酶类1(silent mating type information regulation 2 homolog 1,Sirt1)、过氧化物酶体增殖物激活受体γ共激活因子1α(peroxisome proliferator-activated receptor γ coactivator-1α,PGC-1α)、B淋巴细胞瘤-2(B-cell lymphoma 2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)、半胱氨酸天冬氨酸蛋白酶3(cysteine-containing aspartate specific protease 3,Caspase-3)的表达。结果:DOX可引起小鼠体质量显著降低(P<0.05),血清LDH活性显著升高(P<0.05),心肌抗氧化酶活力显著降低(P<0.05);与DOX组相比,高剂量D-核糖可以显著降低血清LDH水平(P<0.05),提高心肌抗氧化酶活力(P<0.05),提高Sirt1、PGC-1α、Bcl-2蛋白表达水平(P<0.05),降低Caspase-3、Bax蛋白表达水平(P<0.05)。结论:高剂量D-核糖可以通过激活Sirt1/PGC-1α通路,缓解氧化应激,抑制心肌细胞凋亡,降低阿霉素诱导的急性心脏毒性。Abstract: Objective: To study the protective effect and mechanism of D-ribose on Doxorubicin (DOX)-induced cardiotoxicity in mice. Methods: Eight-week-old male ICR mice were randomly divided into normal group (Con), model (DOX) group, D-ribose low-dose group (LDR) and D-ribose high-dose group (HDR), with 10 mice in each group. DOX acute cardiotoxicity mouse model was established by a single intraperitoneal injection of high dose doxorubicin (15 mg/kg). Lactate dehydrogenase (LDH) activity levels in serum and adenosine triphosphate (ATP) content in heart tissue were detected by the commercial kits. The pathological changes of myocardial tissue were observed by hematoxylin-eosin stain (HE) staining. Cardiac oxidative stress was assessed by measuring the activities of total superoxide dismutase (T-SOD), catalase (CAT) and malondialdehyde (MDA) in myocardial tissue. The levels of silent mating type information regulation 2 homolog 1 (Sirt1), peroxisome proliferator-activated receptor γ coactivator-1α (PGC-1α), B-cell lymphoma 2 (Bcl-2), Bcl-2 associated X protein (Bax) and cysteine-containing aspartate specific protease 3 (Caspase-3) were detected by Western blotting. Results: DOX could significantly reduce the body weight of mice (P<0.05), serum LDH activity was significantly increased (P<0.05), antioxidant enzyme activity significantly decreased (P<0.05); Oral D-ribose significantly decreased LDH levels (P<0.05) and increased antioxidant enzyme activity (P<0.05), increased Sirt1, PGC-1α, Bcl-2 protein expression levels (P<0.05), decreased Caspase-3, Bax protein expression levels (P<0.05). Conclusion: D-ribose could alleviate the DOX-induced acute cardiotoxicity by activating Sirt1/PGC-1α pathway, inhibiting oxidative stress and apoptosis.
-
Keywords:
- D-ribose /
- doxorubicin /
- cardiotoxicity /
- apoptosis /
- oxidative stress
-
D-核糖(D-ribose,DR)是一种五碳醛糖,天然存在于所有生命细胞中,参与三磷酸腺苷(Adenosine triphosphate,ATP)的合成,在能量代谢中起重要作用[1]。D-核糖作为磷酸戊糖途径的产物,有助于磷酸戊糖途径的循环,增强氧化酶活性,快速清除自由基,提高机体氧化系统的防御能力[2-3]。目前,D-核糖作为一种新食品原料,已广泛应用于饮料、能量棒等多种食品加工中[4]。袁保辉等[5]和张振刚等[3]的研究发现,补充D-核糖可以改善疲劳模型小鼠的心脏损伤,延长小鼠游泳时间并促进疲劳小鼠体能恢复;临床研究表明,D-核糖对慢性疲劳综合征[6]、纤维肌痛[7]和充血性心力衰竭患者舒张功能障碍[8]等具有一定的改善作用。此外,已有研究表明:补充D-核糖可以改善大鼠心肌缺血再灌注损伤[9-10]。以上研究结果表明,D-核糖具有一定的心脏保护作用。
近年来,癌症的发病率和死亡率呈逐年上升趋势,严重危害人类的健康[11]。阿霉素(Doxorubicin,DOX)作为蒽环类化疗药物的代表,是目前临床最常用的高效广谱抗肿瘤药物之一,但因严重的心脏毒性限制了其应用[12]。研究表明,口服D-核糖对心脏具有保护作用,并能减轻顺铂介导的肾脏损伤[13]。然而,尚未见D-核糖对DOX心脏毒性保护作用的报道。因此,本研究通过采用单次腹腔注射大剂量阿霉素(15 mg/kg)建立DOX急性心脏毒性小鼠模型,通过检测血清生化指标和心脏组织病理变化评价D-核糖对DOX心脏毒性的保护作用,并进一步通过蛋白免疫印迹法检测凋亡相关蛋白的表达揭示其潜在的分子机制,以期为DOX心脏毒性的防治研究提供一定的参考和理论依据。
1. 材料和方法
1.1 材料与仪器
40只ICR雄性小鼠,8周龄、体重25~30 g 济南朋悦实验动物繁育有限公司(中国济南),实验动物生产许可证号:SCXK鲁2019-0003。所有小鼠均于温度(23±2)℃、湿度(45%±10%)、12 h光照/12 h黑暗循环的环境下饲养,自由进食和饮水。动物实验经聊城大学伦理委员会批准(批准号20200803)。
D-核糖 江西诚志生物工程有限公司;盐酸阿霉素(纯度≥98%,货号:D807083) 上海麦克林生化科技有限公司;乳酸脱氢酶(lactate dehydro-genase,LDH)试剂盒、过氧化氢酶(Catalase,CAT)测定试剂盒、总超氧化物歧化酶(Total superoxide dismutase,T-SOD)测定试剂盒 南京建成生物工程研究所;脂质氧化(Malondialdehyde,MDA)检测试剂盒、增强型ATP检测试剂盒、BCA蛋白浓度测定试剂盒、总蛋白提取试剂盒 上海碧云天有限公司;脱脂奶粉(纯度≥99%,货号:D8340) 北京索莱宝科技有限公司;沉默信息调节因子2相关酶类1(silent mating type information regulation 2 homolog 1,Sirt1)抗体 北京博奥森生物技术有限公司;4%多聚甲醛液、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)抗体 武汉赛维尔生物科技有限公司;过氧化物酶体增殖物激活受体γ共激活因子1α(peroxisome proliferator-activated receptor γ coactivator-1α,PGC-1α)、半胱氨酸天冬氨酸蛋白酶3(cysteine-containing aspartate specific protease 3,Caspase-3)、B淋巴细胞瘤-2(B-cell lymphoma 2,Bcl-2)、HRP-Goat Anti-Rabbit IgG(H+L)、HRP-Goat Anti-Mouse IgG(H+L)抗体 Proteintech、3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phophoate dehy-drogenase,GAPDH)抗体 Cell Signaling Technology。
Centrifuge 5804 R高速台式离心机 德国Eppendorf公司;Tecan Spark®多功能酶标仪 瑞士TECAN公司;PowerPac HC美国伯乐高流电泳仪电源、Mini-PROTEAN Tetra小型垂直电泳槽、Trans-Blot SD转印槽 美国Bio-Rad公司;Tanon-4600SF化学发光图像分析系统 上海天能科技有限公司;OLYMPUS IX73倒置显微镜 日本OLYMPUS。
1.2 实验方法
1.2.1 动物分组及给药
小鼠适应性喂养一周后,随机分为对照组(Con)、模型(DOX)组、D-核糖低剂量组(LDR)、D-核糖高剂量组(HDR),每组10只。Con组、DOX组灌胃给予生理盐水(10 mL/kg),D-核糖低剂量组灌胃给予D-核糖(0.9 g/kg,10 mL/kg),D-核糖高剂量组灌胃给予D-核糖(1.8 g/kg,10 mL/kg),均连续给药7 d。D-核糖的剂量选择参考袁保辉等[5]的方法。在第8 d灌胃结束后30 min,除对照组腹腔注射生理盐水(5 mL/kg,下同)外,其余各组均腹腔注射DOX(15 mg/kg),期间小鼠全部存活。DOX注射48 h后处死小鼠,称体重后摘眼球取血,血液样本在室温下保存30 min, 4000 r/min离心15 min,获得用于生化分析的血清,并保存于−80 ℃冰箱备用。同时收集心脏组织并称重,计算心脏指数。部分心脏用于组织病理检测,部分置于−80 ℃保存,以便进行后续分析。
心脏指数(mg/g)=心脏重量(mg)/体重(g)
1.2.2 血清生化指标检测
小鼠在给予DOX处理48 h后,摘眼球取血,分离血清并保存于−80 ℃冰箱备用。按照LDH测定试剂盒说明书测定血清中LDH水平。
1.2.3 心脏组织苏木素-伊红(Hematoxylin-eosin stain,HE)染色
参考文献[14]方法将心脏组织收集后置于4%多聚甲醛液中固定,48 h后脱水、透明、浸石蜡,包埋,切片,进行HE染色,脱水封片后显微镜观察心肌组织病理学变化。
1.2.4 心脏组织ATP含量测定
称取心脏组织,用ATP检测裂解液匀浆,制备10%组织匀浆。在4 ℃以12000 g离心5 min,收集上清液,通过BCA蛋白质测定试剂盒测定每个样品的蛋白质浓度。按照ATP检测试剂盒说明书测定心脏组织ATP含量。
1.2.5 心脏氧化应激水平分析
称取心脏组织,用预冷的生理盐水匀浆,制备10%组织匀浆。在4 ℃以2500 r/min 离心10 min,收集上清液,通过BCA蛋白质测定试剂盒测定每个样品的蛋白质浓度。严格按照试剂盒说明书,测定心脏组织内T-SOD、CAT活力和MDA含量。
1.2.6 Western blot检测相关蛋白表达水平
用总蛋白提取试剂盒提取心脏组织总蛋白,并用BCA法测定样品蛋白浓度。随后,取等量蛋白样品进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE),使用聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)进行转膜,5%脱脂奶粉室温封闭2 h。分别使用抗Sirt1、PGC-1α、Bax、Bcl-2、Caspase-3、GAPDH抗体4 ℃孵育过夜;洗膜缓冲液(Tris Buffered Saline Tween,TBST)洗膜后加入相应的HRP-Goat Anti-Rabbit IgG(H+L)、HRP-Goat Anti-Mouse IgG(H+L)二抗,室温孵育2 h,采用ECL化学发光法进行显影。使用Image J软件对蛋白表达水平进行定量分析,并将GAPDH作为内参蛋白进行量化。
1.2.7 免疫组织化学法检测Caspase-3表达水平
组织切片经二甲苯脱蜡、梯度乙醇水化后,柠檬酸缓冲液抗原修复,3%的双氧水处理阻断内源性过氧化物酶,正常山羊血清封闭,加入兔源性Caspase-3一抗4 ℃孵育过夜,次日加入山羊抗兔二抗室温孵育,二氨基联苯胺(3,3 N-Diaminobenzidine Tertrahydrochloride,DAB)显色,苏木素复染细胞核,脱水、透明、封片,显微镜下观察拍照。每只鼠选取3张切片,应用Image J软件进行定量分析,取切片中阳性染色的面积占总面积的百分比作为Caspase-3相对表达量进行统计作图[15]。
1.3 数据处理
所有数据以均数±标准误 (mean±SEM)表示,采用GraphPad Prism 5软件进行统计分析并作图,多组间比较采用单因素方差分析,组间两两比较采用Tukey’s检验。其中,P<0.05表示差异显著。
2. 结果与分析
2.1 小鼠体重变化及心脏指数
由表1可知,各组小鼠在进行DOX和D-核糖处理前体重并无明显差异,而在进行DOX处理48 h后,DOX组小鼠的体重较Con组小鼠显著降低(P<0.05)。推测DOX处理后小鼠体重显著下降可能主要与小鼠摄食量下降有关。虽然D-核糖处理组小鼠体重高于DOX组,但并无显著差异(P>0.05)。同时,各组小鼠处理后心脏指数无显著差异(P>0.05),这可能与小鼠心脏质量变小,同时体质量下降有关。
表 1 各组小鼠干预前后体质量变化及心脏指数比较Table 1. Comparison of body weight and heart index of each group before and after treatment指标 Con DOX LDR HDR 初始体重(g) 34.70±0.38 34.58±0.33 34.62±0.73 34.59±0.51 终体重(g) 41.78±0.31 37.85±0.74* 38.72±0.93 39.31±0.55 心脏质量(g) 0.19±0.007 0.18±0.005 0.17±0.006 0.19±0.005 心脏指数(mg/g) 4.52±0.16 4.66±0.15 4.43±0.06 4.72±0.11 注: *表示与对照组相比差异显著,P<0.05。 2.2 D-核糖对DOX介导血清LDH水平的影响
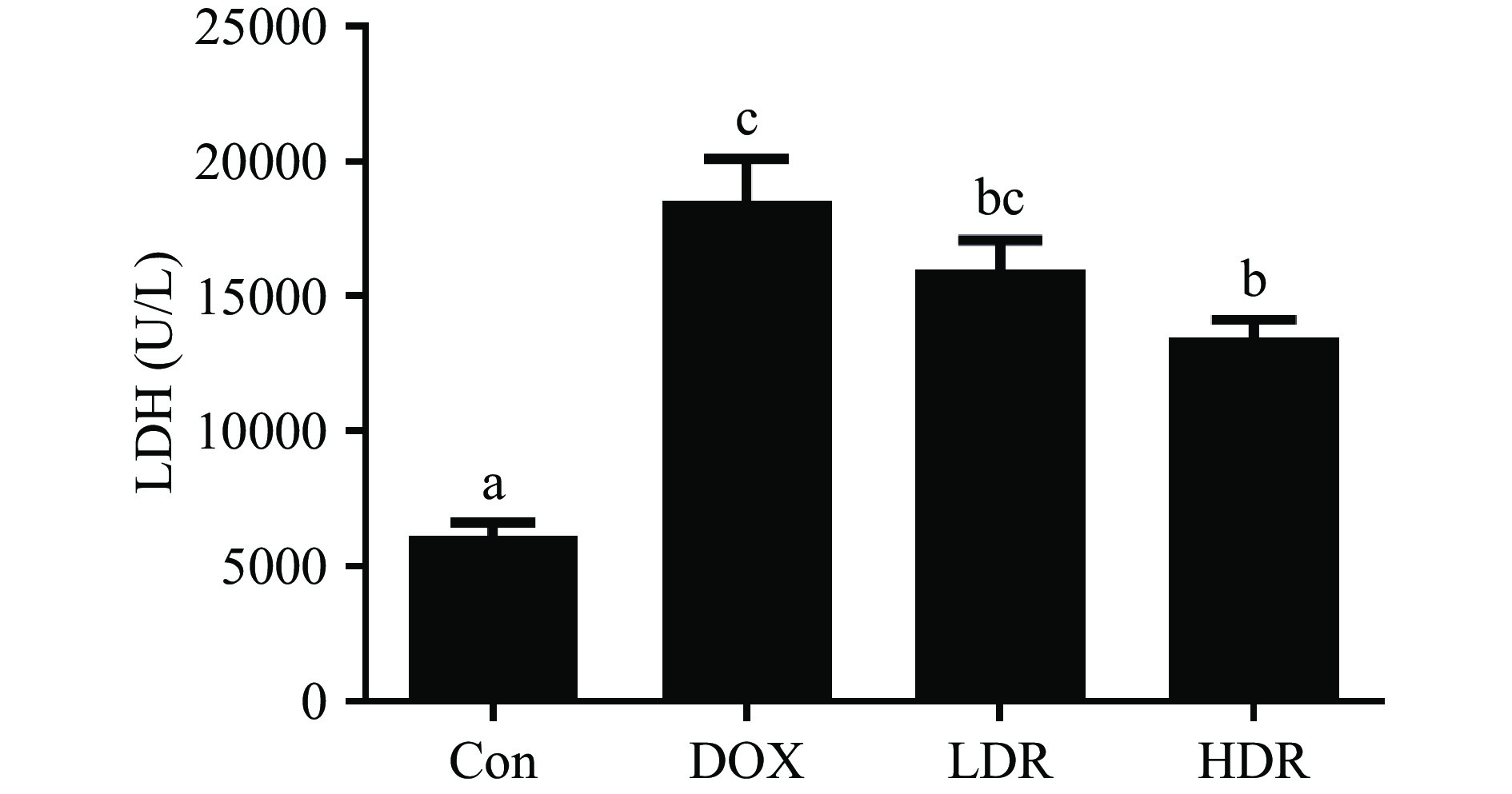
LDH是常见心肌酶之一,在心肌受到损伤时,LDH从受损的心肌细胞膜渗漏到血液中,是心脏毒性的标志酶之一[16]。如图1所示,与Con组比较,DOX组小鼠血清中LDH活性显著升高(P<0.05),表明DOX组小鼠心肌组织损伤严重,DOX诱导心脏毒性造模成功;D-核糖各处理组LDH活性降低,且随D-核糖剂量的增加而下降,HDR组与DOX组具有显著性差异(P<0.05)。这与刘平怀等[10]研究发现的D-核糖可以降低缺血性心肌梗塞大鼠模型LDH活性,改善心功能的结果一致。
2.3 D-核糖对DOX介导心脏组织病理学的影响
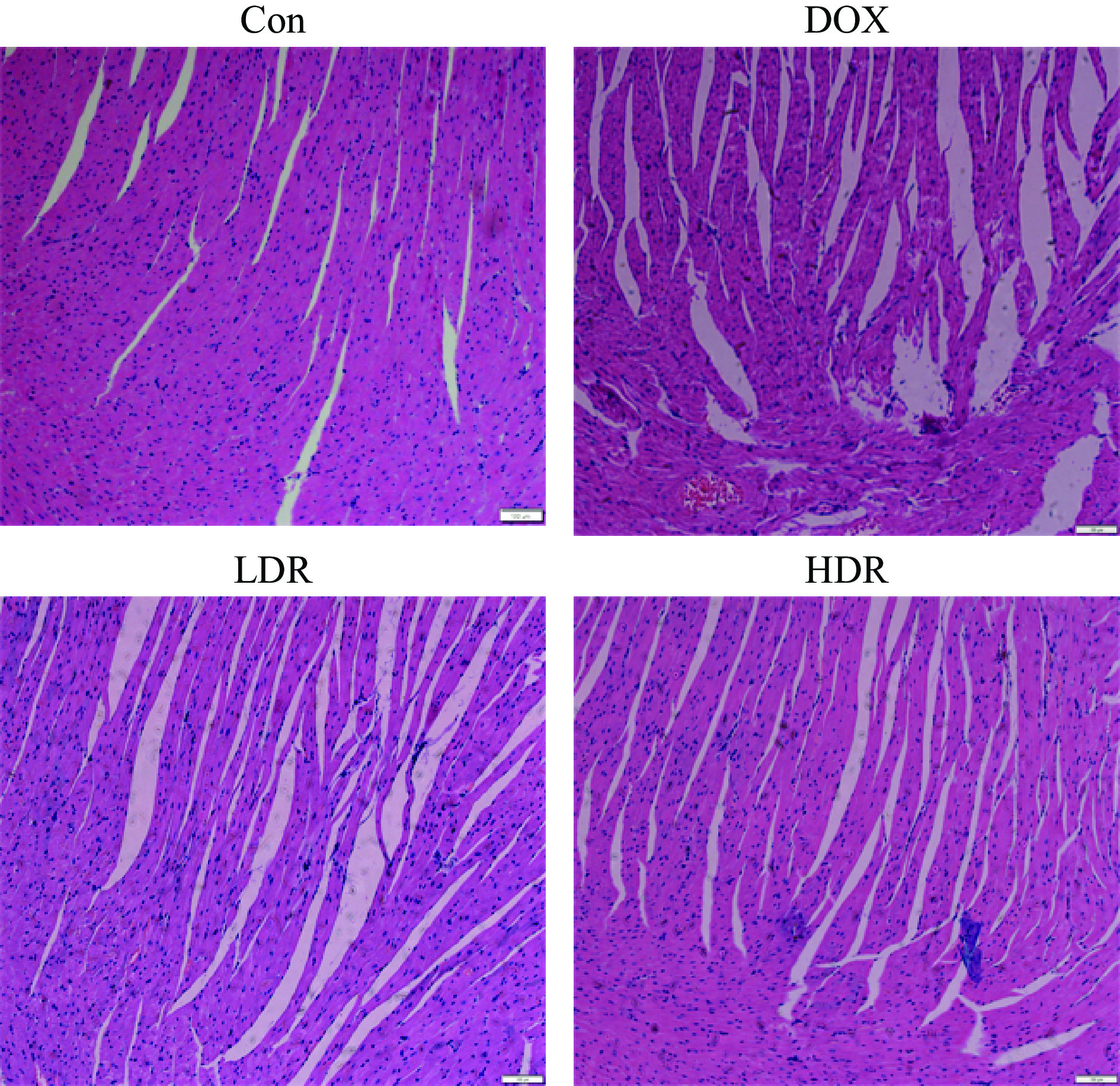
组织病理学研究发现,DOX可以导致心肌细胞发生空泡变性、心肌间隙增宽等病理改变[14, 17]。如图2所示,Con组心肌细胞结构完整,心肌纤维排列整齐,横纹清晰,无明显组织病理学损伤。DOX组心肌细胞内出现空泡变性,心肌细胞间隙明显增宽,表明模型建立成功。与DOX组相比,LDR组没有明显变化,HDR组心肌细胞内可见空泡变性、心肌细胞间隙减少,心肌组织病理学损伤有明显改善。综上所述,D-核糖能使DOX处理小鼠心脏组织形态趋于正常化,具有一定心脏保护作用。
2.4 D-核糖对DOX介导心脏ATP水平的影响
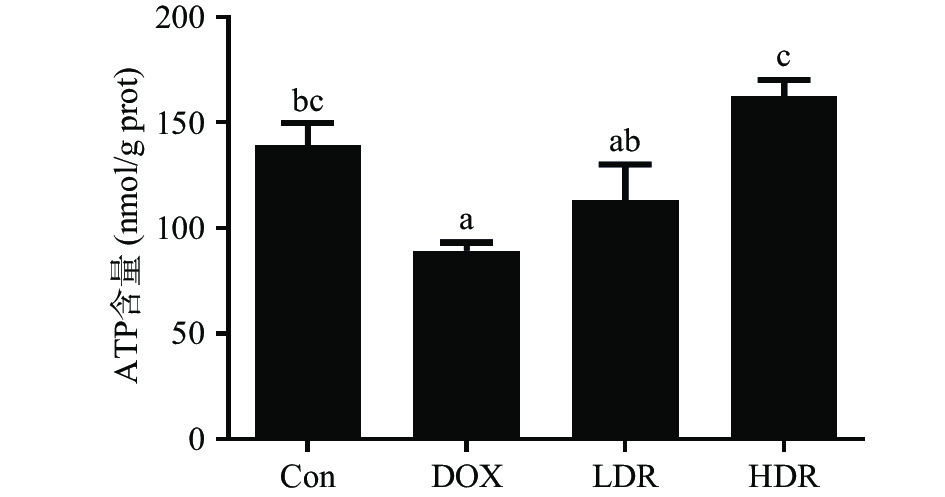
DOX可导致心肌细胞线粒体肿胀和电子传递链的解偶联[18-19],降低心肌细胞内ATP水平(20%~50%),诱发心肌损伤[20-21]。Tang等[22]研究表明,提高心肌组织内ATP水平,可以显著改善DOX介导的心脏损伤(P<0.05)。如图3所示,与Con组比较,DOX可显著降低心脏组织内ATP含量(P<0.05);与DOX组比较,LDR组ATP含量有一定升高,但无显著性差异(P>0.05),而HDR组ATP含量显著升高(P<0.05)。王亚坤等[23]研究发现D-核糖能够补充运动过程中消耗的ATP,对大鼠运动后心脏功能的恢复具有一定的作用。以上结果表明,D-核糖可能通过快速补充ATP,改善小鼠的心脏功能。
2.5 D-核糖对DOX介导心脏氧化应激的影响
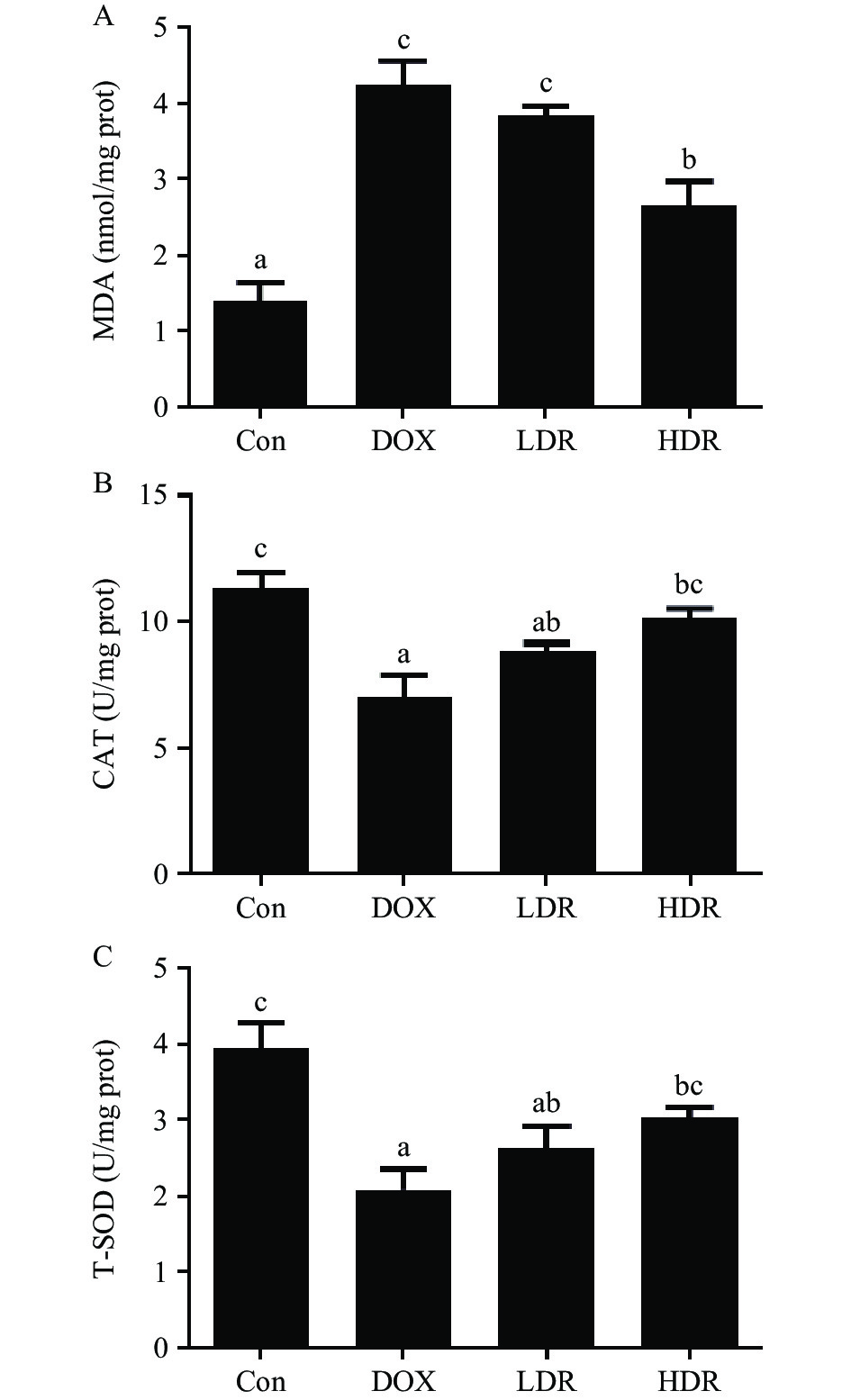
研究表明DOX介导的心脏毒性与氧化应激密切相关[24]。氧化应激导致脂质过氧化物增加、DNA损伤和线粒体功能障碍,引发细胞死亡[25-26]。吴文英等[27]和Zhao等[28]研究发现抑制氧化应激,可以减轻DOX心脏毒性。如图4所示,与Con组比较,DOX可显著增加心脏组织内脂质过氧化产物MDA的含量(P<0.05),并降低心脏组织抗氧化酶T-SOD、CAT活力(P<0.05);与DOX组比较,LDR组MDA含量有一定下降,T-SOD、CAT活力有一定升高,但均无显著性差异(P>0.05),而HDR组MDA含量显著下降,T-SOD、CAT活力显著升高(P<0.05)。上述结果表明,D-核糖可通过抑制DOX介导的氧化应激损伤减轻其心脏毒性。
2.6 D-核糖对DOX介导心脏凋亡相关蛋白表达的影响
研究表明细胞凋亡是DOX心脏毒性的重要机制之一,抑制细胞凋亡能够有效改善DOX诱导的心脏毒性[29-30]。Bcl-2/Bax比值降低启动细胞凋亡,并由Caspase-3蛋白执行细胞凋亡。本研究中,如图5 Western blot结果所示,与Con组小鼠相比,DOX可显著增加小鼠心肌组织内促凋亡蛋白Bax、Capsase-3的表达水平,降低抗凋亡蛋白Bcl-2的表达水平(P<0.05);与DOX组相比,LDR组Bax、Capsase-3表达水平有一定降低,Bcl-2表达水平有一定升高,但无显著性差异(P>0.05);而HDR组Bax、Capsase-3表达水平显著降低,Bcl-2表达水平显著升高(P<0.05)。此外,Caspase-3免疫组织化学结果如图5B、E所示,与Con组相比,DOX组中Caspase-3蛋白阳性表达增强(棕色)。与DOX组比较,LDR组Caspase-3蛋白阳性表达无明显变化,而HDR组Caspase-3蛋白阳性表达明显降低。以上结果显示,D-核糖对DOX心脏损伤的保护作用可能与其抑制细胞凋亡相关。
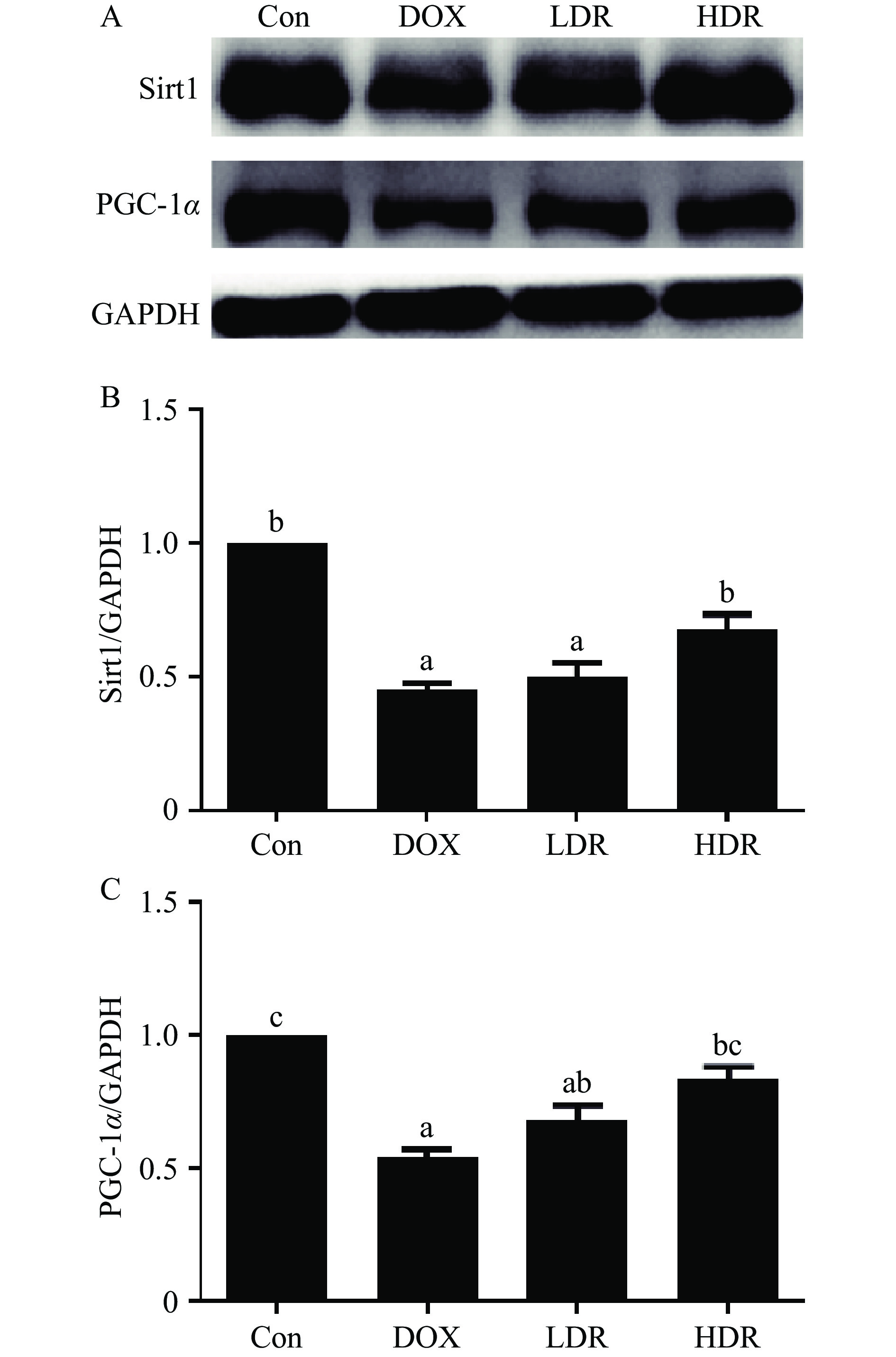
2.7 D-核糖对Sirt1/PGC-1α通路相关蛋白表达的影响
前期研究发现,激活Sirt1/PGC-1α通路,可以降低心脏氧化应激和线粒体损伤,缓解DOX诱导的急性心脏毒性[31-33]。如图6所示,与Con组相比,DOX显著降低Sirt1、PGC-1α表达水平(P<0.05);与DOX组相比,LDR组Sirt1、PGC-1α无显著变化(P>0.05),而HDR组Sirt1、PGC-1α表达水平显著升高(P<0.05)。综上所述,推测D-核糖可能通过激活Sirt1/PGC-1α信号通路,提高ATP水平,改善心肌组织能量代谢;同时抑制氧化应激和细胞凋亡,进而对DOX介导心脏毒性发挥保护作用。
3. 讨论与结论
DOX诱导心脏毒性的机制较为复杂,尚未完全阐明,可能与细胞凋亡、氧化应激、能量代谢障碍、自噬等相关[34-35]。心脏是机体主要的耗能器官之一,线粒体是心肌能量产生和储存的主要场所,心脏损伤时线粒体功能改变导致ATP生成减少,ATP水平是评价心肌损伤的标志之一[36]。本研究中,与Con组相比,DOX组小鼠心脏组织中ATP水平显著降低(P<0.05),提示心肌损伤;与DOX组相比,HDR干预小鼠心脏中ATP水平显著升高(P<0.05),LDR组ATP水平虽然表现出升高的趋势,但无显著性差异(P>0.05),表明HDR可能通过改善线粒体能量代谢改善DOX介导的心肌损伤。
大量研究表明,DOX进入细胞后代谢产生过量的ROS,诱导细胞氧化应激,下调抗凋亡蛋白Bcl-2/凋亡蛋白Bax,触发线粒体依赖的细胞凋亡,抑制细胞凋亡能够有效改善DOX诱导的心脏毒性[29-30]。本研究中,与Con相比,DOX组小鼠心脏中T-SOD、CAT活力显著降低(P<0.05),MDA含量显著增加(P<0.05),提示氧化应激发生;同时,DOX显著上调促凋亡蛋白Bax、Caspase-3表达(P<0.05),下调抗凋亡蛋白Bcl-2表达,提示线粒体依赖的细胞凋亡发生。HDR干预小鼠后,心脏中T-SOD、CAT活力显著升高(P<0.05),MDA水平显著性降低(P<0.05),这与之前的研究一致[3, 37]。此外,与DOX组相比,HDR干预显著下调促凋亡蛋白Bax、Caspase-3表达(P<0.05),上调抗凋亡蛋白Bcl-2表达,但LDR干预对上述指标无显著性影响(P>0.05)。以上结果提示,D-核糖干预可能通过缓解DOX介导的氧化应激抑制线粒体依赖的细胞凋亡,且具有一定的剂量效应。
沉默信息调节因子1(Sirt1)是一种烟酰胺腺苷二核苷酸(NAD+)依赖的转录调节因子参与调控氧化应激、细胞凋亡、线粒体功能等,在DOX介导的心脏毒性中发挥重要的保护作用[38-39]。过氧化物酶体增殖物激活受体γ辅激活因子1α(PGC-1α)是线粒体生物合成、氧化代谢及细胞能量稳态的关键调控分子,在心脏代谢和功能发挥中起重要作用[22, 29]。Liu等[33]研究发现,紫檀茋通过激活Sirt1/PGC-1α通路,降低心脏氧化应激和线粒体损伤,缓解DOX诱导急性心脏毒性。与前述一致,本研究发现DOX显著下调Sirt1、PGC-1α的表达。与DOX组相比,HDR干预显著上调Sirt1、PGC-1α的蛋白表达水平(P<0.05),但LDR干预对Sirt1、PGC-1α表达无显著性影响(P>0.05)。结果表明,HDR可能通过激活Sirt1/PGC-1α通路调控线粒体功能(ATP产生和抗氧化),且具有一定的剂量效应。
本研究初步探究了D-核糖对DOX介导急性心脏毒性的保护作用。高剂量D-核糖干预可显著提高心肌组织中ATP含量,缓解心肌氧化应激,抑制线粒体依赖的细胞凋亡,说明改善心肌细胞线粒体功能可能是D-核糖保护DOX介导心肌损伤的重要机制之一。进一步的机制研究揭示,D-核糖对线粒体功能的改善作用与其激活Sirt1/PGC-1α信号通路有关。然而,D核糖干预对DOX心脏毒性最佳保护效果的剂量值得进一步研究。本实验结果为D-核糖在心血管疾病和肿瘤患者营养配方食品中的应用提供科学依据,有利于促进D-核糖在临床营养领域以及我国特殊医学用途配方食品行业的发展。
-
表 1 各组小鼠干预前后体质量变化及心脏指数比较
Table 1 Comparison of body weight and heart index of each group before and after treatment
指标 Con DOX LDR HDR 初始体重(g) 34.70±0.38 34.58±0.33 34.62±0.73 34.59±0.51 终体重(g) 41.78±0.31 37.85±0.74* 38.72±0.93 39.31±0.55 心脏质量(g) 0.19±0.007 0.18±0.005 0.17±0.006 0.19±0.005 心脏指数(mg/g) 4.52±0.16 4.66±0.15 4.43±0.06 4.72±0.11 注: *表示与对照组相比差异显著,P<0.05。 -
[1] 柏建新, 邓崇亮. D-核糖[J]. 中国食品添加剂,1999(3):60−63. [BAI J X, DENG C L. D-ribose[J]. China Food Additives,1999(3):60−63. BAI J X, DENG C L. D-ribose[J]. China Food Additives, 1999, (3): 60-63.
[2] TEITELBAUM J E, JOHNSON C, CYR J S. The use of D-ribose in chronic fatigue syndrome and fibromyalgia: A pilot study[J]. Journal of Alternative and Complementary Medicine (New York, N. Y. ),2006,12(9):857−862. doi: 10.1089/acm.2006.12.857
[3] 张振刚, 王峰. 有氧运动联合补充D-核糖对小鼠抗疲劳和抗氧化的作用[J]. 食品工业科技,2022,43(2):368−375. [ZHANG Z G, WANG F. Effects of aerobic exercise combined with D-ribose supplementation on anti-fatigue and anti-oxidation in mice[J]. Science and Technology of Food Industry,2022,43(2):368−375. ZHANG Z G, WANG F. Effects of aerobic exercise combined with D-ribose supplementation on anti-fatigue and anti-oxidation in mice[J]. Science and Technology of Food Industry, 2022, 43(2): 368-375.
[4] 袁保辉, 丁琪, 刘桂芹, 等. D-核糖的生理功能及其应用[J]. 中国生化药物杂志,2016,36(5):210−212. [YUAN B H, DING Q, LIU G Q, et al. Physiological function and application of D-ribose[J]. Chinese Journal of Biochemical Pharmaceutics,2016,36(5):210−212. YUAN B H, DING Q, LIU G Q, et al. Physiological function and application of D-ribose[J]. Chinese Journal of Biochemical Pharmaceutics, 2016, 36(5): 210-212.
[5] 袁保辉, 刘桂芹, 刘敏, 等. 复方D-核糖对小鼠抗疲劳作用的研究[J]. 食品工业科技,2016,37(22):349−353. [YUAN B H, LIU G Q, LIU M, et al. Study on the anti-fatigue effect of compound D-ribose on mice[J]. Science and Technology of Food Industry,2016,37(22):349−353. YUAN B H, LIU G Q, LIU M, et al. Study on the anti-fatigue effect of compound D-ribose on mice[J]. Science and Technology of Food Industry, 2016, 37(22): 349-353.
[6] JONES K, PROBST Y. Role of dietary modification in alleviating chronic fatigue syndrome symptoms: A systematic review[J]. Australian and New Zealand Journal of Public Health,2017,41(4):338−344. doi: 10.1111/1753-6405.12670
[7] THOMPSON J, NEUTEL J, HOMER K, et al. Evaluation of D-ribose pharmacokinetics, dose proportionality, food effect, and pharmacodynamics after oral solution administration in healthy male and female subjects[J]. Journal of Clinical Pharmacology,2014,54(5):546−554. doi: 10.1002/jcph.241
[8] MAHONEY D E, HIEBERT J B, THIMMESCH A, et al. Understanding D-Ribose and mitochondrial function[J]. Advances in Bioscience and Clinical Medicine,2018,6(1):1−5. doi: 10.7575/aiac.abcmed.v.6n.1p.1
[9] 马林峰, 杨双强, 杨庆军. 外源性D-核糖对大鼠心肌缺血再灌注损伤的保护作用[J]. 重庆医科大学学报,2011,36(6):689−692. [MA L F, YANG S Q, YANG Q J. Protective effect of exogenous D-ribose on myocardial ischemia/reperfusion injury of rat hearts[J]. Journal of Chongqing Medical University,2011,36(6):689−692. MA L F, YANG S Q, YANG Q J. Protective effect of exogenous D-ribose on myocardial ischemia/reperfusion injury of rat hearts[J]. Journal of Chongqing Medical University, 2011, 36(6): 689-692.
[10] 刘平怀, 符健, 黄川, 等. D-核糖对实验性心肌缺血和心律失常的作用研究[J]. 中国药业,2005,14(10):26−28. [LIU P H, FU J, HUANG C, et al. Research of anti-myocardial ischemia and anti-arrhythmia cordis effect of D-ribose[J]. China Pharmaceuticals,2005,14(10):26−28. LIU P H, FU J, HUANG C, et al. Research of anti-myocardial ischemia and anti-arrhythmia cordis effect of D-ribose[J]. China Pharmaceuticals, 2005, 14(10): 26-28.
[11] SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA:A Cancer Journal for Clinicians,2021,71(3):209−249. doi: 10.3322/caac.21660
[12] LIU C, MA X, ZHUANG J, et al. Cardiotoxicity of doxorubicin-based cancer treatment: What is the protective cognition that phytochemicals provide us?[J]. Pharmacological Research,2020,160:105062. doi: 10.1016/j.phrs.2020.105062
[13] UEKI M, UENO M, MORISHITA J, et al. D-ribose ameliorates cisplatin-induced nephrotoxicity by inhibiting renal inflammation in mice[J]. The Tohoku Journal of Experimental Medicine,2013,229(3):195−201. doi: 10.1620/tjem.229.195
[14] GU Y, JU A, JIANG B, et al. Yiqi Fumai lyophilized injection attenuates doxorubicin-induced cardiotoxicity, hepatotoxicity and nephrotoxicity in rats by inhibition of oxidative stress, inflammation and apoptosis[J]. RSC Advances,2018,8:40894−40911. doi: 10.1039/C8RA07163B
[15] 汤洁. 瑞舒伐他汀对大鼠阿霉素心肌损伤的保护作用及其机制研究[D]. 济南: 山东大学, 2015. TANG J. Protective effects of Rosuvastatin against cardiac gap junction remodeling in rats with adrimycin-induced cardiomyopathy[D]. Jinan: Shandong University, 2015.
[16] ZILINYI R, CZOMPA A, CZEGLEDI A, et al. The Cardioprotective effect of metformin in doxorubicin-induced cardiotoxicity: The role of autophagy[J]. Molecules (Basel, Switzerland),2018,23(5):1184. doi: 10.3390/molecules23051184
[17] 徐繁, 李潇, 肖旭, 等. 灵芝多糖对阿霉素所致心肌损伤的作用及机制研究[J]. 中国现代医学杂志,2021,31(10):29−34. [XU F, LI X, XIAO X, et al. Effect and mechanism of Ganoderma lucidum polysaccharide on myocardial injury induced by doxorubicin[J]. China Journal of Modern Medicine,2021,31(10):29−34. doi: 10.3969/j.issn.1005-8982.2021.10.007 XU F, LI X, XIAO X, et al. Effect and mechanism of Ganoderma lucidum polysaccharide on myocardial injury induced by doxorubicin[J]. China Journal of Modern Medicine, 2021, 31(10): 29-34. doi: 10.3969/j.issn.1005-8982.2021.10.007
[18] BERTHIAUME J M, WALLACE K B. Persistent alterations to the gene expression profile of the heart subsequent to chronic doxorubicin treatment[J]. Cardiovascular Toxicology,2007,7(3):178−191. doi: 10.1007/s12012-007-0026-0
[19] FANG X, WANG H, HAN D, et al. Ferroptosis as a target for protection against cardiomyopathy[J]. Proceedings of the National Academy of Sciences of the United States of America,2019,116(7):2672−2680. doi: 10.1073/pnas.1821022116
[20] MARQUES-ALEIXO I, SANTOS-ALVES E, MARIANI D, et al. Physical exercise prior and during treatment reduces sub-chronic doxorubicin-induced mitochondrial toxicity and oxidative stress[J]. Mitochondrion,2015,20:22−33. doi: 10.1016/j.mito.2014.10.008
[21] POINTON A V, WALKER T M, PHILLIPS K M, et al. Doxorubicin in vivo rapidly alters expression and translation of myocardial electron transport chain genes, leads to ATP loss and caspase 3 activation[J]. PLoS One,2010,5(9):e12733. doi: 10.1371/journal.pone.0012733
[22] TANG D X, ZHAO H P, PAN C S, et al. QiShenYiQi Pills, a compound chinese medicine, ameliorates doxorubicin-induced myocardial structure damage and cardiac dysfunction in rats[J]. Evidence Based Complementary and Alternative Medicine: eCAM,2013,2013:480597.
[23] 王亚坤, 孙文敬, 刘敬泽. D-核糖对大鼠负载游泳后胰岛素、去甲肾上腺素、肾上腺素的影响及其抗疲劳、抗缺氧能力研究[J]. 食品科学,2008,29(11):591−596. [WANG Y K, SUN W J, LIU J Z. Study on the effects of D-ribose on insulin, norepinephrine and epinephrine after swimming in rats and their anti-fatigue and anti-hypoxia abilities[J]. Food Science,2008,29(11):591−596. doi: 10.3321/j.issn:1002-6630.2008.11.139 WANG Y K, SUN W J, LIU J Z. Study on the effects of D-ribose on insulin, norepinephrine and epinephrine after swimming in rats and their anti-fatigue and anti-hypoxia abilities[J]. Food Science, 2008, 29(11): 591-596. doi: 10.3321/j.issn:1002-6630.2008.11.139
[24] CHATTERJEE K, ZHANG J, HONBO N, et al. Doxorubicin cardiomyopathy[J]. Cardiology,2010,115(2):155−162. doi: 10.1159/000265166
[25] HU C, ZHANG X, WEI W, et al. Matrine attenuates oxidative stress and cardiomyocyte apoptosis in doxorubicin-induced cardiotoxicity via maintaining AMPKα/UCP2 pathway[J]. Acta Pharmaceutica Sinica B,2019,9(4):690−701. doi: 10.1016/j.apsb.2019.03.003
[26] KOLEINI N, NICKEL B E, EDEL A L, et al. Oxidized phospholipids in doxorubicin-induced cardiotoxicity[J]. Chemico Biological Interactions,2019,303:35−39. doi: 10.1016/j.cbi.2019.01.032
[27] 吴文英, 尹术华, 李露, 等. 鱼腥草挥发油对多柔比星致大鼠心肌损伤的保护机制[J]. 食品工业科技,2020,41(14):302−310. [WU W Y, YIN S H, LI L, et al. Protective mechanism of essential oil of heartleaf houttuynia herb against myocardial injury induced by doxorubicin in rats[J]. Science and Technology of Food Industry,2020,41(14):302−310. WU W Y, YIN S H, LI L, et al. Protective mechanism of essential Oil of Heartleaf Houttuynia Herb against myocardial injury induced by doxorubicin in rats[J]. Science and Technology of Food Industry, 2020, 41(14): 302-310.
[28] ZHAO L, TAO X, QI Y, et al. Protective effect of dioscin against doxorubicin-induced cardiotoxicity via adjusting microRNA-140-5p-mediated myocardial oxidative stress[J]. Redox Biology,2018,16:189−198. doi: 10.1016/j.redox.2018.02.026
[29] LIU D, MA Z, DI S, et al. AMPK/PGC1α activation by melatonin attenuates acute doxorubicin cardiotoxicity via alleviating mitochondrial oxidative damage and apoptosis[J]. Free Radical Biology & Medicine,2018,129:59−72.
[30] MA Y, YANG L, MA J, et al. Rutin attenuates doxorubicin-induced cardiotoxicity via regulating autophagy and apoptosis[J]. Biochimica et Biophysica Acta (BBA)-Molecular Basis of Disease,2017,1863(8):1904−1911. doi: 10.1016/j.bbadis.2016.12.021
[31] XU C, LIU C H, ZHANG D L. MicroRNA-22 inhibition prevents doxorubicin-induced cardiotoxicity via upregulating SIRT1[J]. Biochemical and Biophysical Research Communications,2020,521(2):485−491. doi: 10.1016/j.bbrc.2019.10.140
[32] DANZ E D, SKRAMSTED J, HENRY N, et al. Resveratrol prevents doxorubicin cardiotoxicity through mitochondrial stabilization and the Sirt1 pathway[J]. Free Radical Biology & Medicine,2009,46(12):1589−1597.
[33] LIU D, MA Z, XU L, et al. PGC1α activation by pterostilbene ameliorates acute doxorubicin cardiotoxicity by reducing oxidative stress via enhancing AMPK and SIRT1 cascades[J]. Aging,2019,11(22):10061−10073. doi: 10.18632/aging.102418
[34] SHAN Q, LI X, ZHENG M, et al. Protective effects of dimethyl itaconate in mice acute cardiotoxicity induced by doxorubicin[J]. Biochemical and Biophysical Research Communications,2019,517(3):538−544. doi: 10.1016/j.bbrc.2019.07.046
[35] CALDERONE A, DE CHAMPLAIN J, ROULEAU J L. Adriamycin-induced changes to the myocardial beta-adrenergic system in the rabbit[J]. Journal of Molecular and Cellular Cardiology,1991,23(3):333−342. doi: 10.1016/0022-2828(91)90069-X
[36] 缪萍, 裘福荣, 曾金, 等. 四逆汤及其不同配伍方对心力衰竭大鼠心肌能量代谢的影响[J]. 中华中医药学刊,2016,34(1):42−45. [MIAO P, QIU F R, ZENG J, et al. Effect of Sini decoction and its components compatibility on myocardial energy metabolism in rats with heart failure induced by doxorubicin[J]. Chinese Archives of Traditional Chinese Medicine,2016,34(1):42−45. MIAO P, QIU F R, ZENG J, et al. Effect of Sini Decoction and its components compatibility on myocardial energy metabolism in rats with heart failure induced by Doxorubicin[J]. Chinese Archives of Traditional Chinese Medicine, 2016, 34(1): 42-45.
[37] 熊正英, 曲洪刚, 刘海斌. 补充核糖对大强度耐力训练大鼠血清自由基代谢和抗氧化酶活性的影响[J]. 中国运动医学杂志,2008,27(3):366−367, 365. [XIONG Z Y, QU H G, LIU H B. Effects of ribose supplementation on serum free radical metabolism and antioxidant enzyme activities in high-intensity endurance training rats[J]. Chinese Journal of Sports Medicine,2008,27(3):366−367, 365. doi: 10.3969/j.issn.1000-6710.2008.03.026 XIONG Z Y, QU H G, LIU H B. Effects of ribose supplementation on serum free radical metabolism and antioxidant enzyme activities in high-intensity endurance training rats[J]. Chinese Journal of Sports Medicine, 2008, 27(3): 366-367, 365. doi: 10.3969/j.issn.1000-6710.2008.03.026
[38] SONI S K, BASU P, SINGARAVEL M, et al. Sirtuins and the circadian clock interplay in cardioprotection: focus on sirtuin 1[J]. Cellular and Molecular Life Sciences: CMLS,2021,78(6):2503−2515. doi: 10.1007/s00018-020-03713-6
[39] WANG A J, ZHANG J, XIAO M, et al. Molecular mechanisms of doxorubicin-induced cardiotoxicity: Novel roles of sirtuin 1-mediated signaling pathways[J]. Cellular and Molecular Life Sciences: CMLS,2021,78(7):3105−3125. doi: 10.1007/s00018-020-03729-y
-
期刊类型引用(5)
1. 宋永,贾璐泽,张一婷,刘佳莉,刘大军,孙庆申. 金冠豆角籽粒淀粉组成及性质研究. 食品工业科技. 2024(07): 59-67 .  本站查看
本站查看
2. 王轶,郑学玲. 前、中、后路小麦淀粉精制前后组成及特性差异性分析. 食品科学. 2024(11): 84-90 .  百度学术
百度学术
3. 刘宏飞,蒋奇男,黄裕隆,胡兴望,彭松,余航,张宇鹏. 复合酶协同液化及糖化桂圆核工艺研究. 食品与发酵科技. 2024(05): 74-77+114 .  百度学术
百度学术
4. 刘庆庆,杨馥祯,刘章兰,杨洪,邓飞. 碱法提取天麻淀粉的工艺优化. 粮食加工. 2023(01): 52-55 .  百度学术
百度学术
5. 蔡阳扬,陶秀萍,李同,尚斌,宋建超,刘璐. 天然高分子絮凝剂的制备及应用研究. 中国农业科技导报. 2023(10): 165-172 .  百度学术
百度学术
其他类型引用(4)





 下载:
下载:

 下载:
下载:



